Metalli e leghe in architettura
Metalli e leghe in architettura
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Metalli e leghe in architettura
I METALLI
MICROSTRUTTURA E PROPRIETÀ
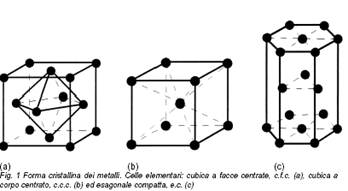 I metalli costituiscono una vasta classe di elementi chimici caratterizzati da uniformi e peculiari proprietà fisiche, meccaniche, chimiche ed estetiche: elevata conducibilità termica ed elettrica, duttilità, malleabilità, durezza, forte tendenza a perdere elettroni per formare ioni positivi e a combinarsi con l’ossigeno atmosferico, capacità di formare leghe, opacità alle radiazioni luminose e lucentezza, solo per menzionare le caratteristiche principali. Cosa accomuna nel comportamento chimico e fisico elementi fra loro così diversi quanto a valenza e peso atomico? Principale responsabile di tutte le proprietà citate è il tipo di legame esistente fra gli atomi metallici: si tratta di un legame primario, forte, che nasce dalla condivisione degli elettroni più esterni, delocalizzati in forma di una nuvola di carica elettronica negativa intorno ad aggregati di ioni metallici positivi (legame metallico). Le geometrie secondo le quali gli ioni metallici possono organizzarsi nello stato solido sono essenzialmente riconducibili a tre reticoli elementari: cubico a facce centrate (c.f.c., Fig. 1a), cubico a corpo centrato (c.c.c., Fig. 1b) ed esagonale compatto (e.c., Fig. 1c). La struttura reticolare identifica, per ogni metallo, le posizioni preferenzialmente occupate dagli ioni, le tipiche distanze interatomiche e l’orientamento dei piani cristallini. Lo slittamento di un piano cristallino su quello adiacente è il meccanismo di deformazione principale di un metallo sottoposto a sforzo. Per brevi slittamenti la deformazione è proporzionale al carico applicato secondo un fattore di proporzionalità E, detto modulo elastico, ed è completamente reversibile (deformazione elastica). Oltre un certo carico limite, detto carico di snervamento, la deformazione, non più proporzionale allo sforzo applicato, non è più recuperabile, e si parla di deformazione permanente, o plastica.
I metalli costituiscono una vasta classe di elementi chimici caratterizzati da uniformi e peculiari proprietà fisiche, meccaniche, chimiche ed estetiche: elevata conducibilità termica ed elettrica, duttilità, malleabilità, durezza, forte tendenza a perdere elettroni per formare ioni positivi e a combinarsi con l’ossigeno atmosferico, capacità di formare leghe, opacità alle radiazioni luminose e lucentezza, solo per menzionare le caratteristiche principali. Cosa accomuna nel comportamento chimico e fisico elementi fra loro così diversi quanto a valenza e peso atomico? Principale responsabile di tutte le proprietà citate è il tipo di legame esistente fra gli atomi metallici: si tratta di un legame primario, forte, che nasce dalla condivisione degli elettroni più esterni, delocalizzati in forma di una nuvola di carica elettronica negativa intorno ad aggregati di ioni metallici positivi (legame metallico). Le geometrie secondo le quali gli ioni metallici possono organizzarsi nello stato solido sono essenzialmente riconducibili a tre reticoli elementari: cubico a facce centrate (c.f.c., Fig. 1a), cubico a corpo centrato (c.c.c., Fig. 1b) ed esagonale compatto (e.c., Fig. 1c). La struttura reticolare identifica, per ogni metallo, le posizioni preferenzialmente occupate dagli ioni, le tipiche distanze interatomiche e l’orientamento dei piani cristallini. Lo slittamento di un piano cristallino su quello adiacente è il meccanismo di deformazione principale di un metallo sottoposto a sforzo. Per brevi slittamenti la deformazione è proporzionale al carico applicato secondo un fattore di proporzionalità E, detto modulo elastico, ed è completamente reversibile (deformazione elastica). Oltre un certo carico limite, detto carico di snervamento, la deformazione, non più proporzionale allo sforzo applicato, non è più recuperabile, e si parla di deformazione permanente, o plastica.
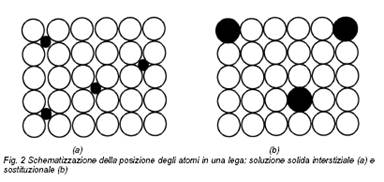 Le proprietà dei metalli sono influenzate in maniera rilevante dal grado di simmetria associato al tipo di reticolo che li caratterizza. In particolare, nel sistema c.f.c., dotato del massimo grado di simmetria, e quindi del maggior numero di possibili piani di slittamento, solidificano i metalli più duttili e malleabili, e quindi più facilmente lavorabili, come l’alluminio, il rame, l’oro e l’argento. Viceversa i metalli che cristallizzano nel sistema e.c., caratterizzato da minore simmetria, come lo zinco, sono più difficilmente deformabili. Ferro e cromo solidificano in un reticolo c.c.c. e mostrano un comportamento meccanico intermedio. La diffusione enorme dei metalli in ogni possibile campo di applicazione fin dagli albori della storia della civiltà deve molto alla capacità di questi materiali di miscelarsi tra loro e formare leghe. Un metallo può infatti contenere disciolti in fase solida nel proprio reticolo quantitativi più o meno rilevanti di elementi diversi, siano essi metallici o non metallici. In particolare, elementi di piccole dimensioni atomiche (tipicamente il carbonio) possono stabilmente assumere posizioni interstiziali nel reticolo spaziale del metallo base, fino ad un grado massimo di distorsione del reticolo (Fig. 2a). Elementi caratterizzati da raggio atomico maggiore sono normalmente solubilizzati nel metallo base sostituendosi ad esso in alcune posizioni del suo reticolo cristallino (Fig. 2b).
Le proprietà dei metalli sono influenzate in maniera rilevante dal grado di simmetria associato al tipo di reticolo che li caratterizza. In particolare, nel sistema c.f.c., dotato del massimo grado di simmetria, e quindi del maggior numero di possibili piani di slittamento, solidificano i metalli più duttili e malleabili, e quindi più facilmente lavorabili, come l’alluminio, il rame, l’oro e l’argento. Viceversa i metalli che cristallizzano nel sistema e.c., caratterizzato da minore simmetria, come lo zinco, sono più difficilmente deformabili. Ferro e cromo solidificano in un reticolo c.c.c. e mostrano un comportamento meccanico intermedio. La diffusione enorme dei metalli in ogni possibile campo di applicazione fin dagli albori della storia della civiltà deve molto alla capacità di questi materiali di miscelarsi tra loro e formare leghe. Un metallo può infatti contenere disciolti in fase solida nel proprio reticolo quantitativi più o meno rilevanti di elementi diversi, siano essi metallici o non metallici. In particolare, elementi di piccole dimensioni atomiche (tipicamente il carbonio) possono stabilmente assumere posizioni interstiziali nel reticolo spaziale del metallo base, fino ad un grado massimo di distorsione del reticolo (Fig. 2a). Elementi caratterizzati da raggio atomico maggiore sono normalmente solubilizzati nel metallo base sostituendosi ad esso in alcune posizioni del suo reticolo cristallino (Fig. 2b).
L’ottimizzazione metallurgica delle proprietà di un materiale metallico consiste principalmente nella ricerca della composizione più adatta a garantire buone caratteristiche meccaniche accoppiate alla necessaria lavorabilità e alle proprietà fisiche e chimiche richieste dalla singola applicazione. L’aggiunta di percentuali anche piccolissime di uno o più elementi leganti può modificare in misura determinante le prestazioni e le proprietà tecnologiche di un metallo, in termini di resistenza meccanica, resistenza alla corrosione in particolari ambienti aggressivi, lavorabilità, colabilità, saldabilità, aspetto estetico, etc. I limiti di solubilità e le diverse fasi possibili in equilibrio al crescere della temperatura e al variare della composizione per leghe di due o tre componenti sono visualizzabili nei cosiddetti diagrammi di fase, rispettivamente binari e ternari, utili ad individuare l’evoluzione della microstruttura di una lega durante il raffreddamento a partire dalla fase liquida e le variazioni strutturali conseguenti a variazioni di temperatura associate ad eventuali trattamenti termici. Altrettanto rilevante rispetto alla composizione, ai fini dell’individuazione delle proprietà meccaniche di un metallo o di una lega, è infatti la conoscenza della sua storia termica e meccanica, ovvero dei trattamenti che il materiale ha subito prima di essere messo in opera. Nella stragrande maggioranza dei casi un metallo viene prodotto a partire dallo stato liquido, portandolo ad una temperatura superiore a quella di fusione, e facendolo successivamente solidificare come semilavorato o direttamente come prodotto finito. La solidificazione procede a partire da nuclei, generalmente disposti sulle pareti dello stampo contenente la massa fusa, che via via si accrescono secondo le direzioni preferenziali tipiche di un certo reticolo cristallino, a formare una struttura a grani. Le giunzioni fra i vari grani (bordi grano) rappresentano discontinuità fra cristalli diversamente orientati. La dimensione media dei grani di un metallo (grana) influenza fortemente molte proprietà del prodotto finito, soprattutto la sua resistenza meccanica: in particolare un metallo caratterizzato da un’elevata densità di bordi grano (grana fine) mostrerà valori di resistenza meccanica più elevati di un metallo della stessa composizione ma cristallizzato con grani di dimensioni maggiori.
PROCESSI PRODUTTIVI, FORMATURA E LAVORAZIONE
Solo raramente i metalli si trovano come tali allo stato nativo. Essi sono molto più frequentemente ottenuti artificialmente per riduzione termica dei loro minerali, principalmente ossidi, silicati carbonati e solfuri. Il primo passo del processo di formatura dei metalli è sempre rappresentato da una colata in forma. Le forme, costruite in metallo o in miscele di argilla e sabbia, possono riprodurre con precisione la forma del pezzo finale (getti), o possono essere geometricamente molto semplici ed essere utilizzate solo per ottenere un semilavorato (lingotto, billetta, bramma), da cui poi ricavare il prodotto finito attraverso successive fasi di lavorazione plastica.
Nel primo caso le leghe utilizzate (leghe da fonderia) devono essere caratterizzate da un sufficiente grado di
colabilità, intesa come capacità di essere facilmente gettate in fase liquida e di riempire efficacemente lo stampo, che può in questo modo assumere forme anche particolarmente complicate. Tale parametro è connesso strettamente a caratteristiche chimico-fisiche della lega liquida, quali la tensione superficiale e la viscosità, e alla composizione chimica della miscela (miscele eutettiche, che formano una fase liquida unica ad una temperatura definita, sono preferibili per le leghe da fonderia). La velocità di raffreddamento del getto influenza in maniera irreversibile la grana del pezzo e, conseguentemente, le sue proprietà meccaniche.
METALLI E LEGHE IN ARCHITETTURA
Molto presto, nella storia della sua evoluzione tecnologica, l’uomo ha imparato a servirsi del metallo nella costruzione di edifici e monumenti, con funzioni sia strutturali che decorative. I metalli infatti costituiscono una classe di materiali dalle caratteristiche speciali, che li rendono particolarmente competitivi, e spesso insostituibili, rispetto ad altri materiali da costruzione, naturali o artificiali. Sono facilmente ottenibili virtualmente in qualsiasi forma e dimensione; sono dotati di attraente aspetto estetico; alcune leghe, in particolare, possiedono caratteristiche di eccellente resistenza meccanica, e possono essere utilizzate in condizioni di elevate sollecitazioni di trazione, laddove pietra, legname o calcestruzzo non garantiscono prestazioni soddisfacenti; possiedono mediamente un’elevata durezza superficiale, e possono essere prodotti con qualsiasi grado di finitura superficiale; alcuni metalli resistono bene al degrado nel tempo, autoproteggendosi, altri possono essere facilmente dotati di maggiore durabilità mediante alligazione o per rivestimento con metalli diversi. Non esiste altro materiale che possa offrire una così ampia gamma di utili proprietà estetiche e meccaniche, combinate ad una facile reperibilità delle materie prime. Non va dimenticata, infine, la possibilità di riciclare efficacemente e a basso costo i metalli degradati o che abbiano perduto la loro funzionalità.
Il ferro rappresenta senza dubbio oggi il metallo più largamente impiegato in forma massiva in architettura, seguito dal rame e dalle sue leghe. Alluminio e titanio si sono aggiunti solo di recente al panorama dei metalli architettonici, e trovano ora vasta applicazione, principalmente in forma di pannelli ed elementi decorativi. Il piombo è tradizionalmente impiegato soprattutto per la copertura di tetti e cupole. Lo zinco è un materiale spesso presente come elemento di lega o utilizzato come rivestimento
FERRO E LEGHE FERRO – CARBONIO
Nella sua forma pura il ferro è un metallo dal peso specifico medio (7870 Kg/m3, maggiore di quello di alluminio e titanio ma minore di quello di rame e piombo), di colore grigio, con un punto di fusione di 1538°C, relativamente tenero, duttile e malleabile, dotato di buone proprietà di resistenza a trazione; esso è generalmente impiegato in campo architettonico in lega con il carbonio.
Il metallo normalmente indicato con il termine ferro costituisce in realtà la lega a minor contenuto di carbonio (%C < 0.035% in peso), prodotta originariamente per combustione dei minerali di ferro a diretto contatto con il carbon coke e per eliminazione di carbonio e scorie (silicati di ferro) mediante successivi stadi di riscaldamento e martellamento.
La ghisa, prodotto primario dell’altoforno, ha un tenore di carbonio molto più elevato, normalmente compreso tra il 2 ed il 5% circa, e contiene percentuali spesso rilevanti di silicio (anche > 2%), manganese, zolfo e fosforo. Essa costituisce essenzialmente, grazie alla bassa temperatura di fusione (1150°C circa) e all’elevata fluidità, la lega di ferro utilizzata in fonderia. Nelle ghise bianche il carbonio è legato al ferro sotto forma di cementite (Fe3C); nelle più comuni ghise grigie parte del carbonio si separa in forma grafitica durante la solidificazione e il raffreddamento, riducendo fortemente i fenomeni di ritiro, e favorendo un efficace riempimento di stampi dalle forme anche molto complesse. La grafite possiede anche ottime proprietà lubrificanti, sfruttate utilmente durante le lavorazioni all’utensile dei getti. Le caratteristiche meccaniche della ghisa la distinguono nettamente dalle altre leghe di ferro. In particolare essa possiede ottime proprietà di resistenza a compressione, ma cede per bassi carichi con minimi allungamenti se sollecitata a trazione. Esibisce buon comportamento al fuoco e discreta resistenza alla corrosione.
Gli acciai sono infine leghe ferro-carbonio con contenuti di carbonio compresi tra lo 0.1 e l’1% circa. Vengono prodotti a partire dalla ghisa mediante soffiaggio di ossigeno in convertitori, o da rottami di ferro in forni elettrici. All’aumentare della percentuale di carbonio le proprietà meccaniche variano notevolmente, aumentando carico di rottura e durezza a scapito di resilienza ed allungamento a rottura.
Gli acciai comuni utilizzati in edilizia in forma di tondini, fili, lamiere e profilati contengono percentuali di C fino a 0.25- 0.3% circa. Esigenze speciali, quali il miglioramento delle proprietà meccaniche o l’aumento della resistenza alla corrosione, possono essere soddisfatte mediante l’introduzione di alliganti diversi, quali Ni, Cr, Mo, Cu etc. In particolare per far fronte al degrado dovuto alla corrosione (come sarà discusso più avanti il ferro è un metallo poco nobile e la struttura bifasica degli acciai, costituiti da ferrite e cementite, li rende facilmente suscettibili di corrosione galvanica) è possibile utilizzare acciai legati al rame, fosforo e cromo (acciai CorTen), adatti all’esposizione ad atmosfere industriali contenenti elevate percentuali di SO2, e, soprattutto, leghe contenenti elevate percentuali di nichel e cromo, dette acciai inossidabili, che, in opportune formulazioni, possono essere utilizzati anche in atmosfere marine. Queste leghe infatti sono in grado di autoproteggersi in ambiente ossidante, formando una sottile patina superficiale di ossidi di cromo, impermeabile agli agenti aggressivi. Il cromo, presente in quantità superiore all’8% in peso, conferisce inoltre a questo tipo di acciai eccellenti proprietà di durezza e resistenza meccanica e formidabili qualità estetiche di lucentezza, che ne hanno fatto negli ultimi decenni il materiale di elezione per la costruzione di strutture metalliche di concezione profondamente innovativa. Migliore durabilità può essere in alternativa conferita agli
acciai comuni con diversi tipi di rivestimenti superficiali. La zincatura costituisce il processo di rivestimento più largamente utilizzato: strati di zinco dello spessore di qualche centinaio di micron proteggono catodicamente l’acciaio, abbassando notevolmente la sua velocità di corrosione in atmosfere mediamente aggressive.
ALLUMINIO
 L’alluminio è un metallo leggero, con basso punto di fusione (660 °C) ed elevata conducibilità termica. Viene
L’alluminio è un metallo leggero, con basso punto di fusione (660 °C) ed elevata conducibilità termica. Viene
estratto dalla bauxite. Resistenza meccanica e durezza non sono elevate, ma possono essere fortemente migliorate mediante alligazione con magnesio, zinco e rame. La resistenza alla corrosione è ottima in ambienti ossidanti in quanto l’alluminio mostra capacità di passivarsi velocemente anche a temperatura ambiente. In ambiente marino vengono utilizzate leghe Al-Mg, dotate di migliore resistenza al pitting.
Il colore delle superfici di alluminio esposte all’aperto è grigio chiaro, e il tipico aspetto opaco è dovuto alla pellicola superficiale di ossido formata naturalmente o artificialmente accresciuta mediante processi galvanici di anodizzazione.
RAME E SUE LEGHE
il rame ottenuto essenzialmente per riduzione e successiva raffinazione termica od elettrolitica di ossidi e solfuri, è un metallo di caratteristiche estetiche eccezionali e dotato di ottime proprietà di durabilità, impiegato in architettura, in forma di metallo puro o di lega, da migliaia di anni.
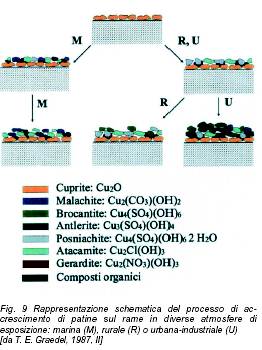
Esposto all’atmosfera il rame sviluppa film superficiali di diversa composizione, di colore e spessore variabile in funzione del tempo di esposizione e della presenza nell’aria di gas o particolato solido di origine naturale o proveniente da fonti legate all’attività umana. Tali strati superficiali, soprattutto quando dotati di colore ed aspetto gradevoli, vengono indicati col nome di patina. Il rame metallico appena esposto ha un colore rosa brillante, che nel giro di qualche settimana si trasforma in un colore bruno, caratteristico della cuprite, o ossido di rame. In atmosfere rurali o poco inquinate, il colore vira poi ad un marrone scuro tendente al nero, a causa della formazione di solfuri di rame. Tuttavia il colore finale, che ci è familiare soprattutto nelle lastre utilizzate come coperture esterne di tetti, è il verde, con sfumature più o meno intense e brillanti di azzurro. Quest’ultima trasformazione, che per completarsi necessita di qualche anno in atmosfere inquinate o di qualche decina d’anni in atmosfere meno aggressive, è causata principalmente dalla conversione dei solfuri in solfati e solfati basici (antlerite e brocantite). Un verde più acceso è invece indice della presenza di cloruri (atacamite). Strati superficiali nerastri, indicati col generico termine di crosta, costituiscono la parte meno nobile della patina e sono generalmente formati da una matrice di prodotti organici nella quale sono inglobate particelle di quarzo, silicati, carbonati, nitrati o ossalati di calcio. Le leghe a base di rame più ampiamente utilizzate in architettura sono senza dubbio i bronzi. Essi costituiscono una classe di materiali dalla composizione estremamente diversa, con percentuali di stagno variabili tra il 10 ed il 20% circa, spesso contenenti piombo o zinco. Bronzi ricchi in stagno e piombo sono fin dall’antichità utilizzati per produrre statue ed oggetti artistici mediante fusione in forma, grazie alle loro caratteristiche di ottima colabilità e basso ritiro.
DEGRADO DEI METALLI
Quasi tutti i metalli mostrano, in presenza di ossigeno atmosferico, umidità ed altri agenti aggressivi, una tendenza più o meno spiccata a ritornare alle forme di combinazione chimica proprie dei minerali dai quali sono stati estratti (ossidi, solfati, carbonati), caratterizzate da un minor contenuto energetico e quindi da una maggiore stabilità termodinamica. Tale naturale processo di degradazione chimica è conosciuto con il nome di corrosione, e le sostanze che si formano, ed eventualmente si accumulano, sulla superficie del metallo in seguito a tale forma di conversione sono dette prodotti di corrosione. La forma di deterioramento più frequentemente riscontrata sui metalli è proprio quella chimica, che sarà più ampiamente trattata nei paragrafi seguenti. I metalli, tuttavia, possono subire anche forme diverse di degrado meccanico, qualora sottoposti a sollecitazioni di varia entità, isolate o ripetute, strutturali o superficiali, a temperatura ambiente o in presenza di calore.
Corrosione
 Per corrosione si intende, in senso generale, ogni forma di degrado che preveda una modificazione chimica od elettrochimica della superficie di un metallo. Dal punto di vista del tipo di processo che interviene durante l’attacco corrosivo e del meccanismo con cui tale attacco si esplica, la corrosione dei metalli può suddividersi in corrosione a secco, quando l’ambiente è costituito da atmosfera gassosa, normalmente a temperatura elevata, e corrosione ad umido. Il tipo di corrosione più frequentemente osservato nei metalli di interesse architettonico è senz’altro la corrosione ad umido, che si manifesta mediante processi elettrochimici qualora ossigeno ed umidità, componenti essenziali della nostra atmosfera, vengano contemporaneamente a contatto con il materiale. Tutti i fenomeni corrosivi che avvengono in presenza di un elettrolita, nella fattispecie l’acqua, si sviluppano per formazione di zone anodiche e zone catodiche. Esse possono avere dimensioni macroscopiche o microscopiche, e tra di esse si instaura uno scambio di corrente in seguito al quale procedono una reazione anodica di ossidazione del metallo, in cui il metallo passa a ione positivo e libera un certo numero, n, di elettroni:
Per corrosione si intende, in senso generale, ogni forma di degrado che preveda una modificazione chimica od elettrochimica della superficie di un metallo. Dal punto di vista del tipo di processo che interviene durante l’attacco corrosivo e del meccanismo con cui tale attacco si esplica, la corrosione dei metalli può suddividersi in corrosione a secco, quando l’ambiente è costituito da atmosfera gassosa, normalmente a temperatura elevata, e corrosione ad umido. Il tipo di corrosione più frequentemente osservato nei metalli di interesse architettonico è senz’altro la corrosione ad umido, che si manifesta mediante processi elettrochimici qualora ossigeno ed umidità, componenti essenziali della nostra atmosfera, vengano contemporaneamente a contatto con il materiale. Tutti i fenomeni corrosivi che avvengono in presenza di un elettrolita, nella fattispecie l’acqua, si sviluppano per formazione di zone anodiche e zone catodiche. Esse possono avere dimensioni macroscopiche o microscopiche, e tra di esse si instaura uno scambio di corrente in seguito al quale procedono una reazione anodica di ossidazione del metallo, in cui il metallo passa a ione positivo e libera un certo numero, n, di elettroni:
o ancora riduzione di un diverso catione presente nella soluzione a forme metalliche o a minor numero di
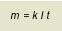 ossidazione. Il numero di elettroni prodotti dalla reazione anodica deve essere uguale a quello degli elettroni consumati nella reazione catodica, e i due processi si sviluppano contemporaneamente e alla medesima velocità. Il flusso della corrente elettrica fra catodo ed anodo viene alimentato nel metallo attraverso il movimento di cariche negative (elettroni), mentre è garantito nell’elettrolita dal trasferimento di anioni (ioni negativi) e cationi (ioni positivi). La quantità di metallo che passa in soluzione, ovvero che si corrode, è proporzionale, secondo la fondamentale legge di Faraday, alla carica scambiata nel processo elettrochimico:
ossidazione. Il numero di elettroni prodotti dalla reazione anodica deve essere uguale a quello degli elettroni consumati nella reazione catodica, e i due processi si sviluppano contemporaneamente e alla medesima velocità. Il flusso della corrente elettrica fra catodo ed anodo viene alimentato nel metallo attraverso il movimento di cariche negative (elettroni), mentre è garantito nell’elettrolita dal trasferimento di anioni (ioni negativi) e cationi (ioni positivi). La quantità di metallo che passa in soluzione, ovvero che si corrode, è proporzionale, secondo la fondamentale legge di Faraday, alla carica scambiata nel processo elettrochimico:
dove
m è il peso (in grammi) di materiale che reagisce,
k è una costante, caratteristica di ogni metallo, detta “equivalente elettrochimico”,
I è la corrente di corrosione, misurata in A,
t è il tempo, misurato in secondi.
La velocità di un processo di corrosione può così essere indifferentemente espressa come perdita in peso per unità di superficie nell’unità di tempo (mg/m2 anno), densità di corrente (A/cm2), o, come più comunemente si preferisce, diminuzione di spessore del metallo nell’unità di tempo (m/anno). La possibilità
termodinamica che una reazione di ossidazione di un metallo abbia luogo è legata al valore della differenza di
potenziale fra la reazione anodica e quella catodica. si riportano i valori dei potenziali delle reazioni di ossidazione di diversi sistemi metallo/ione, misurate rispetto all’elettrodo normale ad idrogeno, scelto come riferimento standard (potenziale convenzionalmente fissato pari a zero), e ordinati per nobiltà crescente, ossia per decrescente tendenza all’ossidazione.
L’effettiva velocità di avanzamento dei processi corrosivi è governata invece dalla cinetica dello stadio più lento che costituisce l’intero percorso di reazione. In particolare essa dipende da fenomeni di sovratensione elettrodica e di polarizzazione di concentrazione, oltreché dallo stato superficiale del metallo (presenza di film
passivanti). La sovratensione elettrodica, ovvero il valore di potenziale aggiuntivo che deve essere superato perché i processi termodinamicamente possibili abbiano luogo con velocità apprezzabili, è essenzialmente causata dal processo di dissoluzione anodica del metallo e dai processi catodici di sviluppo di idrogeno e, in misura molto minore, di riduzione di ossigeno. Il processo di dissoluzione anodica può creare delle sovratensioni dovute alla difficoltà del metallo a rilasciare in soluzione i propri ioni: i metalli che mostrano i valori più elevati di sovratensione anodica, fra i quali Pt, Fe, Ni, Cr, Ti sono detti metalli elettrochimicamente inerti, e sono normalmente caratterizzati da elevata temperatura di fusione, elevata durezza e piccole distanze interatomiche nel reticolo cristallino; metalli come Hg, Sn, Pb, Mg e Al, detti metalli normali, sono invece caratterizzati da bassa tendenza a trattenere i propri cationi, e quindi da bassa sovratensione anodica. Anche la sovratensione da idrogeno dipende fortemente dalla natura del materiale, e mostra un andamento inverso rispetto al fenomeno precedente: metalli inerti come il Pt non offrono praticamente alcuna resistenza al processo catodico di sviluppo di gas. La sovratensione elettrodica dell’ossigeno è fenomeno pressoché trascurabile. Molto più rilevante può essere invece il contributo della polarizzazione di concentrazione, ovvero del valore di potenziale aggiuntivo causato dalla resistenza alla diffusione dell’ossigeno all’interno della soluzione.
immunità (reazione di ossidazione impossibile),
passivazione (naturale formazione di una sottile patina superficiale di prodotti di corrosione - ossidi, idrossidi o sali - stabili e compatti, capaci di proteggere il materiale sottostante dall’ulteriore progresso della corrosione).
Dal punto di vista della morfologia del degrado, diverse sono le forme attraverso cui si può esplicare un attacco corrosivo; le più tipiche sono schematizzate in Fig. 12. La corrosione generalizzata (diffusa o uniforme, Fig. 12, a-b) si verifica su superfici metalliche omogenee, interamente esposte ad atmosfere aggressive, e procede con velocità pressoché uniforme su tutta la superficie. Il risultato è un assottigliamento progressivo ed omogeneo del metallo. Tale forma di corrosione interessa un numero elevatissimo di strutture, ma non costituisce la forma di attacco più pericolosa, in quanto il suo andamento è facilmente prevedibile ed è possibile calcolare con un certo margine di sicurezza la vita residua di una struttura metallica interessata da questo genere di danneggiamento. Inoltre la protezione, sotto forma di rivestimenti o inibitori di corrosione, è in questi casi generalmente piuttosto agevole. La corrosione localizzata, in tutte le sue diverse forme, e tipicamente quelle della vaiolatura, o pitting, (Fig. 12, c-f) e dell’avanzamento attraverso 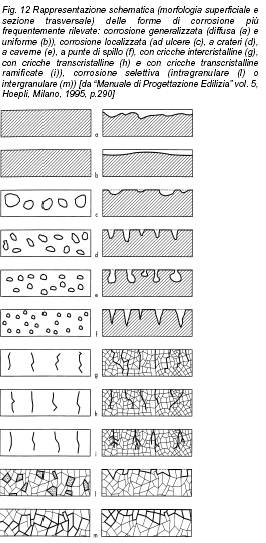 cricche intergranulari e transgranulari, (Fig. 12, g-i) è invece potenzialmente assai più pericolosa, in quanto conduce ad un attacco profondo del materiale che può, in alcuni punti, portare ad una netta diminuzione della sezione resistente della struttura. La corrosione per pitting, in particolare, si verifica in presenza di ossigeno e di ioni specifici, normalmente ioni cloruro (tipicamente quindi in ambienti marini o costieri), su materiali a comportamento attivo-passivo. In seguito al danneggiamento e all’asportazione localizzata di piccole porzioni del film passivante si creano infatti le condizioni elettrochimiche per un attacco veloce e penetrante da parte degli agenti aggressivi.
cricche intergranulari e transgranulari, (Fig. 12, g-i) è invece potenzialmente assai più pericolosa, in quanto conduce ad un attacco profondo del materiale che può, in alcuni punti, portare ad una netta diminuzione della sezione resistente della struttura. La corrosione per pitting, in particolare, si verifica in presenza di ossigeno e di ioni specifici, normalmente ioni cloruro (tipicamente quindi in ambienti marini o costieri), su materiali a comportamento attivo-passivo. In seguito al danneggiamento e all’asportazione localizzata di piccole porzioni del film passivante si creano infatti le condizioni elettrochimiche per un attacco veloce e penetrante da parte degli agenti aggressivi.
La corrosione selettiva, infine, può verificarsi in un materiale non omogeneo, o, più spesso, in una lega, qualora uno degli elementi che la costituiscono subisca un attacco più evidente degli altri, in particolari ambienti aggressivi (Fig. 12, l-m).
È questo il caso, ad esempio, della già menzionata grafitizzazione delle ghise (corrosione selettiva del ferro nei confronti della grafite), o della dezincificazione degli ottoni (leghe rame-zinco), in cui lo zinco viene preferibilmente attaccato rispetto al rame (tale forma di attacco è facilmente individuabile dalla variazione cromatica dell’ottone, che viene via via ad assumere la colorazione tipica del rame).
Un forma di corrosione particolare che merita di essere analizzata più a fondo è quella che si verifica quando metalli caratterizzati da diversa nobiltà vengono posti in un ambiente aggressivo a diretto contatto tra loro, o vengono connessi elettricamente attraverso un conduttore (contatto galvanico). In queste condizioni il materiale meno nobile, ovvero quello che occupa posizioni più elevate nella serie elettrochimica, tende ad assumere un comportamento anodico rispetto al metallo più nobile, che viceversa si comporta da catodo, e la velocità dell’attacco corrosivo ai suoi danni si fa quindi molto più elevata. Sarà buona regola, nella scelta degli accoppiamenti fra materiali a diverso comportamento elettrochimico, non porre mai a contatto diretto due metalli caratterizzati da una grande differenza di potenziale. Particolare cura dovrà essere posta, nel
caso tale tipo di giunzione non possa essere evitata, nella quantificazione del rapporto fra l’estensione delle aree anodiche e catodiche. Le conseguenze più gravi si osservano nel caso in cui le aree anodiche siano molto più piccole delle aree catodiche, essendo in tali condizioni l’attacco corrosivo assai più concentrato, e quindi inevitabilmente più veloce e distruttivo. Ad illustrare questo comportamento valgono gli esempi di giunzioni fra lastre in rame effettuate mediante chiodature in ferro o in acciaio, in cui si verifica un veloce attacco corrosivo del ferro, e di giunzioni di lastre in ferro con chiodi in rame, che, vista la loro piccola dimensione, non provocano gravi danneggiamenti delle adiacenti lamiere in ferro, in cui l’attacco si distribuisce su un’area estesa (Fig. 13). Anche il flusso d’acqua o umidità da un metallo a comportamento nobile verso un metallo a comportamento più attivo dovrebbe essere evitato, in quanto ad esso può corrispondere un trasferimento di ioni metallici e l’insorgere di microscopici ma pericolosi accoppiamenti galvanici.
.
AGGRESSIVITÀ DEGLI AMBIENTI
CORROSIONE ATMOSFERICA
La presenza di acqua sulla superficie di un manufatto metallico esposto all’aperto è condizione necessaria per l’innesco e l’avanzamento di un processo corrosivo. Il fenomeno del “bagnamento” può essere fatto risalire a
diversi meccanismi chimico-fisici: la presenza di acqua di pioggia, la condensazione dell’umidità atmosferica sulla superficie metallica al di sotto della temperatura di rugiada, la condensazione del vapore d’acqua nei pori di piccole dimensioni, attivata da fenomeni di capillarità, l’adsorbimento e, infine, la condensazione chimica, dovuta alla presenza di sali igroscopici. Il tempo totale di bagnamento (time of wetness), somma dei contributi dati dai singoli meccanismi, è uno dei parametri fondamentali che entrano nella formulazione di precise funzioni, dette funzioni di danno, con le quali si tenta di modellare e prevedere l’entità del danneggiamento di un determinato metallo, caratterizzato da un certo tipo di patina superficiale, esposto per un dato periodo di tempo ad un’atmosfera contenente note quantità di inquinanti. Rimane tuttavia un compito assai complesso riuscire a descrivere in maniera compiuta l’interazione tra un microambiente continuamente mutevole e difficilmente caratterizzabile ed un materiale pure in forte trasformazione, spesso non omogeneo e non omogeneamente esposto, con una storia di produzione e passata esposizione sovente sconosciuta.
In generale l’aggressività dell’atmosfera è strettamente legata al valore della frazione di tempo in cui la superficie metallica è rivestita da un film di acqua (normalmente calcolata come frazione di ore in cui si verificano precipitazioni o in cui l’U.R. è superiore all’80% e la temperatura è superiore agli 0°C); tuttavia molti altri parametri devono essere attentamente valutati, prima fra tutti la concentrazione di sostanze inquinanti o dannose. Essenzialmente le cinque diverse categorie a corrosività crescente possono essere ricondotte ai tipi seguenti:
• Ambienti interni: in queste condizioni di temperatura ed umidità controllata il metallo è sottoposto al minimo rischio di corrosione; alcuni metalli possono essere bruniti o corrosi in seguito a contatto con detergenti frequentemente utilizzati per il vetro o la pietra (acido muriatico o altri acidi deboli), anche soltanto in forma di fumi o vapori.
• Atmosfere rurali: la corrosione procede piuttosto lentamente; alcuni pericoli possono venire dalla presenza di fertilizzanti che si depositano in film alcalini aggressivi.
• Climi aridi: in atmosfere secche, desertiche o semidesertiche, così come in zone dal clima particolarmente rigido, la corrosione non può avanzare velocemente. Qualora la temperatura sia molto elevata, la forma di degrado più probabile sarà legata a sollecitazioni conseguenti ad espansioni termiche differenziali. In caso di frequente presenza di forte vento, il trasporto di particelle abrasive (sabbia) può provocare gravi danni da erosione. Una superficie erosa, caratterizzata da una elevata rugosità, e quindi da elevata superficie esposta, è comunque più sensibile all’attacco corrosivo.
• Zone costiere: in strutture a diretto contatto con l’acqua di mare, o in zone che risentono comunque fortemente della presenza di aerosol marino, l’agente di maggiore pericolosità è il sale, e più in particolare lo ione cloruro. Il sale, accumulato in pori ed interstizi e concentrato nel velo di umidità che ricopre la superficie metallica, provoca gravi attacchi di tipo localizzato a tutti i metalli che tendono ad autoproteggersi con la formazione di una patina superficiale. In questo caso la superficie corrosa appare coperta da piccoli crateri, più o meno profondi a seconda dell’entità dell’attacco. La soluzione fortemente conduttiva contribuisce comunque a creare sulla superficie del metallo fenomeni di polarizzazione localizzata, fra i diversi grani di un metallo o fra i diversi costituenti di una lega, accelerando così il processo corrosivo.
• Atmosfere urbane o industriali: costituiscono l’atmosfera di esposizione potenzialmente più pericolosa. L’agente più aggressivo in ambienti fortemente urbanizzati o industrializzati è l’anidride solforosa (SO2), che in presenza di ossigeno e umidità si ossida ad anidride solforica (SO3) e si trasforma parzialmente in acido solforico (H2SO4),fortemente corrosivo. Anche cloro, acido cloridrico, acido solfidrico e composti ammoniacali possono esercitare azione aggressiva.
CORROSIONE NELLE ACQUE
Le acque dolci esercitano azione più o meno aggressiva sui metalli in funzione di pH, temperatura, alcalinità totale (presenza di ioni carbonato e bicarbonato), contenuto di ossigeno, concentrazione di specifici ioni (principalmente Ca2+, SO4 2-, Cl-) e velocità del flusso. In funzione di tali parametri, in particolare, è possibile prevedere l’insorgenza di pericolosi fenomeni di pitting in acciaio al carbonio e leghe ferrose. Oltre alle strutture metalliche utilizzate per il trasporto di acque dolci, sono soggetti all’azione corrosiva di questo tipo di ambiente i metalli utilizzati in fontane ornamentali.
L’acqua di mare costituisce un agente ben più aggressivo, a causa dell’elevato contenuto salino (circ.30,000 ppm) che ne fa un ottimo elettrolita, esasperando tutti i fenomeni di corrosione galvanica ed interstiziale eventualmente innescati. Anche in questo caso la velocità di corrosione è influenzata dal contenuto di ossigeno, dalla temperatura, dalla velocità di flusso e dal tipo e la quantità degli organismi e microorganismi presenti. In particolare, per strutture esposte parzialmente all’acqua di mare la velocità di corrosione è massima nelle zone di splash o di bagnasciuga, mediamente elevata nella zona bagnata dall’acqua solo per una frazione di tempo (intervallo di escursione tra alta e bassa marea), minima nelle parti sempre immerse o sopra la zona degli spruzzi.
CORROSIONE NEL CALCESTRUZZO
Il ferro è un materiale dal comportamento attivo-passivo, in grado di autoproteggersi in determinate condizioni ambientali, rivestendosi di un sottile film, compatto ed impermeabile, di prodotti di corrosione. Le condizioni ideali per la passivazione del ferro (elevata basicità dell’ambiente) non si riscontrano normalmente nelle atmosfere di esposizione, ma sono perfettamente raggiungibili quando il metallo è immerso nel calcestruzzo, un materiale solido il cui estratto acquoso è caratterizzato, in condizioni normali, da valori di pH
compresi fra 12 e 13. Il ferro nel calcestruzzo, quindi, non si corrode, fino al momento in cui agenti esterni di
diversa origine non intervengano a perturbare l’equilibrio descritto. Per la trattazione della corrosione del ferro nel calcestruzzo si rimanda al capitolo di questo manuale riguardante le strutture in calcestruzzo armato.
DEGRADO DELLE PATINE
Anche le patine, strati superficiali accresciutisi nel tempo sul metallo in conseguenza della sua interazione con l’ambiente, possono subire un vero e proprio attacco chimico, degradandosi più o meno intensamente in
funzione della loro composizione e della loro microstruttura. Numerosi studi sulla formazione e l’alterazione delle patine del rame in condizioni di diversa aggressività ambientale - soprattutto in termini di concentrazione di composti dello zolfo e di sali di cloro e di acidità dell’acqua di pioggia, nebbia e condensa -
hanno dimostrato che alcuni composti sono dotati di grande stabilità chimica in tutte le condizioni. È bene ricordare che condizioni di elevata acidità (pH<2.5) possono essere raggiunte con una certa frequenza nell’acqua di pioggia di atmosfere urbane fortemente inquinate o negli ultimi stadi dell’evaporazione dei film superficiali di acqua depositati sui manufatti metallici.Vanno considerate inoltre quali cause di degrado l’azione fisica di erosione da parte del particelle sospese in presenza di vento e quella di dilavamento da parte dell’acqua ruscellante, responsabili, assieme alla solubilizzazione di alcuni fra i componenti delle patine, dell’assottigliamento ineguale degli strati superficiali protettivi accresciuti sul metallo. Patine più porose ed incoerenti, spesso accresciutesi con la velocità più elevata negli ambienti più aggressivi, sono evidentemente più facilmente soggette a questo tipo di deterioramento.
ALTERAZIONI DEL FERRO
Il ferro produce la cosiddetta ‘ruggine’, termine comune col quale s'intende una patina costituita da ossidi a differente grado di ossidazione e idratazione: tra questi la goethite scura, durissima; la limonite, gialla, polverulenta. La goethite, sebbene molto compatta, è spesso poco aderente al substrato; forma consistenti stratificazioni che, raggiunto un certo spessore, si scompongono, cadendo in scaglie di dimensione variabile. Gli spessori che questi prodotti di corrosione riescono a raggiungere sono proporzionalmente molto maggiori rispetto a quelli della stessa quantità di metallo non degradato: succede quindi che spesso il progredire della corrosione porti alla formazione di patine stratificate talmente voluminose da non poter essere più contenute nelle sedi dove si sono formate, per esempio dentro i fori di perni o di staffe d'ancoraggio. La necessità di spazio, per consentire l'espansione, genera pressioni molti forti, capaci di fratturare anche blocchi di pietra di notevoli dimensioni. La limonite, al contrario, è polverosa e proprio a causa di questa sua caratteristica è più difficile da rinvenire, a esclusione di alcune aree protette dall'azione solvente dell'acqua. Come nel bronzo e nel rame, anche le patine del ferro si sciolgono se sottoposte a dilavamento piovano.
PULITURA DEL FERRO
Il ferro manifesta forme di degrado piuttosto anomale, rispetto agli altri metalli, soprattutto per la natura dei prodotti di corrosione; produce, infatti, minerali molto duri che, però, aderiscono poco tra loro e con il substrato, inoltre è un metallo altamente reattivo. Un manufatto in ferro, anche di epoca relativamente recente, se sottoposto a condizioni critiche di degrado, può essere deformato dai prodotti di corrosione, al punto da diventare irriconoscibile.
Nel caso che questi prodotti di corrosione non siano di spessore eccessivo, come la comune ruggine, si può intervenire con i metodi meccanici, tra i quali non è da sottovalutare la tradizionale carta abrasiva di varie granulometrie e le spazzole in ferro. Esistono anche diversi metodi chimici: dai bagni in olio di paraffina, all'acido fosforico diluito, dalla soluzione di acido ossalico al 9%, al sempre efficace sale dell'acido etilendiamminotetracetico a diverse concentrazioni (3-10%). Efficace può anche essere un trattamento con acido tioglicolico, diluito in una soluzione a pH 7, ottenuto con l'aggiunta di ammoniaca; fra i trattamenti elettrochimici ricordiamo l'immersione di un manufatto arruginito in una soluzione di soda caustica al 10-20%, ricoperto da granuli o lana di zinco. Per le grandi strutture in ferro o in ghisa, come le cancellate, alcuni ponti ottocenteschi, le colonne in ghisa dell'Acquario Romano, le membrature della Gare d'Orsay a Parigi, e
tante altre, spesso arrugginite e con residui di vecchie vernici alterate, non è ragionevole intervenire con i metodi minuziosi del restauratore di reperti archeologici. In questi casi si può ricorrere a sverniciatori chimici neutri o all'azione della fiamma, metodi che richiedono comunque tempo; è ragionevole intervenire, quando possibile, con la sabbiatura, che viene eseguita solo da ditte specializzate: le superfici rimangono scabrose offrendo una migliore presa alle vernici protettive, da applicare subito perché il ferro, in quelle condizioni, è particolarmente vulnerabile dalla corrosione.
INIBITORI DI CORROSIONE
Terminati gli interventi di pulitura, meccanica o chimica, si devono eseguire sempre lavaggi con acqua deionizzata o distillata per eliminare sali solubili ancora presenti sulle superfici. Quest'operazione non può essere considerata come un inibitore di corrosione, ma è comunque molto utile alla conservazione dei metalli; infatti quanto è maggiore la presenza di questi sali sulle superfici tanto più aumentano le possibilità di corrosione. I lavaggi possono eseguirsi con lo stesso criterio su tutti i metalli, facendo attenzione a non mettere in contatto due metalli diversi nella stessa acqua di lavaggio, ed a non immergere oggetti composti da più metalli, per non produrre pile di corrosione. È opportuno considerare che non tutti i metalli hanno la stessa resistenza nei confronti dell'acqua: per esempio, il ferro e il piombo sono molto sensibili all'umidità.
Gli inibitori chimici veri e propri sono prevalentemente sostanze organiche che formano, sul metallo, strati superficiali protettivi; agiscono generalmente sui prodotti di corrosione rendendoli più stabili e più resistenti agli attacchi di sostanze aggressive. L'applicazione di soluzioni più concentrate porta alla formazione di efflorescenze cristalline superficiali che possono, comunque, essere eliminate con risciacqui in alcool etilico puro. Affinché la sostanza reagisca, bisogna che le superfici del manufatto rimangano bagnate con la soluzione inibente per almeno mezz'ora insistendo con la stesura a pennello. La sostanza è tossica, anche per inalazione; bisogna dunque prendere le dovute precauzioni durante l'impiego.
In futuro potranno essere messi a punto nuovi inibitori di corrosione. Sarà buona regola,prima di applicarli sull'opera intera, provarli su piccole porzioni; queste sostanze, infatti, reagiscono chimicamente sempre e solo con i materiali costitutivi delle patine, provocando sovente variazioni cromatiche irreversibili e non sempre gradite.
fonte: ftp://pc30.architettura.unirc.it/Giglio/Scienza%20dei%20Materiali%20(prof.%20Chiovaro)/I%20METALLI.doc
Autore del testo: non indicato nel documento di origine
Metalli e leghe in architettura
Visita la nostra pagina principale
Metalli e leghe in architettura
Termini d' uso e privacy