Biochimica del fegato
Biochimica del fegato
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Biochimica del fegato
Il fegato dispone della più ampia versatilità metabolica.
A cavallo tra circolo portale e circolo generale il fegato smista le sostante nutritive che gli pervengono dall’assorbimento intestinale e, oltre ad esse, molecole più elaborate che il fegato sintetizza ad uso generale: lipoproteine, albumina, enzimi, colesterolo, fosfolipidi ecc..
Solo il fegato riceve oltre al sangue arterioso proveniente dal cuore (arteria epatica) il sangue venoso refluo dal canale digerente (vena porta). Il sangue proveniente da queste 2 sorgenti si mescola nei sinusoidi epatici, che differiscono dai capillari per non avere una parete propria; sono infatti delimitati dalle cell di Kupffer ed ottimamente predisposti per una rapida ed efficiente diffusione dei metaboliti nelle cell epatiche.
Il fegato è anche strettamente connesso per via ematica con la milza e ciò spiega come la degradazione dell’emoglobina, iniziata nella milza, venga completata nel fegato.
Una ulteriore peculiarità del fegato è di avere proprietà di ghiandola esocrina. Essa infatti elabora un secreto, la bile, che prodotta in quantità di circa 1000 ml al giorno viene raccolta nei dotto epatici biliari e convogliata alla colecisti, dalla quale viene scaricata nel duodeno attraverso il condotto cistico durante la digestione.
Le cell epatiche sono di due tipi principali:
- le cell parenchimatose o epatociti (60-80% della popolazione cell epatica)
- le cell di Kupffer adibiti a funzioni protettive e alla degradazione dell’emoglobina (15-30% della popolazione cell epatica). Esse che contengono un elevato numero di lisosomi, deputati ad un’intensa fagocitosi, possono rigonfiarsi, bloccando il flusso ematico nei sinusoidi, qualora le particelle assunte non siano state ancora digerite.
Gli epatociti sono organizzati in lobuli, strutture anatomiche a sezione esagonale con un diametro di circa 1 mm. In corrispondenza di ciascun angolo dell’esagono scorrono lungo il lobulo 3 piccoli vasi condotti :
- una venula del sangue portale
- una arteriola dell’arteria epatica
- un canalicolo biliare
Nel centro del lobulo scorre un piccolo ramo della vena epatica. Gli epatociti si irradiano dalla venula centrale verso la periferia del lobulo e vanno incontro ad una zonazione metabolica funzionale.
Quelli collocati più perifericamente (epatociti periportali) a contatto con il sangue di origine portale ed arteriosa, ricco di substrati e ossigeno, hanno intenso metabolismo ossidativo e biosintetico mentre quelli più vicini alla venula epatica (epatociti perivenosi) sono più attivi nella glicolisi e nella chetogenesi.
Le cell epatiche hanno una grande capacità rigenerativa.
Funzione degli epatociti
Agli epatociti competono in modo esclusivo:
- la biosintesi della gran parte delle proteine e lipoproteine del plasma
- la formazione dei sali biliari e dei pigmenti biliari
- la chetogenesi
- i processi di detossificazione o cmq di metabolizzazione di composti esogeni ed endogeni
Inoltre esplicano anche la funzione:
- gluconeogenica
- ureogenica
- uricogenica
Si osservi che il contenuto di acqua è molto inferiore nella bile colecistica che nella bile epatica e che tutti i componenti solidi sono molto più concentrati nella bile colecistica ad esclusione dei Sali inorganici che invece sono diminuiti. Ciò indica che durante il soggiorno della bile nella colecisti ne vengono selettivamente assorbiti acqua e minerali.
Metabolismo glucidico
Glicogenosintesi
Il fegato cattura i monosaccaridi provenienti dall’assorbimento
intestinale, veicolati dal sistema venoso portale, li trasforma in glicogeno per poi ridistribuirli in forma di glucosio ai vari tessuti su richiesta.
Ciò è possibile per la grande capacità glicogeno sintetica del fegato, per la sua proprietà di riversare in circolo il glucosio e per la sua abilità di convertire i monosaccaridi l’uno nell’altro.
Il fegato riesce a mantenere costante la glicemia: funzione glucostatica del fegato.
La estremamente elevata capacità di sintesi del glicogeno da parte del t.epatico è fondamentalmente dovuta alla presenza della glucochinasi, enzima inducibile dall’insulina e, per le sue caratteristiche cinetiche, capace di fosforilare il glucosio in glucosio-6-P, anche quando la concentrazione elevata di questo non lo consentirebbe.
Va infatti ricordato che, a differenza della esochinasi, la glucochinasi non è inibita da un eccesso di glucosio-6-P.
Nel fegato la glicogeno fosforilasi epatica è inibita da elevate concentrazioni di glucosio; nel contempo la fosforilasi chinasi epatica è capace di fosforilare anche la glicogeno sintetasi, rendendola così inattiva. L’insieme di queste capacità funzionali fanno sì che il contenuto di glicogeno del fegato possa raggiungere concentrazioni anche molto elevate (10g/100 in condizioni di riposo e di buona alimentazione).
La riserva epatica di glicogeno è a disposizione degli altri tessuti. Per es. durante un esercizio muscolare prolungato il glicogeno del fegato decresce molto più drasticamente e rapidamente che non lo stesso glicogeno muscolare.
La capacità di rilasciare glucosio in circolo, propria del fegato, è dovuta alla presenza della glucosio-6-P fosfatasi, che idrolizza il glucosio-6-P in glucosio e fosfato inorganico (Pi):
glucosio-6-P à glucosio + Pi
Solo il glucosio libero può infatti permeare la membrana cellulare. Pertanto quando la glucosio-6-P fosfatasi è assente si ha accumulo abnorme di glicogeno nel fegato e profonda ipoglicemia.
Il processo glicolitico non è invece predominante come in altri tessuti: il 30% circa del glucosio epatico sceglie infatti la via dei pentoso fosfati che, a differenza della glicolisi, non è intesa a fornire energia bensì “equivalenti riducenti” che il tessuto impiega per i processi sintetici e in particolare per la sintesi di lipidi, proteine e lipoproteine.
Gluconeogenesi
È con questo processo di trasformazione di materiale non glucidico in glucosio che il fegato mantiene la glicemia nei limiti normali ed assicura, anche in carenza di glucidi, un adeguato rifornimento di glucosio soprattutto al t.nervoso, agli eritrociti e alla midollare del rene e del surrene, che utilizzano il glucosio come substrato preferenziale o esclusivo.
Per la gluconeogenesi il fegato può utilizzare:
- acido lattico
- aminoacidi glucogenici
- glicerolo-3-fosfato
L’acido lattico proviene dal muscolo funzionante in anaerobiosi e dagli eritrociti. A differenza del fegato, nel muscolo la glicolisi anaerobica è molto attiva, mentre la gluconeogenesi è praticamente silente. Sotto questo punto di vista fegato e muscolo sono complementari, in quanto l’acido lattico che il fegato riceve dal muscolo viene restituito come glucosio.
Gli aminoacidi glucogenici che il fegato incanala nella gluconeogenesi, dopo la loro transaminazione in piruvato, ossaloacetato ed α-chetoglutarato, provengono per lo più dai muscoli in seguito a proteolisi, particolarmente intensa dopo digiuno prolungato. Altra sorgente di questi (serina) è il rene.
Il glicerolo-3-fosfato deriva per lo più dal glicerolo, prodotto dell’idrolisi dei trigliceridi e fosfolipidi. Una glicerolo chinasi specifica, presente nel fegato, fosforila il glicerolo in glicerolo-3-fosfato; questo viene ossidato a fosfodiossiacetone e quindi convertito in glucosio.
La gluconeogenesi dal glicerolo-3-fosfato è particolarmente attiva quando i glucidi della dieta sono scarsi e i lipidi abbondanti (in questa situazione il glicerolo viene utilizzato per la sintesi del glucosio e gli acidi grassi per quella dei corpi chetonici). Situazione analoga si verifica in seguito a stimolazione ormonale della lipolisi nel t.adiposo.
Formazione dell’acido glucuronico
In misura notevolmente superiore agli altri tessuti, il fegato forma acido glucuronico per utilizzarlo molto attivamente, nella forma di UDP-acido glucuronico, nei processi detossificanti di coniugazione.
Utilizzazione del fruttosio
Il fruttosio, che perviene al fegato dall’intestino, viene in parte trasformato in fruttosio-6-P dalle esochinasi e, in parte prevalente, in fruttosio-1-P dalla fruttochinasi, che nel fegato è molto attiva. È per questo che nel fegato e solo nel fegato, il fruttosio è utilizzato nel processo glicolitico.
Metabolismo lipidico
Chetogenesi
I mitocondri epatici sono la sede esclusiva della sintesi dei corpi chetonici (chetogenesi).
Nel fegato il catabolismo degli acidi grassi nel processo della β-ossidazione produce acetil-CoA ad un ritmo superiore di quello del suo smaltimento nel ciclo di Krebs. È questa quota eccedente di acetil-CoA che viene incorporata nei corpi chetonici.
Normalmente la concentrazione dei corpi chetonici del sangue è relativamente bassa (0,2-2 mM/L); nelle condizioni di digiuno, quando l’organismo deve attingere alle fonti energetiche endogene, una maggior quantità di NEFA arriva al fegato e il processo cheto genetico ne risulta incrementato.
Il meccanismo dell’aumentata chetogenesi nel digiuno è duplice:
- la diminuita concentrazione ematica di glucosio induce una diminuita secrezione di insulina e un’aumentata secrezione di glucagone. Questa situazione ormonale induce a sua volta un’aumentata lipolisi a livello del t.adiposo ed un maggior apporto di acidi grassi al fegato.
- nel fegato gli acidi grassi, attivati ad acil-CoA, vengono preferenzialmente avviati alla ossidazione mitocondriale piuttosto che alla esterificazione citoplasmatica in trigliceridi.
Sintesi delle lipoproteine plasmatiche
Il fegato è la sede principale della sintesi delle lipoproteine ed in particolare delle VLDL e delle HDL.
Nelle prime il fegato immette i trigliceridi che sintetizza dagli acidi grassi di produzione endogena (lipogenesi epatica) da quelli (NEFA) che gli arrivano dal t.adiposo e da quelli che ricava, per idrolisi, dai chilomicroni secondari
I trigliceridi delle VLDL sono un materiale energetico importante che il fegato rilascia, insieme, ma non parallelamente, con il glucosio a beneficio dei tessuti extraepatici.
Con le VLDL il fegato esporta anche il colesterolo, che i tessuti extraepatici utilizzano o a fini strutturali o per metabolizzarlo in vario modo.
La frazione lipidica prevalente che il fegato immette nelle HDL sono invece i fosfolipidi.
La formazione delle lipoproteine nel fegato è un processo complesso e graduale che inizia nel RER, a livello del quale vengono sintetizzate le apolipoproteine. Nel REL a quest’ultime si aggregano le varie frazioni lipidiche. Le lipoproteine “nascenti” passano quindi nelle cisterne del Golgi dove acquistano la componente glucidica necessaria per la loro secrezione che avviene, previo inglobamento in vacuoli secretori, negli spazi di Disse (esocitosi).
Il fegato assume quindi una posizione centrale anche nel metabolismo lipidico. È infatti il fegato che decide, in ultima analisi, come modificare il materiale lipidico che gli perviene ed in quale forma smistarlo.
Steatosi epatica
Più di ogni altro organo o tessuto il fegato è particolarmente predisposto alla steatosi, una condizione caratterizzata da un massivo accumulo di trigliceridi (fegato grasso).
Quando la steatosi diventa cronica evolve in degenerazione fibrotica ed infine in cirrosi.
Due sono le cause principali:
- prolungato aumento dei NEFA ematici, sia per eccessiva “mobilizzazione” degli acidi grassi del t.adiposo, sia per esaltata idrolisi dei trigliceridi delle lipoproteine o chilomicroni da parte della lipoproteina lipasi; entrambe queste condizioni possono verificarsi nel digiuno prolungato, nel diabete mellito non controllato o in seguito ad eccessiva introduzione di lipidi
- ipoproduzione epatica delle lipoproteine plasmatiche per difettosa o insufficiente sintesi delle apolipoproteine o dei fosfolipidi componenti le lipoproteine; questa condizione è talvolta associata a deficienza dei cosiddetti fattori lipotropi, fra i quali colina e metionina.
Steatosi epatica può conseguire anche ad introduzione di tossici (etanolo, cloroformio..) capaci di inibire la sintesi proteica nel fegato, con conseguente minore disponibilità di apolipoproteine e quindi minore esportazione di trigliceridi con le VLDL.
Metabolismo degli aminoacidi
Il fegato riceve gli aminoacidi proveniente dall’assorbimento intestinale e quelli prodotti dall’idrolisi proteica nei tessuti extraepatici, specialmente muscoli.
Gli aminoacidi sono utilizzati, dopo adeguata interconversione mediata dai processi transaminativi, per la sintesi delle proteine intraepatiche e di buona parte di quelle plasmatiche o per la gluconeogenesi.
La frazione più rilevante di aminoacidi che contribuisce alla sintesi dell’urea è quella proveniente dall’intestino; in particolare sono la citrullina e la arginina, entrambi precursori metabolici della ornitina, i più attivi.
Processi di detossificazione
Il fegato è anche la sede principale della “detossificazione” dei composti tossici che si formano nell’organismo, quali l’ammoniaca e la bilirubina o che vi arrivano dal di fuori, i cosiddetti xeno biotici (farmaci, veleni, additivi alimentari e inquinanti ambientali).
Il processo consiste nel modificare l’attività dei composti indesiderati e/o nel renderli più idrosolubili, onde facilitarne la eliminazione renale, impiegando reazioni di idrossilazione e di coniugazione.
Ammoniaca à sua conversione in urea, sostanza solubile e atossica.
Bilirubina à trasformazione nel coniugato idrosolubile bilirubina-diglucuronide.
La coniugazione a derivati idrosolubili (glucuronidi, esteri solforici..) è pure impiegata per rendere eliminabili con le urine composti endogeni, quali gli ormoni steroidei e tiroidei: in questo caso non si tratta di vera detossificazione ma di fase terminale del metabolismo.
Nel caso degli xeno biotici la metabolizzazione avviene in 2 fasi:
- la più comune reazione della 1° fase è la idrossilazione, catalizzata da idrossilasi o monoossigenasi o ossidasi a funzione mista, più note col nome di citocromi P450.
- i composti idrossilati vengono coniugati con sostanze idrofile quali l’acido glucuronico, il solfato, il glutatione e la glicina; in questo modo l’originale molecola idrofobica si trasforma in un derivato idrofilico che può essere eliminato dall’organismo attraverso le urine.
È possibile ottenere anche l’effetto esattamente opposto: attivazione o aumento della tossicità!
Reazioni di idrossilazione
I citocromi P450 o CYP sono una famiglia di monoossigenasi ad elevato grado di omologia di sequenza aminoacilica; sono particolarmente abbondanti nel fegato dove risiedono prevalentemente nel reticolo endoplasmatico (CYP microsomali) ma anche nella membrana mitocondriale interna (CYP mitocondriali).
I CYP sono cromoproteine il cui gruppo prostetico è costituito da una singola molecola di proto porfirina IX contenente un atomo di Fe²+/³+ cui si può legare una molecola di O2.
La più comune reazione catalizzata dai CYP è:
Substrato-H + NADPH(H+) + O2 à Substrato-OH + H2O + NADP+
in cui un atomo di ossigeno è incorporato nel substrato in forma di –OH e l’altro atomo si combina con 2 protoni del NADPH(H+) formando acqua.
Il meccanismo di inserimento di ossigeno nel substrato da parte del citocromo P450 a sede microsomale prevede che:
il substrato (SH) si combina con la forma ossidata del CYP cioè il cit P450.Fe³+ il quale assume un primo elettrone riducendosi a cit P450.Fe²+-SH; l’elettrone è ceduto dal gruppo prostetico di una flavoproteina cit P450 reduttasi, il FMNH2 il cui nucleo isoallosazinico passa alla forma semichinonica. In una tappa successiva una molecola di O2 si ancora al Fe del cit P450.Fe²+ e assume un elettrone (secondo elettrone) trasformandosi in radicale superossido O2˙¯, sempre legato al cit P450. Anche il secondo elettrone proviene dal FMNH2 (semichinone) con formazione di FMN.
Nel contempo i due protoni liberati dal FMN formano acqua con un atomo dell’O2 legato al cit P450 mentre l’altro atomo di ossigeno è assunto dal substrato con formazione dell’idrossiderivato S-OH. Concomitantemente il cit P450.Fe²+ cede un elettrone e diventa cit P450.Fe³+. Il FMN torna allo stato ridotto, con intervento della stessa falvoproteina, con ossidazione del FADH2 a FAD e successivamente ripristino del FADH2 a spese del NADPH(H+) che diventa NADP+.
-immagine-
Nel complesso si configura un passaggio di elettroni e protoni dal NADPH(H+) al substrato e all’O2 con il concorso di 2 enzimi: la flavoproteina-FMN/FAD (cit P450 reduttasi) e il cit P450.
Nel caso del cit P450 mitocondriale il meccanismo di reazione è simile a quello sopra descritto con le differenze che la flavoproteina ha solo il FAD/FADH2 come coenzima e che tra di essa e il cit450 è inserita un’altra ossido reduttasi a Ferro/zolfo, l’adrenodoxina.
I citocromi P450 sono tra gli enzimi conosciuti i più versatili in termini di differenti substrati nei quali essi possono inserire ossigeno e propedeutici in termini di predisporre gli stessi substrati ad ulteriori modificazioni metaboliche.
Un’importante caratteristica dei cit P450 è la loro facile indicibilità: svariate sostanze, quali farmaci antistaminici, tranquillanti, anestetici, analgesici, neurostimolanti e stimolanti psicomotori nonché etanolo, insetticidi, idrocarburi cancerogeni, sono in grado di indurre a produzione di cit P450, quando somministrati ripetutamente.
Un altro aspetto rilevante è il loro polimorfismo genetico, per cui l’efficacia di un farmaco e la sensibilità a sostanze, quali l’etanolo, può variare moltissimo da un soggetto all’altro.
Va infine ricordato che particolarmente nel caso del fegato, uno stato patologico serio quale la cirrosi, riduce la capacità ossidativa dei citocromi P450 e di conseguenza abbatta la capacità di metabolizzare farmaci.
Reazioni di coniugazione
La coniugazione con la glicina, il solfato, l’acido glucuronico, il glutatione, l’acido acetico e il metile è il processo che il fegato impiega non solo per detossificare composti tossici endogeni ed esogeni ma anche per inattivare o avviare alla eliminazione ormoni di natura idrofobica.
- Coniugazione con la glicina
Utilizzata per facilitare la eliminazione di acidi aromatici come l’acido benzoico e salicilico. Nel caso dell’acido benzoico il processo implica l’attivazione di questo con il CoA e la sua successiva coniugazione con la glicina.
- Coniugazione con il solfato
Il solfato viene preliminarmente attivato a solfato attivo (PAPS) a spese di due molecole di ATP. Il PAPS, che viene utilizzato dal fegato, come da altri tessuti, per incorporare il solfato nei GAG e nei solfo lipidi, agisce come donatore di gruppi solforici con formazione degli esteri solforici anche di numerosi composti tossici ed ormonali. Questi, trasformati in forme solubili, passano nel sangue e vengono poi eliminati attraverso l’emuntorio renale.
- Coniugazione con acido glucuronico
Il composto che promuove la coniugazione dell’acido glucuronico con vari fenoli esogeni, molti ormoni steroidei e la bilirubina, formando i rispettivi glucuronidi, è l’UDP-glucuronato.
- Coniugazione con glutatione (GSH)
Il glutatione, di natura nucleofila, può essere trasferito su molecole elettrofile attraverso il suo gruppo solfidrico con intervento di glutatione-S-trasferasi, enzima di cui è particolarmente ricco il fegato. La reazione generale è:
X + G-SH à X-S-G
in cui X è un qualunque elettrofilo.
La coniugazione con glutatione è molto comunemente usata con farmaci e xeno biotici potenzialmente tossici, spesso composti alogenato e nitrocomposti, tra cui alcune sostanze cancerogene.
Il coniugato con glutatione può essere eliminato con le urine.
- Coniugazione con acido acetico
L’acetilazione è un processo utilizzato dal fegato per inattivare molecole aminate di origine esogena. Gli enzimi interessati sono acetiltransferasi e l’agente acetilante è l’acetil-CoA.
- Coniugazione mediante metilazione
Processo usato per inattivare taluni composti fenolici, quali le catecolamine e l’acido nicotinico. L’agente metilante è la S-adenosilmetionina con intervento di metil-trasferasi.
Altri processi di detossificazione
Anche l’ureogenesi che incorpora l’ammoniaca (tossica) in urea (non tossica) costituisce un tipico processo di detossificazione epatica.
Nella logica delle modificazioni chimiche è inserito anche il processo della uricogenesi; in questo caso il processo chimico impiegato è la ossidazione a carico del nucleo purinico, catalizzata dalla xantina ossidasi con produzione di acido urico. La xantina ossidasi è particolarmente abbondante nel fegato.
Funzione delle cell non parenchimatose
Le cell non parenchimatose del fegato costituiscono una popolazione eterogenea comprendente:
- le cell di Kupffer
- le cell endoteliali
- le cell adipose
Compito specifico di tali cell è il riconoscimento e la degradazione di materiali estranei che arrivano al fegato. Tale funzione degradativa è assicurata da un apparato liso somale molto ben sviluppato e dalla presenza in esso di attivi enzimi proteolitici e lipolitici; grazie a questi enzimi le cell esplicano una intensa attività nel degradare le lipoproteine plasmatiche che ritornano al fegato ed in particolare nell’idrolizzare gli esteri del colesterolo trasportati dalle HDL.
È quindi molto probabile che queste cell svolgano una funzione primaria nel regolare il turnover delle lipoproteine circolatorie e quindi assumano una inaspettata importanza nella prevenzione della aterosclerosi!!
Il fegato possiede il più elevato turnover proteico e flusso ematico ed è secondo solo al cuore per quanto attiene il consumo basale di O2.
Metabolismo epatico dell’etanolo
L’etanolo ha un elevato contenuto energetico, tuttavia a differenza dei comuni (veri) nutrienti che, quando assunti in eccesso, possono essere accumulati, in misura maggiore o minore, nei vari organi e tessuti, l’etanolo non viene depositato bensì catabolizzato o eliminato al più presto.
Inoltre mentre i comuni nutrienti possono essere utilizzati da tutti i tessuti, l’etanolo è metabolizzato primariamente solo dal fegato!
L’etanolo viene assorbito dall’intestino tenue ed in parte anche dallo stomaco per libera diffusione; la velocità di assorbimento è quindi proporzionale alla quantità di etanolo ingerito e la barriera gastrointestinale non oppone alcun controllo al suo assorbimento.
Gran parte dell’etanolo assunto viene metabolizzato in CO2 e H2O ed una porzione, variante tra il 5 e il 15%, viene eliminata tale e quale con l’aria espiratoria e con le urine.
È il fegato l’organo maggiormente impegnato nel metabolismo dell’etanolo; in condizioni di apporto limitato, l’etanolo viene ossidato in aldeide acetica e questa in acido acetico, che per la maggior parte viene riversato in circolo.

Solo in minor misura l’acido acetico viene attivato ad acetil-CoA e quindi ossidato in CO2 nel ciclo di Krebs od incorporato nei corpi chetonici o negli acidi grassi.
L’attività della acetato tiochinasi epatica (enzima che trasforma l’acetato in acetil-CoA) è infatti relativamente scarsa:
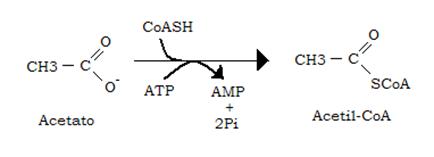
Quando l’apporto di etanolo è elevato il fegato diventa incapace di convertire tutto l’etanolo in acetato e riversa in circolo anche aldeide acetica.
Enzimi epatici che ossidano l’etanolo in aldeide acetica
Gli enzimi che catalizzano l’ossidazione dell’etanolo in aldeide acetica sono:
- la alcool deidrogenasi
- il sistema microsomiale ossidante etanolo (MEOS)
- la catalasi
Alcool deidrogenasi (ADH)
Catalizza l’ossidazione dell’etanolo in aldeide acetica a spese del NAD+

Tale ossidazione comporta un aumento del rapporto NADH(H+)/NAD+ e di riflesso del rapporto lattato/piruvato e β-idrossibutirrato/acetoacetato.
La ADH del fegato umano è un dimero contenente 4 atomi di Zn per molecola; due di questi atomi sono situati in corrispondenza del sito attivo e contribuiscono al legame dei substrati (NAD+ ed etanolo) all’enzima, gli altri due hanno la funzione di stabilizzarne la struttura terziaria.
La dipendenza delle attività dell’ADH dallo Zn spiega il maggior fabbisogno in Zn degli etilisti cronici.
La ADH è presente nel fegato umano in varie forme isoenzimatiche: ADH1, ADH2, ADH3; essendo la ADH un dimero, le forme molecolari (isoenzimi) possibili possono essere omodimeriche (αα,ββ,γ¹γ¹,γ²γ²) o eterodimeriche (αβ,αγ¹,αγ²,βγ¹,βγ²,γ¹γ²); sono così possibili 10 isoenzimi ed è possibile che la dotazione delle diverse forme isoenzimatiche di ADH, che caratterizza geneticamente ogni individuo, condizioni la predisposizione e la tolleranza all’alcool.
Sistema microsomiale ossidante l’etanolo (MEOS)
Una idrossilasi mista associata alla frazione microsomiale e capace di catalizzare la seguente reazione:

Il MEOS è un sistema inducibile dall’etanolo e la ipertrofia del REL, di cui il MEOS è parte integrante, costituisce una delle prime modificazioni morfologiche conseguenti ad ingestione di etanolo; questa ipertrofia è un fenomeno di adattamento che conferisce al fegato aumentata capacità a metabolizzare l’etanolo.
Catalasi
È capace di catalizzare, fra le altre, la seguente reazione:
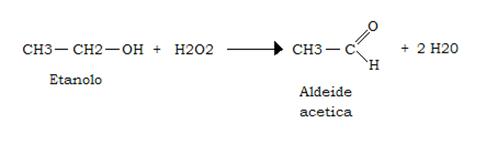
Il contributo della catalasi epatica alla ossidazione dell’etanolo è significativa solo quando l’etanolo è presente in concentrazioni piuttosto elevate.
Ossidazione dell’aldeide acetica in acido acetico
L’aldeide acetica viene ossidata in acido acetico nello stesso epatocita ad opera della acetaldeide deidrogenasi, che catalizza la reazione:
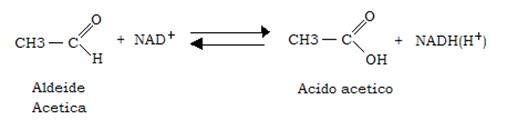
La reazione è praticamente irreversibile a causa della molto bassa affinità dell’acetato per l’enzima, che invece una elevata affinità per l’aldeide.
La acetaldeide deidrogenasi, la cui attività richiede la integrità dei suoi gruppi tiolici (-SH), è inibita dai reagenti tiolici e fra questi il disulfiram, un farmaco che viene usato nella “terapia di disgusto” (infatti l’accumulo di aldeide acetica, che questo inibitore induce, crea tale malessere da indurre talvolta l’etilista alla rinuncia delle bevande alcoliche).
Alterazione metaboliche indotte dall’etanolo
Gran parte della alterazioni metaboliche del fegato indotte dall’etanolo sono conseguenti all’eccesso di equivalenti riducenti [NADH(H+)] che l’ossidazione dell’etanolo ad acetato comporta e alla conseguente scarsa o nulla disponibilità di NAD+.
Per eccesso di NADH(H+) il piruvato viene ridotto ad acido lattico e sottratto sia all’ossidazione ad acetil-CoA, sia alla carbossilazione ad ossaloacetato. La diminuita formazione di ossaloacetato determina un blocco della gluconeogenesi, anche perché l’ossaloacetato preesistente viene ridotto a malato dall’eccesso di NADH(H+).
Si spiega così la ipoglicemia che spesso consegue ad ingestione di etanolo, specie in condizioni di digiuno e che può complicare, a volte drammaticamente, l’etilismo acuto.
Tali reazioni metaboliche sono ancor più accentuate allorché, come sovente accade, la ingestione di alcool è associata ad insufficiente alimentazione. Per tale concomitanza il fabbisogno glucidico è ancor più dipendente dalla gluconeogenesi (che però è resa difficile) e l’esaltata mobilizzazione degli acidi grassi accentua la steatosi epatica e la immissione di trigliceridi nel sangue, ma porta inesorabilmente alla chetosi.
Naturalmente questi deragliamenti metabolici conseguono ad ingestione di forti quantità di etanolo!
Al contrario un modesto consumo di etanolo, in modo ancor più evidente se associato ad esercizio fisico, induce un aumento del colesterolo legato alle HDL. Questa particolare frazione di colesterolo avrebbe un’azione protettiva contro la malattia aterosclerotica coronarica.
Sintesi acidi biliari
Gli acidi biliari sono sostanze detergenti, in grado cioè di disperdere in soluzione acquosa i lipidi insolubili in acqua; per questo motivo gli acidi biliari ricoprono un ruolo di primo piano nei processi di digestione ed assorbimento dei lipidi.
Gli acidi biliari vengono prodotti dal fegato a partire dal colesterolo e - insieme ai loro coniugati ed ai rispettivi sali - sono i principali costituenti della bile.
Acidi biliari primari (prodotti dal fegato)
L'enzima 7-α-idrossilasi dà il via a quella serie di trasformazioni biochimiche che, partendo dal colesterolo, portano alla sintesi degli acidi biliari primari: l'acido colico e dall'acido chenodesossicolico (o semplicemente chenico).
La 7-α-idrossilasi rappresenta l'enzima limitante nella sintesi degli acidi biliari.
Acidi biliari coniugati
Nella bile gli acidi colici e chenodesossicolici si trovano in gran parte coniugati con due amminoacidi, la glicina e la taurina (con un rapporto di circa 3:1), e come tali prendono il nome di acidi glicocolici, taurocolici (più abbondanti), glicochenodesossicolici e taurochenodesossicolici. Tale coniugazione aumenta l'idrosolubilità degli acidi biliari.
Sali biliari
Poiché la bile è un liquido alcalino ricco di sodio e potassio si ritiene che gli acidi biliari primari ed i loro coniugati siano presenti in gran parte sottoforma di sali (principalmente di sodio).
Acidi biliari secondari (prodotti dalla flora batterica intestinale)
A livello intestinale gli acidi biliari vengono in parte deconiugati e deidrossilati ad opera dell'enzima 7-α-deidrossilasi prodotto dalla flora batterica dell'intestino. I prodotti di queste reazioni sono chiamati acidi biliari secondari e sono rappresentati principalmente dall'acido desossicolico e dall'acido litocolico, rispettivamente derivati dall'acido colico e da quello chenodesossicolico.
In totale la maggior parte (94-98%) degli acidi biliari presenti a livello intestinale viene riassorbita e ricondotta al fegato tramite il circolo portale. Nel tenue e nel colon si ha un riassorbimento passivo che diventa attivo solo nell'ileo terminale (porzione conclusiva del tenue). Soltanto una piccola parte degli acidi biliari viene eliminata con le feci; tale quota è rappresentata perlopiù dall'acido litocolico, scarsamente riassorbito.
Gli acidi biliari, una volta riassorbiti, giungono a livello epatico dove sono riciclati e nuovamente secreti nella bile (circolo enteroepatico degli acidi biliari). La loro concentrazione, inoltre, influenza la sintesi ex-novo di acidi biliari, che risulta tanto più stimolata quanto minore è la quota di acidi biliari riciclabili (quelli secondari riassorbiti a livello intestinale), e viceversa.
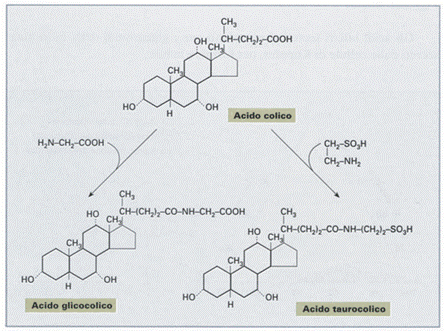
Gli acidi biliari primari (glicocolico e taurocolico) sono convertiti in secondari dai batteri della flora intestinale per ossidazione dell’idrossile in C7 (e riassorbiti dal circolo enteroepatico).
Acidi biliari nel sangue, acidi biliari alti
I sali biliari sfuggiti alla captazione epatica determinano le concentrazioni presenti nel sangue; per questo un danno epatocellulare riduce precocemente la captazione epatica degli acidi biliari (in particolare dal sangue proveniente dall'intestino). Alti livelli ematici di acidi biliari, ed in particolare di quelli secondari, si registrano quindi in presenza di epatite A, epatite B, mononucleosi infettiva, cirrosi, tumori del fegato ed epatopatie da farmaci o da alcol.
I livelli di acidi biliari nel sangue, ed in particolare di quelli primari, aumentano tipicamente nella colestasi, come quando - ad esempio - un calcolo impedisce il deflusso della bile nell'intestino. La stessa condizione si ha in alcune donne durante la gravidanza, a causa delle caratteristiche modificazioni ormonali che l'accompagnano.
Ittero
Si definisce ittero la colorazione giallastra della pelle, delle sclere e delle mucose causata dall'eccessivo innalzamento dei livelli di bilirubina nel sangue.
Affinché l'ittero sia visibile il livello di bilirubina deve superare 3-5 mg/dL.
È una condizione parafisiologica nel neonato, mentre è frequentemente segno di patologia nell'adulto.
Ittero a bilirubina prevalentemente indiretta
È dovuto a un'aumentata produzione di bilirubina e/o ad un'impossibilità da parte del fegato di effettuare il processo di coniugazione con acido glucuronico.
La produzione di bilirubina aumenta in corso di emolisi, cioè a una aumentata distruzione di globuli rossi. Questo avviene in alcune malattie del sangue: deficit enzimatici del globulo rosso (come il deficit di G6PD, glucosio-6-fosfato deidrogenasi, anche noto come "favismo").
Ittero a bilirubina prevalentemente diretta
È dovuto a colestasi, condizione in cui la bilirubina viene normalmente prodotta, va a costituire la bile, ma questa incontra un ostacolo e non può percorrere il normale tragitto che la porterebbe nell'intestino e quindi a essere eliminata con le feci.
Questo porta ad altri sintomi e segni:
- urine colorate (color marsala), dovute al fatto che la bilirubina diretta, essendo idrosolubile (a differenza di quella indiretta), una volta in circolo può essere eliminata con le urine
- feci chiare, dovute al fatto che il loro colore normale è dato dai pigmenti biliari che in questo caso non riescono a raggiungere l’intestino
- prurito, infatti nella bile sono presenti anche i Sali biliari che, quando vanno in circolo, tendono a depositarsi a livello cutaneo, dando appunto un intenso prurito
Ittero neonatale
L'ittero neonatale solitamente viene considerato fisiologico. Si osserva in circa il 50% dei neonati a termine e nell' 80% dei neonati pretermine. Si presenta in seconda/terza giornata e può durare fino a 8 giorni nei neonati a termine e fino a 14 nei pretermine. I livelli di bilirubina solitamente si assestano senza alcun intervento. I neonati con l'ittero neonatale vengono trattati con l'esposizione ad una intensa luce blu (fototerapia).
L'ittero neonatale può avere conseguenze nefaste in caso di Kernicterus in quanto la bilirubina ha degli effetti tossici sul sistema nervoso centrale e può provocare danni permanenti quando la sua concentrazione supera i 20-25 mg/dL.
Fonte: http://www.medwiki.it/sites/default/files/Biochimica%20del%20fegato.doc
Sito web da visitare: http://www.medwiki.it/
Autore del testo: non indicato nel documento di origine
Parola chiave google : Biochimica del fegato tipo file : doc
Visita la nostra pagina principale
Biochimica del fegato
Termini d' uso e privacy