Anatomia della foglia
Anatomia della foglia
La foglia è il solo organo ad accrescimento definito della pianta.
La bozza fogliare che abbiamo visto formarsi sui fianchi dell’apice vegetativo aumenta rapidamente di dimensioni grazie alle mitosi che , inizialmente, interessano tutta la bozza e, successivamente , si localizzano in certe regioni (per es. i margini laterali, destinati a espandere la lamina ) . I territori della bozza in cui cessano le mitosi avviano il processo di distensione , e contestualmente, il differenziamento verso i tipi cellulari adulti. Terminato in tutte le zone il differenziamento, la foglia ha raggiunto struttura e dimensioni definitive, che manterrà per tutto il periodo (pochi mesi o pochi anni ) della sua vita.
La morfologia delle foglie , dalla forma della lamina e del suo margine , alla distribuzione dei fasci conduttori (“nervature”), alle modalità di inserzione sul fusto (direttamente con la lamina oppure tramite una struttura assile detta picciolo, nella quale decorrono i fasci che poi innerveranno la lamina ) ecc.. è delle più varie ma caratteristica di ogni specie, tanto che , insieme alla fillotassi (anch’essa caratteristica della specie ) costituirà un importante strumento diagnostico, come potrete sperimentare nel corso di Botanica sistematica.
Ancora più numerose e diverse tra loro sono le caratteristiche anatomiche e istologiche, che spesso è possibile interpretare come risposte adattative ai vari ambienti. Le variazioni strutturali interessano tutti e tre i sistemi fondamentali che costituiscono la foglia : il sistema tegumentale, il sistema parenchimatico clorofilliano che effettuerà la fotosintesi , il sistema conduttore destinato a portare alla foglia acqua e sali minerali e ad esportare la sostanze organiche prodotte. Tuttavia, è possibile (e utile) estrarre da questa grande variabilità alcuni schemi generali , caratterizzanti le foglie dei 3 grandi gruppi sistematici (Gimnosperme e , fra le Angiosperme, Dicotiledoni e Monocotiledoni ) cui abbiamo fatto riferimento anche per l’anatomia di fusto e radice.
Nelle Dicotiledoni la lamina fogliare è portata dal fusto in modo da essere più o meno orizzontale e parallela al terreno. Conseguentemente, la sua faccia superiore risulterà direttamente esposta ai raggi solari, a differenza della faccia inferiore.
Nelle Monocotiledoni è più frequente un portamento verticale o leggermente obliquo della lamina fogliare, le cui facce risulteranno sostanzialmente esposte allo stesso tipo di illuminazione.
Nelle Gimnosperme le foglie non hanno la forma di sottili lamine espanse tipica delle Angiosperme, bensì di stretti e allungati cilindri aghiformi (pensate alle foglie di pino per es.).
A questi 3 modelli morfologici corrispondono strutture anatomiche interne profondamente diverse.
La foglia tipica delle Dicotiledoni è definita a “simmetria dorso ventrale ” e risulta costituita da una “metà ” superiore differente della “metà ” inferiore. (Fig. 33)
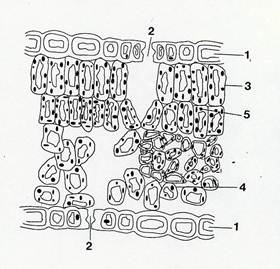
Fig.33 – Schema di sezione trasversale di lamina di foglia dorsoventrale.1: epidermide; 2: stomi; 3: palizzata; 4: lacunoso; 5: cloroplasto.
La faccia superiore , direttamente investita dalla radiazione solare, si trova esposta ad un microambiente più caldo e più secco (oltre che più illuminato, ovviamente ) rispetto a quello della faccia inferiore , ed è infatti provvista di sistemi di controllo e riduzione della perdita di acqua (più elevato grado di impermeabilizzazione, carenza o assenza di stomi) maggiori rispetto all’epidermide inferiore.(Tav.35)
E’ meno frequente che l’epidermide superiore faccia ricorso, per ridurre la traspirazione, anche alla presenza di peli di protezione. Questi , infatti, essendo morti e pieni di aria, riflettono la radiazione solare (le foglie provviste di un fitto tappeto di peli appaiono biancastre) e ciò ostacolerebbe la fotosintesi del sottostante parenchima clorofilliano.
Più diffusa la presenza di peli nell’epidermide inferiore, ricca di apparati stomatici e quindi sede della maggior parte degli scambi gassosi della foglia. La presenza di abbondanti peli di protezione, specialmente se ramificati e intrecciati , determina la formazione di uno “strato limite” più stabile e spesso. Per “strato limite”si intende la sottile zona di atmosfera circondante la foglia, zona che, per la semplice presenza della foglia, possiede caratteristiche fisiche (temperatura , umidità relativa) diverse dalla circostante atmosfera. In particolare è l’umidità relativa ad essere più elevata, perché i peli rallentano il movimento diffusivo del vapore acqueo che fuoriesce dalle aperture stomatiche e questo, come già detto in precedenza , a sua volta rallenta la diffusione di molecole di acqua dagli spazi intercellulari all’esterno. In assenza di peli lo strato limite è molto sottile e se l’aria intorno alla foglia è in movimento (“tira vento”) viene praticamente eliminato , causando un aumento della perdita di acqua per traspirazione da parte della foglia. Misure di traspirazione effettuate su diverse specie hanno dimostrato che, a parità di grado di apertura degli stomi, la perdita di acqua può essere superiore di 3-5 volte in “aria in movimento” rispetto a “aria immobile”.
La zona compresa fra le 2 epidermidi viene detta mesofillo. I tessuti del mesofillo sono essenzialmente parenchimi clorofilliani , anch’essi diversi nelle due metà della foglia.
La maggior parte della fotosintesi di una foglia viene svolta dai parenchimi della faccia superiore , esposti alle condizioni migliori di illuminazione. Per la forma e la disposizione delle cellule, questa zona è denominata “parenchima a palizzata”.
Le cellule del parenchima a palizzata sono più o meno cilindriche , allungate con il loro asse maggiore perpendicolare all’epidermide, ricche di cloroplasti e di spazi intercellulari. Questi ultimi non hanno grandi dimensioni ma interessano larga parte delle pareti delle cellule, le quali sono in contatto fra loro solo su ristrette superfici. Questo ampio sviluppo di superfici interne , di gran lunga maggiore della superficie esterna dell’intera foglia, è essenziale per un intensa fotosintesi: è a livello di queste superfici, liberamente esposte all’atmosfera degli spazi intercellulari, che avverranno gli scambi gassosi e in particolare l’ingresso di CO2 nelle cellule e nei cloroplasti.
La disposizione delle cellule del palizzata è la più soddisfacente anche per la penetrazione in profondità della radiazione solare. A parità di intensità luminosa incidente, uno strato di cellule allungate , perpendicolare alla superficie , frappone meno ostacoli (pareti cellulari) rispetto a 3 o4 strati di cellule disposte orizzontalmente .
Il parenchima a palizzata può essere costituito da uno o più strati cellulari sovrapposti. Specie caratteristiche di ambienti a bassa intensità luminosa (“specie sciafile”) hanno foglie con un solo strato di palizzata (eventuali strati sottostanti riceverebbero una radiazione insufficiente a sostenere una efficace fotosintesi) ; gli strati di palizzata sono invece 2 o più in piante di ambienti ad alta irradianza (“specie eliofile ”).
Le foglie di piante eliofile hanno quindi uno spessore maggiore e sono anche provviste di più accentuati dispositivi di controllo della traspirazione (cuticola, peli ecc.), perché ambienti ad alta irradianza sono anche più caldi ed aridi rispetto a quelli a bassa irradianza (es. un sottobosco) ed impongono, contemporaneamente , adattamenti all’elevata intensità luminosa e al secco (adattamenti xeromorfici).(Tav.36)
Le differenze fra specie eliofie e sciafile riguardano tutti i livelli dell’apparato fotosintetico, non solo quello istologico. Il parenchima clorofilliano delle piante sciafile contiene più cloroplasti (che sono anche più grossi e più ricchi di clorofille) per cellula rispetto alle piante eliofile. Queste ultime, tuttavia, avendo una maggiore quantità di parenchima clorofilliano, hanno un più elevato contenuto in clorofille per unità di superficie fogliare (per es. mg di clorofilla /dm2 di superficie fogliare) .Infine, nei cloroplasti di piante sciafile sono più abbondanti i sistemi di cattura della luce (i pigmenti dei sistemi antenna o LHC), visto che per loro è la luce il fattore limitante la fotosintesi, mentre in quelli di piante eliofile sono più abbondanti le proteine solubili implicate nella fissazione della CO2.
Le conseguenze di tutte queste differenze sull’andamento della fotosintesi sono vistose. Comunemente l’intensità della fotosintesi viene analizzata misurando gli scambi gassosi di una foglia e viene espressa, per es., in mg di CO2 assorbita/dm2 di superficie fogliare / minuto. Quando, in qualsiasi pianta, si rapporta l’intensità fotosintetica all’intensità luminosa incidente, si ottiene una curva come quella riportata nel grafico. (Fig 34) Ad irradianza 0 , cioè al buio, non si registra assorbimento ma emissione di CO2 (la fotosintesi ovviamente è assente ma la respirazione cellulare funziona). Man mano che l’irradianza aumenta, diminuisce l’emissione di CO2 (non perché la respirazione diminuisce, ma perché è iniziata la fotosintesi che assorbe e utilizza CO2). Ad una data irradianza, la curva intercetta l’asse delle ascisse e ciò significa che per quella intensità luminosa non c’è emissione ne assorbimento di CO2, o meglio l’emissione di CO2 dovuta alla respirazione è esattamente controbilanciata dall’assorbimento di CO2della fotosintesi. Questa intensità luminosa viene detta “punto di compensazione della luce ”. Al di sotto del punto di compensazione una pianta muore (perché consuma più di quanto produce), al punto di compensazione sopravvive ma non può crescere perché consuma, per il suo mantenimento tutto quanto produce. Aumentando ancora l’irradianza, la curva sale sopra l’asse delle ascisse, e ciò indica che la pianta ora produce per fotosintesi più di quanto consumi con la respirazione . L’incremento della fotosintesi diventa via via meno intenso con l’aumentare dell’ irradianza e infine si arresta ad una soglia oltre la quale ogni ulteriore somministrazione di energia radiante risulta ininfluente. Questa soglia è il “punto di saturazione della luce ”.
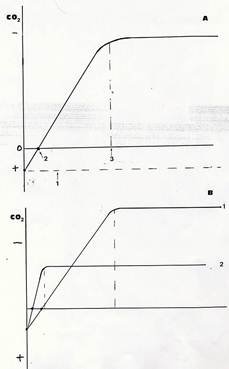
Fig.34 – In A è riportata la velocità (consumo di CO2) di fotosintesi (in ordinate ) in funzione dell’intensità luminosa (in ascisse). Sono evidenziati il tasso di respirazione al buio, (1) il punto di compensazione (2) e quello di saturazione (3). In B, i due grafici sono relativi a una pianta eliofila (1) e a una pianta sciafila (2)
I punti di compensazione e saturazione hanno valori molto diversi in piante sciafile ed eliofile, come mostra il grafico .In una pianta sciafila il punto di compensazione è molto vicino allo 0 a causa del basso livello di respirazione e dell’elevata efficienza di queste piante nella cattura della luce. A bassi livelli di irradianza, l’efficienza fotosintetica delle piante sciafile è superiore a quella delle eliofile. Il punto di saturazione viene però raggiunto già a modesti livelli di intensità luminosa (anzi, livelli più elevati riducono la fotosintesi perché l’apparato fotosintetico viene danneggiato).
Nelle piante eliofile il punto di saturazione è raggiunto ad irradianze molto superiori, che ovviamente determinano un’ intensità fotosintetica massima molto più elevata.
Differenze del tipo di quelle ora ricordate , anche se meno marcate , spesso si osservano anche all’interno della stessa specie (fra individui di popolazioni adattatesi ad ambienti con differenti livelli di irradianza ) e addirittura fra foglie della stessa pianta . In un albero le condizioni di illuminazione cui sono esposte le foglie apicali (o comunque periferiche) della chioma sono molto diverse da quelle delle foglie interne o basali e questa diversità si riflette in differenze (anatomiche, citologiche, ecc..) spesso molto consistenti (“foglie di sole”e “foglie di ombra”) .(Tav.36)
Anche la parte inferiore del mesofillo è costituita da parenchima clorofilliano, molto meno efficiente, tuttavia, fotosinteticamente. Le cellule contengono pochi cloroplasti, piccoli e con poca clorofilla;il fatto è spesso apprezzabile ad occhio nudo: le foglie sono in genere di un verde molto più intenso nella pagina superiore. Questo parenchima è detto “lacunoso” per sottolineare l’abbondanza e l’ampiezza degli spazi intercellulari, causati dalla forma e disposizione irregolare delle cellule. La rete di spazi intercomunicanti del parenchima lacunoso è collegata direttamente con l’atmosfera esterna tramite le aperture stomatiche ed assicura alla lamina fogliare rapidi scambi gassosi.
Nelle foglie dorsoventrali delle Dicotiledoni il tipo di nervatura più frequente è quello “penninervio ”: una grande nervatura centrale, ben visibile a occhio nudo perché sporgente nella faccia inferiore, dalla quale si dipartono lateralmente nervature di 1°, 2° ordine ecc.,. sempre più piccole e che si concludono con un gruppetto di 2 o 3 tracheidi che terminano a fondo cieco contro le cellule del mesofillo.
La nervatura principale contiene uno o più fasci conduttori, collaterali chiusi(almeno nelle foglie che vivono una sola stagione vegetativa), accompagnati da parenchima in genere privo o carente di cloroplasti (le nervature appaiono infatti chiare, biancastre, ad occhio nudo) e spesso da tessuto di sostegno (collenchimi o sclerenchimi) localizzato nelle zone sottoepidermiche .
L’abbondanza di tessuti meccanici è maggiore nelle piante di climi aridi, nelle quali il sostegno meccanico della foglia non può essere affidato al solo stato di turgore cellulare , difficile da realizzare in periodi di stress idrici.
Dimensioni a parte, la struttura delle nervature secondarie che percorrono il mesofillo ripete quella della nervatura centrale.
Nelle tipiche foglie di Monocotiledoni (foglie a simmetria isolaterale: Fig. 35 ) le due “facce” non so no esposte a microanbienti diversi ed hanno quindi struttura simile. Le due epidermidi sono cutinizzate e cuticolarizzate in modo identico e sono entrambe provviste di stomi. Il mesofillo è costituito da parenchima clorofilliano omogeneo non distinto in palizzata e lacunoso; quando è eterogeneo, sotto entrambe le epidermidi si trova parenchima simile al palizzata e nella parte centrale cellule più o meno isodiametriche con pochi cloroplasti. Nel mesofillo decorrono parallelamente i fasci conduttori collaterali chiusi (la nervatura più frequente è quella “parallelinervia” ), di dimensioni diverse fra di loro e in genere accompagnati da tessuti meccanici (prevalentemente sclerenchima) nelle zone sottoepidermiche .(Tav.37)
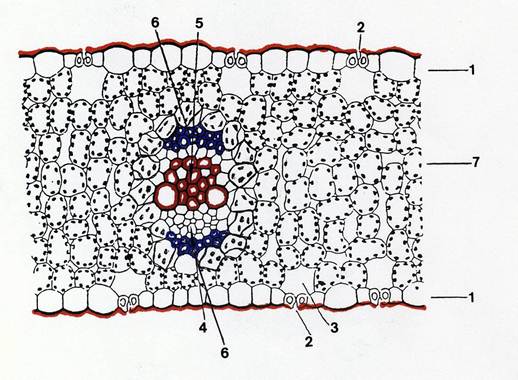
Fig.35 – Schema di sezione trasversale di foglia isolaterale. 1: epidermide, 2: stomi; 3: camera sottostomatica; 4: floema; 5: xilema; 6: fibre sclerenchimatiche; 7: parenchima clorofilliano.
In alcune Monocotiledoni (ed anche in alcune Dicotiledoni ) i fasci sono avvolti da una guaina di cellule parenchimatiche clorofilliane strettamente addossate fra di loro, contenenti cloroplasti diversi dai normali cloroplasti del mesofillo : dimensioni notevoli , carenza o assenza di grana nel sistema lamellare, abbondanza di amido. Questa particolare struttura , detta “anatomia Kranz” (Fig. 36) è nota da tempo ai Botanici ed oggi sappiamo essere collegata alla fotosintesi C4, il cui meccanismo è stato descritto nella parte di biologia cellulare (Tav.38). Conviene qui soffermarsi su due aspetti del funzionamento della foglia conseguenti a questo meccanismo.
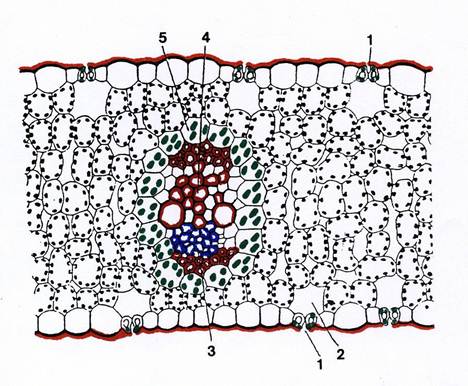
Fig.36 – La lamina fogliare di una pianta C4. 1: stomi, 2: camera sottostomatica; 3. floema ; 4: xilema; 5: guaina del fascio.
- se determiniamo la curva fotosintesi–irradianza usando la foglia di un pianta C4 e la confrontiamo con quella di una pianta C3 due vistose differenze emergono con chiarezza: nella C4 il punto di compensazione per la luce è più basso e il punto di saturazione è più elevato e, conseguentemente , più elevata è la fotosintesi massima (una pianta di mais, C4, produce più di una pianta di frumento, C3 ). Al punto di saturazione per la luce la fotosintesi non incrementa ulteriormente perché limitante non è più l’energia radiante bensì la disponibilità di CO2. In una pianta C4 il contenuto di CO2 diventa limitante “più tardi”, a più alti livelli di irradianza, grazie all’”altissima affinità ” per la CO2 della PEP carbossilasi, alla sua capacità, cioè, di consentire lo svolgimento della fotosintesi anche con concentrazioni di CO2 molto basse, di poco superiori allo 0. Questo è tanto vero che se misuriamo la fotosintesi di una pianta C3 in atmosfera arricchita artificialmente di CO2, otteniamo una curva molto simile a quella di una C4 .(Fig.37)
- il meccanismo C4 consente di risparmiare acqua. L’ efficienza nell’utilizzazione dell’acqua è misurata dalla “produttività di traspirazione ”(gr di acqua traspirata per grammo di sostanza secca prodotta ). Un valore medio per le piante C3 è 600-700 gr H2O/gr. s.s. , valore che si abbassa a circa 300 nelle piante C4 . Una pianta C4, può, a parità di altre condizioni, tenere gli stomi un po’ più chiusi di una C3 . grazie alla buona efficienza fotosintetica a livelli di CO2 molto bassi, che invece determinano il blocco della fotosintesi in una C3 . Questo ha dei riflessi importanti sulla traspirazione. A stomi aperti, la CO2 atmosferica diffonde dentro la foglia (“flusso assimilatorio”) e il vapor d’acqua dagli spazi intercellulari all’esterno(“flusso traspirazionale ”). Essendo entrambi movimenti di diffusione, il flusso è descritto da questa formula : ΔG/R, dove al numeratore troviamo la differenza di concentrazione fra le due zone , che è la forza motrice, e al denominatore la resistenza che il movimento incontra.
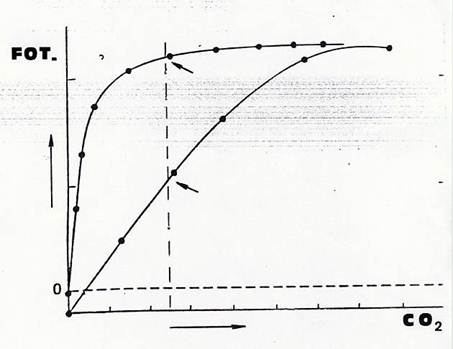
Fig 37 – Intensità fotosintetica, in piante C3 eC4, in funzione della concentrazione di CO2. La più elevata fotosintesi della pianta C4 in condizioni naturali di concentrazione di CO2(linea verticale tratteggiata ) dipende dalla migliore efficienza nell’uso della CO2.Il punto di compensazione per la CO2 (la concentrazione di CO2 alla quale la fotosintesi netta è nulla) è molto vicino a zero nella C4, sensibilmente più elevato nella C3. In atmosfera artificialmente arricchita di CO2, l’intensità fotosintetica delle due piante è simile. Questa intensità della pianta C4 è raggiunta già a concentrazioni di poco superiori a quella naturale
Per i due flussi la formula assume questa formula
Δg Δg
F.T.= --------- F.A. =----------------
Rl + Rs Rl + Rs+ Rm
dove ΔG è la differenza di concentrazione (di acqua fra interno e esterno , di CO2 fra esterno e interno) ; Rl la la resistenza dello strato limite e Rs la resistenza stomatica (che, per una data architettura stomatica, dipende essenzialmente dal grado di apertura degli stomi: più piccola è la rima stomatica, più alta la resistenza).
Per il flusso traspirazionale non dobbiamo ipotizzare altre resistenze perchè la diffusione del vapor acqueo inizia nella camera sottostomatica e si conclude nell’atmosfera (dove la concentrazione è più bassa).
Per il flusso assimilatorio dobbiamo introdurre un’altra resistenza : Rm o resistenza mesofillare. Il cammino diffusivo della CO2 è infatti più lungo e difficile. Inizia nell’atmosfera (dove la concentrazione di CO2 è più alta ) ma non si conclude negli spazi intercellulari: la CO2, per giungere al punto di utilizzo, che abbassa la concentrazione, deve attraversare la parete cellulare, il citosol e la membrana del cloroplasto. La resistenza apposta da quest’ultima parte del cammino è difficilmente misurabile ma sicuramente molto alta.
Stando così le cose, una parziale chiusura degli stomi aumenta Rs e quindi la resistenza totale di entrambi i flussi. Ma se restano invariate le altre resistenze (Rl per F.T. , Rl e Rm per F.A.)è evidente che percentualmente è aumentata molto di più la resistenza di F.T che quella di F.A. E quindi la traspirazione diminuisce molto più quando diminuisce la fotosintesi .
Naturalmente, bisogna permetterselo. E le C4, con il loro efficiente uso della CO2, possono permetterselo.
La più elevata efficienza nell’uso nell’acqua la riscontriamo non nelle piante C4 ma nelle piante CAM, nelle quali il raporto di traspirazione scende a 50-80 gr.\H2O/gr. di sostanza organicata.
CAM significa “metabolismo acido delle Crassulacee”. Per la prima volta nelle Crassulacee fu osservata una particolare variazione giornaliera dell’acidità del succo vacuolare, elevata di notte, bassa di giorno . Questa variazione circadiana è stata poi riscontrata anche in altre famiglie e si è capito essere la conseguenza di una particolare ritmica di apertura-chiusura degli stomi e di un meccanismo fotosintetico per molti aspetti simile a quello delle piane C4.
Le piante CAM sono tipiche di ambienti aridi e caldi. La scarsità di acqua nel terreno e l’elevata temperatura dell’aria (che abbassa l’umidità relativa e aumenta quindi il gradiente fra foglie e atmosfera ) determinerebbero una traspirazione elevata, non compensabile dall’assorbimento di acqua nel terreno, se le piante tenessero aperti gli stomi di giorno.
Queste piante aprono gli stomi di notte, quando la temperatura è più fresca, e li chiudono di giorno. Ovviamente la CO2 disponibile per la fotosintesi diurna è solo quella introdotta di notte e accumulata in forma di acidi organici nel vacuolo. La produttività di queste piante è quindi molto bassa. Il meccanismo fotosintetico e la ritmica di apertura degli stomi consentono però alle piante CAM di sopravvivere in ambienti estremi, impossibili per altre piante.
Meccanismi di controllo dell’apertura-chiusura degli stomi sono necessari e presenti (anche se non con le drastiche modalità delle CAM ) in tutte le piante.
La regolazione del grado di apertura della rima stomatica tende a realizzare un compromesso accettabile fra la necessità di introdurre abbastanza CO2 per la fotosintesi e la necessità di non perdere troppa acqua per traspirazione. Il meccanismo di controllo dovrà quindi essere sensibile ai fattori della fotosintesi (CO2, luce) ed anche allo stato idrico , della pianta come dell’atmosfera e del terreno.
In piante C3 e C4, la variazione giornaliera dell’energia radiante incidente , dell’intensità fotosintetica e del grado di apertura degli stomi sostanzialmente hanno lo stesso andamento, come indicato in Fig.38 .
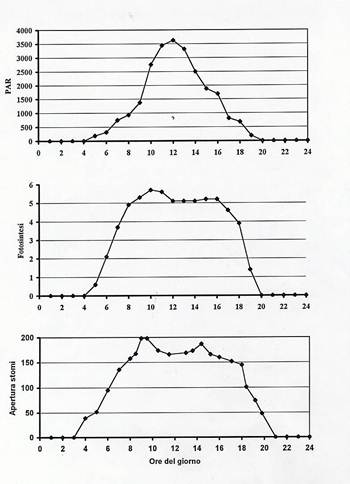
Fig.38 – Variazione giornaliera dell’irradianza (PAR), della velocità di fotosintesi, del grado di apertura degli stomi.
Il segnale “intensità luminosa” viene percepito dagli stomi e tradotto in una progressiva apertura della rima stomatica.
Abbiamo visto in precedenza che i cambiamenti di forma delle cellule di guardia derivano da variazioni dello stato di turgore delle stesse. L’ingresso (o l’uscita ) di acqua in una cellula avviene per osmosi e dipende dall’esistenza di un gradiente di potenziale idrico.
La ricerca del o dei soluti responsabili della formazione del gradiente ha una storia di decine di anni.
Per molto tempo è stata accettata l’ipotesi che le variazioni del potenziale idrico delle cellule di guardia dipendessero dalla trasformazione dell’amido (presente nelle cellule di guardia, che sono le uniche cellule epidermiche a contenere cloroplasti) in glucosio, (solubile e quindi osmoticamente attivo) e dalla trasformazione inversa . L’ipotesi era attraente perché collegava strettamente luce-fotosintesi-apertura e giustificava la presenza, nelle sole cellule di guardia, dei cloroplasti.
Una serie di risultati sperimentali, che sarebbe troppo lungo riportare, hanno fatto accantonare questa ipotesi e l’idea che fosse il glucosio la sostanza osmoticamente attiva.
Il principale soluto responsabile oggi è ritenuto il K+, per il quale sono state trovate variazioni di concentrazione molto elevate (anche 5-6 volte) nella transizione buio-luce e, quindi, chiusura-apertura .
Il pompaggio di K+ dentro le cellule di guardia si ritiene sia un trasporto secondario, preceduto e reso possibile dall’attivazione della pompa protonica che estrude H+ all’esterno . In molti esperimenti con spellature epidermiche o con sospensioni di protoplasti di cellule di guardia illuminate si è osservata infatti una intensa emissione di H+ (e quindi acidificazione del mezzo esterno ).
La pompa protonica consuma ATP (fornito dal cloroplasto ) per estrudere protoni e il gradiente protonico funziona da forza motrice per il trasporto, contro gradiente, di K+.
L’ ingresso di un catione richiede, per bilanciare le cariche , il contemporaneo ingresso (o generazione interna )di anioni. Con diverso peso nelle varie specie , gli anioni individuati sono Cl- e malato.
La genesi del malato merita di essere descritta. L’alcalinizzazione del citosol (dovuta all’estrusione di H+) attiva l’enzima PEP carbossilasi, che catalizza il legame della CO2 (proveniente dall’esterno) sul PEP formando acido malico, la cui dissociazione produce lo ione malato (che entra nel vacuolo) e H+, utilizzati dalla pompa. Il PEP deriva dall’idrolisi dell’amido e successiva glicolisi del glucosio. Come vedete, le vecchie indicazioni dei Botanici sulla scomparsa dell’amido alla luce e sulla sua riformazione al buio non erano sbagliate. Errate erano le deduzioni fatte.
Questa catena di eventi è schematizzata in Fig. 39.
Rimane da dire qualcosa sull’attivazione della pompa protonica da parte della luce . Come in tutte le fotorisposte, si parte dalla determinazione dello “spettro d’azione “ della luce .
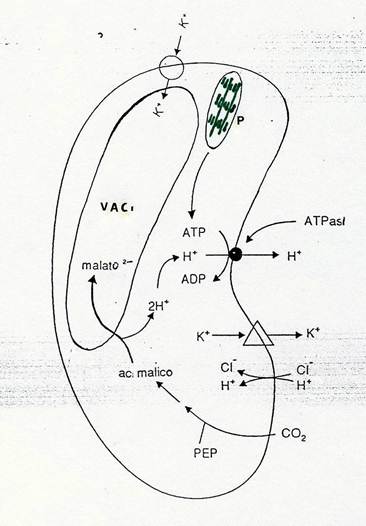
Fig 39 – Schema riassuntivo dei componenti il meccanismo di apertura e chiusura degli stomi. Nello schema ,Δ rappresenta il componente che estrude K+ sotto l’influenza di ABA.VAC= vacuolo; P = cloroplasto
I risultati indicano che sono presenti due diversi sistemi di fotoricezione (e non sappiamo perché siano necessari due sistemi). La prima componente è mediata dal cloroplasto , perché coincide con lo spettro di assorbimento della clorofilla, la seconda è attivata dalla luce blu (“risposte alla luce blu”ne abbiamo già incontrate ). Entrambe stimolano il pompaggio di protoni. La seconda componente probabilmente attiva direttamente la pompa.
Il controllo della chiusura degli stomi ha più componenti. In tutte le piante sono presenti sia una chiusura idropassiva che una chiusura idroattiva .
Le cellule di guardia sono esposte direttamente all’ambiente esterno e quindi possono perdere acqua (e gli stomi si chiudono) direttamente nei confronti di un’ atmosfera particolarmente secca anche quando lo stato idrico della pianta è soddisfacente. In queste condizioni, la pianta potrebbe perdere acqua senza danni immediati ma visto il forte gradiente di potenziale idrico con l’atmosfera, l’introduzione di una molecola di CO2 le costerebbe la perdita di troppe molecole di acqua . Meglio rimandare la fotosintesi a tempi migliori
Quando la foglia si trova in condizioni di deficit idrico, entrano in azione i meccanismi di chiusura idroattiva. Grosso modo , nelle cellule di guardia si verificano, in direzione opposta, tutti quei cambiamenti che abbiamo descritto a proposito dell’apertura. E a scatenarli sono la redistribuzione e una accelerata biosintesi di ABA. E’ stato dimostrato che è proprio lo stato di deficit idrico delle cellule del mesofillo che attiva redistribuzione e biosintesi di ABA.
Una chiusura idroattiva può verificarsi anche quando la foglia non è in situazione di stress idrico ma lo è invece l’apparato radicale perché l’acqua nel terreno si va esaurendo. Si tratta di una “risposta preventiva “: la pianta non potrà più essere rifornita di acqua ; quella ancora presente nella pianta è bene conservarla per evitare guai peggiori. Anche in questo caso il “messaggero” e poi l’esecutore è l’ABA: lo stato di stress idrico scatena nella radice la sintesi di ABA che verrà poi trasportato alle foglie con la corrente ascensionale nello xilema.
La morfologia delle foglie delle Gimnosperme (sottili aghi e non lamine espanse ) ricorda molto quella delle xerofite (piante adattate a vivere in ambienti aridi). Uno degli adattamenti più diffusi nelle xerofite è infatti la riduzione della superficie fogliare fino ai casi estremi (es. un cactus) di riduzione delle foglie a spine.
La struttura interna delle foglie di Gimnosperme suggerisce considerazioni analoghe (Tav.39). L’epidermide ha pareti di notevole spessore, talvolta lignificate, e lo strato di cuticola è rilevante. Gli stomi si aprono al fondo di cavità (camera prestomatica) parzialmente ostruite dalle cere I primi strati cellulari sottoepidermici sono occupati da fibre (ipoderma meccanico ) con grosse pareti secondarie lignificate. Il parenchima clorofilliano è compatto, con pochi spazi intercellulari .Il sistema conduttore è costituito da una unica nervatura , che percorre longitudinalmente l’ago senza mai ramificarsi. La nervatura contiene uno o più fasci collaterali, circondati da un tessuto detto di “trasfusione ” per il suo ruolo di trasferimento di acqua e soluti dai fasci al mesofillo e viceversa. Le cellule del tessuto di trafusione sono di tipo parenchimatico ma spesso sono presenti, e rendono più facile il trasporto, vere e proprie tracheidi con punteggiature areolate. L’intera nervatura è circondata da uno strato monocellulare che ha le caratteristiche strutturali dell’endoderma visto nella radice e che, al pari di quello radicale, interviene nel controllare gli scambi di acqua e soluti.
L’insieme di queste caratteristiche anatomiche ha un chiaro significato. Controllo e riduzione degli scambi gassosi, in particolare della traspirazione. All’origine di questa necessità non è l’ambiente in cui vivono (le Gimnosperme si ritrovano in zone aride come umide ) quanto piuttosto la funzionalità del loro tessuto conduttore, costituito esclusivamente da fibrotracheidi. La velocità di flusso in questo sistema è molto bassa (un valore indicativo può essere 1-2 m/h, mentre in un Angiosperma la velocità è 10-20 m/h ) a prescindere dalla disponibilità idriche del terreno. Molto bassa dovrà necessariamente essere la velocità con cui l’acqua viene persa per traspirazione dalle foglie .
Fonte: http://www.agr.unifi.it/laboratorio/biologia/testi/ANATOMIA%20DELLA%20FOGLIA.doc
Anatomia della foglia
Anatomia della foglia
Visita la nostra pagina principale
Anatomia della foglia
Termini d' uso e privacy