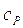Calore specifico
Calore specifico
Tabella calore specifico materiali
Calori specifici
I valori sono calcolati a 20 °C e 1 atm, se non diversamente indicato
| Sostanza | cal/g × °C | J/kg × °C |
| Alluminio | 0.21 | 896 |
| Argento | 0.057 | 239 |
| Rame | 0.092 | 385 |
| Zinco | 0.096 | 389 |
| Piombo | 0.031 | 129 |
| Ferro | 0.108 | 450 |
| Stagno | 0.057 | 239 |
| Bronzo | 0.091 | 380 |
| Invar (lega di acciaio al 36% di Ni) | 0.11 | 460 |
| Ottone | 0.091 | 380 |
| Oro | 0.031 | 129 |
| Mercurio | 0.033 | 139 |
| Carbone vegetale | 0.263 | 1200 |
| Zolfo | 0.175 | 732 |
| Ghiaccio ( a 0 °C) | 0.488 | 2040 |
| Acqua ( a 0 °C) | 1.01 | 4218 |
| Acqua | 1 | 4180 |
| Acqua di mare | 0.95 | 3925 |
| Glicerolo | 0.572 | 2390 |
| Etanolo | 0.581 | 2430 |
| Benzina | 0.536 | 2240 |
| Olio lubrificante | 0.443 | 1850 |
| Petrolio | 0.455 | 1900 |
| Aria | 0.24 | 1005 |
| Idrogeno | 3.397 | 14280 |
| Ossigeno | 0.291 | 917 |
| Azoto | 0.248 | 1038 |
| Biossido di carbonio | 0.20 | 836 |
| Vapore d'acqua ( a 100 °C) | 0.464 | 1940 |
- Il calore specifico dell’acqua, 1 Cal/g °C a 14.5 °C e 1 atm, è superiore a quello della maggior parte delle altre sostanze.
Fonte: http://www.tuttowebitalia.com/tabelle/tabella-calore-specifico-materiali.html
Misura del calore specifico
Obiettivo: Utilizzare il calorimetro delle mescolanze per determinare il calore specifico di alcune sostanze.
Strumenti e materiali occorrenti:
- Calorimetro delle mescolanze con agitatore e termometro
- Pezzi di materiali differenti (rame, ferro, alluminio, ecc.) di cui si vuole misurare il calore specifico
- Acqua distillata
- Una bilancia e un cilindro graduato
- Un recipiente per riscaldare l'acqua
- Un fornello elettrico
Fasi dell’esperimento:
Prima di determinare il calore specifico di alcune sostanze utilizzando il calorimetro, devi conoscere il suo equivalente in acqua me.
Misura dell'equivalente in acqua del calorimetro
Procedi nel seguente modo inserendo tutti i dati misurati nella tabella 1:
|
T1 (°C) |
T2 (°C) |
Te (°C) |
me (g) |
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
- versa nel calorimetro 300 g di acqua (m1), mescola e leggi la temperatura T1;
- scalda 200 g di acqua (m2) fino a una temperatura di circa 80 °C; prima di versare l'acqua nel calorimetro, misurane la temperatura T2;
- dopo aver aver rapidamente versato l'acqua e chiuso con il coperchio il calorimetro, mescolando, aspetta che sia raggiunto l'equilibrio termico, quindi misura la temperatura Te;
- calcola l'equivalente in acqua del calorimetro, me, con la formula:

- la misura dell'equivalente in acqua del calorimetro è sicuramente influenzata da errori sperimentali. Per minimizzarli, ripeti il procedimento altre due volte, infine calcola la media dei tre valori.
Esegui l'esperimento:
- Incomincia con la prima sostanza di cui vuoi misurare il calore specifico cs riportando in tabella 2 tutti i dati misurati, compresi gli errori assoluti associati;
- versa una quantità ml di acqua (che hai misurato con una bilancia) nel calorimetro e misurane la temperatura T1; gli errori assoluti sulla massa e sulla temperatura sono uguali alla sensibilità degli strumenti di misura utilizzati;
- versa nel recipiente una certa quantità di acqua e dopo aver misurato la massa m2 del primo pezzo di metallo, immergilo nel recipiente e riscalda il tutto sul fornello;
- quando l'acqua arriva a ebollizione (T2=100 °C), aspetta qualche secondo affinché il pezzo raggiunga l'equilibrio termico, quindi estrailo con la pinza il più rapidamente possibile, in modo da evitare che si raffreddi, immergilo nel calorimetro e chiudi con il coperchio; riporta anche il valore T2 nella tabella 2 con relativo errore;
- mescola l'acqua dentro il calorimetro in modo che il sistema si porti all'equilibrio termico e, quando il termometro non rileva più variazioni, misura la temperatura Te.
- ripeti la misura per gli altri materiali e completa la tabella 2.
Sostanza |
m1 |
ea (m1) |
T1 |
ea(T1) |
m2 |
ea (m2) |
T2 |
ea (T2) |
T e |
ea (T2) |
|
(g) |
(g) |
(°C) |
(°C) |
(g) |
(g) |
(°C) |
(°C) |
(°C) |
(°C) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Elaborazione e rappresentazione dei dati:
Ora devi ricavare il calore specifico cs delle sostanze considerate a partire dai dati raccolti. Nel S.I. l'unità di misura del calore specifico è J/(kg K). Per comodità, nel nostro esperimento utilizziamo cal/(g °C). Uguagliando il calore assorbito dall'acqua a quello ceduto dal pezzo di materiale posto dentro il calorimetro, si ottiene:

dove ca è il calore specifico dell'acqua. Poiché ca è pari a 1 cal/(g °C) risolvendo rispetto a cs si ot‑
tiene quindi: 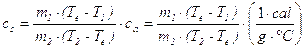
Per ottenere un valore più preciso del calore specifico, si deve tenere conto dell'equivalente in acqua del calorimetro me e, quindi, aggiungere questo valore a m1. La relazione precedente diventa:

Pertanto:
- per ciascun pezzo calcola cs e cs' attraverso le due relazioni scritte sopra e riporta i valori nella tabella 3;
- accanto vanno inseriti gli errori percentuali, che ottieni calcolando l'errore relativo con le regole della propagazione degli errori. Inoltre, l'errore assoluto dell'equivalente in acqua del calorimetro è dato dalla semidispersione massima dei dati di me raccolti nella tabella 1.
sostanza |
cs (cal/(g °C)) |
ε % |
cs’ (cal/(g °C)) |
ε’ % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- Confronta i valori misurati del calore specifico delle sostanze in esame con i dati riportati nei libri di testo. Le differenze che hai riscontrato dipendono dall'accuratezza con cui hai eseguito tutte le operazioni, comprese quelle di misura. Sai identificare le possibili cause di errore?
Calore specifico a temperatura ambiente (T =273 K) e a pressione atmosferica
sostanza |
c (J/kgK) |
c (cal/(g °C) |
sostanza |
c (J/kgK) |
c (cal/(g °C) |
Acqua |
4186 |
|
Rame |
387 |
|
Alluminio |
880 |
|
Acciaio |
502 |
|
Ferro |
460 |
|
|
|
|
Fonte: http://www.luzzago.soluzione-web.it/Resource/Calorespecifico.doc
Calore specifico
Salvatore Battaglia & Jolanda Coralli
Calorimetri e calori specifici
TESINA
Corso di Fondamenti
di Fisica I
Prof. V. Bellini
══════════════════════════════════════════════════
ANNO ACCADEMICO 2002 – 2003
Calori specifici e calorimetri
In questa tesina trattiamo il problema della definizione e del calcolo del calore specifico, e la descrizione ed il funzionamento di due diversi tipi di calorimetri: il calorimetro delle mescolanze o di Regnault e il calorimetro di Bunsen.
L'approccio è di tipo didattico, il tema trattato ci appare alla portata di un uditorio di studenti del quarto anno di una scuola secondaria superiore.
Le conoscenze che vengono richieste per la parte generale e per la parte applicativa sono: la termometria e il concetto di temperatura, l'equazione dei gas perfetti, il I principio della termodinamica, il principio di equipartizione dell'energia, il momento angolare e il momento d'inerzia.
Abbiamo dunque diviso l'argomento nei seguenti paragrafi:
1. Introduzione;
- Capacità termica e calore specifico;
- Calorimetri;
- Calorimetro delle mescolanze o di Regnault;
- Calorimetro di Bunsen;
4. Calori specifici nei gas.
1. Introduzione.
È ben noto che mettendo a contatto termico due corpi a diversa temperatura, il corpo più caldo diminuisce di temperatura, mentre la stessa aumenta nel corpo più freddo. Se sono lasciati in contatto per un po’ di tempo, i due corpi raggiungeranno infine una temperatura d'equilibrio comune che ha valore compreso fra le due temperature iniziali. In casi come questo si dice che del calore si è trasferito dal corpo più caldo a quello più freddo. I primi ricercatori che si posero il problema di scoprire la causa del trasferimento di calore, supponevano che il calore fosse una sostanza materiale invisibile, detta "calorico", che veniva trasferita da un corpo all'altro. Secondo questa teoria il calorico non poteva essere né creato né distrutto e il primo esperimento che si pose in contrasto con questa teoria fu fatto da Benjamin Thompson alla fine del diciottesimo secolo. Thompson notò che nel perforare un cannone d'artiglieria a Monaco, veniva sprigionata una grande quantità di calore e l'acqua che veniva usata per raffreddare il trapano doveva essere spesso rimpiazzata e molta di essa evaporava. Secondo la teoria del calorico sarebbe dovuto accadere che aumentando le dimensioni della limatura, sarebbe dovuta diminuire la capacità della limatura stessa di trattenere il calorico e inoltre il trasferimento di calorico all'acqua di raffreddamento ne avrebbe dovuto causare l'ebollizione. Thompson trovò che le quantità d'acqua fatte evaporare da un trapano smussato o da uno appuntito erano confrontabili per una data velocità, e congetturò che una quantità di calorico quasi infinita poteva essere prodotta da una quantità finita di limatura di metallo. Egli rigettò la teoria del calorico e pensò al calore come una forma di moto trasferito dal trapano all'acqua.
Un altro esperimento che fu fatto contro la teoria del calorico fu quello eseguito da Sir Humphry Davy, il quale sfregò due blocchi di ghiaccio fra loro in un giorno in cui la temperatura esterna era inferiore a 0ºC e notò che essi si sciolsero.
Pertanto fu evidente che il lavoro meccanico fatto sul sistema era equivalente alla somministrazione diretta di calore allo stesso, cioè che calore e lavoro sono entrambi forme di energia. Comunque solo nella seconda metà del diciannovesimo secolo si sviluppò il concetto meccanico moderno del calore. Infatti proprio in questo periodo gli esperimenti fatti da James Joule dimostrarono che ogni qual volta del calore viene ceduto o assorbito da un sistema durante qualche trasformazione, l'assorbimento o la cessione di calore possono essere spiegate da un'equivalente quantità di lavoro meccanico fatto dal sistema.
2.Capacità termica e calore specifico
Il concetto di calore non ha senso se riferito ad un corpo, in quanto esso indica l'energia trasferita da un oggetto ad un altro, cioè il flusso di calore è un trasferimento di energia che ha luogo come conseguenza di differenze di temperatura.
Cerchiamo ora di definire la quantità di calore ΔQ in termini di un processo specifico. L'unità di misura del calore comunemente usato è la caloria (cal).
La caloria è definita come la quantità di calore necessaria per aumentare la temperatura di 1g di acqua da 14,5ºC a 15,5ºC alla pressione di 1 atmosfera.
La quantità di calore necessaria per innalzare di una certa quantità la temperatura di una sostanza di massa data varia da una sostanza all'altra e dalle condizioni in cui avviene la trasformazione. Infatti, per esempio, il calore richiesto per innalzare di 1ºC la temperatura di 1 g d'acqua è 1 cal, mentre il calore necessario per variare di 1ºC la temperatura di 1g di carbonio è solo 0.12 cal (bisogna osservare che le trasformazioni che stiamo considerando avvengono entrambe in laboratorio a pressione di 1 atmosfera, e quindi sono trasformazioni a pressione costante).
La capacità termica, C', di un campione particolare di una sostanza è definita come la quantità di calore necessaria per aumentare la temperatura del campione stesso di un grado Celsius.
In pratica, è spesso più facile utilizzare il calore specifico, c, definito come la capacità termica per unità di massa:

Il calore molare, C, di una sostanza è definito come la capacità termica per mole:
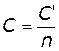
Poiché il numero di moli, n, è uguale alla massa, m, divisa per il peso molecolare, M, possiamo esprimere il calore molare nella forma

Dalla definizione di capacità termica si può dunque esprimere la quantità di calore ΔQ trasferita tra un sistema di massa m e l'ambiente per una variazione di temperatura ΔT come:
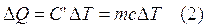
Si osservi che se la temperatura aumenta, ΔT e ΔQ sono entrambi positivi, implicando che il calore viene assorbito dal sistema. Viceversa, quando la temperatura diminuisce, ΔT e ΔQ sono negativi e il calore viene ceduto dal sistema.
Le definizioni date dalle equazioni (1) e (2) assumono che il calore specifico non varia con la pressione e con la temperatura nell'intervallo ΔT.
In realtà, ciò non è vero. Le variazioni con la pressione sono tanto più notevoli quanto più bassa è la temperatura. Esse non seguono leggi generali semplici. Tuttavia, per pressioni sufficientemente piccole (dell'ordine di qualche atmosfera) e a temperature non troppo basse, la variazione dei calori specifici con la pressione è molto piccola. Più interessante è la variazione dei calori specifici con la temperatura. In generale essi aumentano con la temperatura. Il mercurio fa eccezione, e anche l'acqua ha un comportamento anomalo. Comunque, essi variano di poco, infatti, per esempio, il calore specifico dell'acqua (1,00 cal/gºC) varia solo di circa 1% da 0ºC a 100ºC alla pressione di 1 atmosfera.
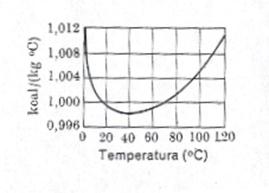 Fig.1 Variazione del calore specifico dell'acqua con la temperatura; in ascissa sono riportate le temperature in °C, in ordinate il calore specifico in kcal/(kg °C)
Fig.1 Variazione del calore specifico dell'acqua con la temperatura; in ascissa sono riportate le temperature in °C, in ordinate il calore specifico in kcal/(kg °C)
Quindi le equazioni corrette sono:
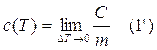
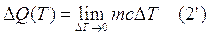 .
.
Iniziamo con il trattare trasformazioni a pressione costante, isobare. Si ha:
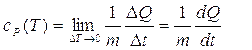
 .
.
Analogamente, la capacità termica molecolare a volume costante, isocora, è data da

 .
.
 Fig.2 Calore specifico a pressione costante di germanio e silicio
Fig.2 Calore specifico a pressione costante di germanio e silicio
Si capisce, quindi, da tali relazioni che il calore specifico e capacità termica dipendono non solo dal materiale in esame e dalla sua temperatura, ma anche dal tipo di trasformazione a cui i materiali sono soggetti.
I calori specifici dei solidi e dei liquidi che di solito consideriamo, sono quelli a pressione atmosferica costante in quanto ottenuti in laboratorio dove la pressione è quella di una atmosfera; per i solidi le capacità termiche a volume costante non differiscono di molto dalle precedenti a causa della scarsa dilatazione termica (cioè l'aumento di volume che si verifica nel riscaldamento a pressione costante è piccolo), mentre per i liquidi si possono avere differenze apprezzabili.
Prima di proseguire nell'esaminare il comportamento dei gas introduciamo i calorimetri, fondamentali per l'individuazione dei calori specifici.
3. Calorimetri.
Il calorimetro è un dispositivo utilizzato sia per determinare la quantità di calore ceduta o assorbita in un processo chimico o fisico, sia per valutare il calore specifico delle diverse sostanze.
Vediamo in dettaglio due tipi di calorimetri, che sono i più comunemente usati nei laboratori: il calorimetro delle mescolanze o di Regnault e il calorimetro a ghiaccio o di Bunsen.
3.1 Calorimetro delle mescolanze o di Regnault.
Il calorimetro delle mescolanze, o di Regnault, è il più semplice dei calorimetri ad acqua ed è usato per la misura del calore specifico. Esso è composto da un recipiente termicamente isolato, generalmente di legno, per evitare perdite di calore con l'esterno, e da una nota quantità d'acqua in cui sono immersi un termometro ed un agitatore.

Fig. del Calorimetro delle mescolanze o di Regnault.
Nel momento in cui si procede ad effettuare l'esperimento, è necessario avere a disposizione altra acqua e sostanze solide, non solubili in acqua, di cui si vuole calcolare il calore specifico.
Per calcolare il calore specifico del corpo preso in esame, è necessario calcolare l'equivalente in acqua del calorimetro A.
Esso può essere determinato sperimentalmente nel seguente modo:
- si considera una massa iniziale di acqua M a temperatura
 ;
; - si aziona l'agitatore e si rileva la temperatura d'equilibrio t;
- si eguaglia la quantità di calore
 che viene assorbita in parte dall'acqua e in parte dal sistema costituito dal calorimetro, dal termometro e dall'agitatore, ottenendo così la relazione:
che viene assorbita in parte dall'acqua e in parte dal sistema costituito dal calorimetro, dal termometro e dall'agitatore, ottenendo così la relazione:

e potendo ricavare da essa A.
Per la misura del calore specifico di un corpo (solido) si procede nel seguente modo:
- si versa nel calorimetro una massa M nota di acqua alla temperatura ambiente
 misurata con il termometro;
misurata con il termometro; - si immerge il corpo di calore specifico incognito
 ;
; - dopo aver agitato il sistema con l'agitatore si misura la temperatura di equilibrio T;
- abbiamo già preventivamente calcolato l'equivalente in acqua del calorimetro A, quindi possiamo porre la relazione

dove c e 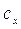 sono rispettivamente il calore specifico dell'acqua a noi noto, e quello incognito da trovare.
sono rispettivamente il calore specifico dell'acqua a noi noto, e quello incognito da trovare.
Quindi risulta che:
 .
.
3.1 Calorimetro di Bunsen.
Questo dispositivo è formato da un'ampolla a cui è saldata una provetta. L'ampolla, contenente acqua, è in comunicazione con un capillare a mezzo di un condotto pieno di mercurio. Facendo evaporare un pò di etere nella provetta, intorno ad essa si forma uno strato di ghiaccio a causa del raffreddamento dovuto all'evaporazione. Il calorimetro è pronto e viene immerso in un recipiente ben isolato contenente ghiaccio fondente, in modo che tutto il dispositivo si porti a 0°C.
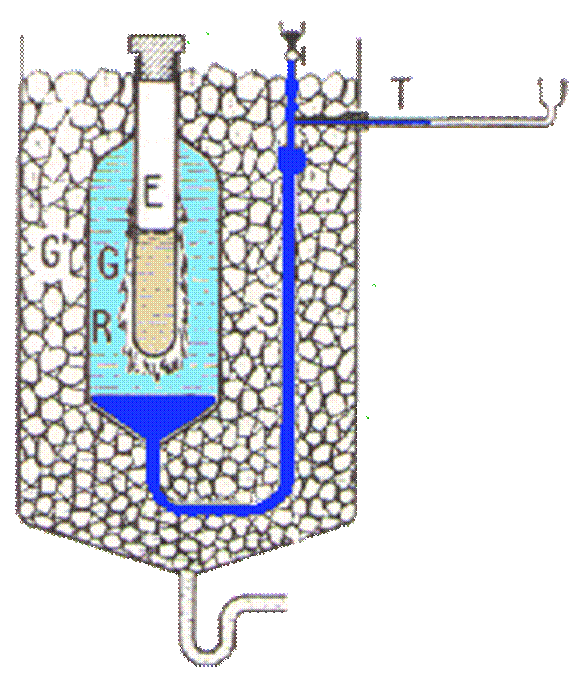
Fig. del Calorimetro di Bunsen:
E:provetta; G:ghiaccio; R:serbatoio; S:tubo; T:capillare graduato;
Ora il dispositivo è pronto e possiamo procedere all'esperimento. Se immergiamo un corpo caldo nella provetta, notiamo che una parte del ghiaccio fonde a causa del calore cedutagli dal corpo. Nella fusione del ghiaccio si ha una diminuzione di volume del sistema ghiaccio-acqua contenuta nell'ampolla e di conseguenza il mercurio del capillare indietreggia verso sinistra. Sul capillare sono segnate alcune divisioni ugualmente distanziate. Il numero di divisioni di cui arretra il mercurio è proporzionale alla massa di ghiaccio fusa, proporzionale alla quantità di calore cedutagli dal corpo immerso nella provetta. Quindi il rapporto di due quantità di calore è definito come rapporto dei corrispondenti numeri di divisione di cui arretra il mercurio, quando queste quantità di calore sono somministrate al calorimetro e dunque si ha che le due quantità di calore sono uguali se tali sono i numeri di tacche di cui arretra il mercurio nel capillare, una quantità di calore Δ .
.
4. Calori specifici nei gas.
Analizziamo adesso ciò che succede nei gas, e poiché il comportamento dei gas reali a bassa densità approssima quello del gas perfetto, studiamo il calore specifico e la capacità termica nel caso di un gas perfetto.
Le grandezze macroscopiche di un gas perfetto sono legate fra loro dalla equazione di stato dei gas perfetti:

dove n è il numero di moli di gas e R (=8,31J/mol K) è la costante universale dei gas.
Microscopicamente un gas perfetto è costituito da molecole il cui volume complessivo è di gran lunga minore di quello del recipiente che contiene il gas. Le molecole hanno un moto disordinato e urtano elasticamente tra loro e con le pareti del contenitore. In queste condizioni, le molecole non hanno nessuna energia potenziale interna, quindi l'energia interna è solo quella cinetica. Si può dimostrare che l'energia cinetica traslazionale media per molecola è  , cosicché l'energia interna U di un gas perfetto contenente N molecole è
, cosicché l'energia interna U di un gas perfetto contenente N molecole è
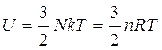
Consideriamo dapprima il caso di un gas monoatomico e cerchiamo di calcolare i calori specifici molari 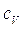 .
.
Supponiamo che un certo numero di molecole di un gas perfetto sia contenuta in un cilindro chiuso da un pistone. Il cilindro è posto a contatto con una sorgente di calore che può essere regolata a piacimento. La pressione p del gas è tale che viene bilanciata dal peso del pistone e da eventuale sabbia posta sopra di esso. Effettuiamo adesso due tipi di trasformazioni differenti: una a volume costante (isocora) e l'altra a pressione costante (isobara).
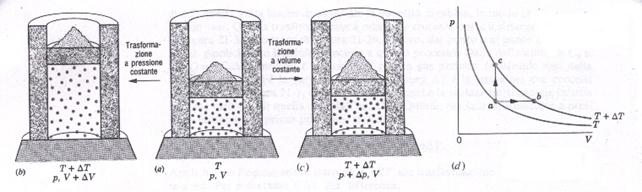 Fig.3 La temperatura di una determinata massa di gas viene innalzata della stessa quantità con una trasformazione isobara (a→b) e con una trasformazione a volume costante (a→c).
Fig.3 La temperatura di una determinata massa di gas viene innalzata della stessa quantità con una trasformazione isobara (a→b) e con una trasformazione a volume costante (a→c).
Per effettuare la trasformazione isocora, abbassiamo lentamente la temperatura della sorgente e togliamo sul pistone della sabbia in modo tale che il volume rimanga costante. Consideriamo il primo principio della termodinamica,
 ,
,
considerando la definizione di 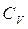 è nullo poiché non si ha variazione di volume. Quindi
è nullo poiché non si ha variazione di volume. Quindi
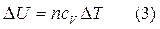 .
.
Ora, ripartendo dal sistema allo stato intermedio, effettuiamo la trasformazione isobara, innalzando lentamente la temperatura, ma questa volta senza aggiungere sabbia sul pistone, in modo che la pressione non vari. Dalla definizione di 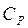 ,si ha , sempre per il primo principio della termodinamica,
,si ha , sempre per il primo principio della termodinamica,
 .
.
Poiché la variazione di temperatura  , quindi uguagliando le equazioni (3) e (4) si ha:
, quindi uguagliando le equazioni (3) e (4) si ha:
 .
.
Ma per p costante si ha:

e quindi sostituendo nella (5), si ottiene:


da cui il risultato noto col nome di relazione di Mayer

Questo risultato è valido per un qualsiasi gas perfetto,e implica che il calore molare di un gas perfetto a pressione costante è più grande del calore molare a volume costante di una quantità R (che è la costante universale dei gas). Per ottenere tale risultato si è ipotizzato che U dipenda solo ed esclusivamente dalla temperatura e non abbiamo usato la relazione  , che invece utilizziamo adesso con la (3) per ottenere il calore specifico a volume costante per un gas perfetto monoatomico per variazioni infinitesimali
, che invece utilizziamo adesso con la (3) per ottenere il calore specifico a volume costante per un gas perfetto monoatomico per variazioni infinitesimali
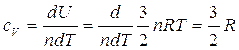 .
.
Da questo risultato, utilizzando la relazione di Mayer, si ottiene il valore del calore specifico a pressione costante dello stesso gas.
Il rapporto di calori molari è una quantità adimensionale 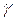 data da
data da
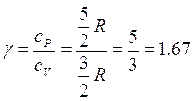
Si verifica sperimentalmente che questi valori  è stato derivato per un gas perfetto monoatomico e ci si attende qualche contributo addizionale al calore specifico dalla struttura interna delle molecole più complesse.
è stato derivato per un gas perfetto monoatomico e ci si attende qualche contributo addizionale al calore specifico dalla struttura interna delle molecole più complesse.
Per un gas biatomico (due atomi per molecola), possiamo pensare che ogni molecola sia strutturata a forma di manubrio (due sfere unite da un'asta rigida). Consideriamo un sistema di riferimento cartesiano ortogonale in cui l'asse delle x coincide con l'asta rigida, il momento d'inerzia attorno a quell'asse è trascurabile, e quindi l'energia rotazionale è costituita da due soli termini,  , fornisce la stessa energia di ciascun grado traslazionale, così che per un gas biatomico avente un moto di rotazione e di traslazione,
, fornisce la stessa energia di ciascun grado traslazionale, così che per un gas biatomico avente un moto di rotazione e di traslazione,

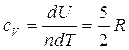


Per gas poliatomici, secondo il nostro modello ciascuna molecola è costituita da tre o più sfere, unite da aste rigide, in modo che la molecola è in grado di ruotare attorno a ciascuno dei tre assi reciprocamente perpendicolari. Quindi, per un gas poliatomico avente sia moto di rotazione che di traslazione,

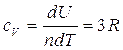

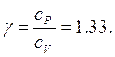
Tipo di gas |
Gas |
|
|
|
|
Mono-atomico |
He |
4,97 |
2,98 |
1,99 |
1,67 |
Biatomi- |
|
6.87 |
4,88 |
1,99 |
1,41 |
Poliato-mico |
|
8,83 |
6,80 |
2,03 |
1,30 |
Vediamo adesso cosa succede nel caso di una trasformazione a temperatura costante (isoterma) per un gas perfetto.
Questo tipo di trasformazione si può effettuare considerando un gas in un recipiente il cui volume viene variato da un valore iniziale  .
.
La legge di Boyle afferma che in una trasformazione di questo tipo è valida la relazione

che è costante.
Il gas si comporta come se fosse dotato di calore specifico il cui valore, indeterminato, è 
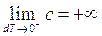 ;
;
 lievemente inferiore a quella necessaria per l'isoterma, si ottiene una lieve variazione dT<0 (diminuzione) di temperatura, sicché ora al limite, per dT che tende a 0 da sinistra, l'isoterma appare dotata di calore specifico negativo ed infinitamente grande
lievemente inferiore a quella necessaria per l'isoterma, si ottiene una lieve variazione dT<0 (diminuzione) di temperatura, sicché ora al limite, per dT che tende a 0 da sinistra, l'isoterma appare dotata di calore specifico negativo ed infinitamente grande
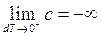 .
.
Infine, consideriamo il caso in cui si effettua una trasformazione adiabatica cioè una trasformazione nella quale il sistema non scambia calore con l'ambiente esterno. Una trasformazione di questo tipo si può avere con un recipiente isolato termicamente contenente un gas in cui viene variato il volume. Per le trasformazioni adiabatiche reversibili è valida la relazione
 .
.
Durante questa trasformazione si hanno variazioni di temperatura senza che si fornisca calore al gas, quindi il calore specifico è uguale a zero.
Appendice
Dimostriamo come l'energia cinetica traslazionale media per molecola sia pari a  .
.
L'equazione di Joule-Clausius afferma che:

considerando l'espressione della velocità quadratica media

l'equazione di Joule-Clausius si scrive

dove 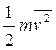 si ha
si ha

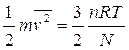
Si ottiene in questo modo un legame tra la temperatura del gas, che è una grandezza macroscopica, e le energie cinetiche traslazionali delle molecole che sono grandezze microscopiche. Poiché ogni mole di gas contiene un numero di molecole uguale al numero  molecole, così dall'ultima equazione si ottiene:
molecole, così dall'ultima equazione si ottiene:

dove la costante universale
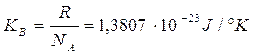
viene chiamata costante di Boltzmann.
Indice
Indice |
pag. |
Calori specifici e calorimetri |
2 |
1. Introduzione. |
3 |
2. Capacità termica e calore specifico |
5 |
3. Calorimetri |
10 |
3.1 Calorimetro delle mescolanze o di Regnault. |
10 |
3.1 Calorimetro di Bunsen. |
14 |
4. Calori specifici nei gas. |
17 |
Appendice |
26 |
Indice |
28 |
Se consideriamo un sistema contenente un gran numero di molecole tali che ognuna di esse ha una propria struttura interna, l'energia posseduta da tali molecole sarà l'energia cinetica di traslazione di tutte le molecole, l'energia cinetica di vibrazione degli atomi in una molecola e l'energia potenziale di vibrazione degli atomi in una molecola. Quando un numero di particelle è grande ed è valida la meccanica newtoniana, tutti i termini hanno lo stesso valor medio e che questo valor medio dipende soltanto dalla temperatura.. questo è denominato Principio di equipartizione dell'energia e fu dedotto da Maxwell. È possibile dimostrare la sua validità attraverso un'analisi statistica.
Fonte: http://www.lemur.it/Sissis/Calorimetri%20e%20calori%20specifici.doc
Calore specifico
Scheda di laboratorio: Misura del calore specifico di un corpo
Argomento
Il calore specifico di un corpo è una costante che dipende solo dalla sostanza di cui è costituito il corpo. Quantitativamente esso è espresso dalla formula:
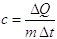
Il calore specifico è il rapporto tra la quantità di calore scambiata da un corpo conseguentemente ad una variazione di temperatura (t) e il prodotto della massa per la variazione della temperatura.
Per le misure del calore specifico si usa il calorimetro, un recipiente costituito da materiali che minimizzano gli scambi di calore con l'ambiente esterno.
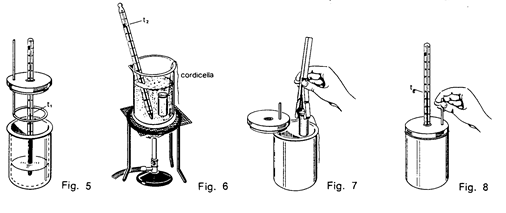 Materiale occorrente
Materiale occorrente
- 300 cc di acqua
- 1 fornello
- 1 reticella amiantata
- 1 cilindro graduato da 100 cc
- 1 calorimetro con agitatore, coperchio
- 1 termometro da 0 a +110C, con sensibilità 0,1°C
- 1 termometro da 0° a 50 °C con sensibilità 0,1C
- 1 bicchiere da 400 cc circa
- campioni di ferro, ottone, alluminio, PVC
- 1 campione di vetro
- 1 pinza
- 1 cordicella
- bilancia
- calcolatrice
Esecuzione dell'esperimento
Nel corso dell'esperienza faremo riferimento alle figure precedenti.
1. Con una bilancia misuriamo la massa del campione mc = ............ .
2. Servendoci di una cordicella introduciamo il campione di ………………. nel bicchiere ove si trovi l’acqua e mettiamo a scaldare l'acqua con il campione e il termometro sul fornello. Lasciamo bollire l'acqua per un po' di tempo in modo che acqua, termometro e campione abbiano la stessa temperatura t2= .......... (intorno ai 100 C).
3. Nel frattempo, facendo uso del cilindro graduato, introduciamo nel calorimetro una massa ma = 100 g di acqua a temperatura ambiente e facciamo stabilizzare la temperatura dell'acqua e del calorimetro. Prendiamo nota di questa temperatura t1 = ............ .
4. Servendoci ancora della cordicella immergiamo rapidamente il campione tolto dall'acqua bollente nel calorimetro, richiudiamolo con il coperchio e mescoliamo con l'agitatore. Aspettiamo un paio di minuti, poi misuriamo la nuova temperatura di equilibrio te.
Se abbiamo avuto cura di chiudere bene il coperchio del calorimetro possiamo affermare che tutto il calore perso dal corpo è stato assorbito dall'acqua, quindi usando la relazione fondamentale della termologia Q = c m t, possiamo scrivere:
Q1 = 1 ma (te – t1) per il calore assorbito dall'acqua
Q2 = c mc (t2 – te) per il calore ceduto dal corpo
dove 1 cal/g C è il calore specifico dell'acqua e c quello incognito del corpo. Per quanto prima detto Q1 = Q2 e pertanto possiamo scrivere:
c mc(t2 – te ) = 1 ma (te – t1)
dalla quale possiamo ricavare il calore specifico incognito c del corpo:
 .
.
L'ultima formula è vera solo approssimativamente in quanto non si è tenuto conto che parte del calore perso dal corpo viene assorbito dal calorimetro, dal termometro e dall'agitatore. Per tener conto di questo fenomeno si osserva che tutto avviene come se inizialmente l'acqua avesse una massa ma+me dove il termine me viene definito equivalente in acqua del calorimetro Per i calorimetri in uso me= ……
In conclusione la formula corretta da applicare per il calcolo di c è :
 .
.
Per comodità riportiamo in ordine le grandezze misurate:
ma=.............. (massa dell'acqua)
mc = .............. (massa del campione)
me= ……… g (equivalente in acqua del calorimetro)
t1 = .............. (temperatura di equilibrio iniziale dell'acqua contenuta nel calorimetro)
t2 = .............. (temperatura del campione prima dell'immersione nel calorimetro)
te = .............. (temperatura finale di equilibrio tra acqua e campione immerso nel calorimetro)
c = .................................................................................................................................................……
Con gli strumenti a disposizione l'errore assoluto sulla misura del calore specifico deve essere in entrambi casi inferiore a 0,01 cal/ g C. Confrontare quindi i valori trovati con quelli riportati nella seguente tabella. C'è accordo tra le misure entro l'errore previsto? ...............
Sostanza |
Calore specifico (cal/g °C) |
Calore specifico trovato (cal/g °C) |
Ferro |
0,11 |
|
Alluminio |
0,21 |
|
Ottone |
0,09 |
|
PVC |
? |
|
Fone: http://www.rtl.mcastelvi.ss.it/Esperienze%20non%20RTL/Scheda%20calore%20specifico.doc
Calore specifico
Visita la nostra pagina principale
Calore specifico
Termini d' uso e privacy