Struttura atomica
Struttura atomica
I riassunti, le citazioni e i testi contenuti in questa pagina sono utilizzati per sole finalità illustrative didattiche e scientifiche e vengono forniti gratuitamente agli utenti.
STRUTTURA ATOMICA
Ancora negli ultimi decenni dell’800 tanto i fisici, quanto i filosofi, si chiedevano se gli atomi fossero realtà fisiche oppure solo costruzioni mentali. Sicuramente il modello atomico della materia era in grado di spiegare numerosi fenomeni, ma nessuno poteva affermare con assoluta certezza l’esistenza degli atomi, poiché di ciò vi erano soltanto prove indirette. I maggiori sviluppi in questo settore delle scienze vennero dallo studio delle relazioni tra materia ed elettricità.
Nel 1752 Benjamin Franklin, grazie all’esperienza col parafulmine, aveva dimostrato che l’elettricità ottenuta dal cielo aveva le stesse caratteristiche di quella prodotta sulla Terra . Nonostante ciò ben poco si poteva ancora dire tanto dell’elettricità che si nascondeva nella bottiglia di Lieda caricata dal fulmine, quanto della luce prodotta dal riscaldamento dell’aria conseguente alla scarica elettrica atmosferica. Un modo per approfondire l’argomento poteva essere quello di scaricare l’elettricità nel vuoto, per vedere come si presentata l’elettricità “nuda”, priva cioè di contatti con la materia dell’aria. All’epoca di Franklin purtroppo non esistevano gli strumenti per produrre quantitativi di elettricità tali da generare un flusso continuo di corrente (che andasse cioè oltre le scariche intermittenti che si ottenevano con le bottiglie di Leida); mancavano inoltre metodi efficaci per ottenere un vuoto sufficiente ad escludere ogni interazione tra corrente elettrica e particelle di aria.
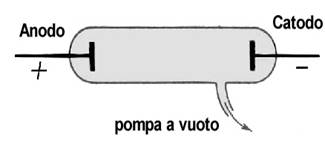 Tuttavia nel corso della prima metà dell’800, prima Volta con la pila e poi Faraday col generatore di corrente, riuscirono a produrre flussi continui di corrente, mentre nel 1855 l’inventore tedesco Wilhelm Geissler (1814 – 1879) riuscì a produrre una pompa capace di eliminare il 99,9 % dell’aria contenuta entro un recipiente sigillato. Abile soffiatore di vetro, Geissler produceva recipienti con due pezzi di metallo sigillati alle estremità opposte e poi vi aspirava l’aria (tali recipienti presero successivamente il nome di tubi di Geissler). Collegando i due pezzi di metallo sigillati nel tubo ai poli opposti di un generatore questi si caricavano elettricamente di segno contrario (in accordo con la terminologia introdotta da Faraday, la placca positiva era un anodo, mentre quella negativa era un catodo). Si otteneva quindi un passaggio della corrente nel tubo che, inizialmente, produceva una luce simile a quella che si osserva nei tubi al neon. Continuando ad abbassare la pressione la luce nel tubo si attenuava, fino a scomparire del tutto; a partire dal catodo si formava allora una luminosità colorata che si dirigeva verso l’anodo, ripresentandosi in modo identico ad ogni ripetizione dell’esperienza: si trattava forse dell’elettricità nuda? Il fisico tedesco Eugene Goldstein (1850 – 1930), studiò attentamente il fenomeno, scoprendo che non dipendeva né dal gas presente entro il tubo prima dello svuotamento, né dal tipo di metallo con cui erano fatti anodo e catodo. Egli concluse quindi che il fenomeno dipendeva unicamente dal passaggio della corrente nel vuoto, cui dette il nome di raggi catodici, in quanto andavano dal catodo verso l’anodo.
Tuttavia nel corso della prima metà dell’800, prima Volta con la pila e poi Faraday col generatore di corrente, riuscirono a produrre flussi continui di corrente, mentre nel 1855 l’inventore tedesco Wilhelm Geissler (1814 – 1879) riuscì a produrre una pompa capace di eliminare il 99,9 % dell’aria contenuta entro un recipiente sigillato. Abile soffiatore di vetro, Geissler produceva recipienti con due pezzi di metallo sigillati alle estremità opposte e poi vi aspirava l’aria (tali recipienti presero successivamente il nome di tubi di Geissler). Collegando i due pezzi di metallo sigillati nel tubo ai poli opposti di un generatore questi si caricavano elettricamente di segno contrario (in accordo con la terminologia introdotta da Faraday, la placca positiva era un anodo, mentre quella negativa era un catodo). Si otteneva quindi un passaggio della corrente nel tubo che, inizialmente, produceva una luce simile a quella che si osserva nei tubi al neon. Continuando ad abbassare la pressione la luce nel tubo si attenuava, fino a scomparire del tutto; a partire dal catodo si formava allora una luminosità colorata che si dirigeva verso l’anodo, ripresentandosi in modo identico ad ogni ripetizione dell’esperienza: si trattava forse dell’elettricità nuda? Il fisico tedesco Eugene Goldstein (1850 – 1930), studiò attentamente il fenomeno, scoprendo che non dipendeva né dal gas presente entro il tubo prima dello svuotamento, né dal tipo di metallo con cui erano fatti anodo e catodo. Egli concluse quindi che il fenomeno dipendeva unicamente dal passaggio della corrente nel vuoto, cui dette il nome di raggi catodici, in quanto andavano dal catodo verso l’anodo.
E’ significativo rilevare che tali esperienze, tra l’altro, dimostrarono come Franklin avesse sbagliato nell’ipotizzare che l’elettricità fluisse dal polo positivo (anodo) a quello negativo (catodo). Egli del resto aveva basato la propria supposizione sull’assunto che l’elettricità fosse un fluido, concettualmente analogo ad un liquido o ad un gas, che poteva essere scambiato tra oggetti mediante lo strofinio. Franklin decise inoltre, in modo del tutto arbitrario, che il fluido doveva passare dallo straccio al vetro, nel quale si sarebbe accumulato, determinando un eccesso e quindi una carica positiva; in modo simmetrico poi il fluido doveva passare dalla resina alla straccio, per cui nella resina si generava un difetto e dunque una carica negativa. In ragione di ciò era logico immaginare che l’elettricità, come ogni altro fluido conosciuto, dovesse scorre dalla parte dove era in eccesso (polo +), verso quella dove era in difetto (polo −), al fine di ristabilire l’equilibrio. Anche Faraday, nell’assegnare i nomi ai due elettrodi o poli fece riferimento alla visione di Franklin ed assegnò il nome di anodo, che in greco significa “via in salita”, al polo positivo, mentre chiamo catodo, che in greco significa “via in discesa”, al polo negativo. Del resto Franklin, che non aveva basato la sua scelta su alcun dato sperimentale, aveva cinquanta probabilità su cento di indovinare ed aveva sbagliato. Gli esperimenti di Goldstein e degli altri che vennero subito dopo, viceversa dimostrarono che le correnti fluiscono dal polo negativo a quello positivo. Tuttavia, nonostante ciò, in fisica ed in elettrotecnica convenzionalmente ancora si continua a mantenere per la corrente il senso di circuitazione di Franklin; in effetti, ai fini pratici, ciò non ha nessuna importanza, in quanto i risultati sono esattamente gli stessi, indipendentemente dalla direzione in cui si immagina che la corrente fluisca, purché, come in ogni convenzione, ci si attenga sempre all’accordo preso e non si cambi parere a metà strada.
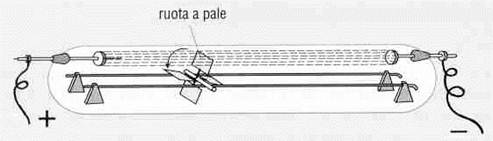 Ulteriori studi sui raggi catodici dimostrarono che se un oggetto solido veniva sigillato nel tubo di fronte al catodo, appariva un’ombra dell’oggetto all’estremità dove era l’anodo: evidentemente ciò che partiva dal catodo veniva in parte arrestato dall’oggetto solido. Nel 1878, il fisico inglese William Crookes (1832 – 1919) avendo inventato apparecchi ancora più perfezionati per creare il vuoto, costruì tubi più sofisticati, chiamati inizialmente tubi di Crookes e successivamente tubi catodici, entro i quali rimaneva appena 1/ 75.000 dell’aria presente nei tubi di Geissler. I raggi catodici apparivano ora più chiaramente e Crookes poté dimostrare che si muovevano in linea retta, in quanto producevano delle ombre, e riuscivano addirittura a far girare un piccola ruota inserita nel tubo medesimo.
Ulteriori studi sui raggi catodici dimostrarono che se un oggetto solido veniva sigillato nel tubo di fronte al catodo, appariva un’ombra dell’oggetto all’estremità dove era l’anodo: evidentemente ciò che partiva dal catodo veniva in parte arrestato dall’oggetto solido. Nel 1878, il fisico inglese William Crookes (1832 – 1919) avendo inventato apparecchi ancora più perfezionati per creare il vuoto, costruì tubi più sofisticati, chiamati inizialmente tubi di Crookes e successivamente tubi catodici, entro i quali rimaneva appena 1/ 75.000 dell’aria presente nei tubi di Geissler. I raggi catodici apparivano ora più chiaramente e Crookes poté dimostrare che si muovevano in linea retta, in quanto producevano delle ombre, e riuscivano addirittura a far girare un piccola ruota inserita nel tubo medesimo.
Tuttavia la natura dei raggi catodici rimaneva oscura. Qualche studioso osservò che se essi emergevano dal catodo, carico negativamente, poteva darsi che avessero una carica elettrica negativa e quindi potessero essere influenzati dalle forze elettriche.
Nel 1897 il fisico inglese J.J. Thomson (1856 – 1940) sottopose a verifica questa ipotesi, facendo passare i raggi catodici tra due lamine metalliche parallele, una delle quali era carica positivamente, mentre l’altra era carica negativamente. Egli constatò che le cariche disposte sulle lamine facevano deviare la traiettoria dei raggi catodici nella direzione della lamina caricata positivamente. Ciò dimostrava che i raggi catodici erano particelle veloci, ognuna delle quali era portatrice di una carica elettrica negativa. Ma quale era l’entità di questa carica? Come sappiamo Faraday aveva fatto ampi studi sul modo in cui la corrente elettrica induce le reazioni chimiche, arrivando nel 1832 a stabilire le leggi dell’elettrochimica che portano il suo nome. In base a queste leggi, ed alla meticolosa misurazione della quantità di elettricità necessaria per depositare una massa nota di una certa sostanza, era possibile calcolare la grandezza della carica elettrica necessaria per far depositare un singolo atomo di essa . Sembrava a questo punto ragionevole ritenere che la carica elettrica coinvolta nel cambiamento chimico di un singolo atomo fosse la più piccola carica elettrica esistente, detta per questo carica elementare, e corrispondesse a quella di un raggio catodico; era quindi plausibile la supposizione che una particella catodica stesse all’elettricità come un atomo sta alla materia. Una volta nota la carica elettrica della particella catodica (pari ad 1,6 10-19 coulomb), Thomson riuscì a determinarne la massa, misurando l’entità della deviazione che le particelle subivano sotto l’effetto di forze elettriche e magnetiche . I risultati furono sorprendenti. Per quanto riguarda gli atomi, infatti, già ai tempi di Thomson si sapeva che il più piccolo di tutti e quello di idrogeno, ma la particella catodica aveva una massa corrispondente a circa 1/1837 della massa di questo ultimo. Per un secolo gli scienziati avevano avuto al certezza che gli atomi fossero le più piccole cose esistenti e che quindi il più piccolo degli atomi fosse la cosa più piccola dotata di massa. Ora questa convinzione andava modificata, ma gli scienziati del tempo ritennero che la particella catodica, potendosi considerare come l’atomo di elettricità, non fosse parte della materia, in quanto l’elettricità era una forma di energia e non di materia. In base a tale assunto non doveva quindi sorprendere che le particelle catodiche fossero molto più piccole degli atomi di materia e potessero scorrere attraverso di essa sotto forma di corrente elettrica. Essendo molto più piccola dell’atomo, la particella catodica venne chiamata particella subatomica; ad essa Thomson volle dare il nome di elettrone, un termine che già era stato introdotto per indicare la più piccola carica elettrica deducibile dalle leggi di Faraday. E’ quindi giusto dire che Thomson scoprì l’elettrone nel 1897.
A questo punto, se nella materia vi sono gli elettroni fino dall’inizio, è possibile dare una nuova e migliore spiegazione ai fenomeni elettrici. Nell’elettrizzazione per strofini, ad esempio, lo straccio cede una parte dei suoi elettroni alla resina, che si carica negativamente, mentre il vetro cede alcuni dei suoi elettroni allo straccio, caricandosi positivamente. Più in generale, qualunque sostanza che riceve elettroni in più accumulerà una carica negativa, mentre se perde alcuni dei suoi elettroni accumulerà una carica positiva. Una corrente elettrica consisterà quindi in un flusso di elettroni che attraversano la materia del conduttore. Dunque, nel tubo catodico, quando la corrente arriva al catodo dal generatore gli elettroni vi si accumulano, caricandolo negativamente, e vengono forzati a viaggiare nel tubo verso l’anodo come un fascio di raggi catodici.
Tuttavia, anche se appariva sempre più probabile che gli elettroni potessero esistere nella materia, veniva dato in un certo senso per scontato che queste particelle di elettricità esistessero separatamente ed indipendentemente dagli atomi, i quali si riteneva fossero indivisibili. Dobbiamo a questo punto fare riferimento ancora una volta alle esperienze di Faraday sull’elettrolisi, il quale avevano tra l’altro dimostrato che la corrente può attraversare certe soluzioni, dette per questo elettrolitiche (ad esempio quelle del cloruro di sodio, il comune sale da cucina) mentre non poteva attraversare altre soluzioni definite perciò non elettrolitiche (ad esempio il saccarosio, il comune zucchero da cucina). Come sappiamo Faraday intuì che qualcosa nella soluzione portava le cariche negative in una direzione e le cariche positive nell’altra; pur non sapendo definire con precisione le caratteristiche dei portatori di carica, decise di chiamarli ioni (dalla parola greca che significa “viandante”).
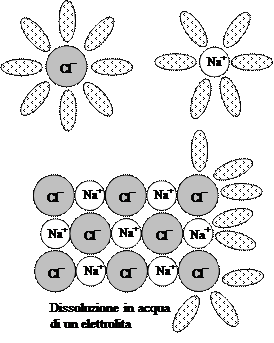 . Quando Thomson scoprì l’elettrone, alcuni anni dopo il lavoro di Arrhenius, apparve chiaro che gli ioni negativi erano atomi con uno o più elettroni in eccesso, mentre gli ioni positivi erano atomi che avevano perduto alcuni degli elettroni normalmente presenti al loro interno.
. Quando Thomson scoprì l’elettrone, alcuni anni dopo il lavoro di Arrhenius, apparve chiaro che gli ioni negativi erano atomi con uno o più elettroni in eccesso, mentre gli ioni positivi erano atomi che avevano perduto alcuni degli elettroni normalmente presenti al loro interno.
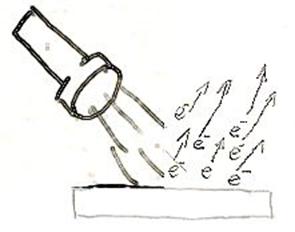 . Ad un certo punto apparve chiaro che l’effetto fotoelettrico non trattava allo stesso modo i due tipi di carica elettrica: infatti un pezzetto di zinco caricato negativamente perdeva la sua carica elettrica quando veniva esposto ai raggi ultravioletti (una radiazione simile alla luce, ma più potente), mentre un pezzetto di zinco carico positivamente non ne veniva affatto modificato e manteneva la propria carica. Evidentemente lo zinco caricato negativamente aveva un eccesso di elettroni e se la luce, in qualche modo, ne provocava l’espulsione, il metallo si scaricava. Viceversa, lo zinco carico positivamente aveva un deficit di elettroni, che la luce non poteva in alcun modo compensare, per cui la sua carica rimaneva immutata. Ad ulteriore conferma di questa ipotesi, Thomson verificò che le particelle cariche negativamente che la luce espelleva dai metalli avevano la stessa massa e la stessa carica delle particelle catodiche ed era pertanto sicuramente elettroni. Successivamente si dimostrò inoltre che gli elettroni emessi da metalli diversi avevano tutti le stesse proprietà; in altri termini, anche se esistevano molti tipi diversi di atomi, tutti avevano associati un unico tipo di elettrone.
. Ad un certo punto apparve chiaro che l’effetto fotoelettrico non trattava allo stesso modo i due tipi di carica elettrica: infatti un pezzetto di zinco caricato negativamente perdeva la sua carica elettrica quando veniva esposto ai raggi ultravioletti (una radiazione simile alla luce, ma più potente), mentre un pezzetto di zinco carico positivamente non ne veniva affatto modificato e manteneva la propria carica. Evidentemente lo zinco caricato negativamente aveva un eccesso di elettroni e se la luce, in qualche modo, ne provocava l’espulsione, il metallo si scaricava. Viceversa, lo zinco carico positivamente aveva un deficit di elettroni, che la luce non poteva in alcun modo compensare, per cui la sua carica rimaneva immutata. Ad ulteriore conferma di questa ipotesi, Thomson verificò che le particelle cariche negativamente che la luce espelleva dai metalli avevano la stessa massa e la stessa carica delle particelle catodiche ed era pertanto sicuramente elettroni. Successivamente si dimostrò inoltre che gli elettroni emessi da metalli diversi avevano tutti le stesse proprietà; in altri termini, anche se esistevano molti tipi diversi di atomi, tutti avevano associati un unico tipo di elettrone.
Da tale serie di evidenze apparve sempre più chiaramente che gli elettroni erano costituenti fondamentali della materia, presenti in ogni momento in qualsiasi tipo di atomo. Questa consapevolezza generò tuttavia un nuovo problema: se gli elettroni erano carichi negativamente, ma gli atomi erano elettricamente neutri, dovevano esistere nell’atomo cariche elettriche positive capaci di neutralizzare quelle degli elettroni. Stando così le cose, se da un atomo si rimuovevano gli elettroni, ciò che restava doveva essere carico positivamente; viceversa, aggiungendo elettroni ad un atomo questo ne possedeva un eccesso, rispetto alla situazione di partenza, e quindi risultava carico negativamente. Tutto ciò spiegava a questo punto anche gli anioni ed i cationi dell’elettrolisi. In base a queste ipotesi, nel 1898 Thomson propose la prima struttura atomica che teneva conto della  carica elettrica. Il modello atomico di Thomson descriveva l’atomo come una minuscola sfera omogenea, dotata di una carica elettrica positiva diffusa, entro cui erano incorporati gli elettroni in numero sufficiente da rendere nulla la carica totale. Tale modello è stato anche definito a panettone, dove la massa della pasta rappresenterebbe alla carica positiva diffusa, mentre gli elettroni corrisponderebbero all’uvetta.
carica elettrica. Il modello atomico di Thomson descriveva l’atomo come una minuscola sfera omogenea, dotata di una carica elettrica positiva diffusa, entro cui erano incorporati gli elettroni in numero sufficiente da rendere nulla la carica totale. Tale modello è stato anche definito a panettone, dove la massa della pasta rappresenterebbe alla carica positiva diffusa, mentre gli elettroni corrisponderebbero all’uvetta.
Secondo il modello di Thomson l’atomo continuava ad essere pieno e compatto, privo cioè di spazi vuoti, in accordo con tutte le teorie che si erano andate sviluppando nell’800, a partire dal modello di Dalton. Tale concezione, del resto, non poteva essere messa facilmente in discussione, in quanto mancavano gli strumenti per poter sondare in modo più approfondito l’intima struttura dell’atomo. Tuttavia, negli stessi anni in cui Thomson effettuava i suoi esperimenti, altri fisici stavano scoprendo nuovi fenomeni e costruendo nuovi congegni che, da li a pochi anni, sarebbero stati in grado di approfondire notevolmente le conoscenze sulla struttura atomica. In particolare il fisico francese Antoine Henri Becquerel (1852 – 1908) stava studiando la fluorescenza di alcuni composti dell’uranio. Per i suoi esperimenti si serviva di lastre fotografiche e, durante una pausa di alcuni giorni del suo lavoro, mise in un cassetto alcune lastre, avvolte nella carta nera, con sopra il minerale di uranio. Sviluppando successivamente, per altri scopi, alcune di queste lastre, si accorse che qualcosa era riuscito ad impressionarle, nonostante l’involucro nero. Approfondendo gli studi, Becquerel comprese che il fenomeno, cui venne successivamente dato il nome di radioattività, era dovuto all’emissione, da parte degli atomi di uranio, di un tipo finora sconosciuto di radiazioni. Studi ulteriori dimostrarono che la radioattività consisteva nell’emissione di tre differenti particelle, chiamate rispettivamente α, β e γ, così chiamate dalle prime tre lettere dell’alfabeto greco. Le particelle α hanno due cariche positive, pari in valore assoluto a quelle di due elettroni, ed hanno massa quattro volte quella dell’atomo di idrogeno (in sostanza esse sono nuclei dell’elemento chimico elio); i raggi β sono elettroni molto veloci, mentre i raggi γ sono radiazioni dotate di grande energia, prive di massa ed elettricamente neutre.
A partire dai primissimi anni del ‘900, il fisico di origine neozelandese Ernest Rutherford ( 1871 – 1937) realizzò una serie di esperimenti, finalizzati a sondare la struttura dell’atomo, attraverso bombardamento con fasci di particelle α. Queste infatti erano abbastanza piccole, ma allo stesso tempo avevano però energia sufficiente a penetrare gli atomi per rivelarne la struttura profonda. Come bersaglio utilizzò sottilissimo fogli di oro, simili a quelli che gli orafi usano per le dorature (e che si dissolvono in polvere soffiandoci sopra un po’ vivamente). Nonostante fossero formati da alcune migliaia di atomi strettamente ammassati, lo spessore dei fogli era di appena 4•10-4 mm, e le particelle α li oltrepassavano in linea retta, come se non fossero esistiti. Misurazioni più accurate rivelarono tuttavia che un piccolo numero di particelle α (meno dell’1% del totale) subivano una deviazione nell’attraversamento dei singoli fogli, mentre un numero ancora più esiguo (circa 1 su 8.000) ritornava addirittura indietro, come rimbalzando. Il risultato era sorprendente tanto che Rutherford ebbe a dire: “Fu il fatto più incredibile che mi fosse capitato…Era così incredibile come se sparando un proiettile di 15 pollici su un foglio di carta esso tornasse indietro e vi colpisse…”. Tali risultati richiedevano un superamento del modello atomico di Thomson. Infatti, se all’interno degli atomi la massa fosse stata distribuita uniformemente, come sosteneva questo ultimo, tutte le particelle α, grazie alla loro capacità di penetrazione, avrebbero dovuto attraversare del tutto indisturbate le lamine di oro; poiché ciò non accadeva, Rutherford propose nel 1911 una nuova struttura dell’atomo, che tenesse conto dei più recenti dati sperimentali. Secondo il modello atomo di Rutherford la carica positiva dell’atomo è concentrata in una zona centrale, chiamata nucleo (da una parola latina che significa piccola noce) ove è racchiusa anche il 99,9% della massa atomica. Le dimensioni del nucleo ( dell’ordine di 10-15 m) sono circa 100.000 volte più piccole di quelle dell’intero atomo (dell’ordine di 10-10 m), la quasi totalità del cui volume è quindi pressoché vuota, in quanto occupata solo da elettroni (di massa ridottissima). Gli elettroni ruotano poi intorno al nucleo, come i pianeti del sistema solare ruotano intorno al Sole, attrattati da forze elettromagnetiche e mantenuti in orbita dalla forza centrifuga; per questo motivo quello di Rutherford viene anche definito come modello planetario dell’atomo. A questo punto appare chiaro che il 99% delle particelle α attraversa la regione di spazio occupata dagli elettroni, non subendo alcuna deviazione; le particelle α che sfiorano il nucleo vengono deviata, mentre quelle che lo urtano in pieno vengono respinte. Per il suo modello atomico, e per altri lavori, Rutherford ricevette il premio Nobel per la chimica nel 1908.
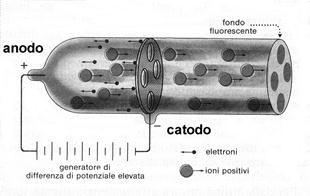 Il nucleo ha dunque una carica elettrica positiva pari alla somma delle cariche di tutti gli elettroni; ma quale è la sua struttura? La carica elettrica è diffusa in modo omogeneo o è suddivisa in particelle? Gli studi che avrebbero condotto alla soluzione di questi problemi erano iniziati diversi anni prima dei lavori di Rutherford, ad opera di Eugene Goldstien, lo stesso scienziato che aveva coniato il termine di raggi catodici. Negli stessi anni in cui Thomson studiava i raggi catodici, egli effettuò una serie di esperimenti coi tubi catodici, per cercare segni di eventuali radiazioni positive. Queste dovevano necessariamente viaggiare dall’anodo verso il catodo (cioè in direzione opposta a quella dei raggi catodici) e, per rilevarne la presenza, pensò di realizzare un catodo con piccoli fori ( o canali), al di là del quale pose uno schermo fluorescente, per rilevare l’arrivo di possibili particelle. L’intuizione si rivelò fondata e Goldstein potette osservare l’arrivo, oltre il catodo, di particelle, cui dette il nome di raggi canale. Studi ulteriori dimostrarono poi che i raggi canale avevano carica positiva (vennero quindi chiamati anche raggi positivi) e massa dello stesso ordine di grandezza degli atomi (molto maggiore quindi di quella degli elettroni). Le massa inoltre variava a seconda dei gas presenti inizialmente nel tubo: se era idrogeno, i raggi canale avevano la massa dell’atomo di idrogeno, se era ossigeno avevano la massa dell’atomo di ossigeno ecc. Quando venne accolta la teoria dell’atomo nucleare di Rutherford si comprese anche la natura dei raggi canale. Gli elettroni veloci che formano i raggi catodici urtavano con gli atomi dei gas sparsi nel tubo catodico; la massa degli elettroni non era sufficiente per disturbare i nuclei atomici, che inoltre venivano colpiti molto raramente. Colpivano tuttavia gli elettroni, strappandoli agli atomi: gli atomi privati degli elettroni erano particelle con carica positiva, che si muovevano quindi dall’anodo verso il catodo ed oltre. Con misure elettriche si scoprì inoltre che le particelle dei raggi positivi, oltre che massa differente, avevano anche carica elettrica differente ed i fisici finirono per chiedersi se fosse stato possibile dividere le particelle dei raggi canale in parti più piccole, magari fino a trovare una particella positiva elementare, simile all’elettrone. Studiando il problema Rutherford si accorse che la particella positiva più piccola che si poteva ottenere aveva la massa dell’atomo di idrogeno, concluse quindi che si trattava del nucleo dell’idrogeno e che corrispondeva alla particella positiva più piccola possibile. Essa aveva una carica positiva uguale in valore assoluto a quella dell’elettrone e massa 1837 volte maggiore di questo; decise quindi di chiamarla protone, dalla parola greca che significa primo.
Il nucleo ha dunque una carica elettrica positiva pari alla somma delle cariche di tutti gli elettroni; ma quale è la sua struttura? La carica elettrica è diffusa in modo omogeneo o è suddivisa in particelle? Gli studi che avrebbero condotto alla soluzione di questi problemi erano iniziati diversi anni prima dei lavori di Rutherford, ad opera di Eugene Goldstien, lo stesso scienziato che aveva coniato il termine di raggi catodici. Negli stessi anni in cui Thomson studiava i raggi catodici, egli effettuò una serie di esperimenti coi tubi catodici, per cercare segni di eventuali radiazioni positive. Queste dovevano necessariamente viaggiare dall’anodo verso il catodo (cioè in direzione opposta a quella dei raggi catodici) e, per rilevarne la presenza, pensò di realizzare un catodo con piccoli fori ( o canali), al di là del quale pose uno schermo fluorescente, per rilevare l’arrivo di possibili particelle. L’intuizione si rivelò fondata e Goldstein potette osservare l’arrivo, oltre il catodo, di particelle, cui dette il nome di raggi canale. Studi ulteriori dimostrarono poi che i raggi canale avevano carica positiva (vennero quindi chiamati anche raggi positivi) e massa dello stesso ordine di grandezza degli atomi (molto maggiore quindi di quella degli elettroni). Le massa inoltre variava a seconda dei gas presenti inizialmente nel tubo: se era idrogeno, i raggi canale avevano la massa dell’atomo di idrogeno, se era ossigeno avevano la massa dell’atomo di ossigeno ecc. Quando venne accolta la teoria dell’atomo nucleare di Rutherford si comprese anche la natura dei raggi canale. Gli elettroni veloci che formano i raggi catodici urtavano con gli atomi dei gas sparsi nel tubo catodico; la massa degli elettroni non era sufficiente per disturbare i nuclei atomici, che inoltre venivano colpiti molto raramente. Colpivano tuttavia gli elettroni, strappandoli agli atomi: gli atomi privati degli elettroni erano particelle con carica positiva, che si muovevano quindi dall’anodo verso il catodo ed oltre. Con misure elettriche si scoprì inoltre che le particelle dei raggi positivi, oltre che massa differente, avevano anche carica elettrica differente ed i fisici finirono per chiedersi se fosse stato possibile dividere le particelle dei raggi canale in parti più piccole, magari fino a trovare una particella positiva elementare, simile all’elettrone. Studiando il problema Rutherford si accorse che la particella positiva più piccola che si poteva ottenere aveva la massa dell’atomo di idrogeno, concluse quindi che si trattava del nucleo dell’idrogeno e che corrispondeva alla particella positiva più piccola possibile. Essa aveva una carica positiva uguale in valore assoluto a quella dell’elettrone e massa 1837 volte maggiore di questo; decise quindi di chiamarla protone, dalla parola greca che significa primo.
Abbiamo già detto che Rutherford immaginava l’atomo come un minuscolo sistema planetario, con i protoni concentrati nel nucleo e gli elettroni che ruotavano nell’enorme spazio circostante, legati al nucleo dall’attrazione elettrica e mantenuti in orbita dal loro movimento. In verità questo modello presentava una grossa lacuna dovuta al fatto che quando una particella elettrica ruotava in questo modo emetteva radiazioni elettromagnetiche, che le facevano perdere energia. A causa di ciò la particella doveva avvicinarsi progressivamente al nucleo, secondo un percorso a spirale, fino a cadervi sopra. Nella realtà però tutto questo non accade: gli atomi infatti restano stabili per periodi indefiniti, con gli elettroni che rimangono nelle zone esterne al nucleo ed il modello di Rutherford non sapeva spiegarne il perché.
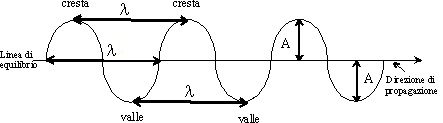 , cioè V = λ /T ovvero, data la relazione precedente, V = λ f.
, cioè V = λ /T ovvero, data la relazione precedente, V = λ f.
Le onde possono fondamentalmente essere divise in onde meccaniche (suono, onde del mare, terremoti), che necessitano di un mezzo per propagarsi ed onde elettromagnetiche, che non necessitano di un mezzo per propagarsi e possono quindi farlo anche nel vuoto, essendo dovute alla vibrazione di un campo elettrico e di uno magnetico, perpendicolari tra loro. Le onde elettromagnetiche hanno tutte la stessa velocità c pari a 3 x 108 m/s, per tutte vale quindi la relazione c = λ f, frequenza e lunghezza d’onda sono quindi inversamente proporzionali tra loro. Tali onde, al variare della frequenza e quindi della lunghezza d’onda, riuniscono fenomeni molto diversi tra loro, che, al diminuire della frequenza, vanno dai raggi γ alle onde radio. Anche la luce è costituita da un insieme di onde elettromagnetiche che, sempre al diminuire della frequenza ed all’aumentare della lunghezza d’onda, vanno dall’ultravioletto all’infrarosso. L’insieme di una serie di radiazioni o onde elettromagnetiche si dice spettro.
![]()
Tutte le onde elettromagnetiche formano quindi lo spettro elettromagnetico, mentre l’insieme delle onde visibili forma lo spettro visibile, le cui varie componenti possono essere messe in evidenza attraverso un prisma di diffrazione. La luce viene definita operativamente in funzione della sensibilità dell’occhio umano, essa corrisponde infatti a quell’insieme di onde elettromagnetiche che l’occhio stesso riesce a vedere. Lo spettro visibile può quindi anche essere definito come l’insieme delle lunghezze d’onda della luce; da ciò deriva poi che ad ogni colore corrisponde una ben precisa lunghezza d’onda. Sarà proprio dallo studio delle interazioni tra luce e materia, ovvero dai modi coi quali i corpi emettono ed assorbono le radiazioni, che gli scienziati dei primi decenni del ‘900 riusciranno ad approfondire le loro conoscenze sulla struttura dell’atomo.
Da quando Newton aveva dimostrato l’esistenza dello spettro della luce, questo fenomeno fu studiato approfonditamente da numerosi ricercatori. Intorno alla metà dell’800 il fisico tedesco Gustav Kirchoff (1824 – 1884) si mise ad analizzare gli spettri che si ottenevano sottoponendo a diffrazione la luce ottenuta dal riscaldamento di alcuni elementi allo stato gassoso o di vapore (tali spettri sono anche definiti spettri di emissione, in quanto si ottengono dalla luce emessa da una sorgente). Egli constatò che in questi casi non si ottenevano spettri continui , come quello solare, bensì spettri a righe, formati cioè da un certo numero di righe luminose separate da bande scure; in tali condizioni la sorgente emetteva quindi solo una serie di onde isolate, la cui lunghezza d’onda poteva essere ricavata dalla posizione della riga stessa all’interno dello spettro. Se inoltre si faceva passare la luce solare attraverso i vapori relativamente freddi di un dato elemento, questi assorbivano solo talune radiazioni; si formavano cioè spettri (detti spettri di assorbimento) costituiti dalla gamma continua dei colori dell’arcobaleno, intervallati però da alcune righe nere, che corrispondevano ai colori emessi dall’elemento stesso quando era caldo. I vapori assorbivano cioè solo quelle lunghezze d’onda che l’elemento emetteva. In altre parole ogni elemento emetteva (quando era caldo) o assorbiva (quando era freddo) le proprie lunghezze d’onda caratteristiche; gli spettri d’emissione e di assorbimento risultavano quindi complementari tra loro. Gli spettri divennero allora uno strumento per identificare gli elementi presenti all’interno di una sorgente luminosa, come ad esempio una stella. Dopo la scoperta dell’elettrone si ritenne che l’emissione di luce da parte dei corpi caldi fosse dovuta all’eccitazione che il calore determinava sugli elettroni stessi, i quali cominciavano quindi a vibrare, liberando l’energia accumulata in forma di onde luminose. Tuttavia le conoscenze fisiche dell’800 non erano in grado di spiegare il motivo della formazione degli spettri a righe, ossia dell’emissione di singole e specifiche radiazioni isolate, di lunghezze d’onda caratteristiche, da parte dei vari elementi chimici riscaldati allo stato aeriforme. Nel 1900 il fisico tedesco Max Planck (1857 – 1947) propose una nuova e rivoluzionaria teoria sul modo in cui è possibile trasferire energia da un corpo all’altro. Fino a quel momento infatti tutti gli scienziati avevano dato per scontato la continuità dell’energia; nessuno si era domandato cioè se anche per l’energia, come per la materia, esistessero entità minuscole che non potevano essere ulteriormente suddivise. Al contrario di ciò, Planck ipotizzò invece che l’energia non fosse continua, bensì venisse trasferita attraverso una serie di pacchetti o unità elementari, che egli definì quanti (il singolare è quanto e deriva dal latino quantum). Secondo questa ipotesi quando noi riceviamo energia, ad esempio sotto forma di calore, non veniamo investiti da un flusso continuo, bensì da una raffica di quanti di energia. Il concetto di quantizzazione che né deriva inizialmente può anche sembrare astruso, ma in verità anche nella vita di tutti giorni possiamo osservare numerosi esempi di grandezze che variano in modo continuo affiancate ad altre che variano invece in modo quantizzato. Il rifornimento di acqua che possiamo ricavare da un rubinetto varia, ad esempio, in modo continuo: noi possiamo infatti ricavare dal rubinetto una quantità di acqua  qualsiasi. Il rifornimento di acqua che viceversa ricaviamo da un distributore automatico di bottigliette è invece quantizzato, poiché possiamo acquistare solo un numero intero di bottigliette. Quando saliamo un dislivello con un piano inclinato, la nostra posizione verticale varia in modo continuo tra il livello di partenza e quello di arrivo. Quando invece saliamo su di una scala, la nostra posizione verticale è quantizzata, poiché essa può solo corrispondere a quella di uno dei gradini (non possiamo infatti trovarci tra un gradino e l’altro, perché saremmo sospesi a mezz’aria). Secondo la teoria di Palnck anche un’onda elettromagnetica può essere pensata come un quanto di energia, il cui valore cresce al crescere della frequenza dell’onda stesse, seconda la relazione E = hf, nota come legge di Planck, ove E è l’energia, f la frequenza ed h è la costante di Planck (il cui valore è 6,63 10-39 Js).
qualsiasi. Il rifornimento di acqua che viceversa ricaviamo da un distributore automatico di bottigliette è invece quantizzato, poiché possiamo acquistare solo un numero intero di bottigliette. Quando saliamo un dislivello con un piano inclinato, la nostra posizione verticale varia in modo continuo tra il livello di partenza e quello di arrivo. Quando invece saliamo su di una scala, la nostra posizione verticale è quantizzata, poiché essa può solo corrispondere a quella di uno dei gradini (non possiamo infatti trovarci tra un gradino e l’altro, perché saremmo sospesi a mezz’aria). Secondo la teoria di Palnck anche un’onda elettromagnetica può essere pensata come un quanto di energia, il cui valore cresce al crescere della frequenza dell’onda stesse, seconda la relazione E = hf, nota come legge di Planck, ove E è l’energia, f la frequenza ed h è la costante di Planck (il cui valore è 6,63 10-39 Js).
Planck era fondamentalmente un fisico teorico e non approfondì quindi le possibili applicazioni della sua rivoluzionaria teoria. Tali applicazioni vennero invece sviluppate da altri fisici, come ad esempio Einstein, che nel 1905 se ne servì per spiegare l’effetto fotoelettrico , nel quale, come già abbiamo detto, una radiazione luminosa di sufficiente energia che colpisce un dato tipo di metallo riesce a strappargli degli elettroni. Sposando al teoria quantistica, Einstein (1879 – 1955) sostenne che anche la radiazione che colpiva la materia era composta da quanti, la cui energia dipendeva dalla frequenza, secondo la legge di Planck. Se i singoli quanti avevano energia sufficiente (in dipendenza della loro frequenza), urtando la superficie di un metallo riuscivano a strappargli un elettrone: nell’effetto fotoelettrico quindi gli elettroni erano estratti dai metalli in conseguenza dell’impatto dei quanti di energia, un po’ come una palla da biliardo che, urtandone un’alta, trasferisce a questa una parte della sua energia. Da questo punto di vista dunque la radiazione luminosa (ovvero la luce) sembrava essere composta da particelle di elevata energia. Ritornava quindi la controversia circa la natura corpuscolare o ondulatoria della luce, che aveva contrapposto Newton e Huyghens nel corso del XVIII° secolo. A questo punto però i fisici capirono che le due teorie non erano in realtà contrapposte, bensì rappresentavano due facce della stessa medaglia: la luce, in sostanza, si comporta come un’onda elettromagnetica nella generalità delle situazioni; tuttavia, in alcuni casi, come nell’effetto fotoelettrico, si comporta invece come una particella; tali particelle vennero successivamente chiamate fotoni . Negli stessi anni, nell’ambito della teoria della relatività, Einstein propose anche la nota relazione E = mc2, la quale stabilisce l’equivalenza tra la massa m di un corpo e la sua energia E, ove c è la velocità della luce. Combinando tale equazione con quella della legge di Planck è possibile arrivare alla seguente uguaglianza:
E = hf = mc2 ovvero hf = mc2
 risolvendo quindi l’equazione rispetto ad m è possibile calcolare la massa di un fotone associato ad un’onda di frequenza f, si ottiene infatti che m = hf/ c2.
risolvendo quindi l’equazione rispetto ad m è possibile calcolare la massa di un fotone associato ad un’onda di frequenza f, si ottiene infatti che m = hf/ c2.
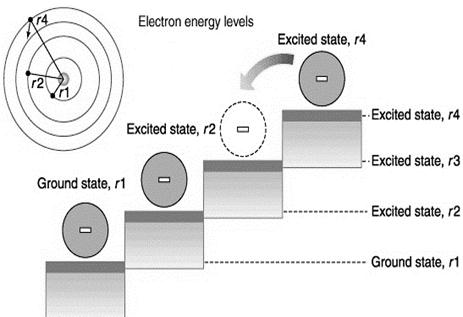 Nel 1913 il fisico danese Nils Bohr (1885 – 1962) utilizzò invece la teoria di Planck per elaborare un nuovo modello atomico, che superava i limiti di quello di Rutherford ed era inoltre capace di spiegare la genesi degli spettri a righe. Egli sostenne che era inutile dire che un elettrone irradiava energia quando orbitava in un atomo, dato che chiaramente non era così. Bohr affermò quindi che l’elettrone non poteva trovarsi a distanza qualsiasi dal nucleo, perché ruotava intorno al esso solo su orbite circolari determinate; il raggio delle orbite può assumere solo valori fissati, definiti da un numero, indicato con n e detto numero quantico principale, che assume solo valori interi: maggiore è tale valore, tanto più lontani dal nucleo ruotano gli elettroni e tanto più alta è la loro energia. Quando l’elettrone percorre una di queste orbite, dette orbite stazionarie, non emette, né assorbe energia: ecco perché non può cadere sul nucleo, come conseguiva invece dal modello atomico di Rutherford. L’elettrone assorbe o emette energia solo quando salta da un’orbita all’altra (tale fenomeno è detto anche salto quantico): assorbendo energia l’elettrone viene promosso infatti verso orbite più esterne, quindi di più alta energia, mentre emette energia quando ritorna verso orbite più interne, e quindi di più bassa energia. Quando l’elemento viene portato ad incandescenza i suoi elettroni assorbono energia, sotto forma di calore, e saltano verso livelli energetici più elevati, ove però non sono stabili; dopo pochissimo ritornano quindi al loro livello iniziale, restituendo, sotto forma di onde di determinata lunghezza, l’energia precedentemente assorbita. Gli elettroni degli atomi di ogni elemento possono assorbire solo determinati quantitativi di energia, che sono quelli esattamente necessari per passare da una all’altra delle loro orbite; tali energie sono associate, tramite la legge di Planck, a radiazioni luminose di determinati colori e corrispondono esattamente alle stesse radiazioni che gli elettroni riemettono tornando al loro livello energetico di partenza. Ecco spiegate quindi le righe corrispondenti degli spettri di emissione e di assorbimento. Gli stati energetici degli elettroni sono quindi determinati e questo viene riassunto dicendo che la loro energia è quantizzata. In pratica Bohr dimostrò che non era possibile ricostruire la struttura dell’atomo utilizzando solo la fisica classica, ma che era necessario ricorrere alla teoria quantistica. Per questo ricevette il premio Nobel nel 1922. Dobbiamo tuttavia ricordare che il modello atomico di Bohr era capace di interpretare esclusivamente lo spettro del più semplice degli atomi, quello di idrogeno, costituito solo da un elettrone e da un protone. Quando si passava infatti ad atomi con anche soli due elettroni e due protoni, il modello non riusciva più fornire spiegazioni degli spettri che si otteneva. Esso rappresentava dunque un importante passo in avanti, ma la natura delle cose era di certo ancora più complessa.
Nel 1913 il fisico danese Nils Bohr (1885 – 1962) utilizzò invece la teoria di Planck per elaborare un nuovo modello atomico, che superava i limiti di quello di Rutherford ed era inoltre capace di spiegare la genesi degli spettri a righe. Egli sostenne che era inutile dire che un elettrone irradiava energia quando orbitava in un atomo, dato che chiaramente non era così. Bohr affermò quindi che l’elettrone non poteva trovarsi a distanza qualsiasi dal nucleo, perché ruotava intorno al esso solo su orbite circolari determinate; il raggio delle orbite può assumere solo valori fissati, definiti da un numero, indicato con n e detto numero quantico principale, che assume solo valori interi: maggiore è tale valore, tanto più lontani dal nucleo ruotano gli elettroni e tanto più alta è la loro energia. Quando l’elettrone percorre una di queste orbite, dette orbite stazionarie, non emette, né assorbe energia: ecco perché non può cadere sul nucleo, come conseguiva invece dal modello atomico di Rutherford. L’elettrone assorbe o emette energia solo quando salta da un’orbita all’altra (tale fenomeno è detto anche salto quantico): assorbendo energia l’elettrone viene promosso infatti verso orbite più esterne, quindi di più alta energia, mentre emette energia quando ritorna verso orbite più interne, e quindi di più bassa energia. Quando l’elemento viene portato ad incandescenza i suoi elettroni assorbono energia, sotto forma di calore, e saltano verso livelli energetici più elevati, ove però non sono stabili; dopo pochissimo ritornano quindi al loro livello iniziale, restituendo, sotto forma di onde di determinata lunghezza, l’energia precedentemente assorbita. Gli elettroni degli atomi di ogni elemento possono assorbire solo determinati quantitativi di energia, che sono quelli esattamente necessari per passare da una all’altra delle loro orbite; tali energie sono associate, tramite la legge di Planck, a radiazioni luminose di determinati colori e corrispondono esattamente alle stesse radiazioni che gli elettroni riemettono tornando al loro livello energetico di partenza. Ecco spiegate quindi le righe corrispondenti degli spettri di emissione e di assorbimento. Gli stati energetici degli elettroni sono quindi determinati e questo viene riassunto dicendo che la loro energia è quantizzata. In pratica Bohr dimostrò che non era possibile ricostruire la struttura dell’atomo utilizzando solo la fisica classica, ma che era necessario ricorrere alla teoria quantistica. Per questo ricevette il premio Nobel nel 1922. Dobbiamo tuttavia ricordare che il modello atomico di Bohr era capace di interpretare esclusivamente lo spettro del più semplice degli atomi, quello di idrogeno, costituito solo da un elettrone e da un protone. Quando si passava infatti ad atomi con anche soli due elettroni e due protoni, il modello non riusciva più fornire spiegazioni degli spettri che si otteneva. Esso rappresentava dunque un importante passo in avanti, ma la natura delle cose era di certo ancora più complessa.
Un ulteriore passo in avanti nella comprensione della struttura atomica, con particolare riferimento alla natura elettroni, venne compiuto nel 1924 dal fisico francese Luisi Victor de Broglie (1892 – 1987). Questi, riprese la tesi di Einstein sulla natura corpuscolare delle onde elettromagnetiche, e la trasferì in modo simmetrico sull’elettrone, avanzando l’ipotesi che, oltre che come particella, l’elettrone potesse essere pensato anche come un’onda elettromagnetica. Questa onda doveva essere di tipo stazionario, ovvero doveva oscillare in modo costante, coprendo le orbite circolari di Bohr con un numero intero di lunghezze d’onda. Tutto ciò in realtà non risolveva il problema che il modello di Bohr fosse valido esclusivamente per l’atomo di idrogeno ed introduceva inoltre nuove complicazioni: come si può pensare infatti di assegnare una posizione ad un’onda, che, per definizione, si estende nello spazio? In verità la questione risiedeva ancora una volta nel fatto che, per interpretare la struttura atomica, non era possibile utilizzare le leggi della fisica classica, quella cioè che usiamo per descrivere i fenomeni del mondo macroscopico, ma era necessario impiegare qualcosa di nuovo. Bohr aveva fatto un primo passo in questa direzione, sostenendo la quantizzazione dell’energia dell’elettrone; egli tuttavia continuava a pensare che il moto dell’elettrone intorno al nucleo fosse analogo a quello regolare e prevedibile dei pianeti intorno al Sole. La realtà dell’atomo richiedeva però un ulteriore passo in avanti verso una nuova fisica. Nel mondo macroscopico, ad esempio, non abbiamo problemi nel calcolare contemporaneamente sia la velocità (e quindi l’energia), che la posizione di un qualsiasi corpo. Pensiamo ad esempio ad un’automobile che viaggia su di un’autostrada: in qualsiasi momento possiamo facilmente conoscere la sua posizione, utilizzando ad esempio un sistema di posizionamento satellitare, ma anche la sua velocità, leggendola direttamente dal tachimetro sul cruscotto.
Nel 1927 un giovane fisico tedesco, di nome Werner Heisemberg (1901 – 1976) sostenne invece che non è possibile conoscere, contemporaneamente ed in modo esatto, sia la posizione che l’energia posseduta da un elettrone. Partendo dal concetto di errore di misura, tale principio, che prende il nome di principio di indeterminazione, sostiene in pratica che se si riesce misurare con molta precisione la posizione dell’elettrone, allora si commette un grosso errore nella misurazione della sua energia e viceversa. Ciò deriva dal fatto che, ogni volta noi misuriamo una data grandezza di un sistema, interagiamo con esso e lo modifichiamo nelle stesse caratteristiche che vogliamo misurare. Se vogliamo, ad esempio, misurare la temperatura di un grosso recipiente di acqua, possiamo impiegare un comune termometro con un bulbo anche di grosse dimensioni, restando certi che la temperatura segnata corrisponde a quella reale dell’acqua. Come è noto, i due oggetti dell’esempio debbono raggiungere una condizione di equilibrio termico, per il quale l’acqua trasferirà una parte del suo calore al bulbo; tuttavia se la massa dell’acqua è sufficientemente grande rispetto al bulbo, la quantità di calore che si perde nel trasferimento è trascurabile. Cosa succede però che vogliamo misurare con lo stesso strumento la temperatura di un ditale di acqua? Analogamente, per determinare la posizione di un oggetto questo deve essere visto, da un osservatore o da uno strumento di misura idoneo (pensate ad un radar o ad una telecamera). Come sappiamo, la visione dei corpi è resa possibile la fatto che essi sono illuminati dalla luce, e quindi colpiti da essa, la quale trasferisce all’oggetto una parte della sua energia. Nel caso di oggetti di dimensioni ordinari un raggio di luce (ovvero un fotone) non influisce in alcun modo sull’energia del corpo illuminato. Ma cosa possiamo prevedere che accada quando un elettrone viene illuminato da un fotone, che possiede energia e dimensioni del suo stesso ordine di grandezza? Queste considerazioni portarono al definitivo superamento della concezione meccanicistica dell’atomo, al cui interno l’elettrone percorre una traiettoria fissa con moto regolare, condizione in cui sarebbe in ogni momento possibile stabilire tanto la sua posizione, quanto la sua energia.
 .
.
L’elettrone dunque non ruota sulle orbite, ma occupa l’orbitale. L’orbitale sostituisce quindi le orbite, quale luogo fisico occupato dall’elettrone, ed eredita da queste tutte le proprietà e le caratteristiche che rendevano ad esempio possibile la spiegazione degli spettri atomici. Un atomo può possedere uno o più orbitali, questi inoltre non sono tutti uguali, ma variano le loro caratteristiche in base ad alcuni numeri, detti numeri quantici . I numeri quantici definiscono ed identificano gli orbitali in modo inequivocabile, per cui, attraverso di essi, sarà possibile sapere quanti orbitali possiede un certo atomo, arrivando in tal modo alla sua costruzione (aufbau in tedesco). Gli orbitali infatti, anche se hanno tutti il centro nel nucleo dell’atomo, differiscono tra loro per forma, dimensioni ed energia. Parlando di energia dobbiamo fare un passo indietro. Nel modello planetario l’elettrone ruotava su orbite circolari grazie all’equilibrio tra la forza elettrica, che lo attraeva verso il nucleo, e la forza centrifuga che lo spingeva all’esterno. Abbiamo visto che in realtà le cose non stanno così, ugualmente però esiste una forza attrattiva di tipo coulombiano tra protoni ed elettroni, a cui questi ultimi contrappongono una propria energia che gli impedisce di andare a schiacciarsi sul nucleo. Più gli elettroni sono lontani dal nucleo e minore è la forza elettrostatica con cui questo li attrae, per cui essi hanno più energia, nel senso che sono meno vincolati e più facilmente possono staccarsi dal resto dell’atomo. Tutti gli orbitali, come già detto, sono centrati sul nucleo e quelli più grandi inglobano quelli più piccoli; in questo senso dunque essi formano una struttura a scatole cinesi, in cui gli elettroni che occupano gli orbitali più grandi sono anche più lontani dal nucleo ed hanno quindi più energia. Attraverso il riempimento degli orbitali da parte degli elettroni si arriva alla configurazione elettronica, definita come il modo in cui gli elettroni si dispongono all’interno degli orbitali. Questa è una caratteristica molto importante di un atomo, in quanto ne determina il comportamento chimico, che corrisponde al modo in cui esso reagisce, a seconda degli altri atomi con cui reagisce, ed a quali composti da luogo. Nelle reazioni chimiche infatti gli atomi entrano in contatto tra loro ed interagiscono solo attraverso gli elettroni più esterni; perciò, a seconda di come questi sono disposti nei loro orbitali, gli atomi reagiranno in un modo o nell’altro, manifestando un certo comportamento chimico: ecco perché la configurazione elettronica è così importante.
Ma torniamo ai numeri quantici, riepilogandone le caratteristiche ed inquadrandone il significato all’interno della teoria degli orbitali:
 il primo numero quantico, si indica con la lettera n e può assumere tutti i valori interi compresi tra 1 e 7 ovvero può essere 1, 2, 3……….7. Esso fornisce indicazioni relativamente alle dimensioni ed all’energia degli orbitali, nel senso che all’aumentare del suo valore gli orbitali sono più grossi ed hanno più energia. Tutti gli orbitali che hanno lo stesso valore di n appartengono allo stesso livello energetico. A questo punto possiamo anche immaginare che l’atomo sia un palazzo, con al massimo sette piani, e che ogni piano sia rappresentato da un livello energetico, mentre le stanze del piano medesimo sono gli orbitali appartenenti a quel dato livello energetico. Questo palazzo è in verità un po’ strano, perché ogni piano contiene quello inferiore, mentre è contenuto in quello superiore; tuttavia, se immaginiamo che il nucleo stia a livello della strada, è facile capire che gli orbitali del secondo piano siano più grossi di quelli del primo, quelli del terzo più di quelli del secondo ecc.
il primo numero quantico, si indica con la lettera n e può assumere tutti i valori interi compresi tra 1 e 7 ovvero può essere 1, 2, 3……….7. Esso fornisce indicazioni relativamente alle dimensioni ed all’energia degli orbitali, nel senso che all’aumentare del suo valore gli orbitali sono più grossi ed hanno più energia. Tutti gli orbitali che hanno lo stesso valore di n appartengono allo stesso livello energetico. A questo punto possiamo anche immaginare che l’atomo sia un palazzo, con al massimo sette piani, e che ogni piano sia rappresentato da un livello energetico, mentre le stanze del piano medesimo sono gli orbitali appartenenti a quel dato livello energetico. Questo palazzo è in verità un po’ strano, perché ogni piano contiene quello inferiore, mentre è contenuto in quello superiore; tuttavia, se immaginiamo che il nucleo stia a livello della strada, è facile capire che gli orbitali del secondo piano siano più grossi di quelli del primo, quelli del terzo più di quelli del secondo ecc.  Numero quantico secondario, è il secondo numero quantico, si indica con la lettera l, e varia al variare di n; per ogni valore di n infatti, l assume tutti i valori interi compresi tra 0 e n-1. l fornisce indicazioni sulla forma degli orbitali. Per l = 0 si hanno orbitali di forma sferica, chiamati orbitali s; per l = 1 si hanno orbitali a farfalla, chiamati orbitali p; per l = 2 si hanno orbitali con una forma troppo complessa per essere rappresentata semplicemente, ma che comunque sono chiamati orbitali d; infine per l = 3 si hanno orbitali che, come i precedenti, non possono essere rappresentati semplicemente e che sono chiamati orbitali f. Nell’analogia tra l’atomo e il palazzo potremmo dire che il numero quantico secondario rappresenta il tipo di stanze presenti in ogni piano. Potremmo ad esempio stabilire che gli orbitali s, che si hanno per l = 0, siano delle cucine, mentre gli orbitali p, che si hanno per l = 1, siano delle camere, gli orbitali d, corrispondenti a l = 2, siano dei bagni ed infine gli orbitali f, corrispondenti a l = 3, siano dei soggiorni.
Numero quantico secondario, è il secondo numero quantico, si indica con la lettera l, e varia al variare di n; per ogni valore di n infatti, l assume tutti i valori interi compresi tra 0 e n-1. l fornisce indicazioni sulla forma degli orbitali. Per l = 0 si hanno orbitali di forma sferica, chiamati orbitali s; per l = 1 si hanno orbitali a farfalla, chiamati orbitali p; per l = 2 si hanno orbitali con una forma troppo complessa per essere rappresentata semplicemente, ma che comunque sono chiamati orbitali d; infine per l = 3 si hanno orbitali che, come i precedenti, non possono essere rappresentati semplicemente e che sono chiamati orbitali f. Nell’analogia tra l’atomo e il palazzo potremmo dire che il numero quantico secondario rappresenta il tipo di stanze presenti in ogni piano. Potremmo ad esempio stabilire che gli orbitali s, che si hanno per l = 0, siano delle cucine, mentre gli orbitali p, che si hanno per l = 1, siano delle camere, gli orbitali d, corrispondenti a l = 2, siano dei bagni ed infine gli orbitali f, corrispondenti a l = 3, siano dei soggiorni. - Numero quantico magnetico: è il terzo numero quantico, si indica con la lettera m e varia al variare di l¸ per ogni valore di l infatti m assume tutti i valori interi compresi tra – l e + l . m fornisce indicazioni sull’orientazione degli orbitali di un certo tipo e quindi sul loro numero, visto che se esistono tre orientazioni differenti dovranno esistere anche tre orbitali differenti, uno per ogni orientazione. In effetti se io ho, ad esempio, tre orientazioni per le camere, una a nord, una a sud ed una a est, questo vuol dire che in quella casa debbo necessariamente esserci tre camere.
- Numero quantico di spin: i tre numeri quantici descritti finora si riferiscono agli orbitali, mentre il quarto numero quantico, indicato col simbolo ms, si riferisce all’elettrone. Questo infatti nel suo moto intorno al nucleo, all’interno dell’orbitale, ruota anche su se stesso, da cui il termine spin (ruotare in inglese). Il senso di rotazione può essere orario o antiorario, per cui il numero quantico di spin assume solo due valori: + ½ e – ½ .
 In base inoltre al principio di esclusione di Pauli in ogni orbitale possono stare al massimo due elettroni che debbono avere spin opposto, ovvero uno deve ruotare su se stesso in senso orario e l’altro in senso antiorario. Da ora in poi per rappresentare gli orbitali utilizzeremo dei quadratini, mentre per rappresentare gli elettroni che li occupano utilizzeremo delle freccette poste al loro interno. Quando le freccette hanno lo stesso verso gli elettroni hanno spin parallelo (cioè ruotano nello stesso senso), quando hanno verso opposto gli elettroni ruotano in senso opposto.
In base inoltre al principio di esclusione di Pauli in ogni orbitale possono stare al massimo due elettroni che debbono avere spin opposto, ovvero uno deve ruotare su se stesso in senso orario e l’altro in senso antiorario. Da ora in poi per rappresentare gli orbitali utilizzeremo dei quadratini, mentre per rappresentare gli elettroni che li occupano utilizzeremo delle freccette poste al loro interno. Quando le freccette hanno lo stesso verso gli elettroni hanno spin parallelo (cioè ruotano nello stesso senso), quando hanno verso opposto gli elettroni ruotano in senso opposto.
 Continuando nell’analogia tra atomo e palazzo potremmo dire che gli elettroni sono gli occupanti delle nostre stanze, che in ogni stanza possono essere al massimo due persone e che queste differiscono sempre tra loro, perché uno è maschio e l’altro è femmina.
Continuando nell’analogia tra atomo e palazzo potremmo dire che gli elettroni sono gli occupanti delle nostre stanze, che in ogni stanza possono essere al massimo due persone e che queste differiscono sempre tra loro, perché uno è maschio e l’altro è femmina.
Proviamo adesso a vedere come è fatto il nostro atomo - palazzo, per costruire il quale dobbiamo utilizzare i numeri quantici con le loro regole e partire ovviamente dai piani più bassi. Una volta costruito il palazzo sarà semplice riempirlo di abitanti - elettroni, in quanto questi cominceranno via via a disporsi nelle stanze più basse a loro disposizione. Al termine di questa operazione arriveremo a vedere come sono disposti gli elettroni all’interno degli orbitali di una atomo, saremo cioè giunti ad individuare la sua configurazione elettronica.
1° livello energetico n = 1
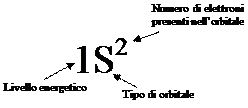 Per questo valore di n l può assumere solo il valore 0 ed m, a sua volta, può anch’esso essere solo 0; nel primo livello energetico abbiamo pertanto un solo orbitale s, dunque sferico, che indicheremo con 1S. In questa simbologia, utilizzata per indicare gli orbitali, il primo numero a sinistra si riferisce al livello energetico, mentre la lettera indica il tipo di orbitale; il numero ad esponente mostra infine quanti elettroni sono presenti al suo interno.
Per questo valore di n l può assumere solo il valore 0 ed m, a sua volta, può anch’esso essere solo 0; nel primo livello energetico abbiamo pertanto un solo orbitale s, dunque sferico, che indicheremo con 1S. In questa simbologia, utilizzata per indicare gli orbitali, il primo numero a sinistra si riferisce al livello energetico, mentre la lettera indica il tipo di orbitale; il numero ad esponente mostra infine quanti elettroni sono presenti al suo interno.
Nel primo livello energetico c’è quindi un solo orbitale, occupato al massimo da due elettroni.
2° livello energetico n = 2
Dopo il primo piano viene ovviamente il secondo e per n = 2, l assume due valori: 0 e 1.
Per l = 0 e m = 0, abbiamo un altro orbitale sferico, chiamato stavolta 2S, all’interno del quale possono stare due elettroni.
Per l = 1, m assume tre valori: -1, 0, +1. Abbiamo dunque tre orbitali a farfalla, disposti secondo le tre direzioni dello spazio; questi, chiamati 2P, possono ospitare al massimo sei elettroni. Detti orbitali possiedono la stessa energia e nel loro riempimento gli elettroni cercano inizialmente di occupare tutto lo spazio disponibile. Tale andamento è riassunto nella regola di Hund (dal nome del fisico che l’ha introdotta), che dice: avendo a disposizione orbitali con la stessa energia, di cui qualcuno semiriempito e qualcuno vuoto, un elettrone va ad occupare uno di quelli vuoti, disponendosi con spin parallelo a quello dell’elettrone o degli elettroni già presenti. Dovendo quindi sistemare due elettroni nei tre orbitali P essi si disporranno nel modo indicato in figura e non andranno ad occupare lo stesso orbitale con spin opposto. Nel caso poi che gli elettroni da sistemare siano tre, questi si disporranno in tre orbitali differenti con spin parallelo tra loro. Solo a partire dal quarto elettrone gli orbitali inizieranno ad essere occupati da due elettroni aventi spin opposto. Nel secondo livello energetico si hanno dunque quattro orbitali, occupati al massimo da otto elettroni.
3° livello energetico n = 3
Con n = 3 l assume tre valori: 0, 1 e 2.
Per l = 0, ⇒ m = 0 abbiamo sempre un orbitale sferico, chiamato stavolta 3S.
Per l = 1, ⇒ m = -1, 0, +1 abbiamo tre orbitali a farfalla, chiamati 3P.
Per l = 2 abbiamo m = -2, -1, 0, 1, 2, ed assumendo cinque valori avremo cinque orbitali, chiamati 3d, all’interno dei quali potremo mettere al massimo 10 elettroni. Nel terzo livello energetico si hanno pertanto nove orbitali, occupati al massimo da diciotto elettroni.
4° livello energetico n = 4
Per n = 4 l assume quattro valori: 0,1,2,3.
Per l = 0, ⇒ m = 0 abbiamo un orbitale sferico, chiamato 4S.
Per l = 1, ⇒ m = -1, 0, +1 abbiamo tre orbitali a farfalla, chiamati 4P.
Per l = 2, ⇒ m = -2,-1, 0, +1,+2 abbiamo cinque orbitali a farfalla, chiamati 4d.
Per l = 3 abbiamo m = -3, -2, -1, 0, 1,2,3, sette valori, cui corrispondono sette orbitali, chiamati 4f, al cui interno potremo sistemare al massimo quattordici elettroni. Nel quarto livello energetico vi sono quindi sedici orbitali, occupati al massimo da trentadue elettroni. A questo punto possiamo dire che in ogni livello energetico il numero di orbitali presenti si ottiene elevando al quadrato il corrispondente valore di n.
Quadro riassuntivo sui livelli energetici e sugli orbitali |
||||||
Livello energetico |
n |
l |
m |
tipo |
N° |
nome |
primo |
1 |
0 |
0 |
S |
1 |
1S |
secondo |
2 |
0 |
0 |
S |
1 |
2S |
1 |
-1, 0, +1 |
P |
3 |
2P |
||
terzo |
3 |
0 |
0 |
S |
1 |
3S |
1 |
-1, 0, +1 |
P |
3 |
3P |
||
2 |
-2, -1, 0, +1, +2 |
d |
5 |
3d |
||
quarto |
4 |
0 |
0 |
S |
1 |
4S |
1 |
-1, 0, +1 |
P |
3 |
4P |
||
2 |
-2, -1, 0, +1, +2 |
d |
5 |
4d |
||
3 |
-3, -2, -1, 0, +1, +2, +3 |
f |
7 |
4f |
||
Il riempimento degli orbitali: dobbiamo adesso popolare il nostro atomo – palazzo con gli inquilini – elettroni e lo faremo cominciando dalle stanze dei piani più bassi, ovvero dagli orbitali più vicini al nucleo, che sono anche quelli con minore energia, tenendo altresì presente quanto sostengono sia il principio di Pauli, che la regola di Hund. In generale l’energia degli orbitali aumenta all’aumentare di n e di l , si riempiranno quindi per primi gli orbitali dei livelli energetici più bassi (cioè quelli con n minore), mentre in uno stesso livello energetico (ovvero a parità del valore di n) gli orbitali si riempiono secondo la sequenza S, P, d, f. Quando invece gli orbitali hanno valori uguali di n e di l hanno anche la stessa energia (si dice che sono isoenergetici) e quindi si riempiono insieme, ferma restando la regola di Hund. In verità però ad un certo punto le cose si complicano, per cui l’ordine di riempimento degli orbitali non è proprio così lineare come sembrerebbe dalle regole sopra enunciate, per cui vedremo che si riempiranno le stanze di un piano superiore anche se quelle del piano inferiore non sono ancora del tutto riempite.
Andando dritti al nocciolo della questione possiamo dire che l’ordine con cui si riempiono gli orbitali è il seguente:
1S, 2S, 2P, 3S, 3P, 4S, 3d; 4P, 5S, 4d, 5P, 6S, 4f, 5d, 6P, 7S, 5f, 6d
dalla sequenza si vede che, ad esempio, prima di riempire gli orbitali 3d si riempiono i 4S, mentre prima di riempire i 4f si riempiono addirittura i 5P ed i 6S. Le ragioni di ciò sono in ogni caso troppo complesse per venire trattate in questa sede.
La configurazione elettronica: a questo punto, utilizzando le regole sopra esposte, possiamo divertirci a fare la configurazione elettronica di qualsiasi elemento. A titolo di esempio, ed anche per familiarizzare con l’argomento, elencheremo di seguito la configurazione elettronica dei primi dieci elementi, raggruppandoli livello energetico per livello energetico.
Ogni configurazione elettronica può essere divisa in due parti: la configurazione elettronica esterna, che corrisponde alla distribuzione degli elettroni negli orbitali dell’ultimo livello energetico, e la configurazione elettronica interna, che corrisponde invece alla distribuzione degli elettroni in tutti i livelli energetici sottostanti al più esterno. Così, ad esempio, la configurazione elettronica interna dell’ossigeno è 1S2, mentre la sua configurazione elettronica esterna è 2S2 2P4. La configurazione elettronica esterna è molto più importante di quella interna, in quanto, come vedremo, gli atomi si legano tra di loro tramite gli elettroni più esterni, ovvero quelli dell’ultimo livello energetico, ed il loro comportamento chimico sarà dunque determinato proprio dalla loro configurazione elettronica esterna. Viceversa gli elettroni più interni non partecipano ai legami, conseguentemente la configurazione elettronica interna assumerà importanza molto minore.
Ciò che caratterizza ogni tipo di atomo è il suo numero atomico, indicato con la lettera Z , che corrisponde al numero dei protoni presenti nel nucleo e quindi anche al numero degli elettroni all’interno dei vari orbitali.
Nome |
Simbolo |
Z |
Configurazione elettronica |
1° livello |
|||
idrogeno |
H |
1 |
1S1 |
elio |
He |
2 |
1S2 |
2° livello |
|||
litio |
Li |
3 |
1S2 2S1 |
berillio |
Be |
4 |
1S2 2S2 |
boro |
B |
5 |
1S2 2S2 2P1 |
|
C |
6 |
1S2 2S2 2P2 |
|
N |
7 |
1S2 2S2 2P3 |
|
O |
8 |
1S2 2S2 2P4 |
|
F |
9 |
1S2 2S2 2P5 |
|
Ne |
10 |
1S2 2S2 2P6 |
 I simboli degli elementi e le formule delle sostanze pure
I simboli degli elementi e le formule delle sostanze pure
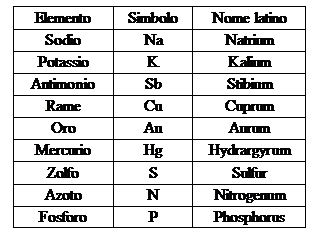
Ogni sostanza elementare, o elemento, viene rappresentato con un simbolo di valenza universale, che è costituito da una o due lettere, di cui la prima maiuscola e la seconda minuscola. Tali lettere generalmente corrispondono alle iniziali del nome dell'elemento stesso in greco o in latino.
Con i simboli degli elementi è possibile scrivere le formule delle sostanze pure. La formula è una rappresentazione che indica quali elementi compongono una certa sostanza ed in quali proporzioni reciproche. Queste ultime sono indicate da dei numerini, detti indici, scritti in basso ed a destra dell'elemento a cui si riferiscono. Come sappiamo la formula dell'acqua è H2O, questo vuol dire che l'acqua è fatta di idrogeno (H) ed ossigeno (O) e che ogni atomo di ossigeno ve ne sono due di idrogeno. Le sostanze elementari, essendo formate solo da atomi di uno stesso tipo, sono rappresentate dal simbolo stesso dell'elemento. Così, ad esempio, col simbolo Fe si rappresenta sia l'elemento chimico ferro, che un vero e proprio atomo di quel metallo. Anche le formule chimiche hanno valenza universale, nel senso che sono le stesse in tutto il mondo; esse tuttavia possono essere scritte solo per le sostanze pure, la cui struttura è ben definita e costante.
Dobbiamo ricordare (Fenomeni elettrici.doc pag. 3) che si definiscono elettroliti i composti le cui soluzioni erano capaci di lasciar passare la corrente, mentre si definiscono non elettroliti quelli le cui soluzioni non consentono il passaggio della corrente.
La fluorescenza è il fenomeno per il quale, fornendo adeguati quantitativi di energia ad alcune particolari sostanze, queste emettono luce di tipo caratteristico.
Ricordiamo che fisicamente la velocità è data dal rapporto tra lo spazio percorso ed il tempo impiegato per percorrerlo V = spazio/tempo.
Si chiamano continui gli spettri nei quali sono presenti e sfumati l’uno nell’altro tutti i colori dello spettro luminoso, dal rosso al violetto.
Se si parte dall’equazione che abbiamo utilizzato per calcolare la massa del fotone hf = mc2, e se ricordiamo che per tutte le onde elettromagnetiche vale la relazione f=c/λ, otteniamo che hc/λ = mc2 . Semplificando e risolvendo rispetto alla lunghezza d’onda otteniamo infine che λ= h/mc, relazione che ci consente di calcolare la lunghezza dell’onda corrispondente ad un elettrone di massa m.
Il termine orbitale assume quindi due significati: da un lato è una funzione matematica e dall’altro è una regione di spazio. Il legame tra i due è dato dal fatto che il volume chiamato “orbitale” è una rappresentazione del quadrato della “funzione orbitale”, attraverso cui è realmente possibile calcolare la probabilità di incontrare l’elettrone. Tuttavia, da ora in avanti, utilizzeremo il termine orbitale solo per designare il volume di spazio.
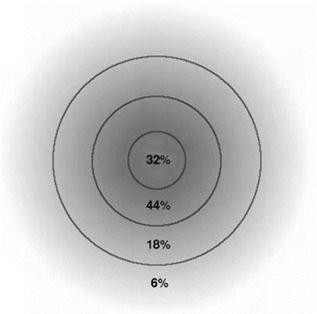
Proviamo a chiarire con un semplice esempio il significato del concetto di probabilità. Immaginiamo che al centro di un grande spiazzo vi sia una persona che gioca a tirare sassi intorno a sé in tutte le direzioni. In modo casuale ne lancia a distanze diverse, alcuni più vicini ed altri più lontani. Non sappiamo a quale distanza dal lanciatore sarà scagliato il prossimo sasso, possiamo tuttavia fare delle previsioni misurando la distanza dal centro al cui interno troviamo il 90% dei sassi già scagliati: è ragionevole supporre che vi è il 90% di probabilità che anche il prossimo sasso cada entro tale distanza. Teoricamente il prossimo sasso può essere scagliato anche più lontano, ma le probabilità sono poche. In questo modo abbiamo definito l’area entro la quale vi è il 90% di probabilità di essere colpiti dai sassi.
Fonte: http://www.liceodavincifi.it/_Rainbow/Documents/struttura%20atomica.doc
Autore: non indicato nel documento
Struttura atomica
Visita la nostra pagina principale
Struttura atomica
Termini d' uso e privacy
 carbonio
carbonio azoto
azoto ossigeno
ossigeno fluoro
fluoro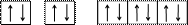 neo
neo