Chimica e gli alimenti
Chimica e gli alimenti
INTRODUZIONE
Il ciclo d'esperienze che ci accingiamo a realizzare consente di comprendere quali sono le reazioni chimiche che avvengono, quando il cibo è digerito e metabolizzato.
Ci serviremo di materiali di laboratorio che si suddividono in oggetti in vetro, strumenti e reattivi chimici.
I materiali in vetro sono: barattoli vari, provette, imbuti, Cilindro da 50 ml, bacchettine, termometro da -10 a 100, vetrino ad orologio 6 cm, vetrino al cobalto, pipette, becher ml 250 ecc.
Gli strumenti sono: spatola, lampada ad alcool, reticella, treppiedi, mortaio con pestello, filo di platino, contagocce tarato, bottiglie a spruzzetta, pinza di legno (per prendere provette che scottano), portaprovette ecc.
I reattivi chimici sono composti chimici che servono, nell’analisi chimica, per il riconoscimento o il dosaggio d'altre sostanze. I reattivi possono essere pericolosi se vengono a contatto con le mani che dovranno essere protette da guanti anticorrosivi.
Ogni esperienza è descritta nei minimi particolari. Bisogna seguire le istruzioni per eseguirle, con la massima precisione.
Ciò che si chiede all’allievo è d'osservare e descrivere, su un quaderno, le reazioni che avvengono.
Le attività si baseranno principalmente in:
- Costruire un’apparecchiatura per misurare l’entalpia di combustione di un alimento;
- Esami di laboratorio per la ricerca e il riconoscimento dei principi alimentari quali
a) L’acqua nell’alimentazione
- Esame della solubilità in acqua di sostanze e alimenti.
- Individuazione di alcuni ioni presenti nelle acque.
- Separazione dell’acqua da un vegetale e suo riconoscimento.
b) Studio dei carboidrati negli alimenti
- Ricerca e riconoscimento dell’amido
- Ricerca e riconoscimento degli zuccheri riducenti.
- Diffusione di carboidrati attraverso una membrana.
c) Studio dei lipidi e dei coloranti presenti negli alimenti
- Ricerca dei lipidi negli alimenti: saggi di solubilità e Saggio con il Sudan IV
- Saggi di riconoscimento dei lipidi: saggio di solubilità e saggio con il Sudan IV
LEZIONE N°1
- OGGETTO DELLA CHIMICA
La chimica generale studia i fenomeni chimici e le leggi che vi presiedono.
La chimica inorganica si occupa delle sostanze che si trovano in natura e dei loro composti tranne quelli derivati dal carbonio.
La chimica organica ha per oggetto esclusivamente i composti del carbonio.
Il nome CHIMICA deriva o dall’egiziano chemia = terra nera o dall’ebraico chaman = segreto perché il suo studio era riservato a pochi.
- BREVI CENNI DI CHIMICA GENERALE
Si dicono sostanze semplici quelle che, con i mezzi a nostra disposizione, non si separano in specie differenti. Es. l’oro, l’alluminio, l’ossigeno. La qualità di materia che costituisce la sostanza semplice, si chiama elemento es. il diamante è costituito dall’elemento carbonio.
Gli elementi sono divisi in metalli e non metalli.
I metalli sono |
Sodio, potassio, magnesio, calcio, radio, alluminio, rame, argento, oro, zinco, mercurio, stagno, piombo, ferro, platino |
I non metalli sono |
Idrogeno, ossigeno, fluoro, cloro, bromo, iodio, zolfo, fosforo, azoto, arsenico antimonio, boro, carbonio silicio. |
Si dicono sostanze composte quelle che, sottoposte a processi di analisi, si decompongono in sostanze semplici, esempio l’acqua si può scindere in idrogeno e ossigeno con un processo di elettrolisi. L’elettrolisi è la decomposizione degli elettroliti mediante la corrente elettrica continua
MOLECOLE (da moles = massa)
Le sostanze sono formate da particelle piccolissime, invisibili microscopio ottico, chiamate molecole.
La molecola è la più piccola particella di sostanza semplice o composta, che e può esistere libera e che della sostanza conserva le proprietà specifiche.
Le molecole non sono a contatto tra loro, ma sono separate da spazi intermolecolari e sono unite dalla forza di coesione.
Vi sono tante specie di molecole quante sono le sostanze semplici o composte.
L’ADESIONE è la forza attrattiva, che si esercita fra le molecole superficiali, di due o più corpi di una stessa sostanza o di sostanze diverse. Per questa forza le lastre di vetro aderiscono fra loro, e l’acqua aderisce al recipiente.
ATOMO(dal greco a= senza, temno = divido)
L’atomo è il costituente fondamentale della materia.
Pur essendo dal punto di vista chimico la più piccola struttura materiale esistente, l’atomo non rappresenta però il costituente ultimo della materia. I progressi della fisica sperimentale, determinati dalla scoperta dei raggi X e della radioattività, hanno messo in luce la complessità della struttura dell’atomo e hanno invalidato il concetto di atomo inteso come particella ultima della materia. I differenti elementi che compongono la materia sono formati da atomi con caratteristiche ben determinate, quali per esempio la massa e il numero atomico.
Una molecola può essere composta da 1, 2, 3 o più atomi, e si dice: molecola monoatomica, biatomica, triatomica.
Le molecole delle sostanze semplici sono formate da uno o più atomi uguali.
Le molecole delle sostanze composte sono formate da uno o più atomi diversi.
STRUTTURA DELL’ATOMO
L’atomo ha un nucleo centrale nel quale sono presenti protoni e neutroni. Intorno al nucleo ruotano, in orbite, gli elettroni.
Il protone è una particella di massa 1 e provvista di carica elettrica positiva.
L’elettrone è una particella con carica elettrica negativa ed avente la massa 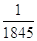 , vale a dire 1845 volte più piccola di quella del protone.
, vale a dire 1845 volte più piccola di quella del protone.
Il neutrone, elettricamente neutro, è formato essenzialmente dall’unione di un protone e di un elettrone, di massa  .
.
Un atomo ha tanti protoni al nucleo quanti elettroni gli ruotano intorno, per questo risulta neutro.
Il numero atomico è il numero dei protoni ed individua un elemento chimico.
Il peso atomico, di un elemento è il numero che indica quante volte un atomo pesa di più della dodicesima parte dell’isotopo 12 del carbonio1. Esempio: sostenere che il sodio (Na) ha peso atomico 23 vuol dire che un atomo di sodio pesa 23 volte di più della dodicesima parte dell’isotopo 12 del carbonio.
Il peso molecolare di una sostanza è il numero che indica quante volte una molecola pesa di più della dodicesima parte dell’isotopo 12 del carbonio.
LEZIONE N°2
LA VALENZA
La capacità che hanno gli elementi di combinarsi con 1,2,3, o più atomi di idrogeno, o di sostituirne 1,2,3 o più atomi, si chiama valenza.
1° Esempio (Elementi che si combinano con atomi di idrogeno)
HCL |
H2O |
NH3 |
CH4 |
1 atomo di cloro è unito a 1 di idrogeno |
1 atomo di ossigeno è unito a 2 di idrogeno |
1 atomo di azoto è unito a 3 di idrogeno |
1 atomo di carbonio è unito a 4 di idrogeno |
MONOVALENTE |
BIVALENTE |
TRIVALENTE |
TETRAVALENTE |
2° Esempio (Elementi che sostituiscono atomi di idrogeno)
H3PO4
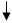 2PO4 CaHPO4 AlPO4
2PO4 CaHPO4 AlPO4
-H -2H -3H
STRATI-SOTTOSTRATI-ORBITE
Gli elettroni sono distribuiti in 7 strati o livelli e ognuno ha uno o più sottostrati.
STRATO |
SOTTOSTRATI |
N° ELETTRONI |
K |
s |
2 |
L |
s, p |
8 |
M |
s, p, d |
18 |
N |
s, p, d, f |
32 |
O |
s, p, d, f |
32 |
P |
p, d |
18 |
Q |
s, p |
8 |
Gli atomi possono perdere uno o più elettroni e poiché il numero dei protoni è maggiore degli elettroni gli atomi avranno carica positiva prendendo il nome di ioni positivi o cationi.
Gli atomi possono acquistare uno o più elettroni e poiché il numero dei protoni risulta minore degli elettroni gli atomi avranno carica negativa e prendono il nome di ioni negativi o anioni.
Se un atomo ha 2 elettroni sul primo livello e 8 sul secondo esso si trova in uno stato di equilibrio. I gas nobili si trovano in uno stato di equilibrio; tutti gli altri elementi tendono a raggiungerlo acquistando o cedendo elettroni per formare le molecole.
Vediamo come:
Se nello strato esterno ci sono 7 o 6 o 5 elettroni, l’atomo tende ad acquistare 1 o 2 o 3 elettroni per completare l’ottetto e saranno monovalente, bivalente o trivalente. Esempio:
Il sodio (Na) si lega al cloro (Cl) per formare il cloruro di sodio (comunemente detto sale da cucina).
Il Na (sodio) ha sull’ultimo livello 1 elettrone
Il Cloro (Cl) ha sull’ultimo livello 7 elettroni
Il Sodio cede il suo elettrone caricandosi positivamente (Na+)
Il Cloro acquista un elettrone caricandosi negativamente (Cl-)
LEZIONE N°3
LE REAZIONI CHIMICHE
I fenomeni chimici si possono chiamare anche reazioni chimiche le quali sono determinate da diversi fattori quali:
- Al semplice contatto;
- Dal calore;
- Dalla luce;
- Dalla pressione;
- Dall’elettricità.
Le reazioni possono essere:
- Esotermiche: se accompagnate dallo sviluppo di calore.
- Endotermiche: se avvengono con assorbimento di calore.
- Complete: se procedono fino all’esaurimento di almeno una delle sostanze che reagiscono.
- Incomplete: se si arrestano prima che le sostanze siano esaurite.
- Reversibili: se, in dipendenza della temperatura e della pressione, possono avvenire in un verso o nel suo opposto.
Esempio:
800°
 BaO2 BaO + O
BaO2 BaO + O
580°
Le reazioni chimiche si possono ridurre a 4 tipi:
Analisi: separazione di un composto in due o più sostanze
AB = A + B
esempio
CH4 = C + 2H2
- Sintesi: unione di due o più elementi per dare un composto
A + B = AB
esempio
H2 + O = H2O
- Sostituzione semplice o semplice scambio: un elemento, reagendo con un composto, sostituisce, liberando uno degli elementi del composto
AB + C = AC + B
(Reazione di ossidazione)
4HCl + O = H2O + 2 Cl2
I coefficienti numerici, che precedono i simboli degli elementi, si definiscono coefficienti di reazione.
Bilanciare un’equazione significa determinare i coefficienti di reazione
- Sostituzione doppia o doppio scambio: due composti si scambiano reciprocamente gli elementi componenti
AB + CD = AD + BC
esempio
HCl + NaOH = NaCl+ H2O
acido Idrossidio cloruro acqua
cloridrico di sodio di sodio
LEZIONE N°4
1 Isotopo: gli atomi di due isotopi, hanno lo stesso numero di elettroni, cioè hanno uguale numero atomico e la medesima carica positiva del nucleo atomico, mentre differiscono per il numero di neutroni che sono contenuti nel nucleo stesso. Il carbonio ha due isotopi Carbonio 12 e Carbonio 14. L’idrogeno ha tre isotopi il prozio (massa 1), trizio (massa 2), il deuterio (massa 3).
LEGGI FONDAMENTALI DELLA CHIMICA
LEGGE DI LAVOISIER (1734-1794)
<<In ogni reazione chimica la somma dei pesi (masse) delle sostanze che reagiscono, è sempre uguale alla somma dei pesi (masse) delle sostanze che si ottengono dalla reazione>>
LEGGE DI PROUST (1754-1826)
<<In ogni composto gli elementi che lo costituiscono sono combinati fra loro in un rapporto in peso fisso e costante>>
Se 2 gr di idrogeno si uniscono con 16 gr di ossigeno; 1 gr di idrogeno si unisce con 8 gr di ossigeno mantenendo sempre costante il loro rapporto, infatti:
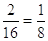
LEGGE DI DALTON (1766-1844)
<<Quando due elementi si combinano per dare diversi composti, le quantità di un elemento che si combinano con quantità fissa dell’altro stanno tra loro in rapporti esprimibili mediante numeri interi e generalmente piccoli>> esempio:
2 gr di H2 + 16 gr di O = 18 gr di H2O (acqua)
2 gr di H2 + 32 gr di O = 34 gr di H2O2 (acqua ossigenata)
LEZIONE N°5
ESAME DI ALCUNE GRANDEZZE FISICHE E CHIMICO-FISICHE
COSTRUZIONE DI UN’APPARECCHIATURA PER MISURARE L’ENTALPIA DI COMBUSTIONE DI UN ALIMENTO.
OBIETTIVO: calcolare il potere calorico degli alimenti a base di lipidi e a base di carboidrati
PER SAPERNE DI PIÙ
L’uomo, per svolgere qualsiasi attività, ha bisogno d'energia che è fornita dalle sostanze contenute negli alimenti. La maggior quantità d'energia è fornita dai carboidrati o zuccheri e dai lipidi o grassi.
Ogni alimento che ingeriamo ha un potere calorico, in altre parole, libera una quantità d'energia, che chiamiamo Kilocaloria o Caloria ed è l’unità di misura usata per descrivere l’energia che s'ottiene dal cibo.
Una Caloria corrisponde alla quantità di calore che serve per aumentare di un grado Celsius un grammo d'acqua.
La quantità di calore per aumentare di un grado Celsius un Chilogrammo d'acqua si definisce Kilocaloria (kcal).
Nei lavori scientifici per misurare la Caloria si usa il kilojoul (kJ), quindi 1 kcal è = a 4,187 kJ.
Per calcolare i kJ prodotti da un cracker salato con kcal 428 bisogna eseguire la seguente moltiplicazione: kcal 428 x 4,187 kJ = 1792 kJ
Prova a calcolare i kJ dell’olio d'oliva che sviluppa un'energia equivalente a 900 kcal e scrivila nel rigo sottostante:
-----------------------------------------------------------------------
Il calorimetroo bomba calorimetricaè un dispositivo usato per calcolare la quantità di calore ceduta o assorbito in processi fisici e chimici. Il calorimetrosi usa per determinare il calore specifico ed i poteri calorifici delle sostanze.
Il calorimetro è un dispositivo ben isolato e resistente alle alte pressioni. In tale contenitore avviene una combustione in presenza d'ossigeno in eccesso a volume costante. Tutto il calore che si sviluppa si trasmette sia all’acqua, contenuta nel calorimetro, che al calorimetro stesso, dopo aver innescato la combustione mediante un sistema elettrico.
La quantità di calore può essere calcolata misurando l’aumento di temperatura dell’acqua e conoscendo la capacità termica del calorimetro.
Un calorimetro lo possiamo costruire con materiale semplice, come ad esempio un vasetto di creta, rivestito di una garza di gesso, nel quale sono praticate dei fori e un’apertura bi base.
I valori che si possono ottenere con tale strumento, non sono molto affidabili ma s'avvicinano a quelli riportati nelle tabelle delle calorie.
Il potere calorifico è calcolato in joule secondo la seguente formula:
FORMULA N° 1 DH (J) = 4,187 x m x DT
legenda
m massa (quantità di acqua nel becher)
T (temperatura registrata dopo la combustione)
ESERCITAZIONE
MATERIALI
- Una camera di combustione (vasetto di creta)
- Un becher con 50 ml di acqua distillata
- Un termometro da -10°C a 110°C
- Un dinamometro per misurare un campione di sostanza
- Una bacchettina
- Fiammiferi
- Un supporto per poggiare la sostanza da esaminare
CAMPIONI ALIMENTARI:
cracker, mandorla, noce e pane
ATTENZIONE !!! Le operazioni indicate devono essere eseguite nell’ordine stabilito
- Versate nel becher 50ml di acqua distillata e immergetevi il termometro e registrate la
- temperatura
- Disponete il becher sul vasetto di creta e annotate la temperatura dell’acqua.
- Pesate 10 g di cracker, con il dinamometro, e poggiatelo sul supporto.
- Con il fiammifero accendete i 10 g di cracker e ponetelo subito nella camera di combustione.
- Con la bacchettina rigirate l’acqua nel becher fino alla fine della combustione del cracker. A questo punto registrare la temperatura raggiunta dall’acqua.
- Calcolate l’entalpia di combustione del cracker vedi FORMULA N° 1
(differenza di temperatura dell’acqua prima e dopo della combustione)
- Ripeti il procedimento, dal punto 1 al punto 6, per determinare il potere calorico per la noce e la mandorla registrando i risultati nella seguente tabella
Alimento |
Peso |
Temperatura iniziale dell’acqua |
Entalpia |
Cracker |
|
|
|
Mandorla |
|
|
|
Noce |
|
|
|
PANE |
|
|
|
LEZIONE N°6
ESAMI DI LABORATORIO PER LA RICERCA E SAGGI DI RICONOSCIMENTO DEI PRINCIPI ALIMENTARI:
L’ACQUA NELL’ ALIMENTAZIONE
Esame della solubilità in acqua di sostanze e alimenti
OBIETTIVO: riconoscere quali sostanze sono solubili e quali quelle insolubili
PER SAPERNE DI PIÙ
Nella gran parte delle reazioni chimiche, legate ai processi vitali, avvengono in soluzione. Conosce le proprietà delle reazioni è importante, per comprendere perché alcuni liquidi si mescolano e altri no oppure perché l’acqua non è in grado di sciogliere alcune sostanze.
Facciamo un esempio: l’olio e l’aceto con il quale condiamo le nostre insalate non si mescolano; l’acqua non è in grado di sciogliere le macchie di vernice ma è necessario l’intervento di solventi adatti.
Le soluzioni si distinguono in omogenee, eterogenee e colloidali
Analizzando una bibita gassata, noteremo che i suoi componenti, zucchero, anidride carbonica e aromi, sono distribuiti nella soluzione in modo uniforme. Questo tipo di soluzione è definita omogenea.
Se in acqua immergiamo la sabbia e agitiamo ritroveremo, sempre la sabbia nel fondo e tale soluzione è definita soluzione eterogenea.
Le soluzioni colloidali sono apparentemente simili alle soluzioni omogenee perché si presentano trasparenti ma in realtà rappresentano una via di mezzo tra la soluzione omogenea e quella eterogenea. Le particelle colloidali sono più grandi dei singoli atomi, ioni o molecole delle soluzioni, ma sono più piccole delle particelle delle sospensioni tali da poter essere viste solo al microscopio e che tendono a precipitare quando la sospensione è lasciata a riposo. I liquidi colloidali più noti sono il latte e il sangue.
In una soluzione omogenea distinguiamo due componenti il solvente, presente in maggiore quantità, e il soluto presente in minore quantità.
Quando tutte le particelle di soluto si diffondono fra le molecole del solvente, si ottiene una soluzione non satura. Se in tale soluzione aggiungo un’altra quantità di soluto l’eccesso, si deposita sul fondo ottenendo una soluzione satura.
- In una soluzione alcolica al 5% l’alcool è il soluto mentre l’acqua è il solvente. Se a tale soluzione si aggiunge ancora alcool, fino al 70%, avremo che l’alcool diventa solvente e l’acqua diventa soluto.
Le soluzioni che dimostrano una completa solubilità sono caratterizzate da componenti con caratteristiche simili.
La capacità di un composto di sciogliersi in acqua dipende dalla capacità delle molecole di attrarsi o respingersi secondo la loro polarità §.
A volte, solvente-soluto formano una soluzione, qualsiasi sia la loro proporzione, in questo caso sono definiti miscibili.
Quando i componenti della soluzione hanno la stessa dimensione e polarità, oppure hanno la stessa dimensione e non hanno polarità, si dicono miscibili in tutte le proporzioni.
Quando i componenti della soluzione hanno polarità diverse mostrano un limite alla solubilità e sono detti parzialmente miscibili §
Quando i componenti, della soluzione, sono formati da uno polare e l’altro non polare la soluzione si dicono immiscibili §.
Nell’esercitazione, che ci accingiamo ad operare, si vedrà come i composti inorganici sono più solubili degli organici.
I composti inorganici formano con l’acqua ioni idrati oppure formano legami con ponte a idrogeno. I composti organici, invece, sono poco solubili e si ha una solubilità solo se la natura polare del loro gruppo rende possibile legame dipolo-dipolo.
ESERCITAZIONE
MATERIALI
- Provette numerate da 1 a 7
- Contagocce
SOSTANZE CHIMICHE (inorganiche e organiche)
- nella provetta N°1 ci sono pochi cristalli di cloruro di potassio
- nella provetta N°2 ci sono pochi cristalli bicarbonato di sodio
- nella provetta N°3 c’è una piccolissima quantità di fruttosio (fructosan)
- nella provetta N°4 c’è una piccolissima quantità di amido (fecola di patata)
- nella provetta N°5 c’è una piccolissima quantità di alcool etilico
- nella provetta N°6 c’è olio + acqua a volumi uguali
- nella provetta N°7 c’è olio + alcool etilico a volumi uguali
§ Le molecole che hanno legami con differenze di elettronegatività, si dicono polari.
Esempio: la molecola HCl (acido cloridrico) ha l’atomo d’idrogeno con elettronegatività 2,1 mentre l’atomo di cloro
ha elettronegatività 3 quindi esiste una differenza di 0,9 e gli elettroni non sono condivisi in misura uguale per questo
l’idrogeno assume una carica positiva e il cloro una carica negativa ed insieme costituiscono una molecola
dipolare. Le molecole che hanno legami con la medesima elettronegatività, si dicono non polari.
§ Esempio di soluzione parzialmente miscibile: acqua + benzina. Quando i due componenti, benzina e acqua hanno
raggiunto il limite di solubilità un’ulteriore quantità di liquido non entrerà in soluzione e si formerà uno strato
distinto
§ Esempio di soluzioni immiscibili: l’olio e l’acqua non si sciolgono l’uno nell’altro perché le molecole dell’olio non
sono polari e non si disperdono tra le particelle polari dell’acqua formando due strati distinti.
ATTENZIONE !!! Contare le gocce con accurata precisione.
Versare 25 gocce di acqua nelle provette contrassegnate dal n° 1 al n°5.
Tenendo conto che nelle provette n° 1 e n°2 vi sono composti inorganici, mentre nelle provette dal n°3 al n°5 vi sono composti organici, valuta il grado di solubilità attraverso la limpidezza del miscuglio. Ricorda che la torbidità e la separazione di due fasi indica l’insolubilità.
In conformità a quanto detto, osserva bene le soluzioni nelle provette e trascrivi nella griglia, sotto indicata, il grado di solubilità del miscuglio (esempio: solubile - insolubile - parzialmente solubile).
N° PROVETTA |
MISCUGLI |
GRADO DI SOLUBILITÀ’ |
1 |
cloruro di potassio + acqua |
|
2 |
bicarbonato di sodio + acqua |
|
3 |
fruttosio + acqua |
|
4 |
amido + acqua |
|
5 |
alcool etilico + acqua |
|
6 |
olio + acqua |
|
7 |
olio + alcool etilico |
|
LEZIONE N°7
ESAMI DI LABORATORIO PER LA RICERCA E SAGGI DI RICONOSCIMENTO DEI PRINCIPI ALIMENTARI:
L’ACQUA NELL’ALIMENTAZIONE
Separazione dell’acqua da un vegetale e suo riconoscimento
OBIETTIVO: verificare e quantizzare la quantità d’acqua in un vegetale
PER SAPERNE DI PIÙ
Tutti gli organismi viventi contengono acqua, che di regola rappresentano il loro costituente più abbondante.
Negli animali e nelle piante, in generale, il contenuto totale d’acqua varia, entro limiti compresi, tra la metà e il 9/10 del peso dell’intero organismo.
Nei vegetali superiori il 75-90% del peso totale è costituito d’acqua, presente in maggiore quantità nella foglia (60-80%) che nei rami (5-10%) e più abbondante durante i fenomeni di germinazione.
L’acqua che l’organismo perde attraverso il sudore l’urina, la respirazione è reintegrata attraverso gli alimenti. La frutta e la verdura fresca contengono molta acqua, infatti, quando si mangia l’insalata è come se si bevesse un sorso d’acqua perché ne contiene circa il 90%. Vediamo nella seguente tabella le percentuali d’acqua nei diversi alimenti:
Alimento |
percentuale d’acqua |
latte intero |
87% |
prosciutto |
13% |
verdura fresca |
90% |
frutta fresca |
85% |
uova |
74% |
pane bianco |
35% |
In natura l’acqua si trova presente nei tre stati, costituendo un ciclo ininterrotto. Assistiamo, infatti, ad una continua trasformazione dell’acqua dallo stato liquido (mare, fiumi, laghi) a quello di vapore (umidità atmosferica, nuvole) e poi nuovamente a quello di liquido (pioggia) o solido (neve, grandine) che riporta a terra l’acqua, salita come vapore nell’atmosfera, per effetto del riscaldamento solare.
L’acqua che penetra nel terreno viene in parte trattenuta dal terreno stesso, in parte assorbita dalle piante.
La presenza dell’acqua nei vegetali rende, questi ultimi, facile preda di microrganismi perciò si ricorre comunemente ai sistemi di conservazione che non alterino le caratteristiche chimico-fisiche e le proprietà biologiche.
Uno dei metodi più diffusi, per la conservazione dei vegetali, è la liofilizzazione.
La liofilizzazione
Tale metodo si basa sulla proprietà dell’acqua di passare dallo stato solido allo stato gassoso.
In ambiente rarefatto a temperature minori di 0°C (Sublimazione), il procedimento consiste essenzialmente in due fasi: congelamento ed essiccazione.
La liofilizzazione permette di disidratare delle sostanze mantenendo inalterate le caratteristiche chimico-fisiche e le proprietà biologiche.
ESERCITAZIONE
MATERIALI
- Bilancia
- Lampadina da 25W
- Fornetto
- Imbuto
- Asta di ferro
- Becher
ALIMENTI
- Foglie di lattuga o di ficus
- Foglie di ficus
Grammi di:
- Mele
- Lattuga fresca
- Patate
- Fagioli freschi
Per misurare la quantità d'acqua presente in un vegetale si può procedere nei due modi seguenti:
1) registrare il peso prima e dopo un procedimento d'essiccazione
2) irradiare una quantità di vegetale con una fonte di calore generata da una lampadina da 25W
PROCEDIMENTO N° 1
Procuratevi una quantità equivalente di alimenti, nel modo in cui è indicato alla 1a pesata nella tabella sottostante.
Sottoponete ogni alimento ad una temperatura di 100° per un tempo di 15’ in un fornetto.
Trascorso il tempo prestabilito, registrare il peso degli alimenti nella colonna che indica la 2a pesata e calcolarne la differenza.
Alimento |
1a pesata |
2a pesata |
Diminuzione di peso |
Mele |
400 g. |
|
|
Lattuga fresca |
400 g. |
|
|
Patate |
400 g. |
|
|
Fagioli freschi |
400 g. |
|
|
Cosa rappresenta la differenza peso?
In quale alimento si è registrata la minore differenza di Peso?
In quale alimento si è registrata la maggiore differenza di peso?
PROCEDIMENTO N° 2
Raccogliere una quantità di foglie e registrare il peso nella tabella sottostante.
Fissate, con un morsetto, un imbuto ad un’asta metallica e mettete sotto di esso un bicchiere graduato o un vasetto di marmellata.
Ponete nel recipiente le foglie e illuminatele con una lampada da 25W.
Osservate cosa succede durante l’irraggiamento e registrare, nel quaderno delle scienze, le vostre osservazioni.
Dopo un certo tempo misurate il liquido raccolto nel bicchiere.
Ripetete tale procedimento con diversi tipi di foglie e annotate le differenze.
Quantità di foglie |
Quantità d'acqua raccolta in c.c. |
Mele |
|
Lattuga fresca |
|
Patate |
|
Fagioli freschi |
|
LEZIONE N°8
ESAMI DI LABORATORIO PER LA RICERCA E SAGGI DI RICONOSCIMENTO DEI PRINCIPI ALIMENTARI:
L’ACQUA NELL’ ALIMENTAZIONE
Individuazione di alcuni ioni presenti nelle acque (saggi alla fiamma)
OBIETTIVO: rilevare i sali minerali presenti negli alimenti in base alla colorazione che la fiamma assume
PER SAPERNE DI PIÙ
L’acqua per il suo elevato potere solvente è il costituente fondamentale delle soluzioni acquose negli ambiente naturali.
I soluti contenuti in esse sono presenti in forma di ioni, derivanti dalla solubilizzazione di alcuni minerali contenuti nelle rocce e trasportati in superficie.
Sia le acque superficiali che sotterranee continuano la loro azione di trasporto degli ioni che, in condizioni idonee, rendono possibile la ricristallizzazione dei minerali.
In quanto soluzioni, le acque naturali presentano proprietà colligative3.
Le particelle di soluto possono, fisicamente, alterare le proprietà colligative delle soluzioni indipendentemente dal tipo di soluto.
Le proprietà colligative sono sfruttate per molti scopi pratici ad esempio:
il glicole etilenico è un liquido che si usa come antigelo per proteggere i motori delle automobili, raffreddati ad acqua, dal congelamento abbassando il punto di congelamento del liquido refrigerante e innalzando il punto di ebollizione della soluzione sottraendo il calore al motore in modo più efficace.
Un altro esempio che sfrutta tali proprietà è cospargere il sale sulle strade innevate o ghiacciate per renderle transitabili e più sicure per gli automobilisti.
Quando il sale si mescola con la neve, si scioglie e forma una soluzione di acqua e sale. Il punto di congelamento di questa soluzione è più basso di quello dell’acqua pura e quindi la neve si scioglie. Se invece del sale fosse stato usato un altro soluto la neve, si scioglieva comunque perché la variazione della temperatura di congelamento non dipende dal tipo di soluto ma dalla concentrazione delle particelle di soluto all’interno della soluzione.
Come abbiamo detto, a pagina 4, l’acqua che penetra nel terreno viene in parte trattenuta dal terreno stesso, in parte assorbita dalle piante e l’uomo assume gli ioni sia attraverso l’acqua e sia attraverso gli alimenti di origine vegetale e animale.
Di alcuni ioni non se ne conosce la funzione, di altri è riconosciuta la tossicità se sono presenti in determinate quantità, di altri ancora, biologicamente importanti, si conoscono le principali funzioni.
Le acque utilizzate dall’uomo per uso alimentare sono quelle potabili.
L’acqua è definita potabile quando è limpida, insapore, inodore, incolore e innocua cioè quando è priva di microrganismi patogeni e sostanze chimiche nocive per l’uomo.
Con il D.P.R. 24/5/1988 n°236, in attuazione della direttiva C.E.E. n° 80/778, sono state stabilite le caratteristiche di qualità delle acque destinate al consumo umano, ad eccezione delle acque minerali che per la loro caratteristica sono soggette ad una normativa specifica e sono adoperate per le proprietà terapeutiche (diuretiche, lassative, antibatteriche).
Le acque potabili devono soddisfare a precisi requisiti organolettici, fisici, chimici e microbiologici, stabiliti dal decreto e sono:
temperatura tra 12°C e 25°C
pH tra 6,5 e 8,5
durezzaª tra 15°F e 50°F
Analizziamo ora la presenza, nell’acqua potabile, degli ioni consentiti e non:
- La presenza dello ione ammonio NH4 è un segnale d’inquinamento in atto.
- La presenza dello ione nitrito NO2 è un segnale d’inquinamento recente
- La presenza dello ione nitrato NO3 è ammesso fino a 50 mg per litro.
- Quantità maggiori determinano asfissia e cianosi per questo deve essere controllata, in particolar modo, nell’alimentazione dei bambini e dei soggetti deboli.
- La presenza dello ione cloruro Cl- è ammesso fino a 200 mg per litro.
- Quantità maggiori indicano inquinamento da liquami e urine.
- La presenza dello ione ferro Fe2+ è ammesso fino a 0,2 mg per litro e lo ione manganese Mn2+ è ammesso fino a 0,05 mg per litro. Maggiori quantità intorbidiscono l’acqua.
- Gli antiparassitari (erbicidi, insetticidi e fungicidi) sono ammessi in quantità tollerabili fino a 0,1 grammo per litro singolarmente e fino a 0,5 grammi per litro complessivamente.
Analizziamo adesso l’aspetto batteriologico dell’acqua:
I coliformi fecali1 e streptococchi fecali2 la loro presenza non è ammessa
I metalli pesanti (mercurio, piombo e cromo) presenti nelle acque sotto forma di composti inorganici rappresentano un pericolo nella catena alimentare perché li ritroviamo negli alimenti (pesce, latte, carne, verdura ecc.). La pericolosità è dovuta al fatto che, tali metalli, reagiscono con il gruppo SH degli enzimi cellulari e di altre proteine provocando gravi danni metabolici e strutturali alle cellule.
ESERCITAZIONE
MATERIALI
- Contagocce
- Provette
- Filo di platino
- Vetrino da orologio
- Vetrino al cobalto
- Becher
- Bacchettina di vetro
- Bicchierini di plastica
- Carta da forno o foglio di alluminio
SOSTANZE CHIMICHE
- Soluzione di nitrato d’argento
- Cloruro di potassio
- Acido cloridrico
- Cloruro di sodio
CAMPIONI ALIMENTARI
Castagna, banana, succo di frutta, acqua di fontana
ATTENZIONE!!! NON TOCCARE MAI IL FILO DI PLATINO CON LE MANI
Ogni operazione deve essere eseguita con accuratezza ed eseguite nell’ordine.
- Versare 50 cc di acqua di fontana o minerale e riscaldarla fino alla completa evaporazione. Durante quest’operazione agitare l’acqua con una bacchettina di vetro estraendola 3-4 volte per evitare che l’acqua schizzi e assicurarsi un’ebollizione regolare.
- Intingere la punta del filo di platino nell’acido cloridrico contenuto in un vetrino da orologio.
- Far aderire alla punta un piccolissimo cristallo di cloruro di potassio toccandolo leggermente e portarlo sul mantello esterno della fiamma della lampada ad alcool.
- Attendere un po' di tempo perché in alcuni casi il colore tarda ad apparire in quanto la presenza di alcuni ioni può mascherarlo.
- Osservate il caratteristico colore della radiazione emessa dal potassio. La stessa colorazione diventa ancora più evidente se osservata attraverso il vetrino a cobalto.
- Pulire alla fiamma il filo di platino intingendolo di tanto in tanto nell’acido cloridrico contenuto in un secondo vetrino. Continuare quest’operazione fino a che il filo risulta pulito cioè deve risultare incandescente e non deve dare alcuna colorazione.
- Ripetere la stessa operazione facendo aderire un cristallino di cloruro di sodio.
- Pulire il filo come al punto 6
- Effettuare un saggio alla fiamma sul residuo ottenuto al punto 1
- Pulire il filo come al punto 6
- Sminuzzare le sostanze alimentari elencate utilizzando il mortaio e il pestello e porle singolarmente su carta da forno
- Disponete su un vetrino da orologio, con l’aiuto della spatola un po' della sostanza alimentare sminuzzata e con il filo raccogliere, delicatamente, un granello e sottoporlo alla fiamma.
- Osservare il colore alla fiamma e registrarlo nella tabella sottostante.
- Ripetete le operazioni al punto 12 e 13 registrando i colori nella tabella.
SOSTANZE ALIMENTARI |
COLORE ALLA FIAMMA |
Castagna |
|
banana |
|
Succo di frutta |
|
Acqua di fontana |
|
|
|
ELEMENTI CHIMICI |
|
Sodio |
|
Potassio |
|
Osservando i colori nella tabella tra quelli risultanti dagli elementi e quelli risultanti dalle sostanze alimentari trova analogie e annotale nelle righe sottostanti.
LEZIONE N°9
ESAMI DI LABORATORIO PER LA RICERCA E SAGGI DI RICONOSCIMENTO DEI PRINCIPI ALIMENTARI:
RICONOSCIMENTO DEI LIPIDI NEGLI ALIMENTI
Saggi di solubilità - Saggio con il Sudan IV
OBIETTIVO: verificare l’insolubilità in acqua e la solubilità in un solvente apolare (Sudan IV)
PER SAPERNE DI PIÙ
Con il nome di lipidi si indicano numerosi composti organici che pur avendo una costituzione chimica e proprietà biologica diversa hanno in comune alcune caratteristiche:
Insolubilità in acqua
- Solubilità in solventi polari
- Peso specifico < di 1g/mL
- Untuosità
I lipidi sono sostanze di origine sia animale e sia vegetale quelli biologicamente importanti sono:
- I grassi, detti anche gliceridi o lipidi semplici, a questi appartengono i trigliceridi che sono la fonte principale di riserva di energia dell’organismo e il loro potere calorico è di 9 Kcal/g.
- I fosfolipidi e le lipoproteine sono componenti importanti della membrana plasmatica della cellula e di altre strutture cellulari.
I lipidi si classificano in:
- Saponificabili cioè danno saponi §
- Non saponificabili ed hanno funzioni specializzate. A questi appartengono il colesterolo e alcuni ormoni sessuali.
Dal punto di vista chimico i grassi sono il prodotto della reazione fra un alcool (glicerina) e un acido grasso (acido carbossilico con un numero di atomi di carbonio superiore a 12).
Secondo il numero di molecole d'acido grasso distinguiamo:
- monogliceride = glicerina +1 acido grasso
- digliceride = glicerina + 2 acido grasso
- trigliceride = glicerina + 3 acido grasso
I trigliceridi si distinguono in:
- Semplici quando sono formati da acidi grassi tutti uguali
- Misti quando sono formati da diversi acidi grassi
La molecola d'acido grasso è caratterizzata dal gruppo -COOH legata ad una catena di carbonio costituendo acidi grassi del tipo:
- Saturo quando i legami fra un atomo di carbonio e un altro sono semplici; esempio:
- ....C - C - C - C - COOH
- (catena satura di atomi di carbonio presente prevalentemente nei grassi animali)
- Ricordiamo l’acido palmitico e l’acido stearico
- insaturo quando i legami fra un atomo di carbonio e un altro sono doppi; esempio:
- ....C - C = C - C = C - C ...C - COOH
- (catena insatura di atomi di carbonio presente prevalentemente nei grassi vegetali)
- Gli acidi grassi insaturi si differenziano tra loro in base al numero dei doppi legami ed abbiamo:
- Acido grasso mono-insaturo (acido oleico) presenta 1 doppio legame.
- Gi acidi grassi poli-insaturi sono:
- acido linoleico presenta sia 2 e sia 3 legami
- acido arachidonico presenta 4 doppi legami
I grassi sono una miscela d'acidi grassi saturi e insaturi.
Se prevalgono gli acidi grassi saturi il composto si presenta in forma solida ed è chiamato grasso (es. Strutto, lardo).
Se prevalgono gli acidi grassi insaturi il composto si presenta in forma liquida ed è chiamato olio.
3 le proprietà colligative sono: la pressione osmotica e la temperatura di ebollizione e di congelamento
ª La durezza delle acque è espressa in gradi francesi °F che indicano la quantità in grammi di
CaCO3 (carbonato di calcio) contenuta in 100 litri di acqua ossia 10 mg di CaCO3 in un litro di acqua.
°F (grado Fahrenheit) corrisponde all’intervallo tra il ghiaccio fondente e l’acqua bollente diviso in 180 parti e non
in 100 parti come nella scala centigrada o Celsius.
CLASSIFICAZIONE DELLE ACQUE SECONDO LA DUREZZA |
|
GRADI FRANCESI |
TIPO |
0 ¸ 7 |
dolcissime |
7 ¸ 15 |
dolci |
15 ¸ 22 |
dure |
22 ¸ 35 |
molto dure |
> 35 |
durissime |
1 I coliformi fecali hanno forma di bacilli ed hanno un ruolo patogeno per l’organismo. Nell’uomo provocano
infezioni all’intestino e in alcuni casi si localizzano nelle vie urinarie o genitali o nelle vie biliari e in casi gravi si
localizzano nel sistema nervoso provocando meningiti.
2 Gli streptococchi fecali sono microrganismi a forma sferica (cocchi), al microscopio appaiono come una
catena. Sono generalmente saprofiti con capacità virulenti dando luogo ad infezioni di vario tipo.
§La fabbricazione del sapone è un processo antico. Quando, al tempo di Giulio Cesare, bollivano il grasso di capra con la potassa, ottenuta dalla cenere dei fuochi a legna, eseguivano la stessa reazione chimica che ora i moderni fabbricanti di sapone applicano su larga scala: l’idrolisi dei trigliceridi i cui prodotti la glicerina e i sali degli acidi carbossilici propriamente detto sapone. La composizione e il metodo di lavorazione possono variare, infatti, si prepara con l’olio di oliva si ottiene il sapone di Marsiglia, se si usa il sale di potassio si ottiene il sapone molle.
Gli alimenti contengono tutti e tre questi acidi grassi (saturo, insaturo e poli-insaturi), in combinazione diverse secondo la loro natura.
Le carni, per esempio, come tutte le sostanze d'origine animale, sono ricche di grassi saturi, i vegetali di grassi insaturi.
ESERCITAZIONE
MATERIALI
- Becher
- Provette
- Portaprovette
- Contagocce
- Siringhe
- Spatola
- Bicchierini di plastica
- Cilindro
- Pinza
CAMPIONI ALIMENTARI
- Olio di oliva
- Sugna
SOSTANZE CHIMICHE
- Isopropanolo
- Acqua distillata
- Soluzione alcolica di Sudan IV
PROCEDIMENTO N° 1 “SAGGI DI SOLUBILITÀ”
ATTENZIONE!!!! Eseguite le operazione nell’ordine dato e con assoluta precisione nelle dosi indicate.
Avete 3 provette contrassegnate con una etichettatura da 1 a 3.
Nella provetta n°1 vi sono 5 mL di isopropanolo
Nella provetta n°2 ci sono 5 mL di acqua distillata
Nella provetta n°2 ci sono 5 mL di acqua distillata
- Con il contagocce versate 1 goccia di olio nella provetta n°1 e 1 goccia di olio nella provetta n°2
- Agitare le provette energicamente con un movimento rotatorio del polso
- Nella terza provetta sarà aggiunto, dall’insegnante, 5 mL di isopropanolo.
Osservare il miscuglio ottenuto nelle singole provette e indicate, nella tabella, in quale provetta si verifica la solubilità e in quale si verifica la non solubilità utilizzando i simboli:
S (solubile)
NS (non solubile
PROVETTE |
SOLVENTE + SOLUTO |
S / NS |
ISOPROPANOLO + OLIO |
|
|
ACQUA DISTILLATA + OLIO |
|
|
ACQUA DISTILLATA + ISOPROPANOLO |
|
Quesiti
In quale provetta si è verificato un miscuglio omogeneo? ....................................
In quale provetta si è verificato un miscuglio eterogeneo? ....................................
Sai giustificare l’insolubilità del miscuglio olio-acqua tenendo conto della natura dei legami delle molecole dell’acqua e quelle dei trigliceridi?
PROCEDIMENTO N° 2 SAGGIO CON SUDAN IV
ATTENZIONE!!!! Eseguite le operazione nell’ordine dato e con assoluta precisione nelle dosi indicate.
Il Sudan IV è un colorante non polare1 solubile che, a contatto con sostanze non polari, forma goccioline rosse.
Avete a disposizione 2 provette contrassegnate con il n°1 e il n°2
- Preparate un becher con acqua bollente
- Con la siringa versate 5 mL di acqua distillata nelle due provette
- Nella 1a provetta aggiungete 4 gocce di olio e agitate
- Nella 2a provetta aggiungete, servendovi della spatola, una punta di sugna
- Ponete le due provette nel becher di acqua bollente e attendere 5 minuti osservando ciò che accade.
- Utilizzando la pinza prendete le provette nelle quali l’insegnante aggiungerà 10-15 gocce di Sudan IV e agitare fino a che le trasformazioni appaiono evidenti
Osservare il miscuglio ottenuto nelle singole provette e indicare, nella tabella, in quale provetta si verifica la solubilità e in quale si verifica la non solubilità utilizzando i simboli:
S (solubile)
NS (non solubile
PROVETTE |
SOLVENTE + SOLUTO |
S/NS |
ACQUA DISTILLATA + OLIO + Sudan IV |
|
|
ACQUA DISTILLATA + SUGNA + Sudan IV |
|
APPROFONDIMENTO
Avete a disposizione:
- 4 pezzi di stoffa unti contrassegnati dai numeri
- ovatta
- sostanze polari e non polari quali: trielina, benzina, alcool e acqua.
Provate a smacchiare i pezzi di stoffa, con le sostanze a disposizione e descrivete il comportamento dei solventi inserendo, nella tabella, il potere solvente utilizzando il simbolo (+).
Esempio se non s'ottiene alcun risultato indicate con (0), se s'ottiene un risultato scadente indicare con (+) e man mano, che il solvente è più efficace, aggiungete il numero di crocette fino ad un massimo di 3 crocette.
PEZZETTI DI STOFFA |
SOLVENTE |
POTERE SOLVENTE |
TRIELINA |
|
|
ACQUA |
|
|
ALCOOL |
|
|
BENZINA |
|
Quesiti
- Dall’esperienza effettuata sulla stoffa, spiega i risultati tenendo conto dell’aspetto chimico.
- In altre parole cosa avviene quando il solvente si trova a contatto con i trigliceridi?.
Nell’esperienza con il Sudan IV avete ottenuto delle goccioline rosse in superficie, tenendo conto della caratteristica molecolare sia del Sudan IV e sia dei trigliceridi spiega perché le goccioline galleggiano.
LEZIONE N°10
ESAMI DI LABORATORIO PER LA RICERCA E SAGGI DI RICONOSCIMENTO DEI PRINCIPI ALIMENTARI:
RICERCA DEI LIPIDI NEGLI ALIMENTI
Saggi di solubilità - Saggio con il Sudan IV
OBIETTIVO: individuare i lipidi nei campioni alimentari
PER SAPERNE DI PIÙ
Un po’ di storia
Fino agli anni “30” le sostanze grasse erano considerate solo fonte d'energia.
Negli anni “50” i grassi del corpo umano erano solo conseguenza del tipo di alimentazione.
Per il resto i grassi erano considerati sostanze immutabili. Si credeva che non esistesse alcuna relazione tra la qualità del cibo e le sostanze grasse che ricoprivano tutti gli organi del corpo. Solo negli ultimi decenni si è scoperto che i lipidi, secondo il tipo di grasso che s'assume, modificano la composizione delle cellule, persino a livello cerebrale.
Ruoli fondamentali dei lipidi
- Innanzi tutto i grassi sono riserve d'energia che l’organismo utilizza quando ne ha bisogno per garantire un rifornimento costante.
- I grassi avvolgono gli organi interni formando dei cuscinetti che proteggono dagli urti e dagli sbalzi di temperatura.
- Se non ci fossero i grassi il nostro corpo, sarebbe privato della vitamina A (indispensabile per la crescita), della vitamina E (indispensabile nella fase riproduttiva) e della vitamina D (indispensabile per la calcificazione delle ossa e dei denti).
- Queste vitamine vanno in circolazione solo se disciolte nei grassi e per tale caratteristica
- si definiscono <<liposolubili>>.
- Siccome l’organismo non è capace di produrre da solo gli acidi grassi, indispensabili per la crescita, questi sono introdotti con l’assunzione dei grassi.
- Uno di questi acidi crassi è l’acido linoleico importante per la crescita e per i tessuti ed è ingerito attraverso gli oli da condimento quali: di arachide, di mais, di soia, di sesamo e di oliva.
- Infine, i grassi e in particolare il colesterolo1 sono i componenti fondamentali delle membrane cellulari, influenzano la composizione del sangue e la formazione di ormoni importanti come quelli sessuali.
I GRASSI NELLA DIETA
Una dieta ricca di grassi può provocare:
- L’arteriosclerosi che si manifesta con l’indurimento, la deformazione e la mancanza d'elasticità sia delle grandi, medie e piccole arterie dovute a deposito di colesterolo cattivo (LDL).
- L’infarto è la morte di zone del tessuto cardiaco dovuto all’interruzione del flusso sanguigno.
Una dieta povera di grassi può provocare:
- Ritardo nella crescita
- Ritardo nello sviluppo del sistema nervoso
- Non si formano gli ormoni sessuali (androgeno, estrogeno e progesterone)
- Non si formano gli acidi grassi
I pericoli delle alterazione dei grassi
I grassi s'alterano a contatto con l’aria e con il calore subendo trasformazioni secondo il tipo di grasso. Si possono verificare due fenomeni:
- La molecola si rompe e lascia liberi gli elementi che la compongono: glicerina e acidi grassi. Questo fenomeno avviene quando il grasso è sottoposto ad alta temperatura il liquido prende un colore scuro, inizia a schiumeggiare e produce molto fumo; la glicerina si trasforma in una sostanza tossica <<acroleina>> che provoca alterazioni a livello polmonare e rallenta la crescita. E’ importante conoscere il punto di fumo di un grasso. In pratica bisogna sapere a quale temperatura si rompono i legami emanando fumo; per l’olio d'arachide il valore è di 162°C, per l’olio d’oliva il valore è di 175°C, per il burro il valore è di 208°C.
- Dai valori dati si comprende che più alto sarà il punto di fumo più il grasso è adatto alla frittura.
- Le molecole s'ossidano, in altre parole subiscono un processo d'irrancidimento. Questo fenomeno avviene quando il grasso viene a contatto con l’ossigeno dell’aria e con la luce del sole. La reazione che avviene è la rottura dei legami degli acidi grassi trasformando i grassi in perossidi che sono sostanze tossiche. Quando i grassi vengono a contatto con la luce del sole, sprigionano radicali liberi che, reagendo tra loro, innescano un meccanismo a catena tale che tutte le molecole di grasso si spezzano in brevissimo tempo. Il fenomeno dell’ossidazione lo subisce particolarmente l’acido grasso polinsaturo (olio di semi). Per tale fenomeno si consiglia di consumare l’olio di semi allo stato crudo anziché cotto.
ESERCITAZIONE
MATERIALI
- Mortaio con pestello
- Carta da filtro
- Imbuto
- Becher
- Bicchierini di plastica
- Provette
- Portaprovette
- Siringhe
- Contagocce tarati
- Cilindro
CAMPIONI ALIMENTARI (in ogni bicchierino c’è un alimento ed è contrassegnato da un numero)
n°1 noce, n° 2 formaggio, n° 3 patata, n°4 panna per dolci, n°5 latte scremato
SOSTANZE CHIMICHE
- Isopropanolo
- Acqua distillata
- Soluzione alcolica di Sudan IV
PROCEDIMENTO N° 1 “SAGGI DI SOLUBILITÀ”
ATTENZIONE!!!! Eseguite le operazione nell’ordine dato e con assoluta precisione
- Pesare 1 g. di ogni alimento
- Pestare l’alimento n°1 dopo che l’insegnante ha aggiunto 10 mL di isopropanolo
- Filtrare la miscela nel bicchierino n°1
- Ripetere l’operazione a e b con l’alimento n°2 e n°3
- Nelle provette, contrassegnate dai numeri 1 a 3 versare 3 mL di acqua distillata e aggiungere 5 mL del filtrato utilizzando le siringhe contrassegnate con gli stessi numeri.
- Osservare il miscuglio ottenuto nelle singole provette.
- Indicare, nella tabella con i simboli SI e NO in quale provetta si verifica un miscuglio torbido
PROVETTE |
SOSTANZE ALIMENTARI |
SI/NO |
NOCE |
|
|
FORMAGGIO |
|
|
PATATA |
|
PROCEDIMENTO N°2 ATTIVITÀ OPERATIVA DIMOSTRATIVA
“SAGGIO CON SUDAN IV”
ATTENZIONE!!!! Eseguite le operazione nell’ordine dato e con assoluta precisione
- Preparare un becher con acqua bollente
- Pesare 1 g. di ogni alimento
- Pestare l’alimento n°1 dopo l’aggiunta 10 mL di acqua distillata
- Ripetere l’operazione b e c con l’alimento n°2, n°3, n°4 e n°5
- Versare nelle prime tre provette le prime tre miscele.
- Far riscaldare, per 5 minuti, le provette
- Versare i campioni contenuti nei bicchierini 4 e 5 nelle provette 4 e 5 e aggiungere 10 mL di acqua distillata e agitare
- Filtrare le miscele ottenute nelle provette riscaldate
- L’insegnante aggiungerà 10-15 gocce di Sudan IV in ciascuna delle 5 provette
- Osservare il miscuglio ottenuto nelle singole provette.
- Indicare, nella tabella con il simbolo SI se il risultato è positivo; NO se il risultato è negativo
PROVETTE |
|
S I/ NO |
NOCE |
|
|
FORMAGGIO |
|
|
PATATA |
|
|
PANNA DA MONTARE |
|
|
LATTE SCREMATO |
|
Osservando i risultati della tabella giustifica i comportamenti degli alimenti.
FORMAGGIO
PATATA
PANNA DA MONTARE
LATTE SCREMATO
QUESITI
- Quali sono le conseguenze di una dieta ricca di grassi?
- Quali sono le conseguenze di una dieta povera di grassi?
Il colesterolo è un grasso buono |
V |
F |
|
LDL è un grasso cattivo |
V |
F |
|
HDL è un grasso cattivo |
V |
F |
|
HDL provoca l’arteriosclerosi |
V |
F |
|
LDL non provoca l’arteriosclerosi |
V |
F |
|
DL non provoca l’arteriosclerosi |
V |
F |
|
L’olio d’oliva ha un basso punto di fumo |
V |
F |
|
Il burro ha un basso punto di fumo |
V |
F |
|
Il grasso con un punto di fumo alto può essere fritto |
V |
F |
|
Il grasso con un punto di fumo alto non può essere fritto |
V |
F |
|
L’olio di semi è buono per friggere |
V |
F |
|
L’olio di arachide è buono per friggere |
V |
F |
|
L’olio di oliva è buono per friggere |
V |
F |
|
Il calore danneggia gli acidi grassi polinsaturi |
V |
F |
|
La dieta ricca di grassi è idonea per coloro che hanno un tasso di colesterolo elevato |
V |
F |
|
Una dieta priva di grassi è adatta ai bambini |
V |
F |
|
Una dieta priva di grassi è adatta agli anziani |
V |
F |
|
Il buio danneggia i grassi rompendo i legami dando cattivo odore |
V |
F |
|
L’acido linoleico è fabbricato dall’organismo |
V |
F |
|
I lipidi sono in grado di sciogliere le vitamine |
V |
F |
LEZIONE N°11
ESAMI DI LABORATORIO PER LA RICERCA E SAGGI DI RICONOSCIMENTO DEI PRINCIPI ALIMENTARI:
RICONOSCIMENTO DEI CARBOIDRATI NEGLI ALIMENTI
Saggio si riconoscimento dell’amido
Saggio con il Benedict
OBIETTIVO: riscontrare la presenza di carboidrati negli alimenti
PER SAPERNE DI PIÙ
Chi produce i carboidrati?
I carboidrati o glucidi o propriamente detti zuccheri forniscono, a parità di massa, meno energia dei grassi perché prodotti direttamente dalla fotosintesi clorofilliana.
I carboidrati, anche se forniscono minore energia, hanno la capacità di scindersi nell’organismo in glucosio o zucchero semplice con processi rapidi rispetto ai lipidi che, pur fornendo maggiore energia, s'assimilano lentamente. Questa è la motivazione per la quale gli atleti assumono alimenti a base di carboidrati, prima di un’attività ad esempio la corsa, in quanto devono sviluppare uno sforzo notevole in pochi secondi. Il potere energetico di un alimento si misura in calorie (vedi pagina 12).
I carboidrati sono fondamentali nella catena alimentare perché sono prodotti dalle piante a partire dall’anidride carbonica, sono utilizzate dagli animali erbivori come fonte d'energia per produrre lipidi e proteine, poi utilizzate dai carnivori.
La chimica dei carboidrati
Secondo la composizione della molecola i carboidrati si suddividono in:
1 MONOSACCARIDI |
DISACCARIDI |
POLISACCARIDI |
glucosio fruttosio |
saccarosio = glucosio + fruttosio maltosio = a glucosio + b galattosio |
cellulosa |
I MONOSACCARIDI sono i carboidrati più semplici
Uno dei monosaccaridi più importanti è il glucosio o zucchero semplice C6H12O6 ed è il costituente fondamentale del miele.
Altro monosaccaride è il fruttosio C6H12O6 esso presenta la stessa formula del glucosio ma ha una diversa formula di struttura ed è responsabile del sapore dolce della frutta matura e di alcune verdure.
I DISACCARIDI sono carboidrati composti da due monosaccaridi a questi appartengono:
- il saccarosio (lo zucchero che usiamo comunemente) formato da glucosio + fruttosio
- il lattosio (è lo zucchero del latte) formato da a glucosio + b galattosio (due strutture ad anello). Il lattosio è assorbito dall’organismo dopo che è scisso in glucosio e galattosio, utilizzati dalle cellule per sviluppare energia
- il maltosio è formato da 2 molecole di a glucosio, non si trova in natura ma si forma nel processo di fermentazione che porta alla produzione della birra e durante la digestione dei polisaccaridi alimentari (es.amido)
I POLISSACARIDI 1 sono carboidrati costituiti da molecole di glucosio unite in grandi catene.
La cellulosa si trova nelle pareti delle cellule e costituisce la struttura delle piante legnose.
L’amido è la forma nella quale le piante immagazzinano il glucosio formato durante la fotosintesi.
1 Il colesterolo è un grasso presente normalmente nel sangue e si distingue in:
- Colesterolo cattivo (LDL) trasportato dalle lipoproteine, a bassa densità, favorisce la formazione della placca arteriosclerotica.
- Colesterolo buono (HDL) trasportato dalle lipoproteine ad alta densità ed è considerato lo spazzino dei vasi sanguigni perché elimina la placca arteriosclerotica formata dal colesterolo cattivo.
Ogni persona deve conoscere necessariamente il valore del colesterolo (HDL) quello (LDL) e il valore totale.
1 La terminologia dei tre tipi di Carboidrati è la seguente
MONOSACCARIDE ® MONO = uno SACCARIDE = zucchero
DISACCARIDE ® DUE Monosaccaridi
POLISACCARIDE ® MOLTI MONOSACCARIDI formando catene complesse (cellulosa e amido)
1 Gli enzimi responsabili della digestione sono in grado di digerire il glucosio presente nell’amido e non quello
della digestione
Il Glucosio è prodotto dalle piante attraverso la sintesi clorofilliana2. L’energia necessaria per tale processo è fornita dalla luce del sole.
(1) 6 CO2 + 6 H2O + luce del sole e clorofilla ----®C6H12O6 + 6O2
Anidride Acqua Glucosio Ossigeno
carbonica
Per ottenere i prodotti di questa reazione Glucosio e Ossigeno la pianta ha bisogno di:
Anidride carbonica che viene fornita dall’aria e penetra attraverso le aperture superficiali (stomi) che si trovano nella pagina inferiore.
Acqua che viene assorbita dalle radici.
Luce che viene fornita dal sole
Le piante utilizzano il glucosio per fabbricare altri carboidrati (come ad es. l’amido), gli amminoacidi, le proteine, i grassi, le vitamine; cioè tutte le altre sostanze necessarie per l’accrescimento e le attività cellulari.
Il glucosio prodotto dalla fotosintesi viene utilizzato o dalla stessa cellula che l’ha prodotta o da una cellula animale (quando l’animale mangia l’erba). In questo processo il glucosio ha bisogno di energia e subisce una trasformazione dando luogo alla respirazione cellulare.
La reazione che avviene è inversa alla reazione (1)
(2) C6H12O6 + 6O2 -----------® 6 CO2 + 6 H2O + energia vitale1
Glucosio Ossigeno Anidride carbonica Acqua + energia vitale
Il glucosio e il fruttosio si trovano in natura sia con una struttura a catena lineare sia con una struttura ad anello. Quest’ultima struttura rende la molecola più stabile nelle soluzioni acquose dove si presenta in ambe le due forme chiamate anomero a e anomero b.
Il riconoscimento dei monosaccaridi è possibile attraverso il reattivo di Benedict (Cu+2) che riducendosi da Cu+2 a Cu+1 da una caratteristica colorazione blu
I carboidrati che riducono i reattivi come quello di Benedict Cu+2, che useremo nel nostro esperimento, sono noti come zuccheri riducenti.
Tutti i monosaccaridi e gran parte dei disaccaridi sono zuccheri riducenti; fa eccezione il saccarosio (il comune zucchero da tavola) che è riducente solo dopo la sua scissione.
ESERCITAZIONE
MATERIALI
- Becher
- Provette
- Portaprovette
- Contagocce
- Siringhe
- Bacchettina di vetro
- Bicchierini di plastica
SOSTANZE CHIMICHE
- Soluzione alcolica di tintura di iodio
- Reattivo di Benedict
SOLUZIONI ALIMENTARI
- Soluzione di amido (campione n°1)
- Soluzione di saccarosio (campione n°2)
- Soluzione di fructosan (campione n°3)
- Soluzione di ammoniaca (campione n°4)
- Soluzione di nitrato d’argento (campione n°5)
PROCEDIMENTO N° 1 “Saggio si riconoscimento dell’amido”
Avete a disposizione 5 bicchierini con i 5 campioni (elencati nel materiale) e cinque siringhe contrassegnate dai numeri da 1 a 5.
ATTENZIONE !!!!! ESEGUITE LE OPERAZIONI CON LA MASSIMA PRECISIONE
- Versare nelle 5 provette (contrassegnate dai numeri da 1 a 5) 1 mL delle singole miscele contenute nei bicchierini.
- Con il contagocce aggiungere 5 gocce della soluzione di tintura di iodio
- (Attenzione! chiudete la boccetta al termine dell’operazione)
- Agitare le provette energicamente con un movimento rotatorio del polso
- Osservare le colorazioni ottenute annotandole nella tabella sottostante
SOLUZIONI |
COLORAZIONE |
Soluzione di amido + Tintura di iodio |
|
Soluzione di saccarosio + Tintura di iodio |
|
Soluzione di fructosan + Tintura di iodio |
|
Soluzione di ammoniaca + Tintura di iodio |
|
Soluzione di nitrato d’argento + Tintura di iodio |
|
PROCEDIMENTO N° 2 SAGGIO DI BENEDICT
Avete a disposizione 5 bicchierini con i 5 campioni (elencati nel materiale) e cinque siringhe contrassegnate dai numeri da 1 a 5.
ATTENZIONE !!!!! ESEGUITE LE OPERAZIONI CON LA MASSIMA PRECISIONE
- Preparare un becher di acqua bollente (quando l’acqua bolle spegnere la lampada)
- Versare nelle 5 provette (contrassegnate dai numeri da 1 a 5) 2 mL delle singole miscele contenute nei bicchierini.
- Con il contagocce l’insegnante aggiungerà 2 mL di reattivo di Benedict
- (Attenzione! chiudete la boccetta al termine dell’operazione)
- Agitare le provette energicamente con un movimento rotatorio del polso
- Osservare le colorazioni ottenute annotandole nella tabella sottostante
SOLUZIONI |
COLORAZIONE |
Soluzione di amido + reattivo di Benedict |
|
Soluzione di saccarosio + reattivo di Benedict |
|
Soluzione di fructosan + reattivo di Benedict |
|
Soluzione di ammoniaca + reattivo di Benedict |
|
Soluzione di nitrato d’argento + reattivo di Benedict |
|
6. Riscaldare le provette nel bagnomaria per 3 minuti
7. Osservare se vi sono stati cambiamenti di colore registrandoli nella tabella sottostante
SOLUZIONI |
COLORAZIONE |
Soluzione di amido + reattivo di Benedict |
|
Soluzione di saccarosio + reattivo di Benedict |
|
Soluzione di fructosan + reattivo di Benedict |
|
Soluzione di ammoniaca + reattivo di Benedict |
|
Soluzione di nitrato d’argento + reattivo di Benedict |
|
LEZIONE N°12
ESAMI DI LABORATORIO PER LA RICERCA E SAGGI DI RICONOSCIMENTO DEI PRINCIPI ALIMENTARI:
RICERCA DEI CARBOIDRATI NEGLI ALIMENTI
Ricerca dell’amido - Saggio di Benedict
OBIETTIVO: individuare i carboidrati nei campioni alimentari
PER SAPERNE DI PIÙ
Chi produce i carboidrati?
I carboidrati o glucidi o propriamente detti zuccheri forniscono, a parità di massa, meno energia dei grassi perché prodotti direttamente dalla fotosintesi clorofilliana.
I carboidrati, anche se forniscono minore energia, hanno la capacità di scindersi nell’organismo in glucosio o zucchero semplice con processi rapidi rispetto ai lipidi che, pur fornendo maggiore energia, s'assimilano lentamente. Ecco perché gli atleti assumono alimenti a base di carboidrati, prima di un’attività ad esempio la corsa, in quanto devono sviluppare uno sforzo notevole in pochi secondi. Il potere energetico di un alimento si misura in calorie (vedi pagina 12).
I carboidrati sono alla base della catena alimentare perché sono prodotti dalle piante a partire dall’anidride carbonica, sono utilizzate dagli animali erbivori come fonte d'energia per produrre lipidi e proteine, poi utilizzate dai carnivori. Non tutti i glucidi liberano energia, uno di questi è la cellulosa. La cellulosa non può essere digerita dall’apparato digerente, sia dell’uomo e sia di tutti gli animali, perché non produce l’enzima per la sua digestione.
ASPETTI POSITIVI E NEGATIVI DEI CARBOIDRATI
I monosaccaridi ed i disaccaridi si distinguono per le seguenti caratteristiche:
- Hanno un sapore dolce e sono facilmente solubili in acqua
- Danno un potere calorico immediato perché facilmente digeribili
- In una dieta equilibrata costituiscono il 10% delle calorie totali giornaliere
- Un abuso provoca la carie dentaria, il tasso elevato di glucosio nel sangue (glicemia) e la formazione di grassi
I polisaccaridi si distinguono per le seguenti caratteristiche:
- Non hanno un sapore dolce e non sono solubili in acqua
- Danno un potere calorico non immediato, perché hanno tempi più lunghi di digestione
- Non provoca la glicemia per quanto detto al punto 2
- Un abuso provoca la formazione di grassi
- In una dieta equilibrata deve costituire il 50% delle calorie totali giornaliere
Non vi sono solo carboidrati naturali ma anche sintetici cioè i dolcificanti e i più diffusi sono:
Aspartame e Saccarina.
L’ASPARTAME ha un potere dolcificante di circa 200 volte maggiore di quello del saccarosio e un uguale potere calorico. Non può essere utilizzato né per bevande a lunga conservazione e né per cibi cotti perché è instabile in acqua e al calore. Se ingerito in quantità modiche non presenta controindicazioni, in caso contrario sembra che dia origine a sostanze tossiche per l’embrione per questo è sconsigliato per le donne in gravidanza. Il Comitato Mondiale della Sanità ha stabilito una dose giornaliera di 0-40 mg per Kg di peso corporeo mentre il Comitato scientifico per l’alimentazione della CEE ha ridotto tale quantità a 10 mg.
La SACCARINA ha un potere dolcificante di circa 400 volte maggiore di quello del saccarosio e un potere calorico nullo. Non viene metabolizzata dall’organismo ma si accumula in organi irrorati dal sangue (fegato, rene, polmoni) e nella vescica. Il suo gusto amaro e l’odore sgradevole che sviluppa con il calore non è la rendono adatta nella preparazione dei dolci.
Il Comitato Mondiale della Sanità ha stabilito una dose giornaliera di 2,5 mg per Kg di peso
corporeo.
La saccarina è un componente del Fructosan insieme con il fruttosio, zucchero presente nella frutta e nel miele. Il Fructosan ha un potere dolcificante circa una volta e mezza più elevato del saccarosio e può essere impiegato nella preparazione dei dolci cotti; può essere assunto anche dai diabetici.
MATERIALI |
SOSTANZE CHIMICHE |
|
|
CAMPIONI ALIMENTARI (in ogni bicchierino di plastica, numerato, c’è una campione)
- Bollitura di riso (campione n°1)
- Soluzione di Fructosan (campione n°2)
- Soluzione di Aspartame (campione n°3)
- Latte (campione n°4)
- Cracker (campione n°5)
- Cipolla (campione n°6)
- Riso crudo (campione n°7)
- Soia (campione n°8)
PROCEDIMENTO N° 1 “RICERCA DELL’AMIDO”
ATTENZIONE !!!!! ESEGUITE LE OPERAZIONI CON LA MASSIMA PRECISIONE
- Versare nelle provette (numerate da 1 a 4) 5 mL di campioni alimentari da 1 a 4
- Aggiungete 5 gocce di tintura di iodio
- (Attenzione! chiudete la boccetta al termine dell’operazione)
- Osservare le colorazioni ottenute annotandole nella tabella sottostante
|
SOLUZIONI |
COLORAZIONE |
Bollitura di riso + Tintura di iodio |
|
|
Soluzione di Fructosan + Tintura di iodio |
|
|
Soluzione di Aspartame + Tintura di iodio |
|
|
Latte + Tintura di iodio |
|
PROCEDIMENTO N° 2 “RICERCA DI ZUCCHERI RIDUCENTI”
Avete a disposizione i campioni alimentari contrassegnati da 5 a 8 già pesati (2g)
- Pestare nel mortaio ogni campione dopo aver aggiunto 20 mL di acqua distillata e filtrare la miscela nel bicchierino corrispondente.
- ATTENZIONE !!! pulire il mortaio dopo ogni alimento pestato
- Preparare un becher di acqua bollente
- Nelle provette contrassegnate da 1 a 8 versare i corrispondenti campioni numerati da 1 a 8 utilizzando le siringhe, anch’esse contrassegnate con gli stessi numeri.
- L’insegnante aggiungerà, in ciascuna provetta, 2 mL del reattivo di Benedict.
- Agitare le provette energicamente con un movimento rotatorio del polso
- Osservare le colorazioni ottenute annotandole nella tabella sottostante
|
SOLUZIONI |
COLORAZIONE |
Bollitura di riso + reattivo di Benedict |
|
|
Soluzione di Fructosan + reattivo di Benedict |
|
|
Soluzione di Aspartame + reattivo di Benedict |
|
|
Latte + reattivo di Benedict |
|
|
Cracker |
|
|
Cipolla |
|
|
Riso crudo |
|
|
Soia |
|
7. Riscaldare le 8 provette nel bagnomaria per 3 minuti
- Osservare se vi sono stati cambiamenti di colore registrandoli nella tabella sottostante
|
SOLUZIONI |
COLORAZIONE |
Bollitura di riso + reattivo di Benedict |
|
|
Soluzione di Fructosan + reattivo di Benedict |
|
|
Soluzione di Aspartame + reattivo di Benedict |
|
|
Latte + reattivo di Benedict |
|
|
Cracker |
|
|
Cipolla |
|
|
Riso crudo |
|
|
Soia |
|
2 La fotosintesi o sintesi clorofilliana è il punto di partenza per la formazione di tutte le altre sostanze
organiche necessarie alle piante
.
1 l’energia vitale è l’energia che ogni organismo utilizza per tutte le proprie funzioni vitali.
L’energia necessaria per tale reazione è di 673 Kcal
fonte: http://www.profpatriziasannino.it/lezioni/LEZIONI%20CHIMICA.DOC
Chimica e gli alimenti
Visita la nostra pagina principale
Chimica e gli alimenti
Termini d' uso e privacy
