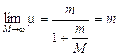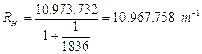Chimica generale 2
Chimica generale 2
Nel 1865 da James Clerk Maxwell (1831-1879) dimostrò che la vibrazione della luce non era di natura meccanica, ma di natura elettromagnetica, sintetizzando in un lavoro teorico le precedenti osservazioni sperimentali di Oersted e di Faraday sul magnetismo e l'elettricità.
Nel 1820 il fisico danese Hans Christian Oersted aveva scoperta che un magnete ed un filo percorso da corrente elettrica si attirano o si respingono reciprocamente (in relazione al verso della corrente o del magnete))
Nel 1831 Michael Faraday trovò che un magnete in movimento esercita una forza su di una carica elettrica ferma costringendola a muoversi (induzione elettromagnetica).
Evidentemente le cariche elettriche in movimento sono in grado di generare forze magnetiche e, viceversa, i magneti in movimento producono forze elettriche.
Maxwell interpretò tali risultati servendosi del calcolo differenziale, e quindi esclusivamente per via teorica, utilizzando il concetto, introdotto da Faraday di campo di forza
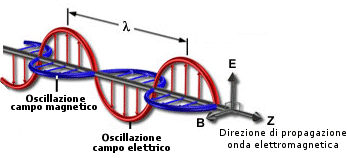
Quando un magnete o una carica elettrica si muovono, ovviamente il campo di forze ad esse associato varia la sua intensità. Maxwell riuscì a dimostrare che un campo elettrico la cui intensità varia con il tempo, produce nello spazio circostante un campo magnetico anch'esso di intensità variabile nel tempo. Il campo magnetico, variando di intensità, induce a sua volta un campo elettrico variabile e così via.
In conclusione la perturbazione iniziale del campo non rimane confinata nel punto iniziale, ma si propaga nello spazio come campi di forze elettriche e magnetiche concatenati la cui intensità varia nel tempo con andamento ondulatorio: un'onda elettromagnetica oscillante nello spazio e nel tempo.
La teoria di Maxwell permette anche di ottenere, sempre per via teorica la velocità di propagazione dell'onda elettromagnetica attraverso la relazione:
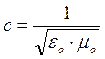
Dove eo è la costante dielettrica del vuoto e mo la permeabilità magnetica del vuoto. Il valore ottenuto da tale relazione è di 300.000 km/s.
La straordinaria coincidenza tra la velocità delle onde elettromagnetiche e quella della luce (calcolata dall'astronomo danese Ole Christensen Romer nel 1675) suggerì a Maxwell l'ipotesi, in seguito verificata da Hertz, che la luce non fosse altro che una radiazione elettromagnetica di particolare lunghezza d'onda.
Il formalismo matematico della teoria di Maxwell implicava inoltre che l'onda elettromagnetica fosse prodotta da campi elettrici e magnetici aventi direzione ortogonale tra loro e contemporaneamente perpendicolare alla direzione di propagazione dell'onda stessa: si dimostrava perciò che la luce era un fenomeno ondulatorio costituito da onde trasversali.
Nel 1888 Heinrich Hertz fornì una straordinaria conferma alla teoria elettromagnetica di Maxwell, producendo per la prima volta delle onde elettromagnetiche di elevata lunghezza d'onda, scoperta che dette l'avvio allo sviluppo della radiofonia.
Egli non poté vedere lo sviluppo della radiofonia, ma le sue scoperte gli permisero di affermare che "Se qualcosa è stabilito con certezza in fisica, questo è la natura ondulatoria della luce"
Ironia del destino volle che l'anno prima Hertz avesse scoperto l'effetto fotoelettrico, un fenomeno inspiegabile tramite la teoria elettromagnetica classica e che pose le premesse per il suo superamento.
La teoria ondulatoria doveva tuttavia conoscere ancora un grande trionfo con la spiegazione nel 1912 della natura elettromagnetica dei raggi X.
Nel 1895 W.K. Roentgen, aveva osservato che, ponendo di fronte al catodo di un tubo di Crookes un ostacolo di natura metallica, detto anticatodo, quest’ultimo si trasformava in una sorgente di radiazioni estremamente penetranti, che non venivano deviate né da un campo elettrico né da un campo magnetico ed erano in grado di impressionare lastre fotografiche. Esse presero il nome di raggi X o raggi Roentgen.
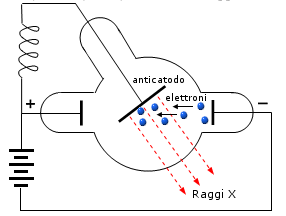
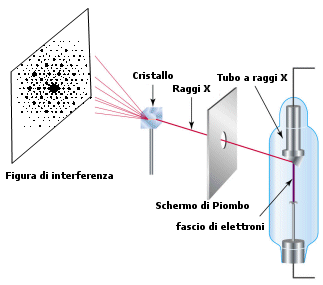
L'impossibilità di deviarli mediante campi elettrici e magnetici ed il fatto che si propagassero nello spazio con la velocità della luce avevano indotto i fisici a pensare che si trattasse di radiazione elettromagnetica. Ma tutti gli sforzi fatti per rifrangerli, diffrangerli e produrre frange di interferenza rimasero senza risultati fino al 1912.
In quell'anno Max von Laue ebbe l'idea di utilizzare come reticolo di diffrazione un cristallo. Gli atomi e le molecole che formavano il reticolo cristallino risultarono essere sufficientemente vicini da formare fenditure dello stesso ordine di grandezza della lunghezza d'onda della radiazione X.
L’esperimento di von Laue ebbe una doppia valenza:
- stabilì la natura ondulatoria dei raggi Roentgen
- costituì una ulteriore conferma della natura particellare della materia e delle dimensioni atomiche.
Inoltre la tecnica messa a punto, oggi nota come difrattometria a raggi X, diventò un potente strumento per indagare la struttura della materia. Dalle figure di interferenza prodotte dai raggi X nell’attraversare la materia si può infatti risalire alle posizioni relative degli atomi al suo interno (cristallografia, strutture molecolari complesse: proteine ed acidi nucleici).
I parametri di un’onda e lo spettro elettromagnetico
Essendo dunque la luce un fenomeno ondulatorio, cioè un fenomeno che si riproduce identico a se stesso un gran numero di volte, se ne possono definire alcuni parametri caratteristici.
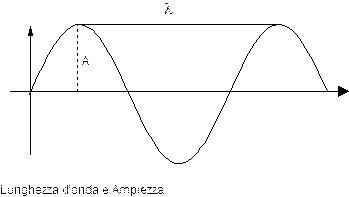
Si definisce lunghezza d'onda (l) la distanza, misurata in cm, che separa due creste successive.
Si definisce periodo (T) il tempo, misurato in s, che intercorre tra due creste successive.
Naturalmente il rapporto tra lo spazio percorso (l) ed il tempo (T) necessario a percorrerlo ci fornisce la velocità (c) della radiazione elettromagnetica.
Poiché c = 300.000 km/s è una costante se ne deduce che l e T sono direttamente proporzionali.
Il numero di creste che passa davanti all'osservatore nell'unità di tempo dipende dalla lunghezza d'onda. Minore è la lunghezza d'onda maggiore è il numero di creste osservate al secondo.
Si definisce frequenza (n) il numero di creste che vengono osservate al secondo. La frequenza si calcola come reciproco del periodo (1/T) e si misura in cicli/s o hertz (1 Hz = 1 vibrazione al secondo).
Si definisce numero d’onde (o numero d’onda) 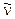 il reciproco della lunghezza d’onda 1/l.
il reciproco della lunghezza d’onda 1/l.
Si definisce infine ampiezza A dell’onda il valore della sua ordinata.
Si tenga presente che un fenomeno ondulatorio è sempre associato ad un trasporto di energia il cui valore è proporzionale al quadrato dell’ampiezza.
Le relazioni fondamentali che legano tali variabili sono:
c = l/ T c = ln
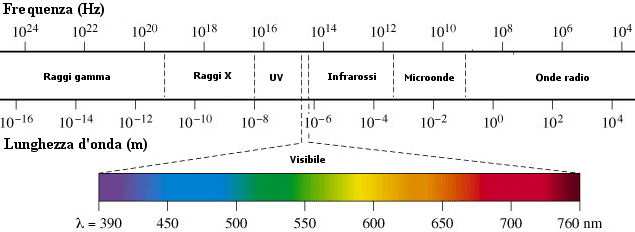
Le onde elettromagnetiche sono state classificate in base alla lunghezza d'onda ( o, il che è lo stesso, in base alla frequenza). La classificazione di tutte le onde elettromagnetiche in funzione della lunghezza d'onda espressa in cm (ma sono frequenti come unità di misura anche il metro, l'Ångström e il micron) è detta spettro elettromagnetico.
Le onde elettromagnetiche che il nostro occhio riesce a vedere rappresentano solo una piccola porzione dell'intero spettro, compresa tra l = 0,76 m (rosso) e l = 0,39 m (violetto).
Noi percepiamo ciascuna lunghezza d'onda all'interno di tale intervallo, detto spettro visibile, come un colore diverso. Quello a maggior lunghezza d'onda è appunto il rosso, poi arancione, giallo, verde, blu e violetto quelli a lunghezze d'onda via via minori.
Le onde elettromagnetiche aventi lunghezza d'onda maggiore sono classificate come infrarosso, microonde, onde radar e onde radio.
Le onde con lunghezza d'onda inferiore sono classificate come ultravioletto, raggi X, raggi gamma.
Le onde elettromagnetiche trasportano energia. L'energia portata da ciascuna radiazione è inversamente proporzionale alla sua lunghezza d'onda. Ciò significa che la luce rossa è ad esempio meno energetica di quella blu.
Spettri di emissione e di assorbimento
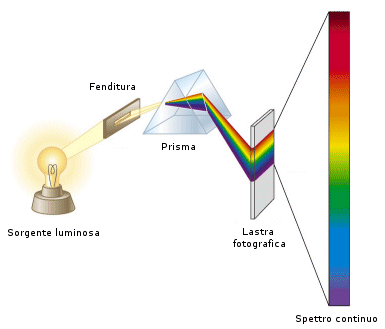
Attraverso una tecnica detta spettroscopia è possibile suddividere una radiazione composta da onde elettromagnetiche di diversa lunghezza d'onda (ad esempio la luce bianca proveniente dal sole), nelle sue componenti, dette radiazioni monocromatiche. Il risultato di tale scomposizione è una serie di righe, ciascuna corrispondente ad una singola lunghezza d'onda, le quali costituiscono uno spettro.
Si distinguono due tipi di spettri: 1) di emissione 2) di assorbimento.
Spettri di emissione
Si formano ogniqualvolta la materia emette radiazione elettromagnetica. Si distinguono in spettri di emissione continui e spettri di emissione a righe.
Spettro di emissione continuo
Se si esamina allo spettroscopio la radiazione proveniente da un corpo liquido o solido a qualsiasi temperatura, essa forma uno spettro continuo, in cui sono presenti tutte le radiazioni monocromatiche in una serie continua. L'intensità delle righe luminose cresce da sinistra a destra e, raggiunto un massimo in corrispondenza di una certa lunghezza d'onda, decresce.
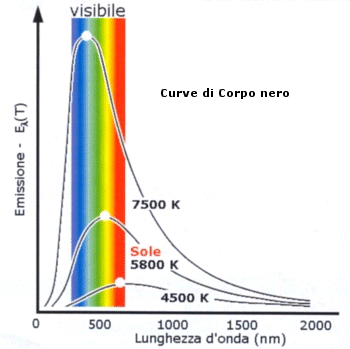
Costruendo un diagramma che abbia in ascissa le lunghezze d'onda crescenti ed in ordinata l'intensità luminosa si ottiene una curva tipica, detta curva di corpo nero , che non dipende dalla natura chimica del materiale emittente, ma è funzione solo della temperatura di emissione.
La lunghezza d'onda in corrispondenza della quale si ha la massima intensità luminosa dipende solo dalla temperatura del corpo emittente. Diminuendo la temperatura la curva, e quindi il massimo della curva, slittano verso destra, cioè verso le lunghezze d'onda maggiori e viceversa.
La posizione del massimo è ricavabile in base alla legge dello spostamento di Wien (1894).
max T = K
dove K vale 0,290 cm K
Temperatura e lunghezza d'onda di massima emissione risultano dunque inversamente proporzionali. È per questo motivo che un corpo portato ad alta temperatura (ad esempio una sbarra di ferro) ci appare prima rosso, poi giallo, poi bianco azzurro.
Il sole ad esempio ci appare giallo perché il giallo è la lunghezza d'onda di massima emissione di un corpo avente una temperatura superficiale di circa 6.000 K.
Per temperature molto basse il massimo di emissione non cade più nella banda del visibile, ma si sposta nella zona dell'infrarosso fino a raggiungere, per temperature bassissime, le microonde o addirittura le onde radio.
Naturalmente un corpo a maggior temperatura deve emettere complessivamente anche una maggior quantità di energia per unità di tempo. Quindi diminuendo la temperatura del corpo emittente la curva non solo si sposta verso destra, ma si abbassa. L'area compresa al di sotto della curva (integrale della funzione) rappresenta infatti l'energia totale emessa nell'unità di tempo e per unità di superficie radiante.
La relazione che descrive la variazione di energia emessa in funzione della temperatura assoluta del corpo emittente è detta legge di Stefan-Boltzmann (1879).
E = sT4
Dove s (sigma) è la costante di Stefan_Boltzmann. Sia la legge di Stefan-Boltzmann che quella di Wien non descrivono però completamente il comportamento di un corpo nero. Per tutta la seconda metà dell'ottocento l'obiettivo di grandi fisici quali Kirchoff, Bartoli, Stefan, Boltzmann, Wien, Rayleigh, era di trovare l'espressione matematica generale della funzione
E = f (l,T)
che fosse in accordo con i dati sperimentali.
Purtroppo applicando le equazioni di Maxwell e le leggi della fisica classica si ottenevano sempre relazioni matematiche in netto contrasto con i dati sperimentali .
Quello del corpo nero rimase un problema irrisolto per tutto l'Ottocento ed uno scoglio insuperato per il modello ondulatorio della luce proposto da Maxwell.
Il cubo di Jeans e la catastrofe ultravioletta
Un famoso esperimento ideale, suggerito da Jeans, contribuì a mettere definitivamente la parola fine alla ricerca di una interpretazione classica del problema del corpo nero.
Alla fine dell'800 la fisica classica aveva raggiunto una struttura che allora appariva praticamente definitiva. Essa si reggeva in pratica su tre pilastri: la meccanica newtoniana sistematizzata da Lagrange, l'elettromagnetismo di Maxwell e la termodinamica classica (Carnot, Clausius).
Sia la termodinamica che l'elettromagnetismo aspiravano a ridursi alla meccanica classica, il cui rigoroso determinismo appariva il fondamento stesso della conoscenza scientifica.
Fu proprio dal tentativo di ridurre le leggi della termodinamica classica a quelle della meccanica che, nella seconda metà dell'Ottocento, nacque la meccanica statistica, ad opera dello stesso Maxwell, di Boltzmann e Gibbs.
Ciò che a noi interessa qui è il cosiddetto principio di equipartizione dell'energia. Applicando tale principio alla curva di corpo nero, si giunge al risultato paradossale che l'energia di un corpo emittente si dovrebbe distribuire in modo uniforme tra tutte le lunghezze d'onda di emissione. Ciò produce un risultato assolutamente non conforme ai dati sperimentali e nel suo esperimento ideale Jeans dimostrò proprio l'inapplicabilità del principio di equipartizione dell'energia alla risoluzione del problema del corpo nero.
Egli immaginò un cubo le cui pareti interne fossero rivestite di specchi ideali, in grado cioè di riflettere il 100% della radiazione incidente, contenente piccolissime particelle di carbone in grado di assorbire e riemettere tutta la radiazione presente nel cubo (in pratica minuscoli "corpi neri", aventi il compito di favorire gli scambi energetici tra vibrazioni di diversa lunghezza d'onda).
Se immaginiamo ora di introdurre una radiazione luminosa e di richiudere immediatamente la scatola, dovremmo attenderci che, per il principio di equipartizione, l'energia si distribuisca in parti uguali fra tutti i sistemi componenti (si suddivida in parti uguali tra tutte le lunghezze d'onda possibili).
Ora, se il cubo ha spigolo pari a L, le lunghezze d'onda compatibili con esso (senza che avvenga interferenza distruttiva) sono 2L, 2L/2, 2L/3, 2L/4, 2L/5 etc .
Ciò significa che mentre esiste un limite superiore alle possibili lunghezze d'onda, non ne esiste uno inferiore. Perciò se noi immettiamo nel cubo una radiazione rossa dobbiamo attenderci che questa cominci a trasformarsi, attraverso una fitta serie di assorbimenti e riemissioni ad opera del pulviscolo carbonioso, in luce verde, blu, ultravioletta, radiazione x e gamma. Tale fenomeno dovrebbe avvenire in certa misura anche nei normali forni di cucina e nelle fornaci, aprendo i quali dovremmo essere investiti da una letale radiazione a breve lunghezza d'onda.
Per molti anni dopo la pubblicazione di questo articolo di Jeans nessun fisico fu in grado di spiegare questo paradossale risultato.
Spettro di emissione a righe
Un gas o un vapore riscaldato emette una radiazione discontinua, formata solo da poche componenti monocromatiche. Tale radiazione scomposta dallo spettrografo produce uno spettro sul quale righe luminose sono separate da ampie bande oscure. Gli spettri a righe dipendono esclusivamente dalla natura chimica del materiale emittente. Ciascun elemento, ciascun composto chimico emette uno spettro a righe caratteristico, con righe di particolare lunghezza d'onda ed intensità, tanto che oggi la spettroscopia viene utilizzata per effettuare analisi chimiche.
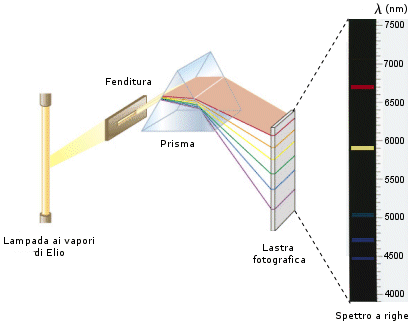
Anche il significato da attribuire alle righe spettrali rappresentò per tutta la seconda metà dell'ottocento un problema che la teoria elettromagnetica non fu in grado di risolvere.
Nel 1855 J. Balmer, studiando le righe emesse dall'idrogeno, scoprì una relazione matematica che permetteva di ottenere il numero d’onde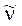 (reciproco della lunghezza d'onda) delle singole righe spettrali.
(reciproco della lunghezza d'onda) delle singole righe spettrali.
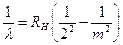
con m = 3,4,5,6.... ed RH costante di Rydberg per l'idrogeno. Se la lunghezza d'onda è misurata in cm la costante di Rydberg per l’idrogeno vale
RH = 10.973.731,568 527 m-1

La relazione di Balmer può essere generalizzata sostituendo al numero 2 un intero n minore di m.
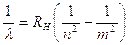
In tal modo, è possibile prevedere per l'idrogeno l'esistenza, oltre alle 4 righe nel visibile ( una nel rosso, una nell'azzurro e due nel blu-violetto), anche altre serie, una nell'ultravioletto (serie di Lyman per n = 1) e 3 nell'infrarosso (serie di Paschen per n = 3; serie di Brackett per n = 4; serie di Pfund per n = 5), in seguito scoperte.
Naturalmente la relazione di Balmer non era in grado di spiegare perché si producessero le righe spettrali, ma solo di calcolarne la lunghezza d'onda.
Spettri di assorbimento
Quando la radiazione continua proveniente da un corpo solido o liquido passa attraverso un gas od un vapore, si constata che allo spettro continuo mancano certe radiazioni monocromatiche, le quali sono state assorbite dal gas interposto.
In pratica si riscontra che i gas ed i vapori assorbono le stesse radiazioni monocromatiche che emettono (legge di Kirchhoff 1859), per cui lo spettro di assorbimento risulta l'esatto negativo dello spettro di emissione a righe. Le righe nere degli spettri di assorbimento sono dette righe di Fraunhofer, il quale le osservò per la prima volta (1815) nello spettro solare.
I quanti di radiazione: fotoni
In definitiva, nonostante gli eccezionali risultati ottenuti, la teoria ondulatoria della luce, non era in grado di dar ragione di tre problemi: lo spettro di emissione del corpo nero, gli spettri a righe, l'effetto fotoelettrico.
La svolta si ebbe nel Natale del 1900, quando Max Planck ebbe un'intuizione che, come ebbe a dire egli stesso, fu più un atto di disperazione che una vera e propria scoperta scientifica.
Nel tentativo di trovare una equazione che descrivesse correttamente la curva di corpo nero, Planck propose che le onde elettromagnetiche non potessero essere emesse da un radiatore ad un ritmo arbitrario e continuo, ma solo sotto forma di pacchetti d'onde che egli chiamò quanti.
Ogni quanto possedeva una certa quantità di energia che dipendeva dalla lunghezza d'onda della luce, secondo la relazione:
E = h n
dove n è la frequenza della radiazione e h è una nuova costante, detta costante di Planck .
Dalla relazione appare evidente come un quanto di luce rossa possa contenere meno energia di un quanto di luce blu. In tal modo un corpo emittente ad una certa temperatura potrebbe avere energia sufficiente per emettere quanti di luce infrarossa o gialla, ma potrebbe non avere sufficiente energia per emettere neppure un quanto di radiazione X o gamma. In tal modo ad alte frequenze il numero di quanti emessi si ridurrebbe drasticamente (e ciò spiegherebbe ad esempio il paradosso di Jeans).
La cosa incredibile fu che la curva di corpo nero così calcolata era in perfetto accordo con i dati sperimentali .
L'introduzione della costante di Planck che inizialmente poteva sembrare più che altro un espediente per salvare i fenomeni, risultò invece portare con sé una serie di novità sconcertanti e rivoluzionarie all'interno della fisica. Con essa nasce quella parte della fisica moderna che va sotto il nome di meccanica quantistica e di cui avremo modo di parlare in seguito.
Planck non portò alle estreme conseguenze il concetto di quanto di radiazione. Si limitò semplicemente a verificare che nel caso particolare in cui la materia emetteva radiazione non lo faceva come un flusso continuo, secondo le leggi dell'elettromagnetismo classico, ma, per qualche misterioso motivo, attraverso scariche di particelle di energia dette quanti. L'ipotesi quantistica di Planck ruppe definitivamente con l'idea del continuo per l'energia.
La luce non poteva dunque più essere considerata semplicemente un fenomeno ondulatorio, visto che, almeno in questo caso particolare, i fisici erano costretti a descriverne il comportamento attraverso un modello corpuscolare. D'altra parte il modello corpuscolare quantistico era inapplicabile per spiegare fenomeni tipicamente ondulatori come la diffrazione e l'interferenza.
Nasce l'idea di un comportamento duale della luce, la quale richiede due modelli, apparentemente in reciproca contraddizione, per essere descritta. Si utilizza il modello ondulatorio per descrivere i fenomeni di propagazione della radiazione elettromagnetica. Si utilizza il modello corpuscolare per descrivere i fenomeni di interazione con la materia (emissione ed assorbimento).
Pochi anni più tardi, nel 1905 Einstein confermò la descrizione quantistica della radiazione, utilizzando l'ipotesi di Planck per spiegare l'effetto fotoelettrico, fenomeno inspiegabile sulla base della teoria ondulatoria.
Un campo di forza è un una distribuzione di forze nello spazio. Ad esempio un campo elettrico è dato dalla distribuzione dei vettori forza intorno ad una carica Q che agiscono su di una ipotetica carica di prova di 1 C
In fisica è detto corpo nero un radiatore integrale, cioè un corpo che riemetta completamente tutta l'energia assorbita. Un corpo nero è naturalmente un'astrazione, ma è possibile approssimarsi ad esso con una scatola di metallo le cui pareti interne sono rivestite di fuliggine, provvista di un foro
EFFETTO FOTOELETTRICO
L'effetto fotoelettrico, scoperto da Hertz, consiste nell'emissione da parte di un metallo di elettroni quando venga colpito da radiazione elettromagnetica di una certa lunghezza d'onda, tipica per ogni metallo. Partendo dal presupposto che l'onda incidente ceda parte della sua energia agli elettroni del metallo, aumentandone in tal modo l'energia cinetica fino ad estrarli e applicando dunque la teoria elettromagnetica classica a questo fenomeno ci si attende che gli elettroni vengano strappati da qualsiasi radiazione purché sufficientemente intensa. In altre parole il modello elettromagnetico prevede che usando luce di qualsiasi colore e cominciando ad aumentarne l'intensità si arriverà ad un punto in cui gli elettroni avranno energia sufficiente per uscire dal metallo. Aumentando ulteriormente l'intensità luminosa gli elettroni dovrebbero uscire con maggiore energia cinetica. L'effetto fotoelettrico avveniva invece con caratteristiche completamente diverse.
- Gli elettroni cominciano ad uscire solo quando il metallo viene investito da una radiazione avente una ben precisa lunghezza d'onda (frequenza di soglia). Utilizzando luce di maggior lunghezza d'onda, anche se molto intensa, non si ottiene alcun effetto.
- Utilizzando luce di giusta lunghezza d'onda ed aumentandone l'intensità non si ottiene la fuoriuscita di elettroni più energetici, ma di un maggior numero di elettroni aventi sempre la stessa energia cinetica
- Utilizzando luce di lunghezza d'onda inferiore a quella di soglia si ottiene la fuoriuscita di elettroni più energetici.
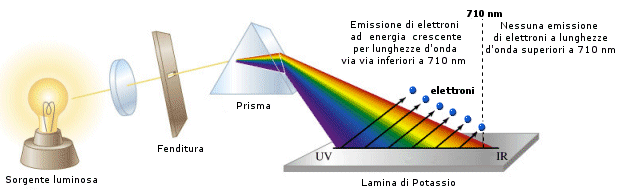
Tale comportamento risultava refrattario ad ogni tentativo di spiegazione che utilizzasse il modello classico. Einstein suggerì dunque di trattare la radiazione che colpiva gli elettroni come particelle di energia E = hn, che egli chiamò fotoni. Detto W il lavoro necessario per estrarre un elettrone dall'atomo, solo i pacchetti di energia per i quali vale hn = w saranno in grado di estrarre gli elettroni.
Aumentando l'intensità luminosa di una radiazione a bassa frequenza, costituita da fotoni non sufficientemente energetici, non si fa che aumentare il numero di fotoni incidenti. Ma ciascuno di essi è sempre troppo debole per estrarre gli elettroni.
Effetto fotoelettrico
1) Gli elettroni vengono emessi dal catodo fotoemittente e registrati dall’amperometro solo se la luce utilizzata supera una certa frequenza di soglia ns tale per cui l’energia di ciascun fotone E = hns sia almeno pari (o maggiore) del lavoro di estrazione w. |
|
2) Utilizzando luce di frequenza di soglia ns ed aumentandone progressivamente l’intensità il metallo fotoemittente (catodo) verrà colpito da un maggior numero di fotoni aventi sempre la medesima energia. Il catodo emetterà pertanto un maggior numero di elettroni che l’amperometro registrerà come un aumento di intensità di corrente elettrica. |
|
3) Utilizzando radiazione di frequenza maggiore di quella di soglia ns, il metallo viene colpito da fotoni di energia più elevata E > hns e ciascun elettrone verrà pertanto estratto con maggior energia cinetica pari a |
|
4) L’energia dell’elettrone estratto può essere determinata facendo variare la tensione V che deve essere applicata per bloccarne il movimento e mandare a zero l’amperometro in modo che con l’energia E degli elettroni in funzione della frequenza n della radiazione usata per illuminarli. La retta ha pendenza h. Variando il tipo di metallo varia il valore del termine noto hns (che rappresenta il lavoro di estrazione w, caratteristico per ogni metallo) e quindi l’intersezione con gli assi, mentre la pendenza rimane costante. |
|
Il lavoro di Einstein mise in evidenza il fatto che la radiazione mostrava un comportamento corpuscolare non solo nei fenomeni di emissione, ma anche in quelli di assorbimento.
Il lavoro sull'effetto fotoelettrico è uno dei tre articoli, fondamentali per la fisica del '900, che Einstein pubblicò nel 1905 nel 17° volume degli Annalen der Physik.
Gli altri due trattavano della relatività speciale e del moto browniano. Quest'ultimo fu un problema che allora non ricevette l'attenzione dovuta, visto l'enorme impressione prodotta dalla teoria della relatività. Ma in esso vi era in pratica la prova dell'esistenza degli atomi.
Nonostante fosse stato fino ad allora raccolto un numero notevolissimo di dati che confortavano l'ipotesi atomica (il numero di Avogadro era stato ad esempio calcolato in una ventina di modi diversi, dando sempre lo stesso risultato), questa sembrava sfuggire a qualsiasi verifica diretta.
Verso la seconda metà dell'Ottocento la maggior parte dei fisici sotto l'influenza della filosofia positivista pensava che la fisica potesse e dovesse evitare qualunque ipotesi sulla struttura della materia.
Fisici positivisti come Pierre Duhem, Wilhelm Ostwald ed Ernst Mach, ritenevano che la scienza dovesse limitarsi ad interpretare solo i fenomeni constatabili direttamente attraverso i sensi, senza costruire modelli che non potessero avere un supporto empirico ed intuitivo.
Tuttavia l'atomismo aveva acquistato nella seconda metà dell'Ottocento consistenza scientifica grazie al lavoro di chimici e cristallografi. Abbiamo già detto di come l'ipotesi atomica si era rivelata utile per descrivere le reazioni chimiche conformemente alle quantità di materia messe in gioco. I cristallografi R.J.Hauy e, poi, R.Bravais interpretarono le proprietà dei cristalli attraverso l'idea di un giustapposizione ordinata e regolare di elementi puntiformi a formare reticoli geometrici.
La stessa meccanica statistica fondò tutti i suoi brillanti risultati sul presupposto che i gas fossero formati da un numero enorme di particelle in moto disordinato.
Per dimostrare l'esistenza degli atomi Einstein si ricollegò ad una osservazione fatta dal botanico inglese Robert Brown, il quale aveva verificato che i granelli di polline presenti in sospensione nell'aria o nell'acqua, osservati al microscopio, presentano uno strano moto disordinato, con rapidi cambi di direzione (moto browniano). Einstein dimostrò, utilizzando la meccanica statistica, che il moto browniano poteva facilmente essere spiegato ipotizzando che i granelli di polline fossero bombardati dalle molecole del mezzo in costante agitazione termica.
La prova decisiva sulla natura corpuscolare della luce si ebbe nel 1923 quando venne scoperto l'effetto Compton, in cui i fotoni si comportano a tutti gli effetti come particelle, scambiando quantità di moto nell'urto con gli elettroni. La quantità di moto di una particella è p = mv, mentre la quantità di moto di un fotone pg, che non possiede massa, si calcola eguagliando la relazione di Einstein E = mc2 con la relazione quantistica dell’energia E = hn ed, esplicitando mc, si ottiene
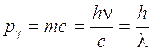
Effetto Compton
Compton aveva intuito che gli elettroni più esterni di un atomo erano debolmente legati e, se colpiti da proiettili sufficientemente energetici, potevano essere considerati pressoché liberi.
Egli utilizzò come proiettili fotoni appartenenti a radiazione X, quindi molto energetici. Quando la radiazione X passa attraverso la materia essa viene diffusa in tutte le direzioni ed emerge con frequenza tanto minore quanto maggiore è l'angolo di diffusione.
Si può facilmente interpretare il fenomeno in termini di teoria dei quanti.
Quando il fotone X di energia E = hn urta un elettrone gli cede una parte della sua energia e quindi della sua quantità di moto, emergendo con un energia e quindi con una frequenza minore È = hn'.
L'urto tra il fotone e l'elettrone può essere trattato come un normale urto elastico tra due sfere rigide.
L'elettrone, supposto fermo, viene deviato e si può facilmente verificare che la quantità di moto acquistata dall'elettrone (poiché l'elettrone può acquistare velocità molto elevate è necessario usare l'espressione relativistica della quantità di moto) è pari a quella persa dal fotone.
Nel caso avvenga una collisione frontale la sfera ferma (elettrone) verrà scagliata ad alta velocità nella direzione dell'urto, mentre la sfera incidente (fotone X) perderà una notevole frazione della sua quantità di moto.
Nel caso di un urto obliquo la sfera incidente (fotone X) perderà minore quantità di moto a favore della sfera ferma e subirà una piccola deviazione rispetto alla direzione dell'urto.
Nel caso di un urto di striscio la perdita di energia del fotone sarà minima e minima la deviazione rispetto alla sua traiettoria.
Si tenga presente che mentre per l'elettrone, che possiede massa, la quantità di moto vale p = mv, per il fotone che possiede solo energia è necessario utilizzare la relazione di Einstein E = mc2 per calcolare la quantità di moto. Eguagliando tale relazione con la relazione quantistica E = hn si ottiene la quantità di moto del fotone
p = mc = hn/c
Naturalmente la quantità di moto del fotone deviato sarà minore di quella iniziale, e tale diminuzione può essere direttamente verificata in termini di diminuzione della frequenza, visto che h e c sono due costanti.
p' = hn'/c
Effetto compton Quando i fotoni X ad alta energia investono la materia vengon diffusi in tutte le direzioni. La perdita di energia di ciascun fotone diffuso è tanto maggiore, quanto maggiore è l’angolo q di diffusione. Applicando i principi di conservazione dell’energia e della quantità di moto e trattando l’urto tra fotone incidente ed elettrone come perfettamente elastico, è possibile giungere alla seguente relazione tra la lunghezza d’onda del fotone diffuso l’ e la lunghezza d’onda del fotone incidente l
|
Modelli atomici quantistici semiclassici
Come abbiamo già avuto modo di dire il modello planetario di Rutherford risultava in contraddizione con i principi dell'elettrodinamica classica e doveva pertanto essere corretto. Rimaneva inoltre ancora irrisolto il problema degli spettri a righe, la cui soluzione appariva con molta probabilità legata proprio alla struttura atomica.
Visto il successo ottenuto nella risoluzione del problema del corpo nero e dell'effetto fotoelettrico, attraverso l'introduzione nel formalismo matematico della costante di Planck, Bohr decise di tentare la stessa strada anche per risolvere il problema degli spettri a righe.
Il modello atomico di Bohr
Preso in considerazione l'atomo di Idrogeno, Bohr introdusse alcune ipotesi in modo da far intervenire all'interno della struttura atomica la costante h.
1a ipotesi |
Esiste uno stato stazionario dell'atomo caratterizzato da particolari orbite circolari lungo le quali gli elettroni si muovono senza emettere radiazioni elettromagnetiche. Gli elettroni che percorrono tali orbite stazionarie possiedono una certa quantità ben definita di energia detta livello energetico dell'orbita.
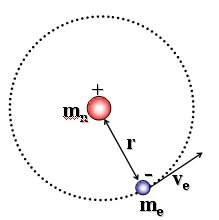
Essendo gli elettroni in equilibrio in tali orbite la forza centrifuga (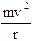 Per l’Idrogeno Z = 1 e la relazione diventa
Per l’Idrogeno Z = 1 e la relazione diventa
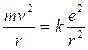
da cui si ricava il raggio
1) 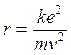
2a ipotesi |
A questo punto Bohr impose, del tutto arbitrariamente una condizione di quantizzazione. Tra le infinite orbite che soddisfano la 1) sono permesse solo quelle che soddisfano la seguente relazione
2) 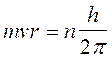
dove mvr è il momento della quantità di moto dell'elettrone in orbita attorno al suo nucleo, detto anche momento angolare orbitale. h/2p prende il nome di costante di Planck normalizzata e viene spesso indicata con 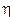 (acca tagliato) ed n è un numero intero positivo, detto numero quantico principale. In pratica Bohr impone una condizione di quantizzazione del momento angolare, che si rivelerà in seguito fondamentale e caratteristica di qualsiasi corpo rotante.
(acca tagliato) ed n è un numero intero positivo, detto numero quantico principale. In pratica Bohr impone una condizione di quantizzazione del momento angolare, che si rivelerà in seguito fondamentale e caratteristica di qualsiasi corpo rotante.
Tale condizione si esprime dicendo che il momento angolare dell'elettrone deve essere un multiplo intero di acca tagliato.
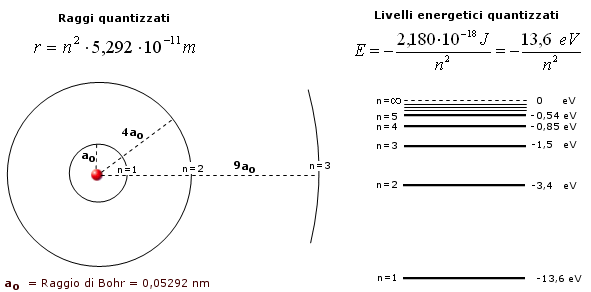
Il momento angolare quantizzato condiziona i valori che possono assumere il raggio delle orbite e l’energia totale (cinetica + potenziale) o livello energetico, che l’elettrone possiede.
Raggi e livelli energetici risultano pertanto anch’essi quantizzati in funzione di n.
Raggio quantizzato: Dalla condizione di quantizzazione del momento angolare si ricava la velocità che sostituita nella 1) fornisce la relazione quantistica del raggio
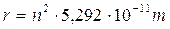
per n = 1
r = 5,292 10-11 m (= 52,92 pm = 0,5292 Å) è il raggio della orbita circolare più vicina al nucleo dell’Idrogeno ed è detto raggio di Bohr (ao) .
In fisica atomica il raggio di Bohr ao viene utilizzato come unità di misura di lunghezza e denominato bohr.
1 bohr = 5,291772 10-11 m
Energia quantizzata (livello energetico): L’energia associata ad un elettrone in moto su di un’orbita quantizzata si calcola come somma dell’energia cinetica (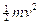 e la sostituiamo nell’espressione dell’energia cinetica, l’energia totale vale
e la sostituiamo nell’espressione dell’energia cinetica, l’energia totale vale
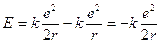
Sostituendo r con il valore quantizzato del raggio si ottiene
Il valore negativo dell'energia deriva dalla convenzione di porre pari a zero l'energia potenziale dell'elettrone a distanza infinita.
Per n = 1 l’elettrone si trova nello stato di minima energia possibile, detto stato fondamentale. Gli stati caratterizzati da n > 1 si dicono stati eccitati.
In fisica atomica l’energia potenziale coulombiana dell’elettrone nella prima orbita di Bohr viene utilizzata come unità di misura di energia e denominata hartree (in onore del fisico inglese Douglas Rayner Hartree).
.
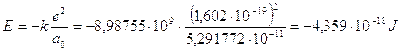
1 hartree = 4,359 10-18 J
Un hartree corrisponde al doppio dell'energia di legame dell'elettrone nello stato fondamentale (n = 1) dell'atomo di idrogeno
3^ Ipotesi |
L'atomo può passare dallo stato fondamentale ad uno eccitato assorbendo energia. In questo modo gli elettroni possono assumere l'energia necessaria per passare da un'orbita più interna ad una più esterna. L'energia assorbita affinché avvenga il salto quantico dell'elettrone, o transizione elettronica, deve essere esattamente uguale alla differenza di energia esistente tra il livello energetico superiore e quello inferiore.

Quando l'elettrone si trova in un orbita superiore a quella in cui si trova normalmente, l'atomo possiede un surplus di energia che lo rende instabile (eccitato). L'elettrone è quindi destinato a tornare nell'orbita di partenza riemettendo l'energia precedentemente assorbita tramite un fotone la cui energia è appunto pari a
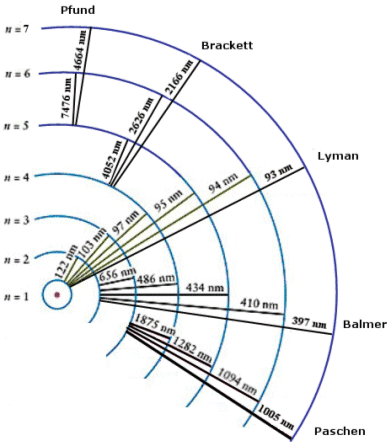
E2 – E1 = DE = hn
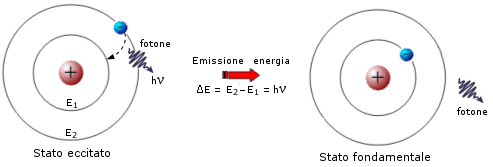
La radiazione emessa, avendo una frequenza univocamente determinata dalla differenza di energia esistente tra due particolari livelli energetici, è rigorosamente monocromatica ed apparirà come una ben determinata riga allo spettroscopio.
L’energia emessa durante una transizione da un livello n2 ad un livello n1, con n2 > n1, è
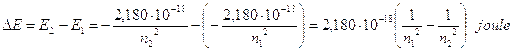
Ricordando che DE = hn e che c = ln, sostituendo opportunamente si ottiene 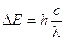 ed in definitiva
ed in definitiva
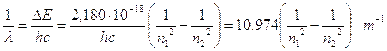
Per calcolare il numero d’onde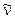
I numeri interi n ed m che nella relazione di Balmer non presentavano alcun significato fisico, nel modello atomico di Bohr diventano rispettivamente il numero quantico del livello più interno n1 ed il numero quantico del livello più esterno n2, tra i quali avviene la transizione.
- Ponendo nella n1 = 2 ed n2 intero superiore a due si possono trovare tutte le lunghezze d'onda delle righe spettrali prodotte dalle transizioni elettroniche dalle orbite più esterne verso la seconda orbita. Tale righe spettrali corrispondono ovviamente alla serie di Balmer.
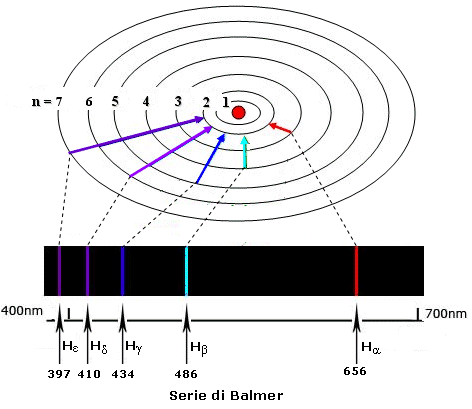
- Ponendo invece n1 = 1 si ottengono le righe spettrali della serie di Lyman, le quali rappresentano dunque le transizioni elettroniche dalle orbite più esterne verso la prima e così via per le altre serie
- Ponendo infine n2 = ¥ si ottiene la lunghezza d’onda che deve possedere la luce con cui irraggiare l'atomo per estrarre l'elettrone e portarlo all'infinito. In altri termini è possibile calcolare teoricamente l'energia di ionizzazione dell'atomo.
Il numero quantico principale n può assumere teoricamente tutti i valori compresi tra 1 ed infinito. In pratica però tutti gli atomi conosciuti sistemano i loro elettroni al massimo in 7 livelli energetici, i quali vengono spesso indicati con le lettere K, L, M, N, O, P, Q.
Righe spettrali (λ in nm) |
||||||||||
|
|
n esterno |
||||||||
Serie |
n interno |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
∞ |
Lyman |
1 |
121,6 |
102,5 |
97,2 |
94,9 |
93,7 |
93,0 |
92,6 |
92,3 |
91,15 |
Balmer |
2 |
|
656.3 |
486.1 |
434.1 |
410.2 |
397.0 |
388.9 |
383.5 |
364.6 |
Paschen |
3 |
|
|
1874.5 |
1281.4 |
1093.5 |
1004.6 |
954.3 |
922.6 |
820.1 |
Brackett |
4 |
|
|
|
4052.5 |
2625.9 |
2166.1 |
1945.1 |
1818.1 |
1458.0 |
Pfund |
5 |
|
|
|
|
7476 |
4664 |
3749 |
3304 |
2279 |
Un altro aspetto notevole del modello di Bohr è che la costante di Rydberg viene ad essere calcolata in funzione di costanti note (come la carica dell’elettrone, la sua massa, la velocità della luce, etc) ed il suo valore risulta in ottimo accordo con il valore misurato sperimentalmente
Costante di Rydberg |
Calcoliamo a titolo d’esempio il dislivello energetico esistente tra n = 2 ed n = 3, la frequenza e la lunghezza d'onda della riga spettrale (Ha) della transizione elettronica relativa.
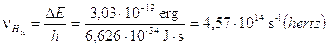
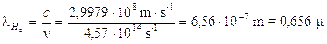
Il modello di Bohr è in grado di giustificare in modo soddisfacente solo il comportamento spettrale dell’Idrogeno e degli atomi idrogenoidi (ioni di altri elementi leggeri con un solo elettrone, come He+ e Li2+), mentre risulta inadeguato per atomi plurielettronici. D'altra parte quando Bohr impose la sua condizione di quantizzazione non poté darne alcuna giustificazione teorica, se non quella che in tal modo era possibile calcolare il valore numerico della costante di Rydberg e le righe spettrali dell’Idrogeno. Solo una decina di anni più tardi Louis De Broglie, avrebbe dimostrato che la condizione imposta da Bohr era una conseguenza della natura ondulatoria dell'elettrone.
Conferme sperimentali del modello di Bohr
Tra il 1913 ed il 1914 venne un'ulteriore conferma del modello atomico di Bohr, grazie agli esperimenti condotti da Moseley sugli spettri di emissione a righe nella regione della radiazione X di vari elementi chimici.
Quando un elettrone del primo livello energetico (livello K) viene espulso, in seguito ad una collisione con un elettrone proiettile o in seguito ad irradiazione con fotoni altamente energetici (gli elettroni del primo livello sono fortemente legati), il suo posto può essere occupato da un elettrone presente nei livelli superiori. Se l'elettrone proviene dal livello L (n = 2) la riga spettrale che si forma è detta K, se proviene dal livello M (n = 3) è detta K, e così via.
Se l'elettrone inizialmente espulso interessa il livello L, le righe che si formano per transizione elettronica dagli strati superiori M, N... sono dette L, L...
La serie K è sostanzialmente analoga alla serie di Lyman per l'idrogeno, ma si manifesta nella regione X.
Le diverse righe della serie K presentano naturalmente un valore diverso nei vari elementi chimici, a causa delle differenze di energia esistenti tra livelli energetici dello stesso tipo in atomi aventi una diversa carica nucleare Z.
Moseley dimostrò che la riga più intensa di questi spettri (riga K) si spostava regolarmente quando si passava da un elemento al successivo nella tavola periodica e che la lunghezza d'onda di tale riga si poteva esprimere in funzione del numero atomico Z, attraverso una relazione sostanzialmente analoga alla relazione di Balmer
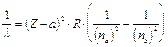
dove a è la costante di schermo, introdotta per tener conto del fatto che la carica del nucleo "vista" da ciascun elettrone è, a causa della presenza degli altri elettroni, inferiore a Ze.
Per la riga K la relazione diventa
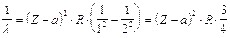
La relazione dimostra che la radice quadrata della lunghezza d'onda è inversamente proporzionale al numero atomico Z.
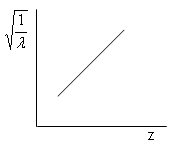
Spostamento delle righe K
in funzione del numero atomico Z
Ciò, oltre a confermare il modello di Bohr, permise, da una parte di dare al numero atomico Z il suo significato preciso di numero di cariche elettriche concentrate nel nucleo (e quindi anche di numero di elettroni orbitanti esternamente per rendere l'atomo neutro), dall'altra di ordinare correttamente gli elementi nella tavola periodica secondo il numero atomico crescente e non secondo il peso atomico crescente. Gli elementi devono infatti essere ordinati con lo stesso ordine con cui si succedono le righe della serie K. Risultò ad esempio che il Co precede il Ni e non viceversa .
Del 1914 sono gli esperimenti condotti da J. Franck e G. Hertz (nipote di H. Hertz) i quali scoprirono che gli elettroni, quando attraversano i vapori di Mercurio, subiscono una perdita di energia secondo “livelli” discreti e che a tale perdita di energia corrisponde una emissione di radiazioni ultraviolette (l = 254 nm) da parte del Mercurio. Pochi mesi più tardi Niels Bohr si rese conto che si trattava di una chiara conferma della validità del suo modello atomico quantizzato.
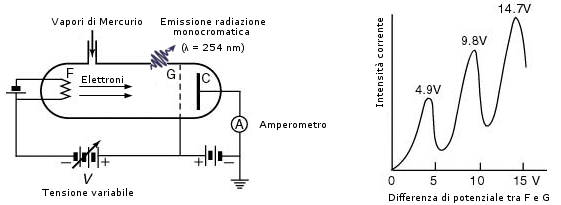
Esperimento di Franck-Hertz
Tra il filamento emittente F e la griglia G viene applicata una differenza di potenziale variabile. Tra la griglia G ed il collettore C viene applicata una differenza di potenziale costante di segno opposto di -1,5 V che esercita un’azione frenante, in modo che solo gli elettroni che hanno acquistato una sufficiente energia cinetica sono in grado di raggiungere il collettore C e contribuire alla circolazione di corrente. Finchè la differenza di potenziale è inferiore a 4,9 V gli elettroni urtano gli atomi di Mercurio in modo elastico, senza cedere energia e, attraversata la griglia, possiedono sufficiente energia per raggiungere il collettore e generare una corrente elettrica. la cui intensità viene misurata (amperometro). In corrispondenza di una tensione di 4,9 V gli elettroni hanno sufficiente energia per eccitare gli atomi di Mercurio che emettono una riga spettrale nell’ultravioletto a 254 nm. La cessione di energia agli atomi di Mercurio, rallenta gli elettroni, facendo diminuire l’intensità di corrente al collettore. Aumentando ulteriormente la tensione il fenomeno si ripresenta con regolarità per valori di tensione multipli di 4,9 V. Infatti, in corrispondenza di una tensione doppia (9,8 V) un elettrone ha sufficiente energia per eccitare in successione due atomi di mercurio, mentre con una tensione tripla (14,7 V) può eccitarne tre e così via.
Nel 1921 Otto Stern e W. Gerlach verificarono un'altra conseguenza della teoria di Bohr. Infatti non solo le singole orbite, ma anche l'intero atomo deve possedere un momento angolare quantizzato, calcolato come vettore risultante dei singoli momenti interni.
In pratica quindi anche l'intero atomo (se possiede un momento magnetico risultante netto) può assumere solo orientazioni spaziali discrete.
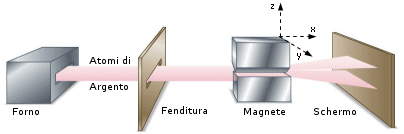
Esperimento di Stern-Gerlach
Un fascio di atomi di Argento attraversa un campo magnetico fortemente disomogeneo. I poli del magnete sono stati sagomati in modo che sul fascio di atomi agisca una forza deviante costante solo in direzione z e nulla in x ed y. Gli atomi si dividono in due fasci, colpendo lo schermo in due punti disposti simmetricamente rispetto alla direzione originaria. Gli atomi dimostrano pertanto di possedere un momento magnetico netto che si orienta in due soli modi possibili e controversi (spin antiparalleli) rispetto al campo magnetico applicato.
Il modello di Bohr-Sommerfeld : numero quantico secondario l
Tra le ipotesi iniziali di Bohr vi era quella che le orbite degli elettroni fossero circolari. Si trattava di un'ipotesi semplificatrice visto che la teoria di Bohr si basa sulla legge di Coulomb, formalmente simile alla legge di gravitazione universale, la quale costringe i corpi a ruotare intorno ad un baricentro comune su orbite ellittiche (la circonferenza può essere considerata un caso particolare di ellisse, con e = 0).
Nel 1915 A. Sommerfeld portò delle modificazioni al modello iniziale di Bohr, introducendo appunto delle orbite ellittiche in cui il nucleo occupava uno dei due fuochi, in modo del tutto analogo a quanto accade per le orbite planetarie.
Egli dimostrò che mentre nel primo livello l'elettrone poteva percorrere solo un'orbita circolare. nel secondo livello oltre ad un'orbita circolare l'elettrone avrebbe potuto occupare con la stessa energia, anche un'orbita ellittica avente l'asse maggiore della stessa lunghezza del diametro dell'orbita circolare.
Nel terzo livello era poi possibile per l'elettrone occupare, oltre all'orbita circolare due orbite ellittiche aventi assi maggiori uguali al diametro dell'orbita circolare, ma diversa eccentricità e cosi via.
L'introduzione delle orbite ellittiche sembrò rappresentare inizialmente una inutile complicazione nei calcoli. Esse permisero invece di risolvere il problema della cosiddetta struttura fine delle righe spettrali.
Con l'affinamento delle tecniche spettroscopiche risultò infatti che, utilizzando maggiori risoluzioni, ciascuna riga spettrale appariva composta da una serie di sottili righe molto ravvicinate, ad indicare la probabile esistenza di sottolivelli all'interno di ciascun livello energetico principale.
La teoria di Bohr era una teoria non relativistica, nel senso che non utilizzava nel suo formalismo le relazioni della relatività speciale. In effetti le equazioni della relatività speciale possono essere trascurate senza incorrere in errori eccessivi se i corpi che si stanno studiando presentano velocità molto inferiori alla velocità della luce. Nel caso la velocità del corpo oggetto di studio si avvicini a quella della luce, la relatività dimostra che la massa del corpo non rimane costante ma cresce al crescere della velocità in modo sensibile.
Tenendo presente che gli elettroni viaggiano a velocità molto elevate intorno al nucleo atomico, Sommerfeld introdusse le condizioni relativistiche nel modello di Bohr.
In pratica, ricordando che nel moto lungo un'ellisse l'elettrone è costretto a viaggiare più velocemente quando si trova più vicino al nucleo e più lentamente quando si trova più distante, la massa elettronica subisce delle modificazioni, aumentando in prossimità del nucleo e diminuendo nel punto più distante. Ciò comporta una diversificazione, seppur minima, delle energie associate alle orbite ellittiche, le quali non coincidono più con le energie delle orbite circolari del livello di appartenenza.
L'introduzione delle condizioni relativistiche da parte di Sommerfeld permise di spiegare in parte la struttura fine dello spettro.
Le orbite ellittiche di Sommerfeld resero però necessaria l'introduzione di un altro numero quantico detto numero quantico secondario o azimutale indicato con l.
l è un numero intero positivo il cui valore dipende dal valore assunto da n
0 £ l £ n - 1
Quindi
se n = 1 l = 0 ® orbita di tipo s
( ciò significa che nel primo livello vi è una sola orbita circolare, indicata appunto con l = 0, o anche con la lettera 's').
se n = 2 l = 0 ® orbita di tipo s
l = 1 ® orbita di tipo p
(ciò significa che nel secondo livello oltre ad una orbita circolare (l = 0), naturalmente di diametro maggiore della precedente, vi è anche un'orbita ellittica ( l = 1) indicata anche con la lettera 'p'.
se n = 3 l = 0 ® orbita di tipo s
l = 1 ® orbita di tipo p
l = 2 ® orbita di tipo d
(ciò significa che nel terzo livello possono trovar posto oltre ad un'orbita circolare s ed una ellittica di tipo p, una seconda orbita ellittica (l = 2), avente naturalmente eccentricità differente, indicata anche con la lettera 'd'.
se n = 4 l = 0 ® orbita di tipo s
l = 1 ® orbita di tipo p
l = 2 ® orbita di tipo d
l = 3 ® orbita di tipo f
(ciò significa che nel quarto livello, oltre alle precedenti orbite può trovar posto una terza orbita ellittica (l = 3), avente forma diversa ed indicata con la lettera 'f'.
In pratica il numero quantico secondario determina la forma dell'orbita descritta dall'elettrone. Comunemente però i quattro tipi di orbite possibili vengono per semplicità indicate con le lettere s, p, d ed f.
Le lettere s, p, d, f sono le iniziali dei termini con cui storicamente venivano indicate in spettroscopia le righe corrispondenti; sharp, principal, diffuse e fundamental.
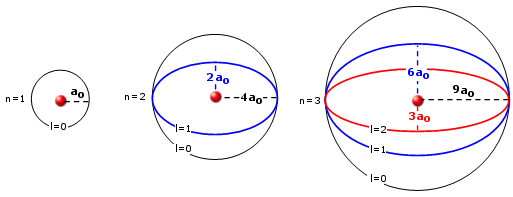
Orbite ellittiche di Sommerfeld per i primi tre livelli energetici (ao = raggio di Bohr)
Il numero quantico magnetico m
Il numero dei sottolivelli prodotto dall'introduzione delle orbite ellittiche non era comunque ancora sufficiente a giustificare tutta la ricchezza della struttura fine dello spettro.
Fin dal 1896 era noto che quando una sorgente luminosa viene sottoposta ad un campo magnetico, le righe spettrali vengono ulteriormente scomposte in diverse componenti (effetto Zeeman)
Il fenomeno può essere spiegato osservando che un'orbita elettronica si comporta come una spira percorsa da corrente elettrica e, come previsto da Ampere nel 1820, produce un momento magnetico che dipende dal suo momento angolare.
Poiché il momento angolare è quantizzato anche il momento magnetico lo è.
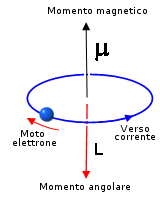
Si dimostra che il momento magnetico è sempre multiplo di una quantità minima detta magnetone di Bohr (mb)
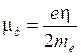
Ora è possibile dimostrare che una stessa orbita sottoposta ad un campo magnetico esterno può orientare il suo vettore momento magnetico solo in alcune direzioni, diversificando il suo contenuto energetico e dando perciò luogo ad ulteriori sottolivelli. Il numero delle direzioni consentite viene espresso dal cosiddetto numero quantico magnetico m che può assumere solo i valori interi compresi tra -l e + l.
-l £ m £ +l
In effetti tali sottolivelli vengono solamente resi più evidenti dall'effetto Zeeman. Essi esistono normalmente nell'atomo poiché le orbite elettroniche sono sottoposte al campo magnetico prodotto dal nucleo carico positivamente.
se l = 0 (orbita circolare s) m = 0
ciò significa che sottoposta ad un campo magnetico esterno un'orbita circolare dà luogo ad un’unica orientazione. Avremo perciò una sola orbita circolare di tipo s.
se l = 1 (orbita ellittica di tipo p) m può assumere i valori +1 0 -1
ciò significa che tale orbita può orientarsi in tre modi diversi producendo tre sottolivelli a differente energia. Avremo perciò 3 orbite di tipo p, indicate ciascuna con un diverso valore di m.
se l = 2 (orbita ellittica di tipo d) m può assumere i valori +2 +1 0 -1 -2
ciò significa che questo tipo di orbita ellittica può orientarsi in 5 modi differenti producendo quindi 5 sottolivelli a differente energia. Avremo perciò 5 orbite di tipo d, indicate ciascuna con un diverso valore di m.
se l = 3 (orbita ellittica di tipo f) m può assumere i valori +3 +2 +1 0 -1 -2 -3 ( ciò significa che questo tipo di orbita può orientarsi in 7 modi diversi, producendo 7 sottolivelli a differente energia. Avremo perciò 7 orbite di tipo f, indicate ciascuna con un diverso valore di m.
In pratica il valore del numero quantico magnetico determina il numero di orbite di una certa forma presenti in ciascun livello energetico principale.
Numero quantico di spin e principio di esclusione di Pauli
Il modello di Bohr-Sommerfeld rimane sostanzialmente invariato anche per atomi con maggior numero di protoni nel nucleo e quindi di elettroni in orbita intorno ad esso. L'unica differenza è in pratica dovuta al fatto che la maggior attrazione esercitata dal nucleo fa diminuire il diametro di tutte le orbite permesse. Il fatto permette di spiegare in modo naturale la diversità degli spettri dei vari elementi, in quanto essendo le orbite via via più compresse anche i salti quantici tra un'orbita e l'altra risultano di differente entità, producendo quindi righe spettrali peculiari.
Vi era tuttavia un problema in quanto per la fisica classica un sistema meccanico è stabile quando possiede il minor contenuto energetico. Pertanto tutti gli elettroni che vengono introdotti nelle orbite dopo il primo, dovrebbero naturalmente liberarsi della loro energia addizionale attraverso una serie di transizioni verso il primi livello energetico. Gli elettroni degli atomi pesanti dovrebbero perciò in definitiva trovarsi addensati tutti sulla prima orbita.
Poiché però tale orbita diventa sempre più piccola per l'attrazione esercitata dai nuclei via via più carichi positivamente, gli elementi più pesanti dovrebbero presentare atomi con diametro via via minore, mentre l'esperienza dimostra che ciò non è vero.
Nel 1925 il fisico tedesco Wolfgang Pauli formulò il principio noto come principio di esclusione, che permise di descrivere correttamente la distribuzione degli elettroni nelle diverse orbite.
Il principio di esclusione di Pauli afferma che ogni orbita quantica non può contenere più di due elettroni, i quali si differenziano per il valore di un quarto numero quantico detto numero quantico di spin. Il numero di spin può assumere solo i valori +1/2 e -1/2.
Con una formulazione alternativa, ma equivalente diremo
Il principio di esclusione di Pauli afferma che in un atomo non possono esistere 2 elettroni con tutti e quattro i numeri quantici uguali.
In altre parole ogni combinazione particolare dei quattro numeri quantici individua uno ed uno solo elettrone.
Ciò ha una conseguenza importante sulle configurazioni elettroniche, in quanto se entrambi i posti disponibili in un orbita sono occupati, gli elettroni successivi devono prendere posto necessariamente in orbite più esterne, sempre due per orbita.
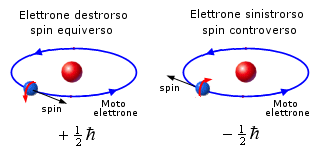
Nel novembre del 1925 G.E. Uhlenbeck e S.A. Goudsmit diedero significato fisico al numero quantico di spin, ipotizzando l'esistenza di un momento magnetico intrinseco dell'elettrone.
In altre parole è possibile immaginare l'elettrone carico negativamente come una piccola trottola che gira intorno al suo asse, in modo da produrre il momento magnetico osservato.
L’elettrone possiede un momento magnetico pari ad un magnetone di Bohr e, come conseguenza del suo moto di rotazione, anche un momento angolare intrinseco o spin, il cui valore può essere determinato in funzione del momento magnetico. Lo spin risulta essere pari a 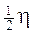 ed il suo verso è opposto al momento magnetico (a causa della carica negativa dell’elettrone)
ed il suo verso è opposto al momento magnetico (a causa della carica negativa dell’elettrone)
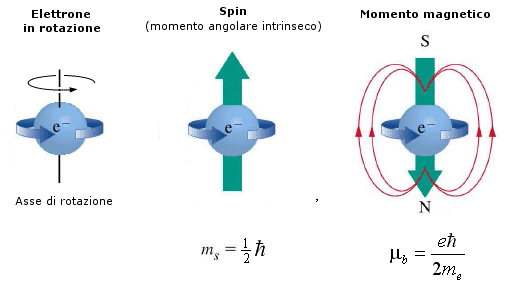
Il momento magnetico dell'elettrone, e quindi anche il suo momento angolare o spin, risulta quantizzato. Sottoposto ad un campo magnetico esterno lo spin dell’elettrone può infatti orientarsi nello stesso verso del campo o in verso opposto.
Convenzionalmente il vettore spin si considera parallelo alla direzione di avanzamento dell’elettrone, per cui i due elettroni si presenteranno:
- uno con spin
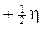
- l’altro con spin
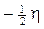
Dunque, in accordo con il principio di Pauli, in ogni orbita possono coesistere al massimo due elettroni i quali si distinguono per avere i vettori spin ad essi associati controversi o, come si usa impropriamente dire, antiparalleli.
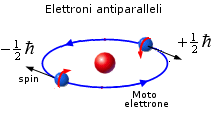
La scoperta dello spin dell'elettrone consentì di spiegare i risultati dell'esperimento di Stern-Gerlach. Gli atomi di argento possiedono infatti un numero dispari di elettroni ( Z = 47 ). Gli spin dei primi 46 elettroni si annullano a coppie, mentre lo spin dell'ultimo elettrone rimane come momento magnetico netto dell'intero atomo. In tal modo gli atomi che possiedono spin +1/2 vengono deflessi in una direzione, quelli che possiedono spin -1/2 in direzione opposta.
Nel 1926 Fermi fece una delle più feconde applicazioni del principio di esclusione, incorporandolo nella meccanica statistica ed ottenendo una nuova statistica, alternativa a quella già proposta da Bose e Einstein.
La formulazione del principio di esclusione e della statistica di Fermi che da esso deriva su basi rigorosamente quantistiche fu fatta da Dirac intorno al 1928. Tale statistica prende oggi il nome di statistica di Fermi-Dirac.
Solo nel 1940 Pauli scoprì un semplice criterio per determinare quali particelle obbediscono alla statistica di Bose-Einstein e quali alla statistica di Fermi-Dirac.
- Le particelle con spin intero sono descritte dalla statistica di Bose-Einstein e sono per questo dette bosoni. Esse non obbediscono al principio di esclusione di Pauli e possono presentarsi pertanto in numero qualsiasi nello stesso stato quantico, addensandosi numerose in uno stesso livello energetico.
- Le particelle con spin semidispari (semintero) sono descritte dalla statistica di Fermi-Dirac e sono perciò dette fermioni. Esse obbediscono al principio di esclusione di Pauli e non possono pertanto occupare lo stesso stato quantico, in numero superiore a due.
Il principio spiega in modo semplice anche la periodicità degli elementi chimici. Quando infatti un livello energetico risulta pieno di elettroni, i successivi sono costretti a riempire il livello energetico successivo, dove si trovano orbite dello stesso tipo del precedente, anche se di dimensioni maggiori. Gli elettroni si distribuiscono nei vari livelli con andamento regolare e periodico.
Poiché poi sono gli elettroni più esterni a fornire le caratteristiche chimiche all'elemento diventa ovvia anche la periodicità di tali caratteristiche che si riscontra nella tavola periodica.
Modelli atomici quanto-meccanici
Nonostante i notevoli successi nello spiegare lo spettro a righe, perfino a livello della sua struttura fine, anche il modello di Bohr-Sommerfeld, dimostrò la sua limitatezza. Soprattutto l'impostazione per così dire semiclassica che lo caratterizzava lasciava insoddisfatti molti fisici. In altri termini tale modello ricorreva ampiamente alle leggi classiche della meccanica e dell'elettromagnetismo, salvo poi essere costretto a fare vistose eccezioni, vietandone arbitrariamente l'applicazione in alcuni passaggi chiave. (orbite stazionarie dove l’elettrone non irraggia). La stessa condizione di quantizzazione risultava introdotta del tutto arbitrariamente.
Inoltre il modello otteneva risultati buoni ed aderenti ai dati sperimentali solamente per lo spettro dell'idrogeno, mentre non riusciva a fare previsioni soddisfacenti per gli atomi plurielettronici.
Il modello subì una radicale ed a tutt'oggi definitiva revisione con la nascita di una nuova meccanica, la meccanica quantistica e la conseguente introduzione di modelli atomici quantomeccanici.
La data di nascita della meccanica quantistica si può fissare al 1900 con la scoperta da parte di Planck del quanto di energia radiante h. Ma per circa vent'anni i fisici non ebbero vera consapevolezza della portata di tale scoperta. Le cose cominciarono realmente a mutare quando nel 1924 il fisico francese Louis De Broglie, avanzò la sconvolgente ipotesi che non solo l'energia, ma anche la materia possedesse una natura duale, corpuscolare e ondulatoria.
La natura ondulatoria della materia: De Broglie
Secondo tale ipotesi ad ogni corpo è possibile associare un'onda, che De Broglie chiamava 'onda di materia'. Per verificare questo assunto era necessario calcolare la lunghezza d'onda associata, ad esempio ad un elettrone, e poi controllare sperimentalmente se l'elettrone poteva produrre fenomeni tipicamente ondulatori come l'interferenza o la diffrazione, di entità compatibile con la lunghezza d'onda calcolata.
Il calcolo della lunghezza d'onda associata ad un corpo di massa m, fu eseguito da De Broglie.
Egli propose di assimilare completamente la trattazione delle particelle materiali a quella dei fotoni. Abbiamo già visto come nell'effetto Compton i fotoni possano essere considerati particelle con quantità di moto pari a
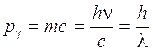
La relazione che nella relatività speciale lega l'energia totale (E), l'energia a riposo (Eo) e la quantità di moto p = mv è infatti E2 = (pc)2 + Eo2. Poiché non possono esistere fotoni fermi, l'energia a riposo di un fotone vale zero e la relazione per un fotone diventa E = pc.
Ricordando poi che E = h, si ottiene per un fotone 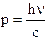 .
.
De Broglie ipotizzò dunque che anche la quantità di moto delle particelle materiali potesse essere calcolata come rapporto tra la costante di Planck e la loro lunghezza d'onda. Veniva in tal modo automaticamente associata ad ogni particella materiale una lunghezza d'onda, detta lunghezza d'onda di De Broglie, il cui valore è dato dalla relazione
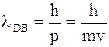
Sostituendo ad m la massa dell'elettrone e a v la velocità caratteristica dei raggi catodici, si può facilmente verificare che un elettrone possiede una lunghezza d'onda dello stesso ordine di grandezza dei raggi X (10-8 cm).
Utilizzando come reticolo di diffrazione reticoli cristallini come era stato fatto per dimostrare la natura ondulatoria dei raggi X, sarebbe stato dunque possibile verificare l'ipotesi di De Broglie con gli elettroni.
L'esperimento fu tentato nel 1927 da, George Thomson (figlio di J.J. Thomson) e, contemporaneamente da C.J. Davisson e L.H. Germer negli U.S.A. Essi dimostrarono che un fascio di elettroni accelerati e fatti passare attraverso un reticolo cristallino produce su di uno schermo caratteristiche figure di diffrazione e interferenza.
Dall'analisi del diametro degli anelli di diffrazione si poté anche calcolare che la lunghezza d'onda della radiazione elettronica coincideva perfettamente con quella prevista da De Broglie.
Si osservò anche che la lunghezza d'onda diminuiva o aumentava quando il fascio di elettroni veniva accelerato o rallentato, secondo quanto previsto dalla relazione di De Broglie.
Pochi anni dopo il fisico Otto Stern ottenne gli stessi risultati usando atomi di sodio al posto di elettroni, dimostrando quindi che tutte le particelle possono essere associate ad onde di De Broglie.
Il motivo per il quale non riusciamo ad osservare il comportamento ondulatorio degli oggetti macroscopici che ci circondano è dovuto al fatto che il rapporto h/mv risulta per tali oggetti piccolissimo, essendo h molto piccolo ed m molto grande.
Ai corpi macroscopici è dunque associata una lunghezza d'onda di De Broglie di dimensioni infinitesime.
Dopo aver sperimentalmente verificato la consistenza dell’ipotesi di De Broglie sulla natura ondulatoria della materia, i fisici si interrogarono sulla natura fisica di un’onda associata alla materia.
In ogni fenomeno ondulatorio c'è sempre qualcosa che si muove o vibra. I fisici si chiesero che cosa vibrasse nei corpi materiali. Lo stesso De Broglie tentò di dare una risposta ipotizzando che si trattasse di vere e proprie onde di materia. In altre parola che la stabilità della materia fosse solo un'illusione del mondo macroscopico, ma che a livello microscopico fosse necessario immaginare elettroni, protoni e atomi come delle nuvolette di materia pulsante senza contorni ben definiti.
Tale interpretazione non ebbe successo, anche perché si scontrava con difficoltà teoriche insormontabili. La risposta, ancor oggi accettata dalla maggior parte dei fisici, venne pochi anni più tardi, da parte di Max Born, segnando il definitivo tramonto del determinismo in fisica.
Natura ondulatoria della materia: interpretazione probabilistica
La descrizione ondulatoria della materia richiede un cambio radicale di prospettiva nel modo di interpretare i fenomeni. Soprattutto quando si passa dal continuo al discreto e viceversa, si assiste spesso ad una perdita di significato di concetti ormai assimilati ed accettati. Un esempio servirà a chiarire ed a familiarizzare con il problema.
Nei fenomeni radioattivi la velocità di decadimento 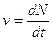 , cioè il numero di atomi che decadono per unità di tempo è direttamente proporzionale al numero iniziale N di atomi: v = lN.
, cioè il numero di atomi che decadono per unità di tempo è direttamente proporzionale al numero iniziale N di atomi: v = lN.
l è detta costante di decadimento radioattivo e rappresenta la frazione di atomi che decadono nell’unità di tempo. Poniamo ad esempio l = 0,01 s-1. Ciò significa che decadono l’1% di atomi al secondo. Se consideriamo un campione iniziale di 10.000 atomi, dopo 1 secondo ne sono decaduti 100; dopo 2 secondi altri 99 (l’1% dei rimanenti 10.000 – 100 = 9.900) e così via.
Consideriamo ora un campione costituito da un singolo atomo, N = 1 e chiediamoci che significato possiamo ora dare a l. Non possiamo certo affermare che in un secondo decadrà 1/100 di 1 atomo. Un atomo, o decade, o non decade. In tal caso l rappresenta dunque la probabilità che un atomo decada nell’unità di tempo. Così l’atomo presenta 1 probabilità su 100 di decadere dopo un secondo, 2 probabilità su 100 di decadere dopo 2 secondi,…..100 su 100 di decadere dopo 100 secondi. Si comprende così il motivo per cui la vita media di un atomo radioattivo è pari al reciproco della sua costante di decadimento.
In modo simile, nell'interpretazione di Born, l'onda associata ad una particella materiale deve essere interpretata in termini di probabilità di trovare la particella in un certo volume di spazio. Su tale interpretazione torneremo più avanti, dopo aver parlato dei fondamentali apporti alla meccanica quantistica forniti da Schrödinger ed Heisenberg.
L’introduzione della interpretazione ondulatoria della materia permise a De Broglie di portare ulteriore chiarezza all'interno del modello di Bohr-Sommerfeld. Alcuni fatti che inizialmente potevano apparire arbitrari e gratuiti ora acquistavano significato.
In particolare De Broglie dimostrò che la condizione di quantizzazione del momento angolare, introdotta in modo alquanto artificioso da Bohr, poteva essere derivata direttamente dalla natura ondulatoria dell'elettrone e ne diventava una sua naturale conseguenza.
Partendo dunque dalla condizione quantistica di Bohr 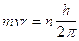 , sostituendo opportunamente nella prima si ottiene
, sostituendo opportunamente nella prima si ottiene
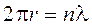
Ciò significa che le orbite quantizzate di Bohr devono soddisfare la condizione di contenere un numero intero n di lunghezze d'onda di De Broglie.
E precisamente, visto che n è il numero quantico principale, la prima orbita deve contenere una lunghezza d’onda, la seconda orbita due lunghezze d’onda e così via.
Si formano in tal modo delle onde, dette onde stazionarie, tali che dopo un'orbita completa l'onda si trova esattamente in fase con se stessa. Le altre orbite non sono consentite poiché in qualsiasi altro caso ventri e cavi delle onde si sovrapporrebbero creando interferenza distruttiva. L'onda si estinguerebbe e con essa la probabilità di trovare l'elettrone.
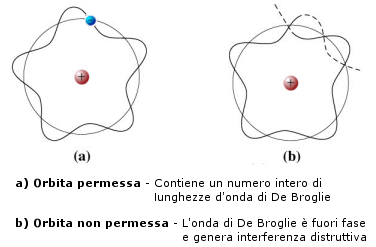
È la stessa condizione che fissa la frequenza di vibrazione di un oscillatore vincolato, ad esempio una corda vibrante di lunghezza fissata.
Ad esempio una corda di chitarra di lunghezza L è vincolata, è cioè fissa in due punti (il ponte ed il capotasto) che ne condizionano la vibrazione. Ciò e dovuto semplicemente al fatto che i due punti vincolati non sono naturalmente in gradi di vibrare.
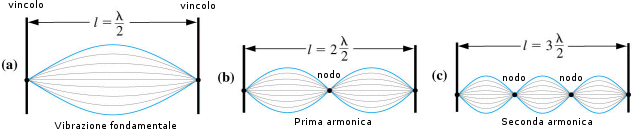
Tenendo ora presente che lungo la corda in vibrazione si distinguono punti in cui l'oscillazione è massima (ventri e creste) e punti in cui è nulla (nodi). La distanza tra i nodi è ovviamente pari a l/2.
Ora, una corda vincolata non è in grado di produrre qualsiasi vibrazione, poiché due nodi sono fissi per definizione in quanto coincidono con i vincoli e gli altri nodi si possono disporre, equidistanti, in modo da dividere la corda in parti uguali.
Vengono in tal modo automaticamente a formarsi solo certe caratteristiche lunghezze d'onda.
In altre parole la corda può necessariamente contenere solo un numero intero di mezze lunghezze d’onda e quindi può produrre solo quelle vibrazioni per le quali vale la relazione
L = n (l/2) n = 1, 2, 3, 4........
dove L è la lunghezza della corda.
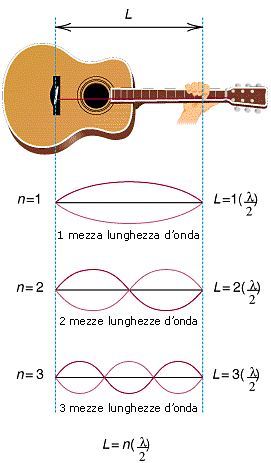
In un oscillatore vincolato si possono dunque formare solo onde stazionarie, aventi una determinata lunghezza d'onda.
Possiamo affermare che data una certa lunghezza della corda di un particolare strumento essa possiede un caratteristico spettro discontinuo (a righe).
Quando la corda contiene mezza lunghezza d'onda la frequenza corrispondente è detta fondamentale, mentre le frequenze superiori sono dette armoniche.
Il timbro del suono, che identifica uno strumento permettendo di distinguere due note uguali emesse da strumenti diversi, è determinato dalla sovrapposizione della vibrazione fondamentale con un certo numero di armoniche, tipiche di quel dato strumento. In altre parole il timbro è l'analogo in acustica dello spettro a righe di una sostanza in spettroscopia. La natura ondulatoria dell'elettrone, "vincolato" dal nucleo che lo attrae, rende l'atomo molto simile ad uno strumento musicale.
Il modello quantistico di Bohr-Sommerfeld acquista con De Broglie caratteristiche ondulatorie che ne giustificano i postulati di base.
La meccanica ondulatoria di Schrödinger
L'ipotesi di De Broglie fu generalizzata e formalizzata dal fisico austriaco E. Schrödinger, che nel 1926 ottenne un'equazione valida per il moto di una qualsiasi particella in un campo di forza, detta equazione d’onda Ψ (la lettera greca psi) o equazione di Schrödinger.
L’equazione d’onda, che descrive l’elettrone ha caratteristiche analoghe a quelle che descrivono le onde stazionarie nella meccanica classica. In entrambi i casi l’onda modifica la sua ampiezza passando alternativamente da valori positivi a negativi. I punti in cui il segno dell’onda cambia (da positivo a negativo o viceversa) e l’onda presenta ampiezza nulla si chiamano nodi.
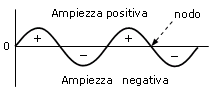
L'equazione d’onda di Schrödinger può essere applicata anche ad atomi diversi da quello dell’Idrogeno e risolta (anche se attraverso approssimazioni) con risultati in buon accordo con i dati sperimentali.
Quando si risolve l’equazione d’onda per un atomo particolare si ottiene una equazione parametrica, detta funzione d'onda , che presenta come parametri i primi tre numeri quantici, n, l, m.
Una funzione d’onda alla quale vengano attribuiti opportuni valori numerici ai numeri quantici individua lo stato di un particolare elettrone e prende il nome di funzione orbitalica o funzione orbitale..
Ogni funzione orbitale corrisponde ad uno stato stazionario dell’elettrone-onda.
Schrödinger arrivò alla conclusione che l'equazione d'onda che descrive un oscillatore meccanico poteva essere applicata anche all'atomo. Ora in acustica se la frequenza fondamentale è x la frequenza della seconda, terza, quarta......ennesima armonica sarà 2x, 3x, 4x......nx. In altre parole sarà sufficiente un solo parametro ( il numero intero positivo n = 1,2,3..) per individuare qualsiasi armonica.
Nel caso delle onde di Schrödinger il problema è più complesso poiché le onde in questione sono tridimensionali e sono necessari tre parametri per determinare una qualsiasi armonica. Tali parametri saranno anche in questo caso necessariamente quantizzati visto che l'onda in questione è un'onda vincolata e quindi stazionaria.
La natura ondulatoria dell'elettrone, "vincolato" dal nucleo che lo attrae, rende l'atomo molto simile ad uno strumento musicale.
Tuttavia la meccanica che descrive le proprietà ondulatorie delle particelle quali l’elettrone differisce in modo sostanziale dalla meccanica classica ed è nota come meccanica quantistica.
La meccanica quantistica ci permette di ottenere informazioni su di una particella risolvendo l’equazione d’onda. L’informazione che si ottiene non è la posizione e la velocità della particella, ma la probabilità di trovarla in una determinata regione di spazio.
Dati certi valori ai numeri quantici n. l ed m, le soluzioni dell'equazione di Schrödinger non forniscono le coordinate del punto P in cui si dovrebbe trovare l'elettrone rispetto al nucleo posto idealmente all'origine degli assi, ma il valore che in quel punto assume la funzione d'onda Y.
Ciò costringe ad abbandonare il concetto di traiettoria definita e quindi di orbita, per introdurre quello di orbitale, inteso come regione di spazio intorno al nucleo alla quale associare una certa probabilità di trovarvi l'elettrone.
Si può dunque descrivere il comportamento di un elettrone attorno ad un nucleo mediante la risoluzione dell’equazione di Schrödinger dove l’energia potenziale è quella esercitata da una carica positiva localizzata sull’origine (nucleo). Il sistema più semplice è l’atomo di idrogeno che contiene un solo elettrone ed è l’unico sistema per cui l’equazione di Schrödinger può essere risolta esattamente.
Come abbiamo già detto in precedenza, l’equazione d’onda che descrive il comportamento degli elettroni all’interno di un atomo presenta diverse soluzioni possibili, dette funzioni d’onda Ψ o funzioni orbitaliche o, semplicemente, orbitali. Gli orbitali s, p, d, f sono descritti da altrettante funzioni orbitaliche. Lo stato di un elettrone è descritto dalla funzione d’onda Ψ.
Tuttavia la funzione d’onda Ψ non ha significato fisico diretto. Si può invece dimostrare che la funzione Ψ2, nota come densità di probabilità fornisce la probabilità di trovare l’elettrone nell’unità di volume, in un determinata posizione dello spazio ad una data distanza dal nucleo ed è quindi proporzionale alla densità di carica presente.
Si noti l’analogia con la radiazione elettromagnetica, nel caso in cui si applichino grandezze caratteristiche del modello ondulatorio ad un singolo fotone. In un’onda elettromagnetica l’energia per unità di volume è proporzionale al quadrato dell’ampiezza dell’onda A2, dove l’ampiezza è data dall’intensità del campo elettrico o del campo magnetico ad esso concatenato. Se ora passiamo dal continuo al discreto e consideriamo la radiazione come un insieme di fotoni, A2 diventa una misura del numero di fotoni presenti nell’unità di volume e, per un singolo fotone, della probabilità di trovarlo nell’unità di volume.
Mentre Ψ può assumere anche valori negativi (l’ampiezza di un’onda può essere sia positiva che negativa), Ψ2 assume solo valori positivi (il quadrato di un valore negativo è sempre positivo ed una probabilità negativa non ha senso)
Le funzioni d’onda più semplici sono quelle che descrivono gli orbitali s.
Le funzioni d’onda Ψ(s) sono sfericamente simmetriche. La probabilità di trovare l’elettrone è la stessa in tutte le direzioni, variando solo con la distanza dal nucleo.
La rappresentazione di un’orbitale può essere fatta in modi diversi. Possiamo vederli esemplificati utilizzando una funzione orbitale particolarmente semplice, quella che descrive l’orbitale s del primo livello energetico (orbitale 1s) dell’atomo di Idrogeno.
1) Il modo più diretto di rappresentare un’orbitale è di tracciare la funzione orbitalica Y in dipendenza dal raggio. Per l’orbitale 1s dell’atomo di idrogeno essa vale
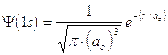
Si osserva facilmente che per r ® 0 il valore della funzione tende a 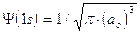 , mentre per r ® ¥ la funzione tende a zero. Il suo valore decresce dunque in modo esponenziale man mano che ci allontaniamo dal nucleo. L’orbitale 1s è infinitamente esteso (tutti gli orbitali lo sono).
, mentre per r ® ¥ la funzione tende a zero. Il suo valore decresce dunque in modo esponenziale man mano che ci allontaniamo dal nucleo. L’orbitale 1s è infinitamente esteso (tutti gli orbitali lo sono).
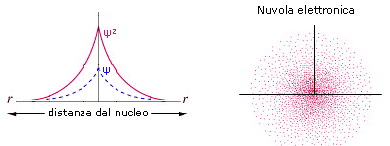
2) Poiché tuttavia la funzione orbitalica Y non presenta un significato fisico diretto si preferisce rappresentare l’orbitale riportando l’andamento della funzione densità di probabilità Y2. Si osserva facilmente che, per l’orbitale 1s, essa presenta lo stesso andamento della funzione orbitalica. La probabilità Y2 di trovare l’elettrone nell’unità di volume è massima e pari a 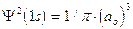 in corrispondenza del nucleo (r = 0), mentre diminuisce progressivamente allontanandoci da esso (r ® ¥). L’andamento di tale funzione viene spesso rappresentato in tre dimensioni attraverso la cosiddetta nuvola di carica o nuvola elettronica. Idealmente si può immaginare di osservare l’elettrone ad intervalli di tempo regolari e di riportare le sue posizioni come punti intorno al nucleo. Si ottiene una nebbia di punti che sfuma radialmente, detta appunto nuvola elettronica. Essa rappresenta una mappatura della funzione Y2. Nelle regioni dove la nuvola è più concentrata e la densità di punti è maggiore, risulta anche maggiore la probabilità di trovarvi l’elettrone.La probabilità Y2 di trovare l’elettrone nell’unità di volume è massima in corrispondenza del nucleo (r = 0), mentre diminuisce progressivamente allontanandoci da esso (r ® ¥). Ma in realtà il massimo di densità di probabilità non implica il massimo di probabilità.
in corrispondenza del nucleo (r = 0), mentre diminuisce progressivamente allontanandoci da esso (r ® ¥). L’andamento di tale funzione viene spesso rappresentato in tre dimensioni attraverso la cosiddetta nuvola di carica o nuvola elettronica. Idealmente si può immaginare di osservare l’elettrone ad intervalli di tempo regolari e di riportare le sue posizioni come punti intorno al nucleo. Si ottiene una nebbia di punti che sfuma radialmente, detta appunto nuvola elettronica. Essa rappresenta una mappatura della funzione Y2. Nelle regioni dove la nuvola è più concentrata e la densità di punti è maggiore, risulta anche maggiore la probabilità di trovarvi l’elettrone.La probabilità Y2 di trovare l’elettrone nell’unità di volume è massima in corrispondenza del nucleo (r = 0), mentre diminuisce progressivamente allontanandoci da esso (r ® ¥). Ma in realtà il massimo di densità di probabilità non implica il massimo di probabilità.
3) Possiamo rendercene conto ricorrendo alla funzione di distribuzione radiale della probabilità, un modo alternativo di rappresentazione dell’orbitale che presenta il pregio di descriverlo in modo più intuitivo. Dividiamo lo spazio intorno al nucleo in gusci sferici concentrici di spessore infinitesimo dr. Il volume di un generico guscio di superficie 4pr2, che si trovi a distanza r, sarà pari a 4pr2dr e la probabilità di trovarvi l’elettrone si otterrà ovviamente come prodotto della probabilità di trovare l’elettrone nell’unità di volume Y2 ed il volume del guscio stesso.
dP = Ψ2 4πr2dr.
Il rapporto dP/dr rappresenta la variazione della probabilità al variare della distanza dal nucleo ed è quindi una funzione di distribuzione della probabilità in funzione del raggio (radiale)
dP/dr = Ψ2 4πr2
Tale funzione vale zero in corrispondenza del nucleo (r = 0) in quanto un punto possiede volume nullo, presenta un massimo in corrispondenza di ao (che per l’atomo di Idrogeno è pari 0.53Å e corrisponde al raggio della prima orbita di Bohr) e si annulla all’infinito. Se sommiamo le probabilità di trovare l’elettrone in ciascun guscio fino ad una certa distanza r, otteniamo la probabilità totale di trovare l’elettrone nel volume compreso tra 0 ed r. (ciò equivale a calcolare l’integrale della funzione da 0 ad r). Tale probabilità complessiva è pari all’area sottesa dalla curva di distribuzione della probabilità. Poiché la funzione si annulla all’infinito, per ottenere una probabilità del 100% è necessario considerare un volume infinitamente grande intorno al nucleo.
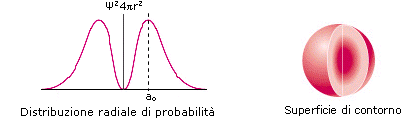
4) Se tuttavia ci accontentiamo di una probabilità inferiore, ad esempio del 95% o del 98%, possiamo individuare una superficie tale che la probabilità di trovarvi l’elettrone all’interno sia quella desiderata ed assumere il volume così individuato come rappresentativo dell’orbitale in questione. Tale superficie, detta superficie di contorno (boundary surface) o superficie di inviluppo o superficie limite, è sferica per gli orbitali s.
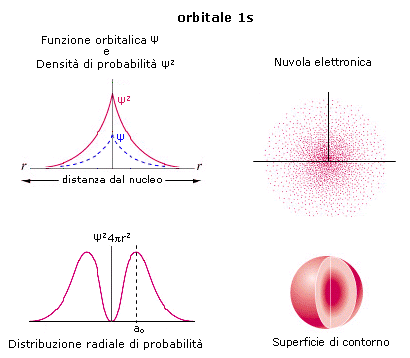
Anche l’orbitale 2s (orbitale s del secondo livello energetico) è sfericamente simmetrico, ma ad una certa distanza dal nucleo la funzione d’onda Ψ si annulla e da positiva diventa negativa (nodo). All’interno della superficie di controrno è pertanto presente una superficie nodale che separa la regione interna in cui la funzione d’onda è positiva dalla regione più esterna in cui la funzione d’onda è negativa. La superficie nodale, a probabilità nulla, separa due massimi, uno più vicino al nucleo ed un massimo principale più lontano.
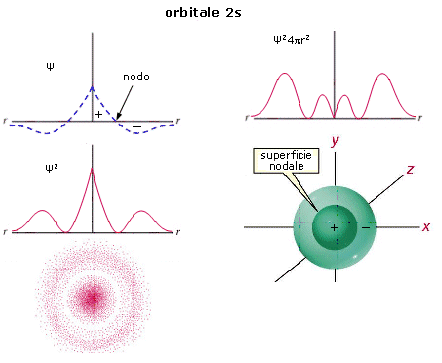
Per l’orbitale 3s la funzione di distribuzione radiale di probabilità presenta tre massimi (due secondari e un massimo principale) e due punti nodali. La superficie di inviluppo contiene quindi due superfici nodali.
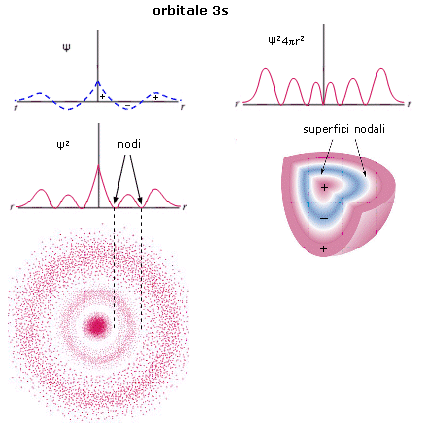
Gli orbitali ns dei livelli superiori mantengono la simmetria sferica e presentano n massimi di densità elettronica ed n-1 superfici nodali (con n = livello energetico di appartenenza).
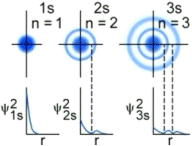
Gli orbitali p hanno simmetria cilindrica, possiedono cioè un asse preferenziale e non cambiano segno per rotazione attorno ad esso. Sono costituiti da due lobi ad elevata densità elettronica (in cui la funzione d’onda Ψ assume segno opposto) ed un piano nodale nell’origine (nucleo). Spesso le superfici di contorno vengono rappresentate con un colore diverso per i due lobi ad indicare il diverso segno (positivo e negativo) della funzione d’onda.
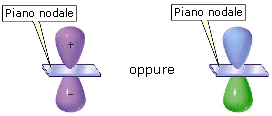
Gli orbitali p sono tre per livello energetico (tranne il primo livello energetico) ed essendo orientati uno perpendicolarmente all’altro nella direzione dei tre assi cartesiani, vengono indicati con la notazione: px, py, pz.
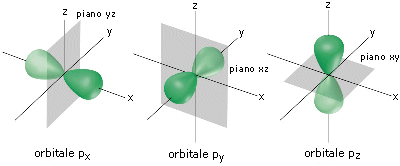
Gli orbitali 2p presentano un piano nodale passante per il nucleo che separa due lobi in cui la funzione d’onda Ψ presenta segni opposti senza alcuna altra superficie nodale al loro interno.
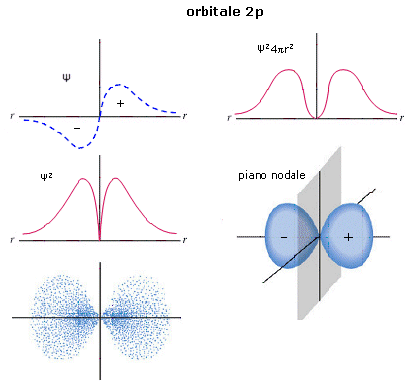
Gli orbitali 3p presentano un piano nodale passante per il nucleo che separa due lobi ad elevata densità elettronica. Ciascun lobo è diviso da una superficie nodale in due regioni in cui la funzione d’onda Ψ presenta segni opposti. La superficie nodale, a probabilità nulla, suddivide ciascun lobo in due massimi di probabilità, uno secondario più vicino al nucleo ed uno principale più lontano.
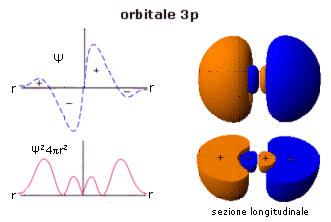
Gli orbitali 4p presentano ciascun lobo suddiviso in 3 regioni (in cui la funzione d’onda Ψ presenta segni alternativamente opposti) da due superfici nodali.

Gli orbitali np dei livelli superiori mantengono la simmetria cilindrica e presentano ciascun lobo suddiviso in n-1 regioni a massima densità elettronica separate da n-2 superfici nodali (con n = livello energetico di appartenenza).
Gli orbitali d sono 5 per livello energetico (tranne i primi due livelli energetici). Quattro di essi sono tetralobati con i 4 lobi in cui la funzione d’onda Ψ assume segno alternativamente opposto. Il quinto orbitale d è bilobato con una regione anulare (in cui la funzione d’onda ssume segno opposto) ad alta densità elettronica che circonda il nucleo.
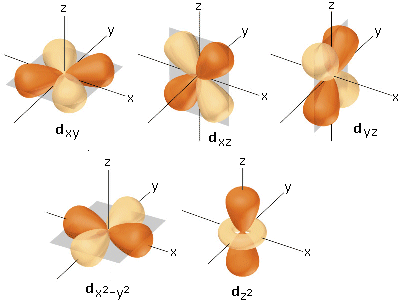
Gli orbitali d tetralobali presentano due piani nodali. Ad esempio l’orbitale dxy presenta due piani nodali perpendicolari che si intersecano sull’asse z
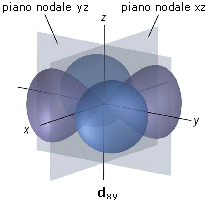
Gli orbitali f sono 7 per livello energetico (tranne i primi tre livelli energetici).
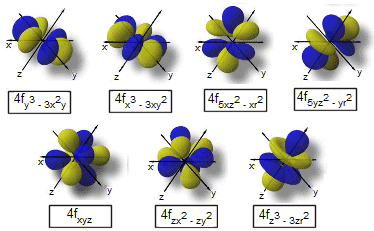
Il significato generale dei numeri quantici n, l ed m rimane inalterato anche se è necessario fare le seguenti precisazioni:
- Il valore assunto da 'n' determina l'energia dell'orbitale ed individua i 7 livelli energetici possibili, detti anche strati o gusci.
- il valore assunto da 'l' è associabile al tipo ed alla forma dell'orbitale. Esistono 4 tipi di orbitali. Gli orbitali 's' presentano simmetria sferica, gli orbitali 'p' presentano una forma a otto di rotazione, gli orbitali 'd' ed 'f' forme complesse.
- il valore assunto da 'm' è associabile al numero di orbitali per tipo presenti in ciascun livello energetico.
- Naturalmente anche il modello di Schrödinger prevede l'esistenza del quarto numero quantico di spin e non possono essere presenti più di due elettroni per orbitale
1° Livello energetico
1 orbitale s (1s) capienza max: 2 elettroni
2° Livello energetico
1 orbitale s (2s) capienza max: 2 elettroni
3 orbitali p (2p) capienza max: 6 elettroni
3° Livello energetico
1 orbitale s (3s) capienza max: 2 elettroni
3 orbitali p (3p) capienza max: 6 elettroni
5 orbitali d (3d) capienza max: 10 elettroni
4° Livello energetico
1 orbitale s (4s) capienza max: 2 elettroni
3 orbitali p (4p) capienza max: 6 elettroni
5 orbitali d (4d) capienza max: 10 elettroni
7 orbitali f (4f) capienza max: 14 elettroni
I livelli successivi presentano al massimo la struttura orbitalica del quarto livello. Gli atomi più pesanti, come l’Uranio, hanno elettroni a sufficienza per occupare 7 livelli energetici, senza tuttavia riuscire a riempirli completamente.
Anche se, in teoria, i livelli energetici più esterni possono presentare tutti i tipi di orbitali, in pratica un atomo non possiede mai un numero di elettroni sufficiente a riempire tutti i possibili orbitali esterni. Così la struttura orbitalica di un atomo è, in pratica, la seguente
Livello |
Orbitali consentiti |
Campienza elettronica |
|||
1° |
1s |
|
|
|
2 |
2° |
2s |
2p |
|
|
2+6=8 |
3° |
3s |
3p |
3d |
|
2+6+10=18 |
4° |
4s |
4p |
4d |
4f |
2+6+10+14=32 |
5° |
5s |
5p |
5d |
5f |
“ |
6° |
6s |
6p |
6d |
|
“ |
7° |
7s |
|
|
|
" |
I tre orbitali p di un medesimo livello energetico presentano lo stesso contenuto energetico e si dicono pertanto isoenergetici o degeneri. Questo accade anche per i cinque orbitali d di un medesimo livello energetico e per i sette orbitali f di un medesimo livello energetico.
Nella tavola periodica esistono quattro coppie di elementi (Ar/K, Co/Ni, Te/I, Th/Pa (Torio/Proattinio)) il cui ordine risulterebbe invertito se fossero ordinati secondo il peso atomico crescente. È notevole il fatto che Mendeleev decise di scambiarli di posto, pensando che il loro peso atomico fosse errato, classificandoli non in base al peso, ma alle loro caratteristiche chimiche
Spesso il magnetone di Bohr viene misurato utilizzando il sistema cgs elettromagnetico. In tal caso, per convertire la carica dell'elettrone, espressa in unità elettrostatiche (1 ues = statC = 1franklin), nelle corrispondenti unità elettromagnetiche (abCoulomb), è necessario dividerla per c, velocità della luce (1 abC = 10 C = c statC, con c = 3 1010 cm/s)) . La relazione diventa . Il magnetone di Bohr vale nel sistema SI 9,2740155.10-24 J T-1, nel sistema cgsem 9,2740155.10-21 erg G-1 e nel sistema cgses 2,7802799.10-10 erg statT-1.
fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Chimica generale 2
Visita la nostra pagina principale
Chimica generale 2
Termini d' uso e privacy

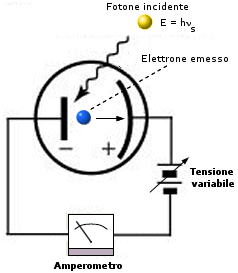
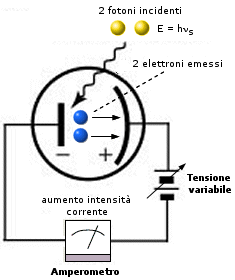
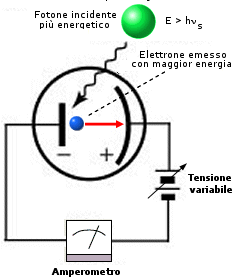
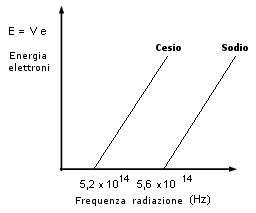
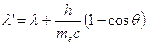
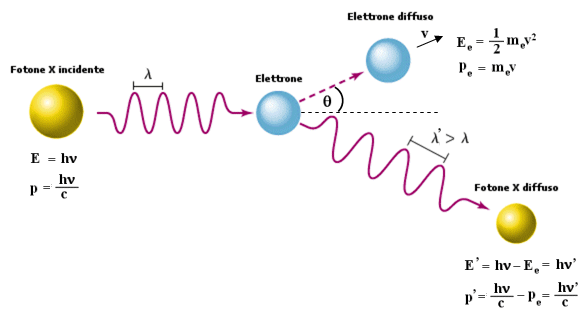
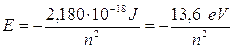
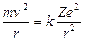
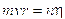
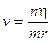 che sostituita nella 1) fornisce il raggio quantizzato
che sostituita nella 1) fornisce il raggio quantizzato 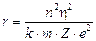
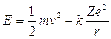
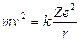 che sostituita nella 4) fornisce
che sostituita nella 4) fornisce 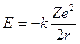
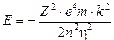
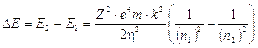
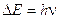 e dunque, dividendo entrambi i membri della 7) per ch, otteniamo
e dunque, dividendo entrambi i membri della 7) per ch, otteniamo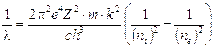
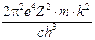 . È possibile tuttavia dimostrare che il moto combinato del sistema elettrone/protone attorno al baricentro comune è equivalente al moto di una particella di massa ridotta ()
. È possibile tuttavia dimostrare che il moto combinato del sistema elettrone/protone attorno al baricentro comune è equivalente al moto di una particella di massa ridotta ()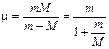
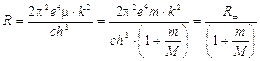
 è infatti il valore calcolato senza tener conto della massa del nucleo M, il che equivale ad ipotizzare un nucleo di massa M infinitamente grande per cui
è infatti il valore calcolato senza tener conto della massa del nucleo M, il che equivale ad ipotizzare un nucleo di massa M infinitamente grande per cui