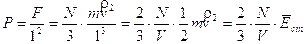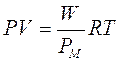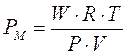Chimica generale 7
Chimica generale 7
Acidi
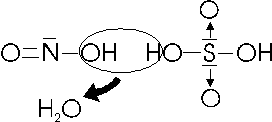
Gli acidi si formano sommando una o più molecole d'acqua ad un'anidride
Anidride + acqua = Acido
Il carattere acido di queste sostanze, cioè la loro tendenza a liberare ioni H+, è legato alla presenza nella molecola di un non metallo, un elemento elettronegativo che attirando gli elettroni di legame li allontana dagli atomi di idrogeno. Sugli atomi di idrogeno si forma una parziale, ma intensa carica positiva che ne facilita la liberazione come ioni H+, una volta in acqua.
Il nome degli acidi si ottiene da quello dell'anidride corrispondente, sostituendo il termine "acido" al termine "anidride".
Per costruire un acido è sufficiente sommare all'anidride 2 atomi di idrogeno e 1 di ossigeno per ogni molecola d'acqua che viene aggiunta.
Ad esempio dall'anidride carbonica si ottiene l'acido carbonico
CO2 + H2O → H2CO3
mentre dall'anidride nitrica si ottiene l'acido nitrico
N2O5 + H2O → H2N2O6 → 2HNO3
Forza di un acido
Un acido si dice forte quando in soluzione acquosa è completamente o quasi completamente dissociato in anioni e ioni H+, si dice debole quando è poco dissociato. La forza di un acido si può prevedere in linea di massima, osservando il numero di atomi di idrogeno e di ossigeno presenti nella sua molecola. Un acido può ritenersi forte quando la differenza tra il numero di atomi di ossigeno ed il numero di atomi di idrogeno è uguale o maggiore di due, debole in caso contrario. Così mentre l'acido carbonico è debole, l'acido nitrico è forte.
Dissociazione di un acido
Un acido con un solo atomo di idrogeno è detto monoprotico, con due biprotico etc.
Una acido monoprotico come l'acido nitrico si dissocia in acqua
HNO3 → H+ + NO3-
un acido poliprotico presenta invece tante dissociazioni quanti sono gli atomi di idrogeno contenuti nella sua molecola. L'acido carbonico ad esempio può dare due dissociazioni
H2CO3 → H+ + HCO3-
HCO3- → H+ + CO32-
Naturalmente è possibile scrivere l'intera dissociazione in forma sintetica
H2CO3 → 2H+ + CO32-
Proviamo ora a costruire le formule dei principali ossiacidi gruppo per gruppo, tenendo presente che non tutte le reazioni che scriveremo tra anidride e acqua possono effettivamente avvenire. Esse ci servono unicamente per ottenere la formula corretta dei diversi acidi. Si tenga inoltre presente che non tutte le anidridi e non tutti gli acidi che scriveremo sono stati effettivamente isolati. Alcuni sono solo teorici e ci servono per poter poi costruire correttamente le formule dei composti salini che da essi derivano.
VII gruppo A |
Il Cloro con i numeri di ossidazione +1, +3, +5 e +7 forma i seguenti acidi
Cl2O + H2O → H2Cl2O2 → 2HClO acido ipocloroso (esiste solo in soluzione)
Cl2O3 + H2O → H2Cl2O4 → 2HClO2 acido cloroso (esiste solo in soluzione)
Cl2O5 + H2O → H2Cl2O6 → 2HClO3 acido clorico (esiste solo in soluzione)
Cl2O7 + H2O → H2Cl2O8 → 2HClO4 acido perclorico
Il Bromo con i numeri di ossidazione +1 e +5 forma i seguenti acidi
Br2O + H2O → H2Br2O2 → 2HBrO acido ipobromoso
Br2O5 + H2O → H2Br2O6 → 2HBrO3 acido bromico
Lo Iodio con i numeri di ossidazione +1, +5 e +7 forma i seguenti acidi
I2O + H2O → H2I2O2 → 2HIO acido ipoiodoso (teorico, esistono i suoi sali)
I2O5 + H2O → H2I2O6 → 2HIO3 acido iodico
I2O7 + H2O → H2I2O8 → 2HIO4 acido periodico
VI gruppo A |
Lo zolfo con i numeri di ossidazione +4 e +6 forma i seguenti acidi
SO2 + H2O → H2SO3 acido solforoso (esiste solo in soluzione)
SO3 + H2O → H2SO4 acido solforico
Altri acidi dello zolfo
a partire dal protossido di zolfo con numero di ossidazione +2 si ottengono 2 diversi acidi
SO + H2O → H2SO2 acido solfossilico (teorico, esistono i suoi sali)
2SO + H2O → H2S2O3 acido tiosolforico (teorico, esistono i suoi sali chiamati erroneamente iposolfiti). Il nome rimanda al fatto che la sua struttura chimica è analoga a quella dell'acido solforico, dove un atomo di ossigeno è stato sostituito da uno di zolfo (il radicale S2- si indica con il suffisso tio-).
A partire dal sesquiossido di zolfo con nox +3 si ottiene
S2O3 +H2O → H2S2O4 acido iposolforoso (o idrosolforoso) (esiste solo in soluzione)
Per reazione tra due molecole di acido solforoso, con perdita di una molecola d'acqua si ottiene
2H2SO3 → H2S2O5 +H2O acido pirosolforoso (teorico, esistono solo i suoi sali)
Per reazione tra due molecole di acido solforico, con perdita di una molecola d'acqua si ottiene
2H2SO4 → H2S2O7 +H2O acido pirosolforico o disolforico
Lo zolfo presenta inoltre, con nox +6, due perossidi tipo acqua ossigenata, che sarebbe opportuno chiamare peranidridi, S2O7 e SO4, le cui formule di struttura potrebbero essere
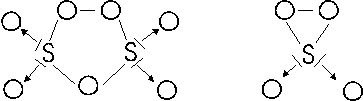
tali composti possono dare due peracidi o perossiacidi (acidi in cui è presente il gruppo OO)
S2O7 + H2O → H2S2O8 acido dipersolforico
SO4 + H2O → H2SO5 acido monopersolforico
Lo zolfo è infine in grado di dare legami SS simili a quelli dell'ossigeno nei perossidi, formando quindi dei persolfuri. Tale caratteristica è ancora più spiccata nello zolfo in quanto esso è in grado di dare anche catene formate da più atomi. Sono noti due persolfuri d'idrogeno: analogo all'acqua ossigenata esiste HSSH e anche HSSSH i due composti sono noti rispettivamente come:
H2S2 disolfuro d'idrogeno H2S3 trisolfuro d'idrogeno
Sfruttando lo stesso tipo di legame tra atomi zolfo si forma anche una famiglia di acidi politionici, di formula generale H2SxO6, dove x = 2, 3, 4, 5,..... con formula di struttura
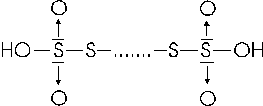
essi vengono denominati acido ditionico, tritionico, tetrationico etc.
Il Selenio con numeri di ossidazione +4 e +6 forma i seguenti acidi
SeO2 + H2O → H2SeO3 Acido selenioso
SeO3 + H2O → H2SeO4 Acido selenico
V gruppo A |
L'Azoto con i numeri di ossidazione +3 e +5 produce i seguenti acidi
N2O3 + H2O → H2N2O4 → 2HNO2 acido nitroso
N2O5 + H2O → H2N2O6 → 2HNO3 acido nitrico
Altri acidi dell'azoto
Facendo reagire l'acido nitrico con l'acqua ossigenata si ottiene un peracido o perossiacido (contenente il gruppo OO), detto acido pernitrico, dove l'azoto presenta nox +5
HNO3 + H2O2 HNO4 + H2O
con formula di struttura 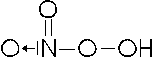
Facendo reagire l'anidride nitrosa con l'acido solforico si ottiene l'acido nitrosil-solforico (il suffisso nitrosil- indica la presenza del gruppo nitrosile NO)
N2O3 + 2H2SO4 2NOHSO4 + H2O
L'acido nitrosil-solforico può essere pensato come prodotto dalla disidratazione (perdita di acqua) tra una molecola di acido solforico ed una di acido nitroso
Il Fosforo con i numeri di ossidazione +3 e + 5 forma una serie di acidi che presentano diversi gradi di idratazione.
In particolare quando un'anidride si lega con una sola molecola d'acqua l'acido che ne deriva viene indicato facendone precedere il nome dal suffisso meta-.
Quando viene legata una seconda molecola d'acqua al meta-acido si forma un acido il cui nome viene preceduto dal prefisso orto-.
P2O3 + H2O → H2P2O4 → 2HPO2 acido metafosforoso
HPO2 + H2O → H3PO3 acido ortofosforoso
P2O5 + H2O → H2P2O6 → 2HPO3 acido metafosforico
HPO3 + H2O → H3PO4 acido ortofosforico
L'acido ortofosforoso, pur avendo 3 idrogeni, è biprotico, ne dissocia cioè solo due. Per questo motivo si ritiene che un idrogeno sia legato direttamente all'atomo di fosforo, piuttosto che ad un ossigeno.
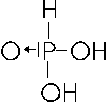
Con il numero di ossidazione +5 il fosforo forma anche l'acido pirofosforico (o difosforico) il quale si forma per disidratazione (perdita di una molecola d'acqua) da due molecole di acido ortofosforico.
Per trovarne la formula in maniera più rapida e veloce è sufficiente aggiungere due molecole d'acqua all'anidride fosforica
P2O5 + 2H2O → H4P2O7 acido pirofosforico
Altri acidi del fosforo
Con il nox +5 il fosforo forma due peracidi o perossiacidi in cui è presente il gruppo OO.
H3PO5, acido monoperfosforico e H4P2O8, acido diperfosforico, con formule di struttura
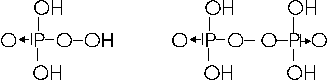
Il tetrossido di fosforo P2O4, analogo all'ipoazotide, dove il fosforo presenta nox +4, sciolto in acqua forma una miscela di acido fosforoso e fosforico. Esiste comunque un acido in cui il fosforo presenta nox +4 e di cui il tetrossido rappresenta l'anidride teorica. E' l'acido ipofosforico H4P2O6, la cui formula può essere ottenuta aggiungendo due molecole d'acqua al tetrossido.
Esiste infine anche un acido ipofosforoso H3PO2, in cui il fosforo presenta nox +1. Corrisponde ad un protossido di fosforo P2O, non conosciuto.
L'Arsenico con i numeri di ossidazione +3 e +5 produce i seguenti acidi
As2O3 + H2O → 2HAsO2
HAsO2 + H2O → H3AsO3 acido ortoarsenioso (esiste solo in soluzione)
As2O5 + H2O → 2HAsO3
HAsO3 + H2O → H3AsO4 acido ortoarsenico
L'acido ortoarsenioso è un composto anfotero. In soluzioni basiche si comporta come un acido, mentre in soluzioni acide si comporta come una base, dissociandosi in ioni OH- e cationi As3+. In tal caso esso va scritto come un idrossido arsenioso
As(OH)3 → As3+ + 3OH-
Esiste infine, analogamente a quanto visto per il fosforo, un acido piroarsenico, ottenibile per disidratazione di due molecole di acido ortoarsenico. La sua formula può essere determinata più facilmente sommando due molecole d'acqua all'anidride arsenica
As2O5 + 2H2O → H4As2O7 acido piroarsenico
IV gruppo A |
Il Carbonio con il numero di ossidazione +4 forma l'acido carbonico
CO2 + H2O → H2CO3 acido carbonico (esiste solo in soluzione)
E' noto anche un peracido, l'acido percarbonico, H2C2O6 dalla formula di struttura
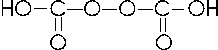
Il Silicio con numero di ossidazione +4 forma due acidi
SiO2 + H2O → H2SiO3 acido metasilicico
H2SiO3 + H2O → H4SiO4 acido ortosilicico
L'acido silicico dà poi per disidratazione una serie di acidi polisilicici, rappresentabili dalla formula generale (mH4SiO4 nH2O). Il primo termine della serie è l'acido ortodisilicico o pirosilicico
2H4SiO4 → H6Si2O7 + H2O acido pirosilicico
III gruppo A |
Il Boro con nox +3 forma l'acido borico ed un peracido, l'acido perborico
B2O3 + H2O → 2HBO2 acido metaborico
HBO2 + H2O → H3BO3 acido ortoborico
l'acido perborico (o perossiborico) HBO3, ha formula di struttura

Scaldando l'acido ortoborico si ottiene infine per disidratazione un poliacido
4H3BO3 → H2B4O7 + 4H2O acido tetraborico
PRINCIPALI ACIDI DEI GRUPPI B
VI gruppo B |
Il Cromo (nox +2, +3, +6) forma composti acidi con il numero di ossidazione più elevato
CrO3 + H2O → H2CrO4 acido cromico (esiste solo in soluzione)
Trattando le soluzioni di acido cromico con acqua ossigenata si ottengono diversi tipi di peracidi, acidi percromici e i relativi sali (i percromati).
Esiste infine una serie di sali che derivano da acidi policromici (teorici), il primo termine della serie è l'acido bicromico
2H2CrO4 → H2Cr2O7 + H2O acido bicromico (teorico, esistono i suoi sali)
VII gruppo B |
Il Manganese (nox +2, +3, +4, +6, +7) forma composti acidi con i due numeri di ossidazione più elevati
Con il nox + 6 forma un acido manganico (teorico), la cui formula è ottenibile da un'anidride manganica MnO3, altrettanto teorica.
MnO3 + H2O → H2MnO4 acido manganico (teorico, esistono i suoi sali)
Mn2O7 + H2O → H2Mn2O8 2HMnO4 acido permanganico
Idrossidi
Gli idrossidi si formano sommando una o più molecole d'acqua ad un ossido
Ossido + acqua = Idrossido
Il carattere basico di queste sostanze, cioè la loro tendenza a liberare ioni OH-, è legato alla presenza nella molecola di un metallo, che rende polare il legame con i gruppi ossidrilici. Sull'atomo di ossigeno dell'ossidrile si intensifica in tal modo la parziale carica negativa, mentre sul metallo si forma una parziale carica positiva che ne facilita la liberazione come catione, una volta in acqua, e la separazione dei gruppi OH-.
Il nome degli idrossidi si ottiene da quello dell'ossido corrispondente, sostituendo il termine "idrossido" al termine "ossido".
Per costruire un idrossido è sufficiente far seguire al metallo tanti gruppi ossidrili quanti ne richiede il numero di ossidazione del metallo.
Ad esempio dall'ossido di potassio si ottiene l'idrossido di potassio
K2O + H2O → 2KOH
mentre dall'ossido di rame si ottiene l'idrossido di rame
CuO + H2O → Cu(OH)2
Forza di un idrossido
Un idrossido si dice forte quando in soluzione acquosa è completamente o quasi completamente dissociato in cationi e ioni OH-, si dice debole quando è poco dissociato. La forza di un idrossido si può prevedere in linea di massima, osservando se il metallo appartenga o meno ad uno dei primi gruppi chimici. In linea di massima un idrossido è forte quando il metallo che lo forma è un metallo alcalino o alcalino-terroso. Così mentre l'idrossido di rame è debole, l'idrossido di potassio è forte.
Dissociazione di un idrossido
Un idrossido con un solo gruppo ossidrile è detto monoprotico, con due biprotico etc.
Un idrossido monoprotico come l'idrossido di potassio si dissocia in acqua
KOH → K+ + OH-
un idrossido poliprotico presenta invece tante dissociazioni quanti sono i gruppi ossidrile contenuti nella sua molecola. L'idrossido di rame può dare due dissociazioni
Cu(OH)2 → CuOH+ + OH-
CuOH- → Cu2+ + OH-
Naturalmente è possibile scrivere l'intera dissociazione in forma sintetica
Cu(OH)2 → Cu2+ + 2OH-
Proviamo ora a costruire le formule dei principali ossiacidi gruppo per gruppo
I gruppo A |
I metalli alcalini hanno tutti nox +1 e quindi formano idrossidi del tipo LiOH, NaOH, KOH etc
II gruppo A |
I ma talli alcalino-terrosi hanno tutti nox +2 e formano quindi idrossidi del tipo Be(OH)2, Mg(OH)2 etc
III gruppo A |
I metalli del terzo gruppo A presentano tutti nox +3 e formano quindi idrossidi del tipo Al(OH)3 etc
L'idrossido di alluminio è in realtà un composto anfotero.
In soluzione acida si comporta infatti come una base, mentre in soluzione basica si comporta come un acido (acido alluminico)
H3AlO3 → AlO33- + 3H+
IV gruppo A |
I metalli del quarto gruppo formano idrossidi con nox +2 e +4
Lo stagno con nox +2 forma l'idrossido stannoso Sn(OH)2, avente carattere anfotero (acido stannoso, H2SnO2). Con nox +4 forma invece un composto a carattere acido
SnO2 + H2O → H2SnO3 acido stannico
Il Piombo, con nox +2 forma l'idrossido piomboso Pb(OH)2, a carattere anfotero (acido piomboso H2PbO2). Con nox +4 forma l'idrossido piombico Pb(OH)4, anch'esso anfotero (acido piombico H4PbO4).
I Sali
I sali sono composti chimici che derivano dagli acidi per sostituzione di uno o più ioni H+ con cationi metallici. I sali sono composti che possono presentare solubilità diverse in acqua (alcuni sono molto solubili, altri poco solubili), ma la frazione di un sale che si scioglie in acqua è comunque totalmente dissociata negli ioni che lo costituiscono. In altre parole i sali sono tutti elettroliti forti.
Si dicono elettroliti tutti i composti chimici che in acqua si dissociano in ioni.
Sono detti forti gli elettroliti che si dissociano completamente, deboli quelli che si dissociano parzialmente.
Il termine "elettrolita" deriva dal fatto che solo i composti chimici che in acqua si dissociano producendo ioni sono in grado di dare "elettrolisi", processo di cui ci occuperemo in seguito.
Per costruire la formula chimica di un sale è necessario
1) procedere alla dissociazione dell'acido
2) sostituire agli ioni H+ il catione metallico
3) scrivere gli opportuni indici, in modo da rendere neutra la molecola (si utilizzerà il nox del metallo come indice dell'anione e viceversa)
4) procedere alla eventuale semplificazione degli indici
Esemplifichiamo la procedura costruendo il sale di sodio dell'acido carbonico
1) dissociamo l'acido carbonico
H2CO3 → 2H+ + CO32-
2) lo ione sodio Na+ va a prendere il posto degli idrogeni
Na CO3
3) il nox del sodio (+1) diventa l'indice dell'anione, mentre il nox dell'anione (-2) diventa l'indice del catione.
Na2CO3
4) gli indici sono già semplificati
Proviamo ora a costruire il sale d'alluminio dell'acido solforico
1) dissociamo l'acido solforico
H2SO4 → 2H+ + SO42-
2) lo ione alluminio Al3+ va a prendere il posto degli idrogeni
Al SO4
3) il nox del alluminio (+3) diventa l'indice dell'anione, mentre il nox dell'anione (-2) diventa l'indice del catione.
Al2(SO4)3
Si noti che l'anione proveniente dalla dissociazione dell'acido è stato messo tra parentesi, infatti l'indice 3 si riferisce a tutto l'anione. Il sale in tal modo risulta neutro, infatti nella molecola sono presenti 2 ioni Al3+, per un totale di 6 cariche positive e 3 anioni SO42-, per un totale di 6 cariche negative.
4) gli indici sono già semplificati
I sali si possono formare sia utilizzando un anione proveniente da un acido completamente dissociato, ed in tal caso sono detti sali neutri, sia da un acido parzialmente dissociato. In tal caso l'anione possiede ancora atomi di idrogeno nella sua molecola e il sale che si forma è detto sale acido.
Ad esempio l'acido ortofosforico può formare tre tipi di sali utilizzando gli anioni provenienti dalle tre dissociazioni successive
H3PO4 → H+ + H2PO4- anione biacido
H2PO4- → H+ + HPO42- anione monoacido
HPO42- → H+ + PO43- anione neutro
Se ora vogliamo costruire i tre sali di calcio utilizzando i tra anioni, otterremo (il calcio ha nox +2)
Ca(H2PO4)2 sale biacido
CaHPO4 sale monoacido
Ca3(PO4)2 sale neutro
I nomi dei sali si formano da quelli degli acidi corrispondenti cambiando le desinenze secondo tale schema
OSO ® ITO
ICO ® ATO
IDRICO ® URO
ad esempio i sali dell'acido solforoso si chiamano "solfiti", quelli dell'acido carbonico "carbonati", quelli dell'acido solfidrico "solfuri". Alcuni sali acidi utilizzano ancora la vecchia denominazione. Ad esempio il carbonato monoacido di sodio NaHCO3 è detto anche bicarbonato di sodio.
Processi di salificazione
La formula chimica di un sale si può costruire come abbiamo appena esposto, ma i sali si producono attraverso numerose reazioni chimiche. Vediamo le principali.
Possiamo riassumere le principali reazioni di salificazione attraverso il seguente schema
Metallo Ossido Idrossido |
|
Non metallo Anidride Acido |
1) metallo + non metallo → sale
2K + F2 → 2KF (fluoruro di potassio)
2) ossido + anidride → sale
MgO + SO3 → MgSO4 (solfato di magnesio)
3) idrossido + acido → sale + acqua
Ca(OH)2 + H2CO3 → CaCO3 + H2O (carbonato di calcio)
4) ossido + acido → sale + acqua
Na2O + H2SO3 → Na2SO3 + H2O (solfito di sodio)
5) anidride + idrossido → sale + acqua
P2O5 + 2KOH → 2KPO3 + H2O (metafosfato di potassio)
Altri processi di salificazione
La salificazione può avvenire per sostituzione dell'idrogeno di un acido o dello ione metallico di un sale da parte di un metallo più elettropositivo (scambio semplice)
a) acido + metallo → sale + idrogeno
H2SO4 + Zn → ZnSO4 + H2↑ (solfato di zinco)
lo zinco, più elettropositivo dell'idrogeno, tende a cedergli i suoi elettroni. L'idrogeno diventa neutro e si libera come gas H2, mentre lo zinco diventa un catione e sostituisce l'idrogeno nell'acido trasformandolo in un sale. Gli acidi tendono dunque ad attaccare i metalli più elettropositivi dell'idrogeno, corrodendoli.
b) sale + metallo → sale + metallo
ZnSO4 + 2Na → Na2SO4 + Zn (solfato di sodio)
il sodio, più elettropositivo dello zinco, lo sostituisce nel sale, cedendogli i suoi elettroni e trasformandosi in ione sodio. Si libera zinco metallico.
La salificazione può avvenire infine per doppio scambio tra un acido e un sale e tra due sali.
c) acido + sale → sale + acido
H2SO4 + CaCO3 → H2CO3 + CaSO4 (solfato di calcio)
L'acido forte (acido solforico) sposta l'acido debole (acido carbonico) dai suoi sali (carbonati). Il processo è legato al diverso grado di dissociazione dei due acidi. Infatti lo ione carbonato, prodotto dalla dissociazione del carbonato di sodio, tende a ridare l'acido carbonico indissociato utilizzando gli ioni H+ provenienti dalla dissociazione dell'acido solforico.
d) sale + sale → sale + sale
NaCl + AgNO3 → AgCl ↓ + NaNO3
Mentre il cloruro di sodio e il nitrato di argento sono molto solubili, il cloruro di argento è poco solubile. gli ioni Ag+ e Cl- presenti in soluzione tendono perciò a precipitare sotto forma di cloruro di argento, mentre in soluzione rimane il nitrato di sodio.
Sali basici
Oltre ai sali neutri e ai sali acidi esistono anche sali basici. Essi si formano quando in una reazione tra un idrossido ed un acido (o un'anidride) l'idrossido non si dissocia completamente e nella molecola del sale sono quindi presenti uno o più gruppi ossidrili
Mg(OH)2 + HCl → MgOHCl + H2O (cloruro monobasico di magnesio)
Bi(OH)3 + HNO3 → Bi(OH)2NO3 + H2O nitrato bibasico di bismuto)
Dissociazione dei Sali
Come abbiamo già detto la maggior parte dei sali sono elettroliti forti e in acqua si dissociano completamente negli ioni costituenti.
Per scrivere correttamente la dissociazione di un sale è necessario riconoscere nella molecola gli anioni provenienti dall'acido e i cationi provenienti dalla base, con i rispettivi indici e cariche elettriche.
A destra della freccia di reazione verranno perciò scritti il catione e l'anione, ciascuno con le rispettive cariche, preceduti da un coefficiente pari all'indice con cui compaiono nel sale.
Ad esempio se vogliamo dissociare il carbonato di sodio Na2CO3, scriveremo
Na2CO3 → 2Na+ + CO32-
E' necessario quindi sapere che il sodio è presente con nox +1, mentre l'anione proviene dall'acido carbonico H2CO3 e quindi è l'anione bivalente carbonato CO32- (anche senza riconoscere l'acido era comunque possibile dedurre la carica dell'anione notando che è necessario un anione per neutralizzare due ioni Na+). L'indice 2 del sodio nel sale diventa poi il suo coefficiente come ione dissociato.
Proviamo ora a dissociare l'ortofosfato biacido di calcio Ca(H2PO4)2
Ca(H2PO4)2 → Ca2+ + 2H2PO4-
Anche qui è necessario sapere che il calcio è presente con nox +2, mentre l'anione proviene dall'acido ortofosforico H3PO4 e quindi è l'anione monovalente fosfato biacido H2PO4- (anche senza riconoscere l'acido era comunque possibile dedurre la carica dell'anione notando che sono necessari due anioni per neutralizzare lo ione positivo Ca2+). L'indice 2 dell'anione solfato biacido nel sale diventa poi il suo coefficiente come ione dissociato.
Sali idratati
Alcuni sali formano solidi cristallini in cui è presente acqua di cristallizzazione secondo proporzioni ben definite. Tali sali si dicono idratati. L'acqua di cristallizzazione viene scritta dopo la molecola del sale, separata da un punto.
CuSO4.H2O solfato rameico pentaidrato
SrCl2.6H2O cloruro di stronzio esaidrato
CaSO4. 2H2O solfato di calcio biidrato (gesso)
Sali doppi
I sali doppi si possono considerare come formati dall'unione di due sali semplici che presentano l'anione in comune e cationi diversi o, più raramente, il catione in comune e anioni diversi. I sali doppi mantengono in soluzione le stesse caratteristiche analitiche dei sali semplici da cui provengono.
In altre parole un sale può essere considerato doppio quando posto in soluzione si dissocia negli stessi ioni in cui si dissocerebbero i sali semplici da cui proviene se fossero posti in soluzione.
Sali doppi con l'anione in comune
K2Mg(SO4)2 → 2K+ + Mg2+ + 2SO42- (solfato doppio di K e Mg)
si ottiene la stessa soluzione sciogliendo separatamente il solfato di potassio, K2SO4 ed il solfato di magnesio MgSO4.
Sali doppi con il catione in comune
Piuttosto rari. Sono sali di questo tipo i minerali noti come apatiti.
Ca5F(PO4)3 → 5Ca2+ + F- + 3PO43- (fluorofosfato di calcio o fluoroapatite)
Sali doppi con catione e anione diversi
Estremamente rari. un esempio è il minerale kainite
KMgCl(SO4). 3H2O (clorosolfato di potassio e magnesio triidrato)
Sali complessi
Si definiscono complessi quei sali che dissociandosi formano ioni diversi rispetto a quelli che si formano dalla dissociazione dei sali semplici che li formano.
Ad esempio se dissociamo separatamente il cloruro di sodio NaCl ed il cloruro platinico PtCl4, si ottiene
NaCl → Na+ + Cl-
PtCl4 → Pt4+ + 4Cl-
ma se mescoliamo le due soluzioni si ottiene un sale complesso, l'esacloroplatinato di sodio Na2PtCl6, il quale non è un sale doppio, ma un sale complesso in quanto si dissocia in
Na2PtCl6 → 2Na+ + PtCl62-
La soluzione presenta quindi caratteristiche diverse da quelle delle soluzioni dei sali semplici
I sali complessi dissociandosi possono dar luogo ad un anione complesso (come nell'esempio precedente), ad un catione complesso o ad entrambi.
Sali con anioni complessi
Si conoscono molti sali con anioni complessi derivati dagli idracidi.
HgI3- anione triiodomercurato
BF4- anione tetrafluoborato
SiF62- anione esafluosilicato
AuCl4- anione tetracloroaurato
SnCl62- anione esaclorostannato
PtCl62- anione esacloroplatinato
Fe(CN)63- anione esacianoferrato o ferricianuro
Fe(CN)64- anione esacianoferrito o ferrocianuro
Tutti questi sali possono essere considerati come derivati da acidi complessi, alcuni dei quali sono in grado di esistere allo stato libero come
HBF4 acido fluoborico
HAuCl4 acido cloroaurico
H2SiF6 acido fluosilicico
H4Fe(CN)6 acido ferrocianidrico
Tali acidi si possono ottenere
a) per reazione tra un alogenuro (un sale di un acido alogenidrico) e l'acido alogenidrico corrispondente
AuCl3 + HCl → HAuCl4
SiF4 + 2HF → H2SiF6
b) spostando l'acido dai suoi sali, mediante trattamento con un acido forte
K2CS3 + 2HNO3 → 2KNO3 + H2CS3 (acido solfocarbonico o tritiocarbonico)
Un gruppo particolarmente numeroso di sali complessi sono i solfosali, che si formano per reazione tra solfuri metallici e solfuri di semimetalli.
Na2S + CS2 → Na2CS3 (solfocarbonato o tritiocarbonato sodico)
Lo zolfo, che appartiene allo stesso gruppo chimico dell'ossigeno, presenta per certi versi una chimica ad esso parallela. La reazione tra il solfuro di sodio e il solfuro di carbonio, ad esempio, è analoga a quella
che avviene tra un ossido e un'anidride. Se sostituiamo lo zolfo con l'ossigeno otteniamo infatti la reazione
Na2O + CO2 → Na2CO3
Così i solfuri metallici possono essere pensati come solfoossidi, mentre i solfuri dei semimetalli come solfoanidridi. La loro reazione produce dei solfosali.
3CaS + As2S5 → Ca3(AsS4)2 solfoarseniato (o tetratioarseniato) di calcio
3CaO + As2O5 → Ca3(AsO4)2 arseniato di calcio
Analogamente si possono ottenere solfoarseniti (o tritioarseniti) come Na3AsS3, solfoantimoniti (o tritioantimoniti) come Na3SbS3, solfostannati (o tritiostannati) come Na2SnS3 etc.
Sali con cationi complessi
Anche se meno numerosi, esistono anche sali che presentano cationi complessi. Se ad esempio viene aggiunta dell'ammoniaca NH3, ad una soluzione satura di cloruro di argento AgCl (sale poco solubile), il precipitato si scioglie per la formazione del catione complesso
Ag(NH3)2+ ione diammino argento
Il sale complesso in soluzione sarà quindi il cloruro di diammino argento Ag(NH3)2Cl
Cationi complessi si formano ad esempio ogni volta che un sale ferrico viene sciolto in acqua. Il Fe3+ forma infatti con sei molecole d'acqua il catione complesso
Fe(H2O)63+ ione esaacquoferrico
responsabile del colore porpora delle soluzioni dei sali ferrici.
Il colore giallastro, molto comune nelle soluzioni dei sali ferrici, è prodotto dalla sostituzione di una molecola d'acqua con un ossidrile
Fe(OH)(H2O)52+ ione pentaacquo idrossi ferrico
Naturalmente si possono formare anche sali in cui sia l'anione che il catione sono complessi, come
Co(NH3)3(H2O)3Fe(CN)6 esacianoferrato (o ferricianuro) di triammino-triacquo-cobalto
Cu(NH3)43(AsS4) tetratioarseniato tetraamminorameico
Cr(NH3)4Cl2Pt(NH3)Cl3 monoammino-tricloro-platinito tetrammino-dicloro-cromico
Composti complessi e agenti complessanti
Sali e acidi complessi appartengono ad un vasto gruppo di composti detti "complessi". In generale un composto complesso si forma quando ad un atomo o ad un catione metallico centrale si legano, con legami di tipo dativo, più molecole di una sostanza detta "complessante", avente una o più coppie di elettroni non condivisi da impegnare. Gli agenti complessanti, detti anche "leganti", sono anioni o sostanze neutre.
Si dice che il catione centrale "coordina" intorno a sé le molecole leganti. Per questo motivo i composti complessi sono anche detti composti di coordinazione.
I più comuni leganti anionici sono
Legante Prefisso
F- fluoro-
Cl- cloro-
Br- bromo-
I- iodio-
S2- tio- (solfo-)
CN- ciano- (CN)
NC- isociano- (NC)
SCN- tiocianato- (SCN)
NCS- isotiocianato- (NCS)
OH- idrossi-
O2- osso- (oxo-)
NO2- nitrito- (ONO)
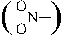
|
NO2- nitro-
SO42- solfato-
I più comuni leganti neutri sono
H2O acquo-
NH3 ammino-
NO nitrosil- (NO)
CO carbonil- (CO)
I cationi che più facilmente formano complessi sono quelli che presentano le più elevate densità di carica (ione piccolo con carica elevata). Il numero di leganti che un catione è in grado di coordinare è detto numero di coordinazione dello ione complessante.
Il numero di coordinazione di gran lunga più frequente è il 6. Abbastanza comuni anche il 2 e il 4. Molto più rari i numeri dispari.
Il numero di coordinazione di un catione è quasi sempre pari al doppio del suo nox più elevato.
Ad esempio
il Ferro (nox +2, +3) presenta numero di coordinazione 6
il Rame (nox +1, +2) presenta numero di coordinazione 4
l'Argento (nox +1) presenta numero di coordinazione 2
il Cobalto (nox +2, +3) presenta numero di coordinazione 6
I complessi esacoordinati sono ottaedrici
I complessi tetracoordinati sono tetraedrici o quadrati planari
I complessi bicoordinati sono lineari
Ad esempio si ritiene che nello ione complesso esammino cromico, Cr(NH3)63+, lo ione Cr3+, che presenta la seguente configurazione superficiale
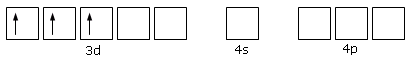
formi 6 orbitali ibridi sp3d2, per i quali la teoria VSEPR prevede appunto una disposizione ottaedrica.
Questi 6 orbitali vuoti sarebbero dunque disponibili per formare 6 legami dativi con altrettante molecole di ammoniaca.
regole convenzionali per la scrittura di un complesso
1) prima si scrive il metallo (agente complessante)
2) poi si scrivono i leganti in ordine alfabetico preceduti dal prefisso che ne indica il numero (mono-, di-, tri-, tetra- etc)
Nomenclatura dei complessi
anioni complessi: il metallo con desinenza -ato, seguito dal suo nox in numeri romani tra parentesi, secondo la notazione di Stock, codificata dalla convenzione IUPAC (International Union of Pure and Applied Chemistry) oppure, secondo la vecchia terminologia, il metallo con desinenza -ato o -ito in relazione al suo nox
Fe(CN)64- anione esacianoferrato (II) (leggi: esacianoferrato due)
oppure
anione esacianoferrito
Fe(CN)63- anione esacianoferrato (III) (leggi: esacianoferrato tre)
oppure
anione esacianoferrato
cationi complessi: il metallo seguito dal suo nox in numeri romani tra parentesi, secondo la notazione di Stock, codificata dalla convenzione IUPAC oppure, il metallo con desinenza -oso o -ico, in relazione al suo nox
Cu(NH3)42+ ione tetraammino rame (II)
oppure
ione tetraamminorameico
Stechiometria
La stechiometria (dal gr. stoikeion = elemento, sostanza fondamentale) è lo studio delle relazioni numeriche e dei rapporti ponderali che intercorrono tra le sostanze chimiche durante le reazioni.
Bilanciamento delle reazioni chimiche
Le equazioni chimiche sono la rappresentazione simbolica delle reazioni chimiche, cioè dei processi in cui una o più sostanze, dette reagenti, si trasformano in altre, dette prodotti di reazione.
Un'equazione in cui compaiano a sinistra del segno di reazione () le formule dei reagenti e a destra le formule dei prodotti di reazione, ha solamente significato qualitativo.
Affinché la reazione acquisti anche un significato quantitativo, in modo da permettere il calcolo delle quantità delle sostanze che partecipano alla reazione, è necessario che la reazione venga bilanciata.
Bilanciare una reazione significa porre dinanzi alla formula di ciascuna sostanza un numero, detto coefficiente stechiometrico, in modo che ogni elemento compaia a destra e a sinistra del segno di reazione con lo stesso numero di atomi (bilancio di massa) e venga così soddisfatto il principio di conservazione della massa.
Per bilanciare una reazione non vi sono regole precise, ma in genere è opportuno seguire i seguenti criteri:
1) Si bilancia inizialmente un elemento che non sia l'idrogeno o l'ossigeno.
2) se bilanciando tale elemento si modifica qualche altro elemento, si procede subito al suo bilanciamento
3) bilanciati tutti gli elementi, si procede a bilanciare l'idrogeno ed infine l'ossigeno
Bilanciamo ad esempio la seguente reazione
Fe2(CO3)3 + HNO3 ® Fe(NO3)3 + H2CO3
Iniziamo bilanciando il ferro:
poiché vi è un atomo di ferro tra i prodotti di reazione e 2 tra i reagenti, moltiplichiamo per 2 il nitrato ferrico ponendogli davanti un coefficiente "2".
Fe2(CO3)3 + HNO3 ® 2Fe(NO3)3 + H2CO3
in tal modo abbiamo modificato anche il numero di atomi di azoto tra i prodotti di reazione che ora sono 6. Poiché tra i reagenti vi è un solo atomo di azoto, poniamo un coefficiente "6" davanti all'acido nitrico
Fe2(CO3)3 + 6HNO3 ® 2Fe(NO3)3 + H2CO3
Ora sia il ferro che l'azoto sono bilanciati. Bilanciamo il carbonio. Vi sono 3 atomi di carbonio tra i reagenti e 1 tra i prodotti di reazione. Poniamo quindi un coefficiente "3" davanti all'acido carbonico
Fe2(CO3)3 + 6HNO3 ® 2Fe(NO3)3 + 3H2CO3
Verifichiamo l'idrogeno. 6 atomi tra i reagenti, 6 atomi tra i prodotti di reazione. L'idrogeno è bilanciato.
Verifichiamo l'ossigeno. 27 atomi tra i reagenti, 27 tra i prodotti di reazione. L'equazione è bilanciata!
Una volta che l'equazione è bilanciata siamo in grado di effettuare considerazioni di tipo quantitativo sulla reazione.
Nel caso della reazione appena bilanciata possiamo ad esempio affermare che una molecola di carbonato ferrico Fe2(CO3)3 necessita di 6 molecole di acido nitrico HNO3 per reagire e che da tale reazione si producono 2 molecole di nitrato ferrico Fe(NO3)3 e 3 di acido carbonico H2CO3.
Inoltre, a seguito della proporzionalità esistente tra numero di molecole e numero di moli, i coefficienti stechiometrici rappresentano contemporaneamente anche il numero di moli di ciascuna sostanza, coinvolte nella reazione chimica.
Ciò è fondamentale poiché ci permette di trasformare i rapporti numerici in proporzioni ponderali, consentendoci di calcolare le quantità in peso che partecipano alle reazioni chimiche.
Ad esempio, dopo aver calcolato il peso molare delle diverse specie chimiche,
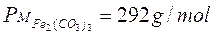
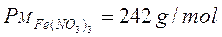
possiamo calcolare quanti grammi di ciascun composto partecipano alla reazione chimica, moltiplicando il peso molare di ciascuno per il numero di moli con cui ciascuna sostanza compare nella reazione.
Possiamo in definitiva affermare che 292 g di carbonato ferrico (1 mole x 292 g/mol) reagiscono con 378 g di acido nitrico (6 moli x 63 g/mol) per dare 484 g di nitrato ferrico (2 moli x 242 g/mol) e 186 g di acido carbonico (3 moli x 62 g/mol).
Reazioni di ossidoriduzione
Ossidazione - Un elemento chimico si ossida quando, durante una reazione, il suo numero di ossidazione aumenta. Una reazione di ossidazione comporta quindi un trasferimento di elettroni. Un atomo che si ossida perde tanti elettroni quanti sono indicati dalla variazione del suo numero di ossidazione (Δnox).
Riduzione - Un elemento chimico si riduce quando, durante una reazione, il suo numero di ossidazione diminuisce. Una reazione di riduzione comporta quindi un trasferimento di elettroni. Un atomo che si riduce acquista tanti elettroni quanti sono indicati dalla variazione del suo numero di ossidazione (Δnox).
E' allora evidente che quando, durante una reazione chimica, un elemento si ossida, perdendo elettroni, dovrà esistere un altro elemento che, acquistandoli, si riduce. Le reazioni di ossidazione e di riduzione devono perciò necessariamente avvenire contemporaneamente. Si parla pertanto di reazioni di ossidoriduzione o di reazioni redox.
Bilanciare una reazione redox è più complicato che bilanciare una reazione in cui non vi è trasferimento di elettroni.
In generale per bilanciare una reazione redox è necessario porre davanti agli elementi che si ossidano e che si riducono dei coefficienti tali da garantire l'eguaglianza tra il numero di elettroni persi da un elemento ed il numero di elettroni acquistati dall'altro (bilancio degli elettroni).
Le reazioni redox possono essere proposte in due modi: in forma molecolare o in forma ionica netta.
Strategia di bilanciamento delle reazioni redox in forma molecolare
Prima di procedere al bilanciamento è ovviamente necessario verificare che la reazione sia effettivamente una "redox". E' cioè necessario verificare che almeno due elementi abbiano subito durante la reazione dei cambiamenti nei numeri di ossidazione.
Ciò risulta particolarmente evidente quando un elemento si trova da un lato della linea di reazione allo stato elementare (nox = 0) e dall'altro si trova legato all'interno di un composto (nox ≠ 0).
In tutti gli altri casi è necessario calcolare i numeri di ossidazione, scrivendo i numeri di ossidazione variati sopra i rispettivi elementi.
0 -2 -3 0
N2 + H2O → NH3 + O2
1) Calcolo elettroni ceduti/acquistati. Si uniscono con una freccia gli atomi dell'elemento che si ossida e con un'altra gli atomi dell'elemento che si riduce, individuando in tal modo le semireazioni di ossidazione e di riduzione. In corrispondenza di ciascuna freccia si scrive il numero di elettroni persi ed acquistati, calcolato come prodotto tra la variazione (in aumento o in diminuzione) del numero di ossidazione (Δnox), ed il numero di atomi (indice) dell'elemento che reagisce.
Nell’esempio che segue:
- l’Azoto diminuisce il suo nox (riduzione) passando da 0 a -3 con una variazione di 3 elettroni (Δnox = 3) che, moltiplicati per i 2 atomi di azoto presenti in N2, cioè per l’indice dell’elemento che si riduce, danno 6 elettroni acquistati
- L’ossigeno aumenta il suo nox (ossidazione) pssando da -2 a 0, con una variazione di 2 elettroni che, moltiplicati per l’unico atomo di Ossigeno presente in H2O, cioè per l’indice dell’elemento che si ossida, danno 2 elettroni ceduti
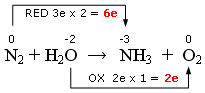
In altre parole i due atomi di azoto che si riducono, acquistando ciascuno 3 elettroni, catturano complessivamente 6 elettroni, mentre l'atomo di ossigeno presente nell'acqua, che si ossida, perde in tutto due elettroni.
2) Scrittura semireazioni e bilancio di massa - Si scrivono le due semireazioni di riduzione e di ossidazione. Si bilanciano gli elementi che si ossidano e che si riducono (bilancio di massa). Nel caso in cui il bilancio di massa implichi una variazione del coefficiente che precede un reagente è necessario moltiplicare per lo stesso numero anche gli elettroni trasferiti nella semireazione, aggiornando il numero di elettroni persi o acquistati.
N2 + 6e → NH3
(riduzione)
H2O → O2 + 2e
(ossidazione)
In questo caso:
- aggiungiamo un 2 davanti all’ammoniaca per bilanciare l’Azoto
N2 + 6e → 2NH3
- aggiungiamo un 2 davanti all’acqua per bilanciare l’Ossigeno e aggiorniamo a 4 gli elettroni persi durante la semireazione di ossidazione (ogni molecola d’acqua cede infatti 2 elettroni, 2 molecole d’acqua ne cedono 4)
2H2O → O2 + 4e
3) Calcolo del rapporto di scambio elettronico e bilancio elettronico - Si calcola il rapporto di scambio elettronico tra la specie che si riduce e quella che si ossida (rapporto tra elettroni acquistati ed elettroni ceduti). In questo caso il rapporto sarà 6/4 = 3/2. In altre parole per ogni 3 elettroni assorbiti dalla semireazione di riduzione, 2 elettroni vengono ceduti dalla semireazione di ossidazione. Si utilizzano numeratore e denominatore del rapporto di scambio per moltiplicare, in croce, entrambi i membri delle due semireazioni.. In altre parole si usa il numero trovato in una semireazione per moltiplicare l’altra (e viceversa) in modo che siano bilanciati (minimo comune multiplo) gli elettroni trasferiti (bilancio elettronico).
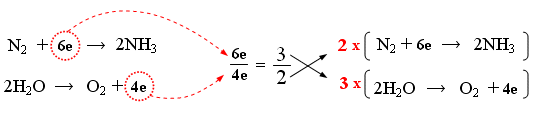
Infatti 2 molecole biatomiche di azoto acquistano complessivamente 12 elettroni, mentre i 6 atomi di ossigeno presenti nelle 6 molecole di acqua perdono complessivamente 12 elettroni.
Sommando membro a membro le due semireazioni si ottiene infine la reazione bilanciata
2N2 + 12e → 4NH3
6H2O → 3O2 + 12e

2N2 + 6H2O → 4NH3 + 3O2
Bilanciamento con numeri di ossidazione frazionari
I numeri di ossidazione frazionari sono numeri di ossidazione medi.
Nel caso dell’ottossido di triwolframio (W3O8), ad esempio, due atomi di Wolframio presentano nox +6, mentre il terzo presenta nox +4. Ciascun atomo di Wolframio ha dunque un numero di ossidazione medio pari +16/3.
1) Calcolo elettroni ceduti/acquistati.
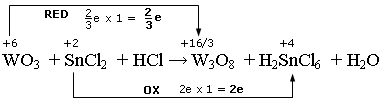
La variazione nel numero di ossidazione del Wolframio è Δnox = 6 - 16/3 = 2/3.
Ovviamente in questo caso la variazione nel numero di ossidazione non ha significato fisico (un atomo di Wolframio non può acquistare 2/3 di un elettrone), ma può essere comunque utilizzata per il bilanciamento.
2) Scrittura semireazioni e bilancio di massa
Scriviamo e bilanciamo le semireazioni
WO3 + 2e/3 → W3O8
(riduzione)
SnCl2 → H2SnCl6 + 2e
(ossidazione)
Lo Stagno è già bilanciato. Bilanciamo il Wolframio ed aggiorniamo il numero di elettroni acquistati da 3 atomi di Wolframio
3WO3 + 6e/3 → W3O8
che equivale a
3WO3 + 2e → W3O8
Il rapporto di scambio elettronico è 2/2 = 1. Le due semireazioni sono già bilanciate per quel che riguarda il numero di elettroni scambiati (la semireazione di ossidazione cede 2 elettroni, tanti quanti ne acquista la semireazione di riduzione).
Sommiamo membro a membro le due semireazioni
3WO3 + 2e → W3O8
SnCl2 → H2SnCl6 + 2e

3WO3 + SnCl2 → W3O8 + H2SnCl6
Aggiungiamo le altre specie chimiche che partecipavano alla reazione, ma che non avevano variato il loro numero di ossidazione.
3WO3 + SnCl2 + HCl → W3O8 + H2SnCl6 + H2O
e completiamo il bilanciamento
3WO3 + SnCl2 + 4HCl → W3O8 + H2SnCl6 + H2O
Reazioni redox di dismutazione o disproporzionamento
Si definiscono dismutazioni (o reazioni di ossidoriduzione interna) quei particolari processi redox in cui il trasferimento di elettroni avviene tra molecole di un medesimo composto. Un medesimo elemento è soggetto sia ad una riduzione che ad un’ossidazione.
Nell'esempio che segue, alcune molecole di ipoclorito si riducono a cloruro, altre si ossidano a clorato
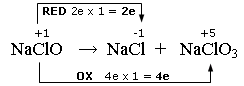
Scriviamo e bilanciamo le semireazioni
NaClO + 2e → NaCl
NaClO → NaClO3 + 4e
Il cloro è già bilanciato in entrambe le semireazioni.
Il rapporto di scambio elettronico è 2/4 = 1/2, pertanto moltiplichiamo rispettivamente per 2 e per 1 le due semireazioni per bilanciare gli elettroni scambiati
2 x ( NaClO + 2e → NaCl ) = 2NaClO + 4e → 2NaCl
1 x (NaClO → NaClO3 + 4e) = NaClO → NaClO3 + 4e
sommiamo membro a membro
2NaClO + 4e → 2NaCl
NaClO → NaClO3 + 4e

3NaClO → NaClO3 + 2NaCl
Ogni tre molecole di ipoclorito che dismutano, due si riducono a cloruro ed una si ossida a ipoclorito.
Redox con più di due elementi che variano il nox
In reazioni redox complesse in cui più di due elementi variano il loro numero di ossidazione risulta più conveniente eseguire il bilancio elettronico aggiornando i coefficienti solo per i reagenti. Si sommano quindi le due semireazioni e si esegue successivamente il bilancio di massa aggiornando i coefficienti anche dei prodotti di reazione
Esempio 1)
Si consideri la seguente reazione
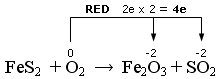
FeS2 + O2 → Fe2O3 + SO2
Qui abbiamo due elementi che si ossidano. Il Ferro che passa da ferroso (+2) a ferrico (+3) e lo Zolfo che passa da -1 a + 4.
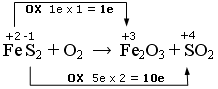
Nell’altra semireazione l’Ossigeno si riduce passando da 0 a -2
Scriviamo la semireazione di ossidazione
FeS2 → Fe2O3 + SO2 + 11e
ossidazione
Scriviamo la semireazione di riduzione
O2 + 4e → Fe2O3 + SO2
riduzione
Il rapporto di scambio elettronico è 11/4. Eseguiamo il bilancio elettronico moltiplicando per 4 i reagenti della semireazione di ossidazione e per 11 i reagenti della semireazione di riduzione.
4FeS2 → Fe2O3 + SO2 + 44e
11O2 + 44e → Fe2O3 + SO2
Combiniamo le due semireazioni
4FeS2 + 11O2→ Fe2O3 + SO2
ed ora completiamo il bilancio di massa aggiornando i coefficienti dei prodotti.
Bilanciamo il Ferro
4FeS2 + 11O2→ 2Fe2O3 + SO2
e poi lo Zolfo
4FeS2 + 11O2→ 2Fe2O3 + 8SO2
Esempio 2)
Si consideri la seguente reazione
Na2CO3 + C + N2 → CO + NaCN
In questo caso vi sono due elementi che si riducono. L’Azoto che passa da 0 a -3 ed il Carbonio del carbonato che passa da +4 a +2
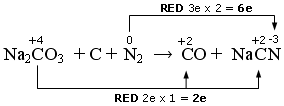
Nell’altra semireazione il Carbonio elementare si ossida passando da 0 a +2.
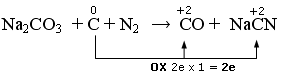
Scriviamo la semireazione di riduzione
Na2CO3 + N2 + 8e → NaCN
riduzione
Scriviamo la semireazione di ossidazione
C → CO + NaCN + 2e
osidazione
Il rapporto di scambio elettronico è 8/2 = 4/1. Eseguiamo il bilancio elettronico moltiplicando per 1 i reagenti della semireazione di riduzione e per 4 i reagenti della semireazione di riduzione
1Na2CO3 + N2 + 8e → NaCN
4C → CO + NaCN + 8e
Combiniamo le due semireazioni
Na2CO3 + N2 + 4C → CO + NaCN
ed ora completiamo il bilancio di massa aggiornando i coefficienti dei prodotti.
Bilanciamo il Sodio
Na2CO3 + N2 + 4C → CO + 2NaCN
ed infine l’Ossigeno
Na2CO3 + N2 + 4C → 3CO + 2NaCN
Strategia di bilanciamento di reazioni redox in forma ionica netta
Spesso le reazioni redox vengono rappresentate in forma ionica netta, riportando solo gli ioni e le molecole indissociate nelle quali avviene un cambiamento del numero di ossidazione ed eventualmente, se necessario ioni H+, OH- e molecole di H2O a seconda che la reazione avvenga in ambiente acido, basico o neutro.
Quando una redox viene proposta in forma ionica è necessario specificare se essa decorre in ambiente acido, basico o neutro. Più correttamente, se la reazione decorre in ambiente acido dovrebbe comparire uno ione H+ sopra la freccia di reazione, mentre se decorre in ambiente basico dovrebbe comparire uno ione OH- sopra la freccia di reazione.
La strategia di bilanciamento prevede
- bilancio elettroni (conservazione degli elettroni scambiati)
- bilancio cariche (conservazione della carica elettrica)
- bilancio masse (conservazione della massa)
Esempio 1 – redox in forma ionica in ambiente acido
I- + MnO4- 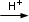 I2 + Mn2+
I2 + Mn2+
1) si scrivono i numeri di ossidazione e si individuano le semireazioni di ossidazione e di riduzione. Si calcola il numero di elettroni persi ed acquistati, come variazione del valore dei numeri di ossidazione (Δnox), moltiplicato per il numero di atomi (indice) dell’elemento che reagisce. Nell’esempio il Manganese diminuisce il suo nox (riduzione) da +7 a +2, con una variazione di 5 elettroni, mentre lo Iodio passa da -1 a 0 (ossidazione) con una variazione di 1 elettrone

2) Si scrivono le semireazioni di ossidazione e di riduzione. Si bilanciano gli elementi che si ossidano e si riducono e, se necessario, si aggiornano gli elettroni trasferiti. Nell’esempio che segue dobbiamo bilanciare lo Iodio ed aggiornare a 2 il numero di elettroni persi durante la semireazione di ossidazione (1 elettrone per ciascun atomo di Iodio)
2I- → I2 + 2e
(ossidazione)
MnO4- + 5e → Mn2+
(riduzione)
3) Si esegue il bilancio di carica per ogni semireazione con ioni H+ (ambiente acido) e, se necessario, si aggiungono molecole di acqua per ribilanciare la massa eventualmente squilibratasi. Si determina quindi il rapporto di scambio elettronico, (rapporto tra elettroni persi ed elettroni acquistati),
La semireazione di ossidazione è già a posto in quanto presenta due cariche negative tra i reagenti e due cariche negative tra i prodotti (i due elettroni)
2I- → I2 + 2e
2 cariche Θ 2 cariche Θ
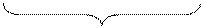
La semirazione di riduzione presenta 6 cariche negative tra i reagenti (uno ione e 5 elettroni) e 2 cariche positive tra i prodotti.
MnO4- + 5e → Mn2+
1 carica Θ 5 cariche Θ 2 cariche Å
6 cariche Θ
Aggiungiamo 8 ioni H+ tra i reagenti per bilanciare la carica e 4 molecole d’acqua tra i prodotti per ribilanciare la massa
8H+ + MnO4- + 5e → Mn2+ + 4H2O
Il rapporto di scambio elettronico tra le due semireazioni è 2/5 (per ogni 2 elettroni persi dalla semireazione di ossidazione vi sono 5 elettroni acquistati dalla semireazione di riduzione)
4) Si usa rapporto di scambio elettronico per il bilancio degli elettroni. Si usa il numero di elettroni trovato in una semireazione per moltiplicare l’altra (e viceversa) in modo che siano bilanciati gli elettroni trasferiti. Si sommano quindi le due semireazioni
(2I- → I2 + 2e) x 5 = 10I- → 5I2 + 10e
(8H+ + MnO4- + 5e → Mn2+ + 4H2O) x 2 = 16H+ + 2MnO4- + 10e → 2Mn2+ + 8H2O

10I- + 2MnO4- + 16H+→ 5I2 + 2Mn2+ + 8H2O
5) Nel caso tutti i coefficienti siano divisibili per un medesimo numero, si esegue la semplificazione.
Esempio 2 – redox in forma ionica in ambiente basico
MnO4- + NH3 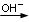 MnO2 + NO3-
MnO2 + NO3-
1) si scrivono i numeri di ossidazione e si individuano le semireazioni di ossidazione e di riduzione. Si calcola il numero di elettroni persi ed acquistati, come variazione del valore dei numeri di ossidazione (Δnox), moltiplicato per il numero di atomi (indice) dell’elemento che reagisce. In questo caso si tratta di una redox in cui il Manganese (nox = +7) si riduce, diminuendo il suo numero di ossidazione a +4 (Δnox = 3e) e l’Azoto (-3) si ossida, aumentando il suo numero di ossidazione a +5 (Δnox = 8e).
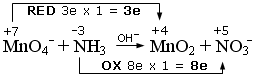
2) si scrivono le semireazioni di ossidazione e di riduzione Si bilanciano gli elementi che si ossidano e si riducono e, se necessario, si aggiornano gli elettroni trasferiti. Nell’esempio che segue sia l’Azoto che il Manganese risultano già bilanciati.
NH3 → NO3- + 8e
(ossidazione)
MnO4- + 3e → MnO2
(riduzione)
Si esegue il bilancio di carica per ogni semireazione con ioni OH- (ambiente basico) e, se necessario, si aggiungono molecole di acqua per ribilanciare la massa eventualmente squilibratasi. Si determina quindi il rapporto di scambio elettronico, (rapporto tra elettroni persi ed elettroni acquistati),
La semireazione di ossidazione presenta 9 cariche negative tra i prodotti e nessuna carica tra i reagenti
NH3 → NO3- + 8e
 1 carica Θ 8 cariche Θ
1 carica Θ 8 cariche Θ
9 cariche Θ
Aggiungiamo 9 ioni OH- tra i reagenti per bilanciare la carica e 6 molecole d’acqua tra i prodotti per ribilanciare la massa
9OH- + NH3 → NO3- + 6H2O + 8e
La semirazione di riduzione presenta 4 cariche negative tra i reagenti (uno ione e 3 elettroni) e nessuna carica tra i prodotti.
MnO4- + 3e → MnO2
1 carica Θ 3 cariche Θ
4 cariche Θ
Aggiungiamo 4 ioni OH- tra i prodotti per bilanciare la carica e 2 molecole d’acqua tra i reagenti per ribilanciare la massa
MnO4- + 2H2O + 3e → MnO2 + 4OH-
Il rapporto di scambio elettronico tra le due semireazioni è 8/3 (per ogni 8 elettroni persi dalla semireazione di ossidazione vi sono 3 elettroni acquistati dalla semireazione di riduzione)
4) Usiamo il rapporto di scambio elettronico per il bilancio degli elettroni. Si usa il numero di elettroni trovato in una semireazione per moltiplicare l’altra (e viceversa) in modo che siano bilanciati gli elettroni trasferiti. Si sommano quindi le due semireazioni
(9OH- + NH3 → NO3- + 6H2O + 8e) x 3 = 27OH- + 3NH3 → 3NO3- + 18H2O + 24e
(MnO4- + 2H2O + 3e → MnO2 + 4OH-) x 8 = 8MnO4- + 16H2O + 24e → 8MnO2 + 32OH-

= 8MnO4- + 3NH3 → 8MnO2 + 3NO3- + 5OH- + 2H2O
5) Nel caso tutti i coefficienti siano divisibili per un medesimo numero, si esegue la semplificazione (in questo caso non è necessario).
Esempio 3 – Dismutazione in forma ionica in ambiente basico
P4 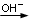 H2PO2- + PH3
H2PO2- + PH3
1) si scrivono i numeri di ossidazione e si individuano le semireazioni di ossidazione e di riduzione. Si calcola il numero di elettroni persi ed acquistati, come variazione del valore dei numeri di ossidazione (Δnox), moltiplicato per il numero di atomi (indice) dell’elemento che reagisce. In questo caso si tratta di una dismutazione in cui il Fosforo elementare (nox = 0) si ossida, aumentando il suo numero di ossidazione a +1 (Δnox = 1e) e si riduce a -3, diminuendo il suo numero di ossidazione a -3 (Δnox = 3e).
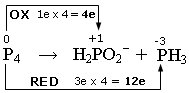
2) si scrivono le semireazioni di ossidazione e di riduzione Si bilanciano gli elementi che si ossidano e si riducono e, se necessario, si aggiornano gli elettroni trasferiti.
P4 → H2PO2- + 4e
(ossidazione)
P4 + 12e → PH3
(riduzione)
bilanciamo gli atomi di Fosforo
P4 → 4H2PO2- + 4e
P4 + 12e → 4PH3
3) Si esegue il bilancio di carica per ogni semireazione con ioni OH- (ambiente basico) e, se necessario, si aggiungono molecole di acqua per ribilanciare la massa eventualmente squilibratasi. Si determina quindi il rapporto di scambio elettronico, (rapporto tra elettroni persi ed elettroni acquistati),
La semireazione di ossidazione presenta 8 cariche negative tra i prodotti e nessuna carica tra i reagenti
P4 → 4H2PO2- + 4e
4 cariche Θ 4 cariche Θ

8 cariche Θ
Aggiungiamo 8 ioni OH- tra i reagenti per bilanciare la carica. La massa ora risulta bilanciata senza aggiungere acqua.
P4 + 8OH- → 4H2PO2- + 4e
La semireazione di riduzione presenta 12 cariche negative tra i reagenti e nessuna carica tra i prodotti
P4 + 12e → 4PH3
12 cariche Θ
Aggiungiamo 12 ioni OH- tra i prodotti per bilanciare la carica e 12 molecole d’acqua tra i reagenti per ribilanciare la massa
P4 + 12H2O + 12e → 4PH3 + 12OH
rapporto di scambio elettronico: 4/12 = 1/3
4) Usiamo il numero trovato in una semireazione per moltiplicare l’altra (e viceversa) in modo che siano bilanciati gli elettroni trasferiti (bilancio elettronico). Si sommano quindi le due semireazioni
(P4 + 8OH- → 4H2PO2- + 4e) x 3 = 3P4 + 24OH- → 12H2PO2 + 12e
(P4 + 12H2O + 12e → 4PH3 + 12OH-) x 1 = P4 + 12H2O + 12e → 4PH3 + 12OH

4P4 + 12OH- + 12H2O → 12H2PO2- + 4PH3
5) Nel caso tutti i coefficienti siano divisibili per un medesimo numero, si esegue la semplificazione. Dividiamo entrambi i membri dell’equazione chimica per 4
P4 + 3OH- + 3H2O → 3H2PO2- + PH3
Trasformazione di una redox proposta in forma molecolare in una redox in forma ionica
Per trasformare una reazione redox molecolare in forma ionica:
- Si attribuisce ad ogni atomo il nox e si verifica in quali elementi esso subisca una variazione.
- Si eliminano tutte le molecole i cui atomi mantengano il nox invariato durante la reazione
- Le molecole rimanenti, i cui atomi abbiano subito variazioni di nox, vengono dissociate se si tratta di sali, acidi ed idrossidi. Non si dissociano in genere le molecole biatomiche dei gas ed i composti binari come ossidi, anidridi, perossidi, idruri etc.
- Si osserva in quale ambiente avviene la reazione (acido, basico o neutro), per poter poi effettuare correttamente il bilancio di carica. In particolare si verifica se tra i composti sono presenti acidi o basi.
- Si riportano nella reazione solo le molecole e gli ioni, ottenuti dalla dissociazione, che contengano atomi che abbiano subito variazioni di nox.
Esempio 1
Proviamo ad esempio a trasformare in forma ionica la seguente redox scritta in forma molecolare
K2Cr2O7 + KI + HNO3 → KNO3 + Cr(NO3)3 + I2 + H2O
Assegniamo i numeri di ossidazione ed individuiamo le specie chimiche i cui atomi abbiano subito variazioni di nox
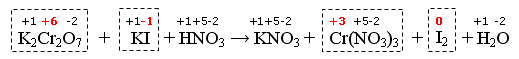
Il Cromo e lo Iodio sono gli elementi che variano il nox durante la reazione
Eliminiamo le specie chimiche che non contengono Cromo e Iodio
K2Cr2O7 + KI → Cr(NO3)3 + I2
dissociamo, se possibile, le rimanenti
K2Cr2O7 → 2K+ + Cr2O72-
KI → K+ + I-
Cr(NO3)3 → Cr3+ + 3NO3-
riportiamo nella reazione solo le molecole e gli ioni, ottenuti dalla dissociazione, che contengano Cromo e Iodio
Cr2O72- + I- → Cr3+ + I2
L’ambiente è acido per presenza di HNO3, per cui quando si effettuerà il bilancio di carica dovranno essere introdotti ioni H+.
La reazione scritta in forma ionica netta è la seguente
Cr2O72- + I- 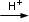 Cr3+ + I2
Cr3+ + I2
Bilanciamola.
Scriviamo la semireazione di riduzione del Cromo. Ciascun atomo di Cromo acquista 3 elettroni passando da un nox = +6 ad un nox = +3. Dunque i due atomi di Cromo dell’anione bicromato acquistano complessivamente 6 elettroni
Cr2O72- + 6e → Cr3+
Eseguiamo il bilancio di massa del cromo
Cr2O72- + 6e → 2Cr3+
Eseguiamo il bilancio di carica.
Ci sono 8 cariche negative tra i reagenti e 6 positive tra i prodotti. Aggiungiamo dunque 14 ioni H+ tra i reagenti
14H+ + Cr2O72- + 6e → 2Cr3+
Ribilanciamo la massa aggiungendo 7 molecole di acqua tra i prodotti
14H+ + Cr2O72- + 6e → 2Cr3+ + 7H2O
Scriviamo ora la semireazione di ossidazione dello Iodio. Ciascun atomo di Iodio perde 1 elettrone passando da un nox = -1 ad un nox = 0.
I- → I2 + 1e
eseguiamo il bilancio di massa dello Iodio aggiornando il numero di elettroni persi
2I- → I2 + 2e
La carica è già bilanciata essendoci due cariche negative sia tra i reagenti che tra i prodotti.
Il rapporto di scambio elettronico è di 6/2 = 3/1. Moltiplichiamo dunque per 1 la semireazione di riduzione e per 3 la semireazione di ossidazione
(14H+ + Cr2O72- + 6e → 2Cr3+ + 7H2O) x 1 = 14H+ + Cr2O72- + 6e → 2Cr3+ + 7H2O
( 2I- → I2 + 2e) x 3 = 6I- → 3I2 + 6e
Sommiamo membro a membro le due semireazioni ed otteniamo
Cr2O72- + 6I- + 14H+ → 2Cr3+ + 3I2 + 7H2O
A questo punto possiamo utilizzare i coefficienti trovati per scrivere l’equazione completa in forma molecolare
K2Cr2O7 + 6KI + 14HNO3 → KNO3 + 2Cr(NO3)3 + 3I2 + 7H2O
Si può notare come tra i prodotti di reazione manchino 7 ioni K+ e 7 ioni NO3-. Aggiungiamo dunque un coefficiente 8 davanti al nitrato di potassio
K2Cr2O7 + 6KI + 14HNO3 → 8KNO3 + 2Cr(NO3)3 + 3I2 + 7H2O
Ciò equivale ad aver aggiunto 14 ioni spettatori (ioni che non partecipano alla redox) alla reazione.
Esempio 2
Al(s) + HNO3(aq) → Al(NO3)3(aq) + NH3(g) + H2O
Dalle notazioni di fase (i pedici che indicano lo stato fisico delle specie che partecipano alla reazione) deduciamo che l’acido nitrico si trova in soluzione acquosa e quindi la reazione avviene in ambiente acido. Individuiamo gli elementi che variano il loro numero di ossidazione.
0 +5 +3 -3
Al(s) + HNO3(aq) → Al(NO3)3(aq) + NH3(g) + H2O
L’Alluminio e l’Azoto sono gli elementi che variano il nox durante la reazione
Eliminiamo le specie chimiche che non contengono Alluminio e azoto
Al + HNO3 → Al(NO3)3 + NH3
dissociamo, se possibile, le rimanenti
HNO3 → H+ + NO3-
Al(NO3)3 → Al3+ + 3NO3-
riportiamo nella reazione solo le molecole e gli ioni, ottenuti dalla dissociazione, che contengano Alluminio e Azoto. Tenendo tuttavia conto del fatto che l’anione nitrato in parte si riduce ad ammoniaca ed in parte rimane inalterato, possiamo escluderlo dai prodotti di reazione (in quanto come prodotto di reazione non partecipa alla redox).
Al + NO3- → Al3+ + NH3
Scriviamo la semireazione di ossidazione dell’Alluminio. Ciascun atomo di Alluminio perde 3 elettroni passando da un nox = 0 ad un nox = +3.
Al → Al3+ + 3e
La semireazione è già bilanciata in massa (un atomo di alluminio per parte) e carica (nessuna carica tra i reagenti; 3 cariche positive + 3 negative = carica nulla tra i prodotti).
Scriviamo la semireazione di riduzione dell’Azoto. Ciascun atomo di Azoto acquista 8 elettroni passando da un nox = +5 ad un nox = -3.
NO3- + 8e → NH3
La semireazione è già bilanciata in massa (un atomo di Azoto per parte).
Eseguiamo il bilancio di carica. Ci sono 9 cariche negative tra i reagenti e nessuna carica tra i prodotti. Aggiungiamo dunque 9 ioni H+ tra i reagenti
9H+ +NO3- + 8e → NH3
Ribilanciamo la massa aggiungendo 3 molecole di acqua tra i prodotti
9H+ +NO3- + 8e → NH3 +3H2O
Il rapporto di scambio elettronico è di 3/8. Effettuiamo dunque il bilancio elettronico, moltiplicando per 8 la semireazione di ossidazione e per 3 la semireazione di riduzione.
(Al → Al3+ + 3e) x 8 = 8Al → 8Al3+ + 24e
(9H+ +NO3- + 8e → NH3 + 3H2O ) x 3 = 27H+ + 3NO3- + 24e → 3NH3 + 9H2O
Sommiamo membro a membro
8Al + 3NO3- + 27H+ → 8Al3+ + 3NH3 + 9H2O
A questo punto possiamo utilizzare i coefficienti trovati per scrivere l’equazione completa in forma molecolare
8Al + 27HNO3 → 8Al(NO3)3 + 3NH3 + 9H2O
Si noti come si siano aggiunti 24 ioni NO3- spettatori tra i reagenti e 24 tra i prodotti di reazione.
Rapporti ponderali: calcolo delle quantità che reagiscono
Ricordando che i coefficienti stechiometrici di un'equazione chimica bilanciata rappresentano, in scala macroscopica, il numero di moli delle sostanze che reagiscono è allora possibile determinare i rapporti in peso, o rapporti ponderali, tra le specie chimiche.
Ricordiamo che il numero di moli (n) di una sostanza chimica è pari al suo peso in grammi (W), diviso il suo peso molare (PM)
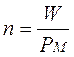
Se dunque dobbiamo calcolare a quanti grammi corrispondono 2,7 moli di anidride carbonica CO2, dopo aver calcolato il peso molare consultando la tabella periodica (PM = Peso atomico carbonio + 2 volte il Peso atomico dell'ossigeno = 12 + 2 x 16 = 44), si avrà
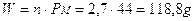
Esempi di calcolo ponderale
1) Data la reazione
CH4 + 2O2 ® CO2 + 2H2O
Calcolare quanta acqua si forma bruciando 1 Kg di metano.
Dopo aver determinato il peso molare del metano (16 g) ed il peso molare dell'acqua (18g), li moltiplichiamo per i rispettivi coefficienti stechiometrici definendo in tal modo il rapporto in peso in cui reagiscono i due composti, pari a 16/36. In altre parole per ogni 16 grammi di metano che reagiscono si formano 36 grammi di acqua.
Possiamo allora impostare la seguente proporzione
16 : 36 = 1000 : x
che risolta ci da il seguente risultato: x = 2250 g
2) data la reazione
FeS + 2HCl ® FeCl2 + H2S
calcolare quanti grammi di cloruro ferroso si formano facendo reagire 100 g di solfuro ferroso con 80 g di acido cloridrico. Calcolare quale dei due reagenti non si consuma completamente e quanto ne rimane alla fine della reazione.
Il peso molare del solfuro ferroso FeS è 87,85 g, dell'acido cloridrico HCl 36,45 g ( 2 moli peseranno allora 2 x 36,45 = 72,9 g) , del cloruro ferroso FeCl2 126,75 g
Verifichiamo allora se 100 g di FeS reagiscono effettivamente con 80 g di HCl, impostando la seguente proporzione
87,85 : 72.9 = 100 : x
da cui x = 82,98 g di acido cloridrico
Ciò significa che 100 grammi di FeS reagiscono con 82,98 g di HCl. Ma nel sistema sono presenti solo 80 g di HCl. Ne deduciamo che non tutti i 100 g di FeS sono in grado di reagire, mentre l'acido cloridrico reagirà completamente. L'acido cloridrico rappresenta la specie chimica limitante.
Vediamo allora quanti grammi di FeS reagiscono con 80 g di HCl, impostando la seguente proporzione
87,85 : 72,9 = y : 80
da cui y = 96,41 g di FeS
Alla fine della reazione troveremo perciò che 100 - 96,41 = 3,59 g di FeS non hanno reagito.
Per calcolare ora quanto FeCl2 si forma possiamo impostare una proporzione partendo indifferentemente dal peso di HCl (80g) o di FeS (96,41 g) che reagiscono. Le due proporzioni sono le seguenti
72,9 : 126,75 = 80 : z
87,85 : 126,75 = 96,41 : z
da cui z = 139,1 g di FeCl2.
Stato gassoso
Lo stato di aggregazione di una sostanza, solido, liquido o aeriforme, dipende, oltre che dal tipo e dall'intensità delle forze intermolecolari, dai valori che assumono la pressione P, la temperatura T ed il volume V. Per questo motivo tali grandezze sono dette variabili di stato.
Nello stato gassoso le distanze tra le molecole risultano molto elevate, poiché le particelle possiedono energia cinetica sufficiente a vincere le forze di attrazione intermolecolari e sono perciò in grado di separarsi. Il moto caotico delle particelle allo stato gassoso determina il fenomeno della diffusione, per il quale un gas occupa sempre tutto lo spazio a sua disposizione e presenta per questo motivo forma e volume del recipiente che lo contiene.
Il Volume è definito come la porzione di spazio occupata da un corpo. Esso viene misurato in m3 ed in chimica, più spesso in litri (L).
La Temperatura misura la capacità di un corpo di dare sensazioni di caldo e freddo. Più precisamente essa è una misura dell'energia cinetica media delle particelle che costituiscono un corpo.
La temperatura si misura in
1) gradi centigradi o Celsius (°C)
2) gradi assoluti o Kelvin (K)
3) gradi Fahreneit (°F).
La scala Celsius (t) è convenzionalmente costruita assegnando al ghiaccio fondente la temperatura di 0 °C e all'acqua bollente la temperatura di 100 °C.
La scala delle temperature assolute (T) è costruita partendo dalla constatazione che la più bassa temperatura Celsius corrisponde a -273,15°C. Poiché non sono possibili temperature inferiori, tale valore rappresenta lo zero assoluto delle temperature.
La scala delle temperature assolute si ottiene quindi traslando l'origine della scala Celsius dagli 0°C a -273,15°C.
E' evidente quindi che per trasformare i gradi Celsius in gradi Kelvin è sufficiente utilizzare la seguente relazione di conversione
T = t + 273,15
Così, ad esempio, lo zero della scala Celsius corrisponde a 273,15 K, mentre l'acqua bolle a 373,15 K.
Nella scala Fahreneit al ghiaccio fondente è assegnata convenzionalmente una temperatura di 32 °F, mentre all'acqua bollente è assegnata convenzionalmente la temperatura di 212 °F . A differenza della scala centigrada dunque, dove tale intervallo è diviso in 100 gradi, nella scala Fahreneit è suddiviso in 180 gradi. Un grado Fahreneit risulta perciò più piccolo di un grado centigrado. |
La temperatura determina la direzione del flusso di calore.
La Pressione si definisce come il rapporto tra una forza e la superficie sulla quale la forza agisce.
Le unità di misura della pressione sono molteplici. Le più utilizzate sono
a) Chilogrammo su centimetro quadrato (kg/cm2)
b) Atmosfera (atm). E' definita come la pressione esercitata dall'atmosfera terrestre sul livello del mare (slm), a 0°C, a 45° N, con un'umidità relativa pari allo 0% .
1 atm = 760 mm di Hg ( o torr) = 1,033 kg/cm2
c) Pascal (Pa). Nel Sistema Internazionale SI è la forza esercitata da 1 N (newton) sulla superficie di m2. ( 1 newton è la forza che, applicata alla massa di 1 Kg produce un'accelerazione di 1 m/s2).
d) Bar. Nel sistema cgs è la forza esercitata da 106 dine su 1 cm2. ( 1 dina è la forza che, applicata alla massa di 1 g produce un'accelerazione di 1 cm/s2).
1 atm = 1,013 Bar = 101.300 Pascal
Si definiscono condizioni normali (c.n.) o standard di temperatura e pressione (STP), la temperatura di 0 °C e la pressione di 1 atm.
Le leggi dei gas
Le ricerche sperimentali effettuate sullo stato aeriforme (a partire dai lavori di Robert Boyle verso la metà del Seicento) hanno dimostrato che se un gas è sufficientemente rarefatto e/o possiede una temperatura sufficientemente elevata, il suo comportamento fisico risulta indipendente dalla sua natura chimica. In altre parole, tutti i gas che si trovano sufficientemente distanti dal loro punto di liquefazione si comportano allo stesso modo e possono essere descritti mediante un unico formalismo matematico.
E' cioè possibile trattare le particelle che compongono il gas (molecole o atomi che siano) come punti materiali le cui interazioni dipendono esclusivamente dal loro numero per unità di volume e dalla loro energia cinetica media, trascurando le forze intermolecolari che dipendono evidentemente dalla loro natura chimica.
Tale approccio verrà in effetti completamente sviluppato e formalizzato solo nella seconda metà dell'Ottocento con la Meccanica statistica, attraverso la teoria cinetico- molecolare dei gas.
E' comunque possibile descrivere il comportamento fisico dei gas senza ricorrere ad una descrizione della dinamica delle interazioni molecolari, limitandosi a formulare le relazioni che legano le variabili macroscopiche o variabili di stato: pressione, volume e temperatura.
Tali relazioni sono note come leggi dei gas perfetti.
Un gas perfetto è un gas ideale in cui gli urti delle particelle sono perfettamente elastici, ciascuna particella non occupa virtualmente volume (particella puntiforme) e non vi sono forze intermolecolari che vincolino in alcun modo il moto delle molecole. E' evidente che un gas perfetto in realtà non esiste, si tratta solo di un'utile astrazione. Ma in opportune condizioni di rarefazione i gas reali possono avvicinarsi in modo accettabile a tale modello ideale.
Le leggi dei gas perfetti sono 4. Le prime tre sono state ottenute mantenendo costante una delle tre variabili di stato ed osservando sperimentalmente la relazione esistente nelle variazioni delle due rimanenti. La quarta legge mette invece in relazione contemporaneamente tutte e tre le variabili di stato in un'unica equazione.
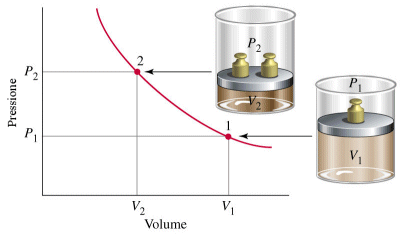
Legge di Boyle
(relazione tra P e V con T costante)
Nel 1662 Boyle dimostrò che mantenendo costante la temperatura il volume di una data massa di gas è inversamente proporzionale alla pressione esercitata su di esso.
P1.V1 = P2.V2 = K
ed in definitiva
PV = K
La curva che si ottiene ponendo in ascisse il volume ed in ordinata la temperatura è naturalmente un ramo di iperbole equilatera detta isoterma. Naturalmente effettuando l'esperimento a diverse temperature si ottengono diverse isoterme. Aumentando la temperatura l'isoterma si sposta verso l'esterno.
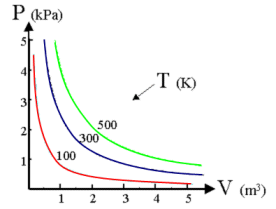
Legge di Charles o 1a legge di Gay-Lussac
(relazione tra V e T con P costante)
Nel 1787 il francese J.A.C. Charles dimostrò che gas diversi mantenuti a pressione costante subiscono la stessa dilatazione quando vengono portati da 0°C a 100°C.
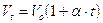 |
Nel 1802 Gay-Lussac, riprendendo le esperienze di Charles, giunge a formulare una relazione che lega il Volume alla temperatura
dove
a = è il coefficiente di espansione e vale 1/273
Vt = Volume alla temperatura di t°C
Vo = Volume alla temperatura di 0°C
In altre parole, mantenendo costante la pressione, ogni aumento di 1° della temperatura produce un aumento del volume pari ad 1/273 del volume che il gas occupava alla temperatura di 0°C.
Infatti
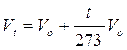
dove si osserva che il volume alla temperatura di t°C (Vt) è pari al volume alla temperatura di 0°C (Vo) aumentato di un valore pari a t/273 del volume Vo.
La relazione precedente può essere scritta
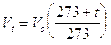
e ricordando che 273 + t = T
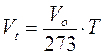
Poiché infine il volume a pressione costante (P = K) e alla temperatura di 0°C assume sempre lo stesso valore, il rapporto Vo/273 è una costante.
Se quindi esprimiamo la temperatura in gradi assoluti, la legge di Gay-Lussac afferma che il volume a t°C è direttamente proporzionale alla temperatura assoluta. Il valore della costante di proporzionalità dipende ovviamente dalla pressione alla quale facciamo l'esperimento e dalla quantità di gas che si prende in considerazione.
La relazione che lega il Volume alla Temperatura a Pressione costante è dunque di proporzionalità diretta ed è quindi rappresentabile tramite una retta di pendenza Vo/273.
Se in ascissa poniamo la temperatura centigrada la retta incontra l'asse delle ordinate in Vo. e quello delle ascisse in -273. Se in ascissa poniamo la temperatura assoluta la retta attraversa l'origine. La retta ottenuta è detta 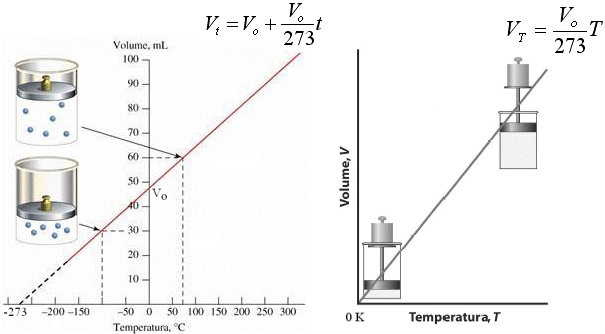
Naturalmente i valori espressi dalla retta hanno significato solo fino ad una certa temperatura, al di sotto della quale il gas si liquefa e diventa in pratica incomprimibile. Facendo comunque proseguire idealmente la retta (linea tratteggiata) si raggiunge lo zero assoluto (-273°C) al di sotto del quale si otterrebbe il risultato assurdo di un volume negativo della materia.
2a legge di Gay-Lussac
(relazione tra P e T a V costante)
Analogamente a quanto avviene nella prima legge di Gay-Lussac, la pressione di un gas a volume costante è direttamente proporzionale alla temperatura.
Se si utilizza la temperatura centigrada si ha
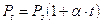
con
a = 1/273
Pt = Pressione alla temperatura di t°C
Po = Pressione alla temperatura di 0°C
In altre parole, mantenendo costante il volume, ogni aumento di 1° della temperatura produce un aumento della pressione pari ad 1/273 della pressione che il gas esercitava alla temperatura di 0°C.
Infatti
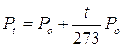
dove si osserva che la pressione alla temperatura di t°C (Pt) è pari alla pressione alla temperatura di 0°C (Po) aumentata di un valore pari a t/273 della pressione Po.
Anche in questo caso, esprimendo la temperatura in gradi Kelvin si ottiene una retta passante per l'origine, detta isocora, di equazione
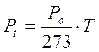
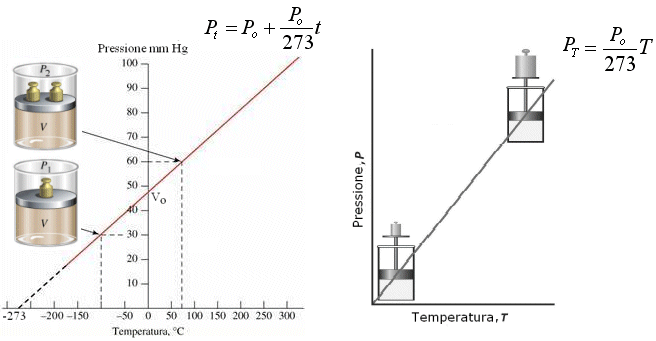
Equazione di stato dei gas perfetti (Clapeyron)
Le tre leggi dei gas possono combinarsi in un'unica relazione in cui compaiono contemporaneamente tutte e tre le variabili di stato. L'equazione è dovuta al francese Clapeyron (1834).
Si consideri 1 mole di un gas qualsiasi e le due isoterme di 0°C e di t°C.
Consideriamo ora i tre punti A, B e C posti sulle isoterme e le trasformazioni A→B e B→C
1) La trasformazione A→B, avvenendo a pressione Po costante è una trasformazione isobara per la quale vale la relazione Vt = Vo(1 + at)
2) la trasformazione B→C, avvenendo a temperatura t costante è una isoterma per la quale vale la relazione PV = PoVt.
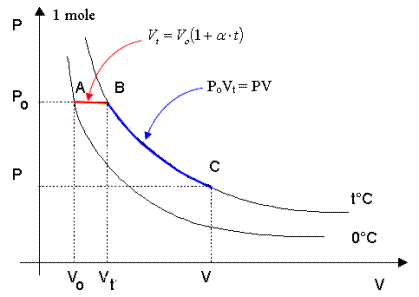
sostituendo ora nella seconda il valore Vt ricavato dalla prima si ottiene
PV = PoVo(1+ at)
da cui 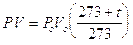
e quindi 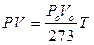
Poiché Po e Vo sono la pressione e il volume alla temperatura costante di 0°C, il loro prodotto è, per la legge di Boyle, costante e quindi anche la quantità 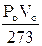 è costante.
è costante.
Ricordando che 1 mole di qualsiasi gas a 0°C e ad 1 atmosfera occupa sempre 22,414 L, se poniamo Po = 1 atm, Vo sarà appunto pari a 22,414 L ed il rapporto, noto come costante universale dei gas R, varrà
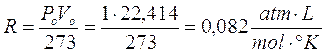
Ricordiamo che se esprimiamo la pressione in Pascal ed il volume in m3 (sistema SI) R vale
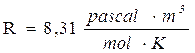
mentre nel sistema cgs R vale
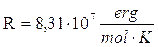
Per una mole di gas l'equazione di stato diventa dunque
PV = RT
Per n moli il volume Vo ad 1 atmosfera e 0°C non sarà evidentemente 22,414 L, ma sarà pari ad n volte 22,414 L e l'equazione diverrà
PV = nRT
Equazione di stato dei gas reali (van der Waals)
Il modello di gas perfetto è basato, come abbiamo visto, sulle seguenti due ipotesi:
i. Le molecole del gas sono sferette rigide puntiformi
ii. L’energia di interazione tra le molecole è nulla
Vedremo come il venire meno di queste ipotesi influenzi il comportamento di un gas reale. Per analizzare il comportamento non ideale di un gas reale si può esaminare il fattore di comprimibilità Z
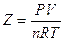
Per il gas perfetto Z = 1, infatti, dalla legge generale del gas perfetto, il rapporto tra PV ed nRT è eguale ad 1.
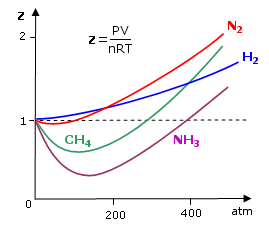
Tutti i gas reali si comportano in modo anomalo, ma tendono all'ideale (Z = 1) quando P tende a 0 e quando la loro T è alta. Per la maggior parte dei gas il rapporto di comprimibilità tende ad essere minore di 1 a basse pressioni. Questo vuol dire che quel dato gas reale è più comprimibile di quanto lo sarebbe un gas perfetto e ciò fa pensare all’esistenza di forze intermolecolari di tipo attrattivo tali da favorire la compressione del gas.
Un fattore di comprimibilità maggiore di 1 (tipicamente ad alte pressioni) è invece indice della presenza di forze intermolecolari repulsive a corto raggio d’azione tali da opporsi alla compressione.
Aumentando la temperatura i minimi delle curve diventano sempre meno marcati, finché per temperature sufficientemente elevate (il cui valore esatto dipende dal gas) il fattore di comprimibilità è sempre maggiore di 1.
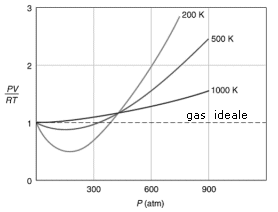
Abbiamo visto che i gas reali soddisfano l’equazione di stato del gas perfetto quando si verificano una delle due (o entrambe) le condizioni seguenti
i. Bassa densità: P → 0
ii. Alta temperatura
I gas reali non sempre si comportano idealmente, specialmente a basse temperature e/o ad alte pressioni. I motivi di questa deviazione dalla idealità sono determinati:
- dalla presenza di forze di interazione tra le particelle (forze di van der Waals);
- dalle reali dimensioni fisiche delle particelle per cui nei gas reali il volume materialmente occupato dalle molecole non è trascurabile rispetto al volume del recipiente in cui è contenuto il gas
Van der Waals modificò l’equazione di stato del gas ideale in relazione in modo da tener conto delle due differenze essenziali fra gas ideale e gas reale:
Covolume
Se n moli di gas reale occupano il volume V, il volume in cui le molecole possono liberamente muoversi non è V ma è la differenza fra V e la parte di V materialmente occupata dall’insieme delle molecole che costituiscono le n moli. Se b è il volume materialmente occupato dalle molecole che costituiscono una mole di gas, indicato come covolume, il volume realmente disponibile per il movimento delle molecole presenti nelle n moli di gas reale è (V – nb). Il volume proprio delle molecole gassose (covolume) diventa apprezzabile in confronto al volume del recipiente quando la densità del gas in molecole per unità di volume (n/V) è elevata. Essendo n/V = P/RT, ciò si verifica ad alte pressioni e/o a basse temperature. Pertanto è:
V(ideale) = V(reale) – n×b
Forze intermolecolari
La pressione misurata sperimentalmente per un gas reale risulta sempre minore del valore ricavato dall’equazione dei gas ideali. La differenza è tanto più evidente quanto maggiore è la densità del gas, cioè ad alte pressioni e/o basse temperature.
Aumentare la pressione comporta una riduzione della distanza media tra le particelle e quindi un aumento delle forze di interazione.
Diminuire la temperatura significa rendere le molecole più lente e quindi più sensibili alle deboli forze di interazione.
Se due molecole di un gas reale vengono progressivamente avvicinate, insorgono dapprima forze attrattive, poi, al diminuire della distanza, diventano sensibili le forze repulsive che, successivamente, equilibrano e superano le forze attrattive. Nel campo di applicabilità dell’equazione di van der Waals, le distanze fra le molecole sono tali che si è sempre nel campo delle forze attrattive.
Ancora una volta, le mutue forze di attrazione intermolecolari (che vedremo più in dettaglio in seguito) diventano sensibili quando la densità del gas in molecole per unità di volume (n/V) è elevata. In queste condizioni l’affollamento è maggiore e la distanza tra le molecole minore.
Le forze di attrazione intermolecolare diminuiscono la frequenza degli urti contro le pareti del recipiente e quindi la pressione reale esercitata dal gas risulta minore di quella ideale. La coesione molecolare rallenta le molecole più esterne della massa gassosa, rendendone con ciò meno frequenti e in media meno violenti gli urti contro le pareti.
All’interno del fluido l’attrazione reciproca tra le molecole è mediamente la stessa in tutte le direzioni e quindi il suo effetto complessivo è trascurabile, mentre negli strati in prossimità delle pareti del recipiente non è così perché la compensazione viene a mancare.
Quindi per le molecole che sono in prossimità della parete si ha una forza netta diretta verso l’interno che diminuisce la pressione che avrebbe il gas in approssimazione di gas perfetto.
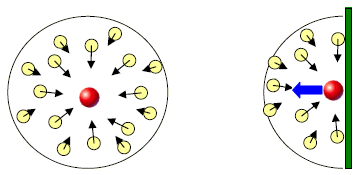
Van der Waals dimostrò che la diminuzione della pressione ideale è direttamente proporzionale al quadrato della densità del gas.
P(ideale) – a×(n/V)2 = P(reale)
Il termine a (n/V)2 è noto come pressione interna o pressione di coesione
La pressione dipende dalla frequenza di collisione con il recipiente e dall’efficacia dell’urto.
Poiché le attrazioni rallentano le molecole il loro effetto sarà duplice: le molecole colpiranno infatti le pareti del recipiente con una frequenza più bassa e con minor energia.
Entrambi gli effetti risultano proporzionali alla concentrazione del gas (n /V), pertanto la riduzione della pressione è proporzionale al quadrato della concentrazione molare.
L’equazione di stato dei gas ideali (Clapeyron)
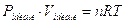
viene dunque modificata secondo van der Waals in
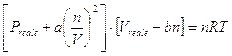
I parametri a e b sono caratteristici di ogni gas e vengono misurati sperimentalmente. Una stima del parametro b è fornita dalla misura del volume molare del composto allo stato liquido.
Si noti che, se il gas è molto rarefatto, cioè se il volume è grande, i termini correttivi introdotti diventano trascurabili e l’equazione di van der Waals tende all’equazione di stato del gas perfetto. Il valore della pressione interna è del tutto trascurabile in rapporto a quello della pressione effettiva alle normali condizioni di pressione e temperatura, non può invece essere trascurato, neanche in valutazioni di prima approssimazione, quando la pressione diventa molto grande e la temperatura molto bassa. Per aria sotto pressione di 1 atm, la pressione interna vale solo 0,0028 atm a 0°C, e 0,0056 atm a -75°C. Ma sotto pressione di 100 atm, la pressione interna vale 26 atm a 0°C, e 84,5 atm a -75°C.
Il valore del covolume, diverso da gas a gas, si aggira mediamente attorno ai 30 cm3/mol, perciò corrisponde a circa lo 0,15% del volume occupato da una mole di gas in condizioni standard di pressione e temperatura (1 atm, 0°C). Si può ritenere che il covolume corrisponda approssimativamente al quadruplo del volume complessivo delle 6,022 1023 molecole contenute in una mole.
Diagramma di Andrews
Consideriamo il comportamento dell’anidride carbonica, le cui isoterme furono determinate da T.Andrews.
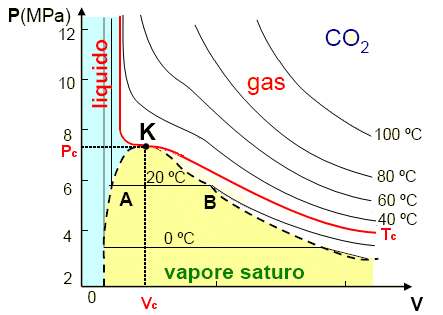
A temperature elevate (> 80 ºC) le isoterme assomigliano a quelle di un gas perfetto. A temperature più basse, le isoterme cominciano a presentare un flesso, ma la pendenza continua ad essere negativa come nel resto della curva. Queste curve, si guardi quella a 40 ºC, assomigliano ad iperboli ai valori bassi della pressione (grandi volumi). A piccoli volumi si comportano diversamente. Al decrescere del volume la pressione diventa rapidamente molto grande; la curva ha un asintoto verticale, che non è, come per l’iperbole del gas ideale, l’asse delle pressioni.
Scendendo con la temperatura si incontra un’isoterma importante, che è caratterizzata dal fatto che il flesso ha tangente orizzontale. Questa isoterma si chiama isoterma critica. Il punto del flesso (K
nella figura) è il punto critico. Le sue coordinate si dicono temperatura critica Tc, pressione critica Pc e volume critico Vc .
Per l’anidride carbonica la temperatura critica vale Tc = 31.04 ºC
Scegliamo ora una temperatura più bassa delle temperatura del punto critico, ad esempio 20 ºC nel caso dell’anidride carbonica. Partiamo da un volume molto grande, cioè da pressioni relativamente basse. Diminuendo il volume si trova che la pressione del gas aumenta, fino a quando esso non raggiunge un valore ben definito (punto B della figura). A questo punto la pressione rimane costante nonostante il volume continui a diminuire. Il punto rappresentativo dello stato percorre un tratto orizzontale a pressione costante fino ad arrivare al punto A. Dopo questo punto la pressione sale bruscamente e diviene impossibile ridurre ulteriormente il volume in maniera apprezzabile. La sostanza che a volumi più grandi si lasciava facilmente comprimere è diventata praticamente incomprimibile.
Se si abbassa ulteriormente la temperatura del gas e si ripete l’operazione, si constata che il tratto orizzontale a pressione costante è divenuto più ampio. Il tratto si allunga molto dalla parte dei volumi grandi e molto poco dalla parte dei volumi piccoli.
Nel punto B inizia la liquefazione del gas. Nel tratto AB sono presenti contemporaneamente ed in equilibrio tra loro le due fasi liquide e gassose della sostanza. Ad una data temperatura questo può avvenire ad una sola pressione, chiamata la pressione del vapor saturo o tensione di vapore. Si ricava sperimentalmente che la tensione di vapore, nelle sostanze pure, dipende solo dalla temperatura e non dalla quantità di gas utilizzata nell’esperimento, vale a dire non dipende dal volume del gas.
La temperatura Tc è la massima temperatura a cui la sostanza può trovarsi nella fase liquida. A temperature maggiori la sostanza si trova solo nello stato gassoso. Seguendo una terminologia che risale ad Andrews, il termine vapore viene usato per indicare una sostanza che si trova nello stato gassoso, ma che è al di sotto della temperatura critica, ed il termine gas per indicare una sostanza gassosa al di sopra della temperatura critica.
Per temperature superiori alla temperatura di punto critico, le curve di van der Waals descrivono abbastanza bene il comportamento del gas reale, riproducendo anche la regione del flesso che non è presente nell’equazione dei gas perfetti.
Nella regione AB della transizione di fase, le curve di van der Waals non presentano il tratto orizzontale ma hanno un andamento a S che incrocia il tratto orizzontale in tre punti. In questa regione l’equazione di van der Waals perde significato fisico.
Le coordinate del flesso a tangente orizzontale dell’isoterma critica, che corrispondono alle coordinate del punto critico del gas reale, sono correlabili ai coefficienti a e b di van der Waals.

Ciò ci consente di stimare i parametri di van der Waals misurando sperimentalmente i parametri critici (Pc, Tc, Vc) di un gas.
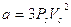
Cenni di teoria cinetica dei gas
Nella seconda metà dell'Ottocento Maxwell e Boltzmann riuscirono a formulare una descrizione coerente del comportamento della materia e dell'energia applicando una teoria chiamata Meccanica Statistica.
Il presupposto alla base della meccanica statistica è che, essendo i sistemi materiali composti da un numero enorme di elementi (atomi o molecole), non è possibile , per ragioni pratiche, applicare alle singole particelle le leggi della meccanica classica, calcolando per ciascuna la posizione, la velocità e l'energia di ciascuna particella. Pur tuttavia rimane possibile descrivere tali sistemi prendendo in considerazione i valori medi che assumono le variabili dinamiche e cinematiche in gioco.
In altre parole tale teoria è una descrizione statistica delle proprietà dinamiche e cinematiche degli aggregati di particelle che costituiscono un sistema materiale.
La meccanica statistica è giunta per tale via ad ottenere risultati di grande rilievo, riuscendo a dimostrare che le variabili macroscopiche che descrivono lo stato esteriore della materia, come il volume, la pressione e la temperatura sono collegabili alle variabili microscopiche che descrivono il comportamento dinamico delle singole particelle, come l'energia cinetica media, la frequenza degli urti tra particelle etc.
Quella parte della meccanica statistica che descrive il moto disordinato delle particelle gassose viene comunemente indicata come teoria cinetica dei gas.
La teoria cinetica si applica ai gas perfetti e vale quindi solo se sono rispettate le seguenti condizioni:
1) Il volume delle particelle (covolume) è trascurabile rispetto al volume del gas.
2) Le forze intermolecolari sono trascurabili
3) il moto caotico delle particelle produce urti reciproci e con le pareti del recipiente perfettamente elastici.
Uno dei risultati più significativi della teoria cinetica dei gas è l'aver dimostrato che la Pressione di un gas dipende dall'energia cinetica media delle particelle che lo compongono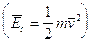 e dalla concentrazione del gas (numero di particelle per unità di volume).
e dalla concentrazione del gas (numero di particelle per unità di volume).
Per una mole di gas, composto da N molecole in un volume V, vale
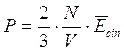
Relazione tra pressione , energia cinetica media e concentrazione delle particelle Consideriamo per semplicità una mole di un gas, ossia N molecole, contenute in un cubo di lato l, sufficientemente grande da poter trascurare gli urti reciproci tra particelle (il gas deve cioè essere sufficientemente rarefatto).Le particelle sono perciò libere di rimbalzare attraverso urti perfettamente elastici avanti e indietro tra due pareti opposte del cubo. Ricordando che essa è pari all'impulso Ft e che in questo caso t è pari ad un secondo, la forza F che le particelle esercitano su di una parete è pari a poiché la pressione P è pari al rapporto tra forza F e superficie l2, otteniamo La relazione permette di affermare che la Pressione è direttamente proporzionale al numero di particelle per unità di volume (N/l3) (concentrazione del gas) e all'energia cinetica media delle particelle. Si è ottenuta una relazione tra variabili macroscopiche (Pressione) e variabili microscopiche (concentrazione delle particelle ed energia cinetica media). |
La relazione può essere scritta anche
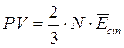
Analoga all'equazione di stato dei gas per 1 mole
PV = RT
Eguagliando i due secondi membri si ottiene
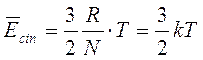
dove k è una nuova costante, detta costante di Boltzmann, pari al rapporto tra la costante dei gas R ed il numero di Avogadro N.
k = 1,3806 10-23 J/K (nel sistema SI)
k = 1,3806 10-16 erg/K (nel sistema cgs)
La relazione mette in evidenza il rapporto esistente tra un'altra variabile macroscopica, la Temperatura, ed una variabile microscopica, l'energia cinetica media delle particelle ( ).
).
La teoria cinetica dei gas dimostra per la prima volta che la temperatura di un corpo non è altro che l'espressione del moto disordinato delle sue particelle. Più precisamente possiamo affermare che la temperatura è una misura dell'energia cinetica media delle molecole che formano il gas
Attraverso la relazione precedente è ovviamente possibile calcolare la velocità quadratica media con cui si muovono delle molecole di massa nota, all'interno di un gas di temperatura T
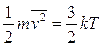
La velocità quadratica media vrms (rms = root mean square) corrisponde alla radice quadrata della media dei quadrati delle velocità delle particelle (in statistica è nota come media quadratica) ed è leggermente diversa dalla velocità media 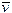 .
.
Tenendo presente che k = R/N e che la massa di una molecola si può calcolare facendo il rapporto tra il suo peso molare ed il numero di Avogadro (m = Pm/N), sostituendo opportunamente la relazione diventa
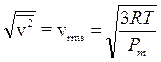
in cui utilizziamo i valori dei pesi molari, più comodi rispetto ai valori delle masse atomiche assolute (m) espresse in grammi.
L'equazione dimostra che ad una certa temperatura tutti i gas presentano la stessa energia cinetica media, ma velocità quadratica media diversa in funzione della loro massa.
Calcoliamo ad esempio la velocità quadratica media dell’Ossigeno molecolare O2 (Pm = 32 g/mol) a 20°C. Per ottenere il risultato in m/s è necessario usare tutte unità di misura del sistema internazionale. Dunque R = 8.31 Pa m3 K-1, mentre il peso molare andrà espresso in Kg/mol e dunque per l’Ossigeno sarà 32 10-3 kg/mol
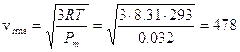 m/s
m/s
La velocità quadratica media può essere infine calcolata in funzione della pressione e della densità ρ (massa volumica) del gas.
Moltiplichiamo numeratore e denominatore sotto radice per il numero di moli n e per il volume V del recipiente, ottenendo
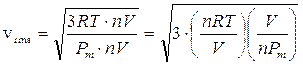
Si noti che la quantità (n·Pm)/V è il rapporto tra il peso di n moli ed il volume in cui sono contenute e rappresenta pertanto la densità ρ del gas (o massa volumica) espressa in kg/m3 (o, il che è lo stesso, in g/dm3 o g/L). La relazione diventa quindi
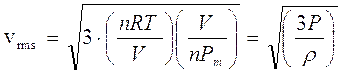
Calcoliamo ad esempio la velocità quadratica media di 3 moli di Ossigeno molecolare O2 (Pm = 32 g/mol) a 20°C contenute in un recipiente di 5L.
Anche in questo caso per ottenere il risultato in m/s è necessario usare tutte unità di misura del sistema internazionale. La pressione dell’ossigeno in pascal sarà
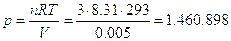 Pa
Pa
3 moli di Ossigeno pesano 3 x 32 = 96 g = 0.096 kg e quindi la densità del gas è 0.096/0.005 = 19,2 kg/m3.
Sostituendo opportunamente si avrà in definitiva
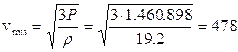 m/s
m/s
Distribuzione delle velocità - Maxwelliana
Secondo la teoria cinetica la velocità così calcolata rappresenta naturalmente solo un valore medio in quanto all'interno del gas le particelle possono assumere valori di velocità molto differenti dal valore medio.
Partendo dall'ipotesi che le particelle si scambino continuamente quantità di moto a causa dei loro urti reciproci e casuali, Maxwell dimostrò che all'interno del gas si stabilisce alla fine un equilibrio dinamico in cui è possibile calcolare la probabilità che una particella possieda una certa velocità, diversa dalla velocità media.
Maxwell ottenne così una relazione matematica, nota come funzione di distribuzione delle velocità F(v) o maxwelliana. In generale una funzione di distribuzione F(x) fornisce la frazione di oggetti che hanno la proprieta’ x. La maxwelliana fornisce dunque la frazione di molecole 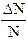 (da 0 ad 1) che possiedono una certa velocità v.
(da 0 ad 1) che possiedono una certa velocità v.
Naturalmente, essendo la frequenza una misura della probabilità (in questo caso una misura molto buona essendo le particelle molto numerose) , la relazione di Maxwell ci permette di calcolare anche la probabilità che una particella possieda una determinata velocità.
La forma di tale distribuzione dipende essenzialmente dalla massa (m) della particella e dalla temperatura assoluta T.
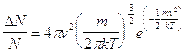
o, operando un cambio di variabile e ricordando che 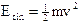
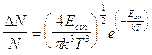
La quantità 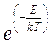 è detta fattore di Boltzmann ed è correlata alla probabilità che una particella presenti energia E.
è detta fattore di Boltzmann ed è correlata alla probabilità che una particella presenti energia E.
Tenendo presente che k = R/N ed m = Pm/N, facendo le opportune sostituzioni si ottiene
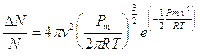
Da tale relazione è possibile ottenere, oltre alla velocità quadratica media, che coincide ovviamente con il valore che abbiamo già calcolato, anche la velocità media 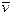
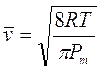
e la velocità più frequente (e quindi più probabile) che coincide con il massimo della curva (conosciuto in statistica come "moda")
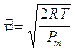
Le tre velocità presentano valori molto vicini che stanno nel seguente rapporto
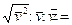 quadratica : media : moda = 1 : 0.9213 : 0.8165
quadratica : media : moda = 1 : 0.9213 : 0.8165
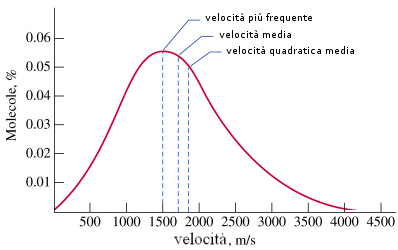
La forma e la posizione della curva rispetto agli assi dipende dai valori della temperatura e del peso molare del gas.
Possiamo ad esempio notare come la velocità più frequente (ma anche la velocità media e la velocità quadratica) sia proporzionale al rapporto T/PM.
All'aumentare del peso molare la curva si sposta verso sinistra (verso velocità minori).
Così alla temperatura di 20°C le molecole di idrogeno (Pm = 2) viaggiano ad una velocità media di 1760 m/s, le molecole di ossigeno (Pm = 32) a 440 m/s, mentre le molecole di anidride carbonica (Pm = 44) ad una velocità media di 375 m/s.
Le variazioni di temperatura producono un effetto opposto.
All'aumentare della temperatura la curva si sposta verso destra e le molecole possiedono quindi mediamente una velocità superiore.

Come si può notare i movimenti della curva in orizzontale si accompagnano a delle variazioni dell'ampiezza della curva stessa. Quando il massimo della curva si sposta verso sinistra (velocità medie basse) le particelle presentano valori di velocità meno dispersi, concentrandosi in un intervallo più ristretto. Viceversa quando il massimo della curva si sposta verso destra (velocità medie elevate) le particelle presentano valori di velocità più dispersi, distribuiti in un intervallo maggiore.
In altre parole all'aumentare della temperatura e al diminuire del peso molare aumenta la percentuale di molecole che presentano valori di velocità molto distanti dal valore medio.
In statistica il parametro che misura la dispersione dei valori intorno ai valori centrali (ampiezza della distribuzione di frequenza) è lo scarto quadratico medio (σ). Più elevato è il suo valore, più dispersi sono i valori intorno alla media.
Lo scarto quadratico medio è pari alla radice quadrata della differenza tra media quadratica e media aritmetica. Utilizzando la velocità quadratica media e la velocità media la relazione diventa
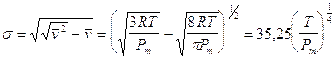
che ci conferma come la dispersione della curva aumenti all'aumentare della temperatura e al diminuire del peso molare.
Si noti infine che, poiché l'area sottesa alla curva (integrale della funzione) rappresenta il numero totale delle particelle (somma di tutte le frequenze), essa è costante ed il suo valore deve sempre essere pari ad 1.
Per questo motivo quando la dispersione aumenta la curva necessariamente si abbassa, in modo che l'area sottesa non vari.
Ciò significa che per temperature superiori e/o pesi molari inferiori diminuisce la percentuale di molecole che presentano valori di velocità vicini al valore medio.
Legge di Graham
La velocità con cui un gas fuoriesce da un foro di piccole dimensioni è inversamente proporzionale alla radice quadrata del suo peso molecolare.
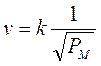
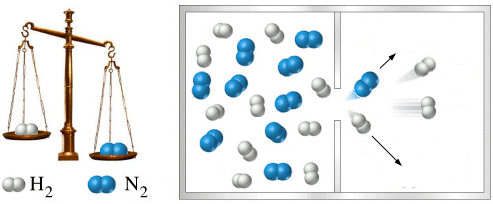
Essendo la velocità inversamente proporzionale al tempo impiegato dal gas per uscire, la legge di Graham può essere data, in forma equivalente, affermando che il tempo impiegato da un gas per diffondere attraverso un foro di piccole dimensioni è direttamente proporzionale alla radice quadrata del suo peso molecolare.
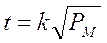
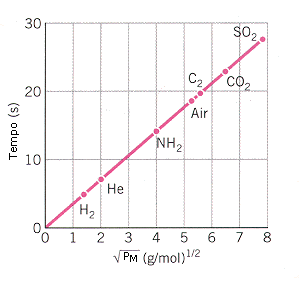
In tal modo, misurando il tempo impiegato da gas diversi per diffondere, è possibile, conoscendo il peso molecolare di uno dei due gas, calcolare il peso molecolare incognito del secondo gas
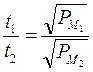
In passato tale tecnica è stata spesso usata per misurare il peso molecolare di composti volatili. Sapendo ad esempio che l’ossigeno impiega 4 volte più tempo dell’idrogeno ad uscire, se ne deduce che una molecola di Ossigeno pesa 16 volte più di una molecola di Idrogeno
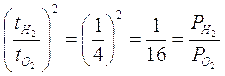
Oggi esistono gli spettrometri di massa, di gran lunga più precisi.
Un altro metodo per misurare il peso molare di un composto volatile sfrutta l'equazione di stato dei gas perfetti.
Al secondo membro si trova la costante R di cui conosciamo il valore e 4 variabili facilmente misurabili |
La legge di Graham fu ottenuta sperimentalmente, ma essa è facilmente derivabile per via teorica dalla teoria cinetica dei gas.
La velocità media delle particelle che costituiscono un gas alla temperatura T è infatti pari
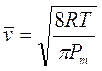
Legge di Dalton o delle pressioni parziali
Quando due o più gas vengono mescolati in un recipiente, senza che tra essi avvenga alcuna reazione, la pressione totale esercitata dalla miscela gassosa è uguale alla somma delle pressioni che ciascun componente la miscela eserciterebbe se occupasse da solo tutto il recipiente (pressione parziale del componente).
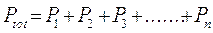
La pressione parziale di un generico componente imo sarà pari a
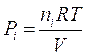
Ciascun componente gassoso si comporta dunque come fosse da solo e contribuisce alla pressione totale in proporzione al suo numero di moli.
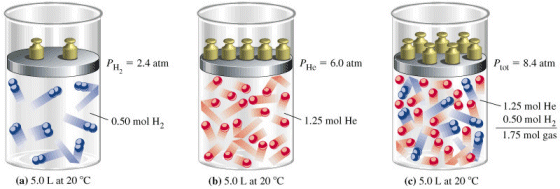
Se in un recipiente vi sono n1 moli del gas 1, n2 moli del gas 2,.....nn moli del gas n, l'effetto complessivo sarà equivalente alla presenza di n1+ n2 +......+ nn= n moli di un unico gas nel recipiente.
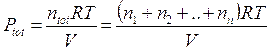
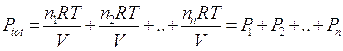
Dividendo membro a membro l'equazione di stato di ciascun componente per l'equazione di stato della miscela si ottiene
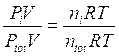
dalla quale si ricava la seguente relazione alternativa per la legge di Dalton, valida per un generico componente imo
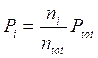
dove il rapporto 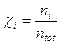 è detto frazione molare del componente imo.
è detto frazione molare del componente imo.
La legge di Dalton si esprime quindi anche dicendo che "la pressione parziale di un componente gassoso è pari al prodotto tra la sua frazione molare e la pressione totale della miscela".
Si noti che la somma di tutte le frazioni molari deve sempre necessariamente essere pari all'unità.
Temperatura critica
Tutti i gas possono essere liquefatti per compressione e/o raffreddamento. Esiste tuttavia una temperatura, detta temperatura critica, al di sopra della quale il gas non liquefa, qualunque sia la pressione alla quale viene sottoposto (per l’acqua 374 °C).
Un aeriforme che si trovi al di sopra della temperatura critica è detto gas.
Un aeriforme che si trovi al di sotto della temperatura critica è detto vapore.
Stato liquido
Nello stato liquido le distanze tra le molecole risultano estremamente ridotte. Le particelle possono infatti considerarsi praticamente addossate le une alle altre, poiché la loro energia cinetica non è sufficiente a vincere le forze di attrazione intermolecolari. Le forze intermolecolari che agiscono sulle particelle di un liquido non sono comunque abbastanza elevate da trattenere le molecole ai vertici di un reticolo cristallino, come avviene nei solidi.
Le molecole di un liquido sono quindi in continuo movimento reciproco, come quelle di un aeriforme, ma, a differenza di quanto avviene in un gas, scorrono le une sulle altre senza separarsi.
Per questo motivo i liquidi risultano praticamente incomprimibili. Essi presentano in definitiva un volume proprio, ma si adattano alla forma del recipiente che li contiene.
Il moto caotico delle particelle determina, anche nello stato liquido, il fenomeno della diffusione. Un liquido diffonde comunque più lentamente di un gas, poiché il movimento delle sue molecole risulta ostacolato dalla presenza delle molecole adiacenti.
Avendo in comune la proprietà di diffondere, liquidi e aeriformi vengono raggruppati sotto la denominazione di fluidi.
Diffusione ed entropia
La diffusione è dunque un movimento spontaneo delle particelle di un fluido da una zona dove esse si trovano più concentrate verso una zona a minor concentrazione, in modo tale da raggiungere uno stato di equilibrio dinamico in cui le differenze di concentrazione sono state annullate e tutto lo spazio occupabile dal fluido è occupato in modo omogeneo ed uniforme.
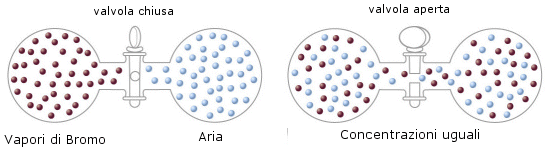
Uno dei risultati più importanti raggiunti dalla meccanica statistica è senz'altro quello di aver giustificato il fenomeno della diffusione sulla base di semplici considerazioni probabilistiche legate al moto caotico delle particelle di un fluido.
La termodinamica classica introdusse (Clausius - 1865) il concetto di entropia (II principio della termodinamica) per descrivere i fenomeni che presentano una certa direzionalità e tentare in tal modo di giustificare il verso assunto spontaneamente in natura da molte trasformazioni.
E' ad esempio noto che il calore migra sempre da un corpo caldo ad un corpo freddo e mai viceversa. Del pari non è mai possibile assistere ad un fenomeno di separazione spontanea di una goccia di inchiostro dall'acqua in cui è stato versato e si è diffuso.
Se però si tenta di spiegare questi, ed analoghi fenomeni mediante la fisica classica ci si rende presto conto che è impossibile dedurre la direzione di un fenomeno dalle leggi che descrivono il moto.
Nessuna legge della meccanica classica vieta ad esempio a tutte le particelle d'acqua tiepida di una bacinella che possiedono minor energia cinetica di dirigersi verso un punto particolare fino a formare un cubetto di ghiaccio, mentre il resto dell'acqua, privata delle particelle più lente, diventi più calda.
Il concetto di entropia venne dunque introdotto per rendere ragione del verso che i fenomeni naturali assumono spontaneamente. Definita infatti l'entropia S come il rapporto tra il calore scambiato ΔQ e la temperatura T della sorgente. Il secondo principio della termodinamica (in una delle sue numerose accezioni) afferma infatti che un sistema evolve naturalmente verso stati di equilibrio caratterizzati da un maggior contenuto entropico. In altre parole sono spontanee le trasformazioni caratterizzate da aumenti del valore dell'entropia di un sistema.
Naturalmente il principio dell'aumento dell'entropia è un postulato. Esso non spiega perché i fenomeni naturali si orientano in una certa direzione. Si limita a calcolare un grandezza che permette di prevedere la direzione di un fenomeno spontaneo.
La meccanica statistica riformula il principio di aumento dell'entropia attraverso una interpretazione di tipo meccanicistico e probabilistico, generalizzandolo a qualsiasi trasformazione spontanea e non solo a quelle in cui sono presenti trasferimenti di calore.
Abbiamo già avuto modo di dire che la meccanica statistica è in grado di mettere in relazione le grandezze macroscopiche che caratterizzano un sistema con le medie statistiche delle grandezze che caratterizzano le singole particelle.
Il valore assunto dalla variabile macroscopica è detto macrostato, mentre i valori assunti dalle grandezze che descrivono le singole particelle sono detti microstati.
Ad esempio un certo valore di temperatura T (macrostato) è la conseguenza di un numero enorme di valori dell'energia cinetica assunti da tutte le particelle (microstati).
Naturalmente uno stesso macrostato (ad esempio un certo valore di temperatura) può essere ottenuto con diverse combinazioni di microstati ( ad esempio con il 100% delle particelle che possiedono un valore di energia cinetica pari alla media o con un 50% di particelle che possiedono energia cinetica massima e 50% che possiedono energia cinetica minima).
Ciò che la meccanica statistica dimostra è che maggiore è il numero di combinazioni diverse di microstati che possono produrre un medesimo macrostato e maggiore è la probabilità che un sistema si trovi in quel particolare macrostato.
Per esemplificare quanto detto prendiamo in considerazione gli 11 risultati che si possono ottenere dal lancio di due dadi. I valori vanno da 2 (1+1) a 12 (6+6).
Essi rappresentano 11 macrostati ottenibili però con diverse combinazioni di microstati. Infatti
macrostato combinazioni possibili numero di microstati probabilità
2 (1+1) 1 1/36
3 (1+2) (2+1) 2 2/36
4 (1+3) (2+2) (3+1) 3 3/36
5 (1+4) (2+3) (3+2) (4+1) 4 4/36
6 (1+5) (2+4) (3+3) (4+2) (5+1) 5 5/36
7 (1+6) (2+5) (3+4) (4+3) (5+2) (6+1) 6 6/36
8 (3+5) (2+6) (4+4) (6+2) (5+3) 5 5/36
9 (4+5) (3+6) (6+3) (5+4) 4 4/36
10 (4+6) (5+5) (6+4) 3 3/36
11 (5+6) (6+5) 2 2/36
12 (6+6) 1 1/36
Come si può facilmente osservare (e come ben sanno tutti i giocatori) il 7 ha la maggior probabilità di uscire rispetto a tutti gli altri numeri. Il fenomeno si spiega facilmente se osserviamo come il 7 si possa ottenere in un maggior numero di modi diversi, attraverso cioè un maggior numero di combinazioni di microstati.
La meccanica statistica afferma dunque che un sistema evolve spontaneamente verso uno stato (macrostato) caratterizzato dal massimo numero possibile di diverse combinazioni di microstati poiché tale stato risulta più probabile.
Un macrostato caratterizzato da poche combinazioni di microstati è detto ordinato.
Un macrostato caratterizzato da molte combinazioni di microstati è detto disordinato.
Così, mescolando casualmente un mazzo di carte avremo pochissime probabilità di ottenere tutte le carte ordinatamente raccolte per seme, poiché tale macrostato ordinato può essere ottenuto mediante un'unica combinazione di microstati (l'asso di cuori in prima posizione, il due di cuori in seconda e così via), mentre saranno elevatissime le probabilità di trovare le carte in disordine, poiché tale macrostato, può essere ottenuto in molti modo diversi, con numerose combinazioni diverse di microstati.
In definitiva la termodinamica statistica dimostra che uno stato disordinato è più probabile di uno stato ordinato e che l'entropia non è altro che una misura di tale disordine. I processi in cui diminuisce l'entropia non sono dunque impossibili, ma solamente altamente improbabili.
Boltzmann ottenne infatti una relazione che permetteva di calcolare l'entropia (S) di un sistema sulla base del numero (n) di combinazioni di microstati attraverso il quale è possibile ottenere uno determinato macrostato
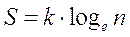
dove k è la costante di Boltzmann, pari a R/N (con R costante dei gas ed N numero di Avogadro).
In tal modo risulta ad esempio più comprensibile e meno arbitrario il terzo principio della termodinamica (principio di Nernst) che afferma che l'entropia di un solido cristallino a 0 K è nulla. Infatti un solido cristallino allo zero assoluto presenta teoricamente tutti i suoi atomi fermi ed ordinati ai vertici del reticolato solido. Tale configurazione perfettamente ordinata si può ottenere evidentemente in un sol modo ed il log 1 = 0.
Analogamente possiamo spiegare anche i fenomeni di diffusione. E' infatti evidente che uno stato in cui le molecole di un fluido si trovano concentrate in uno spazio limitato risulta più ordinato di uno stato in cui le molecole occupano, in modo casuale tutto lo spazio a disposizione. Lo stato disordinato può essere ottenuto in un numero di modi maggiore ed è per questo motivo di gran lunga più probabile.
Evaporazione e tensione di vapore
Anche le velocità (o le energie cinetiche) delle molecole che compongono un liquido possono essere descritte tramite una distribuzione di Maxwell.
Per ciascun liquido esiste un valore critico di Energia cinetica (Ec), che dipende essenzialmente dalla natura chimica della sostanza e dall'intensità delle forze intermolecolari, oltre il quale le molecole possiedono energia sufficiente per abbandonare la superficie del liquido e passare allo stato di vapore.
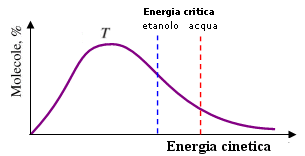
Tale processo interessa solo le molecole sufficientemente energetiche che si trovano sulla superficie del liquido ed è detto evaporazione.
Aumentando la temperatura del liquido la maxwelliana si sposta verso destra ed una frazione maggiore di molecole risulta possedere energia cinetica sufficiente per passare allo stato di vapore. All'aumentare della temperatura il processo di evaporazione si fa dunque più intenso.
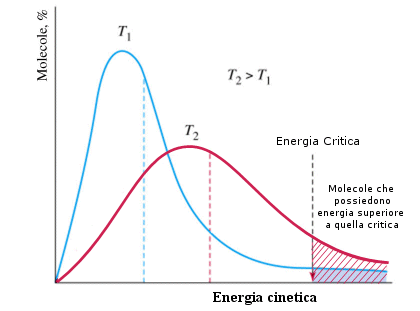
Se poniamo un liquido all'interno di un recipiente chiuso dove abbiamo precedentemente fatto il vuoto, lo spazio non occupato dal liquido viene occupato dal suo vapore. Man mano che il processo di evaporazione procede il vapore che sovrasta la superficie del liquido si fa sempre più concentrato, essendo il recipiente chiuso, e la pressione misurabile all'interno aumenta progressivamente |
|
All'aumentare della concentrazione del vapore si fanno sempre più frequenti gli urti tra le particelle gassose da una parte e tra le particelle e le pareti del recipiente dall'altra, in modo tale che un numero sempre maggiore di molecole, trasferendo quantità di moto durante gli urti, perde energia cinetica e ricade sulla superficie del liquido. dove compare il fattore di Boltzmann |
|
Finchè la velocità di evaporazione rimane più elevata di quella di condensazione, la concentrazione del vapore aumenta e, con essa, la pressione misurata. Si arriva tuttavia ad uno stato di equilibrio dinamico in cui la velocità del processo di evaporazione eguaglia la velocità del processo di condensazione. Poiché in tale situazione possiamo ritenere che il numero di particelle che evaporano sia pari al numero di particelle che condensano, il vapore non è in grado di arricchirsi ulteriormente e la pressione cessa dunque di aumentare. Il vapore viene per questo detto vapore saturo e la pressione esercitata è detta tensione di vapor saturo. All’equilibrio avremo dunque k’ [vapore] = k’” Essendo la pressione direttamente proporzionale alla concentrazione del vapore possiamo anche scrivere p = k |
|
.
fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Chimica generale 7
Visita la nostra pagina principale
Chimica generale 7
Termini d' uso e privacy


 (i risultati ottenuti con tale ipotesi semplificatrice possono essere facilmente estesi al caso generale in cui le particelle si muovano disordinatamente in tutte le direzioni).
(i risultati ottenuti con tale ipotesi semplificatrice possono essere facilmente estesi al caso generale in cui le particelle si muovano disordinatamente in tutte le direzioni).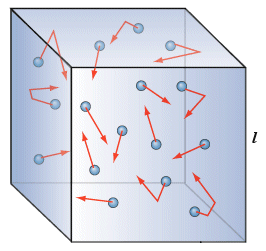
 .
.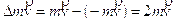
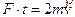
 , il numero di urti al secondo è dato dal rapporto tra lo spazio percorso in un secondo e la distanza da percorrere (2l) tra due urti successivi sulla stessa parete.
, il numero di urti al secondo è dato dal rapporto tra lo spazio percorso in un secondo e la distanza da percorrere (2l) tra due urti successivi sulla stessa parete.