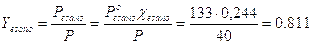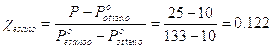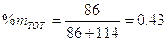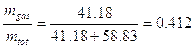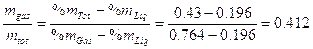Chimica generale 8
Chimica generale 8
Ebollizione
Come abbiamo già visto la tensione di vapore aumenta con la temperatura, poiché maggiore è il numero delle particelle che possiede un'energia cinetica superiore al valore critico.
La tensione di vapore varia da liquido a liquido. A parità di temperatura è maggiore per i liquidi caratterizzati da deboli forze intermolecolari, per ciò detti volatili; è minore per i liquidi caratterizzati da intense forze intermolecolari che tengono particolarmente coese le particelle.
Quando al crescere della temperatura la tensione di vapore eguaglia la pressione esterna (normalmente la pressione atmosferica), allora il processo di evaporazione interessa tutta la massa del liquido ed il passaggio di stato avviene in maniera tumultuosa, attraverso un processo detto di ebollizione. in cui si formano bolle di gas anche all'interno del liquido.
Si definisce punto di ebollizione normale la temperatura alla quale la tensione di vapore assume il valore di 760 mm di Hg (pressione normale). Per l'acqua, ad esempio, il punto di ebollizione normale è di 100°C (si noti come nel grafico seguente le curve della tensione di vapore crescano esponenzialmente al crescere della temperatura).

Naturalmente se la pressione esterna è inferiore a 760 mm, come avviene ad esempio in montagna, l'acqua raggiunge il punto di ebollizione a temperature inferiori; mentre se la pressione esterna è superiore, come in una pentola a pressione, l'acqua bolle a temperature superiori.
Se forniamo calore ad un liquido esso aumenta la sua temperatura fino al momento in cui non raggiunge il suo punto di ebollizione. Durante il passaggio di stato la temperatura del liquido resta invece invariata nonostante l'apporto di calore. Il calore fornito non viene utilizzato per aumentare l'energia cinetica delle particelle, ma si trasforma in un aumento di energia potenziale delle particelle gassose.
Tale calore, assorbito dal sistema senza produrre un aumento di temperatura, è noto come calore latente. Esso viene naturalmente restituito all'ambiente durante il processo di condensazione.
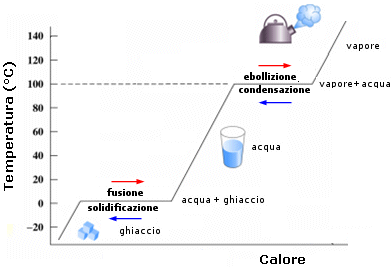
Tale comportamento è caratteristico di ogni passaggio di stato. Si noti che il passaggio dallo stato liquido a quello aeriforme è detto vaporizzazione e può avvenire per evaporazione, se la tensione di vapore è inferiore a quella atmosferica, o per ebollizione.
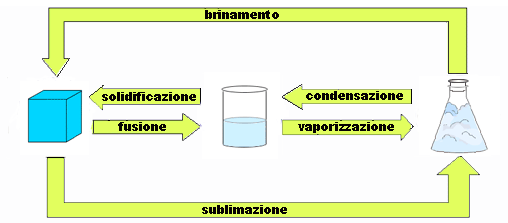
Diagramma di stato
Un diagramma di stato è una rappresentazione grafica delle condizioni di Temperatura e Pressione alle quali una sostanza si trova allo stato solido, liquido e aeriforme.
Un punto del piano cartesiano individua una particolare coppia di valori Pressione/Temperatura ai quali corrisponderà un particolare stato di aggregazione della sostanza.
E' possibile costruire un diagramma di stato per ogni sostanza, in modo che a ciascun stato di aggregazione sia assegnata una diversa zona del piano cartesiano.
Nell'esempio che segue è riportato il diagramma di stato dell'acqua.

Le linee che in un diagramma di stato separano due regioni sono dette confini di fase.
I punti che si trovano su tali linee corrispondono a condizioni termodinamiche (valori di Temperatura e Pressione) in cui si trovano in equilibrio dinamico due stati fisici.
Linea 1: evidenzia le condizioni di pressione e temperatura in corrispondenza delle quali il solido si trova in equilibrio con il liquido. La curva mostra dunque come varia la temperatura di fusione del ghiaccio al variare della pressione alla quale è sottoposto. Per la maggior parte delle sostanze tale curva presenta una pendenza positiva. Nell'acqua la pendenza negativa (all'aumentare della pressione la temperatura di fusione si abbassa) è dovuta al fatto che l'acqua, a differenza della maggior parte delle altre sostanze liquide, congelando aumenta di volume.
Linea 2: evidenzia le condizioni di pressione e temperatura in corrispondenza delle quali il liquido si trova in equilibrio con il proprio vapore. La curva può essere dunque considerata come un grafico della tensione di vapore del liquido.
Linea 3: evidenzia le condizioni di pressione e temperatura in corrispondenza delle quali il solido si trova in equilibrio con il proprio vapore. La curva può essere dunque considerata come un grafico della tensione di vapore di sublimazione del solido.
Punto A: detto punto triplo, corrisponde alle condizioni in cui la fase solida, la fase liquida e quella aeriforme coesistono in un equilibrio dinamico. Per l'acqua corrisponde a 0,01°C e 4,6 mm di Hg. In tale punto la tensione di vapore del solido è uguale alla tensione di vapore del liquido. Poiché il punto triplo è il punto più basso della regione in cui una sostanza esiste allo stato liquido, esso segna la pressione al di sotto della quale uno sostanza non può esistere allo stato liquido, qualunque sia la sua temperatura.
Così se in una fredda e asciutta mattinata d'inverno la pressione parziale di vapore è inferiore a 4,6 mm di Hg e la temperatura scende sotto 0,01°C il vapore può trasformarsi direttamente in ghiaccio (brina) senza passare allo stato liquido.
Punti B e C: rappresentano rispettivamente il punto normale di fusione e di ebollizione dell'acqua essendo l'intersezione della curva 1 e 2 con l'ordinata di 1 atmosfera.
Punto D: rappresenta la temperatura critica della sostanza, oltre la quale non è possibile ottenere la fase liquida, qualunque sia la pressione alla quale la sostanza viene sottoposta.
Soluzioni
Una soluzione è un sistema omogeneo di due o più componenti solidi, liquidi o gassosi, in cui i componenti sono presenti allo stato atomico o molecolare e risultano pertanto inosservabili.
Per definizione si chiama solvente la sostanza presente in quantità maggiore e soluto (o soluti) la sostanza (o le sostanze) presente in minor quantità.
Le soluzioni gassose (gas in gas) vengono normalmente dette miscele gassose.
Le soluzioni solide sono dette leghe.
Noi ci occuperemo delle soluzioni liquide in cui un soluto (solido, liquido o gassoso) si scioglie in un liquido ed essenzialmente delle soluzioni acquose, in cui il solvente è l'acqua.
Concentrazione di una soluzione
La concentrazione esprime la quantità relativa dei soluti rispetto al solvente. La concentrazione di un soluto si indica mettendo tra parentesi quadre la formula chimica. Ad esempio [H2SO4] si legge "concentrazione dell'acido solforico". Esistono diversi modi per esprimere la concentrazione di una soluzione.
1) Percentuale in peso C(p/p)
E' il rapporto percentuale tra il peso del soluto ed il peso della soluzione (grammi di soluto per 100 g di soluzione)

2) Percentuale in volume C(v/v)
E' il rapporto percentuale tra il volume del soluto ed il volume della soluzione (ml di soluto per 100 ml di soluzione). Viene spesso utilizzata nelle soluzioni in cui tutti i componenti sono liquidi. La gradazione delle bevande alcoliche è ad esempio espressa come percentuale in volume.

3) Rapporto peso-volume C(p/v)
E' il rapporto tra il peso del soluto espresso in grammi ed il volume della soluzione espresso in litri (g/L).

4) Frazione molare (c)
E' il rapporto tra il numero di moli di soluto ed il numero di moli totali.

5) Molarità (M)
E' il rapporto tra il numero di moli di soluto ed il volume della soluzione espresso in litri. Indica il numero di moli di soluto presenti in un litro di soluzione (mol/L).

6) Molalità (m)
E' il rapporto tra il numero di moli di soluto ed il peso del solvente espresso in kg. Indica il numero di moli di soluto presenti per chilogrammo di solvente (mol/kg)
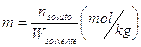
7) Normalità (N)
E' il rapporto tra il numero di equivalenti di soluto ed il volume della soluzione espresso in litri. Indica quanti equivalenti sono presenti in un litro di soluzione (eq/L).

Un equivalente (eq) o grammo-equivalente o peso-equivalente (Peq) è una quantità, espressa in grammi, il cui valore dipende dal tipo di sostanza e dal tipo di reazione.
a) Nel caso di una reazione redox il peso-equivalente è il rapporto tra il peso molare della sostanza che si ossida (o si riduce) e il numero di elettroni persi (o acquistati)
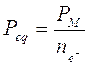
Calcoliamo ad esempio il peso equivalente dell'anidride solforosa, nelle seguenti 2 reazioni redox
1) SO2 + O2 ® SO3
2) SO2 + Fe2O3 ® FeS2 + O2
Nella prima lo zolfo si ossida passando da nox +4 a nox +6 con una perdita di 2 elettroni. Il peso equivalente dell'anidride solforosa sarà quindi in questa reazione
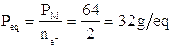
nella seconda lo zolfo si riduce passando da nox +4 a nox -1 con un acquisto di 5 elettroni. Il peso equivalente dell'anidride solforosa in questa seconda reazione sarà dunque
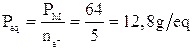
b) nel caso di una dissociazione di un acido (o di una base), il peso-equivalente è il rapporto tra il peso molare ed il numero di ioni H+ (o OH-)

Ad esempio calcoliamo il valore del peso equivalente dell'acido ortofosforico relativamente alle seguenti due reazioni di dissociazione
1) H3PO4 ® 2H+ + HPO42-
2) H3PO4 ® 3H+ + PO43-
Nella prima in cui si liberano solo 2 ioni H+ il peso equivalente vale
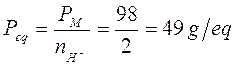
Nella seconda in cui si liberano 3 ioni H+ il peso equivalente vale
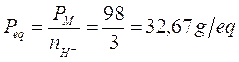
c) nel caso di una dissociazione di un sale, il peso-equivalente è il rapporto tra il peso molare ed il numero delle cariche positive (o negative) prodotte dalla dissociazione
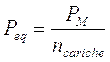
Calcoliamo ad esempio il peso equivalente del solfato ferrico nella seguente reazione
Fe2(SO4)3 ® 2Fe3+ + 3SO42-
Poiché vengono liberate complessivamente 6 cariche positive (o 6 negative) il peso equivalente risulta
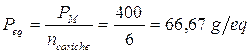
E' evidente che il peso equivalente ha un significato fisico analogo al peso molare. Se il peso molare è una quantità in grammi di una sostanza che contiene un numero di Avogadro di particelle, il peso equivalente è una quantità in grammi di una sostanza in grado di mettere in gioco, a seconda delle circostanze, un numero di Avogadro di elettroni, di ioni H+ ( o OH-) o di cariche ioniche positive (o negative).
Ora, allo stesso modo in cui si calcola il numero di moli (n) facendo il rapporto tra il peso in grammi (W) ed il peso di una mole (PM), si può calcolare il numero di equivalenti (neq) facendo il rapporto tra il peso in grammi di una sostanza ed il peso di un equivalente (Peq).

Per esemplificare quanto detto calcoliamo la Molarità e la Normalità di 2,3 L di una soluzione contenente 45 g di Cloruro di Magnesio MgCl2.

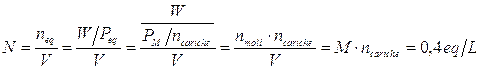
Da cui si deduce che per calcolare la Normalità di una soluzione è sufficiente moltiplicare il valore della Molarità per il numero di cariche ioniche (o di elettroni o di ioni H+) messe in gioco.
L'uso della Normalità permette di calcolare direttamente le quantità di sostanze che partecipano ai processi chimici senza bisogno di bilanciare la reazione. Infatti è facilmente verificabile che in qualsiasi reazione 1 equivalente di una sostanza reagisce sempre con un equivalente di qualsiasi altra sostanza che partecipi alla reazione.
7) Diluizioni
Diluire una soluzione significa aggiungere una opportuna quantità di solvente in modo da portare la sua concentrazione dal valore iniziale (Min) al valore finale (Mfin). Per calcolare la quantità di solvente che deve essere aggiunta, si consideri che il processo di diluizione non modifica il numero di moli di soluto contenute nella soluzione. Potremo pertanto scrivere
nin = nfin
e ricordando che la molarità è pari a M = n/V e dunque n = MV
Min Vin = Mfin Vfin
da cui
Vfin = (Min Vin) / Mfin
e, finalmente, la quantità di solvente da aggiungere sarà
Solvente da aggiungere = Vfin - Vin
Solubilità
Una vecchia regola della chimica afferma che il simile scioglie il simile: solventi polari sciolgono sostanze ioniche o polari, mentre solventi apolari sciolgono sostanze apolari.
Come abbiamo già avuto modo di dire noi prenderemo in considerazione esclusivamente soluzioni acquose dove il solvente è l'acqua, un liquido molto polare.
Le parziali cariche elettriche dell'acqua esercitano sugli ioni o sulle molecole polari di un soluto un'attrazione che indebolisce considerevolmente le forze interne che mantengono integra la struttura del solido. Le particelle che si trovano sulla superficie del solido (polare o ionico) posto in acqua, finiscono quindi per essere estratte, circondate dalle molecole dell'acqua (solvatazione) e portate in soluzione. Se il solvente è l'acqua il fenomeno prende il nome di idratazione.
Si definisce solubilità la massima quantità di soluto che può essere disciolta in una data quantità di solvente. La solubilità è quindi la concentrazione della soluzione satura.
Il processo di solubilizzazione può essere sia esotermico che endotermico.
Effetti della temperatura sulla solubilità
In genere se il soluto è un solido il processo è endotermico (per questo motivo i soluti solidi si sciolgono meglio in liquidi caldi). Nonostante il processo non sia favorito dal punto di vista energetico esso risulta egualmente spontaneo poiché l'entropia di una soluzione è molto maggiore di quella di un solido cristallino (il grado di disordine è molto più elevato nei fluidi che nei solidi).
Se il soluto è un fluido (liquido o gas) in genere il processo di solubilizzazione è esotermico (per questo motivo i gas si sciolgono più facilmente in liquidi a bassa temperatura).
Effetti della pressione sulla solubilità (legge di Henry)
Poiché i solidi ed i liquidi sono praticamente incomprimibili la variazione della pressione non ha alcun effetto sulla loro solubilità.
Diverso è il caso di soluti gassosi. Infatti in soluzioni di gas in liquidi la concentrazione del soluto è proporzionale alla pressione parziale del gas in equilibrio con la soluzione.
La legge di Henry afferma che la solubilità di un soluto gassoso (espressa come molalità) è direttamente proporzionale alla pressione parziale del gas

dove KH è la costante di Henry. La costante di Henry dipende sia dalla natura chimica del soluto che del solvente.

La legge di Henry spiega ad esempio perché, stappando una bevanda gasata in cui è disciolta dell'anidride carbonica a pressione superiore a quella atmosferica, si formi improvvisamente dell'effervescenza. Trovandosi infatti bruscamente sottoposto ad una pressione esterna inferiore, il gas non è più in grado di rimanere in soluzione. Il processo è del tutto analogo a quello che provoca la formazione di bolle di gas (embolia) nel sangue dei sommozzatori che risalgono troppo rapidamente in superficie, sottoponendosi ad una brusca diminuzione di pressione.
Elettroliti, non-elettroliti e grado di dissociazione
Le sostanze che si sciolgono in acqua (ed in generale nei solventi polari) si dividono in elettroliti e non-elettroliti.
1. I non-elettroliti sono sostanze che sciolte in acqua non si dissociano in ioni di carica opposta. Sono esempi di non elettroliti il glucosio, l'alcool etilico, l'anidride carbonica. Il termine "non-elettrolita" fa riferimento all'impossibilità per le soluzioni che contengono questo tipo di soluti di dare il processo dell'elettrolisi.
2. Gli elettroliti sono sostanze che disciolte in acqua si dissociano, in misura più o meno elevata, in ioni di carica opposta. Il termine "elettrolita" fa riferimento al fatto che solo le soluzioni che contengono ioni di carica opposta sono in grado di dare processi elettrolitici.
Gli elettroliti si dicono "forti" quando si dissociano in modo completo. Sono elettroliti forti quasi tutti i sali, gli acidi forti (HCl, HBr, HI, HNO3 etc) e le basi forti (idrossidi dei metalli alcalini e alcalino-terrosi).
Gli elettroliti si dicono "deboli" quando sono solo parzialmente dissociati. Sono elettroliti deboli gli acidi deboli (HF, H2S, HCN HNO2 etc) e le basi deboli (gli idrossidi degli altri metalli).
Si definisce grado di dissociazione a il rapporto tra il numero di moli dissociate ed il numero di moli inizialmente presenti.

Il grado di dissociazione è evidentemente uguale a 0 per i non-elettroliti, è pari a 1 per gli elettroliti forti e assume valori compresi tra 0 ed 1 per gli elettroliti deboli.
Se una sostanza presenta ad esempio un grado di dissociazione pari a 0,3 significa che per ogni 100 molecole che sono state poste in soluzione, 30 si sono dissociate in ioni, mentre 70 sono disciolte senza essere dissociate.
Il grado di dissociazione non è una buona misura della forza di un elettrolita debole, in quanto, come vedremo, aumenta con la diluizione. In altre parole il grado di dissociazione di un elettrolita debole aumenta progressivamente man mano che diluiamo la soluzione. Per confrontare la forza di due elettroliti deboli possiamo confrontarne il grado di dissociazione solo se le due soluzioni presentano la stessa concentrazione.
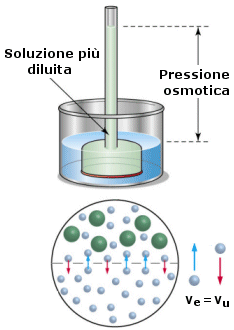
Osmosi e Pressione osmotica
Il fenomeno dell'osmosi si produce ogniqualvolta due soluzioni a diversa concentrazione sono separate da una membrana semipermeabile (selettivamente permeabile), che permette il passaggio selettivo (diffusione) solo di alcuni componenti la soluzione e non di altri.
Analizziamo il caso più semplice in cui una soluzione contenente un unico soluto è separato dall’acqua pura attraverso una membrana semipermeabile.Il soluto non è in grado di diffondere ed attraversare la membrana, mentre il solvente diffonde liberamente.
1) Poiché il movimento di diffusione del soluto è impedito dalla presenza della membrana semipermeabile, l'unico movimento consentito è quello del solvente (acqua). Le molecole di solvente si muovono naturalmente nei due sensi, ma inizialmente la probabilità che l’acqua entri nella soluzione è maggiore di quella che esca. Finchè la velocità di entrata Ve è maggiore della velocità di uscita Vu, il movimento netto del solvente in entrata contribuisce a diluire la soluzione e ne fa alzare il livello, mentre il livello dell’acqua pura esterna si abbassa. Il fenomeno è noto come osmosi. |
2) Man mano che la soluzione si diluisce (ed aumenta dunque in essa la quantità di solvente) aumenta la probabilità che le molecole d’acqua escano dalla soluzione. Il fenomeno esmotico raggiunge un punto di equilibrio quando la velocità dell’acqua in entrata eguaglia la velocità dell’acqua in uscita. Il livello della soluzione si alza fino a quando al punto in cui la pressione esercita dalla colonna di liquido innalzatasi fa esattamente equilibrio alla pressione esercitata dal solvente in entrata. |
Sperimentalmente si osserva che la pressione osmotica prodotta da una soluzione rispetto al solvente puro obbedisce all'equazione di stato dei gas perfetti

dove V = volume della soluzione ed n = numero di moli di soluto
Tenendo conto poi che n/V è la molarità della soluzione, la relazione diventa
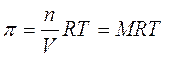
La pressione osmotica di una soluzione, a temperatura costante, dipende dunque esclusivamente dalla sua concentrazione.
Nel caso si prendano in considerazione 2 soluzioni a diversa concentrazione, la pressione osmotica è proporzionale alla differenza di concentrazione DM.

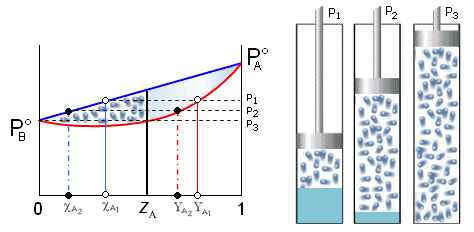
Legge di Raoult
Il processo di evaporazione interessa, come sappiamo, solo le molecole presenti sulla superficie del liquido. In una soluzione in cui siano disciolti alcuni soluti, nelle quantità molari n1, n2, n3,.....nn, le molecole di ciascuno di essi sono distribuite in modo uniforme su tutta la massa della soluzione, e quindi anche sulla sua superficie, in modo proporzionale alla loro frazione molare (ni/ntot).
Ciascuna delle specie chimiche presenti in soluzione sarà soggetta ad un processo di evaporazione e contribuirà pertanto alla formazione di un vapore, costituito da una miscela di aeriformi. Ciascun componente la soluzione contribuirà alla tensione di vapore della soluzione in modo proporzionale alla frazione di molecole che occupano la superficie della soluzione ed alla sua maggiore o minore volatilità. In altre parole la tensione di vapore della soluzione dipenderà dalla frazione molare di ciascun componente la soluzione e dalla tensione di vapore del componente stesso.
La legge di Raoult esprime quantitativamente tale fenomeno, affermando che la tensione di vapore (P) di una soluzione, a temperatura costante è data dalla somma delle tensioni di vapore di ciascun componente la soluzione allo stato puro (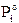 ), moltiplicato per la frazione molare (ci) con cui il componente compare nella soluzione stessa.
), moltiplicato per la frazione molare (ci) con cui il componente compare nella soluzione stessa.

In altre parole, la tensione di vapore di una soluzione è una media ponderata delle tensioni di vapore dei suoi componenti, dove le frazioni molari rappresentano i fattori di ponderazione.
Ad esempio se misceliamo 5 moli di H2O, la cui tensione di vapore a 25°C è di 23,8 mm di Hg con 3 moli di alcool etilico, la cui tensione di vapore a 25°C è di 58,9 mm di Hg, la tensione di vapore della soluzione sarà

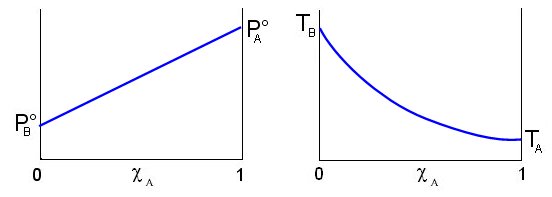
Possiamo rappresentare graficamente l'andamento della tensione di vapore nel caso di una soluzione a due componenti A e B, in funzione della loro frazione molare.
Il componente A, più volatile ( , secondo la relazione
, secondo la relazione

che rappresenta una retta di pendenza  .
.

Il componente B, meno volatile ( , secondo la relazione
, secondo la relazione

che rappresenta una retta di pendenza 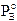 .
.

Tenendo conto che 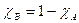 che potremo rappresentare sullo stesso grafico di A ottenendo
che potremo rappresentare sullo stesso grafico di A ottenendo
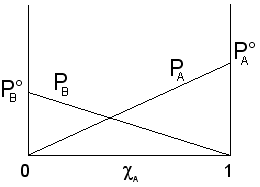
L'andamento della tensione di vapore della soluzione per tutte le possibili combinazioni di A e B può quindi essere ottenuta, secondo quanto previsto dalla legge di Raoult, sommando punto a punto gli apporti dei due componenti (PA + PB). Si ottiene

e riordinando
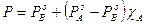

Dove si vede che il valore della tensione di vapore è sempre compreso tra quello dei due componenti allo stato puro, variando linearmente tra questi due estremi. La tensione di vapore totale è rappresentabile in un grafico che porti la frazione molare del componente A in ascissa, come una retta di pendenza  . Le soluzioni che rispettano la legge di Raoult si dicono soluzioni ideali.
. Le soluzioni che rispettano la legge di Raoult si dicono soluzioni ideali.
In moltissime soluzioni i soluti sono solidi che presentano tensioni di vapore talmente basse da poter essere trascurate. Nel caso più semplice di un unico soluto solido non volatile la legge di Raoult diventa

e, poiché possiamo porre  = 0, si otterrà
= 0, si otterrà
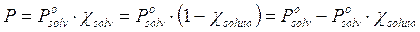
da cui

Tale relazione esprime il fatto che la presenza di molecole di soluto che non evaporano (o evaporano in modo trascurabile) alla superficie della soluzione, diminuiscono la superficie utile per l'evaporazione del solvente di una percentuale pari alla frazione molare del soluto e finiscono quindi per far diminuire la tensione di vapore del solvente della stessa percentuale.
La legge di Raoult per un soluto poco volatile afferma infatti che l'abbassamento relativo della tensione di vapore del solvente  .
.
Se ad esempio sciogliamo 100 g di saccarosio (soluto poco volatile, PM = 342 g/mol) in 500 g di H20 a 26°C ( PM = 18 g/mol, P° = 25,2 mm di Hg), possiamo calcolare di quanto si abbassa la tensione di vapore del solvente, calcolando semplicemente la frazione molare del soluto
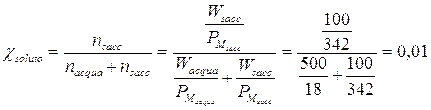
La tensione di vapore del solvente si abbassa dunque dell'1%, pari 25,2.0,01 = 0.25 mm di Hg e la tensione di vapore della soluzione sarà pari a
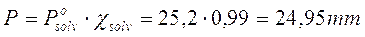
Si noti infine che, se due componenti una soluzione possiedono diversa volatilità (diverse tensioni di vapore), quello più volatile tenderà ad arricchire maggiormente il vapore e la sua frazione molare nella miscela gassosa risulterà, per la legge di Dalton, superiore alla sua frazione molare nella soluzione.

Se ad esempio mescoliamo, a 25°C, 15 moli di acqua (tensione di vapore 23,8 mm) con 15 moli di alcool etilico (tensione di vapore 58,9 mm), per la legge di Raoult la tensione di vapore della soluzione sarà pari a

Si noti che la pressione parziale del vapor d'acqua nella miscela gassosa è di 11,9 mm di Hg, mentre la pressione parziale dell'alcool etilico gassoso è di 29,45 mm di Hg.
Per la legge di Dalton la frazione molare di un componente una miscela gassosa è esattamente pari al rapporto tra la sua pressione parziale e la pressione totale, per cui la frazione molare dell'alcool etilico nella miscela gassosa sarà pari a

superiore alla frazione molare dell'etilico in soluzione  . Il componente più volatile si trova dunque nel vapore in percentuale maggiore rispetto a quanto non sia in soluzione.
. Il componente più volatile si trova dunque nel vapore in percentuale maggiore rispetto a quanto non sia in soluzione.
Per distinguerla da quella dei componenti liquidi, la frazione molare dei componenti gassosi viene in genere indicata con la lettera Y.
Possiamo esprimere la frazione molare Y di un componente nella fase gassosa in funzione della frazione molare c che esso presenta nella soluzione. La frazione molare dei componenti nella fase gassosa vale
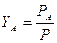
ricordando che 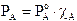 otteniamo
otteniamo

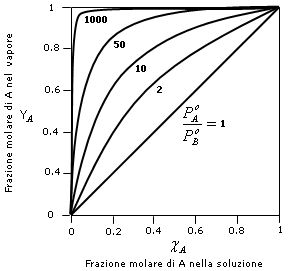
dove possiamo osservare che la frazione molare del componente più volatile A nella fase gassosa è tanto più elevata quanto maggiore è il rapporto tra la sua tensione di vapore e la tensione di vapore del componente meno volatile B.
Se i due componenti presentano la medesima tensione di vapore  .
.
Nel grafico successivo è riportato l’andamento della curva 
Possiamo infine esprimere la tensione di vapore della soluzione in funzione della frazione molare YA del componente più volatile nella fase gassosa.
Ricordando che la frazione molare YA del componente più volatile nella fase gassosa è pari a
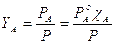
esplicitiamo la frazione molare cA del componente nella soluzione

e sostituiamone il valore nella tensione di vapore della soluzione 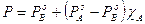 . Otteniamo
. Otteniamo

dove possiamo osservare che la tensione di vapore non varia linearmente con la frazione molare YA del componente nella fase gassosa.

Se riportiamo in un unico grafico l’andamento della pressione di vapore (a T costante) in funzione della frazione molare sia in fase gassosa (YA) che in fase acquosa (cA), otteniamo un diagramma in cui è possibile osservare come il vapore sia più ricco nel componente più volatile (YA > cA)

Questa circostanza permette normalmente di separare i due componenti una soluzione per distillazione. Il vapore che si ottiene facendo bollire una soluzione è infatti più ricco nell'elemento più volatile. Se i vapori così ottenuti vengono poi fatti condensare, la nuova soluzione che se ne ottiene risulta anch'essa più concentrata nell'elemento più volatile. Eseguendo più volte il processo è possibile separare completamente i due componenti.
Regola della leva
Quando la soluzione (fase liquida) è in equilibrio con i suoi vapori (fase gassosa) è presente un sistema bifasico di cui possiamo calcolare le percentuali relative (in massa) delle due fasi in equilibrio. La frazione molare ZA totale (vapore + liquido) del sistema bifasico sarà evidentemente compresa tra quella del gas e quella del liquido (YA > ZA > cA) ed il suo valore sarà correlato al rapporto molare tra fase gassosa e fase liquida (ng/nl)
Consideriamo il componente A più volatile ed indichiamo con
ng = numero di moli presenti nella fase gassosa
nl = numero di moli presenti nella fase liquida
n = ng + nl = numero di moli totali, presenti in entrambe le fasi in equilibrio
ng Y A = numero di moli di A presenti nella fase gassosa
nl cA = numero di moli di A presenti nella fase liquida
n ZA = (ng + nl) ZA = numero di moli di A presenti in entrambe le fasi
Ora, applichiamo il principio di conservazione della massa ed eseguiamo il bilancio di materia. Il numero totale di moli di A (presenti in entrambe le fasi) dovrà essere uguale alla somma delle moli di A in fase liquida ed in fase gassosa. Possiamo allora scrivere
(ng + nl) ZA = nl×cA + ng×Y A
da cui
ng ×ZA + nl ×ZA = nl×cA + ng×Y A
ng ×ZA + nl ×ZA = nl×cA + ng×Y A
raccogliendo ng ed nl, si arriva infine alla relazione seguente che costituisce la regola della leva
ng (Y A - ZA) = nl (ZA - cA)
Il nome si deve al fatto che la relazione è analoga a quella che fornisce la condizione di equilibrio di una leva in cui il prodotto della forza F1 per il suo braccio b1 deve essere uguale al prodotto della forza F2 per il suo braccio b2. Dunque il numero di moli contenute in ciascuna fase stanno tra loro in modo inversamente proporzionale ai segmenti congiungenti i punti che rappresentano le fasi con il punto che fornisce la composizione chimica media ZA del sistema bifasico.
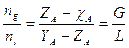
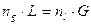
La lunghezza della congiungente il punto indicante la composizione globale ZA della miscela con quello indicante la composizione della singola fase è inversamente proporzionale alla percentuale
di quella fase presente.

Dunque il numero di moli presenti nella fase gassosa è proporzionale al segmento G, mentre il numero di moli di A presenti nella fase liquida è proporzionale al segmento L.
Applicando la medesima regola è possibile calcolare non solo il rapporto molare tra fase gassosa e fase liquida (ng/nl), ma anche la frazione molare del sistema bifasico presente in una determinata fase. Ricordando infatti che la lunghezza del segmento L è proporzionale al numero di moli in fase liquida, mentre la lunghezza del segmento G è proporzionale al numero di moli in fase gassosa, potremo scrivere

dove
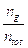 = frazione delle moli totali presente sotto forma di vapore
= frazione delle moli totali presente sotto forma di vapore
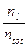 = frazione delle moli totali presente sotto forma di liquido
= frazione delle moli totali presente sotto forma di liquido
In un sistema bifasico liquido-vapore in reciproco equilibrio la frazione molare totale Z (vapore + liquido) è ovviamente costante. Se tuttavia sottoponiamo il sistema ad una variazione di pressione, esso si riassesta verso una nuova condizione di equilibrio in cui varia il rapporto quantitativo tra la fase liquida e quella di vapore e le concentrazioni delle singole fasi.
In particolare, diminuendo la pressione il sistema si sposta verso la fase di vapore (una maggior quantità di liquido evapora) ed entrambe le fasi risultano meno concentrate nel componente più volatile.
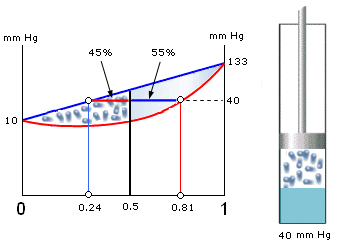
Esempio Essendo il sistema equimolare (moli esano = moli ottano) la frazione molare dell’esano è Z = 0,5
|
|
Applichiamo ora la legge di Dal ton per calcolare la frazione molare dell’esano nel vapore Applichiamo infine la regola della leva per calcolare la frazione di molecole che si trovano sotto forma di vapore
Dunque il 45,1% delle moli totali si trova sotto forma di vapore e contiene l’81,1% di esano, mentre il rimanente 54,9% delle molecole totali si trova in fase liquida e contiene il 24,4 % di esano. |
|
Se ora portiamo la pressione del vapore a 25 mm Hg, il sistema sposta il suo equilibrio verso la fase gassosa. Rieseguiamo i calcoli precedenti per una pressione di 25 mm Hg Applichiamo la legge di Raoult per calcolare la tensione di vapore dell’esano nella soluzione Applichiamo ora la legge di Dal ton per calcolare la frazione molare dell’esano nel vapore Applichiamo infine la regola della leva per calcolare la frazione di molecole che si trovano sotto forma di vapore
Dunque il 71,7% delle moli totali si trova sotto forma di vapore e contiene l’64,9% di esano, mentre il rimanente 28,3% delle molecole totali si trova in fase liquida e contiene il 12,2 % di esano. |
|
Si tenga presente che la regola della leva rimane valida anche usando le percentuali in peso (massa) al posto delle frazioni molari. Ovviamente in questo caso si troveranno valori numerici diversi.
Esempio la frazione molare dell’esano Z = 0.5, espressa come percentuale in massa, diventa Calcoliamo la massa dell’esano presente in 0.451 moli di vapore 0.451 x 0.811 x 86 = 31.46 g Calcoliamo la massa dell’ottano presente in 0.451 moli di vapore 0.451 x (1-0.811) x 114 = 9.72 g Dunque 0.451 moli di vapore pesano 31.46 + 9.72 = 41.18 g e contengono una percentuale in massa di esano pari a Calcoliamo la massa dell’esano presente in 0.549 moli di soluzione 0.549 x 0.244 x 86 = 11.52 g Calcoliamo la massa dell’ottano presente in 0.549 moli di vapore 0.549 x (1-0.244) x 114 = 47.31 g Dunque 0.549 moli di fase liquida pesano 11.52 + 47.31 = 58.83 g e contengono una percentuale in massa di esano pari a Calcoliamo la percentuale in massa del sistema presente in fase gassosa Verifichiamo che tale valore poteva essere ottenuto applicando la regola della leva
|
Distillazione e diagramma lenticolare
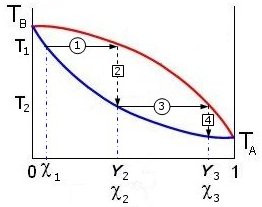
Per descrivere il processo di distillazione si fa riferimento alla curva che lega la temperatura di ebollizione della soluzione alla frazione molare del componente più volatile. Il componente più volatile è ovviamente quello con la più alta tensione di vapore e quindi con la più bassa temperatura di ebollizione. TB è la temperatura di ebollizione del componente B puro e TA è la temperatura di ebollizione del componente A puro.
Come si può osservare nei grafici successivi, a differenza della tensione di vapore, la temperatura di ebollizione della soluzione non varia linearmente in funzione di cA
Se in ascissa si riporta sia la frazione molare della soluzione (c) che del vapore (Y) si ottengono due curve a pressione costante (isobare) che costituiscono il cosiddetto diagramma lenticolare. La curva inferiore, che rappresenta la temperatura alla quale il liquido bolle, è detta curva di bolla. La curva superiore, che rappresenta la temperatura alla quale il vapore condensa, è detta curva di rugiada. All’interno della lente è presente un sistema bifasico liquido + vapore in reciproco equilibrio
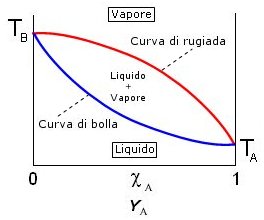
Come abbiamo già detto la distillazione permette di separare i due componenti a diversa volatilità di una soluzione sfruttando il fatto che il vapore risulta più ricco nel componente più volatile. Facendo ricondensare i vapori, la nuova soluzione che se ne ottiene risulta anch'essa più concentrata nell'elemento più volatile. Eseguendo più volte il processo è possibile separare completamente i due componenti.
|
Distillazione
|
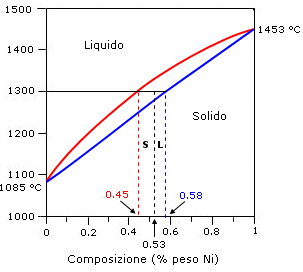
Si tenga presente che la regola della leva può essere applicata anche ai diagrammi isobari lenticolari ed in generale a qualsiasi sistema bifasico in equilibrio, ad esempio una lega metallica solida in equilibrio con il suo fuso.
Esempio
|
|
Soluzioni non ideali: deviazioni dalla legge di Raoult e azeotropi
La maggior parte delle soluzioni non presenta un comportamento ideale e manifesta delle deviazioni dalla legge di Raoult.
Si osservano deviazioni positive, quando la pressione osservata sperimentalmente è maggiore di quella prevista dal modello di Raoult. A livello microscopico questo comportamento è dovuto ad una interazione di repulsione fra le molecole A e B che formano una miscela binaria e/o alla preferita associazione di una delle due specie A o B con se stessa, per esempio tramite legami a idrogeno.
Il sistema n-eptano + etanolo presenta ad esempio deviazioni positive dalla legge di Raoult a causa della
diversa polarità delle due molecole e a causa della autoassociazione dell’etanolo via legame a idrogeno. Analogamente nella miscela acetone-carbonio disolfuro i due componenti hanno diversa polarità e mostrano deviazioni positive come risulta dal diagramma seguente.

Le deviazioni positive dalla legge di Raoult danno dunque luogo a diagrammi di fase con un punto di massimo nella curva della pressione di vapore e quindi con un punto di minimo nei diagramma isobaro nella curva della temperatura di ebollizione.
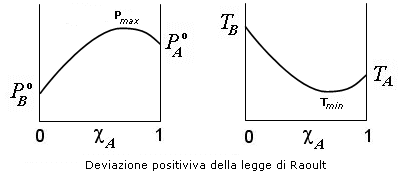
Si osservano deviazioni negative, quando la pressione osservata sperimentalmente è minore di quella prevista dal modello di Raoult. A livello microscopico questo comportamento è dovuto ad una forte interazione di attrazione di A verso B, o tramite legami a idrogeno o con formazione di idrati nel caso di soluzioni acquose. Il cloroformio si associa ad esempio con l’acetone per legame a idrogeno e quindi la miscela presenta deviazioni negative dalla legge di Raoult come risulta dal diagramma seguente.

Le deviazioni negative dalla legge di Raoult danno dunque luogo a diagrammi di fase con un punto di minimo nella curva della pressione di vapore e quindi con un punto di massimo nei diagramma isobaro nella curva della temperatura di ebollizione.

La miscela avente la composizione corrispondente a tali estremi (punti di massimo o minimo) si chiama miscela azeotropica o semplicemente azeòtropo (dal greco azeotropos, che bolle immutato). Si osserva che per tali miscele la composizione del vapore è identica a quella del liquido. Il diagramma isobaro lenticolare forma infatti due asole con la curva di bolla e quella di rugiada che presentano un punto in comune in corrispondenza dell’azeotropo.
.

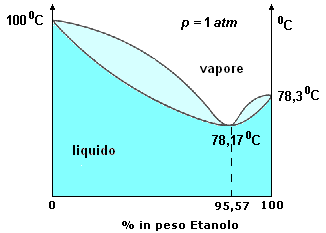
L'azeotropo è dunque una miscela con punto di ebollizione massimo, o minimo, rispetto a tutte le altre composizioni del sistema ed in corrispondenza della quale la composizione del liquido è uguale alla composizione del vapore. I sistemi con punto di ebollizione minimo sono i più comuni, ed il più noto è la miscela acqua-etanolo.
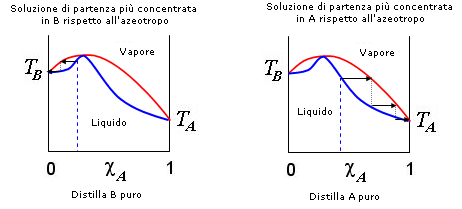
Azeotropo bassobollente Le soluzioni di acqua ed etanolo (alcool etilico) presentano un punto azeotropico al 95,57% in peso (frazione molare = 0.894) di etanolo con temperatura di ebollizione di 78,17 °C. Per distillazione è dunque impossibile ottenere etanolo puro. Quando si arriva ad ottenere per distillazione la soluzione azeotropica, i vapori che essa forma sono sempre formati dal 95,57% di etanolo e dal 4,43% di acqua. |
|
Per distillazione frazionata di tali miscele è possibile ricavare allo stato puro solo il componente presente in eccesso, che rimane come residuo della distillazione, mentre il distillato tende alla miscela azeotropica
In generale:
Per distillazione di un azeotropo di minimo, il distillato tende alla composizione azeotropica, mentre rimane come residuo della distillazione il componente presente inizialmente in eccesso rispetto alla composizione dell’azeotropo.

Per distillazione di un azeotropo di massimo, la distillazione tende a separare un liquido puro arricchito nel componente che si trova, rispetto alla composizione azeotropica, dalla stessa parte della miscela di partenza
Innalzamento ebullioscopico ed abbassamento crioscopico
Abbiamo visto come la temperatura di ebollizione di un liquido sia la temperatura alla quale la tensione di vapore eguaglia la pressione esterna. Si è inoltre osservato come l'aggiunta di un soluto non volatile abbassi la tensione di vapore di un solvente. Ciò ha dunque come conseguenza che quando una soluzione raggiunge la temperatura di ebollizione del suo solvente, la sua tensione di vapore è inferiore a quella necessaria per produrre l'ebollizione. La temperatura di ebollizione di una soluzione risulta quindi superiore a quella del solvente puro.
La differenza tra la temperatura di ebollizione della soluzione e quella del solvente puro è detta innalzamento ebullioscopico (Dteb) ed è proporzionale alla concentrazione molale della soluzione
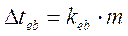
dove keb è una costante di proporzionalità, detta costante ebullioscopica, il cui valore dipende dalla natura chimica del solvente (non del soluto).
E' possibile verificare il fenomeno osservando come, nel diagramma di stato, la linea della tensione di vapore del liquido slitti, nel caso di una soluzione, verso destra ed incontri quindi l'ordinata di pressione 1 atmosfera a temperature superiori.

Un effetto analogo si ha anche sul punto di congelamento (o di solidificazione, o di fusione). La presenza di un soluto poco volatile abbassa infatti il punto di congelamento. La variazione nel punto di congelamento viene detta abbassamento crioscopico (Dtcr) e si dimostra come anch'esso sia proporzionale alla molalità della soluzione
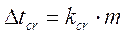
dove kcr è una costante di proporzionalità, detta costante crioscopica, il cui valore dipende dalla natura chimica del solvente (non del soluto).
Si tenga presente che quando una soluzione congela in realtà è solo il solvente (o comunque il componente a più elevato punto di congelamento) che solidifica, "espellendo" le molecole di soluto dal reticolato solido che si va formando. In tal modo la soluzione liquida che deve ancora congelare diventa via via più concentrata in soluto ed il suo punto di congelamento si abbassa ulteriormente. Ciò spiega come le soluzioni non congelino in realtà ad una temperatura ben definita, ma si solidifichino gradualmente all'interno di un certo intervallo di temperatura.

L'abbassamento crioscopico si spiega se pensiamo che il fenomeno del passaggio di stato solido/liquido avviene quando vi è equilibrio tra la velocità con cui le molecole del liquido passano allo stato solido e quella con cui le molecole del solido passano allo stato liquido. Ma mentre la superficie del liquido a contatto con il solido presenta delle molecole di soluto che rallentano e ostacolano il processo di solidificazione del solvente, il solido presenta una superficie di interfaccia con il liquido costituita solo di molecole di solvente e la velocità con cui passa allo stato liquido non viene influenzata dalla presenza del soluto.

Proprietà colligative
Si definiscono proprietà colligative di un sistema quelle proprietà il cui valore dipende dal numero delle particelle presenti e non dalla loro natura chimica e fisica. Ad esempio la pressione ed il volume dei gas sono proprietà colligative.
Per quanto riguarda le soluzioni risultano proprietà colligative la pressione osmotica, l'abbassamento relativo della tensione di vapore nelle soluzioni, l'innalzamento ebullioscopico e l'abbassamento crioscopico.
Per esemplificare quanto detto prendiamo in considerazione la pressione osmotica.
Abbiamo visto che la pressione osmotica si calcola
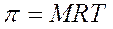
La pressione osmotica di una soluzione 0,1 M di un qualsiasi soluto a 20°C dovrebbe dunque essere pari a

ma se misuriamo la pressione osmotica di una soluzione 0,1 M di cloruro di sodio, NaCl nelle stesse condizioni di temperatura, troviamo un valore doppio, pari a 4,8 atm.
Il fenomeno si spiega facilmente se pensiamo che il cloruro di sodio, come quasi tutti i sali, è un elettrolita forte (a = 1) ed è quindi completamente dissociato. In soluzione non si trovano dunque 0,1 moli per litro di molecole di NaCl, ma 0,1 mol/l di ioni Na+ e 0,1 mol/l di ioni Cl-, per un totale di 0,2 mol/l di particelle.
Poiché la pressione osmotica è una proprietà colligativa, il suo valore effettivo dipende dal numero di particelle effettivamente presenti, che in questo caso particolare risultano essere esattamente il doppio di quelle teoricamente immesse in soluzione.
In generale dunque per ottenere dei valori attendibili per le proprietà colligative sarà necessario moltiplicare il numero di moli teoriche per un coefficiente che ci dia il numero di particelle effettivamente presenti in soluzione.
Per trovare il numero di particelle effettivamente presenti possiamo procedere in questo modo:
supponiamo di mettere in soluzione n moli di un elettrolita E il quale si dissoci in n ioni e presenti un grado di dissociazione a.
Allora
n = numero di moli inizialmente presenti
na = numero di moli che si dissociano
n - na = numero di moli indissociate
nan = numero di ioni che si formano dalle moli dissociate
(n - na) + nan = numero di moli indissociate + numero di ioni che si formano = numero totale di particelle
Raccogliendo a fattor comune il numero di moli n inizialmente presenti si ottiene
n(1 - a + an)
La quantità (1 - a + an) è detta numero ί di van't Hoff e rappresenta per l'appunto il coefficiente per cui è necessario moltiplicare il numero di moli iniziali n per ottenere il numero di particelle effettivamente presenti in soluzione.
Il numero ί di van't Hoff rappresenta quindi il coefficiente per cui è necessario moltiplicare il valore teorico di una proprietà colligativa per ottenere il valore effettivo. Nel caso della pressione osmotica possiamo dunque scrivere

Cinetica chimica
Velocità di reazione
Viene definita cinetica chimica quella branca della chimica che studia la dinamica delle reazioni chimiche ed in particolare la loro velocità.
Presa in considerazione una generica specie chimica A (reagente o prodotto di reazione), la velocità di una reazione si esprime come rapporto tra la variazione nella sua concentrazione D[A], nell'intervallo di tempo Dt preso in considerazione (è presente il valore assoluto poiché convenzionalmente la velocità viene espressa mediante valori positivi anche quando le variazioni del specie chimica considerata sono in diminuzione, come nel caso dei reagenti).

Ad esempio se la velocità di decomposizione dell'acido iodidrico in iodio e idrogeno (2HI à I2 + H2) è pari a 5 mmol l-1 s-1 ( 5 millimoli per litro per secondo), ciò significa che, mediamente si decompongono 5 millesimi di mole di acido iodidrico al secondo per litro di soluzione.
Naturalmente in tal modo si calcola la velocità media. La velocità istantanea è diversa e varia in genere con il procedere della reazione. Poiché il suo valore dipende nella maggior parte dei casi dalla concentrazione del reagente, esso presenta i valori più elevati all'inizio, quando la concentrazione è massima, per poi decrescere col procedere della reazione stessa, man mano che la concentrazione della specie chimica diminuisce. Ponendo in un diagramma cartesiano la concentrazione di una specie chimica A in funzione del tempo t, otteniamo

Per calcolare la velocità istantanea è necessario calcolare la derivata della curva in un punto. In pratica è sufficiente calcolare la pendenza della retta tangente alla curva nel punto desiderato, pari alla tangente trigonometrica dell'angolo che la retta forma con l'asse delle ascisse.
Nel figura si può ad esempio osservare come la velocità al tempo t1 sia pari alla pendenza della retta tangente alla curva nel punto P, pari a tana mentre al tempo t2 la pendenza della retta tangente sia minore e minore risulti pertanto anche la velocità istantanea.
I dati sperimentali suggeriscono che la velocità istantanea sia legata alla concentrazione dei reagenti da una relazione del tipo

dove A e B sono due reagenti generici, m ed n sono rispettivamente il numero di molecole di A e B che effettivamente partecipano alla reazione. m è l'ordine della reazione rispetto al reagente A, mentre n è l'ordine della reazione rispetto a B.
k è una costante di proporzionalità, detta costante di velocità specifica o costante cinetica.
Si definisce ordine complessivo della reazione la somma m + n degli esponenti a cui sono elevate le concentrazioni dei reagenti.
Generalmente m ed n coincidono con i coefficienti stechiometrici di A e B. Ciò non è comunque sempre vero. La determinazione dell'ordine di una reazione è infatti un dato sperimentale e dipende in ogni caso dal numero di particelle reagenti che effettivamente partecipano alla processo.
Per questo motivo molto spesso il valore assunto dall'ordine di una reazione può essere compreso solo attraverso la conoscenza del reale meccanismo di una reazione. Un esempio servirà a chiarire quanto affermato.
1) nella reazione 2HI → H2 + I2, la velocità dipende dal quadrato della concentrazione di HI
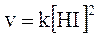
La reazione è dunque di secondo ordine e l'ordine coincide con il valore del coefficiente stechiometrico. Ciò perché effettivamente il meccanismo di reazione richiede che si scontrino due molecole di HI per dare una molecola di H2 ed una di I2.
2) Nella reazione NO2 + CO → NO + CO2, la velocità dipende dal quadrato della concentrazione di NO2

La reazione è dunque di secondo ordine e l'ordine non coincide con il coefficiente stechiometrico di NO2 e per di più non risulta nemmeno dipendere dalla concentrazione di CO. Per comprenderne il motivo è necessario far riferimento al meccanismo di reazione. La reazione avviene infatti in due stadi:
primo stadio - 2NO2 → NO3 + NO In cui è necessario lo scontro di due molecole di NO2. Per tale stadio la velocità sarà dunque 
secondo stadio - NO3 + CO → NO2 + CO2 in cui è necessario lo scontro di una molecola di NO3 con una di CO. Per tale stadio la velocità sarà dunque 
Poiché la velocità del primo stadio è molto minore della velocità del secondo stadio, la velocità della reazione complessiva coincide in pratica con la velocità del primo stadio.
Reazioni di primo ordine (cinetica di primo ordine)
Presentano una cinetica di primo ordine quelle reazioni in cui la velocità è direttamente proporzionale alla concentrazione di un solo reagente, secondo una legge del tipo
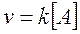
Ciò non significa che nella reazione non possa essere coinvolto più di un reagente, ma solo che la velocità dipende solo da uno dei reagenti presenti.
Nelle reazioni di primo ordine k si esprime in s-1 (infatti si ottiene come v/[A])
Più spesso viene utilizzata la relazione di velocità integrata (si ottiene integrando la relazione precedente) che mette in funzione la concentrazione con il tempo di reazione t
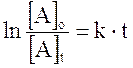
dove
[A]o = concentrazione iniziale di A
[A]t = concentrazione di A al tempo t
k = costante di velocità specifica
t = tempo di reazione
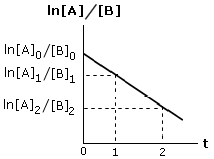
Si noti che, se la reazione segue una cinetica di primo ordine, riportando in un grafico l’andamento del logaritmo della concentrazione in funzione del tempo si ottiene una retta di pendenza k

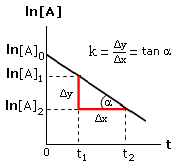
La costante di velocità specifica k può dunque essere calcolata conoscendo le concentrazioni a due tempi diversi. Il rapporto tra la differenza delle ordinate (Δy = ln[A]2 - ln[A]1) e la differenza delle ascisse (Δx = t2 – t1) di due punti fornisce infatti la pendenza della retta.

Esempio 1
Sapendo che la reazione 2N2O5 → 4NO2 + O2 segue una cinetica di primo ordine e che la costante di velocità specifica a 65°C vale k = 5,2.10-3 s-1, calcoliamo la concentrazione di N2O5 dopo 5 minuti, sapendo che la sua concentrazione iniziale era di 0,25 mol/L
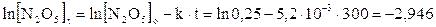
da cui
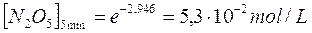
Esempio 2
La reazione in fase gassosa A(g) → 2B(g) + C(g) segue una cinetica di primo ordine. In condizioni di volume e temperatura costanti, la pressione totale iniziale del sistema è di 0,2227 atm, mentre dopo 21 minuti la pressione totale è di 0,3744 atm. Calcoliamo la costante di velocità e la pressione totale a 9 minuti.
Al tempo t = 0 la pressione totale è generata solo dal reagente ( i prodotti non si sono ancora formati) per cui la pressione di A al tempo t = 0 è pari a 0.2227 atm.
Al tempo t = 21 min hanno reagito x moli di A per dare 2x moli di B ed x moli di C. Le pressioni parziali dei tre gas avranno subito una variazione proporzionale. Per cui al tempo tempo t = 21 min le pressioni parziali dei tre gas saranno
A(g) → 2B(g) + C(g)
0,2227 – x 2x x
e la pressione totale della miscela al tempo t = 21 min sarà, per la legge di Dalton dell miscele gassose
Pt = PA + PB + PC = (0,2227 –x) + 2x + x = 0,3744 atm
da cui x = 0.07585 atm
La pressione parziale di A al tempo t= 21 min sarà quindi
PA(21 min) = 0,2227 – x = 0,2227 – 0,07585 = 0,14685 atm
Usiamo ora la relazione integrata di velocità per una reazione del primo ordine per calcolare la costante di velocità specifica


da cui k = 2 10-2 min-1
Calcoliamo ora la pressione parziale di A al tempo t = 9 min

da cui
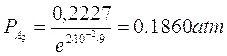
Se ne deduce che dopo 9 minuti la pressione di A è diminuita di 0.2227 – 0.1860 = 0.0367 atm
Ricordando che per ogni x atmosfere di diminuzione della pressione di A, la pressione di B aumenta di 2x atmosfere e quella di C aumenta di x atmosfere, dopo 9 minuti la pressione parziale dei prodotti sarà
PB = 2(0.0367) = 0.0734 atm
PC = 0.0367 atm
La pressione totale dopo 9 minuti sarà pertanto
Ptot = PA+ PB + PC = 0.1860 + 0.0734 + 0.0367 = 0.2961 atm
Esempio 3
Una reazione del primo ordine presenta una velocità iniziale V0 = 10-2 mol L-1 ore-1. Dopo 40 minuti la velocità si è ridotta ad un decimo. Calcolare la costante di velocità e la concentrazione iniziale del reagente.
Poiché in una reazione di primo ordine la velocità è direttamente proporzionale alla concentrazione del reagente V = k [A], possiamo scrivere
V0 = k [A]0 e Vt = k [A]t
Dividendo membro a membro si ottiene
V0/ Vt = [A]0 /[A]t
e poiché la velocità iniziale V0 è 10 volte maggiore della velocità Vt al tempo t = 40 minuti (4/6 di ora) potremo scrivere
V0/ Vt = [A]0 /[A]t = 10
Scriviamo ora la relazione di velocità integrata per le reazioni di primo ordine

e sostituiamo
ln (10) = k (4/6)
da cui k = 3,45 ore-1
Usiamo ora la costante di velocità specifica per calcolare la concentrazione iniziale
V0 = k [A]0
e, sostituendo
10-2 = 3,45 [A]0
da cui
[A]0 = 10-2 / 3,45 = 2,90 10-3 mol/L
* * * * * * * * *
Seguono cinetiche di primo ordine anche i decadimenti radioattivi, per i quali si calcola generalmente il tempo di dimezzamento
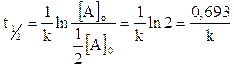
Come si può osservare, nel caso di cinetiche di primo ordine, il tempo di dimezzamento dipende solo dal valore di k e non dalla concentrazione iniziale. Nel caso dei decadimenti radioattivi k prende il nome di costante di decadimento radioattivo. Sapendo ad esempio che la costante di decadimento del carbonio14 è pari a 1,21.10-4 anni-1, possiamo facilmente calcolare il suo tempo di dimezzamento

Reazioni di secondo ordine (cinetiche di secondo ordine)
Presentano una cinetica di secondo ordine quelle reazioni in cui la velocità è direttamente proporzionale al prodotto delle concentrazioni di due reagenti oppure al quadrato della concentrazione di un solo reagente, secondo leggi del tipo

oppure

Nelle reazioni di secondo ordine k si esprime in L.mol-1.s-1 (o atm.s-1 se la specie chimica è gassosa)
Più spesso vengono utilizzate le relazioni di velocità integrata (si ottiene integrando una delle precedenti relazioni ) che mettono in funzione la concentrazione con il tempo di reazione t. Esse sono rispettivamente
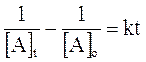
e
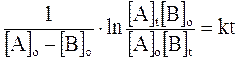
dove
[A]o = concentrazione iniziale di A
[A]t = concentrazione di A al tempo t
k = costante di velocità specifica
t = tempo di reazione
A) cinetica di tipo k[A]2
Se la reazione segue una cinetica di secondo ordine del tipo v = k[A]2, riportando in un grafico l’andamento del reciproco della concentrazione in funzione del tempo si ottiene una retta di pendenza k
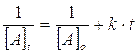
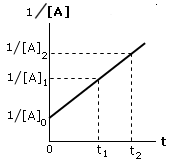
La costante di velocità specifica k può dunque essere calcolata conoscendo le concentrazioni a due tempi diversi
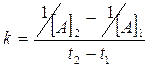
Esempio 1
Sapendo che la reazione 2HI → H2 + I2 segue una cinetica di secondo ordine e che la costante di velocità specifica a 800 K vale k = 9,2.10-2 L.mol-1.s-1, calcoliamo dopo quanto tempo la concentrazione di HI si è ridotta del 25%, sapendo che la sua concentrazione iniziale era di 5,3.10-2 mol/L

Esempio 2
La dimerizzazione gassosa a 326 °C del butadiene avviene secondo una cinetica del secondo ordine. Sapendo che la pressione iniziale è P0 = 0.8315 atm e la pressione dopo 33 minuti è P33 = 0,6944 atm, calcoliamo la costante di velocità.
Indichiamo con A il butadiene e con B il suo dimero. La reazione è del tipo
2A → B
Al tempo t = 0 la pressione totale è dovuta solo al butadiene (non si è ancora formato il dimero) e quindi la pressione iniziale Po del butadiene è pari a PA(0) = 0,831 atm
Al tempo t = 33 min. hanno reagito 2x moli di butadiene per dare x moli di dimero. Le pressioni parziali dei due gas avranno subito una variazione proporzionale. Per cui al tempo le pressioni parziali dei due gas saranno
PA(33) = (0,8315 – 2x) atm
PB(33) = x atm
e la pressione totale della miscela al tempo t = 33 min sarà
Pt(33) = PA(33) + PB(33) = (0,8315 – 2x) + x = 0,6944 atm
da cui x = 0.1371 atm
La pressione parziale del butadiene al tempo t= 33 min sarà quindi
PA(33) = (0,831 – 2x) = (0,8315 – 2•0,1371) = 0,5573 atm
Usiamo ora la relazione integrata di velocità per una reazione del secondo ordine del tipo 2A = B
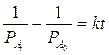
Sostituendo si ottiene
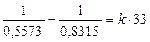
da cui k = 1,79 10-2 atm min-1
B) cinetica di tipo k[A] [B]
Se la reazione segue una cinetica di secondo ordine del tipo v = k[A][B], riportando in un grafico l’andamento del logaritmo del rapporto delle concentrazioni delle due specie chimiche in funzione del tempo si ottiene una retta di pendenza k([A]0 - [B]0)

La costante di velocità specifica k può dunque essere calcolata conoscendo il rapporto delle concentrazioni a due tempi diversi e la differenza di concentrazione al tempo iniziale.

Esempio 1
Una soluzione contenente 24.7 mM di arsenito di sodio e 50 mM di tellurato di sodio, tenuta per 4 h a 86° C, viene poi raffreddata rapidamente per bloccare la reazione. Si trova che il 74.2% dell’arsenito si è trasformato in arseniato:
AsO33- + TeO43- → AsO43- + TeO33-
Determiniamo il valore di k, assumendo che la reazione sia di primo ordine rispetto ad entrambi i reagenti.
[A]0 = [AsO33-]0 = 24,7 mM
[B]0 = [TeO43-]0 = 50 mM
Dopo 4 ore il 74,2% di A , pari a 24,7 x 0.742 = 18.3 mM, ha reagito con una eguale quantità di B. La quantità residua dei due reagenti sarà quindi
[A]t = [A]0 – 18.3 = 24.7 – 18.3 = 6.4 mM
[B]t = [B]0 – 18.3 = 50 – 18.3 = 31.7 mM
Utilizziamo ora la relazione di velocità integrata per le reazioni di secondo ordine

e sostituiamo
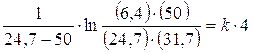
da cui k = 8,84 10-3 mmol L-1 h-1
Esempio 2
La reazione di spostamento di Br- dal bromuro di n-propile mediante lo ione tiosolfato a 37,5 °C
S2O32- + n-C3H7Br → n-C3H7S2O3- + Br-
segue una cinetica del secondo ordine con un’equazione di velocità:
v = k[S2O32-][ n-C3H7Br]
Trattando l’n-propile con tiosolfato in eccesso e determinandone la sua concentrazione residua a tempi diversi sono stati ottenuti i seguenti risultati
t(s) |
0 |
1110 |
∞ |
[S2O32-] (mol L-1) |
0,0966 |
0,0904 |
0,0571 |
Calcoliamo la costante di velocità e la concentrazione del prodotto di reazione al tempo t = 7380 s.
Per semplicità indichiamo con [A] la concentrazione del tiosolfato e con [B] la concentrazione del bromuro di n-propile.
Calcoliamo la concentrazione iniziale [B]o di n-propile al tempo t = 0 s. Poiché la reazione avviene in presenza di un eccesso di tiosolfato, possiamo assumere che al tempo t = ∞ tutto l’n-propile inizialmente presente abbia reagito, con una quantità di tiosalfato pari alla differenza tra la concentrazione iniziale di tiosolfato [A]o e la sua concentrazione finale [A]∞. Si avrà quindi
[B]o = [n-propile]o = [A]o - [A]∞ = 0.0966 – 0.0571 = 0.0395 M
Calcoliamo ora la concentrazione [B]t di n-propile al tempo t = 1110 s. Osserviamo come al tempo t = 1110 s la concentrazione del tiosolfato è diminuita di una quantità pari a
Δ[A] = [A]o - [A]t = 0.0966 – 0.0904 = 0.0062 M
Poiché i due reagenti reagiscono in rapporto di 1 a 1, anche la concentrazione dell’n-propile sarà diminuita della stessa quantità. Per cui al tempo t = 1110 s la sua concentrazione sarà pari a
[B]1110 = [B]o – 0.0062 = 0.0395 – 0.0062 = 0.0333 M
Usiamo la relazione integrata di velocità

e sostituiamo opportunamente le concentrazioni

da cui k = 1,65 10-3
Se ora indichiamo con x la quantità di tiosolfato reagente che reagisce in 7380 secondi con altrettante mol/L di n-propile per dare x mol/L di ciascuno dei due prodotti di reazione, le concentrazioni iniziali e le concentrazioni dopo t = 7380 s saranno
[A]o = [S2O32-]o = 0.0966 M [A]t = [S2O32-]t = (0.0966 – x) M
[B]o = [n-propile]o = 0.0395 M [B]t = [n-propile]t = (0.0395 –x) M
Sostituendo nella relazione integrata di velocità si ottiene

da cui x = 0.0245 mol L-1
Esempio 3
La velocità specifica della seguente reazione di idrolisi di un estere RCOOR’:
RCOOR’(aq) + OH-(aq) → RCOO-(aq) + R’OH(aq)
risulta essere 0.2 Lmol-1s-1. Calcoliamo la concentrazione dell’estere dopo 15 secondi dall’aggiunta della base, sapendo che le concentrazioni iniziali della base e dell’estere sono rispettivamente 0.10 M e 0.20 M
La reazione segue una cinetica di secondo ordine (ce lo conferma l’unità di misura della costante di velocità specifica Lmol-1s-1). Per risolvere il problema si usa pertanto la relazione

Per semplicità indichiamo con [A] la concentrazione dell’estere e con [B] la concentrazione della base (ione OH-). Se ora indichiamo con x la quantità di estere che reagisce in 15 secondi con altrettante mol/L di base, le concentrazioni dopo 15 secondi saranno
[A]15 = [RCOOR’]t = 0.2 - x M
[B]15 = [OH-]t = 0.1 - x M
Sostituendo nella relazione integrata di velocità si ottiene

Da cui x = 0,041 mol/L
Le concentrazioni dopo 15 secondi saranno pertanto
[A]15 = [RCOOR’]t = 0.2 - x = 0.2 – 0.041 = 0.159 M
[B]15 = [OH-]t = 0.1 - x = 0.1 – 0.041 = 0.059 M
Reazioni di ordine zero (cinetiche di ordine zero)
Presentano una cinetica di ordine zero quelle reazioni in cui la velocità è indipendente della concentrazione, secondo una legge del tipo

Un esempio di reazione di ordine zero è dato dalla decomposizione dell'ammoniaca su di un filo di platino riscaldato 2NH3  N2 + 3H2. La velocità di decomposizione dell'ammoniaca rimane costante per tutto il processo.
N2 + 3H2. La velocità di decomposizione dell'ammoniaca rimane costante per tutto il processo.
fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Chimica generale 8
Visita la nostra pagina principale
Chimica generale 8
Termini d' uso e privacy