Storia della chimica
Storia della chimica
- Quando nasce la chimica?
Gli uomini primitivi, quando incominciarono a servirsi degli utensili, accettavano la natura come la trovavano. Il femore di qualche grosso animale poteva essere usato come bastone…..
Col passare dei millenni, gli uomini impararono a forgiare le pietre in modo da dotarle di bordi taglienti oppure di impugnature. Comunque la pietra rimaneva pietra.
A volte, tuttavia, la natura della materia si trasformava. Poteva accadere che un fulmine incendiasse una foresta, oppure un pezzo di carne guasta incominciava a puzzare. Questo genere di trasformazioni nella natura e nella struttura delle sostanze si dicono trasformazioni chimiche.
Solo quando l’uomo apprese l’arte di accendere e di tenere in vita il fuoco, ebbe la possibilità di effettuare vantaggiose trasformazioni chimiche. Una volta appresa quest’arte, l’uomo iniziò a diventare un chimico di professione, cioè iniziò a escogitare sistemi che gli permettessero di guidare la luce e il calore prodotto dal fuoco per i suoi scopi. Pian piano iniziò a utilizzare il calore generato dal fuoco per provocare ulteriori trasformazioni chimiche: si cuoceva il cibo, si poteva cuocere l’argilla per fare mattoni e vasellame e a lungo andare si arrivò alla produzione di qualche tipo di vetro.
1.1 Il primo chimico: l’uomo che lavorava i metalli
Era ancora il neolitico (8.000-4.000 anni fa) quando l’uomo iniziò a elaborare tecniche di lavorazione dei materiali (in Medio Oriente nell’attuale Egitto e Iraq). Il materiale più usato rimaneva sicuramente la pietra, o meglio le pietre. Si scoprirono che alcune pietre rare erano molto particolari: erano belle perché lucenti e facilmente lavorabili (malleabili): l’uomo aveva scoperto i primi metalli, rinvenuti sotto forma di pepite (pepite di oro e rame). Con la lavorazione dei metalli l’uomo inizia a trasformare la natura per i suoi scopi.
Presto si scoprì che il rame non occorreva trovarlo necessariamente puro, ma che era possibile ottenerlo partendo dalla pietra (la scoperta forse ha avuto origine in un fuoco di legna acceso sopra uno strato di sassi azzurrognoli contenente rame). Il rame venne impiegato per utensili, padelle, armi (3200. a. C. in tomba egizia). Poi i minerali di rame vennero fusi insieme a minerali di stagno e si ottenne la prima lega: il bronzo. (La guerra di Troia fu combattuta da guerrieri muniti di armature e scudi di bronzo che si scagliavano addosso lance dalla punta di bronzo).
Ancora per caso, forse grazie a un fulmine, venne scoperto un metallo molto più duro: era il ferro. Il guaio è che il ferro è legato alla pietra molto più strettamente del rame. Per fondere il ferro occorrono temperature molto più alte e il fuoco di legna è insufficiente. Il segreto della fusione del ferro fu scoperto finalmente nel 1500 a. C. nell’Asia Minore dagli Ittiti (Turchia), un popolo che creò un grande impero.
In Egitto la pratica chimica raggiunse un notevole sviluppo nei metodi di imbalsamazione e di conservazione del corpo umano dopo la morte.
Possiamo quindi concludere che ancora prima del grande splendore della civiltà greca, l’arte della chimica pratica aveva raggiunto un notevole grado di sviluppo.
- Quando si inizia a studiare chimica? La grande civiltà greca
Verso il 600 a. C. gli studiosi greci o filosofi (amanti della saggezza), iniziarono a indagare sulla natura dell’universo e la struttura delle sostanze che lo compongono. Essi si preoccupavano non tanto della tecnologia o della possibilità di applicazioni pratiche, quanto al perché dei fenomeni. I greci furono i primi di cui si possa dire che abbiano studiato quella che oggi chiamiamo chimica teorica.
2.1 Quali erano le domande dei greci sulla natura?
Due questioni fondamentali interessarono i greci:
- “Qual è la vera natura dell’universo?”. La prima domanda quindi riguarda la ricerca della sostanza (elemento) di base che forma tutto il resto. A questa domanda vennero date molte risposte: per il filosofo Talete l’acqua era l’elemento di base che costituisce tutte le sostanze; per Eraclito era il fuoco ad essere presente in ogni cosa; per Anassimene l’elemento dell’universo era l’aria; Empedocle sosteneva che non esiste un elemento unico, ma quattro, cioè aria-acqua-terra-fuoco; Aristotele ai quattro elementi di Empedocle ne unisce un quinto, l’etere, per descrivere il firmamento.
- “È possibile prolungare all’infinito la suddivisione della materia?”. La seconda domanda è quindi relativa alla divisibilità della materia. Leucippo e Democrito (400 a. C.) credevano che a lungo andare, da questa divisione, si sarebbe ottenuto un frammento di dimensioni minime non suscettibile di ulteriori divisioni. Fu Democrito, in particolare, che chiamò atomos, cioè indivisibile, le particelle minime della materia. Noi abbiamo ereditato questa parola sotto forma di atomo.
Democrito riteneva che gli atomi di ciascun elemento fossero diversi per forma e dimensione, e che proprio questa diversità spiegasse le differenti proprietà dei vari elementi. Le sostanze reali, continua Democrito, che possiamo vedere e toccare erano composte di miscugli di atomi dei vari elementi e si poteva trasformare una sostanza in un’altra modificando la natura del miscuglio.
Tutto questo ci sembra straordinariamente moderno, ma Democrito non ricorse a esperimenti per dimostrare la validità delle sue teorie.
- L’alchimia
Nei secoli successivi le culture dei diversi popoli iniziarono a fondersi e la conoscenza greca della teoria incontrò l’abilità egiziana nel campo dell’imbalsamazione dei morti e nei riti religiosi. Un alone di mistero iniziò ad avvolgere la chimica e la gente comune iniziò a guardare con timore le persone che la praticavano.
La teoria dei quattro (o cinque) elementi permetteva di pensare che le varie sostanze differissero tra loro soltanto nella natura del miscuglio degli elementi. Sembrava quindi legittimo pensare di potere effettuare qualunque trasformazione, anche la trasformazione del ferro in oro. La chimica divenne qualcosa di magico (chiamata alchimia), ma anche oscuro, in mano a ciarlatani e imbroglioni che si spacciavano per studiosi seri.
Tralasciamo cosa successe nei secoli successivi, basti dire che fino al 1100 d. C. la storia della chimica in Europa è praticamente inesistente. Dopo il 650 d. C. la conservazione e il progresso delle conoscenze greco-egiziane passarono completamente in mano agli arabi, che svilupparono lo studio dei metalli e delle medicine. A testimonianza di ciò ricordiamo che molti termini chimici derivano dall’arabo: alambicco, nafta, alcool, zirconio,…
3.1 Dopo gli arabi, nel 1200 la chimica torna in Europa
Con la decadenza dell’impero arabo e le crociate, le immense conoscenze arabe tornarono in Europa. Dopo un periodo di diffidenza e riluttanza verso i testi arabi (gli arabi erano i mortali nemici del mondo cristiano), alcuni studiosi iniziarono a tradurre in latino le loro opere. A partire dal 1200 gli studiosi europei ebbero la possibilità di assorbire le conoscenze alchimistiche del passato e di cercare di farle progredire.
Con Bacone nel 1200 iniziò a intravedersi la convinzione che, per aspirare al progresso della conoscenza, era necessario fondarsi sull’esperienza e applicare alla scienza metodi matematici. Bacone intravvedeva una importante verità, ma i tempi non erano ancora maturi.
3.2 La stampa e la divulgazione dei testi
Il 1400 e il 1500 furono caratterizzati dalle grandi esplorazioni geografiche e dall’invenzione della stampa. Il 1543 vede la pubblicazione di due libri rivoluzionari che prima dell’invenzione della stampa sarebbero stati ignorati e probabilmente trascurati. Ora però questi testi si diffusero ovunque e portarono all’inizio di quella che viene chiamata “la rivoluzione scientifica”.
Uno di essi era il libro di Copernico in cui si sosteneva che il centro dell’universo è il sole e non la terra, come insegnavano i grandi astronomi greci. L’altro libro, scritto dal fiammingo Vesalio, descriveva l’anatomia umana con una precisione senza precedenti. Molte osservazioni di Vesalio respingevano antiche convinzioni che risalivano a fonti greche.
Nonostante le novità in campo scientifico, ancora si accettava l’idea dei quattro elementi e si cercava la pietra filosofale, anche gli studiosi iniziarono a manipolare i metalli non tanto per ricavare l’oro, quanto piuttosto per la preparazione di medicine.
Nel diciassettesimo secolo l’alchimia andò perdendo gradualmente la propria importanza, finché nel diciottesimo secolo si trasformò in quella che oggi chiameremo chimica.
- Il vero cambiamento si ha con il metodo sperimentale e le misurazioni
La rivoluzione scientifica iniziata nel 1500, arrivò al culmine con Galileo (1564-1642) e Newton (1642-1727). Nel 1687 venne pubblicato il libro con le tre famose leggi sul moto dei corpi in Newton descrive il movimento dei corpi attraverso il linguaggio matematico. La matematica che descrive la realtà!!!
Mentre si edificava la struttura moderna della fisica e dell’astronomia con una solidità che stupirono il mondo scientifico, in campo chimico ancora ci si affannava a staccarsi dall’alchimia e dalla ricerca dell’oro. La colpa del persistere di questo atteggiamento errato non era esclusivamente dei chimici. Se essi esitavano ad adottare le tecniche matematiche quantitative di Galileo e Newton, era anche perché l’oggetto del loro studio era difficilmente rappresentabile dal linguaggio matematico.
Il primo a dare una svolta significativa fu Boyle (1627-1691). Egli intraprese lo studio dei gas e giunse a due fondamentali scoperte. In primo luogo utilizzò, come Newton, il linguaggio matematico per descrivere il comportamento dei gas, in secondo luogo ripropose l’ipotesi atomistica per descrivere la natura della materia. Secondo Boyle la compressione dell’aria altro non è che l’eliminazione degli spazi vuoti dal volume e il conseguente avvicinamento degli atomi. L’atomismo inizia a fare molti proseliti, tra cui anche Newton, anche se il concetto di atomo continua a essere nebuloso.
La carriera di Boyle segna il tramonto dell’alchimia e fu proprio lui a cambiare il nome di questa scienza in chimica. Boyle era scettico e insoddisfatto dei tentativi di individuare gli elementi dell’universo per mezzo del semplice ragionamento. Secondo lui, occorreva mettere alla prova i presunti elementi per stabilire se fossero effettivamente semplici. Boyle era quindi in favore del metodo sperimentale.
Nei decenni che seguirono avvennero grandi cambiamenti:
- vennero scoperti nuovi elementi (gas e metalli);
- venne dato il via alla rivoluzione industriale (verso ilo 1700) grazie all’invenzione della macchina a vapore;
- venne studiata la combustione e la formazione della ruggine;
- vennero inventate tecniche per raccogliere e pesare i gas prodotti durante una reazione chimica;
- venne potenziata l’analisi chimica per riconoscere le varie sostanze.
- Il padre della chimica: Antonine Laurent Lavoisier
Verso la fine del 1700 cominciò a imporsi l’esigenza di riunire in una teoria generale le numerose e importanti scoperte avvenute nel campo della chimica. L’uomo che ci riuscì fu il chimico francese Antonine Laurent Lavoisier (1743-1794). Fin dall’inizio delle sue ricerche, egli aveva riconosciuto l’importanza di misurazioni accurate. Studiò le combustioni, la formazioni dei metalli a partire dai minerali, la condensazione dell’acqua… e arrivò a conclusioni fondamentali per la storia della chimica:
- capì che il diamante è una forma particolare del carbonio;
- che i minerali sono combinazioni di metalli e gas;
- che l’aria è una miscela di vari gas;
- che il flogisto (questa strana essenza contenuta nelle sostanze che bruciano) non esiste;
- che la composizione degli acidi coinvolge l’ossigeno;
- ma soprattutto enunciò la legge di conservazione della massa, vera e propria pietra angolare della chimica.
Le nuove teorie di Lavoisier implicavano una completa razionalizzazione della chimica. Venivano aboliti tutti i misticismi; d’ora in avanti, avrebbero avuto interesse per i chimici solo le sostanze in grado di essere pesate o altrimenti misurate. Nel 1787 pubblicò un sistema logico di nomenclatura, così che la chimica non sarebbe più stata una farragine di nomi come ai tempi dell’alchimia. Nel 1789 pubblicò il primo trattato moderno di chimica dando al mondo una visione unitaria della conoscenza della chimica.
Fonte: http://malpighi.altervista.org/fguizzardi/downloads/storia%20della%20chimica.doc
Storia della chimica
Romanelli Matteo
Bianconi Maria Concetta
LA CHIMICA LETTA ATTRAVERSO L’OPERA DEI SUOI PROTAGONISTI
IL PERIODO ANTICO
La chimica nasce come tecnologia e non come scienza a partire dal IV millennio a.C. nell’area del Mediterraneo orientale (Egitto, Mesopotamia, Asia Minore). A quell’epoca gli scopi principali erano essenzialmente di carattere pratico (lavorazione dei metalli, produzione del vetro, estrazione di pigmenti naturali…), ma in Egitto la khemeia assunse rapidamente significato religioso. I greci per primi cominciarono a dare alla materia anche un connotato teorico, ma questo rimaneva basato sul metodo deduttivo aristotelico, che permise ben poche scoperte.
 L’ALCHIMIA
L’ALCHIMIA
L’alchimia venne all’inizio praticata da Arabi e Bizantini a partire dal V secolo, passando successivamente anche nell’Europa occidentale. Lo scopo dell’alchimista era la scoperta della pietra filosofale, una fantomatica sostanza in grado di trasformare ogni materiale in oro. Ovviamente l’alchimia non raggiunse mai il proprio scopo, ma fu molto importante per l’eredità che lasciò ai futuri chimici, come la scoperta delle proprietà di molte sostanze o la messa a punto di nuovi strumenti. Inoltre nell’alchimia si trovano anche le radici delle odierne farmacologia e fisiologia. L’alchimia entrò in crisi con la formulazione da parte di Galileo Galilei del metodo scientifico sperimentale e poi viene considerata conclusa con l’opera di Robert Boyle.
 ROBERT BOYLE, IL CHIMICO SCETTICO
ROBERT BOYLE, IL CHIMICO SCETTICO
Si può senza dubbio alcuno affermare che l’opera di Boyle abbia precorso i tempi di almeno 150 anni, anticipando quella dei primi chimici moderni. Robert Boyle nacque a Lismore, in Irlanda, nel 1627, figlio del duca di Cork. La provenienza da una famiglia nobile gli consentì di coltivare la passione per gli studi e in particolare per l’alchimia. Ebbe la possibilità di viaggiare in Francia e in Italia, dove conobbe l’opera di Galileo. Grazie alla sua abilità sperimentale, come detto sorprendente per l’epoca, unita ad un’elevata capacità speculativa, riuscì a cogliere diversi successi: enunciò la legge isoterma PV=k, poi fissò per primo lo 0 come temperatura di fusione del ghiaccio, infine dimostrò sperimentalmente il paradosso idrostatico , già spiegato teoricamente da Stevino con l’omonima legge. Ma la sua opera principale è il libro “Il chimico scettico” in cui riassume le proprie scoperte, critica aspramente la teoria degli elementi, dimostra che l’aria è un miscuglio ed enuncia una prima teoria corpuscolare, che poi ritroveremo, perfezionata, nell’enunciato di Dalton. Infine definisce per la prima volta i termini composto e elemento in questi termini:
ELEMENTO: sostanza non separabile ulteriormente nemmeno con reazioni chimiche
COMPOSTO: sostanza formata da più elementi.
Negli ultimi anni della sua vita si dedicò soprattutto a ricerche pratiche, ma ebbe ancora successi, come la scoperta del fosforo o la sintesi dell’acido fosforico. Morì a Londra nel 1691, dopo aver fondato la Royal Society, che aveva come scopo lo scambio di informazioni e la cooperazione tra differenti scienziati. Anche qui in anticipo, Boyle aveva capito che la ricerca non può essere compiuta da uno scienziato isolato, ma deve essere il risultato dell’unione delle differenti esperienze di vari ricercatori.
 STAHL E IL FLOGISTO: UN PASSO INDIETRO NELLA RICERCA CHIMICA
STAHL E IL FLOGISTO: UN PASSO INDIETRO NELLA RICERCA CHIMICA
Il Seicento è stato un secolo di grande sviluppo economico, a partire dalla fine della grande epidemia di peste del 1630. Per questo l’attività estrattiva dei metalli divenne sempre più importante, per sostenere la continua crescita delle manifatture, primo nucleo di quel fenomeno oggi noto come rivoluzione industriale. Ma, pur essendo le tecniche di lavorazione dei metalli note fin dall’epoca degli Ittiti, alcuni processi restavano tuttavia oscuri. Soprattutto era complicato lo studio della combustione e della calcinazione dei metalli. Infatti si osservava che durante la fusione parte di essi bruciava, trasformandosi in calce ed aumentando di peso. Mentre poi scaldando queste calci con carbone, riavevamo il metallo di partenza, assieme ad una diminuzione di peso. Per risolvere la questione, nel 1715 il professore tedesco Stahl, dell’università di Jena, avanzò la teoria del flogisto: metalli e combustibili erano ricchi di questa sostanza dalle straordinarie proprietà: aveva peso negativo, era il principio dell’infiammabilità, aveva la facoltà di uscire da un corpo per entrare in un altro. Stahl dunque spiegò con queste due reazioni i fenomeni di combustione e calcinazione:
METALLO – FLOGISTO = CALCE (avendo il flogisto peso negativo, la calce pesa più del metallo)
CALCE + COMBUSTIBILE = METALLO + CENERE (il combustibile è ricco di flogisto, lo cede alla calce, che così riduce il suo peso e diviene metallo)
La teoria di Stahl può sembrare oggi abbastanza astrusa, ancora figlia di una mentalità alchimistica, piuttosto che di una ricerca scientifica, ma ebbe grande successo specialmente in Inghilterra e in Francia. Solo nel 1770 alcuni iniziarono a mettere in dubbio la validità di quella che a tutti gli effetti è stata la prima teoria chimica di ampie proporzioni, ma si dovrà attendere Lavoisier nel 1789, perché la teoria venga del tutto superata. Per assurdo, però, oggi si può dire che la teoria del flogisto sia stata anche di qualche utilità per la chimica: infatti le frenetiche ricerche fatte dai chimici per tentare di isolare il flogisto (che ovviamente non fu mai trovato) produssero una serie di scoperte accessorie, che furono humus necessario per il lavoro di Lavoisier.
Georg Ernst Stahl non deve però essere ricordato solamente per la sua teoria del flogisto, ma anche per i suoi studi sulla fermentazione, che in alcuni punti restano ancora oggi validi, e per quello sui sali di potassio. Inoltre fu il primo ad osservare che gli acidi possono avere differenti gradazioni di forza. Fu anche eccellente medico, tanto da divenire dottore personale di Federico Guglielmo I di Prussia.
LA CHIMICA PNEUMATICA
È necessario, prima di approfondire la nascita della chimica moderna grazie alle prime tre leggi ponderali di Lavoisier, Proust e Dalton, accennare rapidamente alle ricerche sui gas che alcuni scienziati compirono nel XVIII sec., ottenendo risultati fondamentali per lo sviluppo della disciplina.
Fino al XVI secolo, l’unica sostanza aeriforme conosciuta era l’aria, ritenuta, secondo la teoria aristotelica degli elementi, non un miscuglio ma una sostanza pura. Poi ci fu il fondamentale lavoro del fiammingo Jan Baptist van Helmont, che scoprì l’anidride carbonica dalla combustione del legno e per primo usò il termine gas, adattamento fonetico al fiammingo della parola greca chaos, che nella cultura classica indicava la caotica sostanza primordiale che, una volta ordinata, dette vita al kosmos.
Ricordiamo ora altri importanti ricercatori: Henry Cavendish, inglese, personalità poliedrica che, nonostante le nobili origini, condusse una vita semplice per amore della scienza. Ottenne notevoli risultati: nel 1766 scoprì l’idrogeno tramite la reazione: 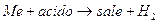 ma soprattutto compì ricerche sui circuiti elettrici con straordinari risultati che gli consentirono tra l’altro di anticipare le leggi di Ohm. Purtroppo la morte lo sorprese nel 1810, prima che i suoi risultati potessero essere completamente pubblicati. Sarà lo scozzese Maxwell a riscoprire, alla fine del XIX° secolo le sue ricerche in maniera completa.
ma soprattutto compì ricerche sui circuiti elettrici con straordinari risultati che gli consentirono tra l’altro di anticipare le leggi di Ohm. Purtroppo la morte lo sorprese nel 1810, prima che i suoi risultati potessero essere completamente pubblicati. Sarà lo scozzese Maxwell a riscoprire, alla fine del XIX° secolo le sue ricerche in maniera completa.
La scoperta dell’ossigeno è dovuta a Priestley e Scheele, che in maniera indipendente giunsero, contemporaneamente allo stesso risultato. Joseph Priestley (1733-1804), non fu solamente chimico, ma anche filosofo e teologo, pur non raggiungendo in questi ultimi due campi i livelli di eccellenza che lo contraddistinsero nella ricerca scientifica, alla quale tuttavia si dedicò solo negli ultimi anni della sua vita, quando fu costretto a rifugiarsi, per motivi politici, negli Stati Uniti, appena divenuti indipendenti, collaborando con illustri personaggi come Benjamin Franklin. Karl Wilhelm Scheele nacque in un sobborgo di Göteborg nel 1742, in una famiglia di umili condizioni. Studiò per otto anni farmacia, trasferendosi a 27 prima a Stoccolma e poi alla prestigiosa università di Uppsäla. A soli 35 anni però, decise di ritirarsi dalla carriera accademica, rifiutando addirittura un’offerta dall’università di Berlino, per potersi dedicare in tranquillità, nella piccola cittadina di Köping, ai suoi studi di chimica, che furono molto fecondi: scoprì l’ossigeno, il cloro, dimostrò che la grafite è composta da carbonio, scoprì l’acido cianidrico (HCN), quello ossalico (H2C2O4) e quello lattico. Ancora oggi l’arsenito rameoso (Cu3AsO3) è conosciuto come verde di Scheele. Il farmacista svedese inoltre dà il suo nome anche ad un minerale, la scheelite, dal quale per primo estrasse il tungsteno (W). Nel 1779 ottenne la glicerina. Morì nel 1786.
LAVOISIER: NASCE LA CHIMICA MODERNA
Antoine Laurent de Lavoisier segna una svolta decisiva nella storia della chimica. Nato in una ricca famiglia borghese parigina nel 1743, si dedica inizialmente agli studi umanistici, particolarmente s’interessa di giurisprudenza. Ma già a vent’anni i suoi interessi si erano spostati nelle materie scientifiche: anatomia, chimica e botanica. A 25 anni iniziò un’indagine meteorologica assieme ad altri ricercatori dell’Accademia delle scienze, che portò ad un radicale cambiamento nelle tecniche agricole della Francia. Si dedicò al perfezionamento della bilancia, che diventò strumento insostituibile delle sue ricerche. Nel 1787 pubblicò un’opera sulla riforma della nomenclatura e del simbolismo chimici. Ma la sua pubblicazione fondamentale è di due anni dopo: Traité Elémentaire de Chimie, dove espone le sue teorie antiflogistiche, ma soprattutto enuncia la prima legge ponderale, nota come legge di conservazione della massa: in una reazione chimica la massa totale delle sostanze reagenti è uguale alla massa delle sostanze prodotte. Con questa affermazione Lavoisier confuta una volta per tutte le teorie flogistiche di Stahl, dimostrando che in realtà le reazioni prese in considerazione da Stahl si potevano spiegare facilmente considerando l’intervento dell’ossigeno. Morì nel 1794, ghigliottinato, vittima del periodo del terrore.

PROUST: LA LEGGE DELLE PROPORZIONI DEFINITE E COSTANTI
Nel 1799, a 10 anni dall’enunciato di Lavoisier, rimanevano però ancora vivi nell’immaginario collettivo alcuni principi alchimistici, come quello secondo cui una stessa sostanza avesse composizione differente a seconda della zona in cui era stata trovata. A superare questa idea così diffusa, pensò Joseph Louis Proust (1754-1826), chimico francese che tuttavia svolse gran parte dei suoi studi in Spagna, dove il re Carlo IV lo aveva nominato direttore della scuola di artiglieria di Segovia. Qui poté studiare la pirite e il solfuro di ferro (FeS2 e FeS), composti necessari nella fabbricazioni delle polveri da sparo, attività per cui era pagato lo scienziato. Proprio l’utilizzo dell’analisi chimica, di cui fu uno dei fondatori, gli permise di dimostrare che la composizione percentuale di Fe e di S era costante in qualsiasi campione si analizzasse, di qualsiasi provenienza. Poi Proust ripeté con successo l’esperimento anche sul carbonato rameico (CuCO3) e sull’acqua. Nel 1806 si ritirò a vita privata, studiando miglioramenti per le mongolfiere, da poco inventate. La sua legge sostiene che“in un composto chimico puro gli elementi costituenti sono sempre presenti in un rapporto di massa definito e costante”. 
 DALTON: LA PRIMA TEORIA ATOMICA
DALTON: LA PRIMA TEORIA ATOMICA
John Dalton fu figura poliedrica e fondamentale nello sviluppo della chimica moderna, riportando d’attualità la teoria atomica che era già stata formulata, anche se su basi non sperimentali ma solo deduttive, nell’antichità greca da Leucippo e Democrito e ripresa in epoca romana da Lucrezio nel De Rerum Natura. In epoca rinascimentale, con la riscoperta delle antiche filosofie antiaristoteliche, dimenticate nel Medioevo , alcuni pensatori riportarono in auge tale idea, di cui anche Boyle, in alcuni testi, parrebbe essere sostenitore. Ma Dalton fu il primo a proporla su basi scientifiche.
Il primo importante risultato fu l’enunciazione della terza legge ponderale, nota anche con il suo nome oppure come legge delle proporzioni multiple: quando due elementi si combinano tra loro per formare due o più composti, i rapporti tra le quantità in massa di uno stesso elemento, combinato con quantità fissa dell’altro sono espressi da numeri interi, generalmente piccoli. Dalton lavorò con le anidridi del cloro: Cl2O, Cl2O3, Cl2O5, Cl2O7. Si vede chiaramente che, tenendo fisse le due moli di Cl, abbiamo un rapporto per l’O di 1:3:5:7 moli .
Poté così formulare la teoria atomica, che si configura come la sintesi delle tre leggi ponderali, riassunta da Dalton in quattro punti:
- La materia è costituita da particelle piccolissime e indivisibili chiamate atomi
- Gli atomi di uno stesso elemento sono tutti uguali ed hanno la stessa massa; atomi di elementi diversi hanno masse diverse (come si evince dalla legge di Proust)
- Atomi differenti possono combinarsi tra loro in rapporti diversi e le combinazioni avvengono fra atomi interi e non tra frazioni di atomi. (Dalton)
- In una combinazione chimica gli atomi degli elementi conservano la loro identità e non vengono distrutti (cambia soltanto il modo in cui essi si combinano per formare un composto). (Lavoisier)
Da ciò deriva che l’atomo è definibile come una particella di materia che durante le reazioni chimiche mantiene la propria identità.
Dalton però sbagliò su un punto, e cioè sulla spiegazione della differenza tra composti ed elementi: infatti ignorava l’esistenza delle molecole e sostenne l’esistenza di atomi composti, di peso uguale alla somma degli atomi elementari che lo compongono.
Non è un errore da poco, infatti Dalton se lo portò dietro anche nella fase successiva della sua ricerca: si propose infatti l’ambizioso obiettivo di massare tutti gli atomi allora conosciuti. Non esistendo strumenti così accurati da permettere un’esatta misura del peso atomico. Poiché misurare una grandezza significa confrontarla con un’unità di misura data, riuscì comunque a superare il problema, decidendo di non utilizzare come termine di paragone il kilogrammo ma la massa dell’atomo che entrava nei rapporti ponderali sempre con il numero minore e cioè l’H, che divenne l’u.m.a. (unità di massa atomica) . Un atomo di H pesava 1 u. Gli altri atomi venivano massati in relazione all’H. Il problema giunse quando si arrivò all’O. Nell’acqua il rapporto tra H e O era di 1:8, ma non conoscendo la molecola (H2O) non si poteva escludere che l’atomo complesso di acqua fosse HO o addirittura HO2. Ma Dalton introdusse in maniera arbitraria (non empirica e dunque errata) il principio della massima semplicità: in assenza di evidenze contrarie, si deve proporre la formula più semplice. Dunque l’acqua è HO e l’O ha massa 8u. Quest’errore sarà corretto solo 50 anni dopo.
Dalton nella sua vita si occupò però anche di altro: fu eccellente meteorologo (e anzi in questa disciplina cominciò la carriera), fisico (enunciò la legge della somma delle pressioni dei gas parziali) e si dedicò anche alla medicina, studiando su sé stesso la malattia oggi nota come daltonismo. Morì a 78 anni nel 1844 nella sua città natale, Manchester.
BREVE STORIA DELLA U.M.A.
L’u.m.a., o dalton, si è resa necessaria per i chimici, data l’impossibilità di massare in termini assoluti atomi e molecole. Dalton la stabilì nell’H, poiché era l’atomo che entrava con il numero più basso nei rapporti ponderali. Ma ben presto si passò all’O, in quanto l’ossigeno forma composti con tutti gli altri elementi ed era dunque più facile il confronto: corretto l’errore di Dalton e riconosciuto che l’O è 16u, si stabilì la nuova u.m.a. in 1/16 dell’O. Solo recentemente la IUPAC decide di passare alla dodicesima parte del carbonio-12, in seguito alla scoperta degli isotopi e alla creazione di strumenti a campi magnetici, come lo spettrometro di massa, in grado di calcolare con estrema precisione la massa degli atomi. La u attuale vale 1,66∙10-27 kg, mentre l’atomo di H vale 1,67∙10-27 kg. Come vediamo la differenza è minima, quasi impercettibile, ma la correzione ha soprattutto carattere teorico. Oggi l’H ha una u.m.a. di 1,008, non tanto per questa minima correzione quanto per l’esistenza di due isotopi: deuterio e trizio.

BERZELIUS RIORDINA LA NOMENCLATURA
Il barone Jöns Jach Berzelius fu amico di Dalton, ma soprattutto un grandissimo chimico. Coetaneo dell’inglese, non ebbe la sua versatilità, ma si dedicò solo alla chimica. Razionalizzò i simboli chimici , inserendone uno certo per ogni elemento, basato sull’iniziale del nome in lingua greca o latina. Propose l’O come u.m.a. e diede il nome di ammonio allo ione NH4+. Fu il primo chimico organico ed enunciò i concetti di isomeria, allotropia e polimeria, oltre alle leggi dell’elettrochimica. Scoprì un gran numero di elementi: selenio, calcio, torio, cerio, bario, tantalio, zirconio, vanadio, stronzio. Descrisse le proprietà del silicio. Fu Presidente dell’Accademia delle Scienze di Stoccolma dal 1810 fino alla morte nel 1848, a 69 anni.
BREVE STORIA DELLA CHIMICA ORGANICA
Apriamo ora una parentesi per analizzare una branca della chimica che cominciò il suo sviluppo proprio in questi anni e che oggi sta assumendo sempre maggiore importanza: la chimica organica. La chimica organica si occupa dello studio delle molecole tipiche dei viventi, a differenza di quella inorganica, che si occupa di sostanze minerali. Fino al XIX secolo, si credeva che si trattasse di due campi completamente separati, poiché si ritenevano i composti organici caratterizzati da una vis vitalis che poteva essere infusa solo da organismi viventi. Nel 1828 però ci fu un importantissimo esperimento del tedesco Friedrich Wöhler il quale riuscì a sintetizzare l’urea [CO(NH2)2], composto organico, partendo da sostanze inorganiche come il cianato d’ammonio (NH4OCN). Pertanto si capì che era sbagliata la precedente definizione e se ne dette una nuova. Sono molecole organiche quasi tutti i composti del carbonio. Si notò infatti che il carbonio entra, spesso con lunghe catene polimerizzate, in tutti i composti organici. Perché tale centralità del C? Esso si trova nel gruppo IVA della tavola periodica, e ciò gli garantisce caratteristiche favorevoli: - possibilità di fare 4 legami; - possibilità di formare lunghe catene covalenti pure, anche con ramificazioni complesse; - un valore di elettronegatività (2,1) tale da rendere covalenti (e poco polari) tutti i legami; - una stabilità dovute alla piccola dimensione dell’atomo (77 pm) ; - la possibilità di formare molecole isomere, cioè con stessa formula grezza ma diversa struttura. Dal 1828 dunque nasce la chimica del C su basi scientifiche. Vari studiosi hanno contribuito al suo sviluppo, ma in particolare dobbiamo ricordare Friedrich August Kekulé von Stradonitz, professore di chimica prima a Gand, in Belgio e poi a Bonn, nato a Darmstadt, in Germania nel 1829 e morto nel 1896. Egli è stato colui che ha permesso di trovare ordine in quella che lo stesso Wöhler definì, in una lettera a Berzelius del 1835: “una primitiva foresta tropicale […] dalla quale è impossibile districarsi e in cui è pauroso entrare”. Fu lui a teorizzare la tetravalenza del C e a comprendere l’importanza di ideare una scrittura che evidenziasse anche la struttura delle molecole. Fu così che nacquero le fondamentali formule di struttura. Kekulé stesso cercò di ricavarne il maggior numero possibile: nel 1867 ricavò il tetraedro del metano, ancora prima, nel 1862, scoprì i primi composti a catena ciclica e nel 1865 ricavò la formula di struttura di quello più importante, il benzene (C6H6). Esso era stato scoperto nel 1825, ma fu Kekulé a comprendere che esso aveva forma esagonale con tre legami semplici e tre doppi, non localizzabili precisamente, ma delocalizzati (oggi sappiamo che tale fenomeno è causato da un’ibridazione laterali tra sei orbitali py). Sessant’anni prima della VB, davvero una felice intuizione! Ma Kekulé deve molto al suo maestro, il barone Justus von Liebig (1803-1873), di cui era concittadino. Egli fu il primo ad introdurre nelle facoltà scientifiche all’Università le lezioni in laboratorio. Fu lui a scoprire il concetto di isomeria e, assieme a Wöhler, quello di radicale, ossia un gruppo di atomi che può trasferirsi in blocco da un composto ad un altro durante una reazione. Nel 1831 isolò il titanio, poi sintetizzò il cloroformio. Fu il primo a tentare una teoria sugli acidi, definiti composti in cui l’H è sostituibile con un metallo. Pubblicò anche una rivoluzionaria teoria sugli alimenti, che suddivise in grassi, carboidrati e proteine secondo la loro funzione. Fece scalpore la sua teoria secondo cui il calore animale deriva dalla combustione degli alimenti.Nell’ultima fase della vita si occupo di chimica quotidiana, studiando il funzionamento dei concimi, le proprietà chimiche del vino e quelle della carne.
 .
.
 , proteine, acidi nucleici, acidi grassi ecc.); 3) Uno stesso composto può subire trasformazioni diverse a seconda dei casi, a causa della variazione delle condizioni chimico-fisiche della cellula che permettono l’attivazione di enzimi diversi.
, proteine, acidi nucleici, acidi grassi ecc.); 3) Uno stesso composto può subire trasformazioni diverse a seconda dei casi, a causa della variazione delle condizioni chimico-fisiche della cellula che permettono l’attivazione di enzimi diversi.
Negli ultimi anni, dopo la Seconda Guerra Mondiale, i biochimici si sono dedicati allo studio delle più complesse molecole organiche: gli acidi nucleici (DNA e RNA). Una pietra miliare nella ricerca è senza dubbio la scoperta del modello a doppia elica del DNA da parte di James Watson e Francis Crick, nel 1953, che ha aperto la strada allo studio dei meccanismi dell’ereditarietà biologica. Non c’è dubbio che oggi sia questo il campo su cui si stanno concentrando gli sforzi dei ricercatori.
GAY-LUSSAC E LA PRIMA LEGGE VOLUMETRICA
 Anche Louis Joseph Gay-Lussac cominciò come meteorologo, ottenendo eccellenti risultati grazie all’utilizzo della mongolfiera, con la quale raggiungeva anche i 7000 m di altitudine per studiare la differente pressione dei gas. Proprio da qui nacque il suo amore per la chimica e la fisica pneumatica. Cominciò a studiare in laboratorio e già a 30 anni, nel 1808, aveva ottenuto brillanti risultati, ricavando la legge isocora, a volume costante P = kT, e la prima legge volumetrica: quando due gas, a condizione di T e P costante, si combinano, i loro volumi stanno in rapporto numerico semplice tra loro e con il prodotto della reazione, se questo è un gas. Alcuni risultati però smentivano clamorosamente la teoria daltoniana: ad esempio 1L di H + 1L di Cl davano 2L di HCl. Berzelius aveva già detto che volumi uguali di gas diversi, a parità di T e P, contengono lo stesso numero di particelle. E questo principio venne confermato da questa legge (altrimenti sarebbero rimaste alcune tracce di uno dei due reagenti). Ma lo svedese, come il suo amico Dalton, credeva che i gas fossero formati da atomi e dunque che si dovesse formare 1 solo L di acido cloridrico. Infatti possiamo mostrare per via grafica cosa sarebbe accaduto se la teoria di Dalton fosse stata corretta (il pallino nero rappresenta l’H, quello bianco il Cl): ● + ○ = ●○. Allora perché l’evidenza empirica mostra che otteniamo due volumi di HCl? A questa domanda darà risposta Avogadro tre anni dopo. Dalton invece, dal canto suo, furioso per aver visto smentita in parte la sua teoria, non volle riconoscere mai questi risultati ed anzi iniziò a sostenere che la teoria corretta era la sua, portando a sostegno le leggi di Coulomb sulla carica elettrica. Grazie al grande prestigio internazionale di cui godeva, Dalton ebbe la meglio e ci vollero più di quarant’anni prima che la comunità scientifica riconosca pienamente i meriti di Gay-Lussac e soprattutto di Avogadro. Il chimico francese nella seconda parte della vita divenne professore presso la Sorbona di Parigi e poi, nel 1831 anche deputato all’Assemblea Nazionale. Si dedicò soprattutto ad applicazioni pratiche ed inventò l’etilometro, l’antenato di quello che oggi chiamiamo “palloncino”, cioè dello strumento che consente di calcolare il tasso alcolico di una persona. Visse per un periodo anche in Italia, compiendo studi di geologia. Morì a 72 anni, nel 1850, in un incidente nel suo laboratorio di Parigi: un banale errore provocò un’esplosione fatale.
Anche Louis Joseph Gay-Lussac cominciò come meteorologo, ottenendo eccellenti risultati grazie all’utilizzo della mongolfiera, con la quale raggiungeva anche i 7000 m di altitudine per studiare la differente pressione dei gas. Proprio da qui nacque il suo amore per la chimica e la fisica pneumatica. Cominciò a studiare in laboratorio e già a 30 anni, nel 1808, aveva ottenuto brillanti risultati, ricavando la legge isocora, a volume costante P = kT, e la prima legge volumetrica: quando due gas, a condizione di T e P costante, si combinano, i loro volumi stanno in rapporto numerico semplice tra loro e con il prodotto della reazione, se questo è un gas. Alcuni risultati però smentivano clamorosamente la teoria daltoniana: ad esempio 1L di H + 1L di Cl davano 2L di HCl. Berzelius aveva già detto che volumi uguali di gas diversi, a parità di T e P, contengono lo stesso numero di particelle. E questo principio venne confermato da questa legge (altrimenti sarebbero rimaste alcune tracce di uno dei due reagenti). Ma lo svedese, come il suo amico Dalton, credeva che i gas fossero formati da atomi e dunque che si dovesse formare 1 solo L di acido cloridrico. Infatti possiamo mostrare per via grafica cosa sarebbe accaduto se la teoria di Dalton fosse stata corretta (il pallino nero rappresenta l’H, quello bianco il Cl): ● + ○ = ●○. Allora perché l’evidenza empirica mostra che otteniamo due volumi di HCl? A questa domanda darà risposta Avogadro tre anni dopo. Dalton invece, dal canto suo, furioso per aver visto smentita in parte la sua teoria, non volle riconoscere mai questi risultati ed anzi iniziò a sostenere che la teoria corretta era la sua, portando a sostegno le leggi di Coulomb sulla carica elettrica. Grazie al grande prestigio internazionale di cui godeva, Dalton ebbe la meglio e ci vollero più di quarant’anni prima che la comunità scientifica riconosca pienamente i meriti di Gay-Lussac e soprattutto di Avogadro. Il chimico francese nella seconda parte della vita divenne professore presso la Sorbona di Parigi e poi, nel 1831 anche deputato all’Assemblea Nazionale. Si dedicò soprattutto ad applicazioni pratiche ed inventò l’etilometro, l’antenato di quello che oggi chiamiamo “palloncino”, cioè dello strumento che consente di calcolare il tasso alcolico di una persona. Visse per un periodo anche in Italia, compiendo studi di geologia. Morì a 72 anni, nel 1850, in un incidente nel suo laboratorio di Parigi: un banale errore provocò un’esplosione fatale.
AMEDEO AVOGADRO: LA TEORIA ATOMICO-MOLECOLARE
Quasi mai ricordato quando si parla dei più insigni scienziati della storia del nostro paese, Amedeo Avogadro è stato in realtà, per le implicazioni che hanno avuto le sue ricerche, una delle figure fondamentali della scienza, non solo chimica, a livello mondiale. Forse questa scarsa considerazione è dovuta al fatto che i suoi meriti gli furono riconosciuti solamente post mortem, come purtroppo troppo spesso accade, a causa del maggior prestigio che Dalton poteva vantare rispetto al chimico piemontese. Nato a Torino nel 1776, Amedeo Avogadro conte di Quaregna e Cerreto si dedicò agli studi di legge, compiendo una brillante carriera fino a divenire segretario di prefettura della capitale del Regno dei Savoia. Si appassionò alla scienza solo in seguito e compì studi di matematica, fisica e chimica da autodidatta. Già nel 1809 divenne professore di matematica e fisica presso il Liceo di Vercelli. Due anni dopo inizia a studiare i risultati di Gay-Lussac e giunge ad una conclusione straordinaria: volumi uguali di gas diversi contengono lo stesso numero di molecole. L’introduzione del concetto di molecola consente ad Avogadro di spiegare allo stesso tempo le tre leggi ponderali e la legge di Gay-Lussac. Infatti la molecola viene definita come la depositaria delle proprietà specifiche delle sostanze. Vediamo cosa accade con molecole biatomiche: ●● + ○○ = ●○ + ●○. Così è risolto il problema. Ma la comunità scientifica si mostrò riluttante ad accogliere l’ipotesi di un professore di liceo al posto di quella di Dalton e così Avogadro, che nel frattempo ottenne la cattedra di fisica a Torino, morì nel 1856 senza ottenere la considerazione che avrebbe meritato. Solo in seguito i chimici, con un omaggio postumo, definirono numero di Avogadro il numero di molecole (o atomi o ioni) contenuti in una mole, numero che è sempre costante e che è di 6,023∙1023. Una mole è una quantità di sostanza di massa in grammi pari alla sua massa molecolare (o atomica) relativa (cioè calcolata rispetto alla u.m.a.).
IL CONGRESSO DI KARLSRUHE E STANISLAO CANNIZZARO
 Nel 1859-1860 i chimici decisero di tenere un congresso internazionale per poter discutere degli ultimi sviluppi della materia e scambiare informazioni su teorie, nuove tecniche di ricerca ecc.
Nel 1859-1860 i chimici decisero di tenere un congresso internazionale per poter discutere degli ultimi sviluppi della materia e scambiare informazioni su teorie, nuove tecniche di ricerca ecc.
Ma il protagonista assoluto di quel congresso divenne il siciliano Stanislao Cannizzaro, nato a Palermo nel 1826, docente all’Università di Genova a causa di un esilio dovuto alla sua partecipazione a rivolte anti-borboniche. Egli riuscì a dimostrare l’esattezza della teoria molecolare formulata cinquant’anni prima da Avogadro. La molecola venne così definita: “La più piccola parte di sostanza (semplice o composta) capace di esistenza indipendente e che presenta l’identità e le proprietà chimico-fisiche della sostanza”. Per questo nel caso dei gas nobili si parla di molecola monoatomica, per non dover stravolgere di nuovo questa definizione.
Cannizzaro inoltre presentò nuovi metodi per determinare la Mr delle sostanze gassose (o riconducibili questo stato) e quella dell’Ar di elementi presenti in sostanze gassose (o riconducibili). Le Mr le calcolò notando che il rapporto fra la massa di ugual volume di due gas a parità di P e T è pari al rapporto tra le loro Mr. Tenendo fisso come uno dei gas l’H2, la cui Mr è 2, riuscì a calcolare le altre. In questo modo l’O divenne, come era corretto, 16u.
Il metodo per calcolare le Ar è invece ancora oggi noto come Regola di Cannizzaro: “Per determinare l’Ar di un elemento basta considerare un gran numero di suoi composti, il maggiore possibile (tale da evitare omissioni significative), determinare di ciascuno la Mr e per ciascuno dedurre, attraverso l’analisi chimica, la quantità dell’elemento considerato contenuta in una quantità del composto pari alla sua Mr: l’Ar è definita dal valore più basso così ottenuto.” Altri due fisici avevano da poco pubblicato, per i metalli, cui non si può applicare questo procedimento, la regola nota con il loro nome, vale a dire Dulong – Petit: Ar moltiplicato per il calore specifico dà sempre una costante uguale a 6,4 cal/°C. Si tratta in realtà di una regola ottenuta con una serie di approssimazioni e il cui risultato non è dunque sempre preciso, oltre a essere limitata da diverse eccezioni. Ma per l’epoca, anch’essa fu molto utile.
Dopo il congresso, Cannizzaro riprese l’attività accademica, tornando nella sua città natale dopo l’Unità d’Italia e passando poi all’Università di Roma dopo la breccia di Porta Pia (fu un fervente sostenitore del Risorgimento). Confermò la tetravalenza del C, che come abbiamo visto era già stata ipotizzata da Kekulé. Morì a Roma nel 1910.

MENDELEEV E IL SISTEMA PERIODICO
Al congresso di Karlsruhe, partecipò anche un giovane chimico russo, nato a Tobol’sk, oltre gli Urali, in piena Siberia, nel 1834. Da giovane si recò negli Stati Uniti, per studiare il petrolio, poi tornò in Russia, da cui non si allontanò più se non per alcuni convegni o congressi. Professore a Pietroburgo, nel 1869 pubblicò una classificazione periodica degli elementi. Il suo nome era Dmitrij Ivanovic Mendeleev. All’epoca diversi chimici avevano già tentato di ordinare gli atomi degli elementi conosciuti, avendo notato che godono di proprietà che tendono a ripetersi in alcuni di essi. Come scrive Isaac Asimov: “Nel 1830 si conoscevano 55 elementi […] In effetti, il numero cominciava a sembrare troppo elevato ai chimici […] quanti ne rimanevano ancora da scoprire? Dieci? Cento? Mille? Un numero infinito? Era una tentazione cercare di trovare un po’ d’ordine nella lista degli elementi noti. Forse in questo modo si sarebbe riusciti a scoprire un qualche motivo del numero degli elementi e qualche mezzo per spiegare la varietà delle proprietà esistenti.” . Il primo che tentò di proporre un ordine fu il tedesco J. W. Döbereinerche nel 1829 propose la teoria delle triadi, terzetti di atomi di peso atomico crescente, ma con proprietà chimiche simili: per esempio Li, Na, K; oppure Ca, Sr, Ba; o anche P, As, Sb. Osservando la tavola periodica odierna, si noterà che si trovano in quest’ordine nei gruppi IA, IIA e VA. Ma le sue ricerche non furono prese in considerazione da altri scienziati. La questione torno d’attualità negli anni ’60, dopo Karlsruhe, quando De Chancourtois propose una classificazione a spirale, nei raggi della quale si inserivano gli elementi che differivano per 10 unità di massa atomica. Ma questa non era la strada giusta. Più importante fu certamente il contributo dell’inglese Newlands che enunciò la legge delle ottave: se si ordinano gli atomi secondo massa atomica crescente, si può notare che le proprietà tendono a ripetersi ogni otto elementi. Ma questa teoria fu a torto ridicolizzata perché simile alla musica.
Mendeleev intuì che la chiave potesse essere la massa atomica e per questo sistemò gli elementi in una tabella ad otto colonne, riempiendo le righe secondo il criterio della Ar crescente. Le righe furono chiamate periodi, mentre le colonne gruppi. In ogni gruppo gli atomi differivano per peso, ma avevano le stesse proprietà chimiche. Per poter mantenere gli elementi con stesse proprietà nel medesimo gruppo, Mendeleev dovette però lasciare dei buchi, che se il suo sistema si fosse rivelato corretto, sarebbero dovuti essere occupati da elementi ancora non scoperti. Così quando furono isolati il gallio, lo scandio e il germanio si vide che andavano a collocarsi nel posto lasciato libero per gli atomi di quelle caratteristiche. La scoperta del cesio da parte di Bunsen e Kirchhoff fu la prova definitiva che sancì la validità del sistema periodico di Mendeleev. La compilazione permise anche di risolvere un problema incontrato dal professore russo: ad un certo punto dovette invertire le posizioni di tellurio Te e iodio I e di cobalto Co e nichel Ni mettendo prima il più pesante, per inserire l’elemento nel gruppo che possedeva le sue stesse proprietà chimiche. Mendeleev però non seppe dare una spiegazione a questa “eccezione”, che in realtà non era tale, perché, come spiegò il fisico inglese Moseley: “Le proprietà degli elementi sono una funzione periodica del loro numero atomico Z”, cioè del numero dei protoni, che nel frattempo erano stati scoperti.
Mendeleev continuò ad insegnare fino alla morte sopraggiunta a S. Pietroburgo nel 1907. In suo onore l’elemento con Z=101, realizzato artificialmente nel 1957 con una reazione nucleare, è stato ribattezzato mendelevio. A pochi altri, cioè Curie, Fermi, Einstein e Nobel, è toccato questo onore.
GIBBS E VON HELMHOLTZ: NASCE LA TERMOCHIMICA MODERNA
In questo periodo abbiamo risultati di rilievo anche nell’ambito dello studio dei meccanismi che sono alla base delle reazioni chimiche. In particolare ci si chiedeva per quale motivo alcune reazioni avvengono a temperatura ambiente mentre altre sono possibili solo ad altissime temperature o addirittura impossibili. Il lavoro di Josiah Gibbs e Hermann Von Helmholtz permette di spiegare ciò. Essi giunsero alla medesima conclusione in maniera indipendente il primo a Yale, il secondo a Bonn attorno al 1880. Essi considerarono l’entalpia [H] (cioè il contenuto termico di un sistema) e l’entropia [S] (il disordine di un sistema). Essi considerarono il fatto che ogni sistema tende a raggiungere la situazione più stabile (dunque con H più bassa) e più probabile, dunque con S più alta. Ma allora come mai in alcuni casi abbiamo un aumento di H (esempio le reazioni endotermiche) o una diminuzione di S (esempio la formazione del ghiaccio)?
Gibbs comprese che l’energia totale di un sistema è divisibile in due parti: quella libera (che può produrre lavoro) e quella vincolata (che viene dispersa in calore latente). Una reazione avviene spontaneamente quando c’è una diminuzione di energia libera. Cioè, come ha quantizzato Von Helmholtz, DG=DH-TDS. Se questa formula da risultato minore di zero, la reazione è possibile.
È interessante notare come questo risultato sia scaturito dall’opera di due studiosi che solitamente si occupavano d’altro. Infatti Gibbs è stato essenzialmente fisico e matematico, autore di importanti studi sullo spazio vettoriale, mentre Von Helmholtz è stato fisiologo, noto anche per essere stato il primo sostenitore di una teoria che prevedeva un’origine extraterrestre per la vita sul nostro pianeta. Con il loro lavoro nasce la termochimica moderna.
BREVE STORIA DELLA CINETICA CHIMICA
Già nel XVI secolo, l’italiano Vannuccio Biringuccio si era dedicato allo studio del ruolo che il tempo ricopre nello svolgersi di una reazione, ma i risultati più importanti, in tale campo, giunsero solo nell’Ottocento. La cinetica chimica si pone come obiettivo quello di stabilire i fattori che influenzano la velocità di una reazione. Per velocità in questo ambito si intende il rapporto tra la diminuzione di concentrazione dei reagenti e il tempo. Vedremo come questi risultati abbiano consentito poi di scoprire il meccanismo alla base delle reazioni chimiche. Da un’osservazione empirica si nota che la velocità di reazione è influenzata da 5 caratteristiche:
- natura dei reagenti: più i legami chimici sono deboli, più veloce è la reazione;
- concentrazione dei reagenti: maggiore è questa, più rapida è la reazione
- temperatura: la reazione è più veloce a temperature più alte. Gia l’olandese Jacobus Hendricus Van’t Hoff empiricamente ricavò che ogni aumento di T di 10° C, si ha un raddoppio o una triplicazione della velocità, ma sarà solo Svante Arrhenius (che ritroveremo poi) che ne dimostrerà la dipendenza esponenziale ;
- eventuale presenza di catalizzatori (come MnSO4, solfato manganoso, oppure gli enzimi del corpo umano) che velocizzano la reazione
- una maggiore superficie laterale dei reagenti, a parità di volume, fa aumentare v.
Nel 1918 il chimico americano William Lewis riassunse tali risultati in quella che è nota come teoria delle collisioni. Infatti egli comprese che la reazione chimica avviene tramite una serie di collisioni tra le molecole dei reagenti. Tuttavia gli urti devono essere efficaci, cioè capaci di determinare la rottura dei precedenti legami, rendendone possibile la formazione di nuovi, con il variare la posizione iniziale degli atomi. L’efficacia degli urti è dovuta alla geometria della collisione e dall’energia cinetica delle particelle. Poiché l’energia cinetica è direttamente proporzionale alla temperatura, si spiega l’influenza della temperatura. Si capisce anche l’importanza della concentrazione e della superficie laterale: rendono più probabili gli urti efficaci .
Fino a qui abbiamo analizzato però reazioni complete ed irreversibili, vale a dire che trasformano tutti i reagenti in prodotti, senza che sia possibile la reazione inversa . Tuttavia in natura le reazioni più numerose sono proprio quelle incomplete e che dunque ammettono una reazione inversa che avviene contemporaneamente a quella diretta. Empiricamente si osserva che all’inizio la velocità della reazione diretta è massima e quella inversa è minima. Se la temperatura rimane costante le due velocità tendono sempre più allo stesso valore, fino a pareggiarsi ad un tempo caratteristico per ogni reazione. Il chimico norvegese Peter Waage, docente di chimica all’Università di Oslo, nel 1868 enunciò pertanto la cosiddetta legge dell’azione di massa: ad una data T costante il rapporto tra le due velocità è costante. Il suo collega di matematica applicata presso la stesso ateneo, Cato Guldberg, noto anche per studi sui moti convettivi dell’atmosfera, si occupò della sua formulazione quantitativa: introdusse una costante Kc, pari a al rapporto tra le costanti cinetiche delle due reazioni diretta e inversa e la definì, per una reazione generica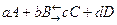 . Pertanto tale legge oggi è nota anche con il nome di legge di Guldberg-Waage.
. Pertanto tale legge oggi è nota anche con il nome di legge di Guldberg-Waage.
L’ultimo contributo fu quello del francese Henri Louis Le Chatelier. Il suo principio analizza infatti cosa avviene quando viene turbato l’equilibrio raggiunto secondo la legge dell’azione di massa. In particolare esso afferma che l’equilibrio si sposta verso la reazione che tende a contrastare il disturbo apportato. Ad esempio, se aumenta la pressione, l’equilibrio si sposta verso la reazione che provoca una diminuzione del volume. Esso non è altro che la lettura chimica del principio generale della fisica secondo cui in natura ciascun sistema tende spontaneamente all’equilibrio.
ALCUNE INTERESSANTI PROPRIETÀ DELLA MATERIA
Dopo Karlsruhe, con la definitiva accettazione della teoria molecolare, il lavoro dei chimici non era certamente terminato: restavano numerosi proprietà della materia che non si riuscivano a comprendere: l’elettrizzazione per strofinio ad esempio. Osservata già da Talete di Mileto nel VII sec. a.C. e descritta in relazione all’ambra da William Gilbert , medico personale della regina Elisabetta I, nel XVII secolo e da questo il fenomeno prese il nome: ambra in greco = elektron. Sarà Charles de Coulomb con la sua legge 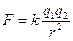 nel 1785 che darà un’interpretazione quantitativa del fenomeno. Ma dove si trovano le cariche nella materia? Nell’800 altri esperimenti mostrarono che le soluzioni acquose, con disciolti acidi, sali e basi, conducevano elettricità. Faraday mostrò come in soluzioni elettrolitiche passi l’elettricità nel 1830-31 e comprese il ruolo degli ioni, cosi detti dal termine greco che significa “che migra”. Infatti gli ioni, che sono i prodotti delle reazioni di ionizzazione degli acidi e di dissociazione di basi e sali, “migrano” verso il polo di carica opposta.
nel 1785 che darà un’interpretazione quantitativa del fenomeno. Ma dove si trovano le cariche nella materia? Nell’800 altri esperimenti mostrarono che le soluzioni acquose, con disciolti acidi, sali e basi, conducevano elettricità. Faraday mostrò come in soluzioni elettrolitiche passi l’elettricità nel 1830-31 e comprese il ruolo degli ioni, cosi detti dal termine greco che significa “che migra”. Infatti gli ioni, che sono i prodotti delle reazioni di ionizzazione degli acidi e di dissociazione di basi e sali, “migrano” verso il polo di carica opposta.
L’ESPLORAZIONE DELL’ATOMO
Apparve chiaro che all’interno dell’atomo, in qualche modo, si dovesse trovare la spiegazione alla presenza di queste cariche. Per fare ciò si inizio ad utilizzare un particolare strumento chiamato tubo di Crookes, riempito di gas. Solitamente la materia allo stato aeriforme non conduce corrente, ma nei gas a volte assistiamo a delle ionizzazioni spontanee, dovute all’azione di fattori esterni, come ad esempio i raggi cosmici (ultravioletti, gamma ecc.). Se poi si applicano elettrodi con elevato d.d.p. (10.000 V), si assiste ad una valanga ionica, che provoca la creazioni di molti altri ioni, detti secondari. Nel 1876 Goldstein osservò che, in particolari condizioni (d.d.p. 10.000 v, P 10-6 atm), partivano radiazioni giallo-verdi dal catodo (-) all’anodo (+), da lui chiamate raggi catodici. Quattro modifiche apportate al tubo consentirono agli scienziati di comprendere meglio la natura di questi raggi. Per prima cosa si introduce nel tubo un ostacolo. Questo consente di capire che i raggi si propagano in linea retta. Poi si applica un campo magnetico e si vede che i raggi sono sensibili al magnetismo. Applicando invece un campo elettrico si osserva che i raggi sono carichi positivamente. Nel 1891 così Stoney afferma che i raggi catodici non sono radiazioni ma particelle. Non ha però prove empiriche. Una quarta modifica al tubo di Crookes consentirà di dimostrarlo. Si applica un mulinello all’interno del tubo, realizzato in maniera da rendere minimo l’attrito. Il mulinello si muove. Dunque i raggi catodici hanno una quantità di moto , e dunque una massa. Sono dunque particelle.
THOMSON E LA SCOPERTA DELL’ELETTRONE
 . Thomson con questa scoperta è solo all’inizio di una brillante carriera. Lo ritroveremo fra poco, quando tratteremo il suo modello atomico.
. Thomson con questa scoperta è solo all’inizio di una brillante carriera. Lo ritroveremo fra poco, quando tratteremo il suo modello atomico.
L’ESPERIENZA DI MILLIKAN
Nel 1911 il 43enne fisico Robert Andrews Millikan, originario dell’Illinois, con un geniale esperimento ricava il valore esatto della carica dell’elettrone, dimostrando allo stesso tempo come la carica sia una grandezza quantizzata, cioè possa assumere solo valori discreti . L’apparato fondamentale dell’esperienza è costituito da un condensatore all’interno del quale sono spruzzate da un nebulizzatore alcune goccioline d’olio, fatte prima passare in un condotto che le caricasse. In un primo momento non applico alcuna differenza di potenziale tra le due armature, in modo tale da non avere campo elettrico. Pertanto il moto della gocciolina, una volta a regime, cioè stabilizzatosi su un valore costante, sarà caratterizzato dall’equilibrio tra tre forze: la gravità, la spinta di Archimede e la resistenza dell’aria. La gravità è mg, con la massa uguale a densità per volume: 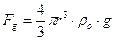 . Ogni esperimento dava sempre come risultato un multiplo di 1,60∙10-19 C. Pertanto tale valore è la carica dell’elettrone, e non vi è carica in natura che non ne sia multiplo intero.
. Ogni esperimento dava sempre come risultato un multiplo di 1,60∙10-19 C. Pertanto tale valore è la carica dell’elettrone, e non vi è carica in natura che non ne sia multiplo intero.
Millikan in seguito si dedicò a studi sull’equazione di Einstein e sulla fisica quantistica. Ottenne fra l’altro la prima determinazione della costante di Planck. Nel periodo bellico si occupò di strumentazioni militari, in particolare di tecnologia sottomarina. Poi si dedicò, con ottimi risultati, allo studio dei raggi cosmici. Nel 1923 ricevette il Nobel per la fisica. Morì a Pasadena, presso Los Angeles, nel 1953.
GOLDSTEIN E LA SCOPERTA DEL PROTONE
Nel frattempo, Eugen Goldstein continuava le sue ricerche sui tubi. Nel tubo a raggi catodici, avviene la seguente reazione: Ne → Ne+ + e-. I raggi catodici evidenziavano l’e-. Però Goldstein tentò un’altra modifica, forando il catodo. Notò che, questa volta dall’anodo, partivano dei raggi rossastri. Applicando le modifiche sopra descritte si giunse alla conclusione che si trattasse di particelle positive. Si trattava ovviamente del Ne+, perciò cambiando il gas, cambiava anche il valore e/m. Il valore più piccolo si otteneva con l’H+. Gli altri erano suoi multipli. Sarà Rutherford a chiamarlo protone , cioè il primo. Ma prima, nel 1898, Wilhelm Wien ne enuncia le caratteristiche in 4 punti:
- la massa delle particelle dei raggi canale varia a seconda del gas
- la massa di qualunque tipo di particella positiva è di gran lunga maggiore di quella dell’elettrone
- la massa più piccola si rileva con l’idrogeno
- le altre masse ne sono tutte multipli.
THOMSON E IL PRIMO MODELLO ATOMICO
Alla luce di quanto scoperto, nel 1904 Thomson ipotizzò quale potesse essere la struttura dell’atomo. Nel 1904 presentò il suo primo modello: parlò di una sfera uniforme di carica positiva con “affogati” qua e là elettroni in modo tale da rendere complessivamente neutra la struttura. Nel 1906 poi si corresse e presentò un nuovo modello, detto a struttura piena o anche, in maniera anche un po’ ironica, a panettone: restano gli elettroni, ma sparisce la sfera uniforme, suddivisa in tante particelle: i protoni. Il modello di Thomson, come vedremo, avrà vita breve. Nonostante ciò nel 1906 vinse il premio Nobel. Morì a Cambridge nel 1940.
ARRHENIUS, BRONSTED E LOWRY: LO STUDIO DI ACIDI E BASI
 Prima di analizzare le varie teorie sulla struttura dell’atomo, è necessario aprire una parentesi su un non meno importante campo di indagine che impegnò molti chimici nei primi trent’anni del ventesimo secolo: lo studio degli acidi e delle basi. Le proprietà degli acidi e delle basi erano state studiate per tutto il XIX secolo, a partire da quando Faraday ne aveva osservato la reazione di ionizzazione in soluzione acquosa. Era però necessario darne una definizione corretta e precisa.
Prima di analizzare le varie teorie sulla struttura dell’atomo, è necessario aprire una parentesi su un non meno importante campo di indagine che impegnò molti chimici nei primi trent’anni del ventesimo secolo: lo studio degli acidi e delle basi. Le proprietà degli acidi e delle basi erano state studiate per tutto il XIX secolo, a partire da quando Faraday ne aveva osservato la reazione di ionizzazione in soluzione acquosa. Era però necessario darne una definizione corretta e precisa.
Il primo a formulare un ipotesi fu Svante Arrhenius. Chimico svedese, nacque nel 1859 a Uppsala. Diventò prima professore e poi rettore dell’Università di Stoccolma. Si occupò a lungo dello studio delle soluzioni acquose, ma nel 1900 propose anche una teoria sulla composizione della coda delle comete. Nel 1903 vinse il Nobel. Nel primo decennio del 1900 dimostrò teoricamente che un aumento dei gas serra nell’atmosfera è responsabile di un aumento della temperatura terrestre . In ambito biologico riprese l’idea di un’origine extraterrestre della vita già enunciata da Von Helmhotz, perfezionandola con la teoria della panspermia, secondo cui la vita sarebbe arrivata sulla Terra sottoforma di spore batteriche spinte dal vento solare. Abbiamo già detto della sua determinazione del valore della costante cinetica di una reazione. Morì a Stoccolma nel 1927.
Egli sostenne che è acida la sostanza che in acqua libera ioni H+ mentre è basica quella che libera ioni OH-. In realtà dovette correggere questa definizione quando gli si fece notare che non tutti gli acidi possiedono H+ o le basi OH-. Arrhenius si corresse dicendo che era sufficiente che queste sostanze spingessero l’acqua a liberare i suddetti ioni, ma la sua teoria iniziò a scricchiolare
Migliore fu la teoria che il danese Johannes Brönsted e l’inglese T. Lowry misero a punto, in maniera indipendente, nel 1923. Essi sostennero che era acida qualsiasi sostanza in grado di cedere protoni, mentre era basica una sostanza in grado di acquistare protoni. Secondo loro non esistono acidi e basi a sé stanti, ma solo coppie coniugate: l’acido perde il protone divenendo la sua base coniugata; la base accetta il protone, divenendo l’acido coniugato. Maggiore è la forza dell’acido, più sarà debole la base coniugata e viceversa.
Un’ulteriore teoria sarà enunciata dall’americano G. N. Lewis negli anni ’30, ma di essa ci occuperemo quando analizzeremo l’opera di questo poliedrico scienziato. Tuttavia, poiché essa corregge solo pochi aspetti, spesso a livello empirico si lavora, per maggior semplicità, con la teoria di Brönsted-Lowry.
LA SCOPERTA DELLA RADIOATTIVITÀ
Nel 1896 il 44enne fisico parigino Henri Becquerel stava compiendo studi sui raggi X appena scoperti, utilizzando tra l’altro dei sali di uranio. Come sempre, alla sera, prima di tornare a casa, pose tali composti in un cassetto che conteneva occasionalmente anche delle pellicole fotografiche appena acquistate, dunque non impresse, che sarebbero dovute servire per un esperimento l’indomani mattina. Quando il giorno dopo si apprestava ad utilizzare la pellicola, si accorse che su di essa si trovavano delle macchie nere, come se qualcuno l’avesse usata. Poiché la sera prima era vergine e nella notte nessuno poteva averla usata egli comprese che l’unica spiegazione fosse che l’uranio avesse emesso una qualche radiazione. Perciò cominciò a studiare quest’aspetto. I risultati più importanti li ottennero i coniugi Pierre e Marie Curie. Pierre Curie è stato uno dei più grandi scienziati della storia di Francia. Nato nel 1859, da giovane studiò alla Sorbona di Parigi, dedicandosi allo studio della conduzione elettrica sui cristalli. Poi analizzò l’influenza della temperatura sul magnetismo, dimostrando come i materiali ferromagnetici perdano le proprie caratteristiche sopra una certa temperatura che, in suo onore, fu chiamata punto di Curie. Il 26 luglio 1895 sposò la giovane fisica polacca Marie Sklodowska, costretta ad emigrare nel 1891 perché di idee antizariste , con la quale cominciò ad analizzare la scoperta di Becquerel. Essi ipotizzarono che l’uranio e il torio, emettendo radiazioni, si trasformavano in nuovi elementi, che chiamarono polonio e radio. Ne ebbero conferma quando riuscirono ad isolare, da un minerale chiamato pechblenda, i primi campioni di Ra. Nel 1903 vinsero assieme il Nobel per la Fisica, condividendolo con Becquerel. Nel 1906 Pierre Curie morì, investito da un carro mentre attraversava la strada. La moglie gli successe come docente di fisica alla Sorbona, prima donna nella storia ad insegnare presso la prestigiosa università. Continuò gli studi sul radio, ottenendo un nuovo Nobel, stavolta per la chimica, nel 1911. Morì, intossicata dalle radiazioni, a Sallanches nel 1934. La scoperta della radioattività, come vedremo fu decisiva per lo sviluppo della ricerca sui modelli atomici e per la scoperta della terza particella atomica. I coniugi Curie ebbero anche una figlia, Irène, che sposò il fisico Frédéric Joliot. Anche la figlia fu una brillante ricercatrice, tanto che per i suoi studi sull’azione dei neutroni sugli elementi pesanti, in particolare sull’U, ottenne il Nobel, assieme al marito nel 1935, a soli 38 anni. Si dedicò poi anche alla politica (ricoprì il ruolo di viceministro per la ricerca nel 1936, in seno all’esecutivo socialista, appoggiato anche dai comunisti, guidato da Léon Blum) impegnandosi particolarmente per l’emancipazione femminile. Nel dopoguerra ricoprirà in quest’ambito cariche a livello internazionale, continuando le ricerche sulle reazioni nucleari. Morirà a 59 anni nel 1956. I suoi lavori degli anni trenta furono la base da cui partirà Fermi nel suo lavoro.

ERNST RUTHERFORD: IL MODELLO A STRUTTURA VUOTA
Il neozelandese Ernst Rutherford, nato nel 1871, fu stretto collaboratore di Thomson a Cambridge e fu tra i primi a dedicarsi allo studio della radioattività. Fu anch’egli Nobel per la chimica nel 1908, per ricerche effettuate con H. Geiger sulla radioattività del Th e sulla natura delle particelle a, che scoprì essere nuclei di He. Ma la sua scoperta più importante è successiva, risale al 1911. Rutherford mise a punto un esperimento con il quale dimostrare l’esattezza del modello del suo amico Thomson, ma finì per smentirlo. Pose una sottilissima (pochi micron) lamina d’oro tra del polonio radioattivo (che emetteva radiazioni a) e una pellicola impressionabile, che tuttavia circondava tutta l’area dell’esperienza. Se la teoria di Thomson fosse stata corretta, il 100% delle emissioni avrebbe raggiunto in linea retta la pellicola (semplicisticamente si può immaginare un proiettile che passa un cuscino). Ma non andò esattamente così: il 99% delle radiazioni era passata, mentre meno dell’1% era stata deviata ed addirittura 1/8000 completamente respinta. Da ciò Rutherford comprese che l’atomo era formato da un nucleo duro ma attorno al quale si trovava il vuoto. Allora propose un modello che ricordava in piccolo il sistema solare: al centro si trovavano i protoni, condensati nel nucleo positivo, attorno al quale ruotavano, come pianeti gli elettroni. Calcolò anche il rapporto tra raggio del nucleo e raggio atomico in 1/10.000.

NASCE LA FISICA MODERNA: L’IPOTESI QUANTISTICA, L’EFFETTO FOTOELETTRICO, L’EFFETTO COMPTON, LA SPETTROSCOPIA
Per poter comprendere gli sviluppi successivi della chimica, è ora necessario accennare brevemente ad alcune grandi scoperte che segnarono l’inizio del ventesimo secolo e che fungono da premessa al successivo sviluppo della chimica moderna.
Max Planck era un professore di fisica già affermato, nato nella città marittima di Kiel nel 1858, successore di Kirchhoff, era soprattutto interessato a studi di termodinamica, in particolare riguardo il principio dell’entropia di Clausius . Nel 1900 stava studiando, sempre in quest’ambito, il corpo nero. Con questo termine si intende un corpo che assorbe tutta la radiazione incidente su di esso e, se portato all’incandescenza, emette su tutte le frequenze dello spettro elettromagnetico .
Empiricamente, si realizzarono durante tutto l’Ottocento dei grafici, con la frequenza sull’asse delle scisse e l’intensità dell’emissione su quello delle ordinate. Come risultato di vedeva che c’era una certa frequenza (e di conseguenza una certa lunghezza d’onda) , detta picco, a cui corrispondeva una intensità massima mentre ogni altra frequenza aveva comunque un’intensità minore del picco ma diversa da 0. Il grafico aveva approssimativamente dunque un aspetto a campana . Si notò così che l’andamento dipendeva solo dalla temperatura del corpo e non dalla sua composizione chimica o da altri fattori. Il già citato fisico Wien poté così ricavare la sua legge sul corpo nero:  .
.
Tali legge erano, come detto, empiriche. Da un punto di vista teorico invece c’erano seri problemi . Le leggi della fisica newtoniana non erano infatti in grado di spiegare l’andamento dei grafici del corpo nero. Secondo queste infatti il grafico avrebbe dovuto tendere all’infinito con una pendenza ripidissima, mentre alle alte frequenze essa tende a 0. Questo problema fu definito perciò catastrofe ultravioletta. Planck per prima cosa riuscì a determinare una funzione matematica che, rappresentata, desse come grafico la curva di emissione del corpo nero, che dunque in suo onore s’ora i poi sarà chiamata curva di Planck. Ora però si doveva dare giustificazione fisica di questa funzione. L’unico modo per spiegare ciò era assumere che l’energia fosse un multiplo intero del prodotto della frequenza per una costante che sarà appunto chiamata costante di Planck, di valore h=6,63∙10-34 J∙s. Pertanto l’energia è quantizzata, potendo assumere solo valori hf, 2hf, 3hf… La fisica classica, secondo cui invece poteva assumere qualsiasi valore era smentita. Tuttavia i fisici, e Planck stesso, erano piuttosto scettici al riguardo: sembrava più un artificio matematico che una reale rappresentazione della natura.
L’unico che pensava che tale teoria potesse essere valida fu un giovane fisico di nome Albert Einstein.  . Tornò in Germania per insegnare a Berlino, vinse il Nobel nel 1921, ma poi fu costretto a fuggire negli USA quando il nazismo salì al potere. Era inviso ai nazionalsocialisti sia per le proprie origini ebraiche sia per le idee cosmopolite e pacifiste. Assunse la cattedra di fisica a Princeton nel 1933, dove rimase fino alla morte nel 1955. Negli ultimi anni di vita si allontanò dalla comunità scientifica internazionale, non riuscendo ad accettare l’idea di universo in espansione e quella dell’incertezza della fisica quantistica.
. Tornò in Germania per insegnare a Berlino, vinse il Nobel nel 1921, ma poi fu costretto a fuggire negli USA quando il nazismo salì al potere. Era inviso ai nazionalsocialisti sia per le proprie origini ebraiche sia per le idee cosmopolite e pacifiste. Assunse la cattedra di fisica a Princeton nel 1933, dove rimase fino alla morte nel 1955. Negli ultimi anni di vita si allontanò dalla comunità scientifica internazionale, non riuscendo ad accettare l’idea di universo in espansione e quella dell’incertezza della fisica quantistica.
Einstein fu il primo a pensare che la quantizzazione dell’energia potesse essere dovuta al fatto che la luce fosse organizzata in “pacchetti” di energia, ciascuno dei quali aveva energia ricavabile dall’ipotesi di Planck . Secondo Einstein, si poteva pensare alla luce come ad un fascio di particelle, ciascuna con un carico hf di energia. Aumentandone l’intensità, aumenta il numero di fotoni. Così si spiega anche la curva di Planck: la frequenza di picco è quella alla quale viene emesso il maggior numero di fotoni. La verifica sperimentale Einstein la ottenne così: fece colpire una superficie di metallo da un raggio di luce incidente, provocando l’emissione di un elettrone. Per liberare un elettrone è necessario una quantità di lavoro W0. Secondo la fisica classica, dunque, avremmo dovuto assistere ad un’emissione con qualsiasi frequenza della luce, essendo sufficiente solamente che l’energia fosse superiore a W0 e l’elettrone avrebbe dovuto avere energia cinetica pari alla differenza tra l’energia del fascio di luce e il W0: quindi ad una maggiore intensità corrispondeva una maggiore K. Invece sperimentalmente si osservava che, indipendentemente dall’energia, l’emissione si aveva solamente se il fascio aveva una frequenza superiore ad un valore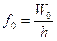 , mentre l’energia cinetica dipende solo da f, un aumento di intensità provoca solo un aumento di elettroni emessi. Questo è considerata una verifica sperimentale al modello a fotoni: infatti se la luce è un fascio di fotoni, aumentando l’intensità ne aumento solo il numero, per aumentarne l’energia devo aumentarne la frequenza.
, mentre l’energia cinetica dipende solo da f, un aumento di intensità provoca solo un aumento di elettroni emessi. Questo è considerata una verifica sperimentale al modello a fotoni: infatti se la luce è un fascio di fotoni, aumentando l’intensità ne aumento solo il numero, per aumentarne l’energia devo aumentarne la frequenza.
L’effetto Compton, dal nome del suo scopritore Arthut Holly Compton, ci mostra un’altra particolarissima caratteristica dei fotoni: essi pur avendo massa 0, hanno una quantità di moto pari a 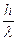 . Tale valore si ricava teoricamente applicando le equazioni della relatività ristretta e se ne ha verifica sperimentale, ed è ciò che fece Compton, facendo scontrare un fotone ed un elettrone ed analizzando l’urto elastico che avviene tra i due.
. Tale valore si ricava teoricamente applicando le equazioni della relatività ristretta e se ne ha verifica sperimentale, ed è ciò che fece Compton, facendo scontrare un fotone ed un elettrone ed analizzando l’urto elastico che avviene tra i due.
L’ultima innovazione che dobbiamo qui ricordare è lo sviluppo della spettroscopia. Il primo spettro di emissione fu ottenuto da Isaac Newton, quando con il prisma scompose la luce visibile. All’inizio del Novecento invece si usava la spettroscopia per riconoscere i vari atomi. Ciascuno di essi infatti emette, se portato all’incandescenza, alcune righe particolari, corrispondenti a determinate lunghezze d’onda, diversi da elemento a elemento. Fu proprio osservando nello spettro del Sole alcune righe non note che nel 1868 Lockyer e Frankland scoprirono l’elio. Particolarmente interessante era l’emissione dell’idrogeno, il quale emetteva nell’ultravioletto (serie di Lyman), nel visibile (serie di Balmer, 4 righe viola, blu, verde mare, rosso) e nell’infrarosso (serie di Paschen) . Lo svizzero Johann Jakob Balmer trovò anche, empiricamente, una formula che permetteva di prevedere la lunghezza d’onda delle righe di emissione dell’H: 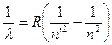 . Tale strumento, di vitale importanza in molti campi della scienza, come per esempio l’astrofisica, permise a Bohr di correggere il modello di Rutherford, alla luce anche delle ultime scoperte della fisica, che lo scienziato neozelandese non aveva considerato.
. Tale strumento, di vitale importanza in molti campi della scienza, come per esempio l’astrofisica, permise a Bohr di correggere il modello di Rutherford, alla luce anche delle ultime scoperte della fisica, che lo scienziato neozelandese non aveva considerato.
BOHR E L’ATOMO AD ORBITE QUANTIZZATE
Il modello di Rutherford, infatti, fu corretto solamente due anni dopo, nel 1913 dal giovane danese Niels Bohr. Nato nel 1885, studiò presso l’Università di Copenaghen. Nel 1908, assieme al fratello Harald, che diverrà uno dei principali matematici dello scorso secolo, partecipò alle Olimpiadi di Londra nella squadra danese di calcio, vincendo la medaglia d’argento. Nel 1922 vinse il Nobel per la fisica , proprio per il suo modello atomico. Si dedicò poi allo studio dei nucleoni. Si rifugiò negli USA durante la seconda guerra mondiale, partecipando alle sperimentazioni sulla bomba atomica a Los Alamos. Nel 1945, appena finito il conflitto, tornò a Copenaghen dove continuò a studiare la meccanica quantistica. Negli ultimi anni della sua vita ottenne numerosi riconoscimenti. Tra l’altro divenne membro dell’Accademia dei Lincei in Italia. Morì nel 1962.
Secondo la fisica teorica, il modello di Rutherford era inaccettabile perché l’elettrone, che è una particella carica, ruotando attorno al nucleo avrebbe dovuto emettere energia sottoforma di radiazione elettromagnetica. Come nel caso di un satellite che subisce l’attrito dell’aria, in un tempo di 10-9 s l’elettrone sarebbe dovuto collassare a spirale sul nucleo, pertanto la materia non potrebbe essere stabile come la vediamo oggi.
 . Il valore del primo fattore, formato solo da costanti, è di R=1,097∙107 m-1. Dunque incredibilmente ho riottenuto l’equazione empirica di Balmer. Questa fu considerata una formidabile dimostrazione della veridicità di tale modello, che ha avuto pure il merito storico non indifferente di fungere da ponte tra la fisica classica di Newton e Maxwell e quella moderna.
. Il valore del primo fattore, formato solo da costanti, è di R=1,097∙107 m-1. Dunque incredibilmente ho riottenuto l’equazione empirica di Balmer. Questa fu considerata una formidabile dimostrazione della veridicità di tale modello, che ha avuto pure il merito storico non indifferente di fungere da ponte tra la fisica classica di Newton e Maxwell e quella moderna.
L’ATOMO DI BOHR-SOMMERFELD
 Anche il modello di Bohr però presentava dei difetti. Quando infatti cercò di espandere il suo modello ad altri atomi (fu sufficiente aggiungere un fattore Z alla formula, indicante il numero atomico), non ebbe problemi con l’He, ma incontrava incongruenze addirittura già considerando il litio (Z=3). A risolverli pensò il suo amico e collaboratore Arnold Sommerfeld, che nel 1916 propose delle correzioni che portarono ad un nuovo modello, chiamato appunto atomo di Bohr-Sommerfeld. Introdusse altri numeri quantici: il numero l, da 0 a n-1, che indicava la forma dell’orbita e che serviva per correggere il momento angolare e il numero m, da –l a +l, che indicava il suo orientamento, detto magnetico perché ricavato dallo studio delle interazioni tra l’elettrone ed un campo magnetico esterno. Poi, nel 1924, un altro collaboratore di Bohr, lo svizzero Wolfgang Pauli, introdusse un nuovo numero, detto magnetico, che identifica lo spin con cui ruota l’elettrone e stabilì il principio di esclusione (in ogni orbita possono trovarsi solo due elettroni di spin opposto). Pauli sarà anche il primo a sostenere l’esistenza del neutrino. Sommerfeld invece continuò le sue ricerche, perfezionando la diffrazione a raggi X che poi nel 1953, tra le altre cose, servirà a Watson e Crick per scoprire la struttura a doppia elica del DNA. Mise anche a punto una prima teoria delle bande per spiegare il legame metallico. Morì a Monaco nel 1951.
Anche il modello di Bohr però presentava dei difetti. Quando infatti cercò di espandere il suo modello ad altri atomi (fu sufficiente aggiungere un fattore Z alla formula, indicante il numero atomico), non ebbe problemi con l’He, ma incontrava incongruenze addirittura già considerando il litio (Z=3). A risolverli pensò il suo amico e collaboratore Arnold Sommerfeld, che nel 1916 propose delle correzioni che portarono ad un nuovo modello, chiamato appunto atomo di Bohr-Sommerfeld. Introdusse altri numeri quantici: il numero l, da 0 a n-1, che indicava la forma dell’orbita e che serviva per correggere il momento angolare e il numero m, da –l a +l, che indicava il suo orientamento, detto magnetico perché ricavato dallo studio delle interazioni tra l’elettrone ed un campo magnetico esterno. Poi, nel 1924, un altro collaboratore di Bohr, lo svizzero Wolfgang Pauli, introdusse un nuovo numero, detto magnetico, che identifica lo spin con cui ruota l’elettrone e stabilì il principio di esclusione (in ogni orbita possono trovarsi solo due elettroni di spin opposto). Pauli sarà anche il primo a sostenere l’esistenza del neutrino. Sommerfeld invece continuò le sue ricerche, perfezionando la diffrazione a raggi X che poi nel 1953, tra le altre cose, servirà a Watson e Crick per scoprire la struttura a doppia elica del DNA. Mise anche a punto una prima teoria delle bande per spiegare il legame metallico. Morì a Monaco nel 1951.

LA RIVOLUZIONE DEGLI ANNI ’20: DE BROGLIE, HEISENBERG, SCHRÖDINGER E L’ATOMO AD ORBITALI
 . È esattamente ciò che aveva postulato Bohr. Questa fu considerata la prova definitiva della validità del modello di de Broglie. Tuttavia ora si doveva riscrivere praticamente tutta il modello atomico di Bohr e non si possedevano mezzi adeguati. A fornire tali strumenti furono Heisenberg e Schrödinger.
. È esattamente ciò che aveva postulato Bohr. Questa fu considerata la prova definitiva della validità del modello di de Broglie. Tuttavia ora si doveva riscrivere praticamente tutta il modello atomico di Bohr e non si possedevano mezzi adeguati. A fornire tali strumenti furono Heisenberg e Schrödinger.
Werner Heisenberg era un giovane tedesco, arrivato alla fisica quasi per caso, dopo essere stato rifiutato dalla facoltà di Matematica all’Università di Monaco. Allievo di Sommerfeld e compagno di studi di Pauli, conobbe Bohr, di cui fui assistente per sei mesi durante uno stage a Copenaghen. Nel 1927 divenne professore di fisica a Lipsia e nel 1932, a soli 31 anni, gli fu attribuito il Nobel per la fisica. Quando nel 1933 salì al potere Hitler, fu molto critico verso gli pseudoscienziati nazisti, che rifiutavano la fisica del Novecento perché ebrea. Tuttavia il suo rapporto con il nazismo fu alquanto ambiguo, perché fu uno dei pochi intellettuali a non fuggire dalla Germania, ed anzi ebbe anche incarichi ufficiale per il regime. Però oggi sappiamo che se Hitler non riuscì ad ottenere la bomba atomica, fu anche per la sua opera di sabotaggio dall’interno. Dopo la guerra fu arrestato con l’accusa di collaborazione con il nazismo, ma dopo pochi mesi fu prosciolto. Così tornò ad insegnare all’Università di Monaco e si impegnò per far tornare ad alti livelli la ricerca nella Germania Ovest. Morì nel 1976 a Monaco.
Il suo contributo è noto come principio di indeterminazione. Esso sostiene che esistono coppie di grandezze che non possono essere misurate contemporaneamente con precisione assoluta, ma anzi l’approssimazione di una è inversamente proporzionale all’altra. Un esempio di tali coppie è posizione – quantità di moto, un’altra è energia – tempo. Questa dimostrazione, che mette in dubbio le basi stesse della fisica newtoniana, che invece era basata sull’assoluto determinismo delle sue leggi, è considerata l’atto di nascita della fisica quantistica, fondata invece sull’incertezza. Essa si fonda sul dualismo onda-materia teorizzato da de Broglie.
Heisenberg partì dall’esperimento della diffrazione a singola fenditura di un fascio di elettroni. L’equazione che regola questo fenomeno è 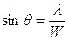 .
.
 È chiaro a questo punto che il modello di Bohr debba essere completamente rivisto: parlare di orbite significa sostenere di conoscere sempre con precisione ogni parametro dell’elettrone: velocità, posizione, energia… cosa che, abbiamo visto, secondo Heisenberg è impossibile.
È chiaro a questo punto che il modello di Bohr debba essere completamente rivisto: parlare di orbite significa sostenere di conoscere sempre con precisione ogni parametro dell’elettrone: velocità, posizione, energia… cosa che, abbiamo visto, secondo Heisenberg è impossibile.
Si deve perciò cominciare a parlare di orbitali, i quali sono definiti zone di spazio nelle quali ho almeno il 90% di possibilità di trovare l’elettrone. Per questi restano validi i 4 numeri quantici introdotti da Sommerfeld, i quali indicano ancora livello energetico, forma, orientamento e spin. Resta valido il principio di Pauli. Bisogna però trovare un modo matematico per esprimerli
Chi arrivò a questo modello fu l’austriaco Erwin Schrödinger. Nato nel 1887 da una ricca famiglia, compì studi umanistici ma decise poi di frequentare la facoltà di fisica all’Università di Vienna. Nel 1914 fu costretto a partecipare alla prima guerra mondiale, combattendo sul fronte italiano. Nel 1917 fu però richiamato in patria e poté così cominciare la carriera accademica, prima in Austria, poi in Svizzera infine in Germania, finché nel 1926 assunse la cattedra lasciata vacante da Planck a Berlino. L’ascesa di Hitler lo convinse a trasferirsi ad Oxford . Dopo l’Anschluss, Schrödinger fu esiliato come oppositore. Perciò si rifugiò a Dublino, dove rimase fino al 1957. Negli ultimi 4 anni della propria vita tornò a Vienna. È importante anche per i suoi studi di biologia. Infatti è considerato il padre della biologia molecolare: fu il primo a comprendere l’importanza di ricavare la struttura delle molecole organiche ed il legame di questa con la loro funzione.
Ma il lavoro per cui è rimasto celebre è senza dubbio la funzione d’onda, con la quale riesce a descrivere il comportamento dell’elettrone se lo intendiamo come un’onda di materia. Essa è considerata la base della meccanica quantistica. L’equazione di Schrödinger ci permette di calcolare la probabilità che un elettrone si trovi in una data posizione. Se consideriamo l’atomo di H e rappresentiamo tale funzione su un piano cartesiano con la posizione alle ascisse e la probabilità alle ordinate, vediamo che essa presenta un massimo proprio a 5,29∙10-11 m, come previsto anche da Bohr. È per questo che il suo modello sembrava ben funzionare. Se invece rappresentiamo funzione in uno spazio tridimensionale, disegnando delle nuvole di probabilità, esse ci rappresentano la forma tridimensionale degli orbitali. Esse sono 4: s, p, d e f. (Vedi immagine in figura). La funzione d’onda Y si ottiene risolvendo la seguente equazione, nota come equazione di Schrödinger: 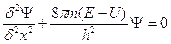 . Si tratta di un risultato molto difficile che riportiamo solo come curiosità: è infatti un’equazione differenziale del secondo tipo la cui risoluzione richiede conoscenze universitarie. Lo stesso Schrödinger all’inizio non sapeva quale valore dare a Y. Fu Max Born che ne dedusse il valore, sostenendo che Y2 non sia altro chela probabilità di trovare la particella in un determinato punto, in un determinato istante.
. Si tratta di un risultato molto difficile che riportiamo solo come curiosità: è infatti un’equazione differenziale del secondo tipo la cui risoluzione richiede conoscenze universitarie. Lo stesso Schrödinger all’inizio non sapeva quale valore dare a Y. Fu Max Born che ne dedusse il valore, sostenendo che Y2 non sia altro chela probabilità di trovare la particella in un determinato punto, in un determinato istante.
orbitale s orbitale p orbitale d orbitale f
CHADWICK SCOPRE IL NEUTRONE
James Chadwick fu allievo di Rutherford. Nato a Manchester nel 1891, durante la Prima Guerra Mondiale fu internato come prigioniero di guerra in Germania. Negli anni venti si dedicò allo studio della disintegrazione degli elementi tramite bombardamento con particelle a. Proprio durante queste ricerche scoprì il neutrone , la terza particella subatomica, grazie alla reazione nucleare Be + a → C + n. Grazie a questa scoperta, ottenne il Nobel per la Fisica nel 1935. Il neutrone non fu comunque scoperto per caso ma anzi era da tempo che si stava cercando, perché la massa degli atomi era troppo elevata per poter essere spiegata solo con la presenza di elettroni e protoni. Si deve sottolineare infine come grazie alle reazioni nucleari sia divenuto possibile trasformare un elemento in un altro: è dopotutto l’antico sogno degli alchimisti che si realizza.

LEWIS, DAGLI ACIDI AL LEGAME CHIMICO
A questo punto è necessario approfondire un ulteriore aspetto della ricerca chimica: lo studio del legame chimico. Si cercava di comprendere come fosse possibile che gruppi di atomi si aggregassero a formare una molecola. Era chiaro che la molecola dovesse essere più stabile, quindi meno energetica, rispetto ad un atomo singolo. Ma come si configurava tale situazione? Il primo a cercare una risposta fu Lewis.
Gilbert Newton Lewis fu un chimico che si occupò di vari aspetti della materia. Docente a Berkeley, si dedicò a migliorare la teoria sugli acidi di Brönsted-Lowry. Infatti essa non prevedeva come acidi sostanze che non disponevano di un atomo di idrogeno ionizzabile. Dunque, per superare questa difficoltà, definì acido qualsiasi sostanza capace di utilizzare una coppia di elettroni e base qualsiasi sostanza capace di mettere a disposizione una coppia di elettroni (rispettivamente elettrofilo e nucleofilo). Questa definizione ampliò di molto le sostanze considerate acide.
Ma Lewis è sicuramente più famoso per la sua teoria sul legame chimico covalente. Anche se ormai superata, prima dalla VB e poi dalla MO, la teoria di Lewis fu molto importante, perché tentò di spiegare in maniera anche piuttosto semplice il legame chimico. Fu la prima interpretazione in chiave elettronica. Lewis prese spunto dalla stabilità che caratterizzava i gas nobili e notò che essi erano caratterizzati sempre da 8 elettroni nel livello energetico più esterno. Lewis sostenne che il legame covalente nasce dalla condivisione, da parte di due atomi, di una o più coppie di elettroni di valenza. In tal modo, entrambi gli atomi realizzano l’ottetto di stabilità se tali elettroni vengono conteggiati per ciascuno degli atomi collegati. Se la coppia è una sola, il legame è singolo, altrimenti può essere doppio o triplo. Il legame covalente poteva essere puro se effettuato tra due atomi con elettronegatività uguale; altrimenti si dice polare ed avremo nella molecola un dipolo positivo ed uno negativo.
KOSSEL E IL LEGAME IONICO
In natura tuttavia esistono anche composti per i quali non si può parlare di molecola. Essi infatti sono costituiti da cristalli composti da ioni che si attraggono elettrostaticamente. Ne è esempio il cloruro di sodio , NaCl, dove tale formula indica solo il rapporto con cui i due ioni si trovano nel cristallo, e non una molecola. Questo tipo di legame è chiamato legame ionico. Fu il tedesco Walter Kossel che nel 1916 enunciò le caratteristiche di tale legame. Esso intercorre tra atomi che abbiano un De>1,9. Per De si intende la differenza di elettronegatività tra i due atomi. L’elettronegatività è un numero che esprime la tendenza di un atomo di attrarre verso di sé gli atomi di legame. Questo fa sì che in un legame covalente tra atomi con elettronegatività differente vi sia un polo negativo ed uno positivo. E questo rende possibile anche il legame ionico. Infatti quando il De è molto elevato, accade che l’attrazione di uno dei due atomi è talmente forte che quello più elettronegativo “strappa” via gli elettrone in comune e se ne impossessa. A questo punto tra i due ioni positivo e negativo intercorre una forza attrattiva di Coulomb. Questo rimase il punto più alto della carriera di Kossel, che si dedicherà poi allo studio degli spettri dei cristalli, in particolare analizzando i raggi x e g, ma senza risultati di rilievo.
LA TEORIA DEL LEGAME DI VALENZA (VB)
La teoria di Lewis come detto fu molto presto superata. Erano evidenti alcuni suoi limiti: innanzitutto esistevano composti che tale modello non spiegava, come il monossido di carbonio (CO), poi furono preparati alcuni composti dei gas nobili (per esempio l’esafloruro di xenon, XeF6), infine essa era ancora basata sull’atomo di Bohr: con la nascita meccanica quantistica, era logica una sua rivisitazione. Per questo negli anni ’30 prese corpo un’ulteriore teoria sul legame covalente ,quella del legame di valenza, secondo cui: un legame chimico si forma spontaneamente tra due atomi che presentino orbitali esterni semivuoti (incompleti) al fine di conseguirne la saturazione. Essa fu formulata nel 1927 dal fisico tedesco Walter Heitler, allievo anch’egli di Sommerfeld, il quale vide che se si fosse ipotizzata una sovrapposizione degli orbitali, effettuabile tramite la somma di due funzioni d’onda, l’energia potenziale del sistema sarebbe diminuita. Quest’accresciuta stabilità spiega il perché dell’esistenza delle molecole. In particolare si vede che il minimo di Ep, si ha ad una distanza pari a quella che poi si è empiricamente riscontrato essere la lunghezza del legame. Da un punto di vista fisico ciò si spiega bilanciando la forza repulsiva tra nuclei e quella attrattiva tra elettroni e nuclei. Ci si potrebbe chiedere come sia possibile il legame per atomi come il berillio (Be) che possiede solo orbitali completi . La risposta è nell’esistenza dell’orbitale ibrido. Infatti si può pensare che in taluni casi, al momento di reagire, la disposizione elettronica, a causa delle energie in gioco, subisca delle alterazioni, in seguito alle quali coppie di elettroni si sciolgono e gli elettroni componenti vanno ad occupare da soli orbitali vacanti, caratterizzati da energie poco superiori. Tale fenomeno comporta una piccola perdita di stabilità che però viene poi compensata dalla formazione del legame. Quindi il Be sposta un elettrone su uno degli orbitali p. A questo punto può formare due legami, uno con l’orbitale s ed uno con il p. Potremmo pensare che, dopo la sovrapposizione, avremmo due risultati diversi. Invece i due legami sono uguali per contenuto energetico e lunghezza. Ciò si spiega ipotizzando che al momento della promozione dell’elettrone, l’energia si sia ripartita egualmente tra l’orbitale s e il p, formando un orbitale ibrido sp. Esistono anche altri tipi di orbitale ibrido che qui ci limitiamo ad enunciare: sp2, sp3, sp3d2, sp3d3. Da essi dipende la forma della molecola. Un ultimo aspetto da sottolineare è il fatto che la sovrapposizione può avvenire in maniera frontale o laterali. A seconda del caso la sommatoria tra le funzioni d’onda darà risultati differenti: più stabile nel primo, detto legame s, meno nel secondo, chiamato legame p.
HUND, MULLIKEN E LA TEORIA DELL’ORBITALE MOLECOLARE (MO)
La teoria della VB era ormai unanimemente accettata, quando nel ne apparve una che appariva migliore in quanto permetteva anche di giustificare i fenomeni di paramagnetismo e diamagnetismo . La teoria fu proposta dal tedesco Friedrich Hund e dall’americano Robert Sanderson Mulliken. Il primo era già noto per aver enunciato la regola di Hund, una legge empirica secondo cui gli elettroni, prima di disporsi su un orbitale in coppia, occupano singolarmente ogni orbitale isoenergetico libero. Il secondo, premio Nobel nel 1966, si dedicò anche allo studio della struttura delle molecole.
Il concetto-base della loro teoria poggia sul fatto che le due funzioni d’onda degli orbitali che si sovrappongono possono essere in fase o fuori fase: nel primo caso avremo un’interferenza costruttiva, nel secondo una distruttiva. Così dalla sovrapposizione di due orbitali atomici (AO) avremo sempre la formazione di due orbitali molecolari (MO), uno costruttivo, detto di legame, con minore energia rispetto agli AO ed uno distruttivo, di antilegame, con maggior energia rispetto agli AO . Restano valide le regole per il loro riempimento ed anche la distinzione tra legame s e p della VB. Vediamo che se gli elettroni più esterni vanno a disporsi su orbitali di antilegame, la molecola non può formarsi. Ecco perché in natura non si trova He2 . Se poi nell’ultimo livello energetico si troveranno elettroni solitari, allora la molecola sarà paramagnetica, altrimenti diamagnetica. La teoria inoltre riesce a spiegare bene anche il legame metallico. Si tratta di un legame particolare, che provoca la creazione di un cristallo di ioni tutti però positivi. Ciò viene spiegato dalla teoria delle bande che propone la formazione di grandi MO che coinvolgono tutto il cristallo, sui quali sono liberi di muoversi gli elettroni, che fungono da collante tra le cariche positive. Ciò spiega anche il fatto che i metalli siano ottimi conduttori.
 ENRICO FERMI E LA REAZIONE DI FISSIONE NUCLEARE
ENRICO FERMI E LA REAZIONE DI FISSIONE NUCLEARE
Enrico Fermi è stato probabilmente il più grande scienziato italiano del Novecento. Al suo nome è legata una delle maggiori innovazioni introdotte dalla chimica nucleare: la reazione di fissione nucleare. Nato a Roma nel 1901, si laureò alla Scuola Normale di Pisa nel 1922. Dopo un breve periodo in Germania, tornò in Italia, dove si dedicò a partire dal 1932 alla fisica nucleare. Fu lui a enunciare il decadimento b, supponendo tra l’altro l’esistenza del neutrino, che pur ipotizzato anche da Pauli, sarà scoperto solo nel 1955. Si tratta di una particella di massa piccolissima o nulla . Tale decadimento prevede la trasformazione di un protone in un neutrone, con l’emissione di un positrone e, appunto, di un neutrino. Poi ebbe un intuizione geniale: capì che se si fosse bombardato con un neutrone lento un atomo di uranio o di plutonio, ciò avrebbe comportato una disgregazione del nucleo (fissione, dal latino fingere, spaccare), liberando neutroni ed energia, molta energia. Inoltre, poiché si liberano neutroni, se la massa del materiale fissile supera una certa soglia detta massa critica, si inizia un processo di reazione a catena che provoca uno sviluppo in progressione geometrica delle reazioni di fissione. Tale fenomeno, se incontrollato, genera un’esplosione nucleare. Fermi invece ideò un metodo per controllarlo, costruendo la pila atomica, antenata dei reattori nucleari. Infatti pensò di inserire materiali come grafite o cadmio che fossero in grado di assorbire neutroni. Inserì poi un sistema di refrigerazione ad acqua che ha il doppio compito di mantenere sotto controllo la temperatura e di, vaporizzandosi per il calore, attivare turbine che poi generano corrente elettrica alternata. Il rendimento di tali reattori è altissimo, ma ha inconvenienti come la pericolosità delle scorie (si tratta sempre di materiali radioattivi con tempi di decadimento lunghissimi) e il rischio di esplosioni. Fermi per questa sua realizzazione ottenne il Nobel nel 1938. Dopo essersi recato a Stoccolma per ritirarlo, invece di rientrare in Italia, scappò negli USA, per evitare che sua moglie, ebrea, incappasse nelle leggi razziale emanate da Mussolini. Fermi resterà negli USA fino alla morte, avvenuta a Chicago, dove era professore universitario, nel 1954, a soli 53 anni, malato di cancro. Durante la guerra partecipò agli studi sul nucleare (anche se non fu a Los Alamos) e poi, negli anni ’50, si dedicò allo studio dei raggi cosmici e delle particelle subatomiche.
GLI SVILUPPI SUCCESSIVI DELLA CHIMICA
Con il modello ad orbitali e le teorie sul legame siamo arrivati agli anni ’30 del Novecento. Ma la ricerca chimica non si è certo qui esaurita. Cercheremo di sintetizzare i risultati ottenuti negli ultimi anni del XX secolo. Nel 1932 Carl David Anderson, statunitense di origini svedesi, grazie ad un nuovo macchinario chiamato camera a nebbia, scoprì nei raggi cosmici una particella che aveva tutte le stesse caratteristiche dell’elettrone ma che sottoposto ad un campo magnetico, si comportava in maniera esattamente contraria: aveva cioè carica opposta. Era un positrone, la prima antiparticella scoperta. Anderson vinse il Nobel nel 1936. Egli ipotizzò che, come l’elettrone, anche il protone dovesse avere un’antiparticella. Ed effettivamente l’antiprotone sarà scoperto nel 1955, grazie agli acceleratori di particelle, dall’americano Owen Chamberlain e dall’italiano Emilio Segré. Entrambi vinsero il Nobel nel 1959. Emilio Segré è figura di spicco nella storia della scienza italiana. Allievo di Fermi, emigrò negli USA col maestro nel 1939. Prima, nel 1937, a Palermo aveva ricavato il tecnezio . Partecipò alla costruzione della bomba atomica. Nel dopoguerra si stabilì in California, dove insegnerà fino alla morte. L’utilizzo degli acceleratori di particelle fu fondamentale: essi permettevano scontri ad altissime energie cinetiche di particelle, creando così energia che, ad un punto-limite, si trasformava in nuove e diverse particelle. Non solo, assieme alla particella, si formava anche un’antiparticella. Per questo oggi si sostiene che ad ogni particella corrisponde una propria antiparticella e non si produce materia senza che si produca antimateria. L’incontro tra materia ed antimateria dà però luogo all’annichilazione, cioè alla trasformazione delle particelle in energia secondo l’equazione E=mc2. Si sono identificate più di 200 coppie di particelle-antiparticelle. Serviva perciò dare un’organizzazione. A fare ciò pensò Murray Gell-Mann, statunitense che propose nel 1961 una classificazione che lo portò a vincere, nel 1969, il Nobel. Il risultato più importante del suo lavoro fu la scoperta del quark: il protone ed il neutrone erano ulteriormente divisibili! I quark, cui ovviamente corrispondono antiquark, possono essere di vario tipo: up, down, charm, strange, top, bottom o beauty; ciascuno di questi può poi essere di tre colori . Combinati a tre a tre danno luogo ai barioni, cioè ai neutroni ed ai protoni . Essi hanno anche carica frazionaria rispetto a quella dell’elettrone.
 , sono mediate da particelle, dette mediatori. Per questo la chimica nucleare diventa fondamentale per cercare di raggiungere il più grande obiettivo della scienza moderna: l’unificazione delle 4 forze, tramite lo studio di queste particolari particelle. Il primo mediatore scoperto fu il fotone, che è vettore della forza elettromagnetica. I mediatori della forza nucleare forte furono invece scoperti nel 1979 ad Amburgo dallo statunitense Samuel Ting, ed è chiamato gluone. Nel 1982 al CERN di Ginevra, fu l’italiano Carlo Rubbia ad identificare i mediatori della forza nucleare debole, chiamati bosoni W e Z. Rubbia vinse il Nobel nel 1984. Grazie a tale scoperta, tre fisici, gli statunitensi Alvin Weinberg e Shaldon Glashow e il pakistano Abdus Salam riuscirono a proporre una teoria che unificava le forze elettromagnetica e nucleare debole. Tuttavia oggi restano ancora problemi insoluti: per esempio si sta ricercando il vettore della forza gravitazionale. È già stato definito gravitone, anche se nessuno è stato in grado di identificarlo. Carlo Rubbia
, sono mediate da particelle, dette mediatori. Per questo la chimica nucleare diventa fondamentale per cercare di raggiungere il più grande obiettivo della scienza moderna: l’unificazione delle 4 forze, tramite lo studio di queste particolari particelle. Il primo mediatore scoperto fu il fotone, che è vettore della forza elettromagnetica. I mediatori della forza nucleare forte furono invece scoperti nel 1979 ad Amburgo dallo statunitense Samuel Ting, ed è chiamato gluone. Nel 1982 al CERN di Ginevra, fu l’italiano Carlo Rubbia ad identificare i mediatori della forza nucleare debole, chiamati bosoni W e Z. Rubbia vinse il Nobel nel 1984. Grazie a tale scoperta, tre fisici, gli statunitensi Alvin Weinberg e Shaldon Glashow e il pakistano Abdus Salam riuscirono a proporre una teoria che unificava le forze elettromagnetica e nucleare debole. Tuttavia oggi restano ancora problemi insoluti: per esempio si sta ricercando il vettore della forza gravitazionale. È già stato definito gravitone, anche se nessuno è stato in grado di identificarlo. Carlo Rubbia
CONCLUSIONI
Siamo così giunti al termine del nostro percorso lungo più di venti secoli, partito all’ombra delle piramidi e terminato nei moderni laboratori. Abbiamo cercato di presentare il maggior numero di figure che hanno avuto un importante ruolo nello sviluppo di questa scienza, cercando per ognuno di delineare un profilo che ne abbracciasse non solo l’attività di scienziato, ma anche le esperienze di vita, dimostrando come la ricerca scientifica non sia avulsa dal contesto storico-sociale ma anzi sia la linfa da cui una civiltà matura dovrebbe trarre nutrimento per continuare a prosperare. Abbiamo cercato una trattazione completa ma che allo stesso tempo fosse il più possibile accessibile a tutti, credendo che lo scopo principale di questa trattazione sia stato il cercare di coinvolgere il maggior numero di persone nello spirito che ha animato questi uomini, ai quali dobbiamo l’agio di cui oggi godiamo grazie alla moderna tecnologia, sperando che l’attività scientifica non resti, come sta avvenendo in questi ultimi anni, solo un’attività per pochi intimi.
Qualunque sia la forma del recipiente, la forza premente è uguale al peso del liquido contenuto in un cilindro con base uguale al fondo del recipiente e altezza pari alla distanza tra il fondo e la superficie libera del fluido.
Tale legge deve oggi tuttavia essere parzialmente corretta alla luce della celebre equazione di Einstein . Infatti quando il sistema non è isolato (e in sistemi reali non lo è mai), c’è sempre uno scambio di energia e dunque anche una variazione di massa. Tuttavia per reazioni non-nucleari l’energia è talmente bassa che il difetto (o l’aumento) di massa non è mai registrabile strumentalmente ed è pertanto trascurabile. Nelle reazioni nucleari invece non è affatto così: il Sole perde ogni secondo, a causa della serie di reazioni nucleari della catena protone-protone, 5∙109 kg di massa
Basato sul fatto che due corpi che viaggiano alla stessa velocità, di carica uguale, percorrono orbite circolari di raggio proporzionale alla massa
Nel periodo alchimistico essi erano rappresentati con i simboli dei pianeti o comunque derivanti dall’astrologia. Non c’era organicità, anzi, per impedire che altri venissero a conoscenza delle proprie ricerche, spesso la simbologia cambiava da alchimista ad alchimista
Il modo più semplice per descrivere un composto, che enuncia solo le specie chimiche coinvolte in esso.
Grosse molecole organiche, a elevata massa molecolare, ottenute combinando tra loro piccole molecole, dette monomeri, che ne costituiscono le unità fondamentali
In particolare il prof. Natta vinse il Nobel per aver sintetizzato con tale procedimento il politene, con cui ancora oggi vengono prodotte le bottiglie per l’acqua minerale.
Mr = Massa molecolare relativa; Ar = massa atomica relativa. Relative perché misurate rispetto all’u.m.a. e non al kg.
Il calore specifico è la quantità di calore necessaria per aumentare di 1° C la temperatura di 1 kg di una determinata sostanza
La IUPAC sta valutando i nomi da assegnare agli elementi 104, 105 e 106, attualmente denominati con delle sigle. Se una delle proposte presentate sarà accolta, anche Rutherford avrà il “suo” elemento
Branca della chimica che si occupa dello studio dello scambio di energia (particolarmente calore) che avviene tra l’ambiente e la reazione chimica
Ce ne occuperemo approfonditamente più avanti, per ora basti sottolineare che essi sono le forze che permettono l’esistenza delle molecole, tramite l’aggregazione di atomi
Secondo la relazione v=k[A]a[B]b, dove k è una costante e a e b sonodue coefficienti ricavabili solo sperimentalmente; le parentesi quadre per convenzione indicano la concentrazione molare
Nobel per la chimica nel 1901, è stato il fondatore della stereochimica organica (studio dell’attività delle molecole organiche esposte alla luce) e colui che ha ricavato quantitativamente il valore della pressione osmotica delle soluzioni (p=iMRT, dove i è appuntodetto coefficiente di Van’t Hoff e indica il numero di ioni in cui è capace di dissociarsi l’elettrolita, M è la molarità [M=n/V]).
Infatti mostrò che k=Ae-E/RT, dove A è una costante che varia a seconda della reazione, E è l’energia di attivazione e R la costante universale dei gas [8,31 J/(mol∙K)]
Da un punto di vista matematico, si dimostrò che il termine A che compare nella formula della costante chimica di Arrhenius, è in realtà il prodotto di r, chiamato fattore sterico, cioè la probabilità che un urto, una volta avvenuto, sia efficace (varia da molecola a molecola a seconda della struttura), e di un fattore Z, una funzione piuttosto complessa nella quale intervengono varie costanti (quella dei gas, il p ecc.) e che dipende linearmente dalla superficie laterale e sotto radice quadrata dalla temperatura.
Famoso tra l’altro per aver formulato la prima teoria sul campo magnetico terrestre, secondo la quale esisteva all’interno del nostro pianeta una gigantesca sbarra ferromagnetica
La quantità di moto, che d’ora in poi indicheremo con p, è uguale al prodotto della massa per la velocità
Possiamo avere cioè solo cariche multiple intere di quella dell’elettrone: pertanto vi saranno cariche +3e (per e si intende la carica dell’elettrone) o -5e ma mai cariche +3,5e
Riportiamo la legenda dei simboli che useremo: r raggio della gocciolina, q carica gocciolina, d distanza armature condensatore, rodensità olio (800 kg/m3), ra densità aria (1,2 kg/m3), h viscosità dell'aria, g accelerazione di gravità (9,81 m/s2), V differenza di potenziale tra le armature, u0 velocità senza campo elettrico E, u velocità con campo elettrico. Si suppone sferica la gocciolina.
Il cui valore è h=6,63∙10-34 J∙s (d’ora in poi, se non chiaramente specificato, per h intenderemo tale valore)
Fenomeno che se oggi può apparire negativo, con il problema dell’eccessivo riscaldamento del pianeta (che tuttavia ha diverse concause e non solo l’aumento delle immissioni umane di CO2) ma che in realtà è positivo, consentendo sulla Terra una temperatura adatta allo sviluppo della vita.
Nel 1795 la Polonia fu occupata e spartita tra Russia, Prussia ed Austria, a seguito di una crisi dinastica che dopo l’estinzione della dinastia sassone al potere vide anche la destituzione del loro successore, il riformista di origini russe Poniatowski. Varsavia, dove era nata Marie Curie, faceva in realtà parte della zona di occupazione prussiana, che tuttavia passò alla Russia dopo il Congresso di Vienna del 1815. La Polonia come nazione indipendente fu ricostituita solo in seguito ai trattati di Versailles e St. Germain, alla fine della prima guerra mondiale.
In natura non esistono corpi perfettamente neri, i quali sono dunque detti ideali, ma ne sono buona approssimazione corpi solidi e liquidi portati all’incandescenza e gas ad alta T e P
Tale definizione, data solo per facilitare la comprensione, non deve essere però presa alla lettera: in matematica il grafico a campana è tipico solamente della funzione gaussiana, di equazione
Ne esiste anche un’altra versione: , più utile per applicazioni, come l’astrofisica, dove si usa per calcolare la T delle stelle, in cui si può ricavare più facilmente la l
La potenza non è altro che energia fratto tempo; s è la costante di Stefan-Boltzmann, di valore 5,67∙10-8 W/(m2∙K4); in realtà tale formula è applicabile a qualsiasi corpo aggiungendo una costante di emittività e, che per il corpo nero vale 1.
Solo oggi i fisici le hanno dimostrate anche in via teorica, rifacendosi proprio al lavoro di Plance. Il procedimento è molto complicato, ma per i lettori più curiosi forniamo i valori che così otteniamo per le due costanti: mentre per la legge di Wien , dove x è la radice dell’equazione trascendente , risolvibile solo con i metodi di approssimazione numerica o per via grafica. k= 1,38•10-23 J/K (costante di Boltzmann)
la teoria si basa sul principio che le leggi fisiche devono essere le stesse per ogni sistema di riferimento inerziale e che la velocità della luce nel vuoto è una costante ed è indipendente da quella della sorgente luminosa. Da questi postulati Einstein giunse a numerose concezioni del tutto nuove che rivelarono i limiti della geometria euclidea, base della fisica classica. La conseguenza più importante, che ha favorito la scoperta e l'utilizzazione dell'energia nucleare, fu quella dell'equivalenza tra massa ed energia espressa dalla celebre formula E= mc², dove E rappresenta l'energia, m la massa e c la velocità della luce nel vuoto.
dove, in base al postulato dell'equivalenza fra tutti i sistemi inerziali e non inerziali, formulò una nuova teoria della gravitazione in cui il campo gravitazionale generato da ogni corpo materiale è rappresentato come una modificazione delle proprietà geometriche dello spazio fisico. Come conseguenza di ciò, la geometria euclidea risultò insufficiente a descrivere le leggi secondo le quali i corpi si comportano nello spazio: infatti, la curvatura dello spazio, ipotizzata dalla teoria, induce a considerare la retta, il piano e le altre entità geometriche, il principio d'inerzia e le altre leggi classiche della teoria newtoniana della gravitazione universale, come casi limite validi solo, con grandissima approssimazione, per lo spazio del nostro sistema planetario. La formulazione matematica della teoria fu possibile, in quanto Einstein adottò la nuova matematica non euclidea formulata da Riemann. La validità delle affermazioni contenute nella teoria della relatività generale fu confermata sperimentalmente dalla rotazione delle ellissi delle orbite planetarie intorno al Sole (constatata per Mercurio); dal fenomeno dello spostamento verso il rosso delle righe spettrali delle stelle; dalla curvatura dei raggi luminosi per effetto dei campi gravitazionali (constatata durante l'eclisse del 29 marzo 1919).
Il quale invece propose come spiegazione una particolare oscillazione degli atomi del corpo nero, simile a quella delle corde stazionarie nell’ambito dell’acustica
Esistono anche una serie di emissioni alle bassissime frequenze, tra cui le più note sono quelle di Brackett e Pfund
In particolare n′≥1 indica la serie della riga (per esempio Lyman è 1, Balmer 2 e così via) mentre n≥ n′+1 indica il numero della riga (per esempio la riga rossa di Balmer vale 2+1=3)
Anche il figlio Aage avrà quest’onore, nel 1975, per una teoria sull’organizzazione energetica dei nuclei atomici
L=mvr (r è la distanza dall’asse di rotazione che, in questo caso, corrisponde al raggio dell’orbita)
Fenomeno per cui un fascio di luce o di un’altra onda, se fatto passare per una fenditura e proiettato, produce una massima intensità centrale e poi, simmetricamente, minimi e massimi alternati.
A suo merito, si deve precisare che Schrödinger non fu costretto a fuggire, fu lui che decise di andarsene perché aveva compreso la drammaticità della situazione tedesca, a differenza di altri che, pur ideologicamente contrari ad Hitler, preferirono non palesare la loro avversione al regime ma anzi, come Hiesenberg, accettarono cariche ufficiali.
Inoltre essi hanno, secondo il numero quantico magnetico m, rispettivamente 1,3,5,7 orientamenti nello spazio, ciascuno dei quali , secondo Pauli contiene 2 elettroni di spin opposto. I diversi orientamenti di uno stesso orbitale sono isoenergetici.
Spieghiamo come è stata ricavata per i più interessati: si tratta della derivata seconda parziale rispetto alla posizione dell’equazione che regola il moto delle onde armoniche , su cui poi, applicando al posto di l l’equazione di de Broglie e sostituendo ulteriormente la quantità di moto con la relazione , si ottiene tale equazione
Si tratta di 6 gas così definiti perché chimicamente inerti, non reagiscono con nessun altro elemento: essi sono elio (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe) e radon (Rn)
Atomo che ha perso o acquistato uno o più elettrone e che dunque non è più elettricamente neutro ma avrà carica positiva o negativa multipla intera di e.
Infatti He ha configurazione elettronica 1s2. Si formano due orbitali, uno di legame, uno di antilegame su cui devono disporsi i 4 elettroni, pertanto i due più esterni si troveranno sull’orbitale ss*.
Questione ancora dibattuta, dalla sua risoluzione dipendono varie teorie fisiche, tra cui i modelli sulla fine dell’Universo ed anche la validità del modello di struttura interna del Sole attualmente adottato dagli astrofisici.
Elemento numero 43. Dunque dovrebbe esistere in natura, prodotto dalle reazioni nucleari delle stelle. Tuttavia è talmente instabile che è ottenibile solo artificialmente, in quanto quello naturale decade in brevissimo tempo
Qui nasce il famoso problema dell’asimmetria del Big Bang: infatti in quel momento si sarebbero dovute formare, secondo quanto detto, tante particelle di materia quante di antimateria, che poi si sarebbero annichilite fra di loro. Tuttavia, poiché la materia esiste, è evidente che per qualche motivo, si debba essere formata più materia che antimateria. Questo è uno dei più fitti misteri della scienza moderna.
Fonte: http://www.sansepolcroliceo.it/LavoriIndividuali/La_Chimica_letta_attraverso_opera_dei_suoi_protagonisti.doc
Storia della chimica
Visita la nostra pagina principale
Storia della chimica
Termini d' uso e privacy
