Elettrolisi
Elettrolisi
I riassunti, le citazioni e i testi contenuti in questa pagina sono utilizzati per sole finalità illustrative didattiche e scientifiche e vengono forniti gratuitamente agli utenti.
ELETTROLISI
L'elettrolisi è il particolare processo per cui, quando si sottopone una soluzione acquosa di acidi, di basi o di sali, ad una differenza di potenziale elettrico, si stabilisce in essa una corrente elettrica con trasporto di materia. I veicoli di queste cariche non sono le molecole intere nè del solvente nè della sostanza disciolta, bensì parti di queste.
Gli acidi, le basi, ed i sali hanno perciò, in soluzioni di determinati solventi, le loro molecole scisse in due parti, delle quali, allo stabilirsi della corrente elettrica, una (anione) migra e si deposita al polo positivo o anodo e l'altra (catione) al polo negativo o catodo. Queste parti della molecola possono essere atomi o gruppi di atomi.
Tale è la separazione, per esempio, degli atomi di cloro e sodio o di cloro e potassio nelle soluzioni elettricamente conduttive che li contengono ionizzati: questa è una delle applicazioni dell'elettrolisi ampiamente sfruttata nell'industria elettrochimica per la produzione di ipoclorito di sodio.

PRODUZIONE DI IPOCLORITO DA ACQUA DI MARE O SALAMOIA
L'ipoclorito è uno dei disinfettanti chimici più usati . Da lungo tempo apprezzato per la sua bassa tossicità, potere deodorizzante, effetto a lungo termine, facilità di trasporto e stoccaggio, questo potente germicida si è dimostrato ideale per applicazioni di vario genere, a partire dal normale uso domestico di ogni giorno (bucato, pulizia casa in genere) fino ad arrivare alle grandi applicazioni industriali. L'industria chimica mondiale odierna produce annualmente più di 40 milioni di tonnellate di cloro gas, del quale circa lo 0,5% è usato per l'eliminazione delle incrostazioni nei sistemi di raffreddamento nelle industrie per la produzione di energia elettrica.
Fonte: http://www.liceogrigoletti.it/docenti/doc14/files/ELETTROLISI%20NaCl.doc
Autore del testo: non indicato nel documento di origine
Elettrolisi
L’elettrolisi dell’acqua
Scomposizione elettrolitica dell’acqua e riconoscimento degli elementi di cui e` composta.
Obiettivi
- Dimostrare che l’acqua e` un composto chimico
- Verificare la reazione di ossidoriduzione delle componenti dell’acqua.
- Osservazione del rapporto esistente tra quantità di idrogeno e quantità di ossigeno, con accenni alla legge di Proust.
- Dimostrazione del processo di elettrolisi.
Strumenti
- Trasformatore
- Raddrizzatore
- Elettrodo negativo
- Elettrodo positivo
- Cilindri graduati collegati tra loro da una struttura verticale terminante all’estremità superiore con un’ampolla.
Materiale
- Acido solforico.
- Acqua.
- 2 provette.
- Un sostegno al quale agganciamo due pinze necessarie per sostenere le due provette e due elettrodi.
- Due morsetti e due cavi elettrici collegati ad un generatore di corrente elettrica continua a basso voltaggio.
- Spruzzetta contenente acqua distillata.
- Bastoncino di legno.
- Accendino.
Principi teorici
Si chiamano elettroliti quei composti che in soluzioni o fusi lasciano passare la corrente elettrica. I nostri elettrodi che abbiamo immerso nella soluzione sono di platino.
Si osservano in questa esperienza i seguenti punti:
- la molecola dell’elettrolito all’atto della soluzione si scinde in ioni, che al passaggio della corrente migrano il catodo (cationi) o l’anodo (anioni)
- l’anione e il catione giunti in prossimità degli elettrodi vi si possono depositare oppure subire trasformazioni chimiche.
- la quantità di sostanza depositata o liberata agli elettrodi dipende soltanto e in modo direttamente proporzionale dalla quantità di elettricità passata nella soluzione (prima legge di Faraday)
- per qualunque elettrolito occorre sempre la stessa quantità di elettricità (seconda legge di Faraday)
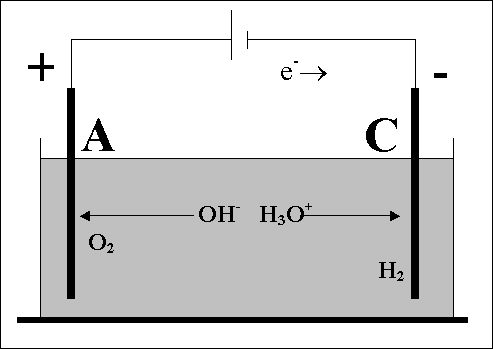
Gli ioni formatisi, o carichi positivamente o carichi negativamente, sono attirati rispettivamente o dall’anodo o dal catodo; si stabilisce in questo modo un trasporto di cariche che realizza il passaggio della corrente elettrica nella soluzione.
Per avere il processo elettrolitico e` necessario applicare una differenza di potenziale minima al di sotto della quale non si ha elettrolisi in modo tale di vincere i fenomeni di resistenza della soluzione.
L’acqua e` un composto stabile, ma la sua molecola può essere tuttavia scissa da elementi con affinità chimica per l’uno o l’altro dei suoi componenti. L’acqua può essere decomposta in idrogeno e ossigeno, ma in altri casi la molecola si scinde in uno ione idrogeno H+ e uno ione idrossido OH-.
Tali reazioni dette idrolisi avvengono con i sali degli acidi deboli e delle basi deboli nel nostro caso dell’acido solforico.
La legge di Proust e` la legge che stabilisce la costante dei rapporti delle masse secondo cui due o piú elementi si combinano tra loro.
Tale legge e` detta anche legge delle proporzioni definite e costanti; tramite questa legge si spiega il perché del rapporto 2-1 dell’idrogeno sull’ossigeno (componenti acqua).
Importante ricordare che un acido in soluzione acquosa sottoposta a elettrolisi libera ossigeno.
Procedimento
Tramite l’ampolla introdurre nella struttura verticale una determinata quantità d’acqua m modo tale da raggiungere una stessa quantità di essa in entrambi i cilindri graduati.
Inserire in quest’ultimi una lamina metallica ciascuno, essa prende il nome di elettrodo.
Collegare infine tramite cavi i due elettrodi ai poli di una pila (positivo e negativo).
Accendere il voltametro.
Osservare la dissociazione delle componenti del composto.
Verificare l’effettività delle componenti raccogliendole in due provette.
Tabella
Tabella dei risultati ottenuti , misurando ogni minuto le quantità di gas prodotte
Tempo in secondi |
Volume idrogeno |
Volume ossigeno |
Primo minuto |
2 ml |
1 ml |
Secondo minuto |
4,2 ml |
2,1 ml |
Terzo minuto |
6,6 ml |
3,3 ml |
Quarto minuto |
8,8 ml |
4,2 ml |
Dalla tabella su scritta si può notare il rapporto direttamente proporzionali tra ossigeno e idrogeno, e il rapporto 2-1 tra gli stessi.
Conclusioni
Dalla formula chimica dell’acqua si deduce che poiché la molecola dell’acqua e` composta da 2 atomi di idrogeno e uno di ossigeno, il volume dell’idrogeno combinato per ottenere le molecole dell’acqua, e` doppio rispetto a quello dell’ossigeno (rapporto 2-1).
Per separare gli elementi si può usare la corrente elettrica; con un processo chiamato elettrolisi, sviluppando agli elettrodi rispettivamente H2 gassoso e O2 gassoso. Le due semireazioni dell’elettrolisi sono:
- 4H2O + 4e- 2H2 + 4OH-
- 4OH- O2 + 2H2O + 4e-
- 2H2O 2H2 + O2
Per verificare l’autenticità dei gas prodotti abbiamo adottato come metodo di riconoscimento la combustione, infatti applicando il bastoncino di legno acceso in entrambi le provette contenenti i gas, abbiamo osservato che nella provetta dove i volume era minore la fiamma si e` ravvivata a dimostrazione che in quella provetta c’era ossigeno (comburente) elemento indispensabile in ogni combustione.
Lo stesso bastoncino e` stato poi riacceso ed avvicinato alla seconda provetta contenente il gas con il volume maggiore in quell’istante si e` udita una piccola deflagrazione a dimostrazione che in quella provetta c’era idrogeno (combustibile). L’esperimento dimostra che l’acqua e `composta da idrogeno ed ossigeno.
Osservazioni
Il voltametro e` costituito da un trasformatore e da un raddrizzatore.
Il voltametro e` un apparecchio per la misura i una quantità di elettricità dedotta dalla quantità di materia liberata per elettrolisi ad un elettrodo. Il trasformatore e` una macchina statica che assorbe energia della stessa specie ovvero elettrica di cui si presta a variare i parametro dai valori d’ingresso ai valori di uscita, nel nostro caso a variare energia elettrica da 220 W a 8 W.
Il raddrizzatore e` anch’esso statico ma atto a trasformare la corrente da alternata a continua o in unidirezionale.
Osserviamo inoltre che subito dopo l’accensione del voltametro inizia una reazione chimica immediata in cui l’ossigeno diventa ossigeno molecolare e si ossida mentre l’idrogeno si riduce (reazione di ossidoriduzione).
Il cilindro collegato al polo positivo ha un volume minore di gas rispetto a quello collegato al polo negativo, cio` fa supporre che l’acqua si scompone in una parte con carica positiva costituita dall’idrogeno e una parte con carica negativa costituita dall’ossigeno. Cariche positive e negative si attraggono.
Fonte: http://www.scuolepie.it/scuolepie/progetti/ACQUA/Ambito%20scientifico/ELETTROLISI.doc
Autore del testo: non indicato nel documento di origine
Elettrolisi
Visita la nostra pagina principale
Elettrolisi
Termini d' uso e privacy