Chimica riassunti
Chimica riassunti
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
L’atomo
La parola atomo deriva dal greco e significa indivisibile, ma oggi sappiamo che essi sono divisibili. Fin dall’antichità si sapeva che essi contenevano cariche elettriche che se di segno opposto si attraevano, mentre se dello stesso segno si respingevano (c’è attrazione anche tra una oggetto neutro, senza carica e uno con una carica attraverso l’induzione), ma fino XX secolo non si sapeva da cosa erano composti gli atomi. Il primo fu J. Thomson che tramite il tubo catodico riuscì a scoprire le particelle dell’atomo cariche negativamente: gli elettroni. Nel tubo catodico privo d’aria venivano posizionati due placche una con una carica negativa, catodo e una con una carica negativa, anodo; Dando corrente dal catodo partivano dei raggi luminosi sparsi che colpivano l’anodo e si trasformavano in un fascio luminoso ordinato che andava verso la fine del tubo. Verso la fine del tubo erano sistemate due placche una negativa in alto e una positiva in basso. Questo fascio di luce tendeva ad andare verso il basso per cui le particelle del fascio di luce dovevano essere cariche negativamente. Thomson chiamò queste particelle elettroni. Per scoprire la particella carica positivamente, il protone fu fatto un esperimento simile da Goldstein, ma invertì la posizione dell’anodo e del catodo facendo partire i raggi dall’anodo, raggi anodici. Però le particelle positive non partivano dalle placche ma provenivano dai gas contenuti nel tubo a bassissima pressione. Goldstein capì che gli atomi dei gas, bombardati dagli elettroni che partivano dalle placche venivano divisi dagli elettroni e rimanevano solo le parti positive, ovvero i protoni. Gli atomi sono formati quindi da protoni e neutroni, senza carica (scoperti nel 1932) nel nucleo e dagli elettroni. Fino al 1909 non si sapeva come fossero fatti gli atomi, ma grazie all’esperimento di Rutherford si scopri che erano composti da un nucleo formato dalle cariche positive e da uno spazio vuoto intorno al nucleo che conteneva gli elettroni. Rutherford si servi di un raggio α (formati da nuclei positivi di elio) con cui bombardò un sottilissimo foglio d’oro. Egli notò che gran parte del raggio attraversava il foglio e una piccola parte veniva rimbalzata indietro (colpivano i protoni) e una piccolissima parte veniva deviata (colpiva gli elettroni).
In passato si pensava che le parti dell’atomo fossero fondamentali, cioè non erano formate da niente, invece oggi sappiamo che protoni e neutroni sono formati da quark.
Esiste un tipo di atomo per ogni elemento e alcuni elementi hanno degli isotopi ovvero degli atomi dello stesso elemento aventi le stesse proprietà chimiche che hanno gli stessi protoni e elettroni ma hanno un diverso numero di neutroni. Ogni elemento è classificato in base al:
- Numero atomico: numero dei protoni (che è sempre uguale a quello degli elettroni
- Numero di massa: numero dei protoni più quello dei neutroni-numero delle particelle presenti nel nucleo
- Peso atomico: media ponderale del numero di massa degli isotopi di un elemento
La struttura dell’atomo
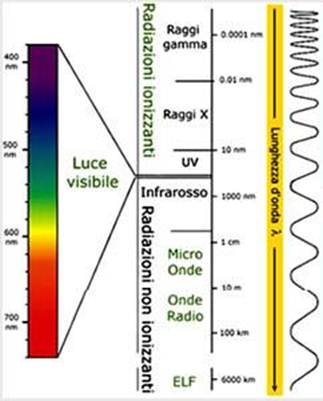
Tutto quello che sappiamo sulla struttura elettronica degli atomi ci viene dall’analisi della luce emessa o assorbita dalle sostanze. La luce e le altre radiazioni elettromagnetiche (insieme di campi elettrici e magnetici che si verificano in successione in modo ortogonale) hanno natura ondulatoria (e in parte corpuscolare). Le grandezze che caratterizzano i fenomeni ondulatori sono:
- La frequenza: il numero di oscillazioni nell’unità di tempo; si misura in Hertz Hz.
- La lunghezza d’onda si misura in metri e si scrive con la lettera lambda.
- La velocità: la velocità della luce nel vuoto è 299792458 m/s, circa 300000000 m/s
- L’ampiezza d’onda ovvero la distanza tra il punto più alto e quello più basso dell’onda
La lunghezza d’onda è inversamente proporzionale alla frequenza
La velocità, la frequenza e la lunghezza d’onda sono correlate dalla seguente relazione: c = λ x ν (velocità della luce = lunghezza d’onda per frequenza).
Lo spettrometro permette di riconoscere le lunghezze d’onda. Lo spettrometro analizza la luce prodotta da un sorgente e la scompone mostrano lo spettro di emissione: ogni elemento ha un diverso spettro di emissione poiché gli elementi possono raggiungere solo determinati livelli di energia.
Le interferenze sono lo scontro tra due onde: se l’interferenza è positiva ovvero le onde sono posizionate in maniere uguale ( con la parte più alta che combacia con la parte più alta o viceversa) le onde si sommano, se il contrario si annullano. I fotoni sono le particelle che portano l’energia della luce e sono responsabili dell’espulsione di elettroni da superfici.
Talvolta si usa la luce per studiare alcune particelle piccole, tramite la diffrazione. Quando una particella viene colpita da un’onda che ha la stessa grandezza, l’onda verrà deviata e formerà su uno schermo una figura detta figura di diffrazione. Tramite una formula matematica dalla figura di diffrazione possiamo risalire alla forma della particella.
Esistono 2 tipi di energia; quella continua o non quantizzata, ovvero tutti gli stati di energia possono essere raggiunti; quella quantizzata o discreta solo alcuni stati possono essere raggiunti e questi stati sono ben separati e non continui. L’energia potenziale gravitazionale è l’energia si un corpo sotto l’effetto della gravita e si calcola E = mgh (massa per gravita(9,81) per l’altezza da una superficie di riferimento). Se prendiamo in esempio una scala mobile e una scala a gradini possiamo vedere come nella prima si possono raggiungere tutti gli stadi di energia potenziale gravitazionale (energia continua), poiché la scala mobile raggiunge tutti i livelli di altezza, invece nella scala a gradini possiamo raggiungere solo i livelli di energia su ogni gradino perché non potremmo essere sospesi tra un gradino e l’altro (energia quantizzata).
Per verificare la verità delle teorie dell’elettromagnetismo si ricorre ai cosiddetti corpi neri, ovvero sorgenti di radiazioni elettromagnetiche ideali che scaldati emettono radiazioni elettromagnetiche. Lo studio di questi corpi neri provocò una crisi in quanto non si riusciva a capire perché questi corpi neri non producevano luce blu. MA arrivavano solo ad emettere luce rossa e gialla. Planck risolse questo problema proponendo che non tutti i livelli di energia erano possibili ma solo alcuni ed espresse una formula par calcolare l’energia: E = h ν dove h è la costante di Planck e ν la frequenza dell’onda. Non si riusciva ad arrivare alla luce blu poiché non si riusciva ad arrivare all’energia necessari per produrre luce blu.
I modelli atomici
Il fisico danese Niels Bohr studiò nel 1913 l’atomo di idrogeno. Il fisico danese suppose che l'elettrone si muovesse intorno al suo nucleo sotto l'influenza di un attrazione con orbite circolari. L’atomo proposto da Bohr ebbe subito un problema poiché l’elettrone perdeva quantità di moto e iniziava a cadere sul nucleo con un moto a spirale. Poiché l’elettrone non poteva scontrarsi col nucleo positivo Bohr propose subito un postulato, ovvero disse che l'elettrone può muoversi solo su alcune determinate orbite dette stati stazionari che seguivano la legge: mvr = n(h/2π) [il movimento angolare (massa per velocità di rotazione per il raggio) deve essere uguale a una costante n(numero quantico principale che può assumere solo valori interi e positivi)che moltiplica la costante di Planck fratto 2π]
Tutti i valori possibili dell'energia di un elettrone sono legati ad un'altra formula: E = -(k/n²) dove k = 2π²·m·e(elevato alla quarta)/h² [ 2π² per la massa per la carica elettrica dell’elettrone alla quarta].
Il raggio dell’orbita è: r = a0 ·n² dove a0 = h²/4π²·m·e². a0 è il primo raggio di Bohr.
Bohr riuscì a spiegare tutto, ma questo modello atomico andava bene solo per l’atomo d’idrogeno.
De Broglie studiò per primo il dualismo onda particella, egli ipotizzò che tutta la materia avesse proprietà ondulatorie: ad un corpo con quantità di moto veniva infatti associata un'onda di lunghezza d'onda λ = h/m·v [lunghezza d’onda = costante di Planck fratto quantità di moto( massa per velocità)].
Schrodinger propose un equazione tenendo conto del movimento ondulatorio dell’elettrone dove compariva la funzione d’onda. Il quadrato della funzione d’onda corrisponde alla probabilità di trovare l’elettrone in un punto particolare dello spazio di coordinate note. Risolvendo l’equazione di Schrodinberg è possibile individuare gli orbitali ovvero le zone intorno al nucleo dove c’è alta probabilità di trovare un elettrone.
Analizzando il modello di Bohr il fisico Heisenberg disse che è impossibile sapere nel medesimo istante e con la massima precisione dove si trovi un elettrone e con che velocità si sta muovendo. Questo è chiamato principio di indeterminazione.
Il principio viene abitualmente reso con la formula: Δx·Δ(m·v) > o = h/4π [l’incertezza della posizione nello spazio (Δ rappresenta l’incertezza e x la posizione nello spazio) per l’incertezza della quantità di moto (massa per velocità) è maggiore o uguale alla costante di Planck fratto 4π].
Ogni orbitale è caratterizzato da 3 numeri quantici, più uno che descrive il verso di rotazione dell’elettrone, e sono riportati nella tabella seguente:
Simbolo |
Significato fisico |
Nome |
valori |
n |
Energia dell’orbitale |
numero quantico principale |
1, 2, 3, ecc |
l |
Forma dell’orbitale |
numero quantico angolare |
Da 0 a n-1 |
m |
Orientamento dell’orbitale |
numero quantico magnetico |
Tutti i valori compresi tra –l e +l |
ms |
Verso di rotazione dell’elettrone |
numero quantico di spin |
+1/2 o -1/2 |
Il numero quantico principale determina la distanza media dal nucleo degli elettroni. Orbitali con lo stesso numero quantico principale costituiscono un livello energetico. Al crescere di n gli orbitali diventano sempre + grandi, la loro energia cresce e gli elettroni sono più distanti dal nucleo.
Il numero quantico angolare determina la forma dell’orbitale. Esistono 4 tipi di orbitali, uno per ogni valore che assume l: per l = 0 si avrà una sfera s, per l = 1 si avrà un orbitale dal nome p, per l = 2 avremo d e per l = 3 avremo f.
In numero quantico magnetico indica l’orientamento dell’orbitale nello spazio, ogni tipo di orbitale (s p d f) ha un diverso numero di orientamenti determinati dal valore di l. L’orbitale s avrà un orientamento, quello p 3, quello d 5 e quello f 7; da come si può vedere nella tabella, perché prendendo in esempio il d, esso avrà come valori di m: -2,-1,0,+1,+2; e sono 5 valori per cui 5 orientamenti.
Il numero quantico di spin indica il verso di rotazione, spin, dell’elettrone. Ogni elettrone può avere due tipi di spin e quindi ogni orbitale potrà contenere due elettroni, poiché in ogni orbitale possono esistere solo elettroni con spin diverso.
Quando si vogliono scrivere gli orbitali si mette prima il livello energetico (ovvero il valore di n), poi il nome
dell’orbitale(s p d o f) e infine il numero degli elettroni presenti in quel tipo di orbitali. Es: 4p6
Per disegnare gli orbitali si fa un quadrato con delle frecce all’interno; ogni freccia rappresenterà l’elettrone per cui potranno essere al massimo due frecce, una rivolta verso il basso e una verso l’alto a rappresentare i due diversi versi di rotazione.
In ogni atomo gli elettroni si dispongono occupando prima gli orbitali a più basso livello di energia, percui l’idrogeno che ha un solo elettrone lo avrà sull’orbitale 1s e il litio che ne ha 3 di elettroni li avrà 2 sull’orbitale 1s e uno sull’orbitale 2s.
Negli orbitali uguali con diverso orientamento hanno stessa energia gli elettroni tendono a stare da soli; Es: nell’azoto con 7 elettroni essi si disporranno cosi: 2 elettroni nell’orbitale 1s, 2 elettroni nell’orbitale 2s, poi gli altri 3 elettroni si disporranno su ognuno dei 3 orbitali 2p, poiché gli orbitali di tipo p hanno tre diversi tipi di orientamento.
Gli orbitali p essendo 3 per ogni strato portano ognuno 6 elettroni (3 orbitali X 2 elettroni = 6), gli orbitali d ne portano 10 e quelli f ne portano 14.
L’ordine di riempimento degli elettroni è normale fino all’orbitale 3p. Poiché gli orbitali d si dispongono non dopo gli orbitali p ma dopo quelli s del livello successivo. Lo stesso accade per gli orbitali f che si dispongono immediatamente dopo quelli s di due livelli energetici superiori.
Questa è l’ordine di riempimento degli orbitali:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Il sistema periodico
Il primo che classificò gli elementi noti del suo tempo fu Mendeleev che nel 1869 ordinò i 63 elementi noti secondo la massa atomica crescente, facendo righe da 7 elementi (i gas nobili non erano ancora stati scoperti) e anche se vi erano dei buchi nella sua tabella previde che esistevano degli elementi che non erano ancora scoperti che potessero tappare quei buchi. Infatti pochi anni più tardi alcuni scienziati scoprirono gli elementi che Mendeleev aveva previsto. Nella tabella moderna il posto occupato da ciascun elemento è stabilito dal numero atomico che indica il numero di protoni nel nucleo (e gli elettroni all’esterno). Gli elettroni su una stessa colonna rappresentano caratteristiche simile per quanto riguarda gli elettroni negli orbitali più esterni e quindi sono chiamati gruppo. Gli elettroni più esterni sono detti elettroni di valenza. Gli elementi del primo gruppo hanno un solo elettrone nel sottolivello più esterno (in questo caso s) che è detto guscio di valenza e sono detti metalli alcalini. Quelli del secondo gruppo sono metalli alcalino-terrosi e hanno due elettroni sul guscio di valenza. Le differenze tra la tabella di Mendeleev e la moderna sono:
- Gli elementi sono ordinati secondo numero atomico e non peso atomico.
- Gli elementi sono 118.
- Le righe formano i periodi, che ci indicano il livello principale di energia (numero quantico principale) dove si trovano gli elettroni di valenza.
- Le colonne formano i gruppi, che hanno una doppia numerazione, una in numeri arabi, l’altra in numeri romani che significa quanti elettroni ci sono nei gusci di valenza. L’ultimo gruppo fanno parte i gas nobile che hanno 8 elettroni nel guscio di valenza e hanno una bassissima reattività in quanto sono stabili.
- Fra il gruppo II e III vi sono gli elementi di transizione che hanno gli elettroni di valenza nei sottolivelli d.
- In fondo alla tavola ci sono due file di 14 elementi che costituiscono le due serie di lantanidi e attinidi che hanno gli elettroni di valenza nei sottolivelli f.
Gli elettroni che si trovano nello stesso gruppo hanno lo stesso numero di elettroni nel livello energetico più esterno e hanno proprietà chimiche simili e fanno parte della stessa famiglia. Lo strato più esterno viene anche chiamato strato di valenza. Per indicare la struttura degli elettroni che hanno come livello esterno orbitali s o p si usano i simboli di Lewis, ovvero scrivere intorno al simbolo dell’elemento considerato tanti puntini quanti sono gli elettrno di valenza.
Il raggio atomico è la metà della distanza minima di avvicinamento fra due atomi dello stesso elemento. Il volume atomico è lo spazio occupato da una mole dell’elemento. Nella tabella periodica i raggi e i volumi atomici decrescono da sinistra verso destra e aumentano dall’alto verso il basso. Il raggio e il volume sono influenzati dal numero quantico principale e dagli elettroni interni, cioè quelli nei livelli energetici inferiori. L’aumento del numero degli elettroni in elettroni dello stesso periodo provoca una contrazione della nube atomica (insieme dello spazio occupato da elettroni e protoni) e quindi una diminuzione del raggio atomico.
Se forniamo energia a un atomo, i suoi elettroni possono effettuare salti quantici verso livelli più esterni, aventi energia più alta. Con energia ancora maggiore l'elettrone può essere espulso definitivamente dall'atomo. Il processo si chiama ionizzazione. L'energia necessaria per «strappare» un elettrone dall'atomo è detta energia di ionizzazione. Fornendo una quantità crescente di energia, è possibile allontanare dall'atomo un elettrone alla volta, ottenendo ioni con carica positiva, cioè cationi.
L'energia di ionizzazione si esprime in kj/mol, cioè l'energia necessaria a rimuovere una mole di elettroni da una mole di atomi. L'energia necessaria per togliere ad un elemento il primo elettrone viene denominata energia di prima ionizzazione e cosi via. Più elettroni togliamo ad un elemento più energia impiegheremo. Per calcolare l’energia di ionizzazione l’elemento viene introdotto in un tubo di vetro sotto vuoto e vengono applicati potenziali elettrici crescenti. Negli elettroni che si trovano su orbitali con lo stesso numero quantico l’aumento di energia di ionizzazione è minore rispetto a elettroni che si trovano su orbitale con diverso numero quantico. Esempio se vogliamo togliere un elettrone su un orbitale 3s impiegheremo molta meno energia rispetto a togliere un elettrone che si trova sull’orbitale 2p. Nella tabella periodica l’energia di ionizzazione è massima in alto a destra e minima in basso a sinistra.
Al contrario se un atomo cattura degli elettrone emette energia. L’energia liberata è detta affinità elettronica. L’affinità come l’energia di ionizzazione si misura in kj/mole e nella tabella periodica è massima in alto a destra e minima in basso a sinistra.
L’elettronegatività di un elemento misura la sua tendenza ad attrarre elettroni nel legame con altri elettroni. Quando due atomi formano un legame scambiandosi elettroni l’elettronegatività ci permette di capire se gli elettroni saranno equidistanti dai due nuclei o saranno spostati verso uno dei due. Nella tabella periodica l’elettronegatività è massima in alto a destra e minima in basso a sinistra.
Gli elementi chimici si dividono in metalli non metalli e semimetalli. Nella tabella periodica quelli più in alto a destra non hanno proprietà metalliche mentre mano a mano che ci si avvicina alla parte in basso a sinistra gli elementi avranno proprietà metalliche. I metalli sono in genere solidi (a parte il mercurio che è liquido) duri, hanno lucentezza metallica, sono buoni conduttori, sono duttili e malleabili. Molte delle proprietà chimiche dei metalli dipendono dalla loro tendenza a perdere gli elettroni, soprattutto quelli del I e II gruppo. Gli atomi dei metalli occupano posizione quasi fisse nei cristalli. Gli ioni metallici occupano posizioni fisse mentre alcuni elettroni più esterni si muovono liberamente da un atomo ad un altro. Esistono inoltre i metalli di transizione che riempiono i sottolivelli d e che sono molto simili tra loro: esistono anche i lantanidi e gli attinidi.
Gli elementi essenziali per la vita sono solo 26 o al massimo 39, ma solo 10 costituiscono più del 99% dell’organismo umano.
I legami chimici
Grazie ai legami chimici gli 89 atomi diversi in natura possono formare tutte le sostanze. Il legame si forma se l’insieme di atomi che ne risulta ha un’energia minore degli atomi separati. Se l’energia potenziale dei due atomi diminuisce i due atomi si uniscono, se aumenta il tentativo di unione fallisce. Nella formazione di legami si libera energia; se si vuole rompere tale legame occorre spendere energia. Tale energia è detta energia di legame ed è misurata in kj/mol o kcal/mol o eV(elettronvolt). In un legame solo gli elettroni più esterni partecipano all’operazione. Gli elettroni dello strato più esterno vengono detti elettroni di valenza. Gli elementi che si trovano nell’VIII gruppo e hanno 8 elettroni di valenza sono detti gas nobili (apparte l’elio che ne ha 2 ma si trova lo stesso nell’VIII gruppo). Gli studiosi capirono che il numero 8 indica la stabilità dell’atomo; pertanto gli altri atomi formano legami chimici per raggiungere questo stato. Quando indichiamo come sono messi gli elettroni negli orbitali potremmo chiamare singoletto un orbitale che contiene un solo elettrone e doppietto uno che ne contiene due. Un doppietto che non interviene in un legame è detto lone pair.
Un esempio di legame chimico è il legame covalente, ovvero quando due atomi condividono una coppia di elettroni; un legame covalente può essere scritto con i simboli di Lewis o con un trattino che sta a segnare quante coppie di elettroni sono condivise: H – H Cl = Cl H – O – H. La valenza è il numero di elettroni che un atomo guadagna, perde o mette in comune quando si lega con gli altri atomi. Gli elementi dal I al IV gruppo tendono ad assumere la configurazione del gas nobile che li precede; quelli del V VI e VII gruppo tentano di assumere quella del gas nobile che li segue. Se 2 atomi condividono un solo elettrone avremo un legame singolo, se condividono 2 elettroni avremo un legame covalente doppio, se ne condividono 3 un legame covalente triplo. Un legame triplo avrà un’energia di legame maggiore di un legame doppio che a sua volta avrà un energia maggiore di un legame singolo. Un particolare tipo di legame covalente è quello dativo, dove un solo atomo condivide una coppia di elettroni. Se il risultato di un legame dativo è uno ione (ovvero che la molecola ha un diverso numero di elettroni e di protoni) il legame dativo si chiamerà legame di coordinazione.
Quando l’accettore di elettroni è un metallo circondato da un numero di ioni negativi si forma un complesso o composto di coordinazione. Le molecole che circondano il metallo si chiamano leganti, mentre il metallo centrale è detto coordinante.
Due atomi identici uniti da legami covalenti esercitano la stessa forza di attrazione sulla coppia di elettroni di legame. Pertanto il legame sarà covalente puro o omopolare. Se ci sono due atomi differenti occorre prendere in considerazione l’elettronegatività, che misura la forza di attrazione di un atomo sugli elettroni di legame. Se la differenza tra i valori di elettronegatività è minore di 0,4 avremo un legame covalente puro; se compresa tra 0,4 e 1,9 avremo un legame covalente polare: ovvero gli elettroni di legame tenderanno a stare maggiormente attorno all’atomo con maggiore elettronegatività, e si formerà tra i due atomi un dipolo ovvero una separazione di cariche. Se la differenza sarà maggiore di 1,9 avremo un legame ionico: dove l’atomo che ha un elettronegatività minore cede l’elettrone all’altro atomo diventando uno ione positivo e l’altro atomo diventa uno ione negativo. I due atomi rimangono uniti a causa dell’attrazione elettrostatica poiché hanno cariche opposte. La valenza ionica rappresenta il numero di elettroni perduti o acquistati dall’atomo. I composti ionici formano cristalli con una struttura solida e ordinata: per esempio ogni atomo di Cl o Na nel cloruro di sodio NaCl si circonda di 6 atomi dell’altro elemento. I composti ionici hanno anche un elevato punto di fusione.
Un altro tipo di legame è quello metallico dove ogni metallo che compone il legame mette in comune gli elettroni più esterni formando una nube esterna dove si muovono questi elettroni che passano liberamente da un atomo all’altro; in questo modo sono tenuti assieme anche gli ioni positivi: Questa mobilità degli elettroni conferisce ai metalli le loro caratteristiche come la conducibilità elettrica e termica, la duttilità e la malleabilità.
I metalli fra loro formano legami metallici; i non metalli legami covalenti; i metalli e non metallici uniscono mediante legami ionici.
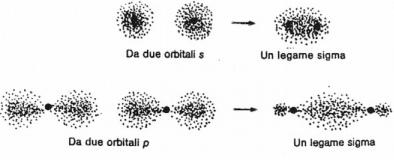 Secondo la teoria del legame di valenza quando si forma un legame covalente gli orbitali semipieni che intervengono danno origine ad un nuovo orbitale detto orbitale molecolare che permette agli elettroni di appartenere a ciascun atomo.
Secondo la teoria del legame di valenza quando si forma un legame covalente gli orbitali semipieni che intervengono danno origine ad un nuovo orbitale detto orbitale molecolare che permette agli elettroni di appartenere a ciascun atomo.
Se la sovrapposizione di due orbitali è frontale, avviene cioè lungo
l'asse che congiunge i due nuclei, il legame che si forma prende
il nome di legame σ (sigma). Si tratta di un legame particolarmente
solido. Se la sovrapposizione fra due orbitali è
laterale, avviene cioè fianco a fianco, si genera
 il legame π (pi greca). Questo legame è più debole del precedente e si forma solo per sovrapposizione di due orbitali di tipo p. E' regola generale che quando due atomi sono legati fra loro da un legame multiplo, uno solo di questi legami è di tipo σ, mentre gli altri sono tutti di tipo π. Nei legami di tipo π troviamo un piano che attraversa i due nuclei dove è nulla la possibilità di trovare gli elettroni. Questo è detto piano nodale.
il legame π (pi greca). Questo legame è più debole del precedente e si forma solo per sovrapposizione di due orbitali di tipo p. E' regola generale che quando due atomi sono legati fra loro da un legame multiplo, uno solo di questi legami è di tipo σ, mentre gli altri sono tutti di tipo π. Nei legami di tipo π troviamo un piano che attraversa i due nuclei dove è nulla la possibilità di trovare gli elettroni. Questo è detto piano nodale.
In alcuni casi come quello del carbonio gli orbitali tendono a ibridarsi, ovvero a mescolarsi e creare orbitali nuovi e con lo stesso livello di energia per poter formare più legami chimici allo stesso livello di energia. Nel carbonio troviamo nello strato più esterno due elettroni nel 2s e due elettroni nel 2p; in questo caso il carbonio potrebbe formare solo 2 legami accoppiando i singoletti. Però avviene per prima cosa la promozione, ovvero l’atomo eccitato fa passare un elettrone del 2s nel 2p formando 4 singoletti; rimane comunque il problema dell’energia poiché il singoletto 2s ha un livello di energia più basso rispetto ai 2p. Perciò avviene l’ibridazione, ovvero la mescolanza degli orbitali s con quelli p che formano 4 orbitali sp³ che hanno lo stesso livello di energia e il carbonio può fare 4 legami come nel caso del metano. Questi nuovi orbitali hanno per ¼ caratteristiche dell’orbitale s e per ¾ le caratteristiche dell’orbitale p. Può avvenire in alcuni casi che 1 o 2 orbitali p non intervengano nell’ibridazione e rimangono singoletti con un livello di energia diverso. Nel caso in cui 1 orbitale p rimanga inalterato avremo 3 orbitali sp² poiché formati da 1 orbitale s e da 2 orbitali p. Nel caso in cui 2 orbitali p rimangano inalterati avremo 2 orbitali sp poiché formati da 1 orbitale s e da 1 orbitale p. Gli orbitali sp formano sempre legami σ, mentre gli orbitali p inalterati formano legami π. Geometricamente se abbiamo solo 2 orbitali sp essi si disporranno in modo lineare formando tra di loro un angolo di 180°. Se abbiamo 3 orbitali sp² si disporranno in modo triangolare piano formando tra di loro 3 angoli da 120°. Se abbiamo 4 orbitale sp³ essi si disporranno in modo tetraedrico e quindi non più piano, ma solido formando angoli di 109,5°
La forma delle molecole
Molte proprietà delle sostanze dipendono dalla forma delle molecole. Gillespie nel 1957 propose una teoria che permette di ricavare le strutture molecolari dalle formule di Lewis. Questa è detta teoria della repulsione delle coppie di elettroni del guscio di valenza o VSEPR. Per studiare la forma delle molecole dobbiamo sapere quanti legami covalenti (singoli o doppi o tripli) Xn forma l’atomo centrale che chiameremo A e quante coppie di elettroni Em dell’atomo centrale non vengono utilizzate nei legami sapendo che le aree che stessa carica si respingono e quindi che la repulsione tra due coppie di elettroni libere è maggiore di quella tra una coppia di elettroni di legame e una coppia libera, che a sua volta è maggiore della repulsione tra due coppie di elettroni di legame. La molecola si schematizza cosi: AXnEm.
- Se la molecola è di tipo AX2 ovvero ha solo due legami covalenti e nessuna coppia di elettroni dell’atomo centrale libera si formerà una molecola con struttura lineare come il BeH2 H – Be – H. Tra i due legami ci sarà un angolo di 180°
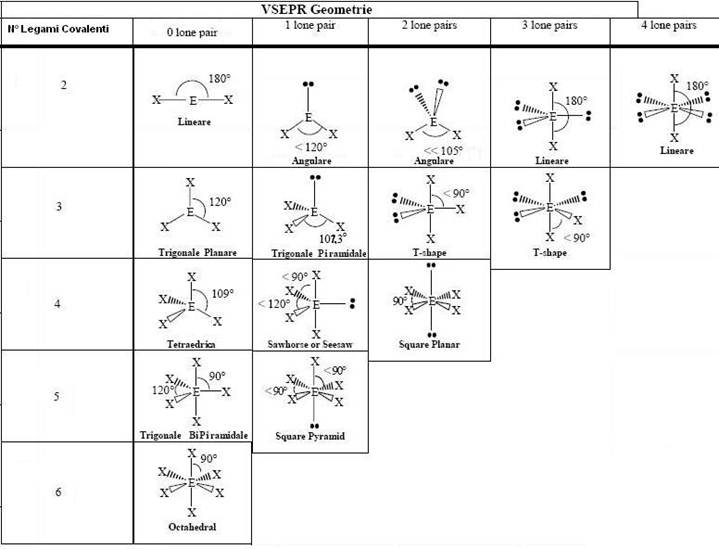
Le altre avranno le forme riportate in questa tabella ricordando che i lone pair sono le coppie di elettroni libere, ovvero che non fanno legami
Gli ibridi di risonanza sono quelle molecole che possono esser scritte in diversi modi come il SO2. Il SO2 ha il S al centro e esso forma un legame covalente singolo con un O e un legame covalente doppio con l’altro O. Questa molecola può essere scritta O = S – O oppure O – S = O. Queste molecole sono più stabili rispetto alle altre. Negli ibridi ammettiamo che la struttura reale della molecola è una delle due o più strutture.
Molecole polari, forze intermolecolari e classificazione dei solidi
La polarità di una molecola dipende dalla sua geometria cioè dalla disposizione nello spazio dei suoi legami. I casi in cui molecola può essere considerata non polare sono se non ci sono doppietti liberi e i legami sono dello stesso tipo. I solventi non polari tolgono molecole non polari. I solventi polari sciolgono molecole polari.
Le forze intermolecolari sono forze di attrazione più deboli dei legami covalenti e formano la materia condensata, solidi e liquidi. le forze dipolo-dipolo, sono interazioni deboli a corto raggio. Esse avvengono quando molecole polari si orientano in modo tale che l'estremità positiva si avvicina a quella negativa del dipolo adiacente. le forze di London avvengono nelle molecole non polari quando la carica può essere sbilanciata per alcuni istanti. Mentre le forze dipolo-dipolo sono permanenti, le forze di London sono temporanee.
Il legame idrogeno è un tipo d'interazione molecolare delle molecole d'acqua, esso da le particolari caratteristiche all'acqua; questo legame è dovuto alla maggiore elettronegatività dell'ossigeno rispetto all'idrogeno. Il legame idrogeno viene indicato con una linea tratteggiata e avviene solo se i tre atomi coinvolti O-H e O sono sulla stessa linea retta. Questa struttura consente all’acqua di stabilire legami con ioni di cristalli ionici.
Con il termine forza di un legame ci si riferisce all'energia occorrente per allontanare l'uno dall'altro di atomi legati. L'energia necessaria per 1 mol è di 96,5 kj/mol.
I solidi possono essere cristallini o amorfi. Nei solidi cristallini gli atomi sono disposti ordinatamente; negli amorfi prevale il disordine:
- I cristalli ionici sono solidi fragili costituiti da ioni aventi cariche opposte: La forza che mantiene uniti gli ioni è elettrostatica; la struttura cristallina assume un ordine tale da rendere massima l’attrazione e minima la repulsione. Basta una lieve deformazione per disturbare questo equilibrio e rompere il cristallo. I solidi ionici hanno un elevato punto di fusione e non conducono elettricità. Le loro soluzioni acquose conducono discretamente l’elettricità, mentre allo stato fuso sono ottimi conduttori.
- Nei solidi reticolari o cristalli covalenti una rete tridimensionale di legami covalenti unisce gli atomi in un enorme molecola. Questi solidi sono duri, hanno un elevato punto di fusione e non conducono elettricità.
- I cristalli molecolari non polari sono tenuti insieme dalle deboli forze di London. Essi diventano solidi a bassissime temperature, poiché anche la minima agitazione termica impedisce alle molecole di solidificare.
- I cristalli molecolari polari sono costituiti da molecole che si attraggono un legami dipolo-dipolo troppo legami idrogeno. I solidi hanno punti di fusione bassi e allo stato fuso non conducono elettricità.
- I cristalli metallici hanno una struttura cristallina mascherata dalla loro aspetto lucente. I metalli sono ottimi conduttori di calore e elettricità, sono opachi per questo se ridotti in polvere appaiono neri. Molti metalli come l’oro o il rame si sciolgono nel mercurio. La soluzione di metalli in mercurio è detta amalgama. Soluzioni di più metalli allo stato solido sono dette leghe
La mole e le reazioni chimiche
Trovare una bilancia che possa pesare un atomo è impossibile, per questo si ricorre alla misura relativa della massa dell’atomo. Il campione di riferimento della massa atomica o peso atomico (cosi si può trovare sella tabella periodica) è il carbonio 12. Il carbonio 12 è l’elemento che viene preso in considerazione per capire le altre masse. Avendo 12 particelle nel nucleo il carbonio ha massa atomica pari a 12 u (dalton), l’idrogeno ha 1 u e l’ossigeno 16 u. Per arrivare alla mole bisogna capire bene cosa sia la massa atomica poiché per trasformare la comune unità di misura della massa (grammi) in mole occorre conoscere come viene calcolata per ogni singolo elemento. Una mole (mol) è una quantità di sostanza che contiene un numero definito di particelle. Per arrivare dai grammi alle moli occorre dividere il peso in grammi per la massa atomica dell’elemento; es. 32 grammi di O sono uguali a 2 mol di O (32:16=2); 34 g di H2 sono 17 mol di H2 (34:2=17), in questo caso la massa atomica è 2 poiché abbiamo due atomi di idrogeno con massa atomica 1 uniti a formare una molecola unica, perciò 1X2=2. Ogni mole di qualsiasi elemento contiene lo stesso numero di particelle, indicate col numero 6,023 X 10²³ (chiamato numero di Avogadro). Una mole contiene sempre questo numero di particelle. Per arrivare ai grammi a partire dalle moli occorre moltiplicare la massa atomica per le moli; es. 3 mol di C sono 36 g, 2,5 mol di H2O sono 45 g (2,5 X (1+1+16) = 45). Per trovare il numero delle particelle occorre moltiplicare il numero delle moli per il numero di Avogadro.
Per rappresentare una reazione chimica occorre scrivere una equazione chimica del tipo H2 + O2 = H2O. I reagenti sono quelli scritti a sinistra, il prodotto è il risultato dell’equazione ovvero quello scritto a destra.
Però quest’equazione chimica ha qualcosa che non va poiché nel prodotto manca una molecola di ossigeno. Infatti questa equazione va bilanciata, cioè vanno variati i numeri delle unità (chiamati coefficienti stechiometrici) di ogni reagente e di ogni prodotto per ottenere un ugual numero di atomi nei reagenti e nei prodotti. In questo caso occorre fare 2H2 + O2 = 2H2O. In questo caso il doppio delle molecole di idrogeno reagiscono con le molecole di ossigeno in modo da dare molecole d’acqua. Dopo aver bilanciato una qualsiasi equazione si può passare ad eseguire i calcoli stechiometrici: si può trovare per ogni equazione il numero di grammi, di moli e di molecole servono per ogni elemento per ottenere una reazione chimica. Prendendo il caso dell’equazione: CH4 + O2 = CO2 + H2O. Innanzitutto occorre bilanciarla: CH4 + 2O2 = CO2 + 2H2O. Dopo troviamo i pesi atomici delle 4 molecole:
CH4 |
2O2 |
CO2 |
H2O |
Elementi |
12+1+1+1+1 = 16 |
16+16 = 32 |
12+16+16 = 44 |
1+1+16 = 18 |
Peso atomico |
48g |
192g |
132g |
108g |
Massa in g |
3 mol |
6 mol |
3 mol |
6 mol |
Moli |
3 X 6,023 X 10²³ |
6 X 6,023 X 10²³ |
3 X 6,023 X 10²³ |
6X6,023 X 10²³ |
N° di molecole |
Per trovare il peso atomico di ogni molecola occorre sommare i pesi atomici dei vari elementi.
Prendendo come esempio di avere 3 mol di CH4 si possono facilmente ricavare le moli degli altri elementi guardando i coefficienti stechiometrici.
Se abbiamo 3 mol di CH4 che ha coefficiente stechiometrico 1 avremo 3 moli per ogni elemento con coefficiente stechiometrico 1. Di conseguenza ogni elemento con coefficiente stechiometrico 2 avrà 6 mol, con coefficiente stechiometrico 3 avrà 9 mol e cosi via….occorre soltanto vedere quale rapporto c’è tra i coefficienti stechiometrici. Per arrivare ai grammi a partire dalle moli abbiamo già visto come fare: (3X16=48)(6X32=192)(3X44=132)(6X18=108).
Per verificare se i nostri calcoli sono giusti occorre sommare le masse in grammi dei reagenti e vedere se la somma è uguale alla somma delle masse in grammi dei prodotti (48+192=240, 132+108=240). A questo punto rimane soltanto da calcolare il n° delle molecole, moltiplicando le moli per il numero di Avogadro.
Se si ha il valore delle moli (se lo abbiamo in grammi basta prima trasformarlo) dei due reagenti dobbiamo verificare che non ci siano reagenti in difetto o in eccesso. Un reagente è in difetto quando è disponibile in quantità inferiore rispetto alla quantità imposta dalla reazione stechiometrica. Es: 2H2 + O2 = 2H2O, in questo caso supponiamo di avere 4 mol di idrogeno e 3 di ossigeno. In questo caso quelle di idrogeno dovrebbero essere il doppio di quelle d’ossigeno, ma non lo sono, poiché servirebbero 6 mol di idrogeno per reagire con 3 mol di ossigeno. In questo caso reagiscono solo 4 mol di H2 e 2 mol di O2, che è il reagente in eccesso.
Se la quantità del prodotto di una reazione (resa effettiva) non è pari a quello che dovremmo ottenere dalla determinata quantità di reagenti (resa teorica) significa che solo una parte dei reagenti hanno reagito. Per calcolare la percentuale dei reagenti che hanno reagito nella reazione (resa percentuale) occorre dividere la resa effettiva per la resa teorica e moltiplicare il tutto per 100 (RE/RT · 100). Es: se nella reazione considerate prima CH4 + O2 = CO2 + H2O nel risultato avremmo avuto (anziché 132g e 108g) come risultato 99g e 81g la resa sarebbe stata 99/132 · 100 = 75% 81/108 · 100 = 75%.
La termodinamica
I sistemi chimici sono costituita dai materiali (reagenti e prodotti) che partecipano alle trasformazioni fisiche e chimiche della materia. I sistemi possono essere aperti, chiusi o isolati. Un sistema si definisce aperto quando scambia con l’ambiente sia materia sia energia (come il nostro organismo). Un sistema si definisce chiuso quando scambiano con l’ambiente soltanto energia, ma non materia. Un sistema è invece isolato quando non ha alcun contatto con l’esterno e non scambiano con esso ne materia ne energia.
La parte della chimica che descrive il trasferimento di calore da un corpo all’altro è chiamata termochimica. Queste è una branca della termodinamica che invece si occupa di tutti i possibili trasferimenti di energia che interessano la materia. Tutte le reazioni chimiche sono accompagnate da una produzione a da un assorbimento di calore. . Le reazioni che avvengono producendo calore, e quindi trasferendo energia dal sistema all’ambiente, si chiamano esotermiche. Le reazioni endotermiche tutte quelle reazione che assorbono il calore dall’ambiente. Le reazioni esotermiche determinano un riscaldamento sia del sistema sia del suo ambiente. Mediante reazioni esotermiche si formano molecole stabili con legami forti. L’energia potenziale del sistema durante una reazione esotermica diminuisce e si produce calore, che fluisce verso l’ambiente.
Le reazione endotermiche portano ad un raffreddamento dell’ambiente circostante. In questo caso si formano molecole poco stabili e con legami deboli. L’energia potenziale del sistema aumenta a spese del calore assorbito dall’ambiente.
Il primo principio della termodinamica afferma che: “L’energia può essere convertita da una forma all’altra, ma non può essere né creata né distrutta”. Da ciò deriva che l’aumento o la diminuzione dell’energia di un sistema è uguale alla quantità di energia che esso riceve o cede medianti scambi di calore o di lavoro con l’ambiente. L’energia totale del sistema rimane dunque sempre costante. L’energia interna U è una grandezza estensiva (dipende dalla massa del corpo) uguale alla somma di energia cinetica (dovuta all’agitazione termica di tutto ciò che compone il sistema) e di energia potenziale (che dipenda dalle attrazioni tra cariche opposte). E’ possibile calcolare la variazione di energia interna mediante la seguente espressione: ∆U = Q + W (variazione di energia interna uguale calore + lavoro). Il calore sarà positivo se assorbito dal sistema, negativo se ceduto. Il lavoro sarà positivo se fatto sul sistema, negativo se fatto dal sistema. L’energia interna dei sistemi isolati rimane costante.
La combustione è una reazione tra un combustibile e un comburente, dalla quale si libera una quantità rilevante di energia. Il combustibile è di solito un composto contente carbonio o idrogeno, mentre il comburente è una sostanza contenente atomi di elementi a elevata elettronegatività. La combustione può essere effettuata in un recipiente chiuso, chiamato bomba calorimetria, in cui viene posto un eccesso di comburente (per esempio ossigeno). Il calore prodotto dalla combustione può essere misurato con un calorimetro. Il calore sviluppato è trasmesso ad una massa d’acqua contenuta in un calorimetro in cui è immerso il recipiente chiuso. La temperatura dell’acqua è registrata da un termometro. Dall’aumento di temperatura risaliamo al calore: Q=c·m·∆T (Calore = calore specifico calorifero X massa calorifero X aumento di temperatura).
Di solito l’energia è scambiata sotto forma di calore, ma ci sono processi in cui l’energia viene trasferita in altre forme, per esempio sotto forma di luce. Immaginiamo di far reagire un campione di magnesio metallico con l’ossigeno dell’aria: Questa reazione produce una grande quantità di calore e di luce. La somma delle energie chimiche dei reagenti è maggiore dell’energia chimica del prodotto ed il legame chimico nell’ossido di magnesio (il prodotto) è più forte di quello dei reagenti. Da ciò deduciamo che per produrre molta energia con una reazione, i reagenti devono possedere legami deboli e i prodotti devono avere, al contrario legami più forti. La variazione di energia interna U dipende dal numero di legami rotti nei reagenti e dal numero dei nuovi legami formati e dalla forza dei legami. A volte l’energia che deriva da un sistema chimico non si trasforma completamente in calore. Per esempio nel caso della formazione di prodotti di reazione gassosi, avviene un espansione. Durante questa espansione il sistema compirà un lavoro sull’ambiente pari a p∆V (la forza in questo caso si esprime come pressione per area e il lavoro diventa tale). Il calore che si sviluppa sarà: Q =- ∆(U+pV)
Poiché in laboratorio la maggior parte delle reazioni avviene a pressione costante, per tener conto del lavoro di espansione usiamo, più spesso dell’energia interna U, la funzione H = U + p · V, chiamata entalpia. Pertanto il calore assorbito dal calorimetro a pressione constante è: Q = -∆H, in cui la variazione di entalpia del sistema è uguale al calore ceduto o assorbito a pressione costante. Si indica con ∆Hº l’entalpia di formazione, ovvero la variazione di entalpia calcolata considerando gli elementi nella loro forma più stabile. L’unità di misura dell’entalpia è il joule. Quando la variazione di entalpia (che è una funzione termodinamica) è minore di zero si verifica emissione di calore e la reazione è esotermica. Se ∆H è maggiore di zero la reazione è endotermica e richiede energia, il sistema assorbe calore dall’esterno. L’entalpia è una funzione di stato. In termodinamica, una funzione di stato (o "quantità di stato") è una proprietà di un sistema che dipende solamente dallo stato iniziale e finale, e non dal particolare cammino seguito per arrivarvi. Un tempo si pensava che solo le reazione esotermiche fossero spontanee. Ma tutt’oggi si conosco un gran numero di reazioni endotermiche e spontanee. In queste reazioni infatti l’entalpia è positiva.
I fenomeni spontanei hanno un’importante caratteristica: si verificano senza interventi esterni. In base al secondo principio della termodinamica, l’energia tende a defluire spontaneamente dai corpi caldi a quelli freddi. Ma perché questo procedimento avviene solo in un verso e non nell’altro? Le ragione possono essere comprese osservando che nelle trasformazioni spontanee si verifica un aumento del disordine, cioè una dispersione di energia e materia. L’energia durante una reazione si conserva ma è distribuita in maniera diversa. Il livello di dispersione dell’energia, cioè di disordine di un sistema, può essere espresso per mezzo di una grandezza che chiamiamo entropia, che indichiamo con S e misuriamo in J\K. L’entropia in un certo istante è uguale a: S = K ln W (in cui K è la costante di Bolzmann(1,38 X 10 alla meno 23), ln è il logaritmo naturale, e W è numero totale delle configurazioni che il sistema può assumere).
La variazione di entropia si esprime con: ∆S = -∆H \ T. (Variazione di entropia = - quantità di calore liberato dal sistema a pressione costante fratto temperatura). In generale, lo stato liquido ha maggiore entropia dello stato solido, e lo stato gassoso ha entropia ancora più alta di quello liquido. Poiché gli stati più probabili sono quelli ad entropia maggiore, i processi spontanei saranno caratterizzati da ∆S > 0. Di solito otteniamo una maggiore entropia con la trasformazione di molecole complesse in molecole più piccole.
Abbiamo incontrato due grandezze che indicano la direzione in cui una reazione è spontanea: l’entalpia e l’entropia. La trasformazione dei reagenti nei prodotto tende:
- a rafforzare i legami (∆h<0)
- verso un maggiore disordine (∆S>0)
L’energia libera ingloba sia l’entalpia che l’entropia serve per prevedere la spontaneità di una reazione chimica; G = ∆H - T∆S. Energia libera = variazione di entalpia – temperatura per variazione di entropia.
L’unità di misura dell’energia libera è kJ/mol. Ogni reazione chimica può avvenire in due possibili direzioni. La direzione in cui la trasformazione avviene spontaneamente è solo quella in cui abbiamo ∆G<0. Con il concetto di energia libera, le reazione endotermiche spontanee risultano comprensibili L’aumento dell’energia dei legami (∆H>0)è compensata da un valore alto di T∆S, tale che il ∆G sia minore di 0.
Le soluzioni
Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Le soluzioni sono formate da un solvente, che è il componente della soluzione che scioglie (di solito si trova in quantità maggiore), e dal soluto, che è la cosa che viene sciolta (di solito si trova in quantità minore). La soluzione assume sempre la fase del solvente (esempio acqua liquida + sale solido = acqua e sale liquido). Nella formazione di una soluzione, le molecole di solvente circondano quelle di soluto. Tale fenomeno è detto solvatazione; quando il solvente è l’acqua la solvatazione è detta idratazione. Nelle soluzioni i legami tra le molecole del soluto e tra le molecole del solvente si rompono e se ne creano di nuovi: per questo non sempre il soluto si mescola con il solvente. Gli ioni che si originano dalla dissociazione d una molecola in acqua si dispongono in modo da rivolgere la loro carica verso quella di carica opposta della molecola d’acqua. In questo stato gli ioni si definiscono idratati. Tutti i composti che in soluzione acquosa formano ioni sono detti elettroliti. Le soluzioni di elettroliti conducono sempre corrente elettrica.
Le soluzioni che contengono una piccola quantità di soluto sono dette diluite, mentre quelle con elevate quantità di soluto sono dette concentrate. Per trovare la concentrazione percentuale in massa occorre dividere la massa del soluto per quella della soluzione e moltiplicare per 100. Per trovare la concentrazione percentuale in massa su volume occorre dividere la massa del soluto per il volume della soluzione e moltiplicare per 100. Per trovare la concentrazione percentuale in volume occorre dividere il volume del soluto per quello della soluzione e moltiplicare per 100.
La molarità di una soluzione è data dal rapporto tra il numero delle moli di soluto e il volume della soluzione espresso il litri. M = n° moli soluto/V soluzione. La molarità si esprime in moli/l e si usa il simbolo M per rappresentarla. La molarità è un’unità di misura della concentrazione che dipende dalla temperatura; al variare di essa dipende la variazione di volume. La molalità è data dal rapporto tra il numero di moli di soluto e la massa del solvente, espressa in chilogrammi. m = n° moli soluto/m solvente. La molalità si esprime in mol/kg. La molalità è indipendente dalla temperatura in quando essa non influenza la massa del solvente.
La soluzione porta anche all’abbassamento delle tensione di vapore (ovvero la pressione parziale del suo vapore a cui si verifica l'equilibrio fra la fase liquida e la fase gassosa), questo è dovuto al fatto che le molecole di solvente vengono trattenute dalle molecole di soluto grazie a legami che si formano in soluzione: questo porta alle proprietà colligative: esse sono l’innalzamento ebullioscopico, l’abbassamento crioscopico e la pressione osmotica.
Le proprietà colligative non dipendono dal numero di particelle di soluto e dalla natura del solvente, ma dalla qualità del soluto. Le molecole in una soluzione si attraggono in modo più forte tra loro e anche a causa della solvatazione fanno si che le molecole di solvente abbiano bisogno di più energia per sfuggire dalla soluzione e diventare vapore o diventare solidi. Per calcolare l’innalzamento ebullioscopico bisogna usare questa formula: Δ Teb = Keb · m · i; variazione di temperatura = costante ebullioscopica molale del solvente per molalità per coefficiente di Van't Hoff. Il coefficiente di Van't Hoff si trova solo in caso di elettroliti forti ovvero quando il soluto si scioglie nella soluzione e forma varie particelle. Il coefficiente di Van't Hoff misura il numero di particelle che si liberano da un soluto che si scioglie (Es: NaCl diventa Na + Cl, per questo i assume valore 2; (NH4)3PO4 diventa NH4 + NH4 + NH4 + PO4 perciò i ha valore 4). Per calcolare l’abbassamento crioscopico si segue la formula: Δ Tc = Kc · m · i; ; variazione di temperatura = costante crioscopica molale del solvente per molalità per coefficiente di Van't Hoff.
La velocità di solubilizzazione dipende dalla superficie di contatto del solido con il solvente. Se aumenta la superficie, cresce la velocità. La solubilità del soluto nel liquido non è illimitata. Ad un certo punto il soluto non si scioglie più e la soluzione è detta satura; il soluto che non si è sciolto rimane come corpo di fondo se si tratta di un solido. Tuttavia lo scambio di particelle tra la soluzione e il soluto restante non cessa e quando il numero di particelle che passa dal soluto non sciolto alla soluzione è uguale a quello che fa il percorso inverso abbiamo una soluzione satura e vi è equilibrio dinamico tra soluto non sciolto e soluto sciolto. La solubilità di una sostanza è la massa che a una data temperatura si scioglie in 100 g di solvente formando una soluzione satura. La solubilità dipende dalla sostanza, dalla temperatura e dalla natura del solvente e soluto.
La solubilità nei liquidi e nei solidi aumenta con l’aumentare della temperatura ed è quindi direttamente proporzionale alla temperatura. Nei gas la solubilità è inversamente proporzionale alla temperatura (all’aumentare della temperatura diminuisce la solubilità) e dipende dalla pressione come descritto nella legge di Henry.
Come gia sappiamo l’osmosi è un processo di diffusione che interessa le soluzioni separate da una membrana semipermeabile che permette il passaggio del solvente verso la soluzione più concentrata. La pressione osmotica rappresenta la pressione idrostatica che bisogna esercitare su una soluzione, separata da un'altra soluzione da una membrana semipermeabile, perché in essa non entri altro solvente. Nelle soluzioni ideali la pressione osmotica si trova con l’equazione di Van't Hoff. π = M · R · T dove π è la pressione osmotica, V il volume della soluzione, T la temperatura e R una costante che ha lo stesso valore della costante dei gas (0,0821 atm l/mol K).Le soluzioni che presentano uguale concentrazione e uguale pressione osmotica sono dette isotoniche. Se 2 soluzioni hanno una concentrazione e una pressione osmotica diverse allora quella con concentrazione minore è detta ipotonica e quella con concentrazione maggiore ipertonica.
La velocità di reazione
La velocità di reazione è la variazione di concentrazione molare del prodotto o di reagente nell’intervallo di tempo Δt v = Δ[P]/Δt o – Δ[R]/Δt.
La velocità di reazione è una grandezza intensiva, cioè non dipende dalla massa del sistema. Le parentesi quadre indicano le concentrazioni molari. Durante una reazione chimica la velocità di reazione non è costante, di solito è più alta all’inizio e diminuisce alla fine. La velocità di reazione può essere espressa anche con la seguente equazione v = k[A]n · [B]m dove A e B sono i reagenti e m e n sono dei valori determinabili solo sperimentalmente. La costante k è una costante cinetica che dipende dalla temperatura che si misura in L/mol · s. La velocità di reazione si misura in mol/L · s. Il valore degli esponenti n e m permette di stabilire l’ordine della reazione che è uguale alla somma di m e n. Esistono reazione di primo ordine (se n + m = 1) di secondo ordine e di ordine zero cui la velocità è indipendente dalla concentrazione del reagente e è costante.
Perché avvenga una reazione devono verificarsi tre condizioni:
- Che si verifichi un certo numero di urti tra le molecole
- Che le collisioni avvengano con una orientazione apposita
- Che l’energia sia sufficiente a effettuare la trasformazione
L’energia minima che occorre per iniziare una reazione è chiamata energia di attivazione. Lo stato di transizione è una fase intermedia della reazione, in cui i legami tra i reagenti si stanno rompendo e si stanno formando quelli tra i prodotti. A questo stadio corrisponde la formazione di un composto chiamato complesso attivato che ha un contenuto energetico elevato ed è instabile e si trasforma subito nel prodotto della reazione. L’energia di attivazione è la differenza tra l’energia del complesso attivato e quella dei reagenti. Il dislivello energetico tra i reagenti e i prodotti corrisponde alla variazione di entalpia.
La molecolarità di una reazione elementare indica il numero delle molecole reagenti che vi partecipano.
I catalizzatori sono le sostanze che accelerano una reazione chimica riducendo l’energia di attivazione, senza consumarsi durante la trasformazione. I catalizzatori omogenei operano nella stessa fase dei reagenti e dei prodotti e catalizzatori eterogenei che operano in una fase diversa da quella dei reagenti e dei prodotti. I catalizzatori sono altamente specifici cioè accelerano solo un tipo di reazione. I catalizzatori più conosciuti sono gli enzimi del corpo umano.
L’equilibrio chimico
Un sistema è in equilibrio dinamico quando le velocità delle trasformazioni opposte sono uguali. L’equilibrio. Le situazione di equilibrio dinamico non sono frequenti in natura poiché esse richiedono sistemi chiusi. In realtà, nel mondo infinitamente piccole degli atomi, le trasformazioni diretta e inversa avvengono in continuazione con velocità identiche. Questo avviene perché in laboratorio le reazioni chimiche avvengono spesso in sistemi che possiamo considerare chiusi. Durante una trasformazione chimica, i reagenti reagiscono per formare i prodotti. Una volta formati i prodotti, essi iniziano a reagire tra di loro per dare di nuovo i reagenti. Dopo poco tempo la velocità della reazione di formazioni dei reagenti diventerà uguale alla velocità di formazione dei prodotti. La reazione ha raggiunto l’equilibrio. All’equilibrio chimico le concentrazioni dei reagenti e dei prodotti non variano nel tempo. Ecco perché indichiamo l’equilibrio con la doppia freccia. Le due frecce hanno la stessa lunghezza per indicare che le reazioni diretta e inversa avvengono, all’equilibrio, con uguale velocità. In un sistema all’equilibrio sono presenti contemporaneamente tutti i reagenti e i prodotti a concentrazioni costanti.
Nel 1864 due studiosi norvegesi notarono che all’equilibrioesisteva un rapporto costante tra le concentrazioni dei prodotti e quelle dei reagenti, elevate al loro coefficiente stechiometrico. Questa costante prende il nome di costante di equilibrio (Keq). Questa scoperta ha portato alla formulazione della legge dell’equilibrio chimico, nota come legge dell’azione di massa, che per una generica reazione si traduce nell’espressione: Si arriva a questa espressione partendo dal principio dell’equilibrio chimico che dice che la velcoità di reazione diretta = velocità di reazione inversa. Sapendo che la velocità di reazione diretta è Kdir (costante cinetica della velocità di reazione diretta) [A]a[B]b e la velocità di reazione inversa è Kinv (costante cinetica della velocità di reazione inversa) [C]c[D]d possiamo dire che all’equilibrio Kdir [A]a[B]b = Kinv [C]c[D]d. Possiamo inoltre mettere in relazione le due costanti:
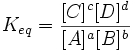 Data una generica reazione chimica all'equilibrio
Data una generica reazione chimica all'equilibrio
 cC + dD
cC + dD
L’enunciato della legge di azione di massa è il seguente:
In un sistema chimico in equilibrio, a una data temperatura e a una data pressione, il rapporto tra il prodotto delle concentrazioni molari dei prodotti e il prodotto delle concentrazioni molari dei reagenti, elevate ciascuna al proprio coefficiente stechiometrico, è costante. La grandezza della costante di equilibrio ci fornisce un’indicazione diretta di quanto la reazione sia spostata verso la formazione dei prodotti, una volta che l’equilibrio è stata raggiunto. Infatti se la costante è molto grande, significa che la concentrazioni dei prodotti è molto maggiore di quella dei reagenti e che la reazione è quasi giunta a completamento. Al contrario se la costante è piccola significa che si sono formati pochissimi prodotti e che la reazione si è arrestata. Dunque se Keq è molto grande l’equilibrio è spostato a destra, quando tende ad 1 le concentrazioni dei reagenti e dei prodotti sono praticamente uguali, quando è molto piccolo l’equilibrio è spostato a sinistra. Bisogna ricordare che ciascuna reazione ha una propria Keq, che è una costante senza dimensioni. Il quoziente di reazione è analogo alle costante di equilibrio; non lo calcoliamo però quando la reazione ha raggiunto l’equilibrio.
Il valore della costante d’equilibrio Keq varia con la temperatura; per ogni temperatura esistono all’equilibrio un diverso valore di Keq e diverse concentrazioni di reagenti e prodotti. Nelle reazioni esotermiche (che rilasciano calore) la costante d’equilibrio Keq diminuisce all’aumentare della tempreratura. Nelle reazioni endotermiche, invece, Keq aumenta all’aumentare della temperatura. Ciò avviene perché se io sottraggo del calore ad una reazione esotermica, il sistema cerca di contrastare la mia azione, producendo calore (fornendo calore la reazione tornerà indietro). Il contrario avviene invece per una reazione endotermica.
L’equilibrio è governato da un ridotto numero di fattori: volume, pressione, concentrazione e temperatura. Il principio di Le Chatelier (o principio dell’equilibrio mobile) ci serve per capire come risponde l’equilibrio se viene turbato da questi fattori. Il principio può essere enunciato nel seguente modo:
Un sistema all’equilibrio, perturbato da un’azione esterna, reagisce in modo da ridurne o annullarne l’effetto, ristabilendo l’equilibrio.
Aggiungendo per esempio un reagente a un sistema all’equilibrio, l’equilibrio si sposta nella direzione che consente la scomparsa di una parte del reagente aggiunto e la formazione del prodotto. Ad esempio, se aumentiamo la concentrazione del reagente, per ristabilire l’equilibrio una parte delle molecole aggiunte si trasformerà in prodotto e l’equilibrio si sposterà a destra.
Le variazioni di pressione e di volume possono condizionare le reazioni i cui componenti sono in fase gassosa, purché la reazione comporti variazioni nel numero di moli di sostanze gassose. L’aumento di pressione di un sistema gassoso all’equilibrio comporta lo spostamento dell’equilibrio nella direzione in cui è presente il numero minore di molecole. Viceversa se aumentiamo il volume (diminuiamo quindi la pressione) favoriamo lo spostamento dell’equilibrio nella direzione in cui è presente il numero maggiore di molecole.
Finora abbiamo considerato reazioni in cui prodotti e reagenti erano nella medesima fase. Cosa succede quando uno dei componenti è in una fase diversa? Quando si sciolgo il sale in acqua, i suoi ioni si disperdono nell’acqua. Si passa quindi spontaneamente da uno stato iniziale di ordine ad uno di disordine, la soluzione. Quando un solido ha raggiunto la massima solubilità consentita dalla propria natura, d non può sciogliersi ulteriormente e rimane come corpo di fondo. La concentrazione di tale soluzione, detta soluzione satura, non varia più, poiché è in equilibrio dinamico con il corpo di fondo. Questo fenomeno è proprio dei composti poco solubili ed è regolato dalle leggi dell’equilibrio chimico di cui abbiamo parlato. Si tratta comunque di un equilibrio eterogeneo. La concentrazione del corpo di fondo, che rimane costante, viene inglobata della Keq, e resta pertanto solo la relazione tra le specie a concetrazione variabile. Tale reazione è’ costante e viene chiamata prodotti di solubilità (Kps). Kps è dunque uguale a Keq x costante. Da questa espressione ricaviamo che nei sistemi eterogenei il valore della costante di equilibrio è indipendente dalla quantità di solidi. Aggiungendo tali componenti, quindi, l’equilibrio non viene modificato.
Acidi e basi
Secondo la teoria di Arrhenius gli acidi sono sostanze che in acqua liberano ioni H+; le basi sono sostanze che in acqua liberano ioni OH-.
Nella reazione HCl + H2O = H3O+ + Cl-:
HCl è l’acido che in acqua libera ioni H+ che sono dei protoni, la cui carica è cosi concentrata che si attacca alla molecola d’acqua formano lo ione idronio H3O.
Nelle reazione basiche come NH3 + H2O = NH4+ + OH-:
NH3 è la base che in acqua libera OH- ovvero lo ione idrossido.
La teoria di Arrhenius aveva un punto debole: la sua applicabilità è limitata alle soluzioni acquose, allora Bronsted e Lowry proposero una nuova definizione di acido e base: Qualsiasi molecola o ione che può donare un protone è un acido, qualsiasi molecola o ione che può accettare un protone è una base. L’acido agisce da donatore solo in presenza di una sostanza che accetti il protone, cioè di una base. Ci deve essere sempre una reazione di trasferimento del protone, affinché possano manifestarsi le proprietà acide e basiche delle sostanze. Un donatore di protoni è quindi una qualsiasi sostanza che possieda atomi di idrogeno legati covalentemente d altri atomi più elettronegativi. Nella reazione ogni acido perdendo il protone diventa una base coniugata. La base acquistando il protone diventa un acido coniugato.
HCl + H2O = H3O+ + Cl-
HCl è l’acido e H2O la base, mentre H3O+ è l’acido coniugato di H2O e Cl- è la base coniugata di HCl.
NH3 + H2O = NH4+ + OH-
NH3 è la base, mentre H2O è l’acido; NH4+ è l’acido coniugato di NH3 e OH- è la base coniugata dell’acqua.
Come abbiamo visto l’acqua può assumere la funzione di base e quella di acido a seconda della sostanza, per questo l’acqua viene considerata una sostanza anfotera.
L’acqua pure è un elettrolita debole e un cattivo conduttore ci elettricità, questo perché Keq dell’acqua pura è molto bassa e quindi poche molecole d’acqua si dividono in ioni H+ e OH-.
A 25° Keq dell’acqua pura è 1,8 · 10-16 e la concentrazione molare dell’acqua non ionizzata [H2O] è 55,4 M. Possiamo quindi arrivare al prodotto ionico dell’acqua, Kw, che si trova Keq · [H2O] = [H+] · [OH-]. Perciò il prodotto della concentrazione molare degli ioni idrogeno e idrossido a 25° è sempre 1,8 · 10-16 · 55,4 = 10-14.
Quando la soluzione è neutra [H+] = [OH-] = 10-7, quando [H+] > [OH-] la soluzione sarà acida e quando [H+] < [OH-] la soluzione è basica. [H+] = [OH-] sono in perenne altalena, all’aumentare dell’uno diminuisce l’altro e il loro prodotto è sempre 10-14.
Il pH esprime la concentrazione di ioni idrogeno presenti in soluzione. La p sta per – log infatti la formula per trovare il pH = - log [H+]. Se il pH è minore di 7 la soluzione è acida, se il pH è maggiore di 7 la soluzione è basica, se è uguale a 7 la soluzione è neutra. Il pOH esprime la concentrazione di ioni idrossido presenti in soluzione pOH = - log [OH-]. Se il pOH è minore di 7 la soluzione è basica, se il pOH è maggiore di 7 la soluzione è acida, se è uguale a 7 la soluzione è neutra. La somma tra il pH e il pOH di una stessa soluzione è semrpe uguale a 14. pH + pOH = 14. Per calcolare il pH o pOH di una sostanza diversa dallo ione idrogeno o ione idrossido dobbiamo vedere quanti ioni H o OH ci sono nella molecola e moltiplicare quel numero per la concentrazione molare della molecola. Es: KOH ha un solo gruppo OH è quindi la molarità va moltiplicata per 1 prima di essere usata per trovare il pOH. H2SO4 ha due H perciò la molarità della molecola va moltiplicata per 2 prima di essere usata per trovare il pH.
Gli acidi e le basi possono essere definiti forti o deboli. Gli acidi e le basi forti sono quelle che in acqua sono completamente dissociati o ionizzati. Se una base è forte il suo acido coniugato è debole, se un acido è forte la sua base coniugata sarà debole e viceversa. Per calcolare il pH occorre utilizzare la formula sopra descritta.
Gli acidi e le basi deboli non sono completamente dissociati e all’equilibrio avranno una Ka (costante di dissociazione acida) o Kb (costante di dissociazione basica), a seconda se siano acidi o basi, molto bassa. Per calcolare il pH partendo dalla concentrazione molare del reagente dobbiamo usare la legge dell’azione di massa.
In una reazione A = C + D dobbiamo usare la seguente formula inserendo la Ka o Kb a seconda se siano acidi o basi Ka o Kb = [C] · [D]/[A]. Partendo dalla costante (che nei problemi abbiamo sempre come dato) e dalla molarità del reagente [A]. Dobbiamo porre la nostra incognita [C]. Sapendo che [C] = [D] scriviamo Ka = X · X/[A] da cui ricaviamo che X² = Ka · [A], ovvero X = (radice di) Ka · [A]. Una volta trovata X usiamo la formula del pH. pH = - log X ovvero pH = - log [C].
Per la misura precisa del pH possiamo usare degli strumenti detti pH-metri, oppure delle sostanze che cambiano colore a seconda del pH della soluzione dette indicatori.
Una reazione tra un acido e una base è detta reazione di neutralizzazione, perché produce acqua + un sale + calore e neutralizza il ph della soluzione facendolo tornare a 7 (solo se abbiamo parti quantità di acido e di basi). La reazione ha per protagonisti gli ioni H+ e OH- che si trasformano in acqua, mentre gli altri ioni detti spettatori si trasformano in sale. Con la titolazione possiamo scoprire la quantità precisa di un acido o di una base in una soluzione sconosciuta. Nel caso si una soluzione acida possiamo aggiungere goccia a goccia una soluzione basica fino a quando il pH della nostra soluzione torna ad essere 7
La nomenclatura degli acidi, delle basi e dei sali
Gli acidi si dividono in Idracidi e Ossiacidi:
 Gli idracidi sono composti da un elemento che si trova a destra della tabella periodica e dall’idrogeno. Se abbiamo un elemento del VII gruppo avremo 1 idrogeno, se del VI gruppo due idrogeni. Gli idracidi finiscono in –idrico
Gli idracidi sono composti da un elemento che si trova a destra della tabella periodica e dall’idrogeno. Se abbiamo un elemento del VII gruppo avremo 1 idrogeno, se del VI gruppo due idrogeni. Gli idracidi finiscono in –idrico

Gli ossiacidi contengono l’ossigeno che si lega con legami dativi. Ogni acido può assumere diverso nomi a seconda di quanti O ha nella molecola.
Per esempio HCl può diventare:
- HClO: l’elemento con meno O ha come prefisso ipo- e termina con -oroso: acido ipocloroso
- HClO2: il primo dei due elementi centrali ha come suffisso -oroso: acido cloroso
- HClO3: il secondo dei due elementi centrali ha come suffisso -orico: acido clorico
- HClO4: l’elemento con più ossigeni ha come prefisso per- e termina con –orico: acido perclorico
Se abbiamo solo due tipi di ossiacidi per ogni molecola si prenderanno solo i nomi contrali, ovvero la terminazione in –oroso e –orico come nel caso di H2SO3 e H2SO4:
Per quanto riguarda le basi inseriremo la parola idrossido prima del composto: le basi sono formate da elementi a sinistra della tabella periodica con l’aggiunta di OH a seconda del gruppo in cui si trovano: se si trovano nel I gruppo avremo un OH se si trovano nel secondo gruppo due OH. Il ferro si trova tra i metalli di transizione e ha tre OH.
Fe(OH)3: idrossido di ferro
LiOH: idrossido di litio
NaOH: idrossido di sodio
KOH: idrossido di potassio
Mg(OH)2: idrossido di magnesio

Ca(OH)2: idrossido di calcio
I sali che derivano dalle reazioni di neutralizzazione prendono il nome a seconda dell’acido presente:
- se l’acido finisce in –idrico, il sale termina in –uro
- se l’acido termina in –ico, il sale ha suffisso –ato
- se l’acido finisce in -oso, il sale termina in –ito.
 Es: NaCl: cloruro di sodio deriva da HCl ovvero acido cloridrico
Es: NaCl: cloruro di sodio deriva da HCl ovvero acido cloridrico
Idrolisi e sistemi tampone
E’ possibile cambiare il pH di una soluzione senza usare acidi o basi, ma solo usando un sale. Quando il sale è sciolto in acqua cationi e anioni si trovano in libertà e sono circondati da numerosissime molecole d’acqua. Alcuni sali, ovvero quelli formati da acidi e basi forti non reagiscono con H2O e non fanno cambiare il pH e vengono detti ioni spettatori. Invece tutti gli anioni e i cationi provenienti da acidi e basi deboli reagiscono con l’acqua e si comportano rispettivamente da basi e da acidi. Il sale che contiene l’anione che è la base coniugata di un acido debole forma soluzioni basiche. Il sale formato da un catione che è l’acido coniugato di una base debole produce soluzioni acide.
Le soluzioni tampone servono per frenare le rapide variazioni del pH dell’acqua. Le soluzioni tampone contengono un acido e la sua base coniugata in concentrazioni pressoché uguali. La coppia coniugata della soluzione tampone è formata in genere da un acido debole e da un sale solubile dell’acido che rappresenta la fonte della base coniugata forte, oppure da una base debole e da un suo sale che fornisce l’acido coniugato forte. Per calcolare il pH di una soluzione tampone: partiamo da Ka = [H+] · [anione]/[acido] il pH sarà pH = - log Ka + log [anione]/[acido]
Le reazioni di ossido-riduzione
La valenza rappresenta il numero di elettroni che un atomo di un elemento acquista cede o mette in comune quando si lega con altri atomi. Il numero di ossidazione rappresenta la carica formale che viene attribuita a un atomo all’interno di una molecola assegnando gli elettroni di legame all’atomo più elettronegativo. Viene assegnato un numero che può essere negativo nelle riduzioni, ovvero con l’acquisto di uno o più elettroni o positivo nelle ossidazioni, ovvero con la perdita degli elettroni, oppure uguale a 0.
Esistono 5 regole per assegnare il numero di ossidazione; tutte si basano sul presupposto di considerare qualunque atomo come se fosse uno ione; per applicarle correttamente dobbiamo ricordare che esiste una gerarchia e che in caso di contrasto, prevale sempre la regola col numero più basso. Le regole sono:
- Allo stato elementare tutti gli atomi hanno numero di ossidazione 0. Ovvero i singoli atomi o le molecole composte da atomi dello stesso tipo. P4, H2, Zn.
- La somma dei numeri di ossidazione di tutti gli atomi di un composto dev’essere uguale a zero (per le molecole neutre) o uguale alla carica complessiva dello ione (nel caso di ioni poliatomici). In H2o la somma dei n.o. (numeri di ossidazione) è uguale a 0. In SO42- la somma da come risultato -2.
- Gli ioni monoatomici hanno numero di ossidazione uguale alla loro carica. Cl- ha n.o. -1
- In un legame covalente si attribuiscono formalmente i due elettroni di legame all’atomo più elettronegativo
- In tutti i composti (tranne gli idruri metallici) l’idrogeno ha sempre n.o. +1.
- In tutti i composti (tranne i perossidi e OF2 ) l’ossigeno ha sempre n.o. -2.
- Gli elementi del I gruppo hanno +1, quelli del II gruppo hanno +2 e quelli del IV gruppo hanno -1
Nelle reazioni di ossidazione il numero di ossidazione aumenta, nelle riduzioni diminuisce.
Nella reazione 2Mg + O2 = 2MgO, sappiamo che per la regola 1 sia Mg che O2 hanno numero di ossidazione 0, ma in MgO l’ossigeno ha n.o. -2 (per la regola 6) e di conseguenza il magnesio deve avere +2 (regola 7). Il Mg si è ossidato, ha perso elettroni e l’ossigeno si è ridotto, ha acquistato elettroni. Nella reazione il Mg ha perso 4 elettroni poiché è passato da 0 a -2 e avendo il coefficiente stechiometrico 2 va tutto raddoppiato. Possiamo affermare che: i n.o. variano durante le ossido-riduzioni e le reazioni di ossidazione e di riduzione avvengono contemporaneamente. L’ossidante è colui che si riduce e che ossida il “partner”, il riducente è colui che si ossida e riduce altre sostanze. La determinazione dei coefficienti nelle reazioni redox (abbreviazione per ossido-riduzione dall’inglese reduction/oxidation reaction) non è facile per questi ricorriamo al metodo ionico elettronico. Le reazioni redox possono avvenire in ambiente acido o in ambiente basico. Prendiamo per esempio la reazione NO3- + Zn = Zn2+ + N2O. Separiamo la reazione per vedere le ossido riduzioni: NO3- = N2O e Zn = Zn2+. Per prima cosa bilanciamo gli atomi e successivamente scrivamo i numeri di ossidazione. 2NO3- = N2O. Per trovare il numero di ossidazione dobbiamo prendere in considerazione le regole soprascritte. Sappiamo che l’ossigeno ha -2. Essendo O3 avremo -6, e per bilanciarlo l’N deve essere +5 poiché NO3- è uno ione negativo che deve avere come risultato dei n.o. -1 in quanto ha 1 meno. In N2O l’ossigeno ha -2 e ogni N ha +1. Perciò l’azoto si è ossidato in quanto ha perso 4 elettroni per ogni atomo. Essendo 2 atomi si perdono 8 elettroni, possiamo scrivere quindi NO3- + 8e = N2O. Per quanto riguarda lo zinco Zn = Zn2+ il primo Zn ha n.o. 0 (regola 1) e il secondo +2 (è uno ione con 2+), perciò si è ridotto e possiamo scrivere Zn = Zn2+ + 2e.
Dobbiamo adesso bilanciare il numero di elettroni persi e acquistati tra le due semireazioni moltiplicando per 4 la reazione Zn = Zn2+ + 2e: 4(Zn = Zn2+ + 2e) = 4Zn = 4Zn2+ + 8e.
Adesso possiamo scrivere la reazione 2NO3- + 4Zn = 4Zn2+ + N2O e dobbiamo bilanciare le cariche. Ci sono 2 cariche negative nella prima parte della reazione (2NO3-) e 8 cariche positive nella seconda (4Zn2+). Per bilanciare le cariche dobbiamo aggiungere H+ o OH- a seconda se stiamo in ambiente acido o basico. In questo caso siamo in ambiente acido e dobbiamo aggiungere H+. In questo caso dobbiamo aggiungere 10H+ ai reagenti poiché occorre bilanciare le 8 cariche positive con le 2 negative dei reagenti(-2 + 10 = +8). 2NO3- + 4Zn + 10H+ = 4Zn2+ + N2O
Dopo aver aggiunto gli H+ o gli OH- dobbiamo bilanciare gli elementi come facevamo prima e potremmo avere degli O o degli H in più. Per bilanciare le cose aggiungiamo dell’acqua (H20) dove occorre.
2NO3- + 4Zn + 10H+ = 4Zn2+ + N2O + 5H2O
Alla fine controlliamo se il bilanciamento degli elementi è corretta e se è giusto abbiamo finito.
Autore del testo: Autore: Federico Ferranti
Fonte:
http://www.riassuntiliceo.altervista.org/quartof/chi1.doc
http://www.riassuntiliceo.altervista.org/quartof/chi2.doc
http://www.riassuntiliceo.altervista.org/quartof/chi3.doc
http://www.riassuntiliceo.altervista.org/quartof/chi4.doc
http://www.riassuntiliceo.altervista.org/quartof/chi5.doc
http://www.riassuntiliceo.altervista.org/quartof/chi6.doc
http://www.riassuntiliceo.altervista.org/quartof/chi7.doc
http://www.riassuntiliceo.altervista.org/quartof/chi8.doc
http://www.riassuntiliceo.altervista.org/quartof/chi9.doc
http://www.riassuntiliceo.altervista.org/quartof/chi10.doc
http://www.riassuntiliceo.altervista.org/quartof/chi11.doc
http://www.riassuntiliceo.altervista.org/quartof/chi12.doc
http://www.riassuntiliceo.altervista.org/quartof/chi13.doc
http://www.riassuntiliceo.altervista.org/quartof/chi14.doc
http://www.riassuntiliceo.altervista.org/quartof/chi15.doc
http://www.riassuntiliceo.altervista.org/quartof/chi16.doc
Chimica riassunti
Visita la nostra pagina principale
Chimica riassunti
Termini d' uso e privacy