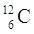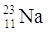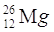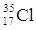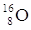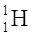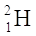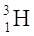Atomo definizione
Atomo definizione
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
L’ATOMO
L’atomo è la parte più piccola di un elemento.
L’atomo è formato da un nucleo. Il nucleo è quella parte che si trova al centro dell’atomo.
Il nucleo è formato da protoni e neutroni.
Attorno al nucleo ruotano, cioè girano, gli elettroni.
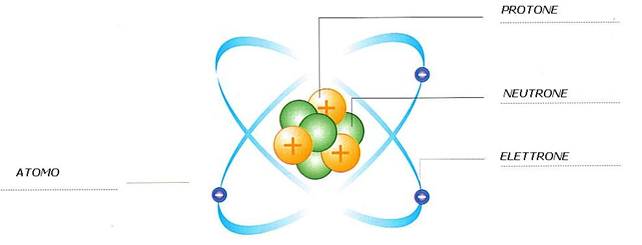
Il numero atomico è il numero dei protoni che ci sono in un atomo, ma è anche il numero degli elettroni che girano attorno ad un atomo.
Se un atomo ha numero atomico 2 significa che ha 2 protoni e 2 elettroni.

fonte: http://www.italianoperlostudio.it/upload/documenti/ATOMO.doc
-
DIDATTIZZAZIONE e SEMPLIFICAZIONE a cura di: Linda Cammarata
-
CONTENUTO NOZIONISTICO a cura di: Prof. Claudio Rosi
ATOMO
MODELLI ATOMICI:
Il termine atomo (dal greco: indivisibile) fu ripreso dal filosofo greco Democrito che per primo, nel IV sec. a.C., aveva ipotizzato che la materia fosse costituita da particelle indivisibili. Quella di Democrito era una teoria filosofica, non si basava cioè su dati oggettivi e non incontrò daltronde un grande favore. Nei secoli che seguirono, infatti, le interpretazioni più seguite furono altre e fu necessario aspettare 2000 anni perchè queste idee riprendessero piede.
La materia è composta da atomi.
L’atomo è la più piccola particella che è formata la materie ed è indivisibile ed indistruttibile. Un insieme di atomi che hanno la stessa dimensione e la stessa massa (per cui hanno le stesse proprietà chimico fisiche) sono chiamati elementi.
Ogni elemento è rappresentabile da un simbolo.
IL MODELLO ATOMICO DI DALTON:
John Dalton (1766 – 1844), insegnante di matematica e filosofia naturale a Manchester, prese spunto dalle ricerche di Lavoisier e Proust per elaborare la prima teoria atomica nel 1803, che si basa sulle seguenti assunzioni
 La materia è fatta di atomi piccolissimi, che sono indivisibili e indistruttibili.
La materia è fatta di atomi piccolissimi, che sono indivisibili e indistruttibili.- Tutti gli atomi di uno stesso elemento sono identici e hanno la stessa massa.
- Gli atomi di un elemento non possono essere convertiti in atomi di altri elementi.
- Gli atomi non possono essere né creati né distrutti, ma si trasferiscono interi da un composto all’altro
Anche la teoria di Dalton tuttavia dovette ben presto essere modificata. Le nuove scoperte fatte tra la fine del 1800 e l'inizio del 1900 dimostrarono infatti che l'atomo è divisibile e costituito da particelle più piccole dette subatomiche. Rimane valida la seguente definizione di atomo:
LA NATURA ELETTRICA DELLA MATERIA
Fin dall'antichità erano note le proprietà di alcuni materiali quali l'ambra (nome greco "electron") di attirare, in seguito a strofinio, corpi di piccole dimensioni come pezzetti di carta o peli.W. Gilbert, nel XVI secolo, catalogò un vasto insieme di materiali che avevano proprietà simili e li definì elettrizzati. Non tutti i materiali elettrizzati sono però in grado di attirare gli stessi piccoli oggetti e ciò è dovuto al fatto che esistono due tipi diversi di elettricità: quella definita positiva e quella definita negativa. Convenzionalmente i materiali dal comportamento analogo al vetro si dice che acquistano carica elettrica negativa (-), mentre quelli che si comportano come l'ambra si dice che acquistano carica elettrica positiva (+).
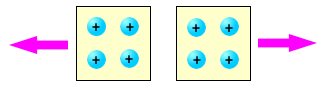
Tra due elementi elettrizzati dello stesso tipo, si manifesta sempre una forza repulsiva. Nella figura è mostrata la repulsione tra due corpi carichi positivamente; tra due corpi carichi negativamente si osserva il medesimo effetto.
Tra due elementi di diverso tipo, ad esempio vetro e ambra, si manifesta sempre una forza attrattiva
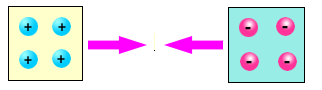
Queste esperienze rivelano una delle proprietà fondamentali della materia cioè la sua carica elettrica. Prima dello strofinio nella materia esiste un ugual numero di particelle positive e negative, la materia ci appare dunque neutra. Strofinando l'ambra alcune particelle di carica elettrica negativa le vengono tolte e rimangono sul panno di lana; per questo l'ambra si carica positivamente. Nel caso del vetro, invece, è la lana a rilasciare alcune particelle negative al materiale caricandolo quindi negativamente.
LE PARTICELLE SUBATOMICHE
Vari esperimenti condotti all'inizio del 1900 dimostrarono che gli atomi non sono indivisibili ma costituiti da particelle più piccole (elementari).
Se a due elettrodi posti alle estremità di un tubo di Crokes in cui è fatto il vuoto viene applicato un alto voltaggio (pila), dall'elettrodo negativo (catodo) si dipartono dei raggi detti raggi catodici.
Thomson dimostrò che tali raggi sono costituiti da un flusso di particelle cariche negativamente che chiamò elettroni.
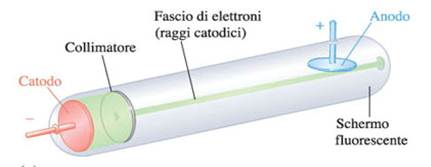
- I raggi catodici mettono in moto la ruota a pale (hanno natura corpuscolare).
- I raggi catodici vengono attratti dal piatto metallico carico positivamente (hanno carica negativa).
MODELLO ATOMICO DI THOMSON:
 Nel 1897 Thomson identificò gli elettroni, particelle subatomiche con carica elettrica negativa e con massa trascurabile. Quindi la teoria atomica di Dalton fu messa in discussione. Thomson poi propose il primo modello di atomo in cui si facesse riferimento a particelle subatomiche, cioè a particelle più piccole dell’atomo: egli ipotizzò che l’atomo fosse una sferetta carica positivamente all’interno della quale erano disposti gli elettroni in modo tale da neutralizzare la carica positiva.
Nel 1897 Thomson identificò gli elettroni, particelle subatomiche con carica elettrica negativa e con massa trascurabile. Quindi la teoria atomica di Dalton fu messa in discussione. Thomson poi propose il primo modello di atomo in cui si facesse riferimento a particelle subatomiche, cioè a particelle più piccole dell’atomo: egli ipotizzò che l’atomo fosse una sferetta carica positivamente all’interno della quale erano disposti gli elettroni in modo tale da neutralizzare la carica positiva.
Il modello di Thomson rappresentò un importante passo avanti, ma non era del tutto convincente: infatti se c’erano delle particelle subatomiche negative dovevano esserci anche delle subparticelle positive. Difatti il modello atomico di Thomson si rappresenta :
 MODELLO ATOMICO DI RUTHERFORD
MODELLO ATOMICO DI RUTHERFORD
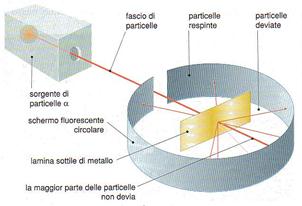
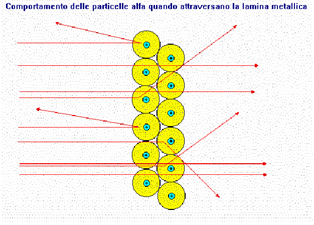
 Rutherford propose un modello secondo cui protoni e neutroni erano disposti nel nucleo, mentre gli elettroni erano liberi di muoversi attorno al nucleo stesso. Questo scienziato bombardando una sottile lamina d’oro, con delle particella alfa (particelle positive), avevano osservato che la maggior parte delle particelle riuscivano a passare indisturbate e soltanto una su ottomila rimbalzava in direzione opposta.
Rutherford propose un modello secondo cui protoni e neutroni erano disposti nel nucleo, mentre gli elettroni erano liberi di muoversi attorno al nucleo stesso. Questo scienziato bombardando una sottile lamina d’oro, con delle particella alfa (particelle positive), avevano osservato che la maggior parte delle particelle riuscivano a passare indisturbate e soltanto una su ottomila rimbalzava in direzione opposta.
Grazie a questo esperimento dedussero che l’atomo è per la maggior parte costituito da spazio vuoto. Il modello atomico di Rutherford considera l’atomo formato da un nucleo centrale, ne l quale risiede la quasi totalità della massa (poiché gli elettroni hanno una massa trascurabile) e dagli elettroni che ruotano intorno al nucleo descrivendo delle orbite, per la sua somiglianza con il sistema solare viene detto modello atomico planetario
Questo modello atomico non era, tuttavia, in grado di dare una valida spiegazione agli esperimenti che avevano messo in evidenza la capacità degli elettroni di assorbire e di emettere energia.
LE PARTICELLE SUBATOMICHE
|
CARICA |
MASSA |
DOVE SI TROVA NELL’ATOMO |
PROTONI |
+ 1C |
1 uma |
NEL NUCLEO |
ELETTRONI |
- 1C |
TRASCURABILE |
RUOTANO SU SETTE ORBITE |
NEUTRONI |
NON HANNO CARICA |
1 uma |
NEL NUCLEO |
LA SOMMA DELLE MASSE DI PROTONI E NEUTRONI DÀ LA MASSA ATOMICA.
Un atomo individuato da queste due grandezze (A e Z) si chiama nuclide:
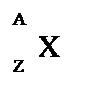
NUMERO ATOMICO (Z) indica il numero di protoni contenuti in un atomo. In un atomo neutro il numero atomico indica anche il numero di elettroni.
INUMERO DI MASSA (A) esprime il numero totale di protoni e neutroni contenuti in un atomo. Il numero di protoni può essere dato dalla differenza A–Z.
Il numero di neutroni è estremamente variabile da un atomo di un elemento all’altro; aumenta con l’aumentare del numero di protoni senza una regola fissa o di stretta proporzionalità.
Le proprietà chimichedell’ atomo sono legate al numero di elettroni, e precisamente a quelli più esterni (ELETTRONI DI VALENZA).
LE PROPRIETÀ CHIMICHE DELL’ATOMO SONO QUINDI LEGATE AL NUMERO ATOMICO.
|
|
|
|
|
|
PROTONI |
6 |
11 |
12 |
17 |
8 |
ELETTRONI |
6 |
11 |
12 |
17 |
8 |
NEUTRONI |
6 |
12 |
14 |
18 |
8 |
QUANTO PESA L’ATOMO? |
12 uma |
23 uma |
26 uma |
35 uma |
16 uma |
ISOTOPI sono atomi che presentano lo stesso numero atomico ma un diverso numero di massa cioè hanno tra di loro un diverso numero di neutroni. Gli elementi presenti in natura sono, di solito, un misto di vari isotopi.
(rispettivamente i nuclidi 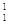 H trizio).
H trizio).
|
|
|
|
PROTONI |
1 |
1 |
1 |
ELETTRONI |
1 |
1 |
1 |
NEUTRONI |
0 |
1 |
2 |
QUANTO PESA L’ATOMO? |
1 |
2 |
3 |
Z = numero di elettroni (e quindi di protoni) NUMERO ATOMICO
A = protoni + neutroni NUMERO DI MASSA
A - Z = numero di neutroni
M = peso atomico o MASSA ATOMICA (in uma)
La massa atomica non coincide col numero atomico per varie ragioni:
- le masse di protoni e neutroni non sono proprio uguali a 1
- in uno stesso elemento spesso ci sono isotopi diversi (diverso numero di neutroni, vedi sotto), che contribuiscono ognuno per una certa percentuale al peso atomico medio finale
- se si potesse pesare, un nucleo peserebbe meno della somma dei pesi dei protoni e neutroni che contiene: all’atto della sua formazione, si libera una grande quantità di energia (energia di legame nucleare), che comporta una perdita di massa (difetto di massa). L’energia che si libera all’atto della formazione dei legami tra nucleoni è la stessa che occorre per scindere il nucleo nei suoi componenti.
L’atomo nel suo complesso risulta elettricamente neutro, perché anche se protoni ed elettroni sono portatori di carica elettrica, queste sono della stessa entità, ma di segno opposto; infatti in un atomo il numero dei protoni è sempre uguale al numero degli elettroni
IONE
atomi o gruppi di atomi con carica elettrica positiva o negativa.
Tipici ioni sono, lo ione sodio Na+, lo ione Cl-. Gli ioni positivi sono chiamati cationi, quelli negativi anioni Cl-.
CATIONI: sono i metalli che hanno perso o uno o più elettroni di valenza per avere l’ultimo livello completo
ANIONI: sono non metalli che acquistano uno o più elettroni per avere l’ultimo livello completo
STRUTTURA DELL’ATOMO.
Al centro dell’atomo c’è il nucleo (109 volte più piccolo del diametro dell’atomo!). Il nucleo è formato da due tipi di particelle (nucleoni): i protoni (carica positiva) ed i neutroni (nessuna carica). Queste particelle, che immaginiamo sferiche, hanno massa di circa 1 uma (unità di massa atomica, è la massa dell’atomo di idrogeno).
Attorno al nucleo ruotano, a grandissima distanza e velocità (circa 1/100 della velocità della luce), gli elettroni: piccole particelle aventi carica negativa e massa 1837 volte più piccola dei nucleoni. Nell’insieme, l’atomo è elettricamente neutro.
Il volume dell’atomo corrisponde di fatto allo spazio in cui ruotano gli elettroni: il suo diametro è dell’ordine degli Angstrom (1 Å = 10-10 m). Il diametro del nucleo è invece molto più piccolo del diametro dell’atomo: circa 10.000 volte inferiore. Ciò significa che l’atomo è per la maggior parte spazio vuoto! Tutta la massa dell’atomo è praticamente situata nel nucleo (essendo la massa degli elettroni trascurabile rispetto a quella dei nucleoni)
La massa degli atomi dei vari elementi è compresa tra 10-24 e 10-22 g: per evitare numeri così piccoli, la massa dell’atomo si misura in unità di massa atomica (uma): 1 uma è per convenzione la dodicesima parte della massa del carbonio 12 (l’isotopo più comune del carbonio).
1 uma = 1.66 x 10-24 g
Massa protone: 1.00757 uma (circa 1)
Massa neutrone: 1.00893 uma (circa 1)
Massa elettrone: 0.000548 uma(circa zero)
La somma delle masse di protoni e neutroni dà la massa atomica.
Esempi: idrogeno 1 uma; carbonio 12 uma; ossigeno 16 uma; sodio 23 uma; cloro 35 uma.
La somma delle masse atomiche dei vari atomi in una molecola dà la massa molecolare.
Esempi: H2O 18 uma; NaCl 58 uma.
Il grammo-atomo è il peso atomico espresso in g (12g per il carbonio); la grammo-molecola è il peso molecolare espresso in g (18g per l’acqua). In un grammo-atomo e in una grammo-molecola è contenuto lo stesso numero di atomi o di molecole: il numero di Avogadro o mole.
L’ATOMO DI BOHR
Il modello di Bohr si basa su alcune ipotesi fondamentali:
PRIMA IPOTESI: Nell'atomo gli elettroni ruotano intorno al nucleo su 7 orbite circolari. Ognuna di queste orbite ha un raggio ben determinato
SECONDA IPOTESI: Il momento angolare degli elettroni é quantizzato. Esso può assumere soltanto certi valori (valori permessi), ma non può assumere i valori intermedi fra quelli permessi.
Dopo aver introdotto queste ipotesi, Bohr studia la situazione dell'elettrone utilizzando le leggi della fisica classica. L'elettrone é soggetto alla forza di attrazione del nucleo. Questa forza provoca il suo moto di rotazione e quindi costituisce la forza centripeta. Gli elettroni nelle loro orbite possiedono una certa quantità di energia; essi infatti sono in moto, e quindi hanno energia cinetica; inoltre hanno energia potenziale dovuta all'attrazione elettrostatica tra elettrone e nucleo.
TERZA IPOTESI: Finché un elettrone rimane nella sua orbita, non emette e non assorbe energia.
Per passare da un'orbita con energia minore a un'orbita con energia maggiore (cioè da un'orbita più interna a una più esterna), l'elettrone deve ricevere dall'esterno una quantità di energia corrispondente alla differenza di energia fra le due orbite; se invece passa da un'orbita con energia maggiore a un'orbita con energia minore, l'elettrone emette una quantità di energia pari alla differenza di energia fra le due orbite. L'energia viene emessa o assorbita sotto forma di radiazione elettromagnetica. Esiste una relazione matematica fra i valori di energia delle orbite di partenza e di arrivo e la frequenza della radiazioni:
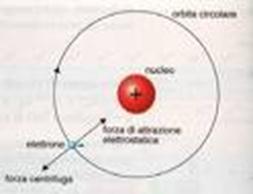
L’ipotesi più accreditata rimane quella di Bohr, secondo cui gli elettroni si muovono attorno al nucleo (in cui sono contenuti protoni e neutroni) descrivendo delle orbite stazionarie ben delimitate.
Bohr considera l’atomo formato da un nucleo centrale, nel quale risiede quasi tutta la massa, e dagli elettroni che ruotano intorno al nucleo descrivendo orbite ben precise (stazionarie). Gli elettroni possono acquistare o cedere energia per passare da un orbita all’altra, la quantità di energia acquistata o ceduta è pari alla differenza di energia esistente tra le due orbite.
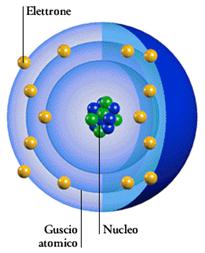
 Nella figura accanto sono rappresentate le sette orbite stazionarie ipotizzate da Bohr. Secondo Bohr l’elettrone emette o assorbe energia soltanto se questa gli consente di passare daun orbita stazionaria all’altra. Attorno al nucleo possono esserci al massimo 7 gusci con elettroni orbitanti. Ogni guscio può contenere solo un numero limitato di elettroni
Nella figura accanto sono rappresentate le sette orbite stazionarie ipotizzate da Bohr. Secondo Bohr l’elettrone emette o assorbe energia soltanto se questa gli consente di passare daun orbita stazionaria all’altra. Attorno al nucleo possono esserci al massimo 7 gusci con elettroni orbitanti. Ogni guscio può contenere solo un numero limitato di elettroni
Fonte: http://www.liceocottini.it/documenti/FAD/chimica/modelli%20atomici.doc
Autore del testo: non indicato nel documento di origine
Atomo definizione
Il modello atomico di Bohr-Rutherford
Nel 1911 Rutherford pose una lamina d’oro in una camera a nebbia contenente il polonio, elemento radioattivo che decadendo libera particelle a2 le quali una volta emesse si propagano in linea retta con un po’ di autonomia, fino ad incontrare uno schermo scintillatore che rileva l’arrivo di ogni particella. Ma Rutherford notò che non accadeva niente e riscontrava che le particelle passavano la lamina senza subire alcuna deviazione. Si accorse che alcune delle particelle emesse dal polonio deviavano il loro percorso solo grazie ad un ampliamento dello schermo, da qui realizzò il suo nuovo modello di atomo che superò quello precedente di Thompson, infatti, realizzò che le particelle che deviavano il loro percorso erano poche proprio perché erano poche quelle particelle a2 che incontravano nel tragitto una carica positiva, di conseguenza pensò che la carica positiva fosse addensata completamente nel nucleo dell’atomo stesso, mentre considerò il resto dell’atomo vuoto, nel quale alloggiavano gli elettroni che avendo carica negativa ruotavano intorno al nucleo. Ruttherfor commise un errore proprio qui, infatti quest’ultima affermazione venne negata più avanti dal danese N. Bohr; è comunque rimasto invariato al modello di atomo più recente il fatto che ci sia un nucleo di carica positiva.
La teoria della gravitazione universale, enunciata da Newton (nel 1687), aveva eliminato la scissione, di derivazione aristotelica, tra fisica celeste e fisica terrestre; ora nello studio del microcosmo atomico si riproponeva una frattura tra le leggi classiche della meccanica e dell'elettromagnetismo viste nel macrocosmo e quelle applicate al microcosmo. Il superamento di queste contraddizioni fu realizzato da Niels Bohr.
Bohr presentò( nel 1913) al Consiglio Solvay, la sua teoria quantistica dell'atomo che si rifaceva al modello atomico di Rutherford, ma con quattro modifiche essenziali:
- prima di tutto, per rispettare l'ipotesi di partenza, l'elettrone non può ruotare intorno al nucleo su orbite qualsiasi ma su orbite fisse privilegiate, corrispondenti ai vari livelli di energia;
- in secondo luogo, se l'elettrone persiste nel ruotare su queste orbite privilegiate non emette energia nonostante la sua accelerazione e la frequenza di rotazione;
- l'elettrone può saltare spontaneamente da un livello all'altro;
- infine, la frequenza della radiazione emessa o assorbita nel salto è legata al "quanto" di energia dalla formula: DE = hn ove “h” è la costante di Plance e “v” è la frequenza della radiazione emessa o assorbita.
In particolare Bohr collegò la nozione di quanto di energia con il movimento rotatorio degli elettroni intorno al nucleo. Un atomo si deve trovare in dati livelli energetici (o stati quantici) che ne spieghino la sua stabilità. Se l'atomo si trova in uno di questi livelli, non emette energia. Emette un "quanto" di energia solo quando passa da uno stato di energia maggiore a uno minore (la differenza tra queste due energie è pari al quanto emesso DE = hn .Quando l'atomo è colpito da una radiazione di una certa frequenza, assorbe un quanto di energia e passa da un livello energetico inferiore a uno superiore.
Bohr era riuscito a rendere conto sul piano teorico di quella stabilità degli atomi che il modello di Rutherford non forniva; in più spiegava anche la costanza degli spettri emessi dalle varie sostanze, cioè dai vari " edifici atomici ". Nello spettro si trovano tutte le frequenze consentite per i vari tipi di atomi, perché in ogni atomo gli elettroni si trovano a certi livelli energetici tipici e consentiti per ogni elemento.
La sua teoria fu un'importante combinazione dei principi della fisica classica con ipotesi che contrastavano con essa e che derivavano come generalizzazione dalle ipotesi di Planck e di Einstein.
Il modello atomico "quantizzato" da Bohr non spiegava tuttavia la diversa intensità delle righe spettrali caratteristiche degli elementi e il loro stato di polarizzazione; si limitava al calcolo delle frequenze delle righe spettrali. Ecco allora il principio di corrispondenza enunciato da Bohr sulla base di una constatazione: se si calcola la frequenza emessa da un salto d'orbita minimo, è indifferente servirsi dei metodi classici o di quelli quantistici; il risultato è sempre lo stesso. Esperienza e calcolo collimano quando cioè si scelgano condizioni limite. Si poteva quindi formulare l'ipotesi che l'intensità e lo stato di polarizzazione di una riga corrispondano all’intensità ed allo stato di polarizzazione della riga corrispondente, che verrebbe emessa dal sistema secondo la teoria classica.
L'anno seguente all'enunciazione delle ipotesi di Bohr venne iniziata da Franck ed Hertz la prima di una serie di esperienze sugli urti fra atomi ed elettroni liberi che avrebbero confermato l'esistenza, non solo per l'atomo di idrogeno (considerato da Bohr) ma per tutti gli atomi, di diversi stati energetici con valori discreti dell'energia. Ciò confermava la validità della formula che lega la frequenza della radiazione emessa alla differenza tra le energie di due stati quantici.
Quindi, per riassumere, Bohr osservò che un elettrone che ruota intorno ad un nucleo deve rispettare certe particolari condizioni dinamiche ed energetiche; questi limiti si possono riassumere in due teoremi:
- un elettrone può descrivere intorno al nucleo solo una successione discreta di orbite, nel senso che non tutte le orbite sono permesse (quantizzazione delle orbite)
- quando un elettrone percorre una data orbita in contrasto con le leggi dell’elettromagnetismo non irradia energia. Solo a seguito di una transizione da un orbita ad un’altra si ha una variazione del contenuto energetico dell’atomo (quantizzazione dell’energia
Secondo Bohr la quantizzazione delle orbite e quindi dell’energia possono essere espresse mediante la relazione:
Mvr= n * h/ 2pi
Ove mvr è il momento angolare di una particella che si muove su di una circonferenza di raggio r. n è il numero naturale ed h è la costante di Plank
Questa equazione viene verificata grazie alla teoria di De Broglie circa il dualismo onda corpuscolo di tutte le particelle, mediante la relazione l = h/ (m*v) (che associa ad una particella di massa “m” e velocità “v” una radiazione d’onda l)
· Si considera un elettrone su un’orbita circolare di raggio r, guidato da un’onda ad esso associato. . Essendo l’atomo un sistema 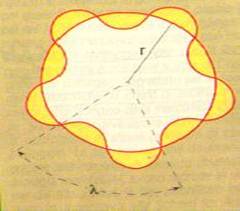 stabile l’elettrone può percorrere solo quelle orbite che rendono l’orbita stazionaria e quindi dividendo la lunghezza 2p r della circonferenza descritta dall’elettrone per la lunghezza dell’onda l otteniamo solo numeri interi
stabile l’elettrone può percorrere solo quelle orbite che rendono l’orbita stazionaria e quindi dividendo la lunghezza 2p r della circonferenza descritta dall’elettrone per la lunghezza dell’onda l otteniamo solo numeri interi
2 p r / l = n 2 p / h* m v r = n m v r = n* h / 2p
LE LACUNE DELLA TEORIA DI BOHR
Ma ecco i problemi irrisolti che la teoria di Bohr lasciava:
- non giustificava il mancato irraggiamento degli elettroni costretti a ruotare intorno solo ad alcune orbite
- non dava alcuna informazione sull’intensità delle righe degli idrogenoidi (oltre all’idrogeno sono atomi degli elementi leggeri ionizzati in modo da aver perduto tutti gli elettroni eccetto uno)
- difficoltà nell’estendere il modello ai sistemi formati da più di un elettrone
- non c’era alcun criterio razionale per ripartire gli elettroni nelle loro orbite
Nel 1916, il fisico tedesco Arnold Sommerfeld estese alle orbite ellittiche dell'atomo di idrogeno le ipotesi che Bohr aveva enunciato solamente per le orbite circolari. Questa estensione avvenne mediante l'applicazione ai moti dell'elettrone della meccanica relativistica di Einstein.
Ne derivò un'importante conseguenza: Sommerfeld poté rilevare che le orbite ellittiche degli elettroni non sono equidistanti, ma formano dei gruppi (detti strati o anelli) elettronici; le orbite dello stesso strato hanno energie che differiscono fra di loro di valori piccolissimi. Questi strati sono per convenzione identificati con le lettere K, L, M, N, eccetera,partendo dagli strati interni. Gli strati comprendono diversi numeri di orbite che vanno da 2 a 8, a 18, a 32, ecc., a mano a mano che si va verso l'esterno.
Tutto a questo punto pareva risolto e controllato sperimentalmente. Ma ancora una volta l'atomo sfuggiva alla presa dei fisici: la teoria di Sommerfeld - applicazione delle teorie relativistiche all'atomo di Bohr- non teneva conto di alcuni fatti: non spiegava quantitativamente la complessità degli spettri, che si rivelavano ad esami più attenti ancor più complicati e non rendeva ragione di alcune anomalie magnetiche dell'atomo.
In breve, il modello di Bohr - Sommerfeld non spiegava sufficientemente i processi che avvengono all'interno dell'atomo: quando un elettrone salta da un'orbita all'altra? Per quanto tempo un elettrone persiste in un'orbita? Bohr stesso scrisse: bisognava rinunciare a descrivere il comportamento individuale degli atomi nello spazio e nel tempo, conformemente al principio di causalità, e immaginare che la natura può fare, tra diverse possibilità, una libera scelta che non è sottoposta che a considerazioni di probabilità.
Nel 1917, Albert Einstein introdusse, nello studio dell'atomo di Bohr, alcuni coefficienti di probabilità. Einstein formulò cioè l'ipotesi che un elettrone cambi orbita spontaneamente, cioè senza intervento di cause esterne al sistema dell'atomo.
Se l'atomo viene colpito da una radiazione luminosa con frequenza pari alla frequenza corrispondente ad un salto, l'elettrone compie questo passaggio in un'orbita esterna e lo compie con tanta maggior probabilità quanto maggiore è l'intensità della luce che colpisce l'atomo.
Nel 1925, i fisici Uhlenbeck e Goudsmit, per spiegare alcuni particolari fenomeni degli spettri di emissione e di assorbimento degli atomi e alcuni fatti riguardanti il ferro magnetismo e il paramagnetismo presenti in certe sostanze (non ancora spiegati con la teoria di Bohr), idearono un'altra ipotesi.
Uhlenbeck e Goudsmit supposero che ogni elettrone, proprio come fanno i satelliti naturali, oltre che ruotare intorno al nucleo ruoti anche su se stesso. Rivoluzione e rotazione tornavano nella similitudine fra atomo e Sistema Solare. L'elettrone cioè aveva proprietà simili a quelle di un giroscopio, il cui asse, grazie al moto di rotazione intorno al l'asse passante per il baricentro, tende a conservare una direzione ben determinata nello spazio. Ma non basta; essendo elettricamente carico, l'elettrone assomiglia ad un piccolissimo magnete. I fisici adottarono il termine spin, che in inglese significa appunto rotazione, e qui è sinonimo di momento angolare meccanico; una grandezza fisica che dà una misura della velocità di rotazione della particella e l'indicazione del verso in cui avviene la rotazione stessa.
Lo spin venne trattato da Uhlenbeck e Goudsmit con le stesse leggi quantistiche usate da Bohr per il moto di rivoluzione dell'elettrone e ne dedussero che un elettrone ha sempre lo stesso ben determinato spin, in altri termini ha sempre la stessa velocità di rotazione su se stesso. Altra conclusione ricavata dall'ipotesi dello spin è questa: poiché produce un campo magnetico, l'elettrone può avere l'asse soltanto in due direzioni rispetto al campo magnetico esterno, o la stessa direzione e lo stesso verso del campo esterno, oppure la stessa direzione ma verso opposto (l'elettrone può essere, si dice, o parallelo o antiparallelo).
I valori dedotti dai due fisici a proposito dello spin e del momento magnetico dell'elettrone permisero di interpretare quantitativamente le proprietà ottiche e magnetiche che non venivano spiegate dal modello atomico di Bohr.
L'ipotesi dell'elettrone ruotante era solo un'immagine, ma rimase per molto tempo una rappresentazione valida anche dal punto di vista teorico. Nel giro di pochi anni, dall'atomo di Rutherford a quello di Bohr-Sommerfeld e a quello di Uhlenbeck e Goudsmit,cioè dal 1911 al 1925, si era passati a una forma più valida di interpretazione; a un modello sempre più complesso che aveva richiesto un lavoro rivoluzionario e ormai ben distante dalla fisica classica.
La teoria di Bohr, formulata inizialmente per l'atomo più semplice, cioè per l'idrogeno, permise di calcolare teoricamente il valore di una costante già stabilita sperimentalmente dalle ricerche spettroscopiche ( costante di Rydberg – costante caratteristica di ciascun elemento, avente le dimensioni dell’inverso di una lunghezza, che interviene nelle serie spettroscopiche, i cui termini danno i numeri d’onda delle radiazioni emesse dall’elemento che si considera)
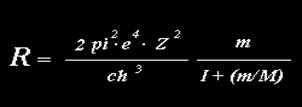
ove e ,m sono la carica e la massa dell’elettrone, M è la massa del nucleo, Z è il numero atomico, c è la velocità della luce nel vuoto, h è la costante di Planck. Tale espressione porta valori numerici: R=109677,69 cm-1 per l’idrogeno, R=109722,40 cm-1 per l’elio, in ottimo accordo con l’esperienza ).
I valori così trovati collimavano: era il primo successo di Bohr.
http://www.atuttascuola.it/tesine/FILES/dalla_guerra/FISICA%20ok/Il%20modello%20atomico%20di%20Boh%20VERO.doc
Autore del testo: non indicato nel documento di origine
LA REALTA’ DEGLI ATOMI
L’ipotesi della costituzione atomica della materia , introdotta da alcuni pensatori greci ( Democrito , Epicuro ) come ardita e geniale intuizione filosofica , ma , necessariamente , senza il supporto di una visione scientifica della realtà , fu abbandonata per secoli dalla moderna scienza fisica . Questa, infatti , progredì fino a tutto il Settecento ipotizzando una materia continua e , quindi , indefinitamente divisibile . Nella meccanica dei corpi rigidi , ad esempio , il calcolo dei baricentri e dei momenti di inerzia dei corpi estesi veniva eseguito componendoli in masse infinitesime e applicando a queste i metodi dell’analisi matematica . Ciò da una parte appariva naturale , perché comportava l’estensione alla materia del concetto di continuità della matematica , dall’altra conduceva alla formulazione di teorie coerenti e in grado di rappresentare correttamente il moto e le proprietà dei corpi di dimensioni ordinarie . E’ chiaro quindi che l’idea che la materia fosse continua sembrava ai fisici corrispondere alla realtà delle cose . C’è da aggiungere che quando si cominciarono a studiare i fenomeni elettrici , l’idea della continuità fu estesa alla carica elettrica : la carica posta su un corpo veniva cioè considerata come una distribuzione continua di cariche infinitesime . Anche in questo settore della fisica , sulla base di questa concezione , si pervenne ad una rappresentazione e ad una spiegazione soddisfacenti dei fenomeni ordinari dell’elettrostatica , per cui la convinzione di una struttura continua delle “ cose “ non veniva in alcun modo messa in dubbio .
L’ipotesi atomica fu introdotta inizialmente in chimica , per interpretare le leggi quantitative che regolano le reazioni . Si tratta della legge delle proporzioni definite di Proust e della legge delle proporzioni multiple e costanti di Dalton . La prima afferma che due elementi che danno luogo ad una reazione si compongono secondo precisi rapporti di peso , che sono definiti e sempre gli stessi . Ciò faceva pensare che in una reazione tra due elementi entrassero un certo numero di unità elementari ( atomi ) dei due elementi e che , in definitiva , il rapporto tra i pesi dei due reagenti fosse determinato dal rapporto tra i pesi dei rispettivi atomi . L’altra legge , quella di Dal ton , afferma che se un elemento può dar luogo , reagendo con un altro elemento , a più composti , le quantità del primo che reagiranno nei vari casi con una quantità fissa del secondo elemento stanno tra loro come numeri interi . E’ facile rendersi conto che anche questa seconda legge può essere interpretata per mezzo della ipotesi della costituzione atomica della materia .
Si comprende bene che la teoria atomica introdotta per questa via costituiva una comoda ipotesi per interpretare le reazioni chimiche , comoda , plausibile , ma nulla più che una ipotesi che lasciava in genere scettici o indifferenti i fisici dell’epoca sulla realtà degli atomi .
Un’altra scoperta importante sulla via dell’affermazione della teoria atomico-molecolare fu quella dei moti browniani . Il botanico Brown , osservando al microscopio delle particelle di polline in sospensione in un liquido , le vide animate da un moto incessante e irregolare . Del fenomeno poteva essere avanzata la seguente spiegazione : le molecole del liquido , invisibili al microscopio in moto termico disordinato e incessante , comunicavano questo moto alle particelle di polline visibili al microscopio . Non c’è dubbio che , se le molecole esistono , il moto browniano ne prova il moto di agitazione termica ; ma esso non prova l’esistenza delle molecole ! E siamo , così , con Brown , al 1827 .
Per i fisici si trattava , però , di dare un supporto quantitativo ed operativo all’ipotesi molecolare , misurando il numero di molecole presenti in una mole di gas ( numero di Avogadro ) , la massa e il dia metro delle molecole e l’ordine di grandezza della loro velocità di agitazione termica . Furono Clausius , nel tentativo di dare un fondamento consistente al I° principio della termodinamica , e in seguito Maxwell aporre le basi per una misurazione indiretta di queste grandezze .
L’ATOMO PARTICELLA COMPLESSA E LA SUA STRUTTURA
Il meccanismo della conduzione elettrica nelle soluzioni elettrolitiche è noto : le parti in cui si spezzano le molecole dei composti in soluzione acquistano una carica e la trasportano agli elettrodi di segno contrario . Al passaggio di corrente elettrica si accompagna , in questo caso , trasporto di materia agli elettrodi . Le cose vanno diversamente nei metalli solidi . qui la conduzione elettrica si verifica senza apparente trasporto di materia attraverso il conduttore . Da cosa è trasportata la carica in questo caso ? Il problema può essere risolto riflettendo un po’ sull’effetto termoelettronico . Un catodo metallico , portato ad alta temperatura , emette particelle che vengono attirate da un anodo positivo . Si tratta quindi di particelle negative . Inoltre , il trasporto di carica avviene senza che si depositi materia all’anodo : queste particelle , dunque , devono avere massa molto piccola . Devono essere quindi queste stesse particelle ( elettroni ) che in un metallo , libere di muoversi sotto l’azione di una differenza di potenziale , danno luogo alla corrente . ‘atomo , quindi , non è indivisibile , non è una particella semplice , ma composta : da esso si possono estrarre elettroni negativi e quindi , data la sua complessiva neutralità , la parte che resta deve essere carica positivamente .
I PROBLEMI APERTI DAL MODELLO DI RUTHERFORD
In realtà il modello di Rutherford pone più problemi di quanti non ne risolva . Anzi , si può dire che la sua importanza nella storia della fisica è legata proprio ai problemi che esso fa sorgere e che aprono la strada alla crisi della fisica classica e a una rivoluzione scientifica che approda a un nuovo modo di porsi verso i problemi della realtà microscopica .
- La teoria elettromagnetica classica stabilisce che una carica in moto accelerato emette radiazione . L’elettrone , in moto circolare attorno al nucleo , dovrebbe , allora , irraggiare ,e perdere conseguentemente energia , spiralizzando rapidamente sul nucleo . Si dovrebbe cioè avere il cosiddetto “ collasso per radiazione “ dell’elettrone , in un tempo di collassamento calcolabile in
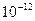 secondi . In realtà , noi constatiamo , invece , la “ testarda “ stabilità dell’atomo , e il modello di Rutherford non ci spiega questa stabilità .
secondi . In realtà , noi constatiamo , invece , la “ testarda “ stabilità dell’atomo , e il modello di Rutherford non ci spiega questa stabilità . - Gli atomi , eccitati , emettono luce soltanto per alcuni valori discontinui di frequenza . Ciò è in contrasto con l’elettromagnetismo classico e con il modello di Rutherford , che lascerebbero prevedere un irraggiamento continuo .
http://arcolesses.altervista.org/atomi.doc
autore: SILVIO ARCOLESSE
Struttura dell’ATOMO (appunti)
La scoperta dell’ELETTRONE
Per tutto l’800, dopo che Dalton aveva ribadito la teoria atomica, perdurò il convincimento della indivisibilità dell’atomo.
Questa concezione fu superata grazie ad una serie di esperimenti la cui natura non era affatto chimica. Il passo avanti si dovette infatti alle ricerche sulla corrente chimica.
La corrente attraversa certe sostanze più facilmente di altre, ad esempio i metalli, ma, dato un potenziale elettrico sufficiente, è possibile far passare una corrente attraverso qualsiasi sostanza solida, liquida o gassosa.
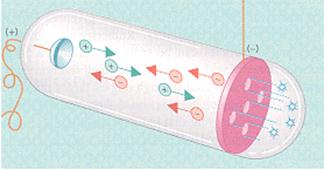
Gli scienziati del XIX secolo stavano studiando la possibilità di far passare la corrente elettrica addirittura nel vuoto. Per ottenere risultati significativi occorreva però disporre di un vuoto abbastanza spinto da permettere alla corrente di attraversarlo senza troppe interferenze daparte della materia.
Nel 1855 un vetraio tedesco, Geissler, costruì un recipiente di vetro nel quale praticava il vuoto. Un suo amico, Plucker, si servì di questi tubi per compiere esperimenti sull’elettricità. Egli fece sigillare due elettrodi alle estremità di in uno di questi tubi e stabilì un potenziale elettrico di 10000 Volt riuscendo così a far passare la corrente. La corrente determinava effetti luminosi all’interno del tubo, dovuti alla ionizzazione delle poche molecole gassose rimaste. Se il vuoto era molto spinto la luminosità si estingueva, ma il vetro del tubo vicino all’anodo (polo +) emetteva una luce verde.
Prima del 1876 il fisico inglese Crookes aveva realizzato un tubo ancora più perfezionato. Per spiegare la luminosità del tubo vicino all’anodo si fece l’ipotesi che dal catodo partissero dei raggi invisibili i quali, incontrando il vetro provocavano un’ eccitazione della materia (atomi) che si manifestava con l’emissione di luce verdastra.
Il moto di questi raggi era rettilineo, perchè interponendo nel tubo un pezzetto di metallo sagomato, si proiettava nitidamente la sua ombra sulla parete dietro l’anodo.
Nel 1876 questo flusso fu chiamato “raggi catodici” dal tedesco Goldstein. Ma questi raggi erano “onde” del tipo ad esempio delle radiazioni luminose o erano “particelle veloci”?
Nel 1897 Thomson definì la natura di questi raggi. Egli accertò che avevano nutura corpuscolare, essendo costituiti da granuli quasi immateriali e che, partendo dal catodo, si muovevano in linea retta con grande velocità (infatti un foglio metallico interposto sul loro cammino si riscaldava) e che, inoltre, possedevano carica elettrica negativa, giacchè fatti passare attraverso un campo elettrico venivano deviati dalla parte del polo positivo e, parimenti, venivano deviati da un campo magnetico. Queste particelle altro non erano che gli ELETTRONI di cui era già stata supposta l’esistenza.
Si stabilì che la luminescenza verdastra osservata sulle pareti del tubo era realmente generata dall’urto degli elettroni sul vetro. Ripedendo l’esperimento con catodi di metalli diversi, la scarica nei gas rarefatti e nel vuoto avveniva con le stesse modalità, il che significava che l’emissione di elettroni era indipendente dalla natura del catodo.
Si constatò inoltre che questi elettroni erano sempre identici qualunque fosse il gas impiegato nel tubo di Crookes.

Nel 1911 Millikan riuscì a misurare, con grande precisione, la carica dell’elettrone e la sua massa
q = 1,6 x 10-19 coulomb
M = 9,1 x 10-31 kg
Restava da chiarire se esistesse qualche rapporto tra l’elettrone e l’atomo, cioè ci si chiedeva se queste erano due unità distinte oppure se erano collegate da una stretta relazione, come si supponeva.
Alla fine dell’800 già si conoscevano gli ioni, atomi con carica elettrica. Si poteva così spiegare la presenza di ioni positivi come risultato della perdita di uno o più elettroni da parte dell’atomo e di ioni negativi come l’acquisto di uno o più elettroni da parte dell’atomo. Questa ipotesi fu confermata da altre esperienze.
Thomson a questo punto enunciò una sua teoria atomica: immaginò che l’atomo fosse una sfera solida di materia dotata di cariche elettriche positive, sulla cui superficie erano attaccati gli elettroni, come l’uvetta sopra una torta. MODELLO A PANETTONE
La scoperta del PROTONE
Nel 1886 Goldstein che aveva dato il nome ai raggi catodici fece degli esperimenti in un tubo sottovuoto con catodo perforato. Quando verso l’anodo venivano emessi raggi catodici, altri raggi passavano attraverso i fori del catodo e si allontanavano nella direzione opposta. Se alla parete di fondo del tubo si appoggiava uno schermo rivelatore di tali raggi, si notava la formazione di una zona luminosa e, applicando all’esterno del tubo un campo elettrico, si trovava che questi raggi (detti anodici o raggi canale) venivano deviati verso il polo negativo. Si giudicò quindi che fossero formati da particelle positive. Ripetendo l’esperimento con gas rarefatti di diversa natura si stabilì che le particelle dei raggi canale possedevano una massa praticamente uguale a quella degli atomi di del gas presente e che la più leggera di queste particelle aveva la stessa massa dell’atomo di idrogeno. Quest’ultima particella aveva carica positiva esattamente uguale a quella negativa dell’elettrone. La sua massa fu calcolata in base a quest’ultima considerazione; essa risultò essere:
M = 1,67 x 10-27 kg
1837 volte maggiore di quella dell’elettrone.
Nel 1914 Rutherford propose che questa paticella venisse accettata come unità fondamentale di carica positiva e fosse chiamata PROTONE
La scoperta del NEUTRONE
La scoperta del neutrone avvenne molto più tardi, nel 1932, ad opera del fisico inglese Chadwick.
Già alla fine dell’800 erano state scoperte sostanze radioattive che emettevano spontaneamente radiazioni capaci di interagire con la materia.
Nel 1896 il fisico francese Bequerel aveva visto come alcuni minerali contenenti uranio impressionavano lastre fotografiche chiuse nel loro involucro. Nello stesso periodo i coniugi Curie avevano scoperto diversi minerali radioattivi da cui avevano isolato elementi come il Thorio, l’Uranio, il Polonio, il Radio. Venne poi studiata la natura di queste radiazioni alcvune corpuscolate, altre elettromognetiche.
Raggi a = particelle cariche (+) formate da due protoni e due neutroni
Raggi b = particelle cariche (-) corrispondenti ad elettroni
Raggi g = radiazioni elettromagnetiche a piccolissima lunghezza d’onda.
Chadwich osservò che particelle elettricamente neutre si produceano quando un elemento, il berillio, veniva colpito dalle radiazioni emesse da una sostanza radioattiva. Tali particelle con massa quasi identica a quella del protone furono chiamate NEUTRONI
Atomo di Rutherford o atomo nucleare
La scoperta delle particelle fondamentali dell’atomo pose chimici e fisici di fronte ad un problema fondamentale: come erano disposte queste particelle all’interno dell’atomo?
Una prima decisiva risposta a questa domanda venne data da Rutherford, fisico inglese che interpretò genialmente una serie di esperienze che consistevano nel bombardare con particelle a sottilissimi fogli metallici. Quando le particelle a si liberano dalle sostanze radioattive possiedono un grande velocità (30.000 km/sec) esse, secondo i calcoli avrebbero dovuto attraversare un foglio metallico subendo una piccola deviazione e perdendo parte della loro energia. Grande fu la meraviglia di Rutherford quando vide che una frazione minima ma costante di queste particelle veniva respinta. Piochè nello spessore di un foglio metallico anche sottilissimo entrano alcuni milioni di atomi, questi risultati dimostravano che:
- la quasi totalità della materia era costituita da spazio vuoto;
- disseminata in zone piccole e lontane le une dalle altre si trovava della materia allo stato enormemente compatto, dotata di cariche positive dal momento che respingeva le particelle a,anch’esse cariche positivamente.
Ogni atomo è formato dunque da un nucleo carico positivamente, piccolissimo e denso attorno al quale ruotano gli elettroni leggerissimi, ma che occupano la quasi totalità del volume dell’atomo.
Se paragoniamo un atomo ad una piazza con diametro 100m il nucleo può venir rappresentato da una biglia di vetro di un cm di diametro al suo centro.
Il diametro dei nuclei è appena 1/10000 – 1/100000 di quello atomico. La densità dei nuclei è sbalorditiva: se 1 cm3 di materia fosse costituito solo da nuclei peserebbe 100 milioni di tonnellate!
Quindi la massa della materia è dovuta quasi esclusivemte ai nuclei, mentre il volume è dovuto agli elettroni in movimento.
Valori che caratterizzano l’atomo
L’atomo è caratterizzato da:
- Il numero atomico, detto Z
- Il numero di massa detto A
- Il peso o massa atomica
Il numero atomico Z
Indica il numero dei protoni e degli elettroni presenti in un atomo. E’ sempre lo stesso per tutti gli atomi di un elemento.
Le diverse proprietà chimiche che caratterizzano ogni elemento sono dovute al diverso numero di protoni e di elettroni (Z) presenti.
In base al numero atomico gli atomi possono essere collocati l’uno dietro l’altro nel sistema periodico.
Il numero atomico di molti elementi fu stabilito da Moseley usando un tubo a raggi catodici provvisto di una piastra metallica (3/4 degli elementi sono metalli) di fronte al catodo. L’urto degli elettroni su di essa produceva radiazioni a bassissima lunghezza d’onda l , dette raggi X. Moseley osservò che la lunghezza d’onda dei RX variava a seconda del metallo usato come piastra: era tanto più piccola quanto più grande era Z. Egli ne trasse una formule applicando la quale conoscendo l era possibile risalire a Z.
Il numero di massa A
E’ dalla somma di protoni + neutroni (nucleoni) e può variare nell’ambito di uno stesso elemento. Atomi di uno stesso elemento che hanno diverso numero di massa sono detti ISOTOPI. L’insieme di tutti gli isotopi di un elemento costituisce la miscela isotopica naturale.
Esempi: si conoscono isotopi diversi dei seguenti elementi
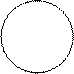
168O 178O 188O 198O à instabile e radioattivo
11H 21H 31H à instabile, radioattivo
126C 146C à instabile, radioattivo
Stabilità e instabilità dei nuclei
Alcuni nuclei sono molto stabili, altri invece tendono spontaneamente a disintegrarsi con emissione di particelle a, b o di raggi g. Bisogna tener presente che:
- La stabilità cresce con il numero di massa (fino a 60) poi diminuisce, ciò si spiega perchè fra le particelle che costituiscono il nucleo (protoni e neutroni) agiscono forze assai intense a corta distanza che riescono a vincere la repulsione tra le cariche + dei protoni. Queste forse, agendo a corta distanza sono efficaci nei nuclei piccoli. I grossi nuclei sono instabili perchè risentono meno delle forse nucleari, mentre cominciano a farsi sentire le forze coulombiane di repulsione fra protoni.
- Nell’ambito di uno stesso elemento sono più instabili quegli isotopi con A dispari
- La stabilità è proporzionale al rapporto protoni/neutroni. Perchè un isotopo sia stabile occorre che questo rapporto sia vicino a 1.
Massa atomica o peso atomico
Gli atomi hanno una massa reale e finita, ma diffcilmente esprimibile data la sua piccolezza. Abbiamo visto che la massa di un protone è di 1,67 x 10-27 kg. Essa corrisponde alla massa dell’atomo più leggero, l’atomo di H. L’atomo di Uranio, uno dei più pesanti ha massa di 397,5x10-27 kg.
Difetto di massa: si intende la piccolissima differenza che esiste fra il peso atomico calcolato sommando i pesi dei singoli protoni e neutroni (gli elettroni si tralasciano perchè troppo leggeri) e quello effettivamente riscontrato. Quest’ultimo è minore in quanto una minima frazione di massa è stata trasformata in energia per tenere unite le particelle nucleari.
Massa atomica i peso atomico relativo
Il peso atomico relativo di un elemento si ottiene prendendo in riferimento la 12ma parte della massa atomica del 12C, questa viene detta unità di massa atomica (uma) ed è pari a 1,66 x 10-27 kg, valore molto vicino alla massa atomica dell’atomo di H.
Esempio, se dico che il peso atomico relativo del Cloro è 35,45 significa che esso è 35,45 volte 1/12 del peso atomico del 12C .
Peso atomico assoluto o massa atomica assoluta: per conoscere il p.a. assoluto di un elemento (miscela isotopica) basta moltiplicare il suo p.a. relativo per 1,66 x 10-27 kg.
Spettrografo di massa
E’ un apparecchio di grande utilità nei laboratori di analisi e ricerca perchè permette di stabilire con esattezza e rapidità la massa atomica o molecolare di svariate sostanze che possono essere così identificate. Brevemente si può dire che funziona così:
Le molecole o gli atomi da analizzare vengono portati allo stato gassoso, poi bombardati con elettroni veloci. Essi si ionizzano positivamente. Gli ioni vengono fatti passare attraverso una fenditura. Il raggio che se ne ricava attraversa un campo magnetico e viene da questo deviato. Il valore della deviazione è tanto maggiore quanto più piccola è la massa dell’atomo. Le particelle deviate terminano su un collettore dove vengono registrate elettronicamente.
Atomo di Bohr
Con l’atomo di Rutherford non si riusciva a spiegare la complessa struttura degli spettri di emissione caratteristici per ogni elemento.
Un atomo come quello immaginato da Rutherford, in cui gli elettroni si muovevano in orbite non fisse, stimolato elettricamente o termicamente avrebbe dovuto emettere radiazioni di tutte le frequenze (spettro continuo) e non solo di alcune (spettro a righe).
Nel 1913 il fisico danese Bohr per spiegare lo spettro a righe dell’idrogeno ebbe un’idea audace: cominciò con l’ammettere che gli elettroni potessero muoversi solo su orbite particolari fisse e stabili. Richiamandosi poi alla teoria dei quanti di energia, Bohr fece notare che tutte le volte che l’atomo di H assorbe un “quanto” o pacchetto di energia (calore, radiazioni, scarica elettrica) il suo elettrone salta dall’orbita in cui si trova, quella più vicina al nucleo (detta stato stazionario o fondamentale), a quella immediatamente successiva. Se l’atomo assorbe due quanti o pacchetti di energia l’elettrone salta su un’orbita ancora più esterna e così via.
In questo modo Bohr introduceva il concetto di livelli di energia; zone intorno al nucleo occupate dagli elettroni. Tali livelli sono rigorosamente separati da un salto di energia, corrispondente ad un quanto. Una volta saltato l’elettrone ritorna immediatamente nel suo stato fondamentale e, ricadendo, l’emergia che aveva assorbito, viene riemessa quantizzata sotto forma di luce e radiazioni elettromagnetiche.
I punti fondamentali della T. Di Bohr validi in particolare per l’atomo di idrogeno,sono i seguenti:
- gli elettroni (uno solo per l’idrogeno) si muovono su orbite fisse, circolari intorno al nucleo
- gli elettroni con maggiore energia percorrono orbite più distanti dal nucleo
- ogni orbita rappresenta un valore definito di energia e non si può passare gradualmente da un orbita all’altra, ma solo per salti
- quando un elettrone passa da un orbita all’altra assorbe o emette energia uguale alla differenza di energia tra i due livelli.
Teoria atomica moderna
Nonostante il successo incontrato dalla Teoria di Bohr nello spiegare la costituzione dell’atomo di idrogeno, appena 10 anni più tardi, fu necessario modificarla in quanto essa non riusciva a spiegare gli spettri degli atomi con più elettroni.
Alla formulazione della teoria atomica moderna oltre a Bohr, hanno quindi contribuito altri fisici: De Broglie, Heisemberg, Schroedinger.
Ipotesi di De Broglie
Nel 1932 il fisico francese DeBroglie estese il concetto della duplice natura onda-particella, attribuita da Planck alla luce, a qualsiasi corpuscolo materiale affermando che, a ciascun corpo in movimento, grande o piccolo che sia, è associata una lunghezza d’onda.
L’energia del fotone è data dall’equazione di Planck:
E = h × c/l
Mentre l’energia di massa di un corpo qualsiasi è data dall’equazione di Einstein
E = mc2
Eguagliando le due equazioni abbiamo:
mc2 = h × c/l
da cui l = hc/mc2 = h/mc
De Broglie ipotizzò che questa relazione fosse valida per qualsiasi particella. Egli sostituì a c (velocità della luce) una velocità qualsiasi ed ottenne
l = h/mv
Successivi esperimenti mostrarono la validità di questi ipotesi: anche gli elettroni hanno proprietà ondulatorie, possono venir diffratti e dare luogo a fenomeni di interferenza.
Principio di indeterminazione di Heisemberg
Heisemberg, fisico tedesco, dimostrò che non è possibile determinare la posizione e la direzione di movimento dell’elettrone. Infatti se “illuminassimo” un elettrone per osservarlo e determinarne la direzione di movimento in un certo istante, l’interazione dei fotoni con l’elettrone farebbe in modo che una parte dell’energia di questi venisse ceduta all’elettrone stesso facendone variare la sua traiettoria. Questa legge è nota come “principio di indeterminazione di Heisemberg”. Essa ha come conseguenza che non è possibile definire la traiettoria dell’elettrone nell’atomo e ciò modifica la teoria di Bohr che prevedeva traiettorie definite per gli elettroni
Contributo di Schroedinger
Il fisico austriaco Schroedinger considerò la natura ondulatoria dell’elettrone scoperta da de Broglie e sviluppò un’equazione matematica per calcolare l’energia totale E posseduta da una particella che si muove in una direzione nello spazio, in funzione della sua energia potenziale e della sua massa. Egli dimostrò che per le particelle che si muovono liberamente (energia potenziale = 0) E può assumere qualsisi valore, quando si considerano particelle vincolate, cioè soggette a forse come gli elettroni nell’atomo, costretti a orbitare intorno al nucleo, l’equazione può essere risolta solo se E assume alcuni valori ben precisi. Egli riconfermava così il concetto di quantizzazione dell’energia degli elettroni atomici prevista da Bohr.
Riassumendo la Teoria atomica moderna si basa sui seguenti principi:
- gli elettroni non sono solo particelle, ma presentano anche carattere ondulatorio
- essi non seguono orbite ben definite intorno al nucleo: è infatti impossibile determinare la traiettoria di un elettrone
- un elettrone può assumere solo particolari valori di energia E, in altre parole i livelli energetici degli elettroni non possono variare con continuità, ma sono quantizzati.
In definitiva la T. atomica moderna non ci consente di creare una semplice immagine mentale dell’atomo.
Orbitali
Come è possibile rappresentare il moto di un elettrone se non si conosce la sua traiettoria intorno al nucleo?
Si può ricorrere, a questo scopo, ad un tipo di rappresentazione chiamata ORBITALE; esso può essere definito come quella zona intorno al nucleo nella quale c’è la massima probabilità (95%) di trovare l’elettrone.
L’orbitale ha:
- una dimensione (volume)
- una forma
- una direzione nello spazio (orientamento)
Ogni orbitale è caratterizzato in base a ciò da tre valori detti NUMERI QUANTICI:
n = numero quantico principale (n° d’ordine del livello energetico)
l = numero quantico secondario che determina la forma dell’orbitale
m = numero quantico magnetico
In ogni orbitale possono trovarsi al massimo due elettroni.
Pauli, fisico svizzero, dimostrò che: in un atomo non vi possono essere elettroni che abbiano tutti i numeri quantici uguali: poichè i due elettroni che occupano uno stesso orbitale hanno i tre numeri quantici che caratterizzano l’orbitali uguali, si dovrà introdurre un quarto numero quantico che differenzi l’uno dall’altro i due elettroni (principio di esclusione di Pauli). Tale numero è detto:
ms numero quantico di spin.
Autore: v.vannucchi
http://89.97.218.226/web1/chimica/files/struttura_atomo.doc
Atomo definizione
Visita la nostra pagina principale
Atomo definizione
Termini d' uso e privacy