Gas ideali
Gas ideali
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Gas ideali
Legge di Boyle
La pressione p è data dalla forza F che si esercita su una certa superficie divisa per l'area A di tale superficie. In questa sezione vogliamo studiare l'equilibrio dei gas e la pressione risulta essere una delle grandezze fondamentali in termini delle quali descrivere il comportamento di un gas ideale. Infatti quando le molecole del gas urtano contro le pareti del recipiente che le contiene esercitano una forza ed è questa forza che determina la pressione del gas.
Il volume V del gas invece coincide con il volume del recipiente che contiene il gas, dal momento che i gas non sono dotati di volume proprio. Accanto alla pressione p e al volume V, altre grandezze fisiche che caratterizzano un gas sono la temperatura T e la quantità di gas che indicheremo con il simbolo n. La mole, unità di misura fondamentale del Sistema Internazionale, è stata definita nel 1971 dal Comitato Internazionale dei Pesi e delle Misure come la quantità si sostanza di un sistema che contiene tante entità elementari quanti atomi sono contenuti in 0.012 kg di carbonio-12. In particolare, 1 mole corrisponde a 6.02 · 1023 molecole.
Quando un gas è in equilibrio la pressione p, il volume V, la temperatura T e la quantità di gas n non sono tutte grandezze fisiche indipendenti ma sono legate tra loro da certe relazioni che andremo ora ad esaminare in dettaglio.
Cominciamo con l'analizzare una trasformazione che avviene a temperatura T costante e a n costante. Se andiamo a comprimere il gas, riducendo il suo volume V, aumentano gli urti delle molecole con le pareti e conseguentemente aumenta la forza e la pressione esercitata dalle molecole sulle pareti. In questo caso la pressione p e il volume V del gas non sono grandezze indipendenti ma sono legate tra loro dalla relazione p · V = costante. Questa legge prende il nome di legge di Boyle. Pressione e volume a temperatura costante sono inversamente proporzionali: se raddoppiamo (triplichiamo) una delle due grandezze fisiche, l'altra si dimezza (diventa uguale a 1 / 3). Dal momento che nel Sistema Internazionale la pressione p si misura in N / m2 e il volume in m3, la costante che compare nella legge di Boyle si misura in N / m2 · m3 = N · m = J, ossia in joule.
Supponiamo invece di considerare un gas a pressione p e temperatura T fissate. Vale in questo caso la legge di Avogadro: una mole di gas occupa lo stesso volume, qualunque sia il tipo di gas che prendiamo in considerazione. Ad esempio, una mole di gas alla pressione p = 1 atm e alla temperatura T = 0°C occupa un volume V = 22.4 l = 22.4 dm3. È interessante osservare come questa proprietà sia totalmente indipendente dalla massa del gas: una mole di elio He2 ha una massa di 4 g, mentre una mole di ossigeno O2 ha una massa di 32 g. Ciò nonostante, entrambi i campioni di gas a 1 atm di pressione e a 0°C di temperatura occupano un volume di 22.4 l: tutte le leggi sui gas ideali dipendono dalla quantità di sostanza, intesa come numero di moli del gas, non dalla massa del campione.
Leggi di Gay-Lussac
Consideriamo un gas ideale a pressione costante. In questo caso il volume V e la temperatura TC, misurata in gradi Celsius, sono legati tra loro dalla seguente relazione: V = V0 (1 + a · TC) dove V0 è il volume occupato dal gas a 0 °C ed il coefficiente a = 1 / 273.15 °C-1.
Questa legge prende il nome di legge di Gay-Lussac. Dal grafico riportato nella figura sopra scopr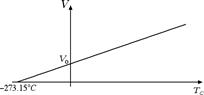 direttamente proporzionali.
direttamente proporzionali.
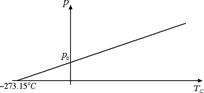 Esiste anche un'altra legge dovuta a Gay-Lussac: essa descrive il comportamento di un gas a volume costante ed è esattamente analoga alla precedente, ossia la pressione p e la temperatura in gradi Celsius TC sono legate tra loro dalla seguente relazione: p = p0 (1 + a · TC) dove p0 è la pressione del gas a 0 °C. La costante a = 1 / 273.15 °C-1 anche in questo caso.
Esiste anche un'altra legge dovuta a Gay-Lussac: essa descrive il comportamento di un gas a volume costante ed è esattamente analoga alla precedente, ossia la pressione p e la temperatura in gradi Celsius TC sono legate tra loro dalla seguente relazione: p = p0 (1 + a · TC) dove p0 è la pressione del gas a 0 °C. La costante a = 1 / 273.15 °C-1 anche in questo caso.
Anche in questo caso la pressione diventa uguale a 0 a -273.15 °C e la legge può essere riscritta in termini della temperatura in gradi Kelvin T come p = p0 · T / T0, ossia a volume costante, abbiamo che la pressione e la temperatura assoluta di un gas ideale sono direttamente proporzionali.
Equazione di stato dei gas perfetti
In questa sezione vogliamo vedere come esista il modo per riassumere in un'unica equazione la legge di Boyle, la legge di Avogadro e le leggi di Gay-Lussac. Prima di ricavarci questa equazione vogliamo rappresentare la legge di Boyle e la legge di Gay-Lussac nel piano di Clapeyron. Il piano di Clapeyron è un diagramma cartesiano che ha in ascissa il volume e in ordinata la pressione del gas. Un gas viene ad essere univocamente determinato da un punto nel piano di Clapeyron: infatti la quantità di gas n è un numero generalmente fissato e, come vedremo derivando la legge dei gas perfetti, la conoscenza della pressione p e del volume V determina in maniera univoca la temperatura T del gas.
Il grafico della legge di Boyle sul piano di Clapeyron è dato da un ramo d'iperbole. Le leggi di Gay-Lussac sono rappresentate invece da due semirette parallele agli assi cartesiani.
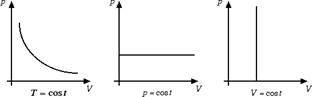
Supponiamo di considerare una mole di gas e di partire da un certo punto (p0, V0) del piano di Clapeyron caratterizzato da pressione p0 = 1 atm e volume V0 = 22.4 l. Se invece di avere una mole di gas ne abbiamo n l'equazione che caratterizza i gas diventa:
p · V = n · R · T.
Questa è l'equazione di stato dei gas perfetti, valida a patto di esprimere la temperatura T in gradi Kelvin. Tale equazione riassume in sé tutte le altre equazioni. Infatti a T costante ritroviamo la legge di Boyle: p · V = costante. A V costante riotteniamo che p è proporzionale a T mentre a p costante riotteniamo che V è proporzionale a T, ossia le due leggi di Gay-Lussac.
Fonte: http://digilander.libero.it/quantum2008/APPUNTI/dispense%20di%20fisica%20II.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Gas ideali tipo file : doc
Gas ideale
Visita la nostra pagina principale
Gas ideali
Termini d' uso e privacy