Fisiologia del cuore
Fisiologia del cuore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Fisiologia del sistema cardiocircolatorio
Caratteristiche strutturali del cuore e ciclo cardiaco
Il cuore è costituito da due pompe separate: quella di destra che spinge il sangue verso i polmoni e quella di sinistra che spinge il sangue negli organi periferici. Le due parti constano di due pompe pulsatili definite atrio e ventricolo di destra e di sinistra. L’atrio funziona principalmente come una debole pompa che aiuta il sangue a passare nei ventricoli. Il ventricolo, invece, genera la massima forza per spingere il sangue nella circolazione polmonare o sistemica.
Dal punto di vista anatomico, il cuore è formato da due sincizi: quello atriale e quello ventricolare. I potenziali d’azione insorgono spontaneamente nel nodo seno atriale (S-A) e quindi dal sincizio atriale e si portano al sincizio ventricolare attraverso un sistema specializzato nella conduzione definito fascio atrio-ventricolare (A-V). La divisione del miocardio in due sincizi funzionali permette agli atri di contrarsi 0.1 secondi prima dei ventricoli e pertanto di pompare sangue nei ventricoli prima che in essi si verifichi la contrazione . Tale fatto è efficace per l’azione pompante del cuore: gli atri fungono da pompa di innesco per i ventricoli che poi generano quella forza atta a spingere il sangue nel sistema vascolare.
Il ciclo cardiaco è costituito da tutti quei fenomeni che avvengono dall’inizio di un battito all’inizio del successivo. Il ciclo cardiaco è costituito da:
- diastole, periodo di rilasciamento nel quale il cuore si riempie
- fase di rilasciamento: (III)
- fase di riempimento: (IV)
- sistole, periodo di contrazione
- fase di tensione: (I)
- fase di eiezione: (II)
Le valvole cardiache determinano la direzione del flusso all’interno del cuore, ovvero il sangue passa dagli atri ai ventricoli (IV) e da questi rispettivamente nell’aorta e nell’arteria polmonare (II). Durante le fasi I e III tutte le valvole sono chiuse. L’apertura e la chiusura delle valvole vengono determinate dalle pressioni che si sviluppano su entrambi i lati delle valvole stesse; vengono chiuse e/o aperte quindi passivamente. Per ragioni strutturali anatomiche la chiusura si verifica quando c’è un gradiente pressorio che spinge il sangue indietro e l’apertura nel caso opposto. Gli alti valori pressori presenti nelle arterie al termine della sistole ventricolare fanno sì che tali valvole si chiudano di scatto e non in maniera dolce come quelle A-V.
Le valvole A-V, cioè la mitrale e la tricuspide impediscono il flusso retrogrado del sangue dai ventricoli agli atri durante la fase di sistole, e le valvole S-L, cioè l’aortica e la polmonare impediscono il flusso retrogrado dall’aorta e dalle arterie polmonari verso i ventricoli durante la fase di diastole.
I muscoli papillari che si inseriscono ai lembi delle valvole A-V per mezzo delle corde tendinee, si contraggono simultaneamente alle pareti ventricolari e, in contrasto a quanto ci si potrebbe aspettare, non aiutano le valvole a chiudersi bensì tirano i lembi internamente verso i ventricoli al fine di prevenire un rigonfiamento troppo consistente verso gli atrii.
Relazione dell’ECG con il ciclo cardiaco
Onda P: il nodo S-A propaga l’eccitazione
Onda Q: eccitazione del ventricolo
Onda R: eccitazione del ventricolo
Onda S: eccitazione del ventricolo
Onda T: fase di ripolarizzazione, le fibre ventricolari iniziano a rilasciarsi
Variazioni pressorie negli atri
Onda a: è causata dalla contrazione atriale che segue all’onda P dell’ECG
Onda c: si verifica quando iniziano a contrarsi i ventricoli. È causata dallo spostamento delle valvole A-V verso gli atri, generato dall’incremento pressorio ventricolare
Onda v: si osserva nella fase finale della contrazione ventricolare ed è causata dal lento fluire del sangue negli atri nelle vene
Il riempimento ventricolare avviene in tre fasi:
- Riempimento ventricolare passivo rapido (IVa): quando la sistole ha termine, il moderato aumento pressorio negli atri induce una brusca apertura delle valvole A-V ed il sangue che si era accumulato durante la fase di sistole ventricolare negli atri fluisce rapidamente nei ventricoli
- Riempimento ventricolare passivo o diastasi (IVb): fluisce poi nei ventricoli soltanto una piccola quantità di sangue che rappresenta quella parte che, in maniera continua, arriva agli atri dalle vene e passa direttamente nei ventricoli. Nelle prima due fasi circa il 75% del sangue è entrato nel ventricolo
- Sistole atriale (IVc): la contrazione atriale provoca un riempimento supplementare dei ventricoli che si aggira su un volume del 25%. Gli atri fungono pertanto semplicemente come pompe di innesco in quanto incrementano il pompaggio ventricolare.
Durante la fase di diastole, il riempimento dei ventricoli porta il volume a valori di 110-120 ml di sangue (volume telediastolico).
Lo svuotamento ventricolare avviene in due fasi:
- contrazione isovolumetrica (I): la pressione cresce subito dopo l’inizio della contrazione ventricolare e ciò causa la chiusura delle valvole A-V. Le valvole semilunari (S-L) aortica e polmonare sono chiuse in quanto, pur essendoci contrazione, il ventricolo non ha sviluppato una pressione tale da aprirle. Non v’è lo svuotamento dei ventricoli.
- eiezione (II): quando la pressione del ventricolo sinistro supera di poco gli 80mmHg e nel destro gli 8 mmHg, rispettivamente le pressioni esistenti in aorta e nell’arteria polmonare, si aprono le valvole semilunari. Il sangue esce in due periodi:
- periodo di eiezione rapida (IIa): porta il 70% dello svuotamento. È caratterizzata da un brusco aumento della pressione ventricolare e aortica, da una riduzione più rapida del volume ventricolare e da un flusso ematico aortico maggiore.
- periodo di eiezione lenta (IIb): porta il restante 30 % dello svuotamento. Durante questo periodo il deflusso di sangue dall’aorta verso la periferia supera l’eiezione ventricolare e, pertanto la pressione aortica declina.
Durante la fase di sistole, lo svuotamento ventricolare determina una diminuzione del volume di circa 70 ml. Tale quantità è definita gittata sistolica, la parte del volume telediastolico che viene eiettata è definita frazione di eiezione e di norma ammonta a circa il 60%. Il rimanente volume di sangue presente in ciascun ventricolo, cioè circa 40-50ml, è definito telesistolico (volume residuo).
- rilasciamento isovolumetrico (III): al termine della sistole ventricolare inizia il rilasciamento e la pressione cade velocemente. Il miocardio ventricolare continua a rilasciarsi sebbene il volume non vari. Gli alti valori pressori presenti nelle grosse arterie distese spingono il sangue verso i ventricoli e tendono a chiudere le valvole S-L aortica e polmonare. Quando la pressione nel ventricolo cadrà poi verso i bassi valori diastolici si apriranno anche le valvole A-V ed inizia un nuovo ciclo di pompaggio. Il periodo tra la chiusura delle valvole S-L e l’apertura delle valvole A-V è chiamato rilasciamento isovolumetrico ed è caratterizzatola una rapidissima caduta della pressione ventricolare, senza variazione del volume.
L’ingresso nel sangue nelle arterie provoca uno stiramento delle loro pareti e la pressione sale. Quando la valvola aortica si chiude si registra un incisura nella curva, data dal breve flusso retrogrado che si ha subito prima della chiusura, seguita poi da una rapida cessazione del riflusso. La pressione aortica, durante la diastole, decresce lentamente. Prima della successiva contrazione ventricolare la pressione aortica scende a circa 80 mmHg (valore diastolico) per poi salire durante la sistole ai 120 mmHg (valore sistolico).
Quando le valvole si chiudono, i lembi delle stesse ed i fluidi circostanti vibrano per il gradiente pressorio che si sviluppa. Tali fenomeni generano suoni o rumori che si propagano in tutte le direzioni nel torace. Durante il ciclo cardiaco si percepiscono tre suoni:
- primo tono: ha una bassa frequenza ed è di lunga durata. È causato dalla chiusura delle valvole A-V durante la sistole ventricolare.
- secondo tono: uno scatto di breve durata. È causato dalle valvole S-L che si chiudono velocemente al termine della sistole
- terzo tono: si percepisce verso il termine del primo terzo della diastole ed è causato dal moto di tipo turbolento con cui il sangue fluisce nei ventricoli quasi del tutto riempiti.
- quarto tono: si sviluppa quando gli atri si contraggono e si presume sia originato dalla irruzione di sangue nei ventricoli
La pompa cardiaca
Il lavoro del cuore è dato dalla quantità di energia che viene trasformata in lavoro per ogni singolo battito allorché il sangue viene spinto nelle arterie. Il lavoro cardiaco al minuto è uguale al valore del lavoro prodotto da una singola sistole, moltiplicato per la frequenza di battiti al minuto. Nel cuore la produzione di lavoro è di due tipi:
- lavoro esterno (volume-pressione): serve a spingere il sangue dalle basse pressioni venose alle alte pressioni arteriose.
- energia cinetica del flusso sanguigno: serve per accelerare il flusso in eiezione attraverso le valvole S-L
Il lavoro esterno del ventricolo destro è circa un sesto di quello del ventricolo di sinistra.
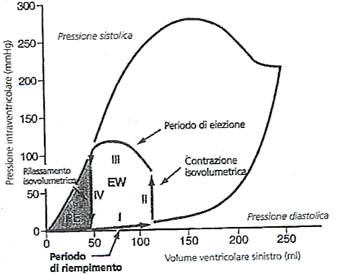
Vediamo su un diagramma “volume-pressione” il ciclo cardiaco:
Periodo di riempimento (I): inizia ad un volume di circa 45 ml (volume telesistolico) ad una pressione diastolica di 0 mmHg. Al fluire del sangue dall’atrio al ventricolo il volume arriva a circa 115 ml (volume telediastolico) e la pressione diastolica a circa 5 mmHg.
Contrazione isovolumetrica (II): il volume non varia poiché tutte le valvole sono chiuse. La pressione intraventricolare cresce fino a raggiungere il valore della pressione aortica di 80 mmHg.
Periodo di eiezione (III): la pressione sistolica aumenta ancora e supera quella aortica. Vi è una diminuzione del volume poiché la valvola S-L aortica si è aperta e sangue esce dal ventricolo.
Rilassamento isovolumetrico (IV): la valvola S-L aortica si chiude e la pressione intraventricolare scende verso il valore diastolico, senza però variare nel volume.
L’area indicata con EW, nel diagramma volume-pressione, mostra il lavoro netto di gittata del ventricolo sinistro. L’area compresa nel diagramma del lavoro si ingrandisce quando il cuore pompa elevate quantità di sangue. Essa si estende verso destra se il ventricolo si riempie di più (viene aumentato il pre-carico) e verso l’alto se vengono generate pressioni maggiori (viene aumentato il post-carico), ma può anche estendersi verso sinistra se il ventricolo si contrae a volumi minori.
Rivediamo ora il concetto di precarico e di postcarico e riportiamolo al cuore:
- precarico: indica il grado di tensione raggiunto da un muscolo allorché esso inizia a contrarsi. Per quanto riguarda la contrazione del miocardio, come precarico si considera la pressione telediastolica ventricolare, ovvero quella pressione causata dal riempimento ventricolare in cui vi è un progressivo aumento della quantità di sangue, prima che vi sia la contrazione.
- postcarico: indica il carico contro cui viene esercitata la forza di contrazione. Per quanto riguarda la contrazione del miocardio, come postcarico si considera il valore di pressione dell’arteria che si diparte dal ventricolo preso in considerazione.
Nella contrazione ventricolare, gran parte dell’energia chimica è convertita in calore ed il resto in lavoro di gittata. Il rapporto tra lavoro e spesa energetica e definito rendimento e il suo valore massimo, in condizioni normali, è tra il 20 ed il 25%.
Se una persona si trova in condizioni di riposo, il cuore pompa soltanto dai 4 ai 6 litri di sangue al min. Durante un intenso esercizio muscolare, al cuore può essere richiesto di pompare da 4 a 7 volte tale quantità. Il cuore può far fronte a tali aumenti di gittata attraverso due meccanismi:
- una regolazione intrinseca nell'azione di pompa in risposta a variazioni nel volume del flusso ematico: la quantità di sangue pompata dal cuore in ogni minuto è in relazione al flusso che torna al cuore attraverso le vene o ritorno venosa. La capacità intrinseca del cuore ad adattarsi a variazioni nel flusso venoso di ritorno è definito legge di Frank-Starling . Fondamentalmente, il meccanismo di Frank-Starling mostra che più il miocardio viene stirato dal riempimento, più alta sarà la sua forza di contrazione e pertanto più alta sarà la quantità di sangue pompata nelle arterie. In altre parole si può dire che: entro limiti fisiologici, il cuore pompa tutto il sangue che ricéve senza che si verifichi un eccessivo ristagno nelle vene. Quando infatti una quantità extra di sangue fluisce nei ventricoli, il miocardio viene stirato ad una maggiore lunghezza. Ciò causa un aumento della forza di contrazione poiché i miofilamentì di aerina e miosina si interdigitano in condizioni ottimali per generare forza. Inoltre, lo stiramento della parete dell’atrio destro induce un aumento dal 10 al 20% della frequenza cardiaca. Al crescere della pressione atriale vi è quindi un rispettivo aumento della gittata ventricolare per minuto. Quindi se il ventricolo si riempie a pressioni striali più alte, il volume ventricolare, la forza ventricolare e la frequenza do contrazione aumentano e il cuore pompa più sangue nelle arterie.
- controllo dell'attività cardiaca da parte del sistema nervoso autonomo: l’azione di pompa è strettamente controllata da:
- fibre nervose ortosimpatiche: una loro intensa stimolazione può determinare un aumento della frequenza cardiaca che può raggiungere valori di 180-200 battiti/min e nel giovane anche a 250 battiti/min. Inoltre, la stimolazione ortosimpatica induce un aumento della forza di contrazione del miocardio per cui sia il volume di sangue eiettato che la pressione di eiezione aumentano. In tal modo, la stimolazione orto-simpatica può raddoppiare o anche triplicare la gittata cardiaca. L'inibizione delle fibre nervose ortosimpatiche può invece essere utilizzata per ridurre in maniera moderata l’azione di pompa del cuore poiché quando l'attività del sistema nervoso ortosimpatico viene depressa, diminuiscono sia la frequenza cardiaca che la forza di contrazione ventricolare (l'azione di pompa si riduce del 30%).
- fibre nervose parasimpatiche (vagali): Una forte stimolazione vagale può arrestare il battito cardiaco per alcuni secondi, pòi però il cuore non risente più di tale stimolazione, eludendo cioè la scarica vagale e dando origine al fenomeno conosciuto come "fuga dal vago", fino a battere ad una frequenza che va dai 20 ai 40 battiti/min. Un'intensa stimolazione vagale può far diminuire inoltre la forza della contrazione cardiaca dal 20 al 30%. Queste risposte portano ad un decremento nell'azione di pompa ventricolare, che supera il 50%.
Anche le concentrazioni di ioni nel liquido extracellulare hanno effetti importanti sull'azione di pompa del cuore:
- ioni potassio: L'eccesso di potassio causa nel cuore un'estrema dilatazione, per cui esso diviene flaccido e rallenta la sua frequenza. Alte quantità di potassio possono anche portare ad un blocco della conduzione degli impulsi dagli atri ai ventricoli attraverso il fascio A-V. Questi effetti sono dovuti al fatto che vi è una diminuzione nel valore del potenziale di membrana delle fibre miocardiche. A tale diminuzione segue una minor ampiezza del potenziale d'azione e un progressivo indebolimento della forza di contrazione.
- ioni calcio: L'eccesso di ioni calcio ha effetti che sono esattamente all'opposto di quelli riportati per gli ioni potassio. Infatti il cuore va incontro ad una contrazione di tipo spastico in quanto vi è un effetto diretto degli ioni calcio nell'eccitare il processo contrattile. Per contro, una carenza di ioni calcio porta a flaccidità cardiaca. A causa del fatto che i livelli di ioni calcio, nel sangue, sono di norma regolati entro limiti piuttosto ristretti, gli effetti sul cuore di anormali concentrazioni di tale ione raramente sono d'interesse clinico.
Anche un aumento della temperatura corporea, come nella febbre, induce un forte aumento della frequenza cardiaca che, talvolta, può anche raddoppiare rispetto al valore normale. Una diminuzione causa invece un forte calo della frequenza. Questi effetti si manifestano per il fatto che il calore induce un aumento della permeabilità di membrana delle fibre miocardiche agli ioni a cui consegue un'accelerazione nel processo dì eccitazione cardiaca. Un modesto aumento della temperatura di solito porta ad un incremento della forza contrattile del cuore, ma se la temperatura rimane elevata le riserve metaboliche si esauriscono e si verifica così un indebolimento della forza di contrazione cardiaca.
II cuore è dotato di un sistema specializzato per:
- generare ritmicamente impulsi
- condurre questi impulsi nel miocardio a velocità ben determinate, inducendo il miocardio a contrarsi ritmicamente e permettendo a tutte le parti dei ventricoli di contrarsi in modo praticamente simultaneo in modo da creare un'opportuna pressione nelle cavità cardiache.
Se questo sistema funziona normalmente la contrazione atriale avviene circa 0,17 secondi prima di quella ventricolare. Ciò permette un riempimento supplementare dei ventricoli prima che essi eiettino il sangue verso la periferia.
Il sistema specializzato per la generazione ritmica dell'impulso e per la conduzione, che controlla le contrazioni cardiache, è formato da:
- il nodo senoatriale (S-A), nel quale si genera il normale impulso ritmico;
- la via internodale attraverso la quale l'impulso viene condotto dal nodo S-A al nodo atrioventricolare (A-V);
- il nodo atrioventricolare (A-V) dove l'impulso rallenta, prima di invadere i ventricoli;
- il fascio atrioventricolare (A—V) che conduce l'impulso dagli atri ai ventricoli;
- i fasci sinistro e destro, o branche, delle fibre del Purkinje che propagano l'impulso a tutte le partì dei ventricoli.
Il nodo S-A si trova nella parete superiore laterale dell'atrio dèstro subito sotto e poco lateralmente allo sbocco della vena cava superiore. Le fibre di questo nodo non hanno filamenti contrattili e sono più piccole di quelle miocardiche, hanno infatti un diametro che va dai 3 a 5 mm. Le fibre del nodo S-A si connettono direttamente con quelle atriali, ed in tal modo ogni potenziale di azione che vi origina diffonde istantaneamente negli atri. Queste fibre hanno la capacità di autoeccitarsi, un processoche induce una scarica ritmica automatica a cui segue la contrazione. Per questa ragione, il nodo S-A controlla la frequenza cardiaca.
Prima di spiegare la proprietà dell’autoritmicità delle fibre del nodo S-A è necessario ritornare sui tre tipi di canali ionici che svolgono un ruolo determinante nel potenziale d’azione:
- i canali rapidi per il sodio: l'apertura di questi canali dura pochi decimillesimi di secondi e provoca la rapida salita iniziale verso il picco del potenziale d'azione, in quanto vi è un rapido ingresso di cariche positive nelle fibre miocardiche.
- i canali lenti per il sodio ed il calcio: l'apertura di questi canali dura alcuni decimi di secondo e porta alla fase di "plateau". Determinano una ulteriore entrata di cariche positive.
- i canali per il potassio: l'apertura di questi canali e la conseguente diffusione di cariche positive all'esterno delle fibre determina il ritorno al valore di riposo del potenziale di membrana.
Il potenziale di membrana della fibra del nodo S-A mostra una negatività di soli -55, -60 mV, mentre nella fibra muscolare miocardica essa è di -85, -90 mV. Tale ridotta negatività è dovuta al fatto che la membrana delle fibre del nodo S-A è più permeabile agli ioni sodio e pertanto le cariche positive portate intracellularmente da questi ioni neutralizzano la negatività che si trova all'interno della fibra stessa.
Per il basso valore di negatività, cioè soltanto -55 mV, vi è una differenza nel comportamento dei canali rapidi per il sodio che sono bloccati. Possono dunque venire attivati o aprirsi soltanto i canali lenti calcio-sodio che sono qui gli unici responsabili della genesi del potenziale d'azione. Di conseguenza il potenziale d'azione si sviluppa più lentamente che nel miocardio ventricolare e mostra anche un più lento decremento.
A causa dell'alta concentrazione di ioni sodio nel liquido extracellulare e della carica elettrica negativa all'interno delle fibre del nodo S-A, gli ioni sodio positivi tendono a portarsi verso l'interno. Inoltre, a riposo, le fibre nodali mostrano un numero esiguo di canali aperti per gli ioni sodio. Pertanto, l'ingresso di ioni sodio positivi induce un lento innalzamento del potenziale di membrana. In tal modo il valore del potenziale di "riposo" cresce gradualmente tra un battito e l'altro. Quando esso arriva ad un voltaggio-soglia di circa - 40 mV, si attivano i canali calcio-sodio e il rapido ingresso di cariche positive genera il potenziale d'azione. Pertanto, fondamentalmente, è la scarsa capacità della membrana delle fibre del nodo S-A a trattenere gli ioni sodio che sta alla base del meccanismo di autoeccitazione.
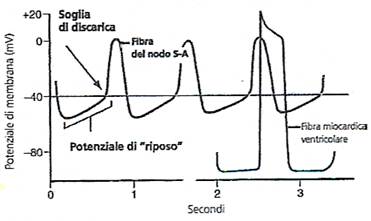 I canali calcio-sodio vengono inattivati e si chiudono dopo circa 100-150 millisecondi dalla loro apertura e poi, in un lasso di tempo approssimativamente uguale, aumenta molto il numero di canali che si aprono per il potassio. Pertanto, cessa l'ingresso nella fibra di ioni calcio e sodio positivi ed escono ioni potassio positivi e ciò porta a terminare il potenziale d'azione. Inoltre, i canali del potassio prolungano là loro apertura per alcuni altri decimi di secondo. Ciò induce un eccesso di flusso di cariche positive all'esterno della fibra che si accompagna ad un'aumentata negatività all'interno. Il fenomeno è definito iperpolarizzazìone. Essa, al termine del potenziale d'azione, porta il valore dal potenziale di membrana a circa -55, -60 mV.
I canali calcio-sodio vengono inattivati e si chiudono dopo circa 100-150 millisecondi dalla loro apertura e poi, in un lasso di tempo approssimativamente uguale, aumenta molto il numero di canali che si aprono per il potassio. Pertanto, cessa l'ingresso nella fibra di ioni calcio e sodio positivi ed escono ioni potassio positivi e ciò porta a terminare il potenziale d'azione. Inoltre, i canali del potassio prolungano là loro apertura per alcuni altri decimi di secondo. Ciò induce un eccesso di flusso di cariche positive all'esterno della fibra che si accompagna ad un'aumentata negatività all'interno. Il fenomeno è definito iperpolarizzazìone. Essa, al termine del potenziale d'azione, porta il valore dal potenziale di membrana a circa -55, -60 mV.
C'è da spiegare infine perché tale nuovo stato di iperpolarizzazione non perduri. La ragione è che, alcuni decimi di secondo dopo il potenziale d'azione, un numero progressivamente crescente di canali per il potassio inizia a chiudersi. Ora, gli ioni sodio, per via della bassa tenuta di membrana, ancora una volta sbilanciano il flusso verso l'esterno degli ioni potassio. In tal modo, il valore del potenziale è nuovamente risospinto verso i -40 mV, cioè al livello soglia per la genesi di un nuovo potenziale d'azione. Dopo di che, l'intero processo ricomincia: autoeccitazione, recupero dal potenziale d'azione, iperpolarìzzazione, spinta del potenziale verso il valore soglia, ancora eccitazione e così via.
La parte terminale delle fibre del nodo S-A si fonde con le circostanti fibre del miocardio atriale, che vengono invase dai potenziali d'azione originati nel nodo stesso. In tal modo, il potenziale d'azione si diffonde a tutta la massa muscolare atriale e al nodo A-V. La velocità di conduzione nel miocardio atriale è di circa 0,3 m/sec. Vi sono poi alcuni piccoli fasci formati da fibre miocardiche atriali:
- il fascio anteriore interatriale, passa attraverso le pareti anteriori degli atri all'atrio di sinistra e conduce l'impulso cardiaco ad una velocità dì circa 1 m/sec.
- I fasci internodali anteriore, media e posteriore, si incurvano nelle pareti atrìali e terminano nel nodo A-V, conducendo anche essi l'impulso ad alta velocità.
La causa della più alta velocità di conduzione, in tali fasci, sta nella presenza di un certo numero di fibre specializzate nella conduzione che sono frammiste a quelle miocardiche atriali. Tali fibre sonò simili a quelle a rapida conduzione del Purkinje presenti nei ventricoli.
Nonostante alcune componenti del cuore, in particolare fibre del nodo A-V e fibre del Purkinje, possano dare origine ad eccitazioni ritmiche. Il nodo S-A guida il battito cardiaco in quanto la sua intrinseca e ritmica frequenza di scarica (circa 70-80/min) è più alta di quella di qualsiasi altra parte del cuore (dai 40 ai 60 impulsi/min le fibre del nodo A-V; dai 15 ai 40 impulsi/minle fibre del Purkinje) . In altri termini, il nodo S-A eccita le altre due strutture prima che queste possano autoeccitarsi. è il primo ad eccitarsi, il primo a ripolarizzarsi e quindi il primo a rieccitarsi. Per tale motivo, il nodo S-A viene definito come il normale avviatore o pacemakercardiaco. In alcuni casi qualche altra parte del cuore sviluppa una scarica ritmica di frequenza più alta di quella del nodo S-A. Un avviatore che si trovi in una parte diversa del nodo S-A è definito ectopico. Esso genera un'anormale sequenza di contrazioni in diverse parti del cuore e può causare un notevole effetto debilitante per l'azione di pompa. Un'altra causa atta a generare degli avviatori ectopici è il blocco della conduzione degli impulsi dal nodo S-A alle altre parti del cuore. Il nuovo avviatore diventa spesso il nodo A-V o la porzione penetrante del fascio A-V.
I1 sistema di conduzione è organizzato in modo tale che l'impulso cardiaco non possa propagarsi dagli atri ai ventricoli troppo velocemente: vi è infatti un ritardo nella propagazione che permette agli atri di completare il riempimento ventricolare prima che inizi la contrazione. Il ritardo si ha nel nodo atrio-ventricolare e nelle fibre di conduzione adiacenti allo stesso. Il nodo A-V è posto nella parete posteriore del setto dell'atrio destro, dietro alla valvola tricuspide e vicino all'apertura del seno coronario. L'impulso, dopo essersi propagato lungo le vie internodali, arriva al nodo A-V in circa 0,03 secondi. Vi è poi un ulteriore ritardo di 0,09 secondi nel nodo A-V stesso prima che l'impulso invada la porzione di accesso del fascio atrio-ventricolare, attraverso la quale esso si porta ai ventricoli. Un ultimo ritardo di 0,04 secondi si ha in tale parte del fascio A-V che è costituita da molteplici fascicoli che passano attraverso il tessuto fibroso che separa gli atri dai ventricoli.
In conclusione, il ritardo totale nel nodo A-V e nel sistema del fascio A-V è di circa 0,13 secondi. Inoltre considerando anche il ritardo iniziale nella conduzione, dal nodo S-A al nodo A-V, che è di circa 0,03 secondi, si ottiene un tempo di ritardo complessivo di 0,16 sec.
Il motivo di questa conduzione estremamente lenta è dovuto al fatto che:
- la dimensione delle fibre del è molto minore di quella delle fibre miocardiche atriali.
- queste fibre hanno valori del potenziale di membrana che sono molto meno negativi rispetto a quelli presenti in altre fibre miocardiche.
- vi sono poche giunzioni che connettono tra di loro le cellule miocardiche formanti la via. Pertanto, vi è una forte resistenza alla conduzione di ioni eccitatori da una cellula alla successiva.
In tal modo, sia il basso voltaggio indotto dalle correnti ioniche che l'alta resistenza al movimento degli ioni stessi sono cause che fanno facilmente capire perché le cellule poste in successione vadano in eccitazione in maniera così lenta.
Le fibre del Purkinjeoriginano dal nodo A-V e attraverso il fascio A-V si portano ai ventricoli; esse mostrano caratteristiche funzionali diametralmente opposte a quelle che costituiscono il nodo A-V. Queste fibre sono di grossa dimensione, e conducono i potenziali d'azione ad una velocità che va da 1,5 a 4 m/sec. permettendo una trasmissione praticamente immediata dell'impulso cardiaco attraverso l'intero sistema ventricolare. La causa della trasmissione rapida nelle fibre del Purkinje potrebbe essere dovuta ad un alto livello di permeabilità nelle giunzioni dei dischi intercalari presenti tra le cellule in successione. Pertanto, gli ioni passano facilmente da una cellula all'altra e ciò induce un'alta velocità di trasmissione. Le fibre del Purkinje presentano anche poche miofibrille per cui al passaggio dell'impulso esse si contraggono molto debolmente.
La parte distale del fascio A-V discende nel setto ventricolare portandosi verso l’apice del cuore dove poi si divide nelle branche sinistra e destra. Queste si sfioccano poi in piccole diramazione che decorrono attorno alla cavità ventricolare e poi risalgono verso la base del cuore. Quando l'impulso arriva al termine delle fibre del Purkinje, esso invade dunque l'intero ventricolo attraverso le fibre miocardiche. La velocità di propagazione è ora soltanto di 0,3-0,5 m/sec. La muscolatura miocardica è organizzata con strati aventi un decorso a una doppia spirale, con setti fibrosi posti tra gli strati stessi.
Pertanto, l'impulso cardiaco non si propaga direttamente verso la superficie esterna ventricolare, ma segue la direzione delle spire propagandosi così in maniera obliqua richiedendo un tempo di altri 0,03 secondi. Così, il tempo totale per la propagazione dell'impulso cardiaco dalla parte iniziale delle due branche alle ultime fibre miocardiche atriali si aggira su un valore di circa 0,06 secondi.
Dalla descrizione del sistema di Purkinje appena fatta, si comprende facilmente che l'impulso cardiaco investe tutte le parti dei ventricoli in un brevissimo lasso di tempo. Infatti, le prime fibre miocardiche ventricolari vanno in eccitazione soltanto 0,03- 0,06 secondi prima delle ultime per cui ciascuna porzione muscolare si contrae di fatto nel medesimo istante, restando poi contratta per circa 0,3 secondi. Questo tipo di contrazione sincrona è particolarmente efficace per l'azione della pompa ventricolare.
Il cuore è innervato sia da fibre nervose di tipo ortosimpatico che di tipo parasimpatico.
Le fibre del parasimpatico, appartenenti al nervo vago, si distribuiscono principalmente al nodo S-A e a quello A-V, in misura minore al miocardio atriale e pochissimo a quello ventricolare. La stimolazione delle fibre nervose parasimpatiche vagali che innervano il cuore induce una liberazione dalle terminazioni nervose di acetilcolina. Questo neurotrasmettitore ha due importanti effetti sul cuore.
- deprime la frequenza di scarica del nodo S-A
- diminuisce l'eccitabilità delle fibre giunzionali poste tra il miocardio atriale ed il nodo A-V: aumenta fortemente la permeabilità della membrana al potassio e tale ione diffonde rapidamente all'esterno delle fibre generando un aumento della negatività all'interno delle fibre (-65, -75 mV) o iperpolarizzazione, che porta ad una diminuzione dell'eccitabilità.
In tal modo viene rallentata la trasmissione dell'impulso cardiaco verso i ventricoli Una lieve stimolazione vagale può anche dimezzare la frequenza del battito, mentre in caso di forte stimolazione può essere completamente bloccata la scarica ritmica del nodo S-A ed anche la propagazione dell'impulso attraverso la giunzione A-V. In ambedue i casi, gli impulsi ritmici non vengono più trasmessi ai ventricoli che cessano di battere per 5-20 secondi. Poi, qualche componente del sistema delle fibre del Purkinje, posto di norma nella porzione sellale del fascio A-V, sviluppa un proprio ritmo e, pertanto, i ventricoli possono contrarsi ad una frequenza che va dai 15 ai 40/min., dando origine a quel fenomeno che viene definito "fuga ventricolare dal vago".
Le fibre ortosimpatiche invece si distribuiscono a tutte le parti del cuore, e sono particolarmente abbondanti nel miocardio ventricolare. La stimolazione ortosimpatica provoca di fatto effetti, sul cuore, opposti a quelli descritti per la stimolazione parasimpatica vagale:
- determina un aumento della frequenza di scarica del nodo S-A
- aumenta la velocità di conduzione e così il grado di eccitabilità in tutte le parti del cuore
- incrementa di molto la forza di contrazione del miocardio sia atriale che ventricolare.
In sintesi, la stimolazione ortosimpatica stimola le proprietà di tutto il cuore, fino a quasi triplicare la frequenza del battito e più che raddoppiare la forza di contrazione in caso di stimolazione massimale.
La stimolazione delle fibre nervose ortosimpatiche induce una liberazione dalle terminazioni di noradrenalìna e si suppone che essa aumenti la permeabilità di membrana al sodio e al calcio. Nel nodo S—A, una maggiore permeabilità al sodio genera fa diventare più positivo il valore del potenziale di "riposo" e aumenta la velocità della depolarizzazione fino al valore soglia per lo sviluppo del potenziale d'azione ritmico. In tal modo si ha una accelerazione del processo di autoeccitazione con conseguente aumento della frequenza cardiaca.Nel nodo A-V, l'aumento della permeabilità di membrana al sodio facilita la propagazione dell'impulso tra le fibre dì conduzione e ciò porta ad un aumento nella velocità di conduzione tra atri e ventricoli. La maggiore permeabilità agli ioni calcio è almeno in parte responsabile dell'aumento della forza di contrazione del miocardio indotta dalla stimolazione ortosimpatica. Infatti, questo ione svolge un ruolo determinante nell'attivare il processo contrattile nelle miofibrille presenti nella fibra muscolare.
Con l’elettrocardiogramma ECG si registrano le differenze di potenziale (di alcuni mV) dovute all’eccitazione cardiaca. I potenziali elettrocardiografici si originano al confine tra porzioni eccitate e quelle non eccitate del miocardio. L’ECG normale è costituito da:
- onda P: causata dai potenziali elettrici che si generano nel processo di depolarizzazione atriale che precede il fenomeno della contrazione. Durante la depolarizzazione, il valore di negatività del potenziale all’interno della fibra gradualmente diminuisce e si verifica poi un’inversione del potenziale; in altre parole, esso diviene leggermente positivo all’interno e negativo all’esterno. L’onda di ripolarizzazione degli atri (che avviene 0.12 – 0.20 secondi dopo l’onda P) non è visibile, poiché di regola mascherata dai successivi picchi. L’onda P, in conclusione, si presenta all’inizio della contrazione atriale.
- intervallo P-Q: è uguale al tempo che passa tra l’inizio della contrazione atriale e quella ventricolare, ha una durata di circa 0.16 secondi. Il passaggio dell’impulso attraverso il sistema di conduzione A-V occupa una parte considerevole di questo tempo.
- complesso QRS: è dovuto ai potenziali che si generano al diffondersi del processo di depolarizzazione ventricolare che precede il fenomeno della contrazione. Questo complesso si verifica quindi all’inizio della contrazione ventricolare. La durata è di norma compresa tra 0.06 sec e 0.10 sec ed è dovuta alla conduzione dell’impulso attraverso i ventricoli.
- intervallo S-T: segmento in cui l’intero miocardio ventricolare è depolarizzato.
- onda T: è causato dai potenziali elettrici che si generano quando i ventricoli risolvono lo stato di depolarizzazione. È quindi un onda di ripolarizzazione ventricolare, processo che si verifica dai 0.25 ai 0.35 secondi dopo la fine della depolarizzazione. La ripolarizzazione porta la positività della fibra al suo esterno. L’onda T è spesso prolungata e il suo valore di voltaggio è notevolmente minore di quello del complesso QRS.
- intervallo Q-T: è il segmento che indica l’intera contrazione ventricolare (sistole elettrica). Il tempo è di norma di circa 0.35 secondi ma varia inversamente alla frequenza del cuore.
Nessuna differenza di potenziale viene registrata nell’ECG quando il miocardio ventricolare o atriale è completamente polarizzato o depolarizzato. Soltanto quando essi sono parzialmente polarizzati o depolarizzanti vi è un flusso di corrente da una parte del ventricolo all’altra ed essa diffonde verso la superficie corporea e causa un ECG registrabile.
Il sistema vascolare
La funzione della circolazione è quella di provvedere alle esigenze dei tessuti fornendo le sostanze nutritive, rimuovendo i prodotti di rifiuto, trasportando gli ormoni da una parte all’altra del corpo e consentendo, in generale, il mantenimento di un ambiente interno ottimale alla sopravvivenza ed al funzionamento cellulare in tutti i liquidi dei tessuti.
La circolazione è divisa in:
- circolazione sistemica
- circolazione polmonare
Circa l’84% dell’intero volume di sangue si trova nella circolazione sistemica, e in particolare il 64% nelle vene, il 13% nelle arterie ed il 7% nelle arteriole e nei capillari sistemici. Il restante sangue è contenuto per il 7% nel cuore e per il 9% nei vasi polmonari.
Poichè il cuore immette di continuo sangue nell’aorta, la pressione in questo vaso è alta e si aggira intorno ai 100mmHg e, a causa dell’intermittenza dell’azione cardiaca, la pressione arteriosa oscilla tra un livello sistolico di 120 mmHg e un livello diastolico di 80 mmHg. Con lo scorrere del sangue lungo la circolazione sistemica la pressione diminuisce progressivamente fino a raggiungere il valore intorno a 0 mmHg nel punto in cui le vene cave terminano nell’atrio destro del cuore. La pressione nei capillari sistemici passa da 35 mmHg nelle arteriole a 10 mmHg nei pressi delle terminazioni venose. La pressione media dei capillari è di circa 17 mmHg.
Nelle arterie polmonari la pressione è pulsatile, esattamente come nell’aorta, ma il livello pressorio è di gran lunga minore essendo la pressione sistolica di 25 mmHg e la pressione diastolica di 8 mmHg. La pressione arteriosa media è di 16 mmHg e la pressione media dei capillari polmonari è di soli 7 mmHg.
Esistono tre principi di base che sottostanno a tutte le funzioni del sistema:
- il flusso del sangue in ciascun tessuto del corpo è quasi sempre controllato con precisione in relazione alle necessità tissutali.
- la gittata cardiaca è fondamentalmente il risultato della somma di tutti i flussi locali tissutali (il cuore risponde all’aumento del ritorno venoso pompando quasi tutto di nuovo nel circolo arterioso).
- in generale la pressione arteriosa è controllata indipendentemente sia dai tessuti locali di controllo del flusso ematico sia da quelli di controllo della gittata cardiaca.
Il flusso (Q) nel vaso sanguigno è determinato da due fattori:
- differenza di pressione (DP) tra le due estremità del vaso: forza efficace che spinge il sangue attraverso il vaso.
- resistenza vascolare (R), impedimento che trova il sangue nello scorrere attraverso il vaso
ed è calcolato dalla legge di Ohm: Q = DP
R
Il termine flusso ematico indica semplicemente la quantità di sangue che passa in un dato punto della circolazione per un dato tempo. Il flusso totale della circolazione di un adulto è di 5000 ml/min. Questo corrisponde alla gittata cardiaca e rappresenta la quantità di sangue pompata dal cuore in una unità di tempo.
Quando il sangue scorre con flusso costante attraverso un vaso lungo e liscio, il suo moto segue linee di flusso disposte in strati concentrici all’interno del vaso. Questo tipo di flusso è chiamato flusso laminare. Nel flusso laminare, la velocità al centro del vaso è di gran lunga più grande di quella che si trova ai bordi e questo fenomeno è detto profilo parabolico della velocità. Il fluido dello strato di molecole che tocca la parete si muove con estrema difficoltà per via della adesione alla parete del vaso. Il secondo strato molecolare scivola sul primo, il terzo sul secondo, il quarto sul terzo e così via.
La pressione del sangue è quasi sempre misurata in mmHg ed esprime la forza esercitata dal sangue sull’unità di superficie della parete vasale.
La resistenza è misurata in URP (unità di resistenza periferica) e rappresenta l’impedimento che il flusso di sangue incontra durante il suo scorrimento in un vaso. La resistenza nell’intera circolazione sistemica (resistenza periferica totale) ammonta a 1 URP. In certe condizioni di intensa vasocostrizione, la resistenza totale periferica può elevarsi fino a 4 URP e in condizioni di estrema dilatazione può abbassarsi fino a 0.2 URP. La resistenza polmonare a riposo è circa 0.14 URP.
La conduttanza è definita dalla quantità di flusso sanguigno che attraversa un vaso per una data differenza di pressione. Viene espressa in millilitri per secondo per mmHg. È il reciproco della resistenza (C = 1/R). Piccole variazioni del diametro di un vaso possono cambiare la sua conduttanza in maniera straordinaria quando il sangue fluisce con moto laminare. La conduttanza del vaso aumenta infatti in proporzione alla quarta potenza del diametro.
Da quello che abbiamo detto sul flusso laminare, in un vaso piccolo tutto il sangue scorre vicino alla parete così che lo scorrimento centrale rapido viene semplicemente a mancare. È chiaro quindi che il valore del flusso sanguigno è direttamente proporzionale al raggio del vaso e precisamente alla quarta potenza del raggio come indicato dalla legge di Poiseuille. Un aumento di quattro volte del diametro vasale può teoricamente far aumentare il flusso ematico di 256.
Questa legge si ottiene integrando le velocità di tutti gli anelli concentrici del flusso ematico e moltiplicandola per le aree degli anelli:
Q = p DP r4
8 h l
La viscosità (h) influisce di molto nella legge di Poiseuille. Quanto maggiore è la viscosità, tanto minore è il flusso. La viscosità è dovuta principalemente all’elevato numero di globuli rossi, ciascuno dei quali esercita un attrito con le cellule adiacenti e le pareti del vaso.
Il valore percentuale di sangue occupato da cellule si chiama ematocrito. L’ematocrito di un uomo si aggira attorno al 42%, quello di una donna attorno al 38%.L’ematocrito viene misurato centrifugando il sangue in un tubo calibrato. Quanto maggiore è la percentuale delle cellule del sangue, cioè quanto maggiore è l’ematocrito, tanto più elevato sarà l’attrito tra gli starti adiacenti del sangue e, quindi, la viscosità.
Un’importante caratteristica del sistema vascolare è la distensibilità di tutti i vasi sanguigni. L’aumento della pressione provoca dilatazione delle arteriole e riduce quindi la loro resistenza. Il fatto che le arterie sono distendibili inoltre, permette loro di accogliere la gittata pulsatoria del cuore e di smorzare le pulsazioni presso rie, trasformando il flusso da pulsatile a continuo nei vasi sanguigni molto piccoli. Il sistema più distendibile è quello venoso; le vene hanno una funzione di riserva temporanea di per grandi quantità di sangue, da poter utilizzare nel momento del bisogno, ogni volta che viene richiesto da altri settori del sistema circolatorio.
La distensibilità è espressa dall’incremento di volume per ogni mmHg di incremento pressorio:
Distensibilità vascolare = aumento del volume
aumento della pressione x volume iniziale
Anatomicamente le pareti arteriose sono molto più robuste di quelle venose e, perciò, in media, circa 8 volte meno distendibili. Nella circolazione polmonare le vene sono simili a quelle della circolazione sistemica, ma le arterie polmonari hanno una distensibilità pari a circa la metà di quella delle vene.
La complianza (capacitanza) è la quantità di sangue che può essere immagazzinata in una specifica parte del circolo, per ogni mmHg di aumento pressorio:
Complianza = aumento di volume
aumento di pressione
La complicanza e la distensibilità sono due concetti del tutto differenti. Infatti, un vaso molto distendibile che abbia un piccolo volume può avere una complicanza molto minore rispetto a quella di un vaso molto meno distendibile che però abbia un volume maggiore. La complicanza è infatti data dal prodotto della distensibilità per il volume.
Vi è una sostanziale differenza nella curva volume-pressione tra la circolazione arteriosa e venosa. Nel sistema arterioso al volume di 750 ml la pressione arteriosa media è di 100 mmHg, mentre al volume di 500 ml la pressione scende a 0; al contrario nel sistema venoso dove la pressione è solitamente 2500-3500 ml, anche notevoli cambiamenti di volume non influenzano significamene la pressione, inducendo variazioni di pochi mmHg.
È evidente che l'incremento del tono del muscolo liscio vasale, causato dalla stimolazione simpatica, causa aumenti del valore della pressione per ogni dato volume nelle arterie e nelle vene mentre l'inibizione simpatica provoca l'effetto contrario. Appare pertanto chiaro che il controllo vasale da parte del simpatico rappresenta un valido mezzo per modificare le dimensioni di una porzione del circolo e per consentire il trasferimento di sangue da un settore all'altro. Un aumento del tono vasale, per esempio, che si verifichi in tutta la circolazione sistemica, può provocare lo spostamento di una grande quantità di sangue verso il cuore. Proprio attraverso questo meccanismo l'organismo aumenta l'attività propulsiva del cuore.
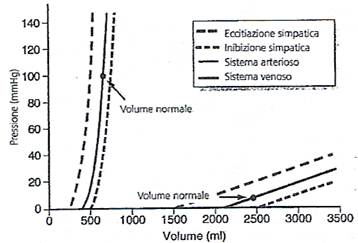 Inoltre il controllo del simpatico sulla capacità vascolare è particolarmente importante anche nel caso di un'emorragia. Un aumento del tono dei vasi, e in special modo delle vene, riduce infatti le dimensioni del sistema circolatorio e la circolazione del sangue può continuare a svolgersi in condizioni quasi normali perfino quando viene perso il 25% del volume totale di sangue.
Inoltre il controllo del simpatico sulla capacità vascolare è particolarmente importante anche nel caso di un'emorragia. Un aumento del tono dei vasi, e in special modo delle vene, riduce infatti le dimensioni del sistema circolatorio e la circolazione del sangue può continuare a svolgersi in condizioni quasi normali perfino quando viene perso il 25% del volume totale di sangue.
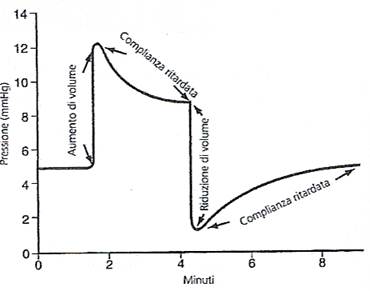 Con il termine dì "complianza ritardata" si vuole indicare che quando i vasi sono sottoposti ad un incremento di volume si verifica dapprima un notevole aumento di pressione e, successivamente, nel giro di minuti o di ore, un graduale ritorno ai valori normali a causa dello stiramento ritardato delle pareti dei vasi. Quando si aggiunge bruscamente altro sangue all'interno del vaso, la pressione sale da 5 a 12 mmHg e, subito dopo inizia a scendere, malgrado non venga asportata alcuna quantità di sangue dal vaso, avvicinandosi alcuni minuti dopo al valore di 9 mmHg. In altre parole, la quantità di sangue aggiunta provoca una distensione elastica della parete venosa ma, in un secondo momento, le fibre muscolari lisce iniziano ad "adattarsi" in risposta all'allungamento e la loro tensione si riduce in maniera corrispondente. Questo effetto è caratteristico di tutti i tessuti muscolari lisci ed è chiamato stress-rilasciamento. Dopo che si è verificata la complianza ritardata, viene rimosso il sangue precedentemente aggiunto. A seguito di questa manovra, la pressione diminuisce immediatamente ad un valore molto basso ma le fibre muscolari lisce tendono a riportare il loro grado di tensione ai valori iniziali. Perciò, entro pochi minuti, la pressione rie! vaso ritorna al valore iniziale normale di 5 mmHg.
Con il termine dì "complianza ritardata" si vuole indicare che quando i vasi sono sottoposti ad un incremento di volume si verifica dapprima un notevole aumento di pressione e, successivamente, nel giro di minuti o di ore, un graduale ritorno ai valori normali a causa dello stiramento ritardato delle pareti dei vasi. Quando si aggiunge bruscamente altro sangue all'interno del vaso, la pressione sale da 5 a 12 mmHg e, subito dopo inizia a scendere, malgrado non venga asportata alcuna quantità di sangue dal vaso, avvicinandosi alcuni minuti dopo al valore di 9 mmHg. In altre parole, la quantità di sangue aggiunta provoca una distensione elastica della parete venosa ma, in un secondo momento, le fibre muscolari lisce iniziano ad "adattarsi" in risposta all'allungamento e la loro tensione si riduce in maniera corrispondente. Questo effetto è caratteristico di tutti i tessuti muscolari lisci ed è chiamato stress-rilasciamento. Dopo che si è verificata la complianza ritardata, viene rimosso il sangue precedentemente aggiunto. A seguito di questa manovra, la pressione diminuisce immediatamente ad un valore molto basso ma le fibre muscolari lisce tendono a riportare il loro grado di tensione ai valori iniziali. Perciò, entro pochi minuti, la pressione rie! vaso ritorna al valore iniziale normale di 5 mmHg.
La complianza ritardata, in definitiva, è un meccanismo molto utile che permette al sistema circolatorio di accogliere anche eccedenti quantità di sangue quando è necessario, così come può avvenire durante una trasfusione. Inoltre, la complianza ritardata, nei fenomeni di segno opposto, è una della modalità che permette al sistema circolatorio di adeguarsi nel tempo di minuti o di ore a riduzioni di volume ematico dovute a gravi emorragie.
Ad ogni battito cardiaco un nuovo volume di sangue entra nelle arterie. Se le arterie non fossero distensibili, il sangue scorrerebbe verso i tessuti solo durante la sistole e si arresterebbe durante la diastole. La combinazione degli effetti della distensìbilità e della resistenza delle arterie riduce le pulsazioni pressorie fino quasi ad annullarle a livello dei capillari. Per questa ragione, normalmente, il flusso di sangue nei tessuti è continuo e non pulsatorio.
Nell'adulto giovane normale, nell'aorta, la pressione sistolica, è di circa 120 mmHg, mentre la pressione diastolica, è di circa 80 mmHg. La differenza tra queste due pressioni ha un valore di circa 40 mmHg ed è denominata pressione pulsatoria o differenziale. La pressione pulsatoria è influenzata principalmente da due fattori:
- la gittata sistolica del cuore o volume sistolico: quanto più è grande la gittata sistolica tanto maggiore è la quantità di sangue che deve essere accolta nel sistema arterioso ad ogni battito cardiaco, e di conseguenza, tanto maggiore è l'oscillazione della pressione tra la fase sistolica e quella diastolica.
- la complianza (distensibilità totale) del sistema arterioso: una minore complianza del sistema arterioso genera un incremento della pressione più elevato per un determinato volume sistolico.
In definitiva la pressione pulsatoria è determinata dal rapporto tra gittata sistolica e complicanza dell’albero arterioso.
Quando il cuore, durante la sistole, spinge il sangue nell'aorta, dapprima si distende solo la porzione prossimale dell'arteria perché l'inerzia del sangue impedisce il rapido fluire verso il circolo periferico. Tuttavia, l'aumento della pressione nell'aorta prossimale, tende a superare rapidamente l' inerzia e il fronte d'onda di distensione si trasmette progressivamente in avanti. Questo fenomeno è chiamato trasmissione dell'onda del polsooppure onda sfigmica(onda di pressione) lungo le arterie. La velocità di propagazione dell'onda del polso nell'aorta normale è di 3-5 m/sec, nelle grandi arterie di 7-10 m/sec e nelle piccole arterie di 15-35 m/sec. In genere, maggiore è la complianza di ogni singolo settore vascolare minore è la velocità, e ciò spiega perché, mentre l'onda di trasmissione del polso nell'aorta è lenta, nelle piccole arterie distali essa è molto più rapida a causa della loro minore distensibilità.
La progressiva diminuzione delle pulsazioni in periferia è anche detta smorzamento dell’onda di pressione ed è dovuto a:
- resistenza al movimento del sangue: la resistenza smorza le pulsazioni perché una piccola quantità di sangue deve fluire in avanti, a livello del fronte d’onda, per distendere la porzione successiva del vaso.
- complicanza vascolare: la complicanza smorza le pulsazioni perché più un vaso è distendibile , maggiore deve essere la quantità di sangue necessaria per innalzare la pressione.
Il grado di smorzamento è quindi quasi direttamente proporzionale al prodotto della resistenza per la complicanza.
Il clinico misura la pressione sistolica e diastolica attraverso mezzi indiretti utilizzando normalmente il metodo ascoltatorio. Uno stetoscopio viene posto sopra l'arteria della parte anteriore del gomito e un manicotto a pressione viene gonfiato attorno al braccio. Fino a quando la pressione che comprime il braccio è così modesta da lasciare l'arteria sempre distesa, non si generano rumori udibili con lo stetoscopio, anche se il flusso del sangue è pulsatile. Ma quando la pressione nel manicotto viene fetta salire ad un livello tale da causare la chiusura dell'arteria durante una parte del ciclo pressorio ad ogni pulsazione, si potranno udire dei rumori. Questi rumori sono chiamati toni di Korotkov e sono dovuti principalmente al getto di sangue che passa attraverso il vaso parzialmente chiuso. Il getto causa turbolenza nel vaso aperto appena oltre il manicotto e ciò genera vibrazioni che sono udibili con lo stetoscopio.
Per determinare la pressione del sangue con il metodo ascoltatorio bisogna inizialmente innalzare la pressione all'interno del manicotto oltre il valore della pressione sistolica. Fintanto che questo valore resta superiore alla pressione sistolica, l'arteria brachiale rimarrà collassata e il sangue non potrà fluire distalmente nell'arteria durante tutto il ciclo pressorio. Non si udranno, pertanto, in alcun modo i toni di Korotkov nella parte distale dell'arteria. Ma appena la pressione del manicotto viene abbassata ad un valore inferiore a quello della pressione sistolica, il sangue comincerà a fluire durante il picco dell'onda pressoria attraverso la parte dell'arteria sottostante il manicotto e si potranno udire alla piega del gomito toni schioccanti in sincronia con il battito cardiaco. Nel momento in cui si odono questi toni, la pressione indicata dal manometro del manicotto è approssimativamente uguale alla pressione sistolica.
Appena la pressione nel manicotto viene abbassata Ulteriormente, i toni di Korotkov cambiano di qualità e diventano meno schioccanti, più ritmici e più aspri. Infine, appena la pressione nel manicotto uguaglia la pressione diastolica, l'arteria non si chiude più durante la diastole. Ciò significa che viene a mancare il fattore che provoca i toni e cioè il getto di sangue attraverso l'arteria compressa. Allora i toni immediatamente si modificano per divenire smorzati e scompaiono completamente per un ulteriore abbassamento di 5-10 mmHg della pressione del manicotto. Si rileva allora la pressione del manometro quando i toni di Korotkov diventano smorzati ed il valore letto corrisponde all'incirca alla pressione diastolica.
Il metodo ascoltatorio per stabilire la pressione sistolica e diastolica non è del tutto accurato, ma normalmente fornisce valori che non si discostano più del 10% da quelli ottenuti direttamente dalle arterie.
La pressione arteriosa media è la media di tutte le pressioni calcolate millisecondo per millisecondo durante un certo periodo di tempo. Il suo valore non è uguale alla media della pressione sistolica e diastolica, perché la pressione resta più vicina al valore dìastolico che non a quello sistolico durante la maggior parte del ciclo cardiaco. Pertanto la pressione arteriosa media è dovuta per circa il 60% alla pressione diastolica e per il 40% a quella sistolica.
Poiché il sangue ritorna all'atrio destro da tutto il sistema venoso, la pressione nell'atrio destro viene chiamata pressione venosa centrale e qualsiasi fattore che la influenza si rifletterà anche sulla pressione venosa di qualsiasi parte del corpo. La pressione dell'atrio destro è regolata da un equilibrio tra la capacità del cuore dì pompare via dall'atrio il sangue e la tendenza del sangue a ritornare dai vasi periferici all'atrio destro.
Se il cuore pompa vigorosamente, la pressione dell'atrio destro tende a diminuire, mentre se il cuore è debole tende ad aumentare. Inoltre, qualsiasi fattore in grado di provocare un rapido afflusso di sangue dalle vene eleva la pressione dell'atrio destro. Alcuni dei fattori che sono in grado di incrementare il ritorno venoso e quindi la pressione atriale destra sono:
- l'aumento del volume del sangue,
- l'aumento considerevole del tono dei vasi in tutti distretti corporei con il conseguente aumento delle pressioni venose periferiche,
- la dilatazione delle arteriole, che riduce la resistenza periferica e consente un rapido flusso di sangue dalle arterie alle vene.
Gli stessi fattori che regolano la pressione dell'atrio destro regolano anche la gittata cardiaca perché la quantità di sangue pompata dal cuore dipende sia dalla efficienza della pompa cardiaca che dalla tendenza del sangue ad affluire al cuore dai vasi periferici. La pressione normale dell'atrio destro è di circa 0 mmHg, cioè il valore della pressione atmosferica.
Le grosse vene offrono così scarsa resistenza al flusso sanguigno quando sono distese che la loro resistenza non ha quasi alcun significato. Ma, la maggior parte delle grosse vene che entrano nel torace sono compresse in parecchi punti dai tessuti circostanti tanto da ostacolare il flusso sanguigno. Per questa ragione le grandi vene offrono di solito una resistenza considerevole al flusso sanguigno, per cui la pressione nelle vene periferiche oscilla tra i 4 e i 7 mmHg ed è più grande della pressione atriale. Quando la pressione dell'atrio destro si alza al di sopra del valore normale di 0 mmHg, il sangue tende a accumularsi nelle grosse vene e a distenderle. La pressione nelle vene periferiche non sì innalza fino a che non sono aperti i tratti collassati tra le vene periferiche e le grosse vene centrali. Ciò si verifica di solito quando la pressione dell'atrio destro si innalza sino a raggiungere i +4, +6 mmHg. Poi, se la pressione atriale destra aumenta ulteriormente, tale incremento pressorio si riflette in modo corrispondente nella pressione venosa periferica.
Nel calcolo delle pressioni del corpo bisogna tener presente il peso del sangue e quindi la pressione idrostatica. Quando una persona è in piedi, la pressione dell'atrio destro è di circa 0 mmHg perché il cuore pompa nelle arterie tutto il sangue che tende ad accumularsi nell'atrio, ma in un uomo adulto che sta in piedi assolutamente fermo la pressione nelle vene dei piedi è di circa - 90 mmHg, semplicemente a causa del peso del sangue nelle vene esercitato tra il cuore e i piedi. I valori delle pressioni venose ai livèlli intermedi del corpo sono proporzionalmente tra 0 e 90 mmHg.
Nelle vene del braccio, la pressione a livello della prima costala è di solito di circa +6 mmHg a causa della compressione che la vena succlavia subisce quando passa al di sopra di essa. La pressione idrostatica lungo il braccio è determinata dal dislivello dalla prima costala. Dunque se la differenza idrostatica tra il livello della costola e la mano è di 29 mmHg, questo valore dì pressione idrostatica deve essere aggiunto ai 6 mmHg di pressione causati dalla compressione della vena succlavia a livello della costola ottenendo così un valore totale di 35 mmHg per le vene della mano.
Le vene del collo di una persona in posizione eretta collassano quasi completamente per tutto il decorso che va dalla testa al cuore a causa della pressione atmosferica che agisce all'esterno.
Per questa tendenza al collasso, la pressione nelle vene del collo in tutta la loro lunghezza rimane a zero. Infatti, ogni tentativo di aumento pressorio oltre lo zero fa dilatare le vene e ciò di nuovo facilita la caduta della pressione a zero per l'aumento del flusso sanguigno. D'altra parte ogni tendenza della pressione a scendere al di sotto dello zero fa collassare le vene ancora di più aumentando la loro resistenza e facendo ritornare di nuovo la pressione a zero. Le vene interne del cranio sono contenute in una camera rigida e perciò non collassano, e ciò rende possibile l'esistenza di una pressione negativa nei seni durali della testa (-10 mmHg nel seno sagittale).
Il fattore idrostatico riguarda anche le pressioni nelle arterie periferiche, nei capillari e nelle vene. Per esempio, una persona in posizione eretta ha una pressione arteriosa di 100 mmHg a livello del cuore ed una pressione arteriosa di circa 190 mmHg a livello dei piedi.
Se non ci fossero le valvole nelle vene, per effetto della pressione idrostatica si avrebbe a livello dei piedi di un uomo adulto in posizione eretta una pressione venosa di circa 90 mmHg. Ciò non avviene perché ogni qualvolta un individuo muove le gambe, contrae i muscoli e comprime le vene dei muscoli o quelle dei tessuti adiacenti. Il sangue viene allora spremuto fuori dalle vene verso il cuore, diminuendo così la pressione. Questo sistema di pompaggio, noto come pompa venosa (pompa muscolare), è efficiente in condizioni ordinarie quando la pressione venosa dèi piedi di un adulto che sta camminando rimane più o meno vicina ai 25 mmHg.
Le valvole del sistema venoso spesso diventano insufficienti o addirittura vengono distrutte. Quando ciò avviene, la pressione nelle vene delle gambe aumenta a causa dell'insufficienza della pompa venosa. In questo modo si formano le vene varicose che sono caratterizzate da grosse protrusioni bulbose delle vene sotto la pelle di tutta la gamba e particolarmente delle porzioni più declivi. L'aumentata pressione delle vene e dei capillari e la fuoriuscita di liquido dai capillari causa uno stato edematoso costante delle gambe ogni volta che una persona affetta resta in piedi per più di qualche minuto. L'edema ostacola la diffusione adeguata dei materiali nutrizionali dai capillari ai muscoli ed alle cellule del derma, tanto che i muscoli diventano dolenti e deboli e la pelle si ulcera di frequente e diventa cancrenosa.
C'è un punto nel sistema circolatorio in cui i fattori idrostatici, dovuti ai cambiamenti delle posizioni del corpo di una persona normale, di solito non provocano variazioni di pressione maggiori di 1 o 2 mmHg. Questo punto si trova in corrispondenza della valvola tricuspide ed è chiamato livello di riferimento pressorio per la misurazione della pressione.
La ragione della mancanza dì effetti idrostatici a livello della tricuspide sta nel fatto che il cuore impedisce automaticamente a questo livello significative variazioni di pressione idrostatica: se la pressione a livello della valvola tricuspidale si alza lievemente sopra la norma, il ventricolo destro si riempie un po' di più del solito e ciò induce il cuore a pompare sangue con più rapidità, riportando così alla norma la pressione a questo livello. D'altra parte se la pressione diminuisce, il ventricolo destro non si riempie adeguatamente, il pompaggio diminuisce ed il sangue si accumula nel sistema venoso fino a quando la pressione tricuspidale non risale di nuovo ai valori normali. In altre parole il cuore agisce come regolatore a feedback di pressione a livello della valvola tricuspide.
Come abbiamo anticipato più del 60% di tutto il sangue del sistema circolatorio si trova di solito nelle vene. Per questa ragione, ed anche perché le vene presentano una elevata complianza, è stato sostenuto che il sistema venoso serve come riserva ematica della circolazione. In effetti, a causa della presenza di un sistema venoso a riserva variabile, il sistema circolatorio può funzionare quasi normalmente anche dopo una perdita del 20% del volume totale di sangue. Certe parti del sistema circolatorio sono così ampie e distensibili da essere considerate in modo specifico come riserve di sangue. Tali riserve includono: la milza, il fegato, le grosse vene addominali, il plesso venoso sottocutaneo, il cuore ed i polmoni.
Nel microcircolo si realizza la funzione più importante della circolazione che consiste nel trasportare i nutrienti ai tessuti e rimuovere i cataboliti. Il microcircolo è formato dai vasi più piccoli del corpo: arteriole, capillari e venule. Le arteriole, il cui diametro varia tra 5 e 100 mm, hanno uno spesso strato di muscolatura liscia che regola il flusso sanguigno in ciascun territorio tissutale, un sottile strato avventizio e un rivestimento endoteliale. Dopo aver abbandonato le arteriole più piccole (metarteriole) il sangue passa nei capillari, vasi estremamente sottili con pareti costituite da un singolo strato di cellule endoteliali molto permeabili. Di solito nel punto in cui i capillari originano dalle metarteriole, una fibra muscolare liscia circonda il capillare (sfintere precapillare). Dopo esser passato attraverso i capillari ed esser avvenuto l’interscambio tra i tessuti e sangue, il sangue entra nella venula e ritorna nella circolazione generale.
Il sangue solitamente non scorre in maniera continua nei capillari, ma in modo intermittente . alla base di questa intermittenza è il fenomeno detto vasomozione, vale a dire la contrazione intermittente delle metarteriole e degli sfinteri precapillari. Spesso la vasomozione è regolata dalla necessità di ossigeno da parte dei tessuti.
L’interscambio dei nutrienti e dei prodotti di escrezione tra i tessuti ed il sangue circolante, avviene per mezzo di tre principali meccanismi:
- per diffusione: le sostanze lipidiche solubili possono diffondere direttamente attraverso le pareti delle cellule dell’endotelio dei capillari. Tra queste sostanze sono da considerare specialmente l’ossigeno e l’anidride carbonica. Le sostanze solubili in acqua possono diffondere soltanto attraverso i pori intercellulari della membrana capillare. Tali sostanze comprendono le molecole dell’acqua, gli ioni sodio, gli ioni cloro e il glucosio. È chiaro che maggiori sono le dimensioni delle molecole insolubili nei lipidi, minore è la diffusione attraverso i capillari. Il coefficiente di riflessione (s) è l’impedimento relativo al passaggio di una sostanza attraverso la membrana capillare. Il coefficiente di riflessione per l’acqua è 0, mentre quello dell’albumina è 1. Pertanto la permeabilità dei pori dei capillari varia in base ai diametri molecolari delle sostanze. Si deve ricordare comunque che la permeabilità della membrana endoteliale dei capillari non è uguale in tutti i tessuti corporei.
- per pinocitosi: un certo trasferimento di sostanze attraverso la parete capillare si può verificare a livello delle piccole vescicole pinocitotiche. Queste vescicole, formate da introflessioni della membrana plasmatici delle cellule endoteliali, possono assumere sostanze da un lato della parete capillare, muoversi attraverso la cellula e depositare il loro contenuto dall’altro lato.
- per filtrazione: riguarda il flusso di fluidi attraverso la parete capillare. La pressione nei capillari tende a spingere il liquido e le sostanze in esso disciolte attraverso i pori dei capillari negli spazi interstiziali. Invece la pressione osmotica causata dalle proteine plasmatiche (pressione oncotica) tende per osmosi a richiamare liquidi dagli spazi interstiziali nel sangue, impedendo così una notevole perdita di liquido dal sangue. Quattro sono in definitiva le forze fondamentali che causano il movimento del liquido attraverso la membrana del capillare:
- pressione del capillare (Pc): tende a spingere fuori il sangue. La pressione nei capillari non è costante e dipende dalla pressione arteriosa, dalla pressione venosa e dalle resistenze precapillari e postcapillari. La pressione capillare varia da tessuto a tessuto. I valori medi ottenuti da molte misurazioni dirette eseguite nella cute dell’uomo si aggirano inorno a 32 mmHg nel terminale arterioso e a 15 mmHg nel terminale venoso.
- pressione del liquido interstiziale (Pi): tende a spingere il liquido all’interno (se è negativa spinge il liquido all’esterno). Si oppone alla filtrazione del capillare, ed è Pc - Pi che costituisce la forza che determina la filtrazione. In condizioni normali il valore di Pi è prossimo allo zero. Pertanto, il valore Pc rappresenta la forza di spinta.
- pressione collido-osmotica (oncotica) del plasma (p): tende a provocare osmosi di liquido verso l’interno della membrana capillare. È influenzata dal coefficiente di riflessione (s). Infatti soltanto quelle molecole o quegli ioni che non sono capaci di passare attraverso i pori della membrana esercitano una pressione osmotica. Tra le proteine plasmatiche, l’albumina ha un effetto preponderante nel determinare la pressione oncotica.
p = s RT (Ci - Ce)
La pressione oncotica è valutata intorno a 25 mmHg.
- pressione collido-osmotica del liquido interstiziale: tende a provocare osmosi di liquido verso l’esterno della membrana capillare. Nonostante l’ampiezza dei pori capillari è minore di quella delle molecole proteiche plasmatiche, una piccola quantità di proteine filtra negli spazi interstiziali attraverso i pori contribuendo ad una pressione collido-osmotica del liquido interstiziale di circa 8 mmHg.

In definitiva la somma delle forze che operano all’estremo arteriolare del capillare determina una pressione effettiva di filtrazione di 13 mmHg atta a muovere il liquido verso l’esterno. Questi 13 mmHg di pressione di filtrazione fanno si che in media circa lo 0.5% del plasma del sangue sia filtrato dall’estremo arteriolare dei capillari negli spazi interstiziali.
La differenza di 7 mmHg tra la forza che spinge il liquido a rientrare nei capillari e quella che si oppone al riassorbimento, esprime la pressione di riassorbimento all’estremo venulare dei capillari. Questa pressione di riassorbimento è notevolmente più bassa della pressione di filtrazione, ma bisogna ricordare che i capillari venosi sono molto più numerosi e permeabili di quelli arteriosi, così che è richiesta minore pressione per ottenere un movimento di liquido verso l’interno. Così, a livello del capillare venulare, si riassorbono circa nove decimi del liquido che è stato filtrato all’estremo arteriolare. Il liquido rimanente viene raccolto dai vasi linfatici.
 In condizioni normali esiste tuttavia a livello della membrana capillare uno stato di equilibrio: l’equilibrio di Starling, per cui la quantità di liquido che filtra all'esterno da una parte del capillare è quasi esattamente uguale alla quantità di liquido che viene riassorbita in circolo da un' altra parte del capillare. Il lieve squilibrio che esiste da ragione della piccola quantità di liquido che ritorna in circolo attraverso la via linfatica. Allora, nell'insieme della circolazione capillare troviamo una condizione di quasi-equilibrio tra le forze totali che spingono all' esterno il liquido (28,3 mmHg) e le forze totali che lo spingono all'interno (28,0 mmHg). Questo lieve sbilanciamento di forze di 0,3 mmHg causa una lieve maggiore filtrazione di liquido negli spazi interstiziali rispetto al riassorbimento. Questo modesto eccesso di filtrazione è chiamato filtrazione netta e richiede il rientro di liquido in circolo attraverso il sistema linfatico. L'entità normale di filtrazione netta in tutto il corpo ammonta solo a circa 2 ml/min.
In condizioni normali esiste tuttavia a livello della membrana capillare uno stato di equilibrio: l’equilibrio di Starling, per cui la quantità di liquido che filtra all'esterno da una parte del capillare è quasi esattamente uguale alla quantità di liquido che viene riassorbita in circolo da un' altra parte del capillare. Il lieve squilibrio che esiste da ragione della piccola quantità di liquido che ritorna in circolo attraverso la via linfatica. Allora, nell'insieme della circolazione capillare troviamo una condizione di quasi-equilibrio tra le forze totali che spingono all' esterno il liquido (28,3 mmHg) e le forze totali che lo spingono all'interno (28,0 mmHg). Questo lieve sbilanciamento di forze di 0,3 mmHg causa una lieve maggiore filtrazione di liquido negli spazi interstiziali rispetto al riassorbimento. Questo modesto eccesso di filtrazione è chiamato filtrazione netta e richiede il rientro di liquido in circolo attraverso il sistema linfatico. L'entità normale di filtrazione netta in tutto il corpo ammonta solo a circa 2 ml/min.
La periferia del sistema linfatico è costituita da una vasta e diffusa rete di terminali chiusi dei capillari linfatici, provvisti di alta permeabilità. Questi capillari linfatici hanno un aspetto simile a quello dei capillari sanguigni. Tuttavia, i capillari linfatici sono in genere privi di tight junction tra cellule endoteliali e possiedono sottili filamenti che li ancorano al tessuto connettivo circostante. Con la contrazione muscolare questi sottili filamenti possono distorcere i vasi linfatici e quindi aprire degli spazi tra cellule endoteliali (piccole valvole), che consentono l'ingresso di proteine, di grosse particelle e perfino delle cellule presenti nel liquido interstiziale. I capillari linfatici drenano in vasi linfatici che diventano progressivamente più grandi e che, alla fine, si immettono nella vena succlavia destra e sinistra, alle loro giunzioni con le rispettive vene giugulari interne.
La funzione dei vasi linfatici è di restituire alla circolazione il plasma filtrato dai capillari. Questo compito viene eseguito grazie alla pressione tissutale; qualsiasi fattore in grado di inalzare la pressione del liquido interstiziale infatti, provocherà un aumento del flusso linfatico. Questi fattori sono:
- aumento della pressione capillare
- riduzione della pressione collido-osmotica plasmatica
- incremento proteico nel liquido interstiziale
- aumento della permeabilità dei capillare
Il flusso linfatico è inoltre facilitato dall'attività intermittente del muscolo scheletrico, dalla contrazione dei vasi linfatici (attività di pompa) e da un ampio sistema di valvole unidirezionali. Pertanto, si può dire che l’entità del flusso linfatico deriva dal prodotto della pressione del liquido interstiziale per l’attività della pompa linfatica.
I linfatici rappresentano l'unico mezzo con cui le proteine che lasciano il compartimento vascolare possono poi ritornare al sangue, in quanto la retrodiffusione nei capillari non può avvenire contro un elevato gradiente di concentrazione dell'albumina. Oltre a riportare liquido e proteine nel letto vascolare, il sistema linfatico filtra la linfa a livello dei linfonodi e rimuove le particelle estranee, come i batteri.
Uno dei principi fondamentali su cui si basa la funzione circolatoria è la capacità di ciascun distretto tessutale di regolare il proprio flusso locale in proporzione alle sue esigenze metaboliche. In generale, quanto più è elevato il metabolismo in un organo, tanto maggiore è il suo flusso sanguigno. Il flusso ematico in ciascun tessuto è solitamente regolato al minimo livello che è sufficiente a rispondere alle sue richieste, né più, né meno. Nei tessuti in cui l'esigenza più importante da garantire è rapporto di ossigeno, per esempio, il flusso ematico è sempre regolato ad un livello appena più alto di quello richiesto per il completo mantenimento della ossigenazione, ma non più di questo. Con tale regolazione, i tessuti non vengono mai a soffrire di deficienza nutritiva ed il carico di lavoro sul cuore è ridotto al minimo.
Il controllo del flusso ematico locale può essere suddiviso in due fasi:
- Il controllo a breve termine si realizza con veloci cambiamenti del grado di costrizione locale delle arteriole, delle metarteriole e degli sfinteri precapillari, ed avviene nel giro di pochi secondi o minuti al fine di garantire rapidamente e mantenere un flusso sanguigno appropriato alle esigenze locali.
- Il controllo a lungo termine, invece, è dovuto a variazioni lente del flusso che richiedono giorni, settimane o perfino mesi. Il meccanismo di regolazione a lungo termine consiste in una variazione del grado di vascolarizzazione dei tessuti. Sono stati infatti scoperti una dozzina di fattori angiogenetici (fattori di crescita delle cellule endoteliali, fattori di crescita dei fibroblasti, angiogenina) , che stimolano lo sviluppo di nuovi vasi sanguigni. Lo sviluppo di nuovi vasi è stimolato dalla necessità dei tessuti di poter disporre in particolari circostanze di un flusso ematico massimale, superiore cioè a quello che è il flusso medio. Dopo lo sviluppo di un certo numero di nuovi vasi, questi rimangono costretti, aprendosi per permettere il fluire del sangue, soltanto quando stimoli locali appropriati, come la carenza d’ossigeno, impulsi nervosi vasodilatatori o di altra natura, fanno aumentare il flusso.
Uno dei fattori nutritivi più necessari èl'ossigeno. Tutte le volte che la disponibilità dell'ossigeno nei tessuti diminuisce, il flusso ematico nei tessuti aumenta marcatamente. Non appena la saturazione arteriosa dell'ossigenò scende a circa il 25% del normale, il flusso ematico aumenta di circa 3 volte. Questo permette di fornire quella quantità di ossigeno che è diminuita in modo da mantenere in maniera quasi automatica un costante rifornimento di ossigeno ai tessuti. Esistono due teorie fondamentali sulla regolazione del flusso ematico locale in risposta alla variazione del metabolismo del tessuto o alla disponibilità dell'ossigeno:
- la teoria della vasodilatazione: maggiore è il grado del metabolismo o minore è la disponibilità di ossigeno o di altre sostanze nutritive al tessuto, più grande è la liberazione di una sostanza vasodilatatrice. Sì è pensato che tale sostanza diffonda fino agli sfinteri precapillari, alle metarteriole ed alle arteriole causandone la dilatazione. Tra le varie sostanze ritenute responsabili di dilatazione, in particolare sono state considerate l'adenosina, l'anidride carbonica, l'acido lattico, i composti di adenosina ed i fosfati, l'istamina, gli ioni potassio e idrogeno.
- la teoria della richiesta di ossigeno: l''ossigeno (come pure le altre sostanze nutritive) è richiesto per mantenere la muscolatura dei vasi in stato di contrazione. Pertanto, in assenza di un adeguato apporto di ossigeno e di altre sostanze nutritive, è ragionevole credere che i vasi sanguigni tendano spontaneamente a dilatarsi. Inoltre, un aumento dell'utilizzazione di ossigeno nei tessuti, come si verifica in relazione ad un aumentato metabolismo, potrebbe teoricamente diminuire la disponibilità di ossigeno nei vasi sanguigni locali causando una vasodilatazione locale. Poiché i muscoli lisci richiedono ossigeno (od altri nutrienti o entrambi) per rimanere in contrazione, si può ritenere che la forza di contrazione degli sfinteri aumenterà con l'incremento della concentrazione di ossigeno.
Di conseguenza, quando la concentrazione dell'ossigeno nel tessuto sale oltre un certo livello, gli sfinteri dei precapillari e delle metarteriole presumibilmente si chiudono e rimangono chiusi fino a che le cellule tessutali non abbiano consumato l'ossigeno in eccesso. Quando la concentrazione dell'ossigeno scende a livelli sufficientemente bassi gli sfinteri si aprono nuovamente per iniziare di nuovo il ciclo.
I meccanismi che finora sono stati descritti per il controllo del flusso locale sanguigno sono chiamati meccanismi metabolici, perché rispondono ai bisogni metabolici dei tessuti. Consideriamo ora due situazioni particolari di controllo metabolico del flusso:
- Iperemia reattiva. Quando l'apporto ematico al tessuto viene bloccato per un certo periodo, da pochi secondi fino a parecchie ore, e successivamente viene ripristinato, il flusso aumenta da quattro a sette volte rispetto alla norma. L'aumento di flusso si manterrà per alcuni secondi se il blocco è durato soltanto pochi secondi, ma potrà continuare per molte ore, se il flusso è stato impedito per un'ora o più. Questo fenomeno è chiamato iperemia reattiva. L'iperemia reattiva è quasi certamente un'altra manifestazione dei meccanismi metabolici di regolazione locale del flusso. La mancanza dì flusso attiva allora tutti quei fattori responsabili della vasodilatazione. Dopo brevi periodi di occlusione vascolare, l'aumento di flusso della fase d'iperemia reattiva dura abbastanza a lungo per compensare in maniera quasi completa quella mancanza di ossigeno di cui i tessuti hanno sofferto durante il periodo di occlusione. Questo meccanismo mette in evidenza l'intima connessione tra il controllo del flusso locale ematico e l'apporto dì ossigeno e di altri nutrienti ai tessuti.
- Iperemia attiva. Quando in un tessuto aumenta notevolmente il livello di attività, come, per esempio, nel caso di un muscolo durante uno sforzo, di una ghiandola gastrointestinale durante un periodo di ìpersecrezione o perfino durante un'attività mentale rapida, la quantità del flusso ematico nel tessuto aumenta. Anche in questo caso, applicando semplicemente i principi basilari della regolazione del flusso, si può facilmente capire la cosiddetta iperemia attiva. L'incremento nel metabolismo locale porta le cellule a divorare i nutrienti del liquido tessutale in modo estremamente rapido ed anche a rilasciare grandi quantità di sostanze vasodilatanti. Ne consegue una vasodilatazione dei vasi locali e, pertanto, un incremento locale del flusso. In questo modo il tessuto attivo riceve ulteriori nutrienti necessari per sostenere il suo nuovo livello funzionale. Come segnalato precedentemente, l'iperemia attiva nel muscolo scheletrico può incrementare il flusso ematico locale di ben 20 volte durante un esercizio fisico intenso.
Quando si parla dell’ “autoregolazione” del flusso ematico in risposta alle variazioni della pressione arteriosa, due sono i meccanismi da considerare:
- meccanismo metabolico: quando la pressione arteriosa diventa troppo alta, l'eccesso di flusso fornisce una quantità eccessiva di ossigeno ed altri nutrienti ai tessuti, e ciò causa costrizione dei vasi sanguigni e il ritorno del flusso a valori vicini al normale, nonostante la pressione più elevata.
- meccanismo miogeno: un brusco stiramento dei piccoli vasi ematici provoca contrazione della parete muscolare vasale. Pertanto, si è pensato che lo stesso stiramento delle pareti dei vasi, causato dall'aumento della pressione arteriosa, provochi a sua volta una costrizione vascolare, riportando il flusso ematico quasi a livello normale. Viceversa, a basse pressioni, il grado di stiramento vasale è minore cosicché il muscolo liscio si rilascia e permette l'aumento del flusso.
Le cellule endoteliali, che rivestono le arteriole e le piccole arterie, sintetizzano alcune sostanze che, se rilanciate, possono influire sul grado di contrazione della parete arteriosa. La più importante tra queste sostanze vasodilatanti è quella chiamata fattore rilasciante endoteliale, composto principalmente da ossido nitrico. Quando il sangue scorre nelle arterie rapidamente, si verifica uno "stress di taglio" (forza tangenziale) sulle cellule endoteliali per via della trazione viscosa del sangue sulle pareti vascolari. Questo stress piega le cellule endoteliali in direzione del flusso e libera una notevole quantità di ossido nitrico che, a sua volta, provocando il rilassamento della parete arteriosa, ne permette la dilatazione. Questo è un meccanismo molto vantaggioso perché è in grado di provocare un incremento secondario delle dimensioni di vasi sanguigni più grandi tutte le volte che il flusso sanguigno vascolare aumenta. Senza questa risposta l'efficacia del controllo del flusso sanguigno locale sarebbe enormemente compromessa e, sovente, totalmente inefficace, poiché molta della resistenza del flusso si sviluppa nella corrente delle arteriole e delle piccole arterie a monte.
La regolazione umorale nella circolazione consiste nella regolazione ad opera di sostanze secrete o assorbite nei liquidi corporei, come ormoni o ioni. Distinguiamo:
- agenti vasocostrittori:
- noradrenalina e adrenalina: la loro secrezione è stimolata dal simpatico durante lo stress o l’esercizio fisico intenso.
- angiotensina:
- vasopressina:
- endotelina:
- ioni calcio:
- agenti vasodilatatori:
- bradichinina:
- istamina:
- ioni potassio:
- ioni magnesio:
- acetato e citrato:
Il controllo nervoso influenza principalmente la ridistribuzione del flusso sanguigno nelle diverse aree del corpo, il potenziamento dell’attività di pompa del cuore e, in particolare, la regolazione rapida della pressione arteriosa.
La sezione più importante del sistema nervoso autonomo che controlla la circolazione è quella del sistema simpatico. La sezione parasimpatica svolge un ruolo di maggiore importanza nella regolazione della funzione cardiaca tramite le fibre che arrivano al cuore con i nervi vaghi, la cui stimolazione provoca una notevole riduzione della frequenza cardiaca e una lieve diminuzione della contrattilità del cuore.
Le fibre nervose vasomotrici del simpatico partono dal midollo spinale con tutti i nervi del tratto toracico e con i primi due nervi del tratto lombare, passano nei gangli della catena simpatica, e da qui raggiungono i vasi sanguigni attraverso due strade:
- i nervi simpatici: innervano il sistema vascolare degli organi interni
- i nervi spinali: innervano i territori periferici
La distribuzione delle fibre nervose del simpatico interessa tutti i vasi, fatta eccezione per i capillari, gli sfinteri precapillari e le metarteriole.
Il sistema simpatico può, se stimolato, incrementare la resistenza a livello delle arterie, determinando, così, una riduzione della quantità di flusso attraverso i tessuti. Ma, dal momento che innerva anche le vene, la stimolazione simpatica può indurre una riduzione del loro volume e, di conseguenza, del volume di tutto il sistema vascolare periferico. I nervi simpatici comprendono dunque un notevole numero di fibre vasodilatatrici e solo poche fibre vasodilatatorie.
Oltre alle fibre nervose destinate ai vasi, il simpatico invia anche fibre dirette al cuore, la cui stimolazione provoca un aumento marcato dell’attività caridiaca, aumentando sia la frequenza che la forza di contrazione del cuore.
La regolazione da parte del SNC delle fibre del sistema simpatico e parasimpatico avviene nel centro vasomotore, posto nella sostanza reticolare del bulbo e nel terzo inferiore del ponte. Questo centro trasmette impulsi parasimpatici al cuore attraverso i nervi vaghi, ed invia impulsi simpatici, attraverso il midollo spinale ed i nervi simpatici periferici, a tutti o quasi tutti i vasi sanguigni del corpo. Il centro vasomotore è composto da:
- area vasocostrittrice: i cui neuroni secernono noradrenalina ed eccitano i neuroni vasocostrittori del simpatico. Quest’area trasmette di continuo segnali alle fibre nervose simpatiche con una bassa frequenza. In questo modo mantiene il tono vasocostrittore del simpatico, ovvero uno stato di parziale contrazione delle pareti dei vasi sanguigni.
- area vasodilatatrice: i cui neuroni proiettano verso l’area vasocostrittrice, inibendone l’attività
- area sensitiva: i cui neuroni ricevono segnali nervosi sensitivi ed inviano poi impulsi ad entrambe le aree vasocostrittrice e vasodilatatrice, garantendo così un controllo “riflesso” di molte attività funzionali del sistema circolatorio.
Le porzioni laterali del centro vasomotore trasmettono al cuore impulsi eccitatori, mentre la porzione mediale che è nelle immediate vicinanze del nucleo motorio dorsale del vago, trasmette al cuore impulsi inibitori. Il centro vasomotore può così aumentare o diminuire l’attività cardiaca. A sua volta il centro vasomotore è controllato da parte dei centri nervosi superiori: la sostanza reticolare del ponte, del mesencefalo e del diencefalo; l’ipotalamo, il lobo temporale anteriore, le aree orbitali della corteccia frontale, il giro del cingolo, l’amigdala e infine l’ippocampo.
Il neurotrasmettitore usato dal simpatico vasocostrittore è la noradrenalina, che agisce direttamente sui recettori “alfa” del muscolo liscio e provoca vasocostrizione. La secrezione di noradrenalina, e anche di adrenalina, sono incrementate a livello della midollare del surrene. In alcuni territori l’adrenalina, interagendo con i recettori “beta” causa vasodilatazione. È il caso dei vasi dei muscoli scheletrici, la cui vasodilatazione stimolata da adrenalina, avviene all’inizio dell’esercizio fisico allo scopo di aumentare il flusso sanguigno in anticipo, prima cioè che i muscoli richiedano un aumento dell’apporto nutritivo.
Una delle più importanti funzioni del controllo nervoso della circolazione è la sua capacità di indurre aumenti di pressione arteriosa con estrema rapidità (controllo a breve termine). A questo scopo il simpatico provoca sia vasocostrizione che cardioaccellerazione, entrambe determinate da un aumento della pressione arteriosa. Tale aumento avviene mediante le seguenti modificazioni:
- costrizione di quasi tutte le arteriole del corpo: aumenta notevolmente la resistenza totale periferica, impedendo il deflusso del sangue dalle arterie e aumentando così la pressione arteriosa.
- costrizione delle vene e dei grossi vasi della circolazione: sposta sangue dai grossi vasi ematici periferici verso il cuore, aumentando in tal modo il riempimento di sangue nelle cavità cardiache. Per questo motivo il cuore si contrae con più forza, aumentando così la gittata cardiaca e la pressione arteriosa.
- stimolazione del cuore: aumenta ulteriormente l’attività di pompa cardiaca
Esistono inoltre molti meccanismi inconsci che operano invece per mantenere continuamente la pressione arteriosa intorno ai suoi livelli normali. Quasi tutti questi sono dei meccanismi riflessi a feedback negativo. Tra i meccanismi di controllo della pressione arteriosa i più conosciuti sono:
- riflesso barocettivo: il rialzo pressorio stira i barocettori, che, così attivati, inviano messaggi al SNC. Da qui, attraverso il sistema nervoso autonomo, i segnali ritornano all’apparato circolatorio e a “feedback” riportano la pressione arteriosa ai valori normali. I barocettori sono terminazioni nervose, localizzate nella parete delle arterie carotidi interne (seno carotideo) e nella parete dell’arco aortico. I segnali da ciascun seno carotideo sono trasmessi attraverso il nervo di Hering al nervo glossofaringeo e poi al tratto solitario del bulbo. Da qui, segnali di secondo ordine vanno ad inibire il centro vasocostrittore del bulbo ed eccitano il centro vagale. Gli effetti che si inducono sono: una vasodilatazione delle vene e delle arteriole nel sistema circolatorio periferico e una diminuzione della frequenza cardiaca e della forza di contrazione del cuore. Il risultato netto è una diminuzione riflessa della pressione arteriosa per la riduzione sia delle resistenze periferiche che della gittata cardiaca. I barocettori del seno carotideo vengono stimolati da pressioni superiori ai 60 mmHg, quelli aortici a livelli superiori ai 90 mmHg. Attorno ai 100 mmHg, anche piccole variazioni di pressione sono in grado di modificare notevolmente la risposta riflessa e di riportare i valori pressori alla norma. Il sistema barocettivo è detto infatti sistema tampone di pressione e di nervi che originano dai barocettori nervi tampone. Quando i barocettori sono integri la pressione arteriosa oscilla nell’arco dell’intera giornata nel ristretto ambito di 85 e 115 mmHg e resta assai vicina a 100 mmHg per la maggior parte del tempo. Il sistema di controllo barocettivo non svolge alcun ruolo significativo nella regolazione a lungo termine della pressione arteriosa, per la semplice ragione che i barocettori tendono ad adattarsi a qualsiasi livello pressorio cui vengano esposti.
- riflesso chemocettivo: i chemocettori sono cellule sensibili alla carenza di ossigeno, ed all'eccesso di anidride carbonica e dello ione idrogeno. Sono situati in numerosi piccoli organi: due corpi carotidei, che si trovano alla biforcazione delle due arterie carotidee comuni, e vari corpi aortici, addossati all'aorta. I chemocettori eccitano le fibre nervose che decorrono con le fibre barocettive lungo il nervo di Hering ed il nervo vago, e raggiungono il centro vasomotore. Ciascun corpo carotideo o aortico è fornito di un abbondante flusso sanguigno per mezzo di una piccola arteria nutritiva, così che i chemocettori sono sempre in stretto contatto con il sangue arterioso. Quando la pressione arteriosa scende al di sotto di un determinato livello critico, i chemocettori cominciano ad essere stimolati perché il lento flusso sanguigno fa diminuire la disponibilità di ossigeno ed aumentare l’accumulo di anidride carbonica e di ioni idrogeno per riduzione della rimozione di queste sostanze. Dai chemocettori i segnali trasmessi lungo le fibre afferenti vanno ad eccitare i! centro vasomotore aumentando così la pressione. Questo riflesso concorre ad alzare la pressione se questa scende troppo in basso. II riflesso chemocettivo non è però efficace nel controllare la pressione arteriosa intorno ai valori normali, perché gli stessi chemocettori non vengono stimolati in modo sufficiente se non quando la pressione scende al di sotto di 80 mmHg. Pertanto, è alle pressioni più basse che il riflesso diventa particolarmente importante e coopera con il sistema barocettivo nell'impedire ulteriori cali pressori.
- riflessi atriali e dell'arteria polmonare : Negli atri e nelle arterie polmonari sono presenti a livello delle pareti recettori di stiramento, chiamati recettori a bassa pressione, simili ai barocettori delle grandi arterie sistemiche. Questi recettori di bassa pressione hanno un ruolo importante per ridurre al minimo le variazioni della pressione arteriosa in risposta ai cambiamenti nel volume sanguigno. Essi evocano riflessi consensuali con i riflessi barocettivi per rendere l'insieme dei riflessi cardiocircolatori molto più potente nel loro controllo della pressione arteriosa.
La distensione degli atri provoca anche una dilatazione riflessa delle arteriole afferenti ai glomeruli renali; è lo stesso effetto riflesso indotto dai recettori di bassa pressione sulle altre arteriole periferiche. La diminuita resistenza delle arteriole afferenti causa il rialzo della pressione capillare nel glomerulo con il risultato di aumentare il filtrato nei tubuli renali, e la diminuzione dell'ormone antidiuretico riduce il riassorbimento dell'acqua dai tubuli. La combinazione di questi due effetti provoca una rapida perdita di liquido con le urine e riporta con efficacia il volume ematico alla norma.
Un aumento nella pressione striale provoca inoltre incrementi di frequenza cardiaca fino talvolta a raggiungere aumenti del 75%: si parla di "riflesso di Bainbridge". Esso origina dall'attivazione di recettori da stiramento localizzati negli atri che trasmettono segnali attraverso i nervi vaghi fino al bulbo. Da qui impulsi efferenti discendono sia con il vago che con il simpatico per aumentare la frequenza cardiaca e, presumibilmente, la forza della contrazione del miocardio. In definitiva, questo riflesso aiuta a prevenire accumulo di sangue nelle vene, negli atri e nella circolazione polmonare, e perciò ha uno scopo differente da quello del controllo della pressione arteriosa.
- risposta ischemica del SNC: quando il flusso ematico del centro vasomotore si riduce al punto da provocare un deficit nutritivo (ischemia cerebrale), i neuroni dello stesso centro rispondono all’ischemia e si eccitano fortemente a causa dell’elevata concentrazione di anidride carbonica. L’eccitazione porta ad un aumento pressorio arterioso. Questo sistema raggiunge la massima attivazione per valori pressori compresi tra i 15-20 mmHg. Un'altra reazione, la reazione di Cushing, avviene nel SNC per proteggere i centri vitali del cervello dalla mancanza di nutrizione, quando la pressione del liquido cerebrospinale si eleva in modo tale da comprimere le arterie cerebrali.
- riflesso di compressione addominale: quando si attua una qualsiasi condizione che stimola il sistema vasocostrittore del simpatico, i segnali nervosi vengono inviati ai muscoli addominali, la cui compressione svuota le riserve venose dell’addome con conseguente trasferimento di sangue dalle riserve venose addominali al cuore. Come risultato maggiori quantità di sangue sono disponibili per essere pompate dal cuore in circolo (aumenta la gittata cardiaca).
Nella misurazione della pressione arteriosa possiamo rilevare alcune "onde":
- onde respiratorie:ad ogni ciclo respiratorio, la pressione arteriosa di solito oscilla da 4 a 6 mmHg. Si registra di solito un incremento nella pressione arteriosa durante la prima parte dell'espirazione, ed una caduta della pressione durante il restante ciclo respiratorio. Le onde sono dovute a molteplici e diversi effetti, alcuni dei quali soro di natura riflessa:
- molti impulsi che originano nel centro respiratorio del bulbo raggiungono il centro vasomotore ad ogni ciclo respiratorio.
- ogni qualvolta il soggetto inspira, la pressione nella cavità toracica diventa più negativa del solito e ciò causa l'espansione dei vasi sanguigni nel torace. Questo riduce il ritorno del sangue al lato sinistro del cuore e perciò diminuisce momentaneamente la gittata cardiaca e la pressione arteriosa.
- i cambiamenti pressori causati dalla respirazione nei vasi toracici possono eccitare i recettori vascolari e quelli di stiramento atriale.
- onde vasomotorie: onde molto più ampie a volte fino a 10-40 mmHg, che oscillano molto più lentamente delle onde respiratorie. La causa delle onde vasomotorie è solitamente legata all'oscillazione di uno o più meccanismi di controllo nervosi pressori. Sono Causate principalmente da oscillazione del riflesso barocettivo: la pressione alta eccita i barocettori che provocano inibizione del sistema nervoso simpatico e conseguente abbassamento della pressione per alcuni secondi. La diminuzióne di pressione, a sua volta, riducendo la stimolazione barocettiva, permette al centro vasomotore di tornare di nuovo attivo e riportare la pressione a valori più alti. Tuttavia, poiché la risposta non è istantanea e ritarda alcuni secondi, l'aumento pressorio avvia un nuovo ciclo e mantiene lo stato di oscillazione. Anche il riflesso chemocettivo può provocare simili onde.
Nell’uomo il sistema reni - liquidi corporei per il controllo della pressione arteriosa è lo strumento fondamentale per la regolazione a lungo termine della pressione. Questo sistema consiste semplicemente nel fatto che l’aumento della pressione arteriosa, che consegue ad un aumento di liquido extracellulare, porta ad eliminare a livello renale il liquido in eccesso attraverso le urine e riporta la pressione alla norma.
Nell’uomo quindi l’eliminazione renale di acqua e cloruro di sodio è sensibile alle variazioni di pressione: può bastare un aumento della pressione arteriosa di appena pochi mmHg per raddoppiare l’eliminazione renale di acqua (diuresi da pressione) e di cloruro di sodio (natriuresi da pressione).
Per capire bene questo sistema andiamo ad analizzare un grafico in cui vi sono due curve:
- la curva di eliminazione renale di acqua e sali
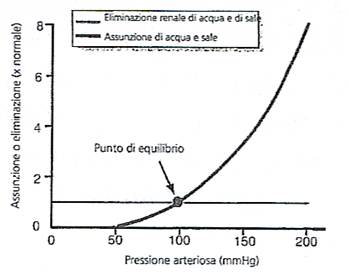 la curva di introduzione netta di acque e sali (ovvero quella ingerita meno quella persa attraverso vie diverse da quelle renali).
la curva di introduzione netta di acque e sali (ovvero quella ingerita meno quella persa attraverso vie diverse da quelle renali).
Queste due curve si intersecano tra loro in un punto di equilibrio. Ora vedremo cosa capita se la pressione arteriosa raggiunge valori diversi da quelli del punto di equilibrio. Se assumiamo che la pressione arteriosa sia di 150 mmHg, dal grafico si vede che l'eliminazione renale di acqua e sale diviene tre volte maggiore della loro ingestione. Di conseguenza il corpo perde liquidi, il volume dì sangue diminuisce e la pressione arteriosa si abbassa Tale bilancio negativo continuerà fino a che la pressione non è scesa precisamente al valore indicato dal punto di equilibrio. In effetti, anche quando la pressione arteriosa è soltanto di 1 mmHg maggiore del punto d'equilibrio, vi sarà ancora perdita di acqua e sale in più rispetto all'assunzione e, perciò, la pressione diminuirà di quell'ultimo 1 mmHg per ritornare esattamente al punto dì equilibrio. Ora, osserviamo cosa capita se la pressione arteriosa discende al di sotto dei punto di equilibrio. Questa volta l'introduzione di acqua e sale è maggiore dell'eliminazione. Perciò il volume del liquido corporeo aumenta insieme al volume ematico e alla pressione arteriosa finché, ancora una volta, non si ritorna esattamente al punto di equilibrio. Poiché la pressione arteriosa ritorna sempre esattamente al punto di equilibrio il guadagno del sistema di controllo pressorio da parte del meccanismo reni - liquidi corporei è "infinito".
Dalla figura si evince che esistono due fattori fondamentali responsabili del livello della pressione arteriosa a lungo termine. Se le linee che rappresentano l'eliminazione renale di acqua e sale e la loro assunzione rimangono esattamente come sono nella figura il livello della pressione arteriosa media a lungo termine si riaggiusterà sempre esattamente intorno a 100 mmHg, cioè il livello di pressione indicato dal punto di equilibrio di questa figura. Tale livello può essere cambiato dal valore di 100 mmHg solo :
- con uno spostamento della curva di eliminazione renale di acqua e sale
- con una variazione del livello di ingestione dì acqua e sale.
Perciò, in termini semplici, i due fattori determinanti fondamentali del livello di pressione arteriosa a lungo termine sono i seguenti:
- l’entità della spostamento della curva di eliminazione renale di acqua e sale;
- il livello della retta che ìndica l'assunzione dì acqua e sale.
È quindi chiaro che è impossibile modificare il livello della pressione arteriosa media a lungo termine senza cambiare uno od entrambi i due fondamentali fattori che sono responsabili del livello pressorio arterioso; se tali fattori verranno modificati la regolazione della pressione arteriosa si assesterà sul livello definito dal valore pressorio del punto di intersezione delle due nuove linee.
In base all'equazione fondamentale della pressione arteriosa
pressione arteriosa = gittata cardiaca x resistenza periferica totale
è chiaro che un aumento della resistenza periferica totale dovrebbe innalzare la pressione arteriosa. Infatti, quando si verifica un aumento della resistenza periferica totale, la pressione arteriosa sale immediatamente. Ma, se i reni funzionano normalmente, tale aumento non si mantiene a lungo e la pressione arteriosa ritorna ai valori normali in circa un giorno.
La ragione di tutto ciò sta nel fatto che l'aumento della resistenza vascolare che si attua ovunque nell'organismo, ad eccezione del livello renale, non cambia il punto di equilibrio per il controllo della pressione arteriosa. I reni, infatti, cominciano immediatamente a rispondere all'alta pressione arteriosa con una diuresi ed una natriuresi da pressione. Entro alcune ore od alcuni giorni, vengono perse dal corpo notevoli quantità di acqua e sale, finché la pressione arteriosa non ritorna al punto di equilibrio.
Abbiamo detto che un sovraccarico di liquido extracellulare porta ad un incremento della pressione arteriosa: l'incremento del volume di liquido extracellulare provoca incremento del volume di sangue e incremento della pressione circolatoria media di riempimento. Questa, a sua volta, aumenta il ritorno venoso del sangue al cuore, la gittata cardiaca e la pressione arteriosa. In particolare la gittata cardiaca innalza la pressione arteriosa in due modi:
- per l'effetto diretto dell'aumentata gittata cardiaca sulla pressione arteriosa
- per un effetto indiretto che risulta dall'autoregolazione locale del flusso sanguigno da parte dei tessuti: in risposta ad un eccesso di sangue che fluisce nei tessuti, si verifica una costrizione dei vasi locali che fa diminuire il flusso fino a riportarlo alla norma. Questo fenomeno è definito "autoregolazione". L'aumento successivo delle resistenze, conseguente al meccanismo di autoregolazione, facilita enormemente l'aumento della pressione arteriosa.
Un aumento dell'assunzione di sale può essere molto più significativo nel provocare un rialzo pressorio che un aumento di acqua. La ragione di tutto ciò è che il sale non viene eliminato dai reni con la facilità con cui l'acqua viene eliminata subito dopo la sua ingestione. Poichè il sale si accumula nel corpo, esso determina indirettamente l'aumento del volume del liquido extracellulare per due ragioni:
- quando il sale è in eccesso nel corpo, aumenta l’osmolarità dei liquidi corporei e ciò a sua volta stimola il centro della sete, spingendo il soggetto a bere una quantità maggiore di acqua in quantità tale da ridurre la concentrazione extracellulare del sale ai livelli normali. Di conseguenza, il volume del liquido extracellulare cresce
- l’aumento dell’osmolarità nel liquido extracellulare stimola anche il meccanismo ipotalamo-ipofisi posteriore a secernere maggiori quantità di ormone antidiuretico, che provoca nei reni il riassorbimento dei liquidi prima che essi vengano eliminati con le urine. Si incrementa quindi il volume del liquido extracellulare.
Un altro potente meccanismo dei reni in grado di controllare la pressione è il sistema renina-angiotensina. La renina è sintetizzata ed immagazzinata in una forma inattiva, cioè la prorenina, nelle cellule juxtaglomentlari del rene. Quando la pressione arteriosa diminuisce una reazione intrinseca nello stesso rene causa la scissione delle molecole di prorenina e la liberazione di renina. La renina è di per sé un enzima e non una sostanza vasoattiva. Essa agisce enzimaticamente su un'altra proteina plasmatica, una globulina chiamata substrato della renina (o angiotensinogeno), liberando un decapeptide: l'angiotensina I. Entro pochi secondi dalla formazione di angiotensina I, altri due aminoacidi sono rimossi per formare l'angiotensina //, che è un octapeptide. Questa conversione avviene quasi interamente nei pochi secondi in cui il sangue passa attraverso i piccoli vasi polmonari ed è catalizzata dall'enzima convertitore che è presente nell'endotelio dei vasi polmonari. L'angiotensina II è una sostanza vasocostrittrice estremamente potente, ed ha anche altri effetti sulla circolazione. Resta nel sangue soltanto 1-2 minuti perché è inattivata immediatamente da numerosi enzimi del sangue e dei tessuti chiamati nel loro insieme angio-tensinasi.
Durante la sua permanenza nel sangue, F angiotensina II presenta due principali effetti che possono innalzare la pressione arteriosa:
- Il primo è la vasocostrizione, che avviene rapidamente. La vasocostrizione è molto intensa nelle arteriole e molto minore nelle vene. La costrizióne delle arteriole aumenta la resistenza periferica per cui la pressione arteriosa risale. Inoltre, la modesta costrizione delle vene promuove Un aumento del ritorno venoso del sangue al cuore, facilitando così l'azione cardiaca contro livelli pressori più elevati.
- II secondo principale effetto dell'angiotensina sulla pressione arteriosa si attua a livello renale dove riduce l'escrezione di acqua e sale. Ciò aumenta lentamente il ' volume di liquido extracellulare e innalza la pressione arteriosa nel giro di ore o giorni. Questo effetto a lungo termine, che agisce attraverso la variazione del volume di liquido extracellulare, è ancora più potente rispetto a quello della vasocostrizione acuta nel far ritornare la pressione alla norma.
Si noti che il sistema vasocostrittore della renina-angiotensina richiede circa 20 minuti per divenire pienamente attivo. Di fatto esso agisce molto più lentamente dei riflessi nervosi e del sistema noradrenalina-adrenalina del simpatico.
L'angiotensina causa a livello renale la ritenzione di cloruro dì sodio ed acqua in due modi:
- Agisce direttamente sul rene inducendo ritenzione di acqua e sale.
- Stimola la secrezione di aldosterone dalla ghiandola, surrenale e, questo ormone, a sua volta, provoca il riassorbimento di sale e acqua da parte dei tubuli renali.
La pressione arteriosa deve risalire ad un livello considerevole per poter superare i due effetti dell'angiotensina sulla ritenzione di liquido. Per questo motivo, ogni volta che l'angiotensina circola in eccesso nel sangue, tutto il meccanismo di controllo pressorio a lungo termine reni-lquidi corporei si aggiusta automaticamente ad un livello di pressione arteriosa più alto del normale.
L'angiotensina è anche una delle più potenti sostanze che controllano la secrezione di aldosterone; quando il sistema renina-angiotensina si attiva contemporaneamente aumenta di solito la velocità di secrezione dell'ormone. Una delle più importanti funzioni dell'aldosterone è di indurre un incremento notevole del riassorbimento di sodio dai tubuli renali, aumentando così il sodio nel liquido extracellulare. Questo riassorbimento porta ad una ritenzione di acqua, come già spiegato, e ad un successivo aumento del volume di liquido extracellulare con ulteriore innalzamento della pressione arteriosa.
È probabile inoltre che una delle più importanti funzioni del sistema renina-angiotensina sia quella di permettere l'assunzione di quantità di sale molto piccole o molto grandi senza provocare variazioni eccessive del volume del liquido extracellulare e della pressione arteriosa.
Ricapitolando: la prima linea di difesa contro i cambiamenti bruschi della pressione arteriosa è effettuata dal sistema di controllo nervoso e, in questo capitolo, abbiamo sottolineato che il controllo a lungo termine della pressione arteriosa è realizzato dai reni.
I meccanismi che regolano la pressione arteriosa possono quindi essere distinti in tre diversi gruppi:
- meccanismi a breve termine di controllo della pressione, che si attuano in secondi o minuti: sono quasi interamente dovuti a riflessi o ad altre risposte nervose. Essi sono:
- il meccanismo a feedback barocettivo,
- il meccanismo ischemico del sistema nervoso centrale,
- il meccanismo chemo-cettivo.
Questi meccanismi non sono soltanto rapidi, ma anche estremamente potenti. A seguito di qualsiasi calo pressorio, come quello che potrebbe essere causato da una grave emorragia, la risposta combinata dei meccanismi nervosi causa:
- costrizione delle vene, che riporta più sangue al cuore,
- aumento della frequenza cardiaca e della contrattilità del cuore,
- costrizione delle arteriole che riduce la fuoriuscita dì sangue dal!'albero arterioso.
Tutti questi effetti avvengono quasi istantaneamente per alzare la pressione arteriosa al livello dì sopravvivenza. Quando, invece, la pressione diviene troppo alta, come potrebbe capitare in risposta ad assunzioni di farmaci oppure ad una trasfusione eccessiva di sangue, questi meccanismi operano in direzione opposta.
- meccanismi a medio termine di controllo della pressione. Alcuni meccanismi di controllo pressorio danno risposte di una certa entità soltanto pochi minuti dopo il cambiamento brusco della pressione arteriosa. Tre dì questi meccanismi sono:
- il meccanismo vasocostrittore della renina-angiotensina,
- l'effetto stress-rilasciamento delle strutture vasali : quando la pressione nei vasi ematici diventa troppo alta, si ha una distensione delle pareti dei vasi che si attua e si mantiene per minuti ed ore; come risultato di questo effetto si ha un ritorno della pressione nei vasi verso la norma.
- lo spostamento di liquido attraverso le pareti capillari, entro e fuori la circolazione, in modo da riadattare il volume del sangue secondo le necessità. Il meccanismo di spostamento del liquido attraverso i capillari agisce ogni volta che la pressione capillare scende troppo in basso ed il liquido è riassorbito per osmosi dai tessuti in circolo, aumentando cosi il volume ematico e la pressione. Viceversa, quando la pressione capillare si eleva troppo, il liquido viene perduto dal circolo nei tessuti, riducendo così il volume ematico e la pressione.
Questi tre meccanismi intermedi diventano pienamente attivi in un periodo di tempo tra mezz'ora e qualche ora ed il loro effetto può durare per lunghi periodi di tempo, anche per giorni, se necessario. L'importanza dei sistemi di controllo intermedio della pressione è spiegata dal fatto che, durante questo tempo, i meccanismi nervosi di solito presentano affaticamento e diventano sempre meno efficaci.
- meccanismi a lungo termine di controllo della pressione arteriosa. Ovvero quelli appenadescritti; parliamo dell'interazione del sistema renina-angiotensina-aldosterone e i meccanismi rene-liquidi del corpo.
Così, il controllo della pressione arteriosa inizia come un meccanismo di salvavita attraverso il sistema nervoso, poi continua con il mantenimento della pressione attraverso i meccanismi ca-ratteristici del controllo intermedio ed, infine, si stabilizza ad un livello a lungo termine attraverso il meccanismo rene-liquidi corporei. Quest'ultimo ha, a sua volta, interazioni molteplici con il sistema renina-angiotensina-aldosterone, con il sistema nervoso e con molti altri fattori che assicurano speciali capacità di controllo per particolari finalità.
La gittata cardiaca è la quantità di sangue pompata dal cuore ogni minuto nell’aorta. Corrisponde alla quantità di sangue che scorre ed è perciò responsabile del trasporto delle sostanze ai tessuti e dai tessuti.
Il ritorno venoso è invece la quantità di sangue che affluisce ogni minuto dalle vene all’atrio destro. I valori della gittata cardiaca e del ritorno venoso debbono necessariamente coincidere.
Nell'uomo adulto, giovane e sano, la gittata cardiaca è a riposo di circa 5,6 litri /min. Nella donna questo valore è inferiore del 10-20%. Se si considerano però soggetti più anziani, nei quali con l'avanzare degli anni l'attività fisica si riduce, la gittata diventa in media quasi esattamente di 5 litri al minuto.
La gittata aumenta approssimativamente in proporzione alla superficie corporea. Perciò si può definire la gittata cardiaca in termini di indice cardiaco, cioè il valore della gittata per metro quadro di superfìcie corporea. Essendo la superficie corporea di circa 1,7 metri quadri in un uomo adulto normale che pesa 70 Kg, il suo indice cardiaco sarà di 3 litri/min per metro quadro di superficie corporea.
Quando si afferma che la gittata cardiaca è regolata dal ritorno venoso si vuole dire che non viene fondamentalmente controllata dal cuore, ma da tutti quei fattori della circolazione periferica che sono in grado di influenzare il volume di sangue che refluisce dalle vene al cuore e cioè, che influenzano il ritorno venoso.
La ragione specifica per cui i fattori periferici sono i principali sistemi di controllo della gittata cardiaca è perché il cuore ha la proprietà intrinseca di pompare automaticamente, entro certi limiti, qualsiasi quantità di sangue affluisca dalle vene nell'atrio destro (legge del cuore di Frank-Starling). In linea di massima, l'aumento del flusso ematico distende le pareti delle cavità cardiache e per effetto dello stiramento il cuore sviluppa una forza di contrazione maggiore. Entro certi limiti questo meccanismo riesce a far svuotare le cavità cardiache tanto quanto in condizioni di riempimento normali. In questo modo, tutto il sangue arrivato in più al cuore viene automaticamente pompato immediatamente nell'aorta ed immesso in circolo.
Un altro fattore importante è l'effetto causato dallo stiramento del muscolo cardiaco sulla frequenza cardiaca. Lo stiramento del nodo senoatriale nella parete dell'atrio destro ha un effetto diretto sulla ritmicità del nodo stesso provocando un aumento della frequenza del 10-15%. Inoltre, lo stiramento dell'atrio destro da origine ad un riflesso chiamato riflesso di Bainbridge. Gli impulsi attraverso il centro vasomotore attivano il simpatico ed inibiscono il vago diretto al cuore, provocando così aumento della frequenza cardiaca. Questo aumento di frequenza facilita l'espulsione del sangue che sta ritornando dal sistema venoso al cuore in quantità maggiore del solito.
Pertanto, in condizioni normali e di non eccessiva sollecitazione, la gittata viene controllata quasi totalmente dai fattori periferici che influenzano il ritorno venoso. Tuttavia quando il ritorno venoso supera la capacità di pompa del cuore, il fattore limitante la gittata diviene a questo punto il cuore.
Poiché il ritorno venoso al cuore è il risultato della somma di tutti i flussi che provengono da ciascun distretto periferico, ne consegue che anche la regolazione della gittata cardiaca è la risultante della regolazione di ciascun flusso locale (il flusso aumenta in modo proporzionale al metabolismo del tessuto e tende ad incrementarsi quindi con il consumo di ossigeno tissutale). Pertanto la gittata è dovuta principalmente alla somma dei diversi fattori che controllano il flusso locale in tutto il corpo. I flussi ematici locali nel loro insieme formano il ritorno venoso.
In condizioni di controllo pressorio normale, il valore a lungo termine della gittata cardiaca varia esattamente in relazione inversa ai cambiamenti della resistenza periferica totale (legge di Ohm): quando la resistenza periferica totale aumenta, la gittata cardiaca si riduce e, viceversa quando le resistenze diminuiscono, la gittata aumenta.
gittata cardiaca = pressione arteriosa .
resistenza periferica toltale
Esistono limiti precisi alla quantità di sangue che il cuor può pompare, che sono ben evidenti nella forma della curva della gittata cardiaca. In questa curva della gittata cardiaca si nota che il plateau è pari a circa 13 litri/min, cioè 2.5 volte la gittata cardiaca normale che è di 5 litri. Ciò significa che il cuore normale, senza alcuno stimolo nervoso, può pompare sangue proveniente dal ritorno venoso in quantità circa 2.5 volte superiore al normale prima di diventare un fattore limitante nella regolazione della gittata cardiaca.
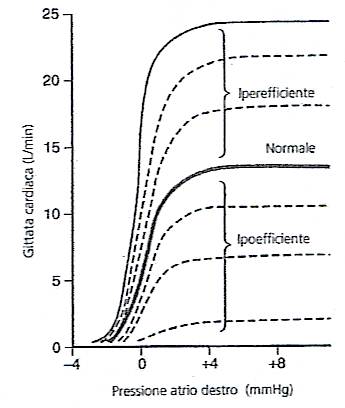
Soltanto due tipi di fattori possono rendere la pompa cardiaca più efficiente e causare l’aumento della gittata cardiaca:
- la stimolazione nervosa del cuore: la stimolazione simpatica e l’inibizione del parasimpatico, porta ad incrementare l’efficienza propulsiva del cuore con due meccanismi:
- aumento della frequenza cardiaca
- aumento della contrattilità del cuore
- l’ipertrofia del muscolo: un carico di lavoro cardiaco elevato, ma non tale da provocare danni al cuore, aumenta la massa cardiaca e la forza di contrazione.
Perché in queste condizioni siano raggiunte elevate gittate cardiache è essenziale allora che, quando i vasi periferici si dilatano per aumento del flusso locale ai tessuti, la pressione sia mantenuta nell’ambito dei valori normali da meccanismi nervosi riflessi.
Durante l’esercizio fisico, il sistema nervoso non solo si oppone ala caduta della pressione arteriosa, ma, addirittura, tende ad aumentarla tramite costrizione venosa, aumento della frequenza cardiaca e della contrattilità del cuore. Aumenti pressori di questo genere assicurano incrementi della gittata cardiaca durante l’esercizio fisico.
Se il cuore viene improvvisamente stimolato in modo eccessivo, la gittata spesso aumenta dal 20 al 30% altrettanto rapidamente, Tuttavia, questo modesto aumento dura solo pochi minuti nonostante il cuore continui ad essere fortemente stimolato. Le ragioni di questa transitorietà sono due:
- l'eccesso di flusso sanguigno ai tessuti provoca automaticamente vasocostrizione per effetto dell'autoregolazione locale. Ciò riduce il ritorno venoso e la gittata cardiaca ai valori normali.
- il lieve aumento della pressione arteriosa che segue l'improvvisa stimolazione cardiaca innalza la pressione nei capillari e liquido filtra fuori dai capillari verso i tessuti. Questo fatto riporta alla normalità il volume sanguigno ed il ritorno venoso. Inoltre, nel giro di ore o giorni, a causa dell'incremento pressorio, viene perso liquido anche a livello renale finché la pressione arteriosa e la gittata non si normalizzano.
Si può perciò concludere che aumenti che durano nel tempo possono derivare non tanto dalla maggiore attività cardiaca, ma dalla riduzione della resistenza totale periferica.
Condizioni che causano una riduzione abnorme della gittata cardiaca possono essere classificate in:
- riduzioni da insufficienza propulsiva del cuore: quando il cuore viene gravemente danneggiato per una qualsiasi causa, il limite massimo della sua efficacia propulsiva può diminuire sotto il minimo necessario per assicurare un adeguato flusso sanguigno ai tessuti.
- riduzioni da diminuzione del ritorno venoso: qualsiasi fattore che ostacoli il ritorno venoso porta anche ad una riduzione della gittata cardiaca. Alcuni di questi fattori sono:
- Riduzione del volume sanguigno: il fattore periferico di gran lunga più comune che porta alla riduzione della gittata cardiaca è la diminuzione del volume sanguigno, come in corso di emorragia. La perdita di sangue riduce il riempimento del sistema vascolare cosi che nei vasi periferici non si trova sangue in quantità tale da generare una pressione sufficiente a spingere il sangue verso il cuore.
- Dilatazione venosa acuta: le vene periferiche si dilatano bruscamente, molto spesso per una improvvisa inattivazione del sistema nervoso simpatico, provocando un aumento della capacità periferica venosa. Ciò riduce la pressione di riempimento del sistema vascolare perché il volume sanguigno non può più generare una pressione sufficiente nei vasi ematici divenuti flaccidi. Si verifica, di conseguenza, che il sangue ristagna nei vasi e non ritorna al cuore.
- Ostruzione delle grandi vene. In rare occasioni le grandi vene dirette al cuore restano ostruite, così che il sangue dei vasi periferici non può più defluire verso il cuore. Ne consegue una notevole diminuzione della gittata cardiaca.
Andiamo ora ad analizzare la regolazione del ritorno venoso e, per far ciò, dobbiamo prendere in considerazione l’intera circolazione sistemica. I tre principali fattori che influenzano il ritorno venoso sono:
- La pressione dell'atrio destro che esercita una forza a ritroso sulle vene ed ostacola il flusso ematico verso l'atrio.
- Il grado di riempimento della circolazione sistemica, misurato come pressione sistemica media di riempimento,che spinge il sangue verso il cuore. Questa pressione corrisponde alla pressione che vige in qualsiasi parte nella circolazione sistemica quando viene bloccato tutto il flusso sanguigno.
- La resistenza al flusso sanguigno tra i vasi periferici e l'atrio destro.
La curva del ritorno venoso confronta la pressione atriale destra con il ritorno venoso, cioè con la quantità di sangue che affluisce al cuore dalla circolazione sistemica.
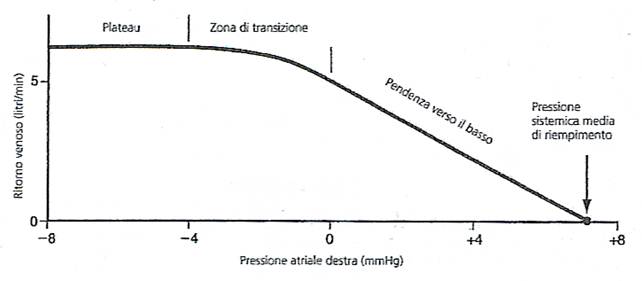
Essa mostra che quando la pompa cardiaca diviene insufficiente la pressione nell'atrrio destro tende ad aumentare. A sua volta, l'aumento pressorio agisce a ritroso sul circolo sistemico e riduce il ritorno venoso. Allorché la pressione atriale raggiunge il valore di circa 7 mmHg in mancanza dì qualsiasi riflesso circolatorio, il ritorno venoso si riduce a zero. Il motivo per cui un così modesto rialzo pressorio nell'atrio destro sia capace di ridurre drasticamente il ritorno venoso sta nel fatto che la circolazione sistemica può essere assimilata ad un sacco cosi distensibile che il sangue tende ad accumularsi piuttosto che a ritornare al cuore, quando sì verificano aumenti pressori a valle.
Mentre la pressione dell'atrio destro va salendo e causa la stasi venosa, anche l'efficacia propulsiva cardiaca si avvicina allo zero e la pressione arteriosa scende fino ad uguagliare quella venosa. Alla fine entrambe le pressioni si equilibrano e tutto il flusso nella circolazione sistemica si blocca alla pressione di 7 mmHg. Questo valore esprime per definizione la pressione sistemica media dì riempimento.
Quando la pressione dell'atrio destro scende al di sotto dello 0 non si hanno più ulteriori aumenti del ritorno venoso. Infatti, mentre la pressione dell'atrio dèstro discende a circa -2 mmHg, il ritorno venoso raggiunge il suo plateau e rimane a questo livello anche se la pressione atriale destra diminuisce fino a -20, -50 mmHg. Il plateau è dovuto al collasso delle vene che entrano nei torace. La pressione negativa dell'atrio destro fa collabire le pareti venose nel punto in cui entrano nel torace, ostacolando l'azione di aspirazione del sangue dalle vene periferiche. Invece, la pressione delle vene immediatamente esterne al torace rimane quasi uguale alla pressione atmosferica (pressione zero), in quanto è questa la pressione che l'aria esercita sulla cute ed i tessuti molli contro le partì esterne delle vene flaccide, provocandone il collasso. Pertanto, praticamente, la pressione venosa non scende mai sotto lo zero laddove le grandi vene entrano nel torace, malgrado il fatto che la pressione dell'atrio destro possa scendere a livelli molto bassi. Ne consegue che anche pressioni molto negative nell'atrio destro non possono aumentare significativamente il ritorno venoso oltre i valori che si hanno quando la pressione atriale destra è di 0 mmH
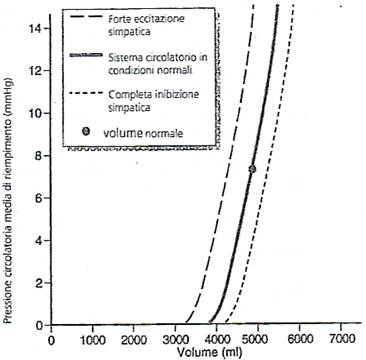 Quando l'attività della pompa cardiaca viene bloccata dopo qualche secondo il flusso del sangue in ogni parte del circolo si ferma. Senza flusso sanguigno le pressioni diventano nel giro di un minuto uguali in qualsiasi punto della circolazione. La pressione raggiunta all'equilibrio costituisce la pressione circolatoria media di riempimento. La pressione circolatoria media di riempimento dipende dal volume di sangue che distende le pareti vascolari. Ad un volume sanguigno di circa 4000 ml la pressione circolatoria media di riempimento è prossima allo zero, perché questo volume non è tale da distendere il sistema circolatorio; ma, ad un volume di 5000 ml la pressione di riempimento già raggiunge il valore normale di 7 mmHg. Volumi ancora più alti provocano aumenti della pressione circolatoria media di riempimento con un rapporto quasi lineare.
Quando l'attività della pompa cardiaca viene bloccata dopo qualche secondo il flusso del sangue in ogni parte del circolo si ferma. Senza flusso sanguigno le pressioni diventano nel giro di un minuto uguali in qualsiasi punto della circolazione. La pressione raggiunta all'equilibrio costituisce la pressione circolatoria media di riempimento. La pressione circolatoria media di riempimento dipende dal volume di sangue che distende le pareti vascolari. Ad un volume sanguigno di circa 4000 ml la pressione circolatoria media di riempimento è prossima allo zero, perché questo volume non è tale da distendere il sistema circolatorio; ma, ad un volume di 5000 ml la pressione di riempimento già raggiunge il valore normale di 7 mmHg. Volumi ancora più alti provocano aumenti della pressione circolatoria media di riempimento con un rapporto quasi lineare.
Una forte stimolazione del simpatico costringe tutti i vasi sistemici come pure i grandi vasi polmonari, e perfino le cavità cardiache. Pertanto, la capacità del sistema si riduce così da provocare un aumento della pressione circolatoria mèdia di riempimento per ogni dato volume ematico. A volume ematico normale, la stimolazione massimale del simpatico aumenta la pressione circolatoria media di riempimento da 7 mmHg a circa 17 mmHg, cioè 2,5 volte il valore normale. Viceversa, una completa inibizione del sistema nervoso simpatico dilata i vasi ematici e il cuore, riducendo la pressione circolatoria media di riempimento dal valore normale di 7 mmHg a circa 4 mmHg.
La pressione circolatoria media di riempimento è quasi sempre uguale alla pressione circolatoria media di riempimento che è importante per determinare il ritorno venoso.
La pressione sistemica media di riempimento normale è di 7 mmHg. La curva più in alto mostra una pressione di riempimento di 14 mmHg, mentre quella più in basso una pressione di 3,5 mmHg. Le curve dimostrano che quanto più è alta la pressione sistemica media di rempimento, cioè quanto maggiore è la tensione con cui il sistema circolatorio è riempito di sangue, tanto più sì sposta in alto e a destra la curva del ritorno venoso. Viceversa, quanto più è bassa la pressione sistemica media di riempimento, tanto più la curva si sposta in basso e a sinistra. Per esprimere il concetto in altro modo, si potrebbe dire che quanto più grande è il riempimento del sistema tanto più è facilitato il ritorno di sangue al cuore e viceversa. Inoltre, più grande è la differenza tra la pressione sistemica media di riempimento e la pressione dell'atrio destro maggiore sarà il ritorno venoso. Pertanto, la differenza tra queste due pressioni è chiamata gradiente pressorio per il ritorno venoso (ricordiamo che quando la pressione atriale uguaglia quella di riempimento non vi è più flusso).
Esiste anche una resistenza al flusso venoso del sangue. Essa è chiamata resistenza al ritorno venosoe si trova a livello delle vene. La resistenza venosa è così importante nel determinare la resistenza al ritorno venoso, perché quando la resistenza nelle vene aumenta, il sangue comincia a ristagnare in tutti i settori della circolazione sistemica. Ma la pressione venosa si alza molto poco perché le vene sono altamente distensibili. Perciò il rialzo pressorio a monte dell'aumento della resistenza venosa, non è elevato abbastanza da superare la resistenza Stessa. Il ritorno venoso allora si riduce drasticamente. Circa due terzi della resistenza al ritorno venoso sono dovuti alla resistenza venosa e circa un terzo alla resistenza arteriolare e alla resistenza delle piccole arterie. Il ritorno venoso può essere calcolato dalla seguente formula:
RV = Psr - PAD
RRV
dove RV = ritorno venoso, Psr = pressione sistemica media di riempimento, PAD = pressione dell'atrio destro, e RRV = resistenza al ritorno venoso.
Nell'uomo normale il ritorno venoso è uguale a 5 litri/min, la pressione sistemica media di riempimento è di 7 mmHg, la pressione dell'atrio destro è di 0 mmHg e la resistenza al ritorno venoso è di 1,4 mmHg per litro di flusso di sangue.
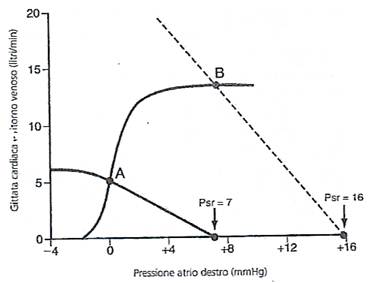 Nella funzione circolatoria globale, il cuore e il circolo sistemico devono operare insieme. Questo significa che il ritorno venoso dalla circolazione sistemica deve uguagliare la gittata cardiaca del cuore e che la pressione dell'atrio destro è evidentemente comune sia al muscolo cardiaco che alla circolazione sistemica. Si può cosi predire il valore della gittata cardiaca e della pressione dell'atrio nel seguente modo:
Nella funzione circolatoria globale, il cuore e il circolo sistemico devono operare insieme. Questo significa che il ritorno venoso dalla circolazione sistemica deve uguagliare la gittata cardiaca del cuore e che la pressione dell'atrio destro è evidentemente comune sia al muscolo cardiaco che alla circolazione sistemica. Si può cosi predire il valore della gittata cardiaca e della pressione dell'atrio nel seguente modo:
- si determina l'efficienza attuale della pompa cardiaca e si costruisce la relativa curva della gittata cardiaca;
- si valuta lo stato attuale dell'afflusso di sangue al cuore e si costruisce la relativa curva del ritorno venoso;
- si confrontano le due curve così ottenute
Nella figura sono illustrate le due curve della normale gittata cardiaca e del normale ritorno venoso. C'è solo un punto sul grafico, il punto A, in cui il ritorno venoso uguaglia la gittata cardiaca, punto in cui la pressione dell'atrio destro ha Io stesso valore sia per il cuore che per la circolazione sistemica. Nella circolazione normale, pertanto, la pressione dell'atrio destro, la gittata cardiaca ed il ritorno venoso sono tutti descritti dal punto A, che è il punto di equilibrio.
Un aumento improvviso del volume sanguigno di circa il 20% fa aumentare la gittata cardiaca di circa 2,5-3 volte. Questo effetto è illustrato dalla curva tratteggiata. Subito dopo una notevole trasfusione di sangue, la pressione sistemica media di riempiménto sale fino a 16 mmHg e la curva del ritorno venoso si sposta a destra. Nel frattempo l'aumento del volume ematico distende i vasi riducendo così la loro resistenza. Cosi anche la resistenza al ritorno venoso diminuisce provocando la rotazione della curva verso l'alto. A causa di questi due effetti si ha che la curva del ritorno venoso cambia e passa dai valori descritti dalla linea continua a quelli descritti dalla linea tratteggiata. Questa nuova curva incrocia quella della gittata cardiaca nel punto B, manifestandosi così un aumento della gittata cardiaca fino a 2,5-3 volte e della pressione dell'atrio destro fino a circa + 8 mmHg. L'aumento della gittata cardiaca indotto da aumenti del volume ematico dura solo pochi minuti perché sopravvengono immediatamente i seguenti effetti compensatori:
- L'aumentata gittata cardiaca innalza la pressione capillare, cosi che il liquido comincia a trasudare dai capillari verso i tessuti. Ciò riporta alla norma il volume ematico.
- L'aumento pressorio nelle vene causa per il meccanismo chiamato stress - rilasciamento, la graduale distensione delle vene; ciò aumenta il volume del serbatoio venoso, in special modo a livello del fegato e della milza, riducendo così la pressione sistemica media di riempimento.
- L'eccesso di flusso ematico nei tessuti perifèrici causa per l'autoregolazione un aumento della resistenza periferica e quindi della resistenza al ritorno venoso.
Questi fattori normalizzano la pressione sistemica media di riempimento e fanno costringere i vasi di resistenza del circolo sistemico. Pertanto, gradualmente, la gittata cardiaca ritorna quasi alla nonna tra 10 e 40 minuti.
La stimolazione del simpatico interessa sia il cuore che la circolazione sistemica perché :
- rende più vigorosa la pompa cardiaca,
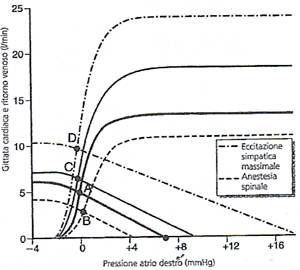 aumenta la pressione sistemica media di riempimento nella circolazione sistemica per la contrazione dei vasi periferici - in special modo delle vene
aumenta la pressione sistemica media di riempimento nella circolazione sistemica per la contrazione dei vasi periferici - in special modo delle vene - aumenta la resistenza al ritorno venoso.
Da notare che la massima stimolazione del simpatico aumenta la pressione sistemica media di riempimento a 17 mmHg (indicata dal punto in cui la curva del ritorno venoso raggiunge lo zero del livello di ritorno venoso) ed aumenta l'efficienza di pompa del cuore del 100%. Ne consegue che la gittata cardiaca sale dai valori normali del punto di equilibrio A a circa il doppio della norma, cioè al punto di equilibrio D - mentre la pressione dell'atrio destro cambia assai poco. Così i vari gradi della stimolazione del simpatico possono aumentare progressivamente la gittata cardiaca fino quasi a duplicarla - almeno per brevi periodi finché non sopravvengono gli effetti compensatori.
II sistema nervoso del simpatico può essere bloccato con anestesia spinale totale Le due curve più basse tratteggiate con tratti brevi, mostrano l'effetto dell'inibizione del simpatico da anestesia totale spinale e dimostrano che la pressione media di riempimento scende a circa 4mmHg e l'efficienza del cuore come pompa si riduce a circa l'80% del normale. La gittata cardiaca scende dal punto A al punto B, con una riduzione del 60%.
Per la misurazione della gittata cardiaca è solitamente utilizzato il metodo di Fick: 200 mi di ossigeno vengono assorbiti dal sangue polmonare ogni minuto. Il sangue che entra nel lato destro del cuore ha una concentrazione di ossigeno di 160 mi per litro di sangue, mentre quello che lascia il lato sinistro ha una concentrazione di ossigeno di 200 mi per litro di sangue. Da questi dati si può desumere che ciascun litro di sangue che passa attraverso la circolazione polmonare raccoglie 40 mi di ossigeno. Poiché la quantità totale di ossigeno assorbito dal sangue polmonare in ogni minuto è di 200 mi, un totale di 5 aliquote di sangue da un litro ciascuna deve passare attraverso la circolazione polmonare in ogni minuto per assorbire tale quantità di ossigeno. Pertanto, la quantità di sangue che scorre nei polmoni in ogni minuto è di 5 litri, e ciò è di fatto il valore che esprime la gittata cardiaca. La gittata cardiaca può essere calcolata con la seguente formula:
Gittata cardiaca (litri/min) = Ossigeno assorbito dai polmoni (ml/min) .
Differenza A-V dell'ossigeno (ml/litro di sangue)
L’attività muscolare durante gli esercizi fisici è per il sistema circolatorio la situazione più difficile da fronteggiare in condizioni normali. Il flusso muscolare totale del sangue in un giovane adulto sano può aumentare durante esercizi molto intensi da meno di 1 litro/min a 20 litri/min, determinando un incremento della gittata cardiaca di 4-5 volte in un soggetto non allenato e di 6-7 volte in quello allenato.
A riposo, il flusso ematico nel muscolo scheletrico si aggira mediamente attorno ai 3-4 ml/min/100gr di muscolo. Durante un esercizio muscolare estremo questo valore può aumentare da 15 a 25 volte, fino a 50-80 ml per 100 grammi di muscolo.
Durante le contrazioni ritmiche muscolari, il flusso aumenta e diminuisce ad ogni contrazione muscolare:
- aumenta durante la fase di rilascio
- diminuisce durante la fase di contrazione a causa della compressione dei vasi ematici da parte del muscolo che si contrae.
Al termine delle contrazioni ritmiche, il flusso sanguigno rimane elevato per qualche secondo e poi ritorna gradualmente ai valori normali nel giro di pochi minuti.
Durante le vigorose attività fisiche tutti i capillari tendono ad aprirsi contribuendo ad aumentare di due, tre volte la superficie di scambio attraverso cui avviene la diffusione dei nutrienti dal sangue.
L’aumento locale del flusso sanguigno è causato dalla riduzione dell’ossigeno nei tessuti muscolari; ciò a sua volta, provoca vasodilatazione sia perché le pareti vasali non possono mantenere lo stato di contrazione in assenza di ossigeno, sia perché la mancanza di ossigeno provoca rilascio di sostanze vasodilatanti (adenosina, ioni potassio, acetilcolina, ATP, ac. lattico, anidride carbonica).
I muscoli sono inoltre provvisti di fibre vasocostrittrici del simpatico: queste fibre secernono noradrenalìna e, se stimolate al massimo, possono ridurre il flusso ematico nei muscoli forse fino alla metà o ad un quarto del normale. Oltre alla noradrenalina secreta dalle terminazioni delle fibre vasocostrittrici del simpatico, grandi quantità di noradrenalina ed adrenalina vengono secrete dalla midollare del surrene nel sangue durante intensi esercizi fisici. La noradrenalina circolante agisce sui vasi muscolari e provoca una vasocostrizione simile a quella causata dalla stimolazione diretta del nervo simpatico. L'adrenalina, invece, ha un leggero o un moderato effetto di vasodilatazione, perchè agisce maggiormente sui recettori beta dei vasi che provocano vasodilatazione, a differenza dei recettori alfa che, stimolati principalmente dalla noradrenalina, inducono vasocostrizione
Durante l'attività muscolare si realizzano tre effetti fondamentali che assicurano il notevole flusso di sangue richiesto dai muscoli. Essi sono:
- l'attivazione generalizzata del simpatico in tutto il corpo con conseguente effetto stimolante sul circolo. Contemporaneamente la scarica del parasimpatico diretta al cuore si riduce enormemente. Ciò provoca tre importanti effetti a livello del circolo:
- il cuore aumenta notevolmente la frequenza e la forza di contrazione per l'aumento dell'azione stimolante del simpàtico e la riduzione dell'inibizione del parasimpatico.
- la maggior parte delle arteriale della circolazione periferica sì contraggono fortemente, ad eccezione delle arteriole dei muscoli attivi, che per il meccanismo di vasodilatazione locale sono dilatate al massimo. In questo modo il sangue viene transitoriamente prestato alla muscolatura. Tuttavia, due sistemi circolatori periferici, il coronarico e il cerebrale, non presentano l'effetto della vasocostrizione, perché non sono provvisti di una ricca innervazione vasocostrittrice, ma ciò è di grande vantaggiò perché sia il cuore che il cervello sono tanto importanti per l'attività muscolare quanto lo sono i muscoli scheletrici.
- le pareti muscolari delle vene e di altri sistemi di capacità della circolazione sono potentemente contratti con il risultato di far aumentare notevolmente la pressione sistemica media di riempimento. Questo è uno dei fattori più importanti nel promuovere il ritorno venoso del sangue al cuore e per incrementare la gittata cardiaca
- l'aumento nella pressione arteriosa che si verifica per:
- vasocostrizione delle arteriole e delle piccole arterie della maggior parte dei tessuti del corpo ad eccezione di quelle dei muscoli in attività
- aumento dell'attività propulsiva del cuore
- notevole incremento della pressione sistemica media di riempimento principalmente causato dalla venocostrizione
- l'aumento della gittata cardiaca è quasi interamente il risultato della stimolazione simpatica cardiaca, che provoca aumento della frequenza fino a 170-190 battiti/min e della forza di contrazione, spesso fino a due volte il normale. Se nessun cambiamento sopravviene a modificare il ritorno venoso, la gittata cardiaca potrebbe non aumentare affatto nell'esercizio fisico, in quanto il livello più elevato della curva normale è solamente di 6 litri/min. In realtà intervengono due cambiamenti importanti:
- La pressione sistemica media dì riempimento aumenta notevolmente all'inizio dell'attività intensa, come risultato in parte della stimolazione simpatica delle vene e di altre componenti capacitative della circolazione. Inoltre la tensione dei muscoli addominali e di altri muscoli del corpo comprime molti vasi interni, provocando così una ulteriore riduzione dell'intero sistema di capacità. Si innalza così la pressione sistemica media di riempimento. Negli esercizi intensi, questi due effetti concomitanti possono aumentare la pressione sistemica media di riempimento da un livello normale di 7 mmHg fino a 30 mmHg.
- riduzione della resistenza praticamente in tutti i vasi del tessuto muscolare attivo. Ciò riduce la resistenza al ritorno venoso.
L'effetto combinato dell'aumento della pressione sistemica media di riempimento e della riduzione della resistenza al ritorno venoso innalza globalmente il livello del ritorno venoso.
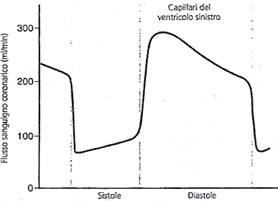 Il cuore riceve quasi interamente il suo apporto sanguigno dalla circolazione coronarica. L’arteria coronaria di sinistra irrora principalmente le parti anteriori e laterali del ventricolo di sinistra, mentre l'arteria coronaria di destra irrora la maggior parte del ventricolo destro e, nell'80-90% dei soggetti, la parte posteriore del ventricolo sinistro. La maggior parte del sangue venoso refluo dal ventricolo sinistro scorre per il seno coronario - che raccoglie circa il 75% del flusso coronarico totale - e quello dal ventricolo destro defluisce attraverso le piccole vene cardiache anteriori che sboccano direttamente nell'atrio destro e non sono in rapporto con il seno coronario. Una piccola quantità di sangue coronarico ritorna al cuore attraverso le piccole vene dì Tebesio, che sboccano direttamente in tutte le cavità cardiache.
Il cuore riceve quasi interamente il suo apporto sanguigno dalla circolazione coronarica. L’arteria coronaria di sinistra irrora principalmente le parti anteriori e laterali del ventricolo di sinistra, mentre l'arteria coronaria di destra irrora la maggior parte del ventricolo destro e, nell'80-90% dei soggetti, la parte posteriore del ventricolo sinistro. La maggior parte del sangue venoso refluo dal ventricolo sinistro scorre per il seno coronario - che raccoglie circa il 75% del flusso coronarico totale - e quello dal ventricolo destro defluisce attraverso le piccole vene cardiache anteriori che sboccano direttamente nell'atrio destro e non sono in rapporto con il seno coronario. Una piccola quantità di sangue coronarico ritorna al cuore attraverso le piccole vene dì Tebesio, che sboccano direttamente in tutte le cavità cardiache.
La Figura mostra l'andamento del flusso ematico medio attraverso i capillari nutritivi del sistema coronarico del ventricolo sinistro nel cuore umano: il flusso ematico nei capillari del ventricolo sinistro scende a valori bassi durante la sistole, al contrario di quanto si verifica in altri distretti vascolari. Ciò si deve alla forte compressione esercitata dal miocardio ventricolare di sinistra sui vasi intramuscolari durante la sistole. Nella diastole, invece, il muscolo cardiaco sì rilascia e, non ostacolando più il flusso, permette ora al sangue di scorrere rapidamente attraverso i capillari durante tutto questo periodo.
II flusso nel sistema coronarico è regolato quasi interamente dalla vasodilatazione arteriosa locale in risposta alle necessità nutritive del muscolo cardiaco: quando la forza di contrazione aumenta, indipendentemente da quale sia stata la causa, aumenta contemporaneamente anche il flusso coronarico. Viceversa, quando l'attività cardiaca si riduce, anche il flusso coronarico si riduce. Questa regolazione locale del flusso ematico è quasi identica a quella che si attua in molti altri tessuti, in particolare a quella dei muscoli scheletrici.
Il flusso sanguigno nelle coronarie è quindi di solito regolato quasi esattamente in funzione del fabbisogno di ossigeno della muscolatura cardiaca. La riduzione della concentrazione di ossigeno provoca liberazione di sostanze vasodilatatrici dalle cellule muscolari e, conseguentemente, la dilatazione delle arteriole. Inoltre la mancanza di adeguate quantità di ossigeno provoca sofferenza non solo al tessuto miocardico ma anche alla muscolatura della pareti arteriolari. Per l'assenza di energia, la contrazione dei vasi coronarici che si oppone all'elevata pressione arteriosa diminuisce e si manifesta una vasodilatazione locale.
Il controllo nervoso del flusso ematico coronarico può avvenire per:
- via diretta: dovuta all'azione dei neurotrasmettitori delle vie nervose sugli stessi vasi coronarici, quali l'acetilcolina del nervo vago e la noradrenalina del simpatico. La stimolazione del simpatico, rilasciando rioradrenalina, aumenta sia la frequenza che la contrattilità cardiaca e, di conseguenza, il metabolismo cardiaco. L'aumento dell'attività del cuore avvia, a sua volta, quei meccanismi locali di regolazione del flusso che portano alla dilatazione dei vasi coronarici. Così il flusso tende ad aumentare in modo proporzionale alle necessità metaboliche del miocardio. Al contrario, la stimolazione del vago, che libera acetilcolina, rallenta l'attività cardiaca del muscolo ed ha un leggero effetto inibitorio sulla sua contrattilità. Ambedue questi effetti riducono il consumo di ossigeno cardiaco e, pertanto, aumentano indiretta-mente il grado di costrizione delle coronarie.
- via indiretta: mediati dall'incremento o dal decremento dell'attività cardiaca che secondariamente inducono le variazioni del flusso coronarico
fonte: http://www.siamofregati.it/ftp/Fisiolo/3.Fisiologia%20del%20sistema%20cardiocircolatorio.doc
Fisiologia del cuore
Fisiologia del cuore
Visita la nostra pagina principale
Fisiologia del cuore
Termini d' uso e privacy