Buco ozono cause effetti rimedi
Buco ozono cause effetti rimedi
I riassunti, le citazioni e i testi contenuti in questa pagina sono utilizzati per sole finalità illustrative didattiche e scientifiche e vengono forniti gratuitamente agli utenti.
CHIARA PIACENTINI
IL BUCO DELL’OZONO
IL FENOMENO
La stratosfera terrestre contiene una concentrazione relativamente alta di ozono, un gas costituito da tre atomi di ossigeno (O3) e che rappresenta un vero e proprio schermo nei confronti delle pericolose radiazioni ultraviolette (raggi UV) provenienti dal sole. Ogni anno, durante la primavera dell’emisfero australe, la concentrazione dell’ozono stratosferico nell’area situata in prossimità del Polo Sud diminuisce a causa di variazioni naturali. Purtroppo, a causa degli inquinanti rilasciati in atmosfera, sin dalla metà degli anni settanta questa periodica diminuzione è diventata sempre più grande, tanto da indurre a parlare del fenomeno come del “buco dell’ozono”. Recentemente si è comunque individuato un assottigliamento della fascia di ozono anche in una piccola zona al polo Nord, sopra il Mare Artico, fatto che potrebbe preludere alla formazione di un altro buco dalla parte opposta.
In effetti il fenomeno non rappresenta nient’altro che l’aspetto più evidente della generale e graduale diminuzione dell’ozono nella stratosfera. Il problema è estremamente importante in quanto una riduzione dell’effetto schermante dell’ozono comporta un conseguente aumento dei raggi UV che giungono sulla superficie della Terra. Nell’uomo l’eccessiva esposizione a questi raggi è correlata ad un aumento del rischio di cancro della pelle, generato a seguito delle mutazioni indotte nel DNA delle cellule epiteliali. I raggi ultravioletti possono causare inoltre una inibizione parziale della fotosintesi delle piante, causandone un rallentamento della crescita e, nel caso si tratti di piante coltivate, una diminuzione dei raccolti. I raggi UV possono anche diminuire l’attività fotosintetica del fitoplancton che si trova alla base della catena alimentare marina, causando di conseguenza uno scompenso notevole a carico degli ecosistemi oceanici.
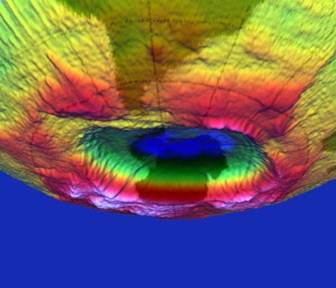
Rappresentazione a tre dimensioni del buco dell'ozono; è stata realizzata sulla base dei dati di concentrazione dell'ozono stratosferico dal Goddard Space Flight Center della NASA. In primo piano in penombra è visibile il Sud America.
Nel dettaglio l'ozono è prodotto mediante la seguente reazione:
O2 + radiaz. UV = O + O
O + O2 = O3
L’OZONO STRATOSFERICO
La formazione della maggior parte dell’ozono della stratosfera avviene a più di 30 Km di altezza, in corrispondenza della zona equatoriale dove risulta più rilevante l’irraggiamento solare. Le radiazioni UV con una lunghezza d’onda inferiore ai 242 nm dissociano l’ossigeno molecolare in ossigeno atomico che, per la sua reattività, si combina rapidamente con una molecola di ossigeno originando l’ozono (O+O2 ® O3). A loro volta le molecole di ozono che si formano nel corso di questa reazione assorbono le radiazioni solari con lunghezza d’onda compresa fra 240 e 340 nm, e questo ne provoca la fotolisi che libera un atomo ed una molecola di ossigeno (O3 ® O2+O).
In definitiva questi processi instaurano un equilibrio dinamico che mantiene la concentrazione del gas ozono pressochè costante (e che permette di schermare per assorbimento gran parte dei raggi UV). Si ritiene che la produzione globale di ozono attraverso questo meccanismo ammonti a circa 4000 tonnellate al secondo. Dalle zone equatoriali l’ozono viene trasportato verso i poli dai venti stratosferici associati con le aree cicloniche (i vortici polari) che si trovano sopra i poli stessi.
Le osservazioni da satellite e dalla terra hanno permesso di valutare la distribuzione media dell’ozono totale sia in funzione della latitudine che della stagione. L’ozono viene solitamente misurato come ozono colonnare, cioè come l’ozono presente in una colonna d’aria che si estende dalla superficie terrestre fino all’apice dell’atmosfera; viene misurato in Unità Dobson (DU). Per avere un’idea delle quantità in gioco basti considerare questo: se si portassero 100 DU di ozono sulla superficie della terra si formerebbe uno strato spesso 1 millimetro. A livello dei tropici i livelli di ozono nel corso dell’anno sono tipicamente fra 250 e 300 DU; il valore si mantiene pressoché costante perché l’attività fotochimica rimane invariata durante tutto il corso dell’anno a causa dell’intensità costante dell’irraggiamento solare. A latitudini diverse le concentrazioni sono più soggette a variazioni. I valori massimi di concentrazione si trovano alle latitudini medio-alte. Per quanto riguarda le variazioni temporali il valore massimo assoluto si verifica all’inizio della primavera alle alte latitudini. In estate si osserva una diminuzione dell’ozono fino a raggiungere un minimo in autunno. Le piccole variazioni che si possono presentare nella distribuzione longitudinale sono essenzialmente dovute all’alternarsi delle terre emerse e dei mari.
VARIAZIONI QUANTITATIVE
Come già accennato in precedenza, la quantità dell’ozono stratosferico può variare anche di molto, sia per cause naturali (cicliche od occasionali) che per l’azione degli inquinanti prodotti dall’uomo.
Esiste una variazione ciclica pluriennale legata all’attività solare che viene definita ciclo solare; dura circa 11 anni e comporta una fluttuazione dell’ozono pari all’1-2%.
La QBO è un’oscillazione legata all’alternarsi dei venti stratosferici nella fascia intertropicale da ovest e da est, è quasi biennale e provoca una variazione quantitativa dell’ordine del 2-4%.
Notevoli oscillazioni annuali (anche il 40%) sono legate alla variabilità naturale intrinseca, mentre fenomeni casuali, come le eruzioni vulcaniche, possono provocare variazioni anche del 10%.
Infine, in tutto il corso dell’anno, possono avvenire delle variazioni della durata di pochi giorni a causa delle particolari condizioni meteorologiche. Queste variazioni possono essere dell’ordine del 30-50%.
In ogni caso, L’azione degli inquinanti originati dalle attività umane è stata chiaramente documentata: a prescindere dalla naturali variazioni cicliche, questi inquinanti stanno causando in tutto il globo una graduale diminuzione dell’ozono stratosferico.
A partire dal 1979, alle latitudini più popolate del globo si è osservata una diminuzione annuale dell’ozono colonnare pari al 5% ogni 10 anni.
Nel periodo inverno-primavera nella fascia dell’emisfero settentrionale fra i 60° e gli 80° di latitudine la diminuzione è stata superiore del 7,5% ogni dieci anni. Le zone equatoriali hanno invece registrato solo una riduzione decennale dell’1,8%, probabilmente a causa degli effetti dell’eruzione del Monte Pinatubo (1991).Il cosiddetto “buco dell’ozono” situato sopra l’Antartide si ripresenta periodicamente all’inizio della primavera, nel periodo settembre-ottobre, e consiste in un brusco assottigliamento (anche del 60%) che dura per un paio di mesi; purtroppo dopo questo periodo il buco non si richiude totalmente ed in genere ogni anno si ripresenta di dimensioni ancora maggiori.
L’assottigliamento risulta più marcato in questa zona del globo soprattutto per l’azione determinante che ha il freddo nei meccanismi di degradazione dell’ozono (vedi il paragrafo specifico).
INQUINANTI IMPLICATI
Il continuo e graduale impoverimento dell’ozono della stratosfera può essere senz’altro ricondotto alla presenza in atmosfera di un gran numero di composti chimici in grado di attaccare l’ozono. Queste sostanze vengono anche definite ODS, Ozone Deplenting Substance (sostanze che distruggono l’ozono). Gli ODS sono generalmente molto stabili nella troposfera e si degradano solamente per l’intensa azione della luce ultravioletta nella stratosfera; quando si spezzano, rilasciano atomi di cloro e di bromo che danneggiano l’ozono.
Per avere un’idea quantitativa degli effetti causati dai composti ODS è stato concepito il potenziale di eliminazione dell’ozono (ODP, Ozone Depleting Potential), un numero che si riferisce all’ammontare della riduzione dell’ozono causata da un composto ODS.
Per la precisione l’ODP viene determinato sulla base del numero di atomi di cloro e di bromo presenti nella molecola, dalla “vita” atmosferica del composto (il tempo totale di permanenza nell’atmosfera, che varia da pochi mesi a migliaia di anni) e dagli specifici meccanismi implicati nella sua degradazione. L’ODP è il rapporto tra l’impatto sull’ozono di un composto chimico e l’impatto causato dal CFC-11 avente la stessa massa della sostanza presa in considerazione. Così, l’ODP del CFC-11 è definito pari a 1.
Le sostanze più implicate nel fenomeno del buco dell’ozono e più in generale nella riduzione dell’ozono stratosferico sono i Clorofluorocarburi (CFC). I CFC sono composti costituiti da Cloro, Fluoro e Carbonio. Questi composti sono comunemente utilizzati come refrigeranti, solventi ed agenti propellenti. I più comuni CFC sono i CFC-11, CFC-12, CFC-113, CFC-114 e il CFC-115. Il potenziale di danno all’ozono (ODP) per ognuno dei CFC citati è
rispettivamente: 1; 1; 0,8; 1 e 0,6. La produzione dei CFC è stata
abbandonata in base ad accordi internazionali.
Altri composti implicati nel fenomeno sono gli HCFC (Idroclorofluorocarburi), una classe di composti chimici che vengono utilizzati temporaneamente per rimpiazzare i CFC. Contengono cloro e per questo sono in grado di deteriorare la fascia di ozono nella stratosfera, ma molto meno efficacemente dei CFC. Hanno un ODP che varia a seconda dei composti fra 0,01 e 0,1. Anche la produzione di HCFC dovrà essere abbandonata (nel 2020 nelle nazioni occidentali e nel 2040 nei Paesi in via di sviluppo).
I gas Halon, anche conosciuti come Bromofluorocarburi, sono composti costituiti da bromo, fluoro e carbonio. Gli halon sono utilizzati come agenti estinguenti del fuoco sia in sistemi fissi che in estintori portatili. Causano la riduzione della fascia di ozono perché contengono il bromo (che è molte volte più efficace nella distruzione della fascia di ozono di quanto possa esserlo il cloro). Il potenziale di eliminazione dell’ozono del halon 1301 e del 1211 sono rispettivamente 10 e 3, anche se recenti studi scientifici riportano 13 e 4.
N.B. tecnicamente tutti i composti che contengono carbonio e fluoro e/o cloro sono halon.Anche altre sostanze sono implicate nella degradazione dell’ozono: per esempio il metilcloroformio ed il tetracloruro di carbonio (comuni solventi industriali) ed in definitiva tutti quei composti volatili che comprendono nella loro struttura atomi di cloro o bromo, come il bromuro di metile, una sostanza chimica molto utilizzata in agricoltura come fumigante per eliminare i parassiti.
DISTRUZIONE DELL’OZONO
La presenza dei vari inquinanti prodotti dall’uomo ha profondamente alterato i naturali meccanismi di formazione e degrazione dell’ozono stratosferico. I composti ODS nell’alta atmosfera causano infatti una lenta ma graduale degradazione dell’ozono, in modo particolarmente vistoso nell’area sopra l’Antartide. In questa zona durante l’inverno australe (in Maggio-Giugno) il Polo Sud si trova completamente immerso nelle tenebre. Nella media e bassa stratosfera si rende così evidente l’azione di una forte corrente circumpolare chiamata vortice polare. Questo vortice isola le grandi masse d’aria posizionate sopra il polo che per l’assenza dei raggi solari e per la mancanza di scambi termici con altre masse d’aria diventano sempre più fredde. Quando la temperatura raggiunge gli 80°C sotto lo zero si formano delle nubi di acido nitrico triidrato e di acqua ad alto contenuto di acido nitrico (normalmente presente in fase gassosa) chiamate nubi stratosferiche polari (PSC, Polar Stratospheric Clouds). Queste nubi costituiscono la superficie catalitica ideale per la formazione di tutta una complicata serie di reazioni che comporta la degradazione dei vari composti ODS e la liberazione di molecole biatomiche di Cloro (Cl2) e Bromo (Br2). All’insorgere della Primavera australe (Ottobre-Novembre) l’azione dei raggi del sole provoca la dispersione delle nubi stratosferiche polari e la scissione delle molecole biatomiche di cloro e bromo in singoli atomi altamente reattivi. L’improvvisa comparsa e liberazione di questi atomi provoca l’inizio di una catena di reazioni catalitiche che comporta la degradazione dell’ozono e la comparsa del cosiddetto “buco dell’ozono”. Gli atomi degli alogeni (cloro o bromo) agiscono come catalizzatori, combinandosi a ripetizione con molecole di ozono e formando una molecola di ossigeno e un monossido (ad es. Cl+O3 —> O2+ClO). Il monossido si combina poi con un atomo di ossigeno liberando ossigeno molecolare e un atomo dell’alogeno che ricomincia il processo (ClO+O —> O2+Cl). Con questo ciclo ripetitivo un singolo atomo di cloro o bromo può distruggere centinaia di molecole di ozono prima di venire neutralizzato (da sostanze come il metano, il perossido di idrogeno o l’idrogeno molecolare). Da notare che il bromo, pur essendo meno presente del cloro, è più reattivo; infatti le molecole volatili che contengono questo elemento hanno solitamente un potenziale di eliminazione dell’ozono relativamente più alto di altre sostanze come i CFC.
L’azione distruttiva delle sostanze ODS, pur essendo presente in ogni parte del globo, diventa particolarmente evidente proprio nella zona antartica per la formazione di queste nubi stratosferiche polari; in ogni caso è bene sottolineare che l’azione degli ODS si verifica dovunque nella stratosfera, seppure in maniera meno vistosa, perché l’azione dei raggi solari stratosferici comporta sempre la liberazione degli atomi di cloro e di bromo che fungono da catalizzatori nella degradazione dell’ozono.
EFFETTI SULL’UOMO
Il buco dell’ozono ed in generale la diminuzione dell’ozono stratosferico non rappresentano al momento un rischio immediato per la salute dell’uomo. Questo, comunque, se le dimensioni del fenomeno non sono destinate a crescere ulteriormente, nel qual caso la situazione potrebbe diventare drammatica. L’ozono agisce infatti schermando la maggior parte delle pericolose radiazioni UV-B provenienti dal sole ed un drastico aumento delle radiazioni ultraviolette anche nelle zone popolate della terra potrebbe causare danni impensabili. Alcuni studi teorizzano che una diminuzione dell’1% dell’ozono colonnare possa comportare un aumento delle radiazioni ultraviolette a livello del suolo pari all’1,2%. I raggi UV-B sono in grado di attaccare e danneggiare molecole come il DNA e l’RNA, così se l’esposizione a questi raggi diviene eccessiva, si possono sviluppare sia dei melanomi che altri tipi di cancro della pelle. Un altro possibile effetto consiste nella creazione di varie interferenze nella regolazione dei meccanismi di difesa immunitaria; il tutto contribuisce all’aumento delle malattie a causa delle minori potenzialità difensive naturali di ogni persona. L’effetto più evidente e diretto è invece legato all’azione che i raggi UV esercitano sulla retina dell’occhio, dove provocano danni che possono rapidamente portare alla cecità. In effetti in Patagonia ed in Nuova Zelanda, regioni vicine al Polo Sud e quindi alla zona più colpita dalla diminuzione dell’ozono stratosferico, sono sempre più frequenti i casi di cecità fra le greggi di pecore.
In definitiva bisogna ricordare che è sempre importante proteggersi contro i raggi UV-B, anche a prescindere dalla riduzione della fascia di ozono, portando cappelli, occhiali da sole e utilizzando creme solari; in ogni modo, tutte queste precauzioni diventeranno sempre più indispensabili con l’aumentare della riduzione dell’ozono stratosferico e con l’allargarsi del famigerato “Buco dell’ozono”.
EFFETTI SULL’AMBIENTE
La presenza di una graduale diminuzione dell’ozono stratosferico comporta inevitabili danni anche a carico della fauna e della flora, anche se l’assorbimento delle radiazioni UV varia molto da un organismo ad un altro. Dato che la riduzione maggiore è presente, per il momento, in aree pressochè disabitate, gli effetti non sono ancora particolarmente gravi, almeno per gli animali superiori. Questi effetti si possono comunque sempre ricondurre all’azione dei raggi UV e più specificamente ai raggi UV-B.
Diversi organismi viventi hanno sviluppato particolari meccanismi di protezione dall’azione dei raggi UV-B: limitano la loro esposizione (alcuni organismi acquatici fermano la loro attività verso metà giornata, quando l’azione dei raggi UV è più intensa); alcuni si proteggono con dei pigmenti; altri possiedono dei meccanismi di riparazione del DNA o riparano i tessuti danneggiati (dalle scottature). In ogni caso, per la maggior parte degli organismi questi meccanismi diventano insufficienti quando aumentano i livelli di irradiazione UV-B.
Dato che queste radiazioni vengono assorbite da pochi strati di cellule (logicamente quelle più superficiali), gli organismi di dimensioni maggiori sono più protetti degli esseri più piccoli, come quelli unicellulari. In effetti gli organismi marini che costituiscono il fitoplancton e lo zooplancton e che giocano un ruolo cruciale nella catena alimentare marina, sono estremamente sensibili. Sulla base di alcune ricerche sembra che diverse specie di plancton siano al limite della massima tolleranza nei confronti delle radiazioni UV. Così, anche un piccolo aumento nei livelli degli UV-B potrebbe comportare un cambiamento estremamente negativo nella varietà e nella quantità degli organismi presenti nelle acque superficiali e di conseguenza, avere ripercussioni su tutta la comunità presente nelle acque.
Sulle piante le radiazioni UV comportano in genere un rallentamento della crescita a causa di un effetto limitante nella crescita della superficie fogliare e quindi dell’area deputata alla cattura dell’energia solare. In piante irradiate da raggi UV si verifica sempre un decadimento generale ed una riduzione nel peso secco. In ogni caso, non sono comunque disponibili delle informazioni scientifiche accurate sugli effetti causati dai raggi UV per tutti gli ecosistemi vegetali, in quanto finora sono stati studiati accuratamente solamente gli effetti su foreste temperate, praterie, tundra, zone alpine e soprattutto aree coltivate. Sulla base di questi studi sono state formulate diverse previsioni negative: tanto per fare un esempio, si ritiene che ad una diminuzione del 25% della concentrazione dell’ozono stratosferico corrisponda una percentuale equivalente di riduzione nella resa della soia. Bisogna sottolineare, però, che la maggior parte degli studi fanno riferimento a pochi esemplari coltivati in serra, e diverse ricerche indicano che almeno i due terzi delle piante presentano diversi gradi di resistenza all’azione dei raggi ultravioletti; inoltre molte specie selvatiche presentano una resistenza maggiore ai raggi UV-B delle corrispondenti specie coltivate.
Piacentini Chiara
2°A Periti
EFFETTO SERRA
LE EMISSIONI
Dall’inizio della Rivoluzione Industriale, la concentrazione atmosferica dell’anidride carbonica è aumentata del 30% circa, la concentrazione del gas metano è più che raddoppiata e la concentrazione dell’ossido nitroso (N2O) è cresciuta del 15%. Inoltre dati recenti indicano che le velocità di crescita delle concentrazioni di questi gas, anche se erano basse durante i primi anni ’90, ora sono comparabili a quelle particolarmente alte registrate negli anni ’80.Nei Paesi più sviluppati, i combustibili fossili utilizzati per le auto e i camion, per il riscaldamento negli edifici e per l’alimentazione delle numerose centrali energetiche sono responsabili in misura del 95% delle emissioni dell’anidride carbonica, del 20% di quelle del metano e del 15% per quanto riguarda l’ossido nitroso (o protossido di azoto).
L’aumento dello sfruttamento agricolo, le varie produzioni industriali e le attività minerarie contribuiscono ulteriormente per una buona fetta alle emissioni in atmosfera. Anche la deforestazione contribuisce ad aumentare la concentrazione di anidride carbonica nell’aria, infatti le piante sono in grado di ridurre la presenza della CO2 nell’aria attraverso l’organicazione mediante il processo fotosintetico. Il danno è ancora più evidente se si pensa che nel corso degli incendi intenzionali che colpiscono ogni anno le foreste tropicali viene emessa una quantità totale di anidride carbonica paragonabile a quella delle emissioni dell’intera Europa. Da notare che la respirazione dei vegetali e la decomposizione della materia organica rilasciano una quantità di CO2 nell’aria 10 volte superiore a quella rilasciata dalle attività umane; queste emissioni sono state comunque bilanciate nel corso dei secoli fino alla Rivoluzione Industriale tramite la fotosintesi e l’assorbimento operato dagli oceani.Se le emissioni globali di CO2 fossero mantenute come in questi ultimi anni, le concentrazioni atmosferiche raggiungerebbero i 500 ppm per la fine di questo secolo, un valore che è quasi il doppio di quello pre-industriale (280 ppm). Il problema viene ulteriormente complicato dal fatto che molti gas serra possono rimanere nell’atmosfera anche per decine o centinaia di anni, così il loro effetto può protrarsi anche per lungo tempo.
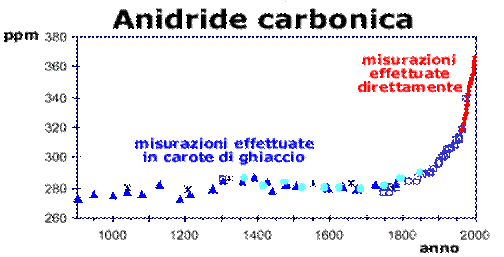
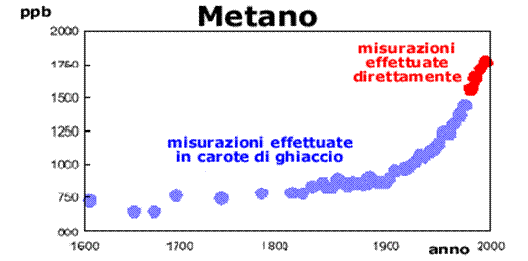
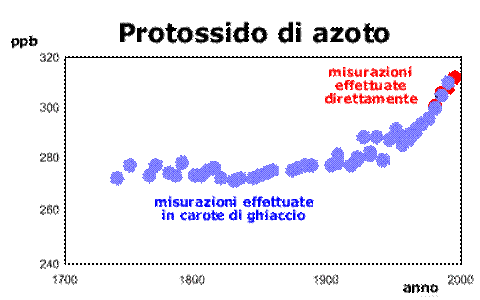
I dati che fanno riferimento al periodo in cui non erano ancora disponibili degli strumenti adatti al rilevamento delle concentrazioni dei gas serra sono stati ottenuti analizzando l'aria intrappolata nel ghiaccio risalente agli anni in esame.
Il Protocollo di Kyoto impegna i Paesi industrializzati e quelli ad economia in transizione (i Paesi dell’est europeo) a ridurre complessivamente del 5% rispetto al 1990 e nel periodo 2008–2012 le principali emissioni
antropogeniche dei gas capaci di alterare il naturale effetto serra (questi Stati sono attualmente responsabili di oltre il 70% delle emissioni). I sei gas serra presi in considerazione sono: l’anidride carbonica, il metano, il protossido di azoto (N2O), gli idrofluorocarburi (HFC), i perfluorocarburi (PFC) e l’esafluoruro di zolfo (SF6). Il vapor d’acqua non è stato considerato in quanto le emissioni di origine antropogenica sono estremamente piccole se paragonate a quelle enormi di origine naturale.
Per i Paesi in via di sviluppo il Protocollo di Kyoto non prevede alcun obiettivo di riduzione. In queste regioni la crescita delle emissioni di anidride carbonica e degli altri gas serra sta avvenendo ad un ritmo che è circa triplo (+25% nel periodo 1990-1995) di quello dei Paesi sviluppati (+8% nello stesso periodo).
La stima delle future emissioni diventa così estremamente difficile perché dipende dai vari trend demografici, economici, tecnologici e dagli sviluppi politici ed istituzionali di tutti i paesi del pianeta. In ogni caso, senza delle misure più restrittive volte alla limitazione delle emissioni, la concentrazione atmosferica dei gas serra continuerà ad aumentare fino a provocare dei danni climatici impensabili.
CAMBIAMENTI CLIMATICI
Il clima del nostro pianeta è dinamico e si sta ancora modificando da quando la Terra si è formata. Le fluttuazioni periodiche nella temperatura e nelle modalità di precipitazione sono conseguenze naturali di questa variabilità. Vi sono comunque delle evidenze scientifiche che fanno presupporre che i cambiamenti attuali del clima terrestre stiano eccedendo quelli che ci si potrebbe aspettare a seguito di cause naturali.
L’aumento della concentrazione dei gas serra in atmosfera sta causando un corrispondente incremento della temperatura globale della Terra. Le rilevazioni effettuate hanno dimostrato che negli ultimi 15 anni del XX° secolo vi sono stati i 10 anni più caldi di tutto il periodo; il 1998 è stato l’anno più caldo in assoluto. Inoltre si ritiene che la temperatura media globale superficiale possa aumentare di 0,6-2,5°C nei prossimi 15anni e di 1,4-5,8°C nel secolo in corso, pur con significative variazioni regionali.
Al momento, l’incremento risulta maggiore per quanto riguarda le temperature minime che stanno aumentando ad una velocità che è doppia di quelle massime. Il riscaldamento è maggiore nelle aree urbane sia a causa dei cambiamenti che si sono verificati nelle coperture dei terreni che per il consumo di energia che avviene nelle aree densamente sviluppate (fenomeno conosciuto come “isole di calore”).
L’aumento delle temperature comporta degli inevitabili effetti a livello meteorologico. Con l’incremento della temperatura vi è un conseguente aumento dell’evaporazione, per cui si ritiene che, a livello globale, l’inasprimento dell’effetto serra porterà ad una crescita delle precipitazioni e ad una maggiore frequenza delle tempeste di forte intensità. I calcoli sui cambiamenti climatici in aree specifiche sono molto meno affidabili di quelli globali e, di conseguenza, non è chiara la variazione che avranno i climi regionali. Si ritiene, comunque, che per il maggior calore vi sarà una riduzione dell’umidità in varie regioni delle zone tropicali che andranno incontro a frequenti siccità.
Un’ipotesi interessante è stata formulata a proposito delle future condizioni climatiche dell’Europa. Alcuni ricercatori ritengono che lo scioglimento dei ghiacci artici provocato dal riscaldamento globale provocherà un potenziamento delle correnti oceaniche provenienti dall’Artico. Queste causeranno la deviazione della Corrente del Golfo del Messico che attualmente lambisce le coste dell’Europa Occidentale. Per capire l’effetto che ha questa corrente sul clima europeo basta fare questa considerazione: a Dicembre in Normandia (Francia) la temperatura si aggira attorno allo 0 centigrado; in Canada, alle stesse latitudini si raggiungono spesso i –30°C. Il venir meno dell’effetto riscaldante della Corrente del Golfo potrebbe così paradossalmente condurre l’Europa verso una nuova glaciazione, in un periodo in cui la maggior parte della Terra va incontro ad un riscaldamento.
In ogni caso si è scoperto che, mentre la maggior parte della terra si sta riscaldando, le regioni che sono sottoposte alla ricaduta delle emissioni di biossido di zolfo si stanno in genere raffreddando. Le nuvole di solfati atmosferici prodotti dalle emissioni industriali raffreddano l’atmosfera riflettendo la luce solare verso lo spazio ed attenuano l’effetto dell’incremento della concentrazione dei gas serra; comunque i solfati hanno una permanenza atmosferica molto bassa e la loro presenza varia, anche di molto, nelle diverse zone della Terra.
EFFETTI sull’UOMO
L’aumento delle temperature a causa del riscaldamento globale provocato dall’incremento della concentrazione dei gas serra nell’atmosfera può comportare sia effetti diretti che indiretti per la salute dell’uomo.
Le temperature estremamente calde aumentano soprattutto i rischi fisici a carico delle persone che presentano problemi cardiaci. Questi soggetti sono più vulnerabili perché in condizioni termiche più elevate il sistema cardiovascolare deve lavorare in modo maggiore per mantenere la temperatura corporea stabile. Il clima più caldo comporterebbe inoltre una maggiore frequenza dei colpi di calore ed un aumento della diffusione dei problemi respiratori.
Le temperature più elevate aumentano inoltre la concentrazione dell’ozono a livello del suolo, favorendone la formazione. Le statistiche sulla mortalità e sui ricoveri Ospedalieri dimostrano chiaramente che la frequenza delle morti aumenta nei giorni particolarmente caldi, in modo particolare fra le persone molto anziane e fra i malati di asma.
In ogni luogo della Terra, la presenza e la diffusione delle malattie sono fortemente influenzate dal clima locale. In effetti molte malattie infettive potenzialmente mortali sono diffuse solamente nelle aree più calde del pianeta. Malattie come la malaria, la febbre dengue, la febbre gialla e l’encefalite potrebbero aumentare la loro diffusione se le zanzare e gli altri insetti che le diffondono trovassero delle condizioni climatiche più favorevoli alla loro diffusione.
Le temperature più elevate possono anche favorire l’aumento dell’inquinamento biologico delle acque, favorendo la proliferazione dei vari organismi infestanti.
Molti ricercatori ritengono anche che l’inasprirsi dell’effetto serra comporterebbe un aumento del fenomeno dell’eutrofizzazione delle acque, con tutti i danni biologici, economici e sanitari che questo comporterebbe.
Tutti questi problemi sarebbero di difficile soluzione anche per i Paesi Occidentali che dispongono di un patrimonio economico ed industriale enorme. Molti degli impatti del cambiamento climatico potrebbero comunque essere risolti tramite l’organizzazione ed il mantenimento di adeguati programmi a difesa dell’ambiente e della salute pubblica. Invece, nei Paesi del Terzo (e Quarto) Mondo, l’inasprimento delle condizioni ambientali provocherebbe delle situazioni sanitarie e sociali insostenibili. L’aumento delle malattie, delle carestie e degli scontri sociali per la crescente povertà e precarietà della vita comporterà delle conseguenze inimmaginabili che finiranno per ricadere anche sui paesi più civilizzati, probabilmente a giusta condanna delle colpe di cui si sono macchiati nel corso di questi ultimi secoli.
EFFETTI sull’AMBIENTE
L’incremento della temperatura della Terra può provocare una serie di effetti ambientali di notevoli proporzioni.
L’aumento del calore e quindi dell’evaporazione dai grandi bacini idrici comporta un aumento corrispondente della quantità d’acqua in atmosfera e quindi un aumento delle precipitazioni. Alcuni ricercatori ritengono che queste siano cresciute di circa l’uno per cento su tutti i continenti nell’ultimo secolo. Le aree poste ad altitudini più elevate dimostrano incrementi più consistenti, al contrario le precipitazioni sono diminuite in molte aree tropicali. In ogni caso si nota una maggiore intensità delle piogge e dei fenomeni meteorologici più violenti (come le tempeste e gli uragani) con un conseguente aumento delle inondazioni e delle erosioni a carico del terreno.Il riscaldamento globale comporta anche una diminuzione complessiva delle superfici glaciali. Le grandi masse di ghiaccio della Groenlandia e dei ghiacciai continentali stanno arretrando notevolmente; e, ultimamente, anche i ghiacci dell’Antartide hanno iniziato a diminuire.L’aumento del volume oceanico a causa della temperatura più alta e lo scioglimento dei ghiacci provocano anche l’innalzamento del livello medio del mare. Negli ultimi cento anni è cresciuto approssimativamente di 15-20 cm.Inoltre, in molte zone tropicali già si assiste ad una riduzione dell’umidità del suolo che comporta una diminuzione nella resa agricola; molte aree, anche in Europa, sono a rischio di desertificazione.
Tutti questi effetti sono già scientificamente evidenti per i molti dati ottenuti a riguardo e si ipotizza un inasprimento della situazione attuale nel caso in cui le concentrazioni dei gas serra aumentassero. Lo scenario che si può ipotizzare è impressionante: i deserti potrebbero espandersi in terre ora semiaride; le foreste, i polmoni della terra, diminuirebbero ulteriormente nella loro estensione; intere popolazioni, ora in regime di sussistenza, non avrebbero più risorse idriche a disposizione; città costiere e numerose isole scomparirebbero nel mare.
Piacentini Chiara
2°A Periti
Omar Saronni

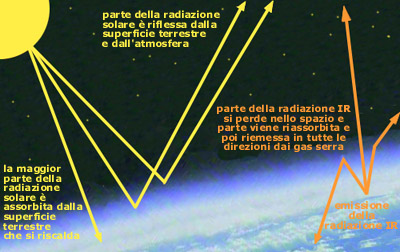
L’effetto serra è un fenomeno senza il quale la vita come la conosciamo adesso non sarebbe possibile. Questo processo consiste in un riscaldamento del pianeta per effetto dell’azione dei cosiddetti gas serra, composti presenti nell’aria a concentrazioni relativamente basse (anidride carbonica, vapor acqueo, metano, ecc.). I gas serra permettono alle radiazioni solari di passare attraverso l’atmosfera mentre ostacolano il passaggio verso lo spazio di parte delle radiazioni infrarosse provenienti dalla superficie della Terra e dalla bassa atmosfera (il calore riemesso); in pratica si comportano come i vetri di una serra e favoriscono la regolazione ed il mantenimento della temperatura terrestre ai valori odierni.
Questo processo è sempre avvenuto naturalmente e fa sì che la temperatura della Terra sia circa 33°C più calda di quanto lo sarebbe senza la presenza di questi gas.
Ora, comunque, si ritiene che il clima della Terra sia destinato a cambiare perché le attività umane stanno alterando la composizione chimica dell’atmosfera. Le enormi emissioni antropogeniche di gas serra stanno causando un aumento della temperatura terrestre determinando, di conseguenza, dei profondi mutamenti a carico del clima sia a livello planetario che locale. Prima della Rivoluzione Industriale, l’uomo rilasciava ben pochi gas in atmosfera, ma ora la crescita della popolazione, l’utilizzo dei combustibili fossili e la deforestazione contribuiscono non poco al cambiamento nella composizione atmosferica.
Il Comitato Intergovernativo sui Cambiamenti Climatici (Intergovernmental Panel on Climate Change, IPCC) ritiene che la temperatura media del pianeta sia aumentata di circa 0,6°C dal 1861. Inoltre, sulla base delle tendenze attuali di emissione dei gas serra, vi è la stima di un ulteriore aumento della temperatura terrestre tra 1,4 e 5,8°C nel periodo fra il 1990 e il 2100. Il conseguente cambiamento climatico comporterà delle implicazioni estremamente significative a carico della salute dell’uomo e dell’integrità dell’ambiente. Il clima infatti influenza fortemente l’agricoltura, la disponibilità delle acque, la biodiversità, la richiesta dell’energia (ad esempio per il riscaldamento o il raffreddamento) e la stessa economia. Il progresso che si farà nella riduzione delle emissioni dei gas serra nell’immediato futuro determinerà il livello di riscaldamento globale a cui dovranno andare incontro le generazioni che verranno. L’approccio dovrà essere necessariamente coordinato, infatti i progressi fatti con la riduzione delle emissioni in un determinato settore possono essere facilmente compromessi dall’aumento delle emissioni in un altro. In ogni caso le azioni intraprese finora a livello internazionale e locale non sono confortanti e la situazione continua a peggiorare.
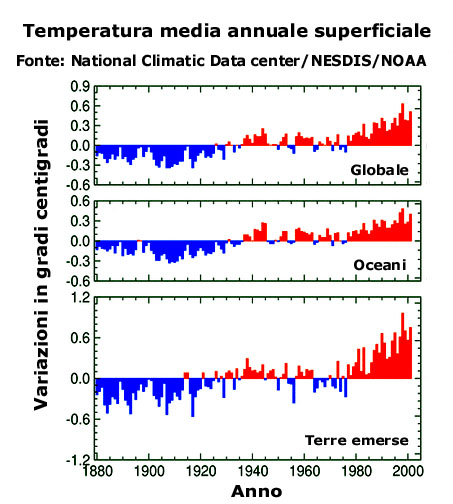
Questo grafico rappresenta la variazione delle temperature medie annuali superficiali nel corso degli anni 1880-2001. La linea dello zero rappresenta la media di tutte le temperature, mentre le barre rosse e blu indicano gli scostamenti da tale media.
Come si può vedere, c'è un chiaro trend di crescita.
Le temperature riferite alle terre emerse presentano degli scostamenti maggiori di quelle degli oceani perchè le terre si riscaldano e si raffreddano più velocemente delle acque.
 Le radiazioni provenienti dal sole non raggiungono la superficie terrestre nella loro totalità: nella misura del 25% vengono assorbite dal pulviscolo, dal vapor acqueo, dall’ozono e da molti altri gas presenti nell’atmosfera, mentre per il 30% vengono invece riflesse nello spazio dal pulviscolo atmosferico, dalle nuvole e dalla superficie terrestre.
Le radiazioni provenienti dal sole non raggiungono la superficie terrestre nella loro totalità: nella misura del 25% vengono assorbite dal pulviscolo, dal vapor acqueo, dall’ozono e da molti altri gas presenti nell’atmosfera, mentre per il 30% vengono invece riflesse nello spazio dal pulviscolo atmosferico, dalle nuvole e dalla superficie terrestre.
La frazione della radiazione solare totale che viene riflessa da un corpo qualsiasi viene anche definita “albedo”. L’albedo può essere espressa sia come percentuale che come frazione unitaria. Le aree ricoperte di neve hanno un valore elevato di albedo (circa 0,9 cioè il 90%) a causa del colore bianco, mentre la vegetazione ha un valore molto basso (circa il 10%) a causa del colore scuro e dell’assorbimento della luce ad opera della fotosintesi.
L’albedo globale terrestre, come già accennato, è circa 0,3.
La radiazione solare rimanente viene assorbita dai materiali e dagli organismi presenti sulla superficie terrestre.
L’energia ricevuta complessivamente dalla superficie terrestre e dalla troposfera viene poi riemessa sottoforma di energia termica come raggi infrarossi. Alcune sostanze presenti in atmosfera (i gas serra) assorbono gran parte di questa radiazione per poi reirradiarla in tutte le direzioni. Circa il 6% di questa energia si perde nello spazio, parte viene riassorbita nuovamente dai composti atmosferici, mentre la quantità maggiore dell’energia viene reirradiata verso la terra, riscaldandola.
I gas serra agiscono così come i vetri di una serra: fanno passare la luce solare e trattengono il calore. Il tutto comporta che la temperatura media della Terra sia di 15°C circa, un valore notevolmente più alto di quanto non sarebbe in assenza di questi gas (-18°C).
 ;
;
Rappresentazione schematica dell'effetto serra

I gas serra sono i gas atmosferici che assorbono la radiazione infrarossa e che per questo causano l’effetto serra. I gas serra naturali comprendono il vapor d’aqua, l’anidride carbonica, il metano, l’ossido nitrico e l’ozono. Certe attività dell’uomo, comunque, aumentano il livello di tutti questi gas e liberano nell’aria altri gas serra di origine esclusivamente antropogenica.
Il vapor d’acqua è presente in atmosfera in seguito all’evaporazione da tutte le fonti idriche (mari, fiumi, laghi, ecc.) e come prodotto delle varie combustioni. L’anidride carbonica è rilasciata in atmosfera soprattutto quando vengono bruciati rifiuti solidi, combustibili fossili (olio, benzina, gas naturale e carbone,), legno e prodotti derivati dal legno.
Il metano viene emesso durante la produzione ed il trasporto di carbone, del gas naturale e dell’olio minerale.
Grandi emissioni di metano avvengono anche in seguito alla decomposizione della materia organica nelle discariche ed alla normale attività biologica degli organismi superiori (soprattutto ad opera dei quasi 2 miliardi di bovini presenti sulla terra).
L’ossido nitroso è emesso durante le attività agricole ed industriali, come del resto nel corso della combustione dei rifiuti e dei combustibili fossili.
Gas serra estremamente attivi sono i gas non presenti normalmente in natura, ma generati da diversi processi industriali, come gli idrofluorocarburi (HFC), i perfluorocarburi (PFC) e l’esafluoruro di zolfo (SF6 ).
La presenza nel tempo di un gas in atmosfera è anche detta vita media atmosferica e rappresenta l’approssimativo ammontare di tempo che ci vorrebbe perché l’incremento della concentrazione di un inquinante dovuto all’attività umana scompaia e si ritorni ad un livello naturale (o perché l’inquinante è stato convertito in un’altra sostanza chimica, oppure perché è stato catturato da un deposito naturale). Questo tempo dipende dalle sorgenti dell’inquinante, dai depositi e dalla reattività della sostanza. La vita media dei gas serra può variare da 12 anni (metano e HCFC-22), a 50 anni (CFC-11), a circa un secolo (CO2), a 120 anni (N2O) ed anche a migliaia di anni (50000 per il CF4).
Per meglio definire l’apporto che ogni determinato gas serra fornisce al fenomeno del riscaldamento globale, si è concepito il potenziale di riscaldamento globale (Global Warming Potential, GWP). Questo valore rappresenta il rapporto fra il riscaldamento globale causato in un determinato periodo di tempo (di solito 100 anni) da una particolare sostanza ed il riscaldamento provocato dal biossido di carbonio nella stessa quantità. Così, definendo il GWP della CO2 pari a 1, il metano ha GWP pari a 21, il CFC-12 ha un GWP di 8500, mentre il CFC-11 ha un GWP di 5000. Vari HCFC e HFC hanno un GWP varabile fra 93 e 12100. L’esafluoruro di zolfo è un gas serra estremamente potente e ha un GWP pari a 23900, il che vuol dire che una tonnellata di SF6 provoca un aumento dell’effetto serra pari a quello causato da 23900 tonnellate di CO2.
Una misura metrica utilizzata per comparare le emissioni dei vari gas serra sulla base del loro potenziale di riscaldamento globale sono gli equivalenti di biossido di carbonio (carbon dioxide equivalent, CDE). Sono comunemente espressi in “milioni di tonnellate di anidride carbonica” (million metric tons of carbon dioxide equivalents, MMTCDE). Gli equivalenti di biossido di carbonio di un determinato gas si ricavano moltiplicando le tonnellate di gas emesso per il corrispettivo GWP.
MMTCDE = (milioni di tonnellate di gas serra)x(GWP del gas)
Spesso la stima delle emissioni dei gas serra viene anche presentata in milioni di tonnellate di carbonio equivalente (MMTCE). La formula per ottenere gli equivalenti di carbonio è:
MMTCE = (milioni di tonnellate di gas)x(GWP del gas)x(12/44)
Nel 1985 un gruppo di scienziati britannici pubblicò i risultati di una serie di misurazioni, da loro stessi effettuate, sull’atmosfera sovrastante l’Antartide. Le misure si erano protratte per otto anni, dal 1977 al 1984, e si riferivano alla quantità di ozono (forma allotropica dell’ossigeno) interno alla massa d’aria, detta stratosfera, che si estende fra i 15 e i 40 km di altezza. In essa vi è una zona chiamata appunto ozonosfera in cui è massima la concentrazione di questo gas e funziona come uno schermo protettivo che assorbe la nociva radiazione ultravioletta che proviene dal Sole, eliminandola da quella complessiva che arriva a terra. Anche se elevata rispetto al resto, la quantità di ozono presente nell’ozonosfera è in realtà poca cosa e, se portata al livello del suolo (dove la pressione atmosferica è maggiore che alle alte quote), formerebbe solo uno straterello che non riuscirebbe a superare l’altezza delle suole delle scarpe. Nonostante la sua bassa concentrazione l’ozono influisce però profondamente sulla vita della Terra perché assorbe una radiazione che in piccole dosi ci abbronza e ci fornisce l’energia necessaria per la sintesi della vitamina D, ma in dosi più elevate provoca tumori della pelle e gravi danni agli occhi.
Ebbene, i dati raccolti dal gruppo di scienziati inglesi mostravano che all’inizio della primavera antartica (cioè alla fine di settembre, primi di ottobre del nostro emisfero), quando il Sole riappariva all’orizzonte dopo la lunga notte australe, la quantità di ozono nell’alta atmosfera si riduceva drasticamente per poi tornare ai livelli normali nel giro di un mese. La scoperta venne in seguito confermata dall’analisi dei dati registrati dai satelliti negli anni precedenti a queste ultime rilevazioni, che delineavano una situazione ancora più preoccupante di quella che si poteva ricavare dalle misure effettuate a terra. Seguendo il fenomeno nel corso del tempo, si era infatti notato che il difetto si era andato aggravando di anno in anno. Non solo, ma mentre nei primi rilevamenti era necessario un mese per il recupero dei livelli ordinari, successivamente si doveva attendere l’estate per il ripristino totale dello strato di ozono.
Con il ritorno del Sole sopra il polo Sud si assisteva quindi ad un forte assottigliamento di questo prezioso strato gassoso che in alcuni anni raggiungeva il 50% del totale. Si parlò allora di “buco dell’ozono” anche se in realtà non si trattava di un vero e proprio buco, però la riduzione dello schermo protettivo era troppo importante per non richiedere uno studio approfondito.
1. OZONO: OSSIGENO TRIATOMICO
Prima di analizzare il fenomeno del buco dell’ozono ed esaminare le conseguenze che la carenza di questo gas nell’alta atmosfera comporterebbe sugli esseri viventi, occorre capire meglio cosa sia l’ozono e come si formi.
L’ozono è una forma particolare di ossigeno: è ossigeno triatomico, ossia un gas le cui molecole, invece che essere formate da due soli atomi uniti insieme com’è in quello che respiriamo, è formato da tre. La formula chimica dell’ozono è quindi O3 (O + O2 = O3) mentre quella dell’ossigeno ordinario è O2. Questo gas è conosciuto fin dall’antichità; ne parla infatti Omero nell’Iliade quando racconta che il temporale lascia dietro di sé un caratteristico odore pungente. Nel 1786 la presenza di un odore agliaceo in vicinanza di macchine elettrostatiche (lo si nota anche in occasione delle fiere paesane dove il funzionamento di alcune giostre produce scariche elettriche) fu confermata e riconosciuta come dovuta a un nuovo gas a cui fu dato il nome di ozono. La vera natura di questa sostanza e la sua formula chimica fu tuttavia accertata solo in tempi relativamente recenti.
La particolare struttura della molecola di ozono rende questo gas adatto a catturare la maggior parte delle radiazioni ultraviolette che giungono dal Sole. La radiazione solare, come sappiamo, è ricca di raggi ultravioletti di bassa lunghezza d’onda e quindi di alta energia e l’ozono, assorbendoli, impedisce che una radiazione tanto pericolosa per noi, ma anche per tutti gli altri esseri viventi, raggiunga la superficie della Terra. Nella stratosfera avvengono reazioni chimiche molto complesse che provocano una continua costruzione e demolizione di molecole di ozono. Il risultato netto di questi due processi contrapposti è che la quantità di ozono si stabilizza in uno stato di equilibrio dinamico nel quale la velocità di formazione delle molecole corrisponde esattamente alla velocità di distruzione delle stesse. Sono quindi sempre le radiazioni ultraviolette che prima creano l’ozono e poi vengono da esso assorbite, e questo assorbimento determina la sottrazione dalla molecola di quel gas dell’atomo che in precedenza era stato aggiunto all’ossigeno ordinario.
Semplificando i numerosi processi chimici che avvengono nell’alta atmosfera, possiamo fare iniziare le reazioni che conducono alla formazione dell’ozono da una molecola di ossigeno ordinario che, colpita dai raggi ultravioletti, si spezza, liberando i due atomi che la costituiscono. Questi due atomi di ossigeno libero sono altamente reattivi e immediatamente si legano ad altrettante molecole di O2 formando due molecole di O3. Le molecole di ozono così ottenute assorbono radiazioni ultraviolette di lunghezza d’onda un po’ maggiore (quindi di energia un po’ minore) di quelle che hanno determinato inizialmente la rottura delle molecole di ossigeno e vengono nuovamente dissociate nei loro componenti (O2 e O). L’atomo di ossigeno, così liberato, si unisce ad un’altra molecola di ossigeno intatta formando di nuovo ozono. Con una serie di reazioni successive l’ozono viene quindi generato, distrutto e rigenerato, sempre ad opera di radiazioni ultraviolette, in una dinamica continua di associazione e dissociazione fino a quando un atomo di ossigeno non incontra un altro atomo di ossigeno libero col quale formare una molecola di O2 stabile.
L’energia contenuta nei raggi ultravioletti viene quindi utilizzata per spezzare sia le molecole di ossigeno sia quelle di ozono con reazioni che producono calore che si disperde nell’ambiente circostante: l’ozonosfera infatti è una fascia eccezionalmente calda immersa nella fredda stratosfera. Grazie all’ozono, come abbiamo detto, solo una piccolissima frazione delle radiazioni ultraviolette è in grado di raggiungere la superficie terrestre. Esse tuttavia possono risultare pericolose anche in proporzioni ridotte soprattutto sulle persone di carnagione chiara, le quali sanno bene che devono esporsi ai raggi del Sole con molta cautela. Naturalmente i guai diventerebbero molto più seri per queste persone, ma anche per tutte le altre, qualora lo strato di ozono dovesse ridursi oltre che al polo Sud anche alle medie latitudini densamente abitate. Si è calcolato che una diminuzione di un sol punto percentuale del contenuto di ozono nell’atmosfera comporterebbe un aumento medio del due per cento dell’intensità della radiazione ultravioletta che raggiunge il suolo. Senza l’effetto filtrante dello strato di ozono la Terra sarebbe probabilmente inabitabile: le piante si seccherebbero, gli animali, uomo compreso, sarebbero colpiti da bruciature, cancro della pelle e cecità e gli oceani si riscalderebbero al punto da rendere impossibile ogni forma di vita.
2. LE CAUSE DEL BUCO
E’ normale la variazione della concentrazione dell’ozono stratosferico riscontrata nelle misurazioni effettuate in Antartide? Secondo alcuni sì, secondo altri no.
Alcuni scienziati ritengono che il buco dell’ozono sia un fenomeno del tutto naturale legato alle particolari condizioni meteorologiche delle zone polari. Questo convincimento deriva dall’osservazione che la diminuzione della quantità di questo gas nella stratosfera non è stata costante nel tempo, ma ha subito mutamenti negli anni senza che fosse preso alcun provvedimento sugli elementi che potrebbero essere la causa del suo assottigliamento. Nel 1987, ad esempio, la diminuzione dell’ozono fu quasi del 50 per cento, mentre un anno più tardi calò inspiegabilmente al 15 per cento. Come mai? Erano sbagliate le misure?
In realtà si è scoperto che sopra l’Antartide la circolazione atmosferica è organizzata come un gigantesco vortice: vi è cioè una massa d’aria isolata dal resto dell’atmosfera che circola, per gran parte dell’anno, intorno al polo australe. Nella tarda primavera, però, il vortice si rompe permettendo un rapido afflusso di aria ricca di ozono proveniente dalle zone tropicali. Questa aria che viene da nord è più ricca di ozono perché nelle zone calde la formazione di questo gas è favorita dalla radiazione solare più intensa. Lo spostamento si verifica quindi in conseguenza del fatto che l’aria stratosferica tende a migrare spontaneamente dalle grandi altezze sovrastanti i tropici, dove si forma abbondante ozono, verso altezze minori delle regioni polari dove si va accumulando il gas di recente formazione.
Prima di questo salutare arricchimento di ozono nella zona mediana della stratosfera antartica la sua quantità era diminuita per l’arrivo di aria proveniente dal basso. Con il ritorno del Sole al Polo Sud, il suolo si riscalda e con esso si riscalda anche l’aria sovrastante. Questa aria è povera di ozono e, divenuta meno densa in seguito al riscaldamento, comincia a salire fino a raggiungere la stratosfera dove non solo va a diluire lo strato ricco di ozono presente in quel luogo, ma lo sposta anche lateralmente. Fenomeni simili in cui correnti d’aria, provocate da variazioni termiche, salgono e scendono all’interno dell’atmosfera sono normali e avvengono a tutte le latitudini.
I processi dinamici che spostano masse d’aria da una zona all’altra del globo non distruggono l’ozono, ma semplicemente lo ridistribuiscono e quindi è naturale che questa teoria sia più rassicurante di quella che concerne alcune sostanze prodotte dall’uomo. La teoria dello spostamento delle masse d’aria tuttavia ha un difetto: non riesce a spiegare la causa del progressivo aggravamento del fenomeno e il sempre più faticoso recupero dei livelli normali dell’ozono stratosferico.
Vi è, di contro, un numero molto consistente di scienziati che ritiene il fenomeno del buco dell’ozono di origine umana, ossia causato da sostanze inquinanti immesse nell’atmosfera dall’uomo, prime fra tutte i tanto discussi clorofluorocarburi (CFC).
I primi allarmi sul pericolo potenziale di un depauperamento dell’ozono stratosferico vennero lanciati negli anni ’70 del secolo passato, quando si cominciarono a costruire i primi aerei supersonici. Gli scienziati avvertirono che i motori di questi aerei tanto potenti avrebbero scaricato grosse quantità di ossidi di azoto direttamente nella stratosfera dove avrebbero dovuto volare e le conseguenze sarebbero state molto gravi. Quando un motore brucia benzina, il grandissimo calore che si sviluppa all’interno dei cilindri, fa sì che una parte dell’azoto, immesso con l’aria per garantire la combustione, si combini con l’ossigeno che non ha preso parte alla reazione, formando monossido di azoto (NO). Si tratta di un gas incolore e leggermente tossico, il quale tuttavia, se rimanesse nell’aria così com’è, non arrecherebbe molto danno alla salute.
Questo gas, invece, all’aria aperta, reagisce con l’ossigeno e si trasforma in diossido di azoto (NO2), un composto di colore bruno rossastro e molto tossico. Il diossido di azoto ha la proprietà di assorbire i raggi ultravioletti di origine solare che gli “rubano” un atomo di ossigeno ripristinando l’ossido di azoto. A questo punto l’atomo di ossigeno libero, altamente reattivo, si unisce ad una comune molecola biatomica di ossigeno ordinario dando origine alla molecola triatomica di ozono ( O + O2 = O3)
L’ozono si forma quindi anche al livello del suolo, per il notevole traffico automobilistico, ma in questo caso non si tratta di un fatto positivo. L’ozono presente al suolo è un pericolo per la salute, soprattutto perché dannoso per l’apparato respiratorio, ma anche perché produce emicrania, nausea e altri disturbi del sistema nervoso. Come si vede, facciamo le cose al contrario, immettiamo ozono nella bassa atmosfera dove è dannoso alla salute e lo distruggiamo là dove invece è indispensabile. Né c’è da illudersi che l'incremento di ozono prodotto al livello del suolo dalle autovetture possa raggiungere l’alta atmosfera per reintegrare le perdite: la molecola di ozono infatti è estremamente instabile e a contatto con i corpi solidi si spezza.
Tornando agli aerei di linea supersonici (tipo Concorde per intenderci) si era calcolato che una flotta di 500 di questi aerei, volando ad un’altezza di 20.000 metri (il doppio dell’altezza a cui viaggiano i normali aerei di linea), in cinque anni avrebbe distrutto il 15% dell’ozono della stratosfera. Nonostante l’allarme lanciato dagli scienziati alcune nazioni come Francia, Inghilterra ed Unione Sovietica portarono avanti i loro programmi immettendo i nuovi aerei in circolazione. Fortunatamente studi successivi appurarono che gli aerei più piccoli producono ozono, proprio come fanno le automobili al livello della superficie terrestre e che questa parte di ozono raggiunge la stratosfera reintegrando così le perdite causate dai grossi aerei. In tempi recenti, la produzione degli aerei supersonici è stata interrotta, ma non per le motivazioni segnalate dagli scienziati.
3. IL PROBLEMA DEI CFC
Scampato il pericolo degli aerei supersonici, la minaccia allo strato di ozono veniva ora individuata nei clorofluorocarburi e si trattava in questo caso di una minaccia molto seria. I clorofluorocarburi sono dei composti sintetizzati per la prima volta nel 1930 dall’americano Thomas Midgley e rappresentarono, a quel tempo, un vero successo industriale per le loro particolari caratteristiche. Questi composti infatti sono stabili e inerti, non sono tossici, non sono infiammabili, ed è facile liquefarli per poi farli tornare alla stato gassoso: il che li rende utilizzabili per raffreddare gli ambienti. Dopo la seconda guerra mondiale, il capostipite della famiglia, il CFC-12, venne utilizzato in modo massiccio nella costruzione dei frigoriferi e per tale motivo assunse il nome commerciale di Freon.
Il Freon viene compresso da un congegno posto all’esterno del frigorifero fino a renderlo liquido; questa operazione genera calore che si disperde nell’ambiente esterno. Il liquido viene quindi introdotto nella cella frigorifera dove trova un apposito ampio contenitore entro il quale ha spazio sufficiente per espandersi e ritornare allo stato gassoso. Il gas, espandendosi, si raffredda e con esso si raffredda l’interno del frigorifero. Quindi il Freon gassoso viene rinviato al compressore esterno e il ciclo ricomincia. La sicurezza nell’uso di questo gas sta proprio nella stabilità della molecola che nessun reagente chimico è in grado di scomporre. Il suo utilizzo nei frigoriferi derivava dal fatto che anche eventuali piccole perdite non avrebbero avvelenato i cibi. In precedenza il liquido refrigerante più usato in questi elettrodomestici era l’ammoniaca la quale è un composto molto tossico e di odore sgradevole. Il Freon viene anche usato nei condizionatori d’aria, compresi quelli montati sulle automobili, dove svolge lo stesso ruolo che nei frigoriferi.
Quando l’inventore di questo eccezionale prodotto lo presentò al pubblico, per dimostrare la non pericolosità della sostanza, ne aspirò i vapori che poi espirò lentamente, attraverso il naso, su una candela accesa spegnendola. Non è la prima volta che un prodotto inventato dall’uomo si dimostra all’inizio del tutto innocuo e ricco di pregi e solo in un secondo tempo evidenzia i suoi difetti. Capitò la stessa cosa con il DDT un insetticida che all’inizio fu accolto con entusiasmo per la sua azione decisa e infallibile sui parassiti, ma che successivamente dovette essere ritirato dal mercato perché si rivelò pericoloso per la salute dell’uomo.
Nel corso degli anni la famiglia dei CFC si arricchì sempre di più e con essa si allargarono gli usi di questi prodotti. Il CFC-11 si rivelò adatto alla costruzione di isolanti termici molto usati nelle abitazioni e, insieme al capostipite CFC-12, fu impiegato come propellente nelle bombolette spray. Il CFC-13 è un solvente impiegato nell’industria elettronica per rimuovere minuscole impurità dalle piastrine di silicio.
Paradossalmente proprio la mancanza di reattività rende i clorofluorocarburi potenzialmente pericolosi per l’ozono della stratosfera. A causa della loro stabilità questi composti hanno infatti vita lunghissima che si stima fra i 75 e i 100 anni, e quindi hanno tutto il tempo, una volta usciti dai vecchi frigoriferi o dalle bombolette spray, di disperdersi nell’ambiente e salire, grazie alla loro bassa densità, fino a raggiungere le quote più alte dell’atmosfera. Qui i raggi ultravioletti ne spezzano le molecole liberando l’atomo di cloro il quale dà inizio ad una serie di reazioni che terminano con la scomposizione delle molecole di ozono.
L’atomo di cloro sottrae un atomo di ossigeno dalla molecola di ozono riducendola ad ossigeno molecolare O2 che non è più in grado di bloccare le radiazioni ultraviolette. Il cloro, dopo aver catturato un atomo di ossigeno, lo cede ad un altro atomo di ossigeno ritornando quindi libero di aggredire un'altra molecola di ozono. La reazione può ripetersi molte volte fino a distruggere con un solo atomo di cloro fino a 30 o 40 mila molecole di ozono. Anche in piccole dosi i clorofluorocarburi sono quindi pericolosi. Ma questi prodotti, presenti nell’atmosfera, attualmente non sono più in piccole dosi: ormai se ne sono accumulate milioni di tonnellate. E anche se si decidesse di interrompere istantaneamente la produzione e l’uso dei CFC, cosa fra l’altro prevista da accordi internazionali per l’inizio del nuovo secolo, l’ozono continuerebbe a diminuire perché, come abbiamo detto, i clorofluorocarburi hanno vita lunghissima tanto che per ripristinare le condizione di partenza ci vorrebbe più di un secolo di pulizia.
4. LA SOLUZIONE DEL PROBLEMA
Molti dei danni causati da sostanze prodotte dall’uomo sono, almeno in linea teorica, eliminabili con opportuni accorgimenti di natura tecnologica e quindi in pratica riducibili a livelli piuttosto bassi, grazie a modifiche dei processi produttivi e di utilizzo. La cosa deve valere, ovviamente, anche per i CFC. Ora, però, prima di accennare a eventuali interventi sulle cause che lo distruggono cerchiamo di capire bene come si accumula l’ozono sopra l’Antartide, dopo che la quantità di questo gas si è ridotta per l’azione inquinante dell’uomo.
Abbiamo visto che la radiazione solare è indispensabile per mettere in moto le reazioni che conducono alla formazione dell’ozono. Ebbene, la radiazione solare più intensa si trova sopra i Tropici e a notevole altezza, ma le concentrazioni maggiori di questo gas si registrano sopra i Poli e nella zona mediana della stratosfera. Come mai?
Sembra che il trasferimento di ozono dai Tropici dove viene prodotto ai Poli dove si accumula avvenga, come abbiamo accennato in precedenza, in seguito a particolari tempeste stratosferiche che rimescolano l’aria delle zone polari con quella delle zone equatoriali. Si è notato però che la distruzione dell’ozono, causata molto probabilmente dai CFC, si verifica sopra il Polo Sud e non da altre parti. Come mai, ad esempio, non avviene la stessa cosa sopra il polo Nord dove esisterebbero delle condizioni meteorologiche molto simili a quelle che si possono osservare sopra l’Antartide? Nell’emisfero Nord del pianeta, oltretutto, vengono prodotti e liberati nell’atmosfera molti più prodotti inquinanti che nell’emisfero Sud meno abitato e meno industrializzato e allora come è possibile che i danni maggiori allo strato di ozono si riscontrino a Sud e non a Nord?
Gli scienziati hanno cercato di dare una spiegazione del fatto. Essi ritengono che le reazioni che liberano il cloro dai CFC avvengano sulla superficie di corpi solidi i quali potrebbero essere costituiti da aghi di ghiaccio che si formano nelle sottilissime nubi che si osservano nella stratosfera sovrastante il Polo Sud e che mancano invece dalle altre parti del globo e anche al Polo nord. Le basse temperature, intorno agli 80 – 90 gradi sotto lo zero che si riscontrano nella stratosfera antartica favorirebbero ulteriormente le reazioni che coinvolgono il cloro. Se non ci fossero le nubi stratosferiche e se le temperature fossero un po’ più alte, gli ossidi dell’azoto presenti a quelle quote bloccherebbero il cloro impedendogli di aggredire le molecole di ozono.
Alle medie latitudini – asseriscono gli esperti – il monossido di cloro reagisce con il monossido di azoto liberando un atomo di ossigeno disponibile per rigenerare l’ozono. Oltre a questa, vi sarebbe un’altra reazione in grado di impedire la distruzione dell’ozono da parte del cloro. In questo secondo caso il cloro si combinerebbe con il biossido di azoto o con il metano sempre presenti soprattutto nell’atmosfera delle medie latitudini formando dei composti che, di fatto, tratterrebbero l’atomo di cloro all’interno di una particolare molecola neutralizzandone l’azione distruttiva. In parole povere sarebbe proprio l’inquinamento delle zone del pianeta più abitate e più industrializzate ad ostacolare l’attività del cloro impedendogli di distruggere lo strato di ozono. Questo inquinamento purtroppo (?) sopra l’Antartide non esiste e le conseguenze sono la distruzione dell’ozono.
I CFC forse non sono gli unici responsabili del buco nella fascia dell’ozono stratosferico, ma sicuramente sono i più importanti. Aerei attrezzati con speciali apparecchiature sono stati fatti volare sopra il continente antartico nel momento in cui si verificava l’abbassamento del livello di ozono. Le apparecchiature installate a bordo hanno registrato la presenza di una notevole quantità di cloro e contemporaneamente una rapida diminuzione dell’ozono. Questi rilevamenti hanno fugato gli ultimi dubbi: il principale responsabile del buco dell’ozono è certamente il cloro.
Cosa possiamo fare per limitare i danni prodotti dal cloro? Innanzitutto eliminare dal mercato i clorofluorocarburi che sono i principali fornitori del micidiale elemento. Certo, non è possibile dall’oggi al domani rinunciare ad un prodotto tanto indispensabile per l’industria senza prima avere provveduto alla sua sostituzione con qualche cosa di simile e meno pericoloso. In realtà sono già stati realizzati dei prodotti sostitutivi dei CFC con meno cloro nella molecola ed altrettanto efficaci, ma questi nuovi prodotti, molto costosi, contengono ugualmente una parte seppur minima di cloro. La sfida tuttavia non è solo quella di sostituire i CFC ma anche di trasferire nuove tecnologie nei paesi del terzo mondo. Se ad esempio indiani e cinesi portassero a termine i loro piani di costruzione di milioni di frigoriferi utilizzando i CFC, l’immissione di questi prodotti nell’atmosfera si moltiplicherebbe in breve tempo. Naturalmente non si può nemmeno impedire a miliardi di persone di nutrirsi meglio e di raggiungere un maggiore benessere.
Dopo che fu chiaro che i maggiori responsabili del disastro che si stava consumando erano i CFC, i rappresentanti dei Paesi maggiormente industrializzati si riunirono a Vienna nel 1985 e l'anno successivo a Ginevra per discutere il problema e trovare le soluzioni più opportune. Il risultato delle relazioni riguardanti il problema della protezione della fascia di ozono portò al cosiddetto Protocollo internazionale di Montreal, ratificato anche dall’Italia nell’agosto del 1988. In quella occasione gli USA erano propensi ad un taglio netto della produzione di clorofluorocarburi mentre gli Europei tergiversavano. I Paesi del terzo mondo, ovviamente, erano contrari a qualsiasi limitazione della produzione e della utilizzazione di un prodotto indispensabile per soddisfare alcune esigenze di sviluppo dei loro Paesi. Alla fine 34 Nazioni di tutto il mondo si accordarono per una riduzione del 50% dei consumi mondiali di CFC entro il 1998 e l’eliminazione completa di questo prodotto entro il 2000. Trentaquattro Nazioni, anche se le più industrializzate, non rappresentano tuttavia il mondo intero.
Gli americani propendevano per l’eliminazione completa di questo prodotto perché alcune società di quel Paese erano già in grado, dieci anni fa, di immettere sul mercato prodotti sostitutivi dei CFC apparentemente meno dannosi. La stessa cosa non erano in grado di fare i Paesi europei e tanto meno i Paesi terzi. Oltre a quelli economici esistono anche problemi sociali, non equamente distribuiti, legati al posto di lavoro di centinaia di migliaia di persone. Gli USA, ad esempio, che hanno pronti i prodotti alternativi, dalla messa al bando dei CFC trarrebbero vantaggio perché una soluzione del genere rafforzerebbe il settore chimico e quello elettronico- informatico di quel Paese.
Alcuni Paesi, approfittando del fatto che le certezze in campo scientifico non esistono e che la sicurezza matematica sugli effetti a lungo termine dei CFC non può essere dimostrata, invitano ad attendere per saperne di più. Questo atteggiamento, apparentemente ragionevole, potrebbe però rivelarsi pericoloso perché rimandando la soluzione del problema si rischierebbe di arrivare troppo tardi al rimedio. Questa vicenda mette in evidenza una volta di più come la solidarietà, al di là delle frontiere nazionali e sociali, sia una condizione tutt’ altro che acquisita.

Omar Saronni
2°A periti 2006-2007
Fonte:http://www.pacioli.net/ftp/def/inquinamento2//file/BUCO%20DELL%27OZONO%20ED%20EFFETTO%20SERRA.doc
Buco ozono cause effetti rimedi
Ozono e chimica della stratosfera
Tesina di De Simone Domenico & Martinelli Antonio
Introduzione
L’atmosfera circonda completamente la Terra e forma spesso uno spesso strato.
L’aria è un fluido inodore ed incolore allo stato gassoso che viene chiamato appunto atmosfera.
L’analisi chimica dell’atmosfera rivela la presenza costante di alcuni gas presenti in percentuali diverse. La tabella che segue mostra la composizione chimica dell’atmosfera e le rispettive percentuali:
Gas |
Percentuali |
Azoto (N2) |
78,03% |
Ossigeno (O2) |
20,99% |
Anidride carbonica (CO2) |
0,03% |
Argon (Ar) |
0,94% |
Idrogeno (H) |
0,001% |
Neon (Ne) |
0,0012% |
Elio (He) |
0,0004% |
I primi quattro gas della tabella si trovano nella bassa atmosfera mentre i rimanenti tre nell’alta atmosfera.
Ora forniamo una suddivisione dell’atmosfera in base al gradiente termico in modo tale da individuare la stratosfera e il suo strato di ozono.
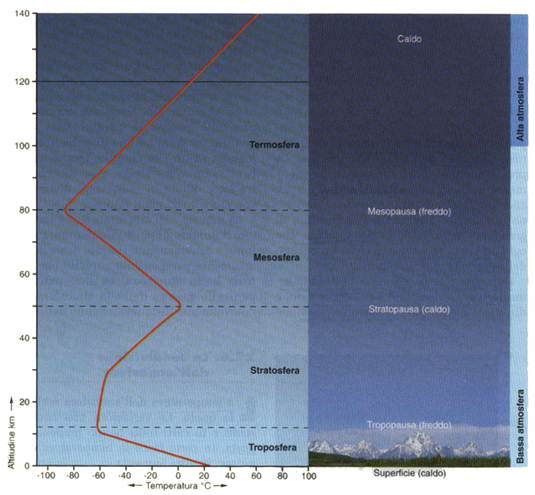
Così si suddivide l’atmosfera in base al gradiente termico.
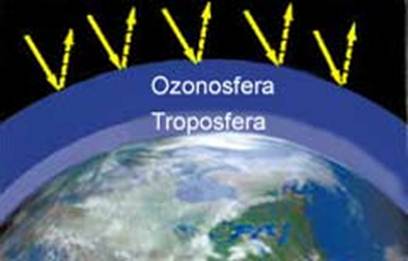
Stratosfera
La stratosfera si colloca immediatamente sopra la troposfera, lo strato atmosferico nel quale siamo naturalmente immersi, e si estende dai 15 ai 50 km circa di altezza.
Come detto in precedenza la composizione chimica della stratosfera si riferisce ai quattro gas citati prima con una percentuale pressoché irrilevante degli altri tre. I quattro gas N2, O2, CO2 e Ar sono presenti nelle stesse percentuali della troposfera ma sono più rarefatti. In questo strato si registra un’assenza di vapore acqueo, che caratterizza invece la troposfera per la determinazione dei fenomeni meteorologici, assenti in questo strato. Questo strato è invece caratterizzato da un aumento della temperatura dovuto alla presenza dell’ozono, fenomeno che chiariremo dopo.
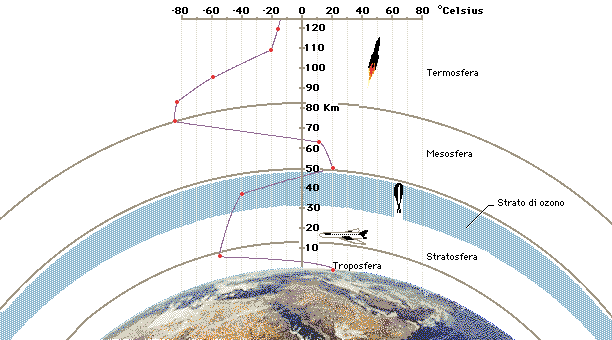
Altra immagine della suddivisione dell’atmosfera in base al gradiente termico; nella stratosfera il gradiente termico è positivo, infatti in questa sfera le temperature si alzano a causa della presenza dello strato di ozono.
Ozonosfera e formazione/distruzione ozono atmosferico
Introduzione
Ozonosfera, strato dell'atmosfera terrestre compreso tra i 20 e i 50 km di quota, caratterizzato da una concentrazione di ozono relativamente alta, che può raggiungere le 10 ppm (parti per milione).
A queste quote, l'ozono si forma naturalmente per effetto dell'interazione delle molecole di ossigeno presenti nell'atmosfera con le radiazioni ultraviolette provenienti dal Sole. La concentrazione naturale di ozono rimane pressoché costante grazie all’equilibrio tra il processo di produzione e quello di distruzione operato da alcuni composti dell'azoto, anch’essi presenti in atmosfera. L’assorbimento della radiazione ultravioletta nell’ozonosfera produce un’inversione nell’andamento della temperatura in funzione della quota: mentre nella troposfera la temperatura diminuisce al crescere della quota, nell’ambito dell’ozonosfera essa aumenta al crescere della distanza dalla superficie terrestre.
A livello della stratosfera, lo strato di ozono crea una sorta di schermo protettivo che assorbe le dannose radiazioni ultraviolette provenienti dal Sole, consentendo la vita sulla Terra. Questo tipo di radiazioni, infatti, altamente energetiche e penetranti, possono alterare e danneggiare il DNA degli esseri viventi.
Nella troposfera, invece, la formazione dell’ozono è correlata soprattutto alle emissioni inquinanti degli autoveicoli e delle industrie, che rilasciano nell’aria anidride solforosa, ossidi di azoto e composti organici volatili. Questo ozono ha un notevole potere ossidante e risulta nocivo per la salute degli organismi, uomo compreso.
Per mantenere costante la quantità di ozono nella stratosfera devono avvenire reazioni fotochimiche che devono essere in perfetto equilibrio fra di loro, ma sono facilmente perturbabili da molecole che possono interferire in questo equilibrio, come i composti clorurati (come i clorofluorocarburi), i bromurati e gli ossidi di azoto.
L’emissione di questi composti in atmosfera accentua il naturale assottigliamento dello strato di ozono che permette alle radiazioni ultraviolette di arrivare sulla superficie terrestre con la seria possibilità di provocare gravi danni agli esseri viventi. Questo problema chiamato comunemente “buco dell’ozono” sta preoccupando gli studiosi, per questo nel 1987 molti paesi del mondo hanno stipulato, nel protocollo di Montreal, la regolamentazione delle emissioni dei composti citati in precedenza.
Lo strato di ozono respinge, attraverso l’assorbimento, le radiazioni ultraviolette provenienti dal Sole.
Ozono
Ozono |
|
Nome IUPAC |
|
ozono |
|
Caratteristiche generali |
|
Formula bruta o molecolare |
O3 |
Massa molecolare (amu) |
48 |
Aspetto |
gas blu |
Numero CAS |
10028-15-6 |
Proprietà chimico-fisiche |
|
Densità (g/l) |
1,7 × 10-3 |
Solubilità in acqua |
0,57 g/l a 293 K |
Temperatura di fusione (K) |
80 (-193°C) |
Temperatura di ebollizione (K) |
161 (-112°C) |
Tensione di vapore (Pa) a 261 K |
5,5 × 106 |
Proprietà termochimiche |
|
ΔfH0 (kJ·mol-1) |
142,7 |
ΔfG0 (kJ·mol-1) |
163,2 |
S0m(J·K-1mol-1) |
238,9 |
C0p,m(J·K-1mol-1) |
39,2 |
Indicazioni di sicurezza |
|
|
|
|
|
L'ozono è un gas dall'odore caratteristico, le cui molecole sono formate da tre atomi di ossigeno (simbolo O3). Presente negli strati alti dell'atmosfera, si forma da molecole di ossigeno (O2) in prossimità di scariche elettriche, scintille, fulmini.
La sua struttura chimica è un ibrido di risonanza tra tre formule limite possibili:
![]()
che ne fa una molecola estremamente reattiva. È un energico ossidante e per gli esseri viventi è un gas altamente velenoso. È tuttavia un gas essenziale alla vita sulla Terra per via della sua capacità di assorbire la luce ultravioletta. Lo spettro di assorbimento dell’ozono va da lunghezze d’onda di 200 nm a 280 nm che permette l’assorbimento delle UV-C mentre non riesce ad assorbire efficacemente lunghezze d’onda maggiori come le UV-B (280-320 nm) e le UV-A (320-400 nm) che costituiscono il 10-30% (a seconda della latitudine) delle ultraviolette. La quantità totale di ozono che ci sovrasta è espressa in unità Dobson (DU) che equivale allo strato di ozono puro dello spessore di 0,01 mm alla densità che questo gas possiede alla pressione atmosferica a livello del suolo (1 atm). L'ozono non è stabile per lunghi periodi e non viene pertanto prodotto e commercializzato in bombole come gli altri gas industriali. Viene generalmente preparato al momento dell'utilizzo attraverso apparecchi detti ozonizzatori che convertono l'ossigeno dell'aria in ozono tramite scariche elettriche .Dato il suo potere ossidante, l'ozono viene impiegato per sbiancare e disinfettare, in maniera analoga al cloro. Tra gli usi industriali dell'ozono si annoverano i seguenti:
- disinfezione dell'acqua negli acquedotti
- disinfezione acqua delle piscine
- disinfezione dell'acqua destinata all'imbottigliamento
- disinfezione di superfici destinate al contatto con gli alimenti
- disinfezione dell'aria da spore di muffe e lieviti
- disinfezione di frutta e verdura da spore di muffe e lieviti
- ossidazione di inquinanti chimici dell'acqua (ferro, arsenico, acido solfidrico, nitriti e complessi organici)
- ausilio alla flocculazione di fanghi attivi nella depurazione delle acque
- pulizia e sbiancamento dei tessuti
- abrasione superficiale di materie plastiche e altri materiali per consentire l'adesione di altre sostanze o per aumentarne la biocompatibilità
- invecchiamento accelerato di gomme e materie plastiche per verificarne la resistenza nel tempo
Formazione e distruzione non catalitica dell’ozono atmosferico:
Formazione:
Al di sopra della stratosfera l’aria è assai sottile e la gran parte della concentrazione delle molecole di ossigeno esiste in forma atomica per effetto della dissociazione atomica delle molecole di O2 .
La dissociazione atomica è una reazione fotochimica, ovvero innescata da un input di energia sotto forma di energia luminosa e la reazione di fotolisi della molecola di O2 avviene nel modo seguente:
O2 + fotone UV-C ® 2 O
Mentre nella stratosfera stessa, l’intensità della luce UV-C è minore di quella dell’aria sovrastante perciò l’aria è più densa e l’ossigeno risulta maggiore in forma molecolare. Per questa serie di ragioni in questo strato il destino cui più comunemente gli atomi di ossigeno atomico vanno incontro è quello di collidere con quello molecolare indissociato generando così ozono:
O + O2 ® O3 + calore
Questa reazione così semplice sta alla base della formazione di tutto l’ozono atmosferico.
Distruzione non catalitica dell’ozono:
La distruzione non catalitica dell’ozono avviene naturalmente ad opera della luce UV in particolare come abbiamo citato prima di onde con lunghezze d’onda inferiori 320 nm quindi di luce UV-C e parte di UV-B. L’assorbimento di tali lunghezze d’onda permette quindi all’ozono di dissociarsi con la conseguente distruzione di tale molecola:
O3 + fotone UV (l 320nm) ® O2 + O*
L’ossigeno O* fa riferimento atomi che possiedono transitoriamente una configurazione elettronica differente da quella ordinaria, ed in particolare ci si riferisce ad atomi eccitati ovvero più energetici.
Distruzione catalitica dell’ozono atmosferico:
Esistono alcune specie atomiche indicate in generale X, che reagiscono efficacemente con l’ozono sottraendo da questo un atomo di ossigeno:
XO + O ® X + O2
La somma delle due reazioni è :
O3 + O ® 2 O2
Quindi le specie chimiche del tipo X sono catalizzatori della distruzione dell’ozono nella stratosfera dato che accelerano (in questo caso O3 e O) venendo alla fine rigenerati e partecipando nuovamente alla reazione, determinando così la distruzione di altre molecole di ozono.
Chimicamente, tutti i catalizzatori del tipo X sono radicali liberi, cioè atomi o molecole contenenti un numero dispari di elettroni; queste specie chimiche sono molto reattive perché hanno una spiccata tendenza a reagire in modo da associare il loro elettrone libero con un altro elettrone anche se questo si trova in una molecola differente.
La versione “naturale” di X , cioè già presente nella stratosfera, è la molecola dell’ossido d’azoto, NO. , prodotta quando l’ossido nitroso N2O sale dalla troposfera alla stratosfera , dove le sue molecole possono collidere con atomi d’ossigeno eccitati prodotti dalla decomposizione fotochimica dell’ozono.
N2O + O* ® 2 NO.
Le molecole prodotte in questa reazione sono catalizzatori del tipo X e agiscono nel seguente modo:
NO. + O3 ® NO2 + O2
NO2 + O ® NO. + O2
-----------------------------------
O3 + O ® 2 O2
La decomposizione dell’ozono da parte delle radiazioni UV o dei catalizzatori del tipo X dipende dalla concentrazione dell’ozono e dall’intensità della radiazione solare o dalla concentrazione del catalizzatore del tipo X ma in generale, la concentrazione dell’ozono aumenta fino a livelli a cui la velocità netta di distruzione eguaglia quella di produzione , allorché rimane costante fintantoché rimane invariata l’intensità della luce solare.
Buco dell’ozono
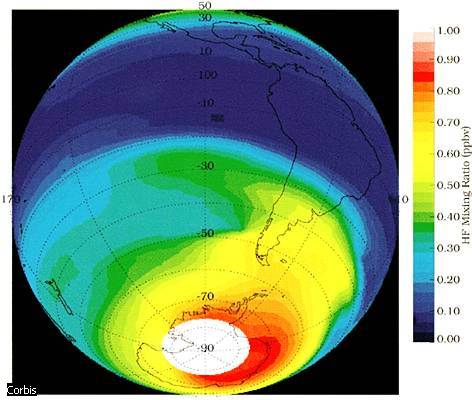
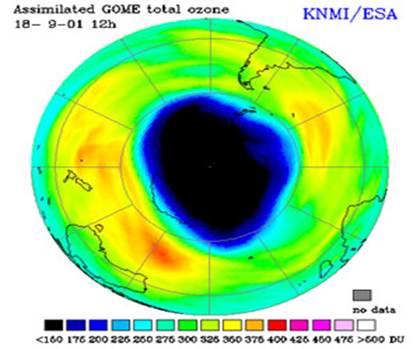
L'ozonosfera è lo strato di atmosfera terrestre in cui è massima la concentrazione di ozono. Da questa immagine, un'elaborazione di dati raccolti dalla NASA, risulta evidente che la concentrazione di questo prezioso gas non è costante intorno al pianeta, ma varia a seconda della zona geografica. In particolare, appare sensibilmente più bassa in corrispondenza dell'Antartide, dove infatti si situa l'ormai noto buco nell'ozono. La scala sulla destra riporta i valori di concentrazione del gas tracciante utilizzato (fluoruro di idrogeno, HF): a concentrazioni maggiori di HF corrispondono concentrazioni minori di ozono.
Gli scienziati hanno scoperto che ogni anno l’ozono della stratosfera al di sopra dell’Antartide si riduce fino al 50% per alcuni mesi, soprattutto per azione del cloro. Questo buco nello strato dell’ozono si forma nei mesi da settembre a novembre che al Polo Sud corrispondono alla primavera. Il buco dell’ozono compare come effetto di particolari condizioni climatiche invernali che trasformano tutto il cloro presente nelle forme cataliticamente inattive come HCl e ClONO2, nelle forme Cl e ClO. Di conseguenza, il provvisorio aumento delle specie chimiche attive provoca un’estesa, seppure temporanee, diminuizione dell’ozono.
La conversione delle forme inattive del cloro in quelle attive avviene alla superficie di cristalli formati da una soluzione di acqua e acido nitrico, HNO gassosi. La condensazione di questi gas in goccioline si verifica poiché la temperatura della bassa stratosfera sopra al polo sud, nei mesi invernali, scende fino a -80° anche se in questa parte di atmosfera la concentrazione dell’acqua è molto ridotta. Il meccanismo di riscaldamento della stratosfera (reazione tra ossigeno molecolare e ossigeno atomico) viene a mancare e, dato che la temperatura è piuttosto bassa si forma una zona di alta pressione sopra il polo sud tale, assieme alla rotazione terrestre, da creare un vortice, una massa d’aria formata da venti che superano la velocità di 300 km/h. in tale vortice non può entrare materia e l’aria all’interno viene ad essere isolata così che rimane fredda per mesi.
gassosi. La condensazione di questi gas in goccioline si verifica poiché la temperatura della bassa stratosfera sopra al polo sud, nei mesi invernali, scende fino a -80° anche se in questa parte di atmosfera la concentrazione dell’acqua è molto ridotta. Il meccanismo di riscaldamento della stratosfera (reazione tra ossigeno molecolare e ossigeno atomico) viene a mancare e, dato che la temperatura è piuttosto bassa si forma una zona di alta pressione sopra il polo sud tale, assieme alla rotazione terrestre, da creare un vortice, una massa d’aria formata da venti che superano la velocità di 300 km/h. in tale vortice non può entrare materia e l’aria all’interno viene ad essere isolata così che rimane fredda per mesi.
I cristalli prodotti dalla condensazione dei gas all’interno del vortice formano le nubi polari stratosferiche (PSC). I primi cristalli che si formano man mano che la temperatura scende sono quelli del triidrato dell’acido nitrico, HNO . 3H2. quando la temperatura scende sotto i -80°C si forma un altro tipo di cristalli di dimensioni maggiori. Le molecole di HCl in fase gassosa si legano alla superficie delle particelle di ghiaccio entrando a far parte del solido. Quando le molecole gassose di cloro-nitrato , ClONO2, collidono con queste molecole di HCl si forma cloro elementare gassoso:
. 3H2. quando la temperatura scende sotto i -80°C si forma un altro tipo di cristalli di dimensioni maggiori. Le molecole di HCl in fase gassosa si legano alla superficie delle particelle di ghiaccio entrando a far parte del solido. Quando le molecole gassose di cloro-nitrato , ClONO2, collidono con queste molecole di HCl si forma cloro elementare gassoso:
HCl(s) + ClONO2 (g) → Cl2 (g) + HNO3 (s)
Acido cloridrico cloro-nitrato superficie dei cristalli cloro biatomico acido nitrico
Durante i mesi invernali, il cloro elementare si accumula diventando la specie chimica gassosa contenente cloro più abbondante. Allorché ricompare il primo sole, all’inizio della primavera antartica, le molecole di Cl2 vengono decomposte in cloro atomico ad opera della componente UV della luce:
Cl2 + luce UV → 2 Cl
Cloro biatomico cloro atomico
Allo stesso modo, la reazione di altre molecole di ClONO2 con l’acqua contenuta nel tipo di cristalli di dimensioni maggiori produce HOCl che, per effetto della luce solare, si decompone in atomi di Cl e radicali liberi OH.
H2O (s) + ClONO2 (g) → HOCl (g) + HNO3 (s)
Cloro-nitrato superfine di cristalli grandi acido ipocloroso
HOCl + luce UV → OH + Cl
Solo quando le PSC e il vortice si sono estinti il cloro può tornare prevalentemente nella forma inattiva. La liberazione di acido nitrico dai cristalli nella fase gassosa causa la trasformazione di questo acido in NO2 per azione della luce solare:
HNO3 + UV → NO2 + OH
Quando il vortice si estingue, l’aria contenente NO2 si mescola con quella polare. Il biossido di azoto si combina rapidamente con il monossido di cloro a formare il cloro-nitrato, cataliticamente inattivo. Conseguentemente, poche settimane che le PSC e il vortice sono scomparsi, i cicli de distruzione catalitica si arrestano e la concentrazione di ozono sale nuovamente fino ai normali livelli. L’effetto di tutto questo è il buco dell’ozono che si richiude per un altro anno. Il meccanismo chimico attraverso cui il cloro atomico catalizza la decomposizione dell’ozono negli strati inferiori della stratosfera sopra il Polo Sud si può dividere in 4 parti:
1- inizia con la consueta reazione tra cloro e ozono:
Cl + O3 → ClO + O2
2-invece di reagire con l’ossigeno atomico, come avviene nella sequenza delle reazioni che portano
alla decomposizione dell’ozono nella parte superiore della stratosfera, le molecole di ClO si
combinano tra loro per formare dicloroperossido, ClOOCl (Cl2O2)
2 ClO → Cl−O−O−Cl
dicloroperossido
la velocità di questa reazione diviene importante ai fini della perdita di ozono poiché la
concentrazione di cloro aumenta gradualmente in conseguenza all’attivazione del cloro.
3/4-durante la primavera antartica la luce solare aumenta, le molecole di ClOOCl assorbono le
radiazioni UV liberando un atomo di cloro. Il radicale ClOO risultante, instabile,
successivamente si decompone liberando l’altro atomo di cloro
ClOOCl + luce UV → ClOO + Cl
ClOO → O2 + Cl
I rilevamenti compiuti dalla stazione scientifica inglese Antarctica Survey evidenziarono una diminuzione del 65% della concentrazione dell'ozono, localizzata per il 95% negli strati atmosferici compresi tra 13 e 22 km di distanza dalla superficie del pianeta. L'estensione e la durata di questa variazione stanno assumendo dimensioni sempre più ampie, come hanno confermato i rilevamenti eseguiti con palloni aerostatici e satelliti meteorologici; la concentrazione complessiva dell'ozono nell'ozonosfera è in costante diminuzione e non solo al di sopra del continente antartico, ma anche in corrispondenza delle regioni artiche.
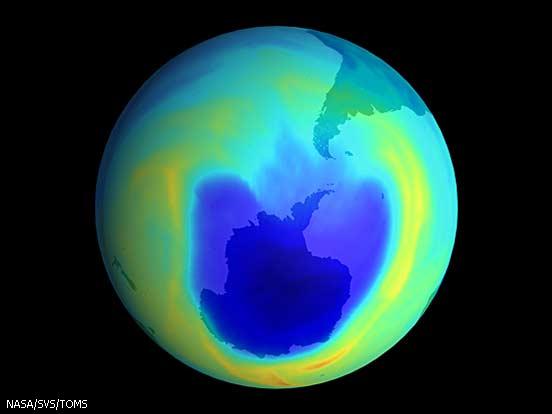
Il fenomeno noto come "buco nell'ozono" è particolarmente evidente in questa immagine a colori falsati del Polo Sud ottenuta da un satellite nell'ottobre del 1999. Le zone in cui l'ozono è più rarefatto sono rappresentate in blu.
Conseguenze biologiche del buco dell’ozono
La riduzione della concentrazione dell’ozono nella stratosfera permette ad una frazione maggiore di radiazioni UVV di raggiungere la superficie terrestre. Gran parte degli effetti biologici degli UVV derivano dal fatto che esse vengono assorbite dalle molecole di DNA che possono essere danneggiate; l’eccessiva esposizione può causare cancri, tra cui il melanoma maligno, della pelle e può avere effetti negativi sul sistema immunitario dell’uomo e sulla crescita di alcune piante e animali. Si prevede che per ogni unità percentuale di diminuizione del livello di ozono nella stratosfera si verificherà un aumento dell’1-2% dell’incidenza del cancro della pelle.
CFC e loro ruolo:
I clorofluorocarburi
I clorofluorocarburi (CFC) furono inventati negli anni '20. Sono composti del carbonio contenenti cloro e fluoro. Sono sostanze chimiche inventate dall'uomo, perciò dette di sintesi o sintetiche. Dalla loro introduzione, i CFC sono stati usati come:
- Refrigeranti nei frigoriferi e negli impianti di condizionamento dell'aria
- Propellenti negli spray
- Agenti schiumogeni nella produzione di imballaggi
- Detergenti usati nell'industria elettronica
- Prodotti chimici per estinguere incendi
I CFC sono particolarmente indicati per questi usi poiché sono ininfiammabili, atossici, hanno un'alta stabilità chimica e le loro caratteristiche chimiche sono particolarmente adatte alle applicazioni citate. Sono inoltre relativamente economici rispetto ai prodotti alternativi e questa è sempre una buona ragione perché un particolare prodotto chimico divenga popolare nell'industria. I CFC sono relativamente sicuri finché restano nella troposfera e negli oceani. E' solo quando passano nella stratosfera che cominciano a rappresentare una minaccia per lo strato di ozono. I tre CFC (clorofluorocarburi) responsabili della liberazione del Cloro, radicale libero, che attraverso le reazioni chimiche descritte in precedenza distrugge le molecole di ozono sono: CF2Cl2 , CFCl3, CF2Cl¾ CF2Cl.
Le tre sostanze citate prima sono anche note, rispettivamente nell’ordine precedente, con i nomi di CFC-12, CFC-11, CFC-113 ed in particolare le prime due hanno anche il nome commerciale di Freon-12, Freon-11 dato da una multinazionale che li produceva.
Queste tre sostanze non riescono ad essere rimosse una volta immesse nella troposfera da nessun processo naturale tanto che il CFC-11 si decompone naturalmente dopo 60 anni ed il CFC-12 dopo 105 anni, ed è anche questo uno dei motivi della loro pericolosità.
Una delle reazioni che libera il cloro è la seguente:
CF2Cl2 + UV-C ® CF2Cl. + Cl.
I CFC-11 e CFC-12 attualmente sono i responsabili della pressoché totale distruzione dell’ozono da CFC.
Alternative ai CFC
Le due principali alternative ai CFC sono gli idroclorofluorocarburi (HCFC) e gli idrofluorocarburi (HFCs). Entrambe queste sostanze chimiche contengono idrogeno e questo significa che esse reagiscono con la troposfera prima di riuscire a raggiungere la stratosfera, dove è situato lo strato di ozono. Solo una piccola frazione di queste sostanze riesce ad attraversare la troposfera e a raggiungere la stratosfera e quindi esse presentano un pericolo molto minore per lo strato di ozono.
Gli HCFC contengono cloro, che può essere rilasciato così come quello presente nei CFC, ma essi vengono usati in quantità ridotta e non permangono in atmosfera tanto a lungo quanto i CFC.
Gli HFC non contengono cloro e non si conosce un modo in cui essi possano essere decomposti nella troposfera, per cui essi possono attaccare e distruggere le molecole di ozono.
Riscaldamento globale provocato da CFC
CFC, insieme a HCFC e HFC, assorbono tutti la radiazione infrarossa riflessa dalla superficie della Terra. Questo significa che essi contribuiscono tutti al riscaldamento globale. Comunque l'impatto degli HFC e degli HCFC è molto minore di quello dei CFC in quanto essi non permangono in atmosfera così a lungo, il che significa che, nella loro vita media, essi assorbono una minore quantità di radiazione infrarossa. Per questo motivo hanno un impatto minore sull'ambiente.
Le posizioni politiche e le controversie sul buco nell'ozono
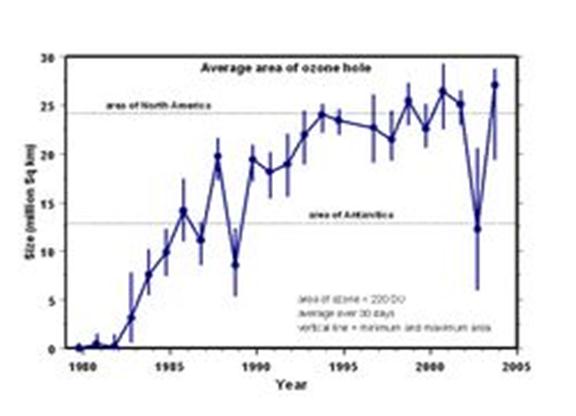
Incremento del buco nell'ozonosfera dal 1979 al 2003.
Gli ambientalisti asseriscono che i CFC hanno causato danni così gravi allo strato di ozono che dovrebbero essere completamente banditi. La completa entità dei danni provocati dai CFC non è conosciuta e non lo sarà ancora per decine di anni; in ogni caso sono già state osservate marcate diminuzioni della colonna di ozono (come è stato spiegato sopra). Nel 1987 è stato firmato il protocollo di Montreal, che controlla le emissioni di CFC. In parte, questi sono stati sostituiti dai meno dannosi idroclorofluorocarburi (HCFC): per alcune applicazioni (come i condizionatori per automobili), si è passati anche all'uso di idrofluorocarburi (HFC), che non contenendo atomi di bromo o di cloro non sono dannosi per lo strato di ozono, ma che sono comunque dei potenti gas serra. In ogni caso, tutte le misure contro l'impoverimento dello strato di ozono che abbiano risvolti negativi per l'economia rimarranno degli argomenti controversi, dati i forti interessi economici in gioco: il dubbio più comune che viene avanzato è che la comprensione dei meccanismi di impoverimento dello strato di ozono non siano stati compresi appieno, e quindi le contromisure non saranno sicuramente efficaci. In quest'ottica, si pensa che la relativa facilità di introduzione del protocollo di Montreal è stata causata dalla disponibilità di sostituti a basso costo dei CFC. Fra la maggior parte dei chimici e fisici dell'atmosfera, è opinione diffusa che la comprensione scientifica ha raggiunto un livello che giustifica le contromisure adottate per limitare la diffusione dei CFC, anche se la decisione finale spetta all'opinione pubblica e ai legislatori.
Protocollo di Montreal
Riportiamo l’introduzione del testo presentato al protocollo di Montreal dove si è discusso del problema del buco dell’ozono.
“Concluso a Montreal il 16 settembre 1987
Le Parti al presente protocollo,essendo Parti alla Convenzione di Vienna per la protezione dello strato d'ozono;
memori del loro obbligo, ai sensi di tale Convenzione, di adottare adeguati provvedimenti per tutelare la salute dell'uomo e l'ambiente da effetti nocivi derivanti o che possono derivare da attività umane che modificano o possono modificare l'ozonosfera;
riconoscendo che le emissioni a livello mondiale di talune sostanze possono impoverire in misura significativa o modificare in altro modo l'ozonosfera, tanto da farne eventualmente derivare effetti nocivi per la salute umana e per l'ambiente;
consapevoli dei potenziali effetti climatici delle emissioni di dette sostanze;
coscienti che le misure adottate per proteggere l'ozonosfera dalla deplezione dovrebbero essere fondate su cognizioni scientifiche pertinenti, tenendo conto di considerazioni tecniche ed economiche;
determinate a proteggere l'ozonosfera con l'adozione di misure precauzionali per regolamentare equamente il volume mondiale totale delle emissioni delle sostanze che impoveriscono l'ozonosfera, in vista dell'obiettivo finale della loro eliminazione, secondo gli sviluppi delle conoscenze scientifiche, e tenendo conto di considerazioni tecniche ed economiche,
riconoscendo la necessità di norme speciali per far fronte alle esigenze dei Paesi in via di sviluppo per quanto riguarda tali sostanze;
notando i provvedimenti precauzionali già adottati a livello nazionale e regionale per controllare le emissioni di alcuni fluorocloroidrocarburi;
considerando l'importanza di promuovere una cooperazione internazionale per la ricerca e lo sviluppo della scienza e della tecnologia per quanto riguarda il controllo e la riduzione delle emissioni di sostanze che impoveriscono l'ozonosfera, tenendo conto segnatamente dei fabbisogni dei Paesi in via di sviluppo[…]”
le nazioni partecipanti dovranno impegnarsi a seguire gli articoli proposti da questo protocollo; ve ne riportiamo qualcuno:
“[…]Articolo 2A - CFC
1. Ciascuna Parte si assicurerà che, per il periodo di dodici mesi avente inizio il primo giorno del settimo mese successivo alla data di entrata in vigore del presente Protocollo, e successivamente, per ogni periodo di dodici mesi, il suo livello calcolato di consumo delle sostanze regolamentate della categoria I dell'Annesso A non superi il suo livello calcolato di consumo per il 1986. Al termine di detto periodo, ciascuna Parte che produca una o più tali sostanze si assicurerà che il suo livello calcolato di produzione delle sostanze non superi il suo livello calcolato di produzione per il 1986, ad eccezione di un eventuale incremento di tale livello non superiore al 10 per cento massimo rispetto ai livelli del 1986. Tale incremento sarà consentito solo nella misura in cui corrisponde[…]
[…]Articolo 6 - Valutazione e riesame delle misure di regolamentazione
A decorrere dal 1990 ed in seguito almeno ogni quattro anni, le Parti procederanno ad una valutazione dell'efficacia delle misure di regolamentazione disposte nell'articolo 2 in base alle informazioni scientifiche, ambientali, tecniche ed economiche in loro possesso. Almeno un anno prima di ogni valutazione, le Parti convocheranno appositi gruppi di lavoro di esperti qualificati nei predetti settori determinando la composizione ed il mandato di ciascuno di tali gruppi. Entro un anno a decorrere dalla loro convocazione, i gruppi comunicheranno le loro conclusioni alle Parti, per il tramite del Segretariato.[…]
[…]Articolo 16 - Entrata in vigore
1. Il presente Protocollo entrerà in vigore il 1o gennaio 1989, a condizione che almeno undici strumenti di ratifica, accettazione, approvazione o adesione al Protocollo, siano stati depositati a tale data da Stati o da organizzazioni regionali di integrazione economica il cui consumo di sostanze regolamentate rappresenti almeno i due terzi del consumo mondiale stimato di sostanze regolamentate nel 1986, ed a condizione che siano state osservate le disposizioni del paragrafo 1 dell'articolo 17 della Convenzione. Se queste condizioni non sono state soddisfatte per quella data, il Protocollo entrerà in vigore il novantesimo giorno successivo alla data alla quale queste condizioni sono state soddisfatte.[…]”
questi sono solo alcuni degli articoli, i più significativi. I risultati di questo protocollo si vedono dato che dal 1989 la concentrazione di ozono nella stratosfera, pur diminuendo continuamente, non subisce più un processo veloce di distruzione, infatti prendendo da esempio la sostituzione dei CFC con altri composti non nocivi per l’ozono si osserva come tale distruzione è diminuita notevolmente.
Bibliografia e sitografia
- “Chimica ambientale”, Colin Baird
- “Le scienze delle terra e l’universo intorno a noi”, Alfonso Borsellini
- “Elementi di chimica sez. F” , Corradi Elis
- enciclopedia Wikipedia (it.wikipedia.org)
- enciclopedia Encarta
- www.interfred.it
Fonte: http://poppif.altervista.org/risorse/ozono.doc
Buco ozono cause effetti rimedi
Visita la nostra pagina principale
Buco ozono cause effetti rimedi
Termini d' uso e privacy