Corrosione dei metalli
Corrosione dei metalli
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
UGO APOSTOLO

LA CORROSIONE
INTRODUZIONE
I materiali metallici usati nella maggior parte delle tecnologie hanno grande affinità con l'ossigeno, l'acqua, lo zolfo, l'anidride carbonica,…: dunque possono essere attaccati, anche profondamente, se non debitamente impiegati o protetti, per esempio, con opportuni rivestimenti.
In natura, infatti, solo pochissimi metalli (oro, platino, palladio, iridio) si trovano allo stato elementare, tutti gli altri sono combinati sotto forma di ioni nei composti che costituiscono i vari minerali.
Non appena, in seguito alle operazioni metallurgiche, i metalli vengono estratti dai loro minerali, essi subiscono da parte degli agenti atmosferici una profonda aggressione che tende a riportarli allo stato di ione.
La chimica generale definisce METALLO ogni elemento che dimostri tendenza, in opportune condizioni, a ossidarsi cioè a perdere elettroni per diventare ione positivo.
Viene definita la capacità di acquistare elettroni, cioè di ridursi, POTENZIALE DI RIDUZIONE o POTENZIALE REDOX e si esprime in volt [V].
Tanto più il potenziale redox di un dato metallo è basso, tanto più facilmente esso è disponibile all'ossidazione e quindi a lasciarsi degradare a ione positivo.
Si può dunque affermare che si verifica corrosione ogni qualvolta un metallo subisce un fenomeno di ossidazione e, trasformandosi in ione positivo, assume una nuova veste chimica più stabile.
Un esempio può essere offerto dalle seguenti reazioni:
Me - n×e- ® Men+ reazione di ossidazione
O2 + 2×H2O + 4×e- ® 4×OH - reazione di riduzione
dove Me generico metallo ed e- elettrone.
Le reazioni elettrochimiche di corrosione implicano la presenza di processi di ossidazione che liberano elettroni e di processi di riduzione che li consumano: le reazioni di ossidazione e riduzione devono essere contemporanee e avvenire complessivamente alla stessa velocità per evitare l'accumulo di cariche elettriche sul materiale. E' possibile che allo stato di ione positivo il metallo reagisca con un eventuale anione (ione negativo) presente nell'ambiente. La misura della capacità che gli ioni positivi hanno di formare composti chimicamente stabili con gli anioni dell'ambiente viene fornita dal valore del prodotto di solubilità dei relativi composti: i composti si formeranno tanto più facilmente tanto più basso è il valore del loro prodotto di solubilità.
Si noti come la reazione di riduzione in un ambiente assolutamente anidro (privo d'acqua) o assolutamente privo di ossigeno sia impossibile: diventa dunque impossibile anche la reazione di ossidazione.
Per taluni materiali, quali ad esempio l'alluminio, sulla superficie si forma uno strato di ossido (o di un composto) che impedisce il prosieguo della azione aggressiva (PASSIVAZIONE).
I metalli, quali l'oro e il platino, che si trovano allo stato elementare vengono difficilmente ossidati e sono detti NOBILI.
La reazione dell'ossigeno con i materiali metallici può avvenire in presenza o in assenza di acqua.
L'attacco in assenza di acqua, CORROSIONE SECCA, è normalmente apprezzabile solo a temperature elevate.
L'attacco in presenza di acqua, allo stato condensato, viene indicato normalmente con il termine di CORROSIONE UMIDA.
Il decadimento del materiale prodotto da un processo corrosivo non è connesso soltanto alla dissoluzione macroscopica del materiale stesso ma si riferisce anche alla riduzione della efficienza funzionale dell'oggetto di cui esso è parte integrante.
Per CORROSIONE quindi si può anche intendere un fenomeno spontaneo di graduale decadimento tecnologico ad opera dell'ambiente che circonda il materiale.
Il termine corrosione viene di solito applicato ai metalli e loro leghe (materiali metallici), mentre per gli altri materiali da costruzione si preferisce usare il termine DEGRADAZIONE.
L'entità del fenomeno può essere espresso come INTENSITA' DI CORROSIONE in termini di variazione di massa per unità di superficie e per unità di tempo [ad esempio mg×dm-2×d-1], oppure in termini di VELOCITA' DI CORROSIONE considerato come penetrazione del processo corrosivo nella massa nell'unità di tempo [mm×a-1].
L'andamento della velocità di corrosione nel tempo dipende da fattori elettrochimici e fisici che intervengono durante il processo di corrosione.
Il fenomeno provocato dalla corrosione può essere valutato in termini di COSTO per DANNI DIRETTI e DANNI INDIRETTI.
Si considerano costi per danni diretti quelli riferiti alla sostituzione delle parti corrose e, in generale, quelli riferiti al procacciamento del materiale base e dei relativi processi tecnologici.
Si considerano costi per danni indiretti, più difficili da valutare e ben più consistenti, quelli che colpiscono l'economia aziendale come, per esempio, la diminuzione dei rendimenti sia in termini di produttività, sia in termini di qualità, il danno di immagine, il danno ecologico provocato da una eventuale fuoriuscita di elementi inquinanti, i costi per il controllo e la sicurezza dell'impianto, il blocco dell'impianto per la riparazione e/o la sostituzione della parte corrosa, …
Sarà quindi necessario trovare un punto di equilibrio tra i processi corrosivi, inarrestabili perché di tipo naturale, ed i processi anticorrosivi utilizzati per controllare e rallentare la corrosione stessa.
I provvedimenti contro la corrosione possono essere di natura diversa e possono essere presi in fasi diverse:
- progettazione: alcuni fenomeni di corrosione traggono origine da particolari situazioni (interstizi, cavità di raccolta di colaticci, sfiati a bassa quota,…) o da sollecitazioni meccaniche (provocate da dilatazioni termiche, vibrazioni, cicli di fabbricazione, montaggi errati,…) e termiche (flussi e salti termici, irraggiamento,…) cui si può, in buona parte, porre rimedio nella fase di progettazione dell'impianto;
- scelta dei materiali;
- manutenzione ed ispezione;
- organizzazione delle procedure di intervento.
DEFINIZIONE E CLASSIFICAZIONI
Per corrosione si può intendere quell'insieme di fenomeni di natura meccanica, chimico-fisica o biologica, che provocano il graduale deterioramento di un solido con il concorso dell'ambiente con cui esso si trova a contatto.
I corpi non modificano soltanto il loro aspetto superficiale ma anche le proprietà fisiche e meccaniche, tra quest'ultime l'allungamento dopo rottura (A) è quella che risente maggiormente del fenomeno.
Noi tratteremo la corrosione dei materiali metallici; di questa, la normativa dà la seguente definizione:
FENOMENO DI NATURA CHIMICO-FISICA CHE PROVOCA IL GRADUALE DECADIMENTO DELLE CARATTERISTICHE DEL MATERIALE CON IL CONCORSO DELL'AMBIENTE CHE LO CIRCONDA.
La corrosione di un materiale metallico è definita:
- corrosione umida: se avviene in presenza di acqua o di altro elettrolita allo stato condensato;
- corrosione secca: se avviene in assenza di acqua o di altro elettrolita allo stato condensato.
Viene distinta in:
- corrosione per correnti impresse (correnti esterne): dissoluzione del materiale metallico causata da correnti elettriche generate fuori dal sistema in cui ha luogo il processo corrosivo; per la valutazione dei fenomeni di corrosione si deve considerare l'andamento nel tempo delle correnti disperse per quanto riguarda sia la loro intensità, sia la loro polarità; viene denominata:
- corrosione anodica: quando la dissoluzione del materiale metallico è provocata dal passaggio della corrente dal materiale metallico (anodo) al mezzo corrosivo;
- corrosione catodica: quando le modificazioni del mezzo corrosivo provocate dal passaggio della corrente dal mezzo corrosivo al materiale metallico (catodo) rendono possibile una corrosione spontanea del materiale stesso;
- corrosione spontanea: dissoluzione del materiale metallico causata da elementi galvanici formati dal materiale metallico e dal mezzo corrosivo ed alla quale corrisponde una diminuzione dell'energia libera del sistema; si usa il termine di:
- corrosione per microelementi galvanici: le aree anodiche e catodiche hanno dimensioni minori di 0,1 mm; la formazione di microelementi galvanici è dovuta a eterogeneità microscopiche del materiale metallico (inclusioni, segregazioni, fasi precipitate, eterogeneità strutturali, eterogeneità cristallografiche, bande di scorrimento,…) ovvero a discontinuità microscopiche (porosità, cricche,…) degli eventuali strati ricoprenti (ossidi, rivestimenti metallici,…);
- corrosione per macroelementi galvanici: le aree anodiche e catodiche sono di maggiore estensione; la formazione di macroelementi galvanici è dovuta ad eterogeneità macroscopiche presenti nel materiale metallico o derivanti dall'accoppiamento di materiali metallici differenti, ovvero a eterogeneità della soluzione a contatto.
Le eterogeneità del materiale metallico possono essere dovute a differenze nella struttura (per esempio incrudimenti), a segregazioni o a inclusioni macroscopiche, a strati superficiali ricoprenti soltanto parzialmente la superficie del materiale metallico.
L'eterogeneità della soluzione può essere dovuta a diverse condizioni fisiche (temperatura, velocità,…) ovvero a differenza di composizione chimica, di pH, di gas disciolti nella soluzione. Essa può essere causata o mantenuta da particolari condizioni geometriche (cavità, fessure, fori, intagli,…), ovvero dalla diversa costituzione fisica (per esempio: sedimenti) che limitano l'apporto per diffusione o per convezione di determinate sostanze (per esempio: ossigeno atmosferico) su certi punti del materiale metallico.
Nell'esempio, di seguito riportato, vediamo la macrocella galvanica con elettrodi di zinco e di rame. Nel circuito, al momento in cui viene chiuso e gli elettroni fluiscono, la differenza di potenziale tra l'elettrodo di rame e quello di zinco è di +1,10 V.
Le reazioni parziali di riduzione sono:
Zn2+ + 2×e- ® Zn E = - 0,76 V
Cu2+ + 2×e- ® Cu E = + 0,34 V
Si ossida l'elettrodo che ha il potenziale di riduzione più negativo, mentre la reazione di riduzione ha luogo sull'elettrodo con potenziale più positivo; quindi l'elettrodo di zinco sarà l'anodo della cella e si corrode, mentre l'elettrodo di rame sarà il catodo: all'anodo è assegnata polarità negativa e al catodo polarità positiva.
Il potenziale elettrochimico complessivo della cella si ottiene sommando il potenziale di ossidazione della semicella di zinco al potenziale di riduzione della semicella di rame. Si noti che il potenziale deve essere cambiato di segno quando la reazione è scritta come reazione di ossidazione:
ossidazione Zn ® Zn2+ + 2×e- E = + 0,76 V
riduzione Cu2+ + 2×e- ® Cu E = + 0,34 V
______________________________________________________
reazione globale Zn + Cu2+ ® Zn2+ + Cu E = +1,10 V
Fra i casi di corrosione spontanea hanno particolare importanza:
- la corrosione per svolgimento di idrogeno, nella quale lo sviluppo di idrogeno è il processo catodico che compensa stechiometricamente il processo anodico di dissoluzione del materiale metallico:
2×H+ + 2×e- ® 2×H ® H2
E' la tipica reazione della corrosione dei metalli in soluzione acida.
La formazione di idrogeno molecolare da quello atomico procede con difficoltà e tende ad arrestarsi, tuttavia se è presente ossigeno diventa possibile la reazione:
4×H + O2 ® 2×H2O
e la reazione catodica si sblocca riattivando la corrosione;
- la corrosione per riduzione di ossigeno, nella quale la riduzione dell'ossigeno è il processo catodico che compensa stechiometricamente il processo anodico di dissoluzione del materiale metallico:
O2 + 2×H2O + 4×e- ® 4×OH -
possibile in soluzione neutra o alcalina.
Si noti in entrambe l'importanza fondamentale dell'ossigeno.
DISTRIBUZIONE DELLA CORROSIONE
Corrosione diffusa: quando, indipendentemente dal suo aspetto morfologico, interessa tutta la superficie considerata del materiale metallico e lo spessore del materiale interessato dal fenomeno è mediamente uguale.
Sono esempi di corrosione diffusa:
- la corrosione uniforme: interessa tutta la superficie considerata del materiale metallico e lo spessore del materiale dissolto è uguale in tutti i punti;
- la corrosione puntiforme (pitting corrosion): si manifesta con piccoli crateri di corrosione isolati tra loro;
- la corrosione selettiva: si manifesta con piccoli crateri di corrosione derivanti dalla dissoluzione preferenziale di uno dei costituenti metallografici del materiale metallico;
- la corrosione intergranulare (intercristallina): si manifesta con corrosioni limitate al contorno dei grani (cristalli) e penetranti profondamente tra questi;
- la corrosione intragranulare (intracristallina): si manifesta con corrosioni limitate alle zone centrali dei singoli cristalli risparmiando il giunto o bordo o contorno del grano;
- la corrosione interdendritica: si manifesta secondo una giacitura preferenziale di localizzazioni corrosive negli spazi fra le dendriti generatesi durante la solidificazione del materiale metallico;
- la corrosione stratificata: si manifesta secondo piani paralleli alla direzione di lavorazione plastica provocando talvolta rigonfiamenti superficiali.
Corrosione localizzata: quando interessa soltanto una parte della superficie del materiale metallico, in dipendenza da fattori geometrici, di forma, strutturali,… che possono condizionare il contatto e la diffusione del mezzo corrosivo sulla superficie del materiale.
Sono esempi di corrosione localizzata:
- la corrosione per contatto: si manifesta nella zona in cui materiali metallici diversi sono a contatto fra di loro; è molto importante in questo caso il rapporto tra le aree catodica e anodica: l'elettrodo anodico più piccolo si corrode più velocemente e quindi deve essere evitato un alto rapporto area catodica/area anodica;
- la corrosione alla linea d'acqua: si manifesta sulla superficie del materiale metallico nella zona che corrisponde al menisco della soluzione che la bagna;
- la corrosione per azione di schermo: si manifesta quando prodotti di corrosione, sostanze estranee od organismi animali e vegetali si accumulano a ricoprire zone limitate del materiale metallico;
- la corrosione interstiziale: si manifesta quando due superfici, di cui una è metallica, risultano molto vicine;
- la corrosione per aerazione differenziale: si manifesta quando il flusso di ossigeno è diverso sulle diverse zone della superficie del materiale metallico; la dissoluzione avviene nelle zone meno aerate (la corrosione per azione di schermo e la corrosione interstiziale possono essere considerate di questo tipo);
- la corrosione fessurante: si manifesta quando sollecitazioni meccaniche si sovrappongono al processo corrosivo e si formano cricche che penetrano anche profondamente all'interno del materiale stesso;
- la corrosione perforante: si manifesta quando la profondità dei crateri di corrosione interessa, o tende ad interessare, l'intero spessore del materiale metallico.
Qualora il materiale metallico sia contemporaneamente soggetto a fenomeni corrosivi e ad azioni o sollecitazioni meccaniche tali da influenzare l'andamento dei fenomeni corrosivi stessi, si possono considerare i seguenti particolari tipi di corrosione:
- corrosione sotto tensione o tensocorrosione (STRESS CORROSION): corrosione di un materiale metallico sottoposto a tensioni meccaniche di tipo statico; le tensioni possono essere di origine esterna (forze applicate) o interna (frutto di deformazioni plastiche a freddo, dilatazioni termiche, trattamenti termici,…);
- corrosione-fatica (CORROSION FATIGUE): corrosione di un materiale metallico sollecitato a fatica (carichi ciclici o ripetuti);
- corrosione-sfregamento (FRETTING CORROSION): corrosione che si verifica in seguito allo sfregamento oscillante di due superfici, dove almeno una è di tipo metallico, pressate fra loro;
- corrosione-abrasione: corrosione di un materiale metallico la cui superficie viene continuamente abrasa a causa dello sfregamento di un'altra superficie oppure a causa dell'azione di sostanze abrasive trasportate da un mezzo liquido o aeriforme;
- corrosione-turbolenza: corrosione di un materiale metallico quando vi sia turbolenza nel movimento del liquido che lo bagna; l'effetto del liquido può essere esaltato se trascina bolle di gas;
- corrosione-cavitazione: corrosione di un materiale metallico stimolata dalle sollecitazioni meccaniche conseguenti a un fenomeno di cavitazione del liquido che lo bagna.
NB. cavitazione: si verifica quando delle bolle che si formano in seno ad un liquido vanno a scontrarsi con una superficie; tali bolle tendono ad essere riassorbite dalla massa liquida (implodono) e perciò liberano una rilevante energia che viene comunicata a piccole superfici che risultano essere soggette a martellamento: ne consegue incrudimento e distacco di particelle (formazione di cavità).
Aspetti della corrosione:
- cratere di corrosione;
- pustola;
- ulcera di corrosione;
- tubercolo;
- offuscamento;
- cricca di corrosione.
Prodotti di corrosione
Per prodotti di corrosione si intendono le sostanze che si formano in dipendenza del fenomeno corrosivo.
I prodotti di corrosione possono risultare in soluzione (vera o colloidale) nel mezzo corrosivo, oppure possono avere la forma di precipitati; i precipitati possono anche non contenere il materiale metallico che si corrode.
La corrosione di un materiale metallico può presentare:
- precipitati in loco, sulla superficie del materiale stesso;
- precipitati non in loco, ma presenti nel mezzo corrosivo;
- nessun precipitato.
I precipitati possono essere:
- aderenti oppure non aderenti al materiale metallico;
- compatti oppure incoerenti;
- colloidali oppure cristallini.
Essi possono essere omogenei oppure eterogenei, qualora i successivi strati di precipitati presentino differenti caratteristiche chimiche e fisiche.
Essi possono essere distribuiti uniformemente sulla superficie del materiale metallico oppure localizzati in alcuni punti di essa.
LA CORROSIONE: ANALISI
Si è soliti distinguere la corrosione in corrosione ad umido, che si può osservare quando il materiale metallico è a contatto con un ambiente liquido, dalla corrosione a secco, comunemente definita ossidazione in quanto viene riscontrata in ambienti gassosi per lo più a carattere ossidante.
Sono essenzialmente due i meccanismi secondo i quali la corrosione umida dei materiali metallici procede nei casi pratici:
- corrosione chimica;
- corrosione elettrochimica.
Nel caso della corrosione chimica si verifica una reazione eterogenea tra una fase solida (il materiale metallico) e almeno un’altra fase che può essere o liquida o gassosa.
Nel caso della corrosione chimica non c’è generalmente passaggio di corrente.
La corrosione elettrochimica è il tipo che si incontra più frequentemente a temperatura prossima a quella ordinaria.
CORROSIONE ELETTROCHIMICA
Si hanno due reazioni principali: una all’anodo e una al catodo.
Le reazioni anodiche sono sempre reazioni di ossidazione che tendono a distruggere il metallo all’anodo che si discioglie come ione positivo oppure ritorna allo stato combinato di ossido.
Le reazioni catodiche sono sempre, invece, reazioni di riduzione di alcuni ioni o di alcune molecole neutre presenti nell’ambiente con corrispondente consumo degli elettroni prodotti dalla reazione anodica e transitati attraverso il metallo.
La corrosione dei materiali metallici in presenza di una soluzione elettrolitica è dovuta a una ossidazione elettrochimica:
Me ® Men+ + n×e-
con formazione di prodotti di corrosione solubili (per esempio, lo zinco in acido solforico);
o del tipo:
Me2+ + 2×H2O ® Me(OH)2 + 2×H+ + 2×e-
con formazione di prodotti di corrosione (ossidi più o meno idrati) che precipitano sul materiale o nella soluzione.
Prodotti di corrosione di natura diversa possono formarsi quando la soluzione contiene degli anioni che formano con il metallo sali insolubili (per esempio PbSO4).
Gli elettroni liberati nel metallo dal processo di corrosione (ossidazione) devono essere consumati da una corrispondente reazione di riduzione, con bilanciamento delle cariche in gioco.
Tra le reazioni di riduzione più caratteristiche e importanti dal punto di vista della corrosione dei metalli si devono citare:
- lo sviluppo di idrogeno:
2×H+ + 2×e- ® H2
- la riduzione dell'ossigeno (in soluzioni acide):
O2 + 4×H+ + 4×e- ® 2×H2O
- la riduzione di altre sostanze ossidanti, quali gli ioni ferrici:
Fe+++ + e- ® Fe++
- la deposizione di metallo:
Men+ + n×e- ® Me
- la riduzione di ossigeno (in soluzioni neutre o basiche):
O2 + 2×H2O + 4×e- ® 4×OH -
La reazione di ossidazione del metallo e la reazione di riduzione corrispondente danno, per esempio, reazioni globali del tipo:
A)
Zn ® Zn2+ + 2×e-
H2SO4 + 2×e- ® SO42- + H2
______________________
Zn + H2SO4 ® ZnSO4 + H2
e si dice in questo caso che lo zinco è soggetto a un fenomeno di corrosione per idrogeno;
B)
2×Ni ® 2×Ni2+ + 4×e-
O2 + 2×H2O + 4×e- ® 4×OH-
______________________
2×Ni + O2 ® 2×Ni(OH)2
e si parla di nichel alteratosi nella corrosione per ossigeno.
Poiché un processo corrosivo può avvenire solo se il potenziale del processo anodico di dissoluzione di un metallo è inferiore al potenziale del processo catodico di sviluppo di idrogeno o riduzione di ossigeno, è molto importante conoscere i valori di tali potenziali, che dipendono dal valore del pH della soluzione.
NB. pH = - log[H+] dove [H+] concentrazione ioni idrogeno;
in soluzione neutra a 25 °C [H+] = 10-7 e dunque pH = 7; in soluzione acida pH < 7, in soluzione basica pH > 7.
E' importante notare che il processo catodico di riduzione dell'ossigeno ha un potenziale più alto nella scala termodinamica dei potenziali rispetto a quello di sviluppo di idrogeno: pertanto tutte le volte che in una soluzione è presente ossigeno, il processo catodico che avviene, ove ne esistano le condizioni termodinamiche, è appunto quello di riduzione dell'ossigeno.
Nel caso in cui nella soluzione non sia presente ossigeno il processo catodico, ove si verifichino le condizioni termodinamiche, in questo caso più restrittive, è quello di sviluppo di idrogeno.
Si possono formare aree anodiche e catodiche non solo per il contatto di due metalli diversi ma anche per molteplici altre cause: inclusioni, liquazioni, imperfezioni superficiali, sollecitazioni superficiali,..., quando vengono a contatto con un elettrolita (soluzione acquosa aerata di un sale, un acido o una base).
Gli ioni metallici allontanatisi dall’anodo e gli ioni ossidrili che provengono dal catodo si muovono in direzioni opposte nell’elettrolita per le loro cariche positive e negative.
Quando si incontrano possono reagire e formare dei prodotti di corrosione e la disposizione di questi prodotti influenza decisamente la velocità di corrosione.
Infatti:
- possono andare in soluzione o svolgersi sotto forma di gas ed in tal caso non riescono ad inibire ulteriori reazioni;
- possono dar luogo ad un composto insolubile che viene a formarsi ad una certa distanza dalla zona corrosa e quindi ha scarso valore protettivo;
- possono formarsi composti insolubili che nella maggior parte dei casi ricoprono la superficie del materiale metallico con uno strato aderente e continuo che rallenta notevolmente la corrosione: quest’ultimo processo viene definito passivazione ed il materiale metallico passivato o passivo. Quando questo strato viene rotto in alcuni punti dal movimento del liquido stesso o, più facilmente ancora, da particelle solide in esso contenute, si ha un altro processo di corrosione: la corrosione-erosione che è caratterizzata da una progressione in direzione preferenziale.
Si possono corrodere in modo generalizzato tutti i metalli immersi in ogni ambiente aggressivo non contenente i suoi ioni, purché il potenziale del processo anodico di dissoluzione del metallo sia inferiore a quello del processo complementare di sviluppo di idrogeno o di riduzione di ossigeno.
Nel caso della corrosione umida il processo è di natura elettrochimica e per analizzare il processo è necessario:
- individuare un processo anodico ed un processo catodico che decorrano e si compensino reciprocamente dal punto di vista delle leggi di Faraday sulla superficie del materiale;
- trovare le relazioni energetiche del processo sia anodico, sia catodico in modo da stabilire se il processo è termodinamicamente possibile (spontaneità del processo);
- nel caso di possibilità del processo determinarne la velocità tramite lo studio della cinetica dei vari processi anodici e catodici concorrenti.
Se le aree anodiche e catodiche sono direttamente collegate tra loro si parla di elementi galvanici in corto circuito, se sono geometricamente separate si parla di macroelementi galvanici o microelementi galvanici a seconda delle possibilità di distinguerli o no ad occhio nudo.
A parte il caso della corrosione per correnti vaganti in cui la corrosione è dovuta alla dissoluzione anodica del metallo in una cella elettrolitica avente il terreno come elettrolita, negli altri casi i fenomeni di corrosione avvengono spontaneamente (Erid>Eox) e comportano una diminuzione dell'energia libera del sistema.
Il fenomeno di corrosione corrisponde al funzionamento di una pila posta in corto circuito e può essere interpretato in base alla teoria degli elementi galvanici in corto circuito.
Il comportamento elettrochimico di un metallo può essere sostanzialmente modificato se sulla superficie del metallo si forma uno strato, anche sottilissimo, di ossido del metallo: si parla di passività.

Potenziali normali E° [V] di ossidoriduzione (dal più nobile al meno nobile) di alcuni elementi alla T=25 °C e p=105 Pa:
1) Au3+ + 3×e- « Au + 1,50
2) Ag+ + e- « Ag + 0,80
3) Cu2+ + 2×e- « Cu + 0,34
4) Sn2+ + 2×e- « Sn - 0,14
5) Ni2+ + 2×e- « Ni - 0,25
6) Fe2+ + 2×e- « Fe - 0,44
7) Zn2+ + 2×e- « Zn - 0,76
8) Al3+ + 3×e- « Al - 1,67
La "classifica" si modifica se si considera la passivazione e diventa:
1) Au oro
2) Ag argento
3) Sn stagno
4) Cu rame
5) Al alluminio
6) Fe ferro
7) Ni nichel
8) Zn zinco
FATTORI CHE INFLUENZANO LA CORROSIONE
I fattori influenzanti i fenomeni corrosivi si possono suddividere in tre classi:
- quelli concernenti l’ambiente corrosivo;
- quelli attinenti il materiale metallico;
- quelli dipendenti dalle condizioni e dal tempo d’impiego.
- fattori relativi all’ambiente aggressivo:
il più importante di questi è la natura chimica dell’elettrolita, in particolare il valore del pH della soluzione; l’andamento della velocità di corrosione Vcor in funzione del pH può essere data dal diagramma seguente:
pH
- caso di metalli nobili
- caso di metalli come Al, Zn, Pb
- caso di metalli come Ni, Cd, Mg
Il ferro ha un comportamento che si può approssimare al caso (c), peraltro a pH>12 e a temperature superiori a 60 °C il comportamento può assimilarsi al caso (b).
Altro fattore importante è la presenza di gas disciolti; il più importante dei gas è l’ossigeno.
L’ossigeno presente in una soluzione può esercitare due azioni di tipo opposto nei confronti della velocità di corrosione:
- un’azione peggiorativa;
- un’azione migliorativa nei casi in cui l’ossigeno può aumentare la stabilità degli ossidi protettivi; in questo caso però la presenza di ossigeno deve essere in concentrazione tale da passivare completamente il materiale metallico.
Di notevole importanza è anche la temperatura; la sua influenza può risultare di natura molto varia nel caso che il valore della temperatura determini anche la morfologia di eventuali prodotti di corrosione che possono presentare un grado diverso di caratteristiche protettive.
Vi è infine il movimento della soluzione stessa perché può generare fenomeni di corrosione-erosione; l’andamento in alcuni casi potrà risultare essere il seguente:

Vcor

Velocità del fluido
2) fattori relativi al materiale:
primo fra tutti è la composizione chimica; la resistenza alla corrosione aumenta aumentando il grado di purezza.
E’ opportuno poi ricordare che per tutti i metalli e leghe possono avere notevole influenza il processo di elaborazione adottato nella fabbricazione e la presenza oltre alle impurità anche delle disomogeneità strutturali, i trattamenti termo-meccanici subiti: le regioni incrudite di un metallo sono quasi sempre attaccate più facilmente rispetto a quelle ricristallizzate.
Anche le dimensioni dei grani cristallini possono interessare la resistenza alla corrosione dei materiali metallici ed inoltre i giunti dei grani costituiscono una regione dove la corrosione può svilupparsi in modo preferenziale.
3) fattori dipendenti dalle condizioni e dal tempo d’impiego:
notevole influenza hanno i procedimenti di lavorazione per l’assemblaggio e lo stato delle superfici.
Non solo infatti la forma dei pezzi può interessare i fenomeni corrosivi ma anche il profilo microgeometrico: le punte hanno una reattività più grande rispetto alle regioni piane e una buona finitura favorisce la resistenza alla corrosione.
Le contaminazioni superficiali dei materiali provocate da olio, grassi od altro possono impedire la formazione dello strato passivante o generare aerazioni differenziali dalle quali si innescano i fenomeni corrosivi.
Lo stato di sollecitazione dei pezzi può poi generare diversi fenomeni di corrosione.
Tra i fattori dipendenti dal tempo di permanenza in esercizio rivestono particolare importanza i fenomeni di invecchiamento, le modificazioni dei rivestimenti protettivi e le variazioni delle temperature.
La velocità di dissoluzione dipende essenzialmente dai seguenti fattori:
- contatto di un materiale metallico con gas o vapori;
- contatto di un materiale metallico con una fase liquida generalmente acquosa;
- temperatura;
- agitazione del mezzo corrosivo;
- grado di aerazione;
- durata d'azione del mezzo corrosivo.
La velocità di corrosione, quantità di metallo sciolto nel tempo può essere ottenuta combinando le leggi di Faraday e di Ohm:
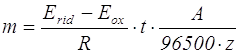
dove:
m quantità di metallo in grammi
t tempo in secondi
Erid potenziale zona catodica in volt
Eox potenziale zona anodica in volt
R resistenza elettrica totale del circuito metallo-soluzione in ohm
A massa atomica dell'elemento ottenuto espressa in grammi
96500 costante di Faraday
z valenza dello ione dal quale è stato ottenuto un certo elemento
CORROSIONE A SECCO
La corrosione a secco è il risultato dell'attacco di un materiale metallico da parte di un gas generalmente a temperatura elevata.
Tra i vari gas è certamente l'ossigeno quello che ha destato maggior attenzione; tale processo viene denominato OSSIDAZIONE.
OSSIDAZIONE
La maggior parte dei materiali metallici quando si trovano esposti a temperatura più o meno elevata in ambienti ossidanti si ossidano in superficie.
Si possono avere diversi casi:
- l'ossido non esiste (caso metalli nobili): non si osserva ossidazione;
- l'ossido è volatile (caso del molibdeno), liquido (caso del vanadio) o addirittura si dissolve nel metallo (caso del titanio); si hanno notevoli fenomeni di corrosione alle alte temperature;
- l'ossido, ed è questo il caso più comune, forma uno strato o più strati sulla superficie del materiale;
- nel caso delle leghe, dove il meccanismo è più complesso, si possono avere i seguenti casi:
1) un solo componente di lega può ossidarsi e quindi si ha un'ossidazione selettiva;
2) più componenti di lega si ossidano dando origine ad ossidi insolubili e quindi ad una scaglia polifasica;
3) più componenti di lega si ossidano dando origine ad una soluzione solida.
Diversi fattori oltre naturalmente alla temperatura, pressione e composizione dell'atmosfera gassosa, possono modificare la morfologia degli strati di ossido: per esempio in seguito ai differenti coefficienti di dilatazione dei vari ossidi e del materiale si possono generare scollamenti e screpolature.
Il grado di protezione che uno strato di ossido offre al materiale dipende da molti fattori, raggiungendo una situazione ottimale se vengono rispettate le seguenti condizioni:
- il rapporto di volume tra ossido e metallo dovrebbe essere vicino a 1;
- lo strato dovrebbe avere una buona aderenza;
- il punto di fusione dell'ossido dovrebbe essere alto;
- lo strato di ossido dovrebbe avere una bassa tensione di vapore;
- lo strato di ossido dovrebbe avere un coefficiente di dilatazione simile a quello del metallo;
- lo strato dovrebbe possedere una buona plasticità alle alte temperature per prevenire la rottura;
- lo strato dovrebbe avere una bassa conducibilità e bassi coefficienti di diffusione per gli ioni metallici e l'ossigeno.
La velocità di ossidazione può essere parabolica (ferro, nichel, rame), logaritmica (zinco), oppure tendente ad un asintoto orizzontale (silicio, alluminio, cromo: casi in cui si forma rapidamente uno strato di ossido impermeabile):questi tre casi si verificano naturalmente quando si ha la formazione di un ossido cosiddetto PROTETTIVO.
Qualora invece (caso dei metalli alcalini: litio, sodio,…, o alcalino terrosi: berillio, magnesio,…) si ha formazione di un ossido NON PROTETTIVO la velocità di ossidazione procede con legge lineare.
Esempi di ossidi che si depositano sui metalli alle varie T [°C]:
METALLO 300 °C 500 °C 700 °C
ferro Fe2O3 Fe3O4 FeO
cobalto Co3O4+CoO CoO CoO
nichel NiO NiO NiO
cromo Cr2O3 Cr2O3 Cr2O3
NB.: negli acciai l'elemento che più di ogni altro favorisce la resistenza all'ossidazione è il cromo, poiché a contatto dell'atmosfera o di un ambiente contenente ossigeno promuove la formazione di uno strato sottilissimo di ossido sulla superficie (Cr2O3) che è capace sia di preservare la struttura sottostante, sia di riformarsi rapidamente se distrutto.
L'inossidabilità dell'acciaio è data da una percentuale di cromo maggiore di 12.
In funzione dello spessore questi strati vengono definiti FILM, se di piccolo spessore (fino a qualche micron), scaglia, se di spessore superiore. I film fanno da schermo protettivo, mentre nel caso delle scaglie, specie di un certo spessore, la protezione viene in genere a mancare.
E' importante tenere presente che in ogni caso di ossidazione a caldo la resistenza del materiale dipende, più che dalla natura del materiale, dalle caratteristiche dello strato di ossido formatosi in superficie.
Se, nelle condizioni di esercizio, l'ossido rimane compatto e aderente si avrà una protezione del materiale metallico, altrimenti si avranno vistosi fenomeni di corrosione per ossidazione.
Non è detto però che ogni strato di ossido continuo e compatto sia protettivo in quanto gli ossidi metallici appartengono al gruppo dei semiconduttori con conducibilità ionica e possono essere stabili anche con eccesso di anioni o cationi; queste anomalie nel rapporto anioni cationi generano la presenza di difetti a livello atomico e questi difetti sono la via attraverso cui le specie aggressive possono raggiungere dall'esterno la superficie metallica.
Altri casi di corrosione alle alte temperature possono essere dovuti a gas di combustione o danneggiamento da idrogeno.
Nel caso di corrosione da gas di combustione lo strato protettivo di ossido può essere distrutto più facilmente sia per la presenza di sostanze riducenti come il carbonio o l'ossido di carbonio, sia per la presenza di zolfo, sia per la presenza di ceneri di combustione.
Se inoltre l'ambiente è riducente l'ossido si riforma con difficoltà.
Il danneggiamento da idrogeno si presenta nell'industria chimica e petrolifera, in particolare nei processi di sintesi dell'ammoniaca e di raffinazione degli idrocarburi.
Generalmente si richiedono temperature elevate e pressione altrettanto elevate.
In queste condizioni l'idrogeno diffondendo nell'acciaio può produrre sia una decarburazione, sia la formazione di microcricche al contorno dei grani.
ANALISI DI ALCUNI ASPETTI DELLA CORROSIONE
- Corrosione uniforme: si manifesta con identica velocità di attacco su tutti i punti e l'intera superficie è interessata all'attacco. Si può presentare sia a contatto con ambienti liquidi, sia a secco ed è caratterizzata dal fatto che le proprietà meccaniche non sono modificate. La velocità di corrosione viene misurata sotto forma di perdita di peso per unità di superficie e di tempo (ad esempio mg×dm-2×d-1) o sotto forma di riduzione di spessore per unità di tempo (per esempio mm×a-1).
Vengono considerati sufficientemente resistenti alla corrosione quei materiali che hanno una velocità di corrosione minore di 0,1 mm×a-1.
- Corrosione intergranulare (intercristallina): si verifica in corrispondenza dei bordi dei grani (cristalli) e nelle loro immediate vicinanze senza che la matrice venga attaccata. Provoca una diminuzione della resistenza meccanica e della plasticità del materiale metallico, con possibilità di fessurazione nei punti sottoposti alle maggiori sollecitazioni. Interessa particolarmente gli acciai inossidabili austenitici (X 10 CrNi 18-09, X 8 CrNi 18-12) quando sono sensibilizzati, cioè è avvenuta la precipitazione dei carburi di cromo (Cr23C6) ai bordi dei grani creando disomogeneizzazione di cromo nella composizione chimica del grano. I fattori che agiscono sul grado di sensibilizzazione sono: temperatura, tempo di permanenza, tenore di carbonio. I mezzi più diffusi per evitare la corrosione intergranulare degli acciai inossidabili austenitici sono:
- diminuzione del tenore di carbonio;
- aggiunta in piccola quantità di elementi quali titanio, niobio o tantalio (esempio: X6CrNiTi 18-11);
- trattamento termico di solubilizzazione.
NB. solubilizzazione (denominato anche "tempra austenitica"): è un trattamento termico al quale vengono sottoposti, normalmente, gli acciai inossidabili austenitici. Consiste nel riscaldare l'acciaio a circa 1000 °C in modo da eliminare tutte le alterazioni strutturali dovute ai processi di fabbricazione e mettere in soluzione tutti i carburi, successivamente raffreddare in modo tale da avere a temperatura ambiente una struttura austenitica ed evitare la precipitazione dei carburi. Per il raffreddamento la prassi comune è quella dello spegnimento in acqua. I fattori che possono influenzare il processo sono: la temperatura, la durata, la velocità di raffreddamento; un aumento della temperatura oltre il necessario, così come una permanenza eccessiva influenzano le dimensioni del grano e quindi la possibilità di attacco intergranulare.
STABILIZZAZIONE: eseguita su acciai inossidabili austenitici al titanio, tantalio o niobio e consiste in un riscaldo a 885 °C con mantenimento per la durata di due ore per ogni parte del pezzo e raffreddamento in aria. Questo trattamento migliora nettamente la resistenza alla corrosione intercristallina in quanto durante il trattamento precipitano i carburi di titanio, tantalio o niobio e quindi non rimane carbonio sufficiente per la precipitazione dei carburi di cromo.
- Corrosione sotto sforzo meccanico (stress corrosion): quando i materiali metallici sono sottoposti all'azione combinata di un mezzo aggressivo specifico e di uno sforzo di trazione e si ha sovrapposizione di meccanismi di tipo elettrochimico con meccanismi di tipo meccanico. Si manifesta con cricche giacenti in piani perpendicolari alla direzione dello sforzo. Tali cricche possono essere intergranulari, transgranulari o di tipo misto. Con questo tipo di corrosione si verificano due periodi distinti: un primo periodo chiamato incubazione durante il quale si formano fessure ed un secondo periodo durante il quale le fessure procedono velocemente all'interno del materiale metallico con carattere discontinuo.
La velocità di propagazione di una cricca può essere molto elevata e dipende dalle condizioni chimiche e meccaniche del sistema. Una velocità di propagazione di 1 ¸ 2 mm×h-1 è stata più volte osservata per acciai inossidabili, leghe di rame e di alluminio.
Le cause che più comunemente possono generare uno stato di tensione meccanica possono essere di origine esterna o interna.
Le cause che generano uno stato di tensione esterna possono essere previste o fortuite; tra quest'ultime possiamo ricordare quelle dovute a:
- difficoltà di assemblaggio;
- spostamenti da assestamento;
- chiodature, rivettature,…;
- escursioni termiche;
- gradienti di temperatura;
- saldature;
- ….
Le tensioni interne generalmente si identificano con le tensioni residue esercitate dai piani deformati plasticamente, sui piani limitrofi che per ragioni geometriche non hanno superato durante la deformazione il proprio limite di elasticità oppure con le tensioni da trattamento termico.
Tra i numerosi fattori che interessano la corrosione sotto sforzo sono particolarmente importanti:
- la composizione chimica e strutturale del materiale;
- i trattamenti termo-meccanici subiti;
- il valore dello sforzo applicato;
- la composizione chimica dell'ambiente aggressivo.
L'applicazione di correnti catodiche o anodiche esterne può influenzare notevolmente lo sviluppo di un processo di stress corrosion.
Casi tipici di corrosione sotto sforzo sono il cedimento stagionale (season cracking) degli ottoni, la "stress corrosion" degli acciai inossidabili.
I metodi più comunemente impiegati per la prevenzione sono:
- evitare le condizioni che possano creare lo stato di tensione;
- creare zone di compressione superficiale con operazioni di martellatura o pallinatura;
- rimuovere le tensioni con opportuni trattamenti termici;
- uso di protezione catodica;
- protezione con strati di metallo puro poco suscettibili di stress corrosion nell'ambiente considerato;
- uso di vernici con pigmenti a carattere anodico rispetto al metallo da proteggere;
- modificazione del mezzo corrosivo
Esempi di ambienti che possono causare corrosione sotto sforzo per alcuni materiali:
MATERIALE AMBIENTE
acciai comuni soluzioni NaOH
soluzioni HCN
acqua di mare
acciai inossidabili soluzioni acido-cloruro
acqua di mare
soluzioni NaCl-H2O2
leghe di alluminio soluzioni NaCl
acqua di mare
soluzioni NaCl-H2O2
vapor d'acqua
leghe di rame acqua, vapor d'acqua
vapori e soluzioni di NH3
- Corrosione puntiforme o per vaiolatura (pitting corrosion): la sua morfologia unitamente alla velocità autoaccelerante di propagazione portano rapidamente alla perforazione completa dello spessore. Il fenomeno della corrosione per vaiolatura è inoltre caratterizzato da aree anodiche localizzate di sviluppo superficiale di gran lunga minori rispetto alle aree catodiche.
Si possono distinguere lo stato di innesco da quello di accrescimento. Il primo stadio si verifica, in generale, in corrispondenza dei bordi dei grani, delle inclusioni, delle bande di scorrimento,…
Lo stadio di sviluppo ha una velocità di corrosione che aumenta nel tempo secondo una legge parabolica.
Le condizioni elettrochimiche in cui si sviluppa questo tipo di attacco sono tali che una vasta area della lega passiva e funzionante da catodo coesiste accanto ad alcune piccole zone attive funzionanti da anodo.
Gli ambienti più favorevoli all'attacco puntiforme sono soluzioni a carattere ossidante contenenti anioni ad azione specifica.
- Corrosione interstiziale o corrosione in fessura (crevice corrosion) : si verifica nelle fessure tra metallo e guarnizioni non metalliche, tra gli interstizi di due pareti di materiale metallico; in quest'ultimo caso si corroderanno in maniera uguale o diversa in ragione del loro grado di nobiltà.
La corrosione interstiziale viene attribuita di solito ad una differente concentrazione di ossigeno tra la soluzione dell'interstizio e quella circostante con la conseguente formazione di una cella ad aerazione differenziale in cui le pareti della fessura fungono da anodo mentre la superficie metallica esterna funge da catodo.
Per prevenire o minimizzare la corrosione interstiziale nelle costruzioni possono essere utilizzati i seguenti metodi:
- nelle costruzioni usare giunti ben saldati, invece di giunti rivettati o forzati;
- progettare in modo da avere un drenaggio completo per impedire la formazione di soluzioni stagnanti;
- se possibile usare guarnizioni non assorbenti come il Teflon, che è idrorepellente.
- Corrosione per fatica (corrosion fatigue): provocata dalla simultanea azione di sforzi ciclici e di un attacco chimico. Gli ambienti chimici promotori di corrosione per fatica sono generalmente ambienti a blanda azione corrosiva, molto simili a quelli promotori di stress corrosion, e che, in assenza di tensioni applicate, avrebbero causato soltanto una limitata azione di attacco.
Se le sollecitazioni periodiche risultano distribuite la corrosione per fatica si manifesta con la formazione di famiglie di cricche transgranulari filiformi e poco ramificate, disposte perpendicolarmente alla direzione dello sforzo.
Se le caratteristiche geometriche del pezzo sono tali da creare una concentrazione degli sforzi si verificherà normalmente una sola cricca con una velocità di penetrazione più elevata rispetto al caso precedente.
Possono verificarsi anche rotture intergranulari quando il materiale ha subito in precedenza una deformazione plastica oppure quando il mezzo corrosivo avrebbe esercitato in assenza di sforzo azione di attacco selettivo ai bordi del grano. Altre volte la morfologia della cricca dipende dall'intensità dello sforzo.
Sono presenti anche qui gli stadi di innesco e di sviluppo del processo. Per la protezione dal fenomeno si può agire come per la stress corrosion:
- modifica del disegno;
- applicazione di trattamenti termici di distensione;
- indurimento superficiale con martellatura o pallinatura;
- modifica dell'ambiente aggressivo con l'uso di inibitori;
- uso di protezione catodica con correnti esterne con difficoltà di applicazione in zone interne o per pezzi
di piccole dimensioni;
- uso di rivestimenti protettivi organici o metallici, condizionato dall'elasticità del materiale ricoprente, dalla sua impermeabilità e resistenza a fatica e dai parametri geometrici dello stato ricoprente rispetto al materiale base.
- Corrosione per sfregamento (fretting corrosion): danneggiamento che si verifica in seguito allo sfregamento oscillante di due superfici metalliche sottoposte a carico ed in contatto tra di loro. Si verifica all'aria generalmente per intervento di sollecitazioni di natura vibratoria di ampiezza critica e si manifesta sulle superfici in contatto con formazioni di cavità simili a pitting.
La fretting corrosion è dovuta alla presenza tra le superfici di particelle di metallo o di ossido provenienti dallo sgretolamento delle asperità provocate dall'azione di sfregamento delle parti in contatto.
Il meccanismo promotore risulta di natura chimica (ossidazione, adsorbimento di ossigeno in superficie) e meccanica (abrasione) per cui ne verrebbe esclusa alcuna influenza di carattere elettrochimico.
Le condizioni che determinano l'insorgenza e lo sviluppo di fretting corrosion variano a seconda del tipo di materiale e del tipo di ambiente.
Le misure preventive contro la fretting corrosion si possono indirizzare verso tre direzioni principali:
- modificare la situazione oscillatoria in modo da allontanarsi dalle condizioni critiche;
- modificare la natura dei materiali in contatto favorendo la combinazione di metalli teneri (piombo, stagno, argento, anche elettrodeposti) con materiali più duri (acciai,…) oppure interponendo guarnizioni di materiale elastico (gomma, teflon,…);
- uso di lubrificanti di buona viscosità che ostacolano l'ossidazione superficiale e la migrazione dei detriti ed abbassano i coefficienti di attrito dei materiali coinvolti.
- corrosione selettiva (dealloying): è la rimozione preferenziale di un elemento di lega in soluzione solida a seguito di processi corrosivi. L'esempio più comune di questo tipo di corrosione è la DEZINCIFICAZIONE che avviene negli ottoni per attacco selettivo dello zinco rispetto al rame.
Poiché il rame residuo non ha la stessa resistenza dell'ottone, la resistenza della lega si abbassa notevolmente. Il meccanismo della dezincificazione implica le seguenti tre fasi:
- dissoluzione dell'ottone;
- permanenza in soluzione degli ioni di zinco;
- rideposizione del rame sull'ottone.
La dezincificazione può essere minimizzata o prevenuta scegliendo un ottone a basso contenuto di zinco: ad esempio 85% di Cu e 15% di Zn. Altre possibilità sono:
- modificare l'ambiente corrosivo;
- ricorrere alla protezione catodica.
PROVE DI CORROSIONE
Le prove di corrosione dei materiali metallici nudi o rivestiti sono classificate in:
- prove di servizio; sono le prove che consentono di ottenere informazioni sull'attitudine di un materiale a resistere nel tempo in presenza di un particolare ambiente aggressivo:
a) in esercizio;
b) in laboratorio;
- prove tipo di laboratorio; sono le prove che servono a caratterizzare il materiale dal punto di vista dei fattori base che intervengono nei processi corrosivi;
- prove di comportamento; vengono eseguite allo scopo di mettere in evidenza il comportamento del materiale al fine di verificarne l'idoneità all'impiego cui la prova si riferisce (spesso dal punto di vista meramente qualitativo).
Per quanto possibile qualsiasi prova di corrosione deve essere comparativa e ciascun particolare deve essere utilizzato una sola volta.
La dispersione dei risultati nelle prove di corrosione è generalmente notevole.
I principali fattori che influenzano le prove sono:
- il materiale di cui è costituito il pezzo o la provetta;
- l'ambiente corrosivo;
- le condizioni di contatto fra l'ambiente ed il materiale.
Per ciascun pezzo o provetta devono essere date le seguenti indicazioni:
- denominazione del materiale;
- composizione chimica del materiale;
- caratteristiche meccaniche del materiale;
- stato del materiale: colato in sabbia, sotto pressione, stampato, fucinato, laminato a caldo, laminato a freddo, trafilato, estruso, tipo di trattamento termo-meccanico subito, …;
- microstruttura e macrostruttura;
- tipo e spessore dell'eventuale strato protettivo: placcatura, metallizzazione, deposito galvanico, trattamento termochimico di diffusione, …;
- modalità di prelievo: taglio con sega, con cesoia,…;
- posizione e direzione di prelievo della provetta;
- aspetto superficiale;
- trattamenti superficiali preliminari chimici o meccanici quali il decapaggio, la sabbiatura, la smerigliatura,…;
- tempo intercorso tra la finitura superficiale della provetta e l'inizio della prova di corrosione, indicando eventualmente anche il tipo di ambiente in cui è rimasta la provetta;
- …(ogni altra informazione ritenuta interessante al fine del giudizio della prova).
Per quanto riguarda le provette devono essere contrassegnate per evitare possibili confusioni e:
- la forma e le dimensioni devono essere scelte, di regola, in relazione alle condizioni d'impiego del materiale, tenendo presente che le provette devono essere le più grandi possibili nei limiti imposti dalla maneggevolezza, dallo spazio a disposizione e particolarmente dalla portata delle bilance con cui le provette devono essere pesate. Il rapporto superficie/volume della provetta deve essere abbastanza grande in modo da favorire il massimo sviluppo dell'attacco corrosivo. Il rapporto area totale/area laterale della provetta non deve essere troppo piccolo per evitare forti dispersioni nei risultati delle prove in relazione al poco controllabile effetto dei bordi. Qualora non esistano ragioni per imporre una forma particolare alle provette si deve scegliere per esse la forma più semplice possibile;
- stato superficiale: ha grandissima importanza nei processi di corrosione e quindi la costituzione superficiale delle provette deve essere uguale a quella del materiale quale viene impiegato in pratica o a quella definita dalle indicazioni specifiche delle prove tipo di laboratorio o di comportamento. Quando le provette abbiano un rivestimento protettivo o presentino una superficie eterogenea rispetto al metallo base, la loro superficie deve essere preventivamente incisa in una zona in modo da poter valutare il loro comportamento conseguente a tale operazione. Il grado di finitura può variare secondo il tipo di prova;
- pulizia delle superfici: prima della esposizione all'ambiente corrosivo le provette devono essere accuratamente pulite e sgrassate.
Al termine della prova le provette devono essere osservate prima e dopo una opportuna sciacquatura, successivamente si procede all'asportazione totale dei prodotti della corrosione evitando sensibili asportazioni del materiale base.
Per i vari materiali vengono consigliati diversi metodi di pulitura.
Per quanto riguarda l'ambiente corrosivo vengono indicati tutti gli elementi chimico-fisici atti a definirlo e per il mezzo di attacco:
- la composizione: natura chimica, gas disciolti, impurità,…;
- la concentrazione;
- il pH;
- l'alterabilità;
- la temperatura;
- la pressione;
- ….
Infine per quanto riguarda il contatto fra il mezzo di attacco e il materiale:
- la natura del contatto;
- la interposizione di particolari sostanze quali ossidi, scaglie,..;
- la quantità degli elementi;
- l'orientamento dei pezzi;
- gli effetti elettrochimici, meccanici, elettrici,…;
- la profondità di immersione se il mezzo di attacco è liquido;
- ….
Criteri di valutazione dei risultati
In generale i risultati delle prove devono essere elaborati in modo da esprimere il comportamento del materiale in funzione del tempo; il numero e la posizione dei punti per il tracciamento del relativo diagramma devono essere scelti di volta in volta in modo da ottenere alla fine un risultato chiaro circa il comportamento sia del materiale in esame, sia dell'eventuale materiale di confronto.
In casi particolari, quali ad esempio prove di comportamento, può essere eseguita una sola prova per una durata prestabilita.
Per la valutazione dei risultati delle prove di corrosione possono essere rilevati i dati seguenti:
- alterazione dell'aspetto superficiale delle provette;
- variazione di peso delle provette;
- profondità dell'attacco; se l'attacco è stato uniforme il risultato della prova si esprime come diminuzione di spessore in millimetri all'anno;
- modificazione della struttura delle provette;
- decadimento delle caratteristiche meccaniche delle provette;
- tipo e costituzione dei prodotti di corrosione;
- modificazione del mezzo corrosivo.
Nb. conversione tra variazione della massa e profondità dell'attacco, con r massa volumica in kg×dm-3:
1 mm×a-1 = 0,0365/r mg×dm-2×d-1
1 mg×dm-2×d-1 = 27,4×r mm×a-1
Le prove di corrosione sono sempre molto delicate, lunghe e costose, in particolare quelle tendenti a riproporre le condizioni reali nelle quali dovranno operare i materiali in prova.
Le prove di laboratorio per avere indicazioni di massima possono essere del tipo:
- i pezzi subiscono una immersione alternata ogni 30 minuti in acqua di mare (10 litri di acqua e 300 grammi di cloruro di sodio) alla temperatura di 35 °C;
- i pezzi vengono esposti all'azione di un'atmosfera di nebbia salina ottenuta per mezzo di un opportuno polverizzatore ad aria compressa; ad una esposizione di 12 ore corrisponde una sospensione di altre 12 ore e questo per giorni o settimane;
- diverse provette (almeno 12) per prova di trazione statica sono immerse in acqua di mare ( al 3% di cloruro di sodio) continuamente agitata, attivata con acqua ossigenata allo 0,1%, alla temperatura di 20 °C. Le provette vengono sottoposte alla prova di trazione dopo permanenze diversificate, per esempio alcune ( nel numero di tre almeno) dopo 15 giorni, altre dopo 30, altre dopo 60, altre dopo 90 giorni.
Resoconto della prova di corrosione
Il resoconto deve contenere l'esito della prova di corrosione fornendo l'eventuale documentazione fotografica, i dati rilevati su ciascuna provetta e i dati medi dell'eventuale gruppo di provette uguali sottoposte alla prova in identiche condizioni.
In genere il resoconto deve contenere anche talune indicazioni da scegliere di volta in volta secondo gli scopi della prova tra le seguenti:
- denominazione del materiale provato;
- composizione chimica del materiale provato;
- dimensioni, forma ed area esposta delle provette;
- stato metallurgico delle provette (trattamento termico, lavorazione meccanica, struttura metallografica,…);
- preparazione delle provette, loro stato superficiale ed eventuale protezione dei bordi;
- caratteristiche del materiale rivestito e condizioni della sua finitura superficiale;
- natura e caratteristiche del rivestimento protettivo e modalità di applicazione;
- numero delle provette di ciascun materiale, o di ciascun tipo di finitura o di rivestimento, sottoposte a prova;
- caratteristiche chimiche e fisiche della soluzione di prova ed alterazioni da esse subite per effetto della prova stessa;
- indicazione di quante volte ed a quali intervalli di tempo è stata corretta oppure sostituita la soluzione di prova;
- temperatura della soluzione;
- condizioni medie dell'atmosfera nell'apparecchio di prova;
- ciclo di immersione-emersione adottato nella prova;
- volume della soluzione di prova riferito alla superficie delle provette;
- metodo usato per la pulitura delle provette dopo la prova ed indicazione della perdita di peso intrinseca all'operazione di pulitura;
- durata della prova;
… (ogni altra indicazione ritenuta importante).
METODI DI PULIZIA DELLE SUPERFICI
I metodi più usati per realizzare un'adeguata preparazione delle superfici prima di ulteriori lavorazioni, soprattutto nel caso in cui si sia deciso di applicare un rivestimento protettivo, sono:
- la pulizia manuale con spazzole metalliche, con lime, con tela smeriglio,…;
- pulizia meccanica con spazzole metalliche rotanti, con mole abrasive,…;
- lo sgrassaggio con solventi o detergenti per eliminare sostanze untuose, sudiciume,…;
- la pulizia con il cannello ossiacetilenico facendo passare sulla superficie la fiamma neutra o leggermente ossidante;
- la sabbiatura: consiste nel lanciare contro la superficie da pulire, per mezzo di aria compressa o per azione centrifuga, della sabbia di quarzo o di silice;
- la granigliatura: simile alla sabbiatura ma con impiego di graniglia, sferica o cilindrica, di ghisa o di acciaio temprato;
- la burattatura: i pezzi da discagliare (liberare dalle scaglie di ossido) sono posti, assieme ad un abrasivo, in un recipiente cilindrico (buratto) che viene fatto ruotare ad una velocità di 20¸30 m×min-1;
- il decapaggio chimico: i pezzi da "pulire" vengono immersi in una soluzione, acida o basica, per un tempo opportuno ad una temperatura opportuna. A temperatura ambiente il decapaggio è lento, a caldo è più rapido ma più costoso e più delicato, per il pericolo di un eccessivo attacco al materiale. La scelta del tipo di soluzione e la sua concentrazione dipendono dalla natura dell'ossido e dalla composizione del materiale metallico (per esempio l'acciaio laminato si decapa con una soluzione al 10% di acido cloridrico ad una temperatura di 60¸80 °C, per l'ottone si usa una soluzione al 10% di cianuro sodico). Nella soluzione, al fine di non intaccare chimicamente il materiale metallico, sono presenti degli inibitori; l'inibitore evita anche l'eccessiva formazione di idrogeno (che peggiorerebbe la resilienza), di fumi e/o gas. Dopo l'operazione di decapaggio è necessario un accurato lavaggio. Il procedimento non è idoneo per le leghe leggere.
- il decapaggio elettrolitico consiste nel collegare i pezzi da trattare come anodi o come catodi (decapaggio anodico, decapaggio catodico) in bagni di acido diluito. Si può agire in corrente alternata in modo che i pezzi funzionino alternativamente da anodi e da catodi. Il passaggio della corrente facilita l'eliminazione e il distacco delle incrostazioni non metalliche dalla superficie dei pezzi.
- pulitura ultrasonica: quando i pezzi da trattare presentano molte anfrattuosità e si vogliono avere maggiori garanzie di successo si ricorre all'uso degli ultrasuoni.
METODI PER CONTRASTARE LA CORROSIONE
I mezzi più idonei per combattere il fenomeno corrosivo consistono nel:
- costruire una apparecchiatura o un impianto osservando determinate norme di selezione e di accoppiamento dei materiali impiegati;
- provocare stati chimici resistenti alla corrosione sulle superfici dei materiali che vanno messi in opera;
- ricorrere a rivestimenti protettivi delle superfici dei materiali che occorre difendere; il rivestimento può essere metallico, ceramico o consistere in verniciature o in coperture con materiali plastici;
- attuare la correzione degli ambienti in cui le apparecchiature devono essere poste in opera.
ANALISI DEI VARI METODI
CASO 1) COSTRUIRE
E' necessaria la sistematica consultazione di cataloghi sulla resistenza alla corrosione dei materiali (per esempio gli acciai inossidabili, le superleghe, i metalli nobili, i sinterizzati costituiscono una inesauribile casistica).
Per evitare la formazione di pile voltaiche è bene:
- scegliere combinazioni di metalli il più vicino possibile nella serie dei potenziali redox, rammentando sempre di considerare il tipo di ambiente in cui si andrà ad operare; inoltre il metallo meno nobile può svolgere una azione protettiva rispetto al più nobile "sacrificandosi";
- l'area del metallo meno nobile deve essere maggiore di quella del metallo nobile;
- isolare tra loro i due metalli con vernici, materie plastiche,…;
- evitare di usare giunti a filetto per unire i due metalli;
- progettare razionalmente il tipo di apparecchiatura o impianto al fine di ridurre i rischi dovuti alla corrosione evitando, per esempio, forme che favoriscano il ristagno di umidità.
CASO 2) PROVOCARE
Molti metalli e loro leghe (cromo, cadmio, nichel, alluminio e sue leghe, acciai inossidabili,...) presentano la proprietà di ricoprirsi di pellicole passive ed in tal modo si autoproteggono.
Lo stato di passività può essere causato dalla formazione di ossidi o di sali superficiali ed è tanto più efficiente quanto più impermeabili, compatti e aderenti sono i rivestimenti superficiali che lo producono.
Talvolta le patine autoprotettive si formano nello stesso ambiente in cui il materiale metallico viene messo in opera; altre volte tali patine vengono provocate elettroliticamente: processo cosiddetto della PASSIVAZIONE ANODICA, disponendo all’anodo di una cella elettrolitica a cui si svolge ossigeno il metallo o la lega da passivare.
Altri metodi che possono portare alla produzione di rivestimenti protettivi artificiali sono:
BRUNITURA:
consiste nel formare, in vario modo (ad esempio scaldando a 800 °C il ferro, trattarlo con vapor d’acqua surriscaldato, successivamente lo si mantiene in forno per un certo tempo in presenza di gas illuminante; un altro processo usa immergere i pezzi in miscele di nitrato di potassio e biossido di manganese a 350 °C), una leggerissima e sottile pellicola di ossido di ferro nero.
L’efficacia della protezione del ferro risulta mediocre soprattutto perché l’ossido di rivestimento si mostra catodico rispetto al ferro e quindi quest’ultimo inizierà a corrodersi non appena si forma qualche fessura nella patina di copertura.
FOSFATIZZAZIONE:
il ferro e le sue leghe vengono trattati con miscele di fosfati solubili e di ossidanti (bicromati, nitrati) e se ne fa coprire la superficie di una patina d’ossifosfati insolubili, capaci di proteggere bene i supporti dalle ordinarie corrosioni ambientali, ma non molto efficaci contro le corrosioni di natura chimica.
Se ai materiali è richiesta resistenza chimica si fa seguire al processo di fosfatizzazione quello di laccatura o di verniciatura.
La fosfatizzazione può essere impiegata anche come mezzo antiusura.
Infine le superfici fosfatizzate sono in grado di trattenere con la loro naturale porosità lo strato di olio lubrificante migliorando così le condizioni di lubrificazione.
CASO 3) RICORRERE
La tecnica di stendere su un materiale metallico un sottilissimo strato di altro metallo molto resistente alla corrosione è molto diffusa.
I procedimenti più utilizzati sono:
- la placcatura;
- la galvanostegia;
- la metallizzazione.
PLACCATURA: tecnica che realizza la sovrapposizione di una lamina di materiale metallico più resistente alla corrosione al corpo di un altro materiale metallico meno resistente; viene realizzata talvolta laminando a freddo le superfici o, più spesso, laminandole a caldo o con altri sistemi tecnologici.
Lo spessore dello strato risulta generalmente più elevato rispetto a quello ottenuto con altri metodi.
Sono esempi le placcatura di alluminio su duralluminio e su altre leghe leggere, rivestimenti su acciai comuni di acciai al cromo e al nichel-cromo; talvolta vengono utilizzati oro e platino.
GALVANOSTEGIA (o elettrodeposizione): comprende le tecniche per il rivestimento di superfici metalliche con altri metalli o leghe. Molti degli attuali processi industriali sono stati introdotti dopo la seconda guerra mondiale. Viene realizzata facendo passare corrente elettrica attraverso una soluzione (bagno elettrolitico) di un sale del metallo che deve costituire il rivestimento protettivo dell’oggetto da ricoprire che viene, dopo un processo di pulizia, collocato al catodo.
All’anodo generalmente si colloca il metallo che si vuol far depositare: in tal modo la dissoluzione anodica rifornisce di ioni il bagno elettrolitico. Tutti gli anodi solubili vengono generalmente avvolti in sacchetti o cestelli destinati a trattenere i fanghi anodici, cioè le particelle di materiale metallico, di ossidi e le altre impurezze che si staccano dall'anodo durante la dissoluzione. Gli anodi possono anche essere insolubili. E' necessario correggere di tanto in tanto la composizione del bagno. Nei bagni galvanici possono essere presenti anche sali che facilitano la dissoluzione degli anodi (se solubili), sali che aumentano la conducibilità del bagno, additivi splendogeni (sostanze che hanno la proprietà di produrre elettrodepositi brillanti) e antipuntinanti (evitano l'occlusione di idrogeno gassoso nel deposito elettrolitico e la conseguente puntinatura). Lo spessore medio del rivestimento aumenta con la densità di corrente e con il tempo (legge di Faraday).
Un notevole progresso nella tecnica di elettrodeposizione è stato realizzato con l'introduzione della elettrodeposizione con inversione di corrente chiamata anche PROCESSO PR (periodic reverse current electroplating). Esso consiste nell'invertire ad intervalli regolari il senso della corrente in modo che per una certa frazione di tempo di elettrolisi la superficie da trattare funzioni da anodo anziché da catodo. Il principale vantaggio del processo PR è quindi quello di ottenere depositi autolivellati e anche l'otturazione di certi tipi di pori del materiale base. Si ottengono rivestimenti omogenei, assai lisci e lucidi anche senza l'aggiunta di splendogeni e senza dover deporre forti strati di metallo.
La struttura cristallina e dunque le caratteristiche tecnologiche di un elettrodeposito dipendono da vari fattori:
- densità di corrente;
- concentrazione e composizione del bagno;
- temperatura;
- agitazione;
- struttura del materiale base;
- disposizione degli elettrodi.
L’aderenza del deposito è la qualità più importante: tale qualità si riscontra in particolare quando i materiali che vengono portati a contatto formano una lega o quando il metallo del rivestimento risulta in grado di diffondere sul materiale base.
Quando mancano questi requisiti si ricorre all’interposizione di un materiale metallico che funge da “legante” per entrambi.
L'aderenza del deposito determina la buona riuscita agli effetti protettivi e la sua resistenza agli effetti meccanici.
Per esempio la resistenza all'usura si può determinare misurando il tempo necessario per eliminare il rivestimento elettrodeposto da un provino in condizioni convenzionali.
I depositi elettrolitici non sono quasi mai di spessore uniforme; esso è minore nelle zone rientranti del catodo, in quelle che si trovano "in ombra" rispetto all'anodo o più lontane da esso: ciò è dovuto al fatto che la densità di corrente non è costante su tutta l'area del catodo.
Poiché lo spessore del rivestimento galvanico varia in generale a seconda della posizione sulla superficie ricoperta si distinguono perciò lo spessore medio, lo spessore in un determinato punto e lo spessore minimo. Agli effetti della protezione il dato più importante è lo spessore minimo.
Per la misura dello spessore esistono prove distruttive e prove non distruttive.
Fra i metodi non distruttivi il più diffuso è quello magnetico; il metodo è applicabile alla misura di rivestimenti magnetici (nichel) su materiali non magnetici quali l'ottone, oppure di rivestimenti magnetici o non magnetici su materiali magnetici.
Di recente si utilizza l'applicazione dell'effetto pellicola che consiste nella tendenza posseduta dalle correnti alternate di passare lungo strati sempre più superficiali di un conduttore; una corrente ad alta frequenza viene fatta circolare nel campione in esame: l'intensità di tale corrente, in condizioni determinate, dipenderà dalla conducibilità degli strati superficiali del campione e, se il materiale base e quello elettrodeposto hanno conducibilità diversa, essa dipenderà anche dallo spessore del rivestimento.
Il controllo dei bagni e la determinazione delle condizioni ottime per una elettrodeposizione si ottengono generalmente per via empirica.
Il potere penetrante (capacità della soluzione di depositare metallo nelle anfrattuosità del catodo e nelle parti più lontane dall'anodo) viene saggiato su provini ondulati o piegati ad angolo acuto o anche con cavità tutte uguali ma di profondità regolarmente crescenti; in quest'ultimo caso il potere penetrante è valutato osservando quante cavità sono completamente rivestite.
Il potere livellante (capacità del bagno di produrre elettrodepositi che livellino, riempiendole, le anfrattuosità microscopiche; non deve però essere confuso col potere brillantante che è la capacità di formare depositi lucidi) viene valutato esaminando al microscopio metallografico una sezione di un provino ottenuto per elettrodeposizione su una superficie avente rigature o incisioni di forma e dimensioni determinate.
La lucentezza di un elettrodeposito può essere determinata con i lucidometri; sulla superficie da saggiare si proiettano, per esempio, immagini di lettere dell'alfabeto a grandezza decrescente: le immagini riflesse sono osservate in condizioni standard e il potere riflettente si valuta determinando le dimensioni della lettera più piccola ancora distinguibile.
Le soluzioni di continuità e i pori possono essere rivelati dall'esame al microscopio metallografico con prove di corrosione accelerata che sveleranno rapidamente le deficienze del rivestimento. Le prove chimiche di porosità si basano sull'azione di reattivi chimici che, attraversando i pori, reagiscono con il materiale base dando reazioni caratteristiche con formazione di macchioline colorate nelle zone porose.
Applicazioni della galvanostegia sono:
- ramatura: rivestimento di rame; essa non costituisce di per sé un rivestimento protettivo del materiale, ferroso in particolare, ma è largamente utilizzata per ottenere rivestimenti intermedi prima della nichelatura e cromatura: i depositi rame-nichel e rame-nichel-cromo sono infatti di alto valore protettivo. Il comportamento del rame elettrodeposto sul ferro è catodico: è essenziale perciò che lo strato di rame sia compatto e relativamente spesso.
La ramatura viene effettuata anche su alluminio e sue leghe, su zinco e sue leghe con alte percentuali di piombo per ottenere rivestimenti intermedi che permettono maggiore aderenza e migliori risultati nelle successive nichelature, argentature o dorature.
Con l'introduzione della elettrodeposizione con inversione di corrente, il PROCESSO PR, si ottengono rivestimenti omogenei, assai lisci e lucidi anche senza l'aggiunta di splendogeni e senza dover deporre forti strati di metallo. Con questo procedimento spessori di 15¸20 mm sono sufficienti come strato intermedio per la successiva nichelatura.
In metallurgia la ramatura viene impiegata per ricoprire parti della superficie di pezzi in acciaio che non si vogliono indurire con il trattamento di cementazione.
- nichelatura: rivestimento di nichel; è il processo di galvanostegia più importante e più diffuso. Spessori di 10 mm sono sufficienti per un rivestimento protettivo e decorativo su materiale ferroso nella comune atmosfera delle abitazioni, mentre più di 50 mm sono necessari per le protezione contro le intemperie (per esempio: paraurti per automobili). Sono in genere usati rivestimenti successivi di rame e nichel: lo strato di rame deve avere uno spessore approssimativamente uguale a quello di nichel. Gli stessi valori sono adottati anche per i rivestimenti composti rame-nichel-cromo.
Per ottenere protezione contro l'usura meccanica sono necessari spessori decisamente più elevati e possono raggiungere anche diversi millimetri; spessori rilevanti consentono anche la riparazione, per riporto di materiale, di parti meccaniche logorate dall'uso.
Anche sullo zinco e sue leghe si effettuano depositi successivi di rame e di nichel.
Le proprietà meccaniche dell'elettrodeposito di nichel variano notevolmente al variare del tipo di bagno e processo usati.
Le tensioni interne del rivestimento hanno rilevante importanza agli effetti della tendenza alla screpolatura e allo sfaldamento, in connessione cioè con la fragilità del rivestimento stesso. Tale fragilità risulta maggiore quando il procedimento nei bagni viene effettuato usando anche agenti splendogeni, ma può ridursi per aggiunta di altri additivi.
La porosità nei rivestimenti di nichel su materiale ferrosi è un inconveniente grave agli effetti della resistenza alla corrosione. Il più semplice ma costoso rimedio consiste nel depositare spessori rilevanti di nichel; un altro rimedio è la coronizzazione che consiste nell'elettrodeposizione di un successivo strato di zinco o di stagno e nel riscaldamento del pezzo sopra il punto di fusione di questi metalli: essi diffondono nel nichel riducendo i pori.
Attraverso la elettrodeposizione con inversione di corrente si ottengono depositi meno porosi, più lisci e più lucenti.
Un fattore molto importante oltre alla concentrazione degli ioni di nichel è l'acidità del bagno.
L'agitazione del bagno per insuflaggio di aria compressa e il movimento alternativo dei catodi facilitano la formazione di un rivestimento uniforme, mantengono a un livello sufficiente la concentrazione degli ioni nichel nelle vicinanze del catodo ed evitano la punteggiatura del deposito.
Gli anodi possono essere di nichel o di materiale diverso insolubile. Gli anodi di nichel devono essere assai puri ed esenti da ferro e zinco, mentre gli anodi insolubili sono di piombo o di carbone. Usando gli anodi insolubili il bagno, durante il funzionamento, si impoverisce di ioni nichel mentre aumenta l'acidità: è necessario aggiungere continuamente carbonato di nichel per neutralizzare l'acido libero che si forma e ripristinare la concentrazione di nichel.
Nell'utilizzare anodi solubili di nichel un inconveniente comune è costituito dalla passivazione degli anodi con formazione di uno strato di ossido di nichel che rallenta o impedisce la dissoluzione dell'anodo stesso.
Si distinguono diversi processi di nichelatura elettrolitica a seconda principalmente del tipo di bagno utilizzato.
La nichelatura nera ha scopo decorativo e si ottiene per aggiunta di solfato di zinco e di solfocianuro di sodio a un bagno di solfato di nichel. E' realizzabile su molti metalli direttamente o meglio su un deposito di nichel; è seguita dall'oliatura o verniciatura protettiva.
La maggior parte degli oggetti nichelati subisce successivamente una leggera cromatura: tale operazione di fissaggio viene effettuata allo scopo di migliorarne ancora l'aspetto e di impedire l'ingiallimento superficiale che va manifestandosi sui depositi di nichel con l'andar del tempo.
- cromatura: rivestimento di cromo; è usata per ottenere un rivestimento decorativo su superfici già lucide, generalmente nichelate: per avere questi effetti sono sufficienti strati sottilissimi, qualche decimo di micrometro.
La cosiddetta cromatura dura è adottata invece per ottenere superfici atte a sostenere notevoli sollecitazioni meccaniche, per esempio per alberi motori e perni: si possono ottenere superfici di durezza da 500 a 1200 punti brinell.
La cromatura si distingue dalle altre elettrodeposizioni in quanto il metallo non si trova nel bagno allo stato di ione positivo, ma prevalentemente allo stato di ione cromato o bicromato. Il processo elettrodico è quindi più complesso. Per una regolare elettrodeposizione è necessaria la presenza di ioni solforici o fluoridrici o fluosilici.
Un elettrodeposito di cromo splendente, che non richieda ulteriore lucidatura, si può ottenere solo operando entro determinati limiti di densità di corrente e di temperatura; tali limiti variano a seconda della composizione del bagno e della natura del materiale base.
Il potere penetrante dei bagni è assai scarso e questo fatto richiede particolare cura nella disposizione degli oggetti nei bagni e talvolta ricorrere all'uso degli elettrodi ausiliari.
Si impiegano anodi insolubili di piombo con 6¸10 % di antimonio o di stagno. Oltre al compito di trasportare la corrente gli anodi hanno anche la funzione di riossidare il cromo trivalente (che si forma in piccola quantità per riduzione al catodo) a cromo esavalente (cromato); la quantità di cromo trivalente presente non deve infatti superare certi limiti. Gli anodi devono avere una superficie maggiore di quella dei catodi e perciò si adottano anodi a superficie multipla (corrugata). Le condizioni di elettrolisi variano a seconda delle caratteristiche della superficie che si vuole ottenere: durezza, resistenza alla rigatura, resistenza alla corrosione, coefficiente d'attrito.
Il coefficiente d'attrito del cromo è inferiore a quello di molti altri metalli: dunque la cromatura è utile anche su pezzi soggetti a continui attriti; poiché il cromo liscio non trattiene i lubrificanti, si procede talvolta alla cromatura porosa. La porosificazione si realizza con sistemi meccanici o elettrochimici sulla cromatura dura precedentemente ottenuta.
NB.: per la nichelatura e la cromatura di pezzi di notevoli dimensioni, di forma irregolare, che sarebbe scomodo disporre in vasche, o di pezzi la cui superficie deve essere rivestita solo in determinate parti è vantaggioso il procedimento al tampone.
Esso può essere applicato senza introdurre il pezzo in una vasca, ma connettendolo al polo negativo, irrorando la parte da rivestire con l'elettrolita e facendovi scorrere a contatto un anodo a forma tubolare simile a una matita assai grossa. La punta dell'anodo è costituita da una massa spugnosa che si imbeve dell'elettrolita. Poiché si adottano altissime densità di corrente l'anodo deve essere cavo e raffreddato con circolazione d'acqua all'interno.
- zincatura: rivestimento di zinco; chiamata impropriamente galvanizzazione, è uno dei più importanti metodi di protezione dei materiali ferrosi contro la corrosione atmosferica. L'elettrodeposizione dello zinco è in concorrenza con la zincatura termica per immersione o a spruzzo e con la sherardizzazione. I vantaggi della zincatura elettrolitica consistono nel minore consumo di zinco e nell'ottenimento di rivestimenti assai omogenei e aderenti.
E' preferita per oggetti in acciaio temprato o per pezzi lavorati di precisione che mal sopporterebbero forti riscaldamenti senza sensibili deformazioni.
Le lastre zincate hanno di solito rivestimenti di circa 1,25 g di zinco per decimetro quadrato, ma possono raggiungere anche valori doppi, corrispondenti a spessori di circa 80¸90 mm, se devono resistere a corrosioni più severe.
E' molto importante che l'elettrodeposto sia costituito da zinco puro.
I bagni possono essere di due tipi: bagni acidi e bagni alcalini.
I bagni acidi danno più facilmente rivestimenti puri, ma hanno scarso potere penetrante e richiedono talvolta l'uso di anodi ausiliari.
I bagni alcalini sono adatti per oggetti di forme complicate e spesso vengono impiegati per una prezincatura a cui si fa seguire la zincatura in bagno acido.
Gli anodi per elettrodeposizione dello zinco sono generalmente di zinco puro o talvolta in lega con altri metalli, per esempio il magnesio; si possono usare, in soluzioni molto acide, anodi insolubili al piombo.
Con aggiunta di adatti splendogeni, come glucosio, destrina, gelatina o colla da falegname, si ottengono zincature lucide con elettrodepositi a grana assai fine.
La resistenza dei rivestimenti di zinco contro la corrosione può essere aumentata passivandoli con il processo di cromatazione, che consiste nell'immersione in bagni contenenti composti di cromo esavalente (acido cromico, cromati) e catalizzatori. Il trattamento provoca la formazione di un film di aspetto vellutato che per essiccamento diventa aderente e flessibile, ma che non è molto resistente all'abrasione.
- cadmiatura: rivestimento di cadmio; l'elettrodeposizione del cadmio presenta molte somiglianze con quella dello zinco sia dal punto di vista termico, sia per quanto riguarda le finalità. I rivestimenti di cadmio sono però superiori per aspetto, duttilità, resistenza alla corrosione marina e idoneità a successive finiture, ma inferiori in durezza e resistenza alla corrosione atmosferica. La cadmiatura è più costosa e quindi è meno diffusa della zincatura.
- stagnatura: rivestimento di stagno; il maggior pregio dei rivestimenti di stagno è la loro azione protettiva di fronte agli agenti atmosferici e di fronte alle soluzioni acquose contenente sali o acidi deboli, come ad esempio le conserve alimentari. Poiché lo stagno può comportarsi, a seconda delle condizioni, sia da anodo, sia da catodo rispetto al ferro è necessario che i rivestimenti non siano porosi, per evitare il pericolo della formazione di coppie galvaniche con corrosione più rapida del ferro in corrispondenza dei pori.
Come la zincatura, anche la stagnatura è effettuata di preferenza per via termica (per immersione, spruzzo). La stagnatura elettrolitica permette un miglior controllo dello spessore.
La stagnatura galvanica è attualmente usata per oggetti in ghisa, per fili di rame, scatole di conserve alimentari e semilavorati in genere.
I rivestimenti ottenuti sono molto duttili ma, a meno che si faccia uso di adatti splendogeni, più opachi di quelli ottenuti per via termica.
- piombatura: rivestimento con piombo; i metodi per ottenere rivestimenti di piombo sono numerosi: piombatura meccanica con lamine di piombo, piombatura a vernice con polvere di piombo e glicerina e successiva fusione, a spruzzo con piombo fuso, per immersione in piombo fuso e infine per piombatura elettrochimica.
La piombatura per elettrodeposizione ha lo svantaggio di dare difficilmente depositi compatti, spessi ed esenti da pori; ha però il vantaggio di essere applicabile sulla maggior parte dei materiali metallici più comuni.
Il piombo è un ottimo rivestimento protettivo contro azioni corrosive anche energiche come quella dell'acido solforico.
Gli anodi sono di piombo raffinato.
- elettrodeposizione di leghe: due o più metalli possono essere simultaneamente deposti dallo stesso bagno. La più comune è l'ottonatura che si ottiene per elettrodeposizione di rame assieme a zinco e serve a scopo decorativo o come strato intermedio per la nichelatura su alluminio o leghe di zinco; il colore varia al variare della percentuale dei metalli componenti.
La codeposizione di stagno e zinco è stata studiata allo scopo di ottenere rivestimenti che abbiano le proprietà protettive dei rivestimenti di stagno, ma senza presentare il difetto caratteristico di questi ultimi e cioè la porosità che ne compromette in parte la funzione protettiva.
Questi depositi sono inferiori, per quanto riguarda la durata, ai depositi di solo zinco, ma sono superiori per l'uso in ambienti molto umidi e per il migliore aspetto.
NB. METALLOCROMIA: indica la coloritura dei depositi galvanici con l'uso di speciali soluzioni, semplicemente per immersione (metallocromia chimica) o con il concomitante uso della corrente elettrica (metallocromia galvanica o elettrometallocromia). Lo scopo che si vuole raggiungere è unicamente decorativo. I bagni sono svariatissimi e i colori ottenuti dipendono dal metallo base e dalla composizione del bagno e risultano dalla formazione di strati sottilissimi di ossidi, solfuri, carbonati.
Questi possono essere protetti ulteriormente con vernici trasparenti. Per l'elettrometallocromia l'oggetto è posto come catodo.
METALLIZZAZIONE: viene realizzata utilizzando come agente ricoprente una forma più o meno suddivisa di metallo.
I sistemi in uso sono:
- la metallizzazione per immersione: si immerge il materiale base in un bagno di quello di copertura;
- la metallizzazione a spruzzo o a vapore: materiali diversi, anche non metallici, possono essere metallizzati mediante proiezione di goccioline direttamente allo stato liquido ovvero provenienti dalla condensazione di vapore; sono esempi i rivestimenti a spruzzo mediante scarica elettrica stabilizzata (plasma), il rivestimento per spruzzofusione alla fiamma;
- la metallizzazione per diffusione: si basa sulla proprietà che hanno i materiali di formare tra loro soluzioni solide per reciproca diffusione a temperatura elevata ma sempre inferiore ai punti di fusione dei materiali stessi.
Con questa via si attuano i seguenti processi:
- sherardizzazione o cementazione superficiale con zinco: trattamento durante il quale l'acciaio assorbe zinco. Si effettua ad una temperatura di 400¸450 °C per un tempo che è funzione dello spessore desiderato: dopo circa 6 ore lo strato superficiale zincato ha uno spessore di 0,05 mm;
- silicizzazione: trattamento di diffusione in un mezzo dal quale l'acciaio possa assorbire silicio; realizzata con polvere di silicio o di lega ferro-silicio o carborundum a circa 900¸1000 °C e in presenza di cloro; la silicizzazione industriale si compie per diffusione in fase gassosa. La durata del processo è in funzione dello spessore richiesto: 2¸4 ore offrono uno spessore di 0,4¸0,5 mm. Il processo è consigliabile per gli acciai a basso tenore di carbonio e di zolfo. Oltre ad una buona resistenza alla corrosione e alla ossidazione a caldo (fino a circa 1000 °C), lo strato presenta buone caratteristiche di resistenza alla usura, ottenuta non per la durezza del deposito (circa 150 punti brinell) ma perché i pezzi silicizzati vengono immersi in olio lubrificante a 120¸150 °C ed assorbono olio;
- cromizzazione: trattamento di diffusione in un mezzo dal quale l'acciaio possa assorbire cromo. Si applica agli acciai a basso tenore di carbonio per ottenere acciai inossidabili e anche molto duri se si aggiunge alla polvere di cromo del carbonio. L'operazione è condotta per 5¸6 ore in funzione dello spessore e la temperatura del trattamento è di circa 1000 °C e dipende dal tenore di carbonio. Il processo provoca cromo atomico che si diffonde nell'acciaio formando uno strato superficiale di carburi di cromo; le proprietà dello strato dipendono dalla composizione dell'acciaio e in particolare dal tenore di carbonio. Offre una resistenza all'ossidazione, in servizio continuo, alla temperatura di 850 °C;
- calorizzazione o alluminatura: trattamento di diffusione in un mezzo dal quale l'acciaio possa assorbire alluminio. La temperatura del processo è di 800¸900 °C circa; la permanenza in forno è funzione dello spessore: da 6¸24 ore per uno spessore da 0,1 a 1 mm. La calorizzazione avviene ponendo i pezzi in una miscela di polvere di alluminio con appositi additivi al fine di facilitare la reazione. Temperature di esercizio superiori a 500 °C possono essere ottenute sottoponendo il pezzo ad un opportuno trattamento di diffusione.
- Si tratta di materiali inorganici applicati come rivestimento mediante un processo di fusione, allo scopo di migliorare l'aspetto, la resistenza alla corrosione,…
- I rivestimenti possono essere di due tipi:
- vetrosi: di solito indicati per temperature non molto discoste da quella ambiente;
- cristallini: usati per alte temperature date le loro proprietà refrattarie.
- MATERIALI VETROSI: sono generalmente conosciuti come smalti, smalti vetrosi, smalti porcellanati e sono silicati amorfi; l'applicazione avviene di solito a spruzzo, ma può anche essere effettuata per immersione o per applicazione a pennello.
- MATERIALI CRISTALLINI: sono di solito ossidi (allumina, ossido di zirconio stabilizzato,…) applicati mediante spruzzatura al plasma.
- Poiché gli ossidi del rivestimento hanno temperature di fusione più elevate di quella del materiale base possono proteggere contro la corrosione e l'erosione alle alte temperature e possono fungere anche da isolanti termici ed elettrici.
- NB.: i pezzi smaltati resistono bene agli agenti chimici, ma sono poco resistenti a bruschi sbalzi termici e agli urti meccanici.
- VERNICI
- Le vernici sono prodotti essenzialmente liquidi, più o meno densi che, stesi in tratti sottili su corpi, formano una pellicola dura ed elastica che ricopre e protegge la superficie sottostante.
- Questi prodotti devono essere in grado di:
- formare pellicole sottili, aderenti e facilmente essiccabili;
- essere facilmente applicate ai supporti;
- essere impermeabili all’acqua;
- essere inerti all’azione della luce e dell’ossigeno dell’aria;
- presentare durezza, elasticità, flessibilità;
- non screpolarsi.
- La vernice non può essere di genere qualunque ma deve rispondere, di volta in volta, a particolari requisiti capaci di renderla refrattaria alle influenze corrosive dei diversi ambienti.
- L’applicazione delle vernici viene eseguita in due tempi:
- preparazione del fondo;
- verniciatura vera e propria, condotta in più stadi: applicando in tempi successivi più strati di vernice.
Le vernici attualmente impiegate a scopo anticorrosivo contengono resine sintetiche che, solo dopo applicazione e sotto l'influenza della luce, dell'ossigeno atmosferico e del calore, subiscono reazioni di polimerizzazione che conducono alla formazione della vera pellicola protettiva.
In caso di polimerizzazione lineare (resine viniliche) la resina conserva la propria solubilità, mentre nella polimerizzazione reticolata (resine fenoliche, epossidiche) si ottengono dei prodotti insolubili in tutti i solventi, anche in quello adoperato per l'applicazione. Nel primo caso le pellicole protettive risultano elastiche, bene aderenti alla superficie da proteggere, ma poco resistenti ai solventi; nel secondo caso la minore elasticità e adesività sono compensate da una grande resistenza meccanica e spiccata durezza.
- RIVESTIMENTI PLASTICI
- Viene scelto il materiale plastico più indicato per realizzare il rivestimento protettivo nelle reali condizioni operative e dopo aver opportunamente preparato le superfici si ancora il rivestimento al supporto.
- Le superfici occorre renderle ruvide in modo da offrire al materiale di copertura una buona presa: il metodo migliore è quello di fosfatizzare le superfici metalliche, però, in generale può essere sufficiente una energica sabbiatura. Fra i metodi di ancoraggio possiamo ricordare l’incollaggio, la chiodatura protetta da opportuni coprigiunti, facendo aderire al recipiente il materiale di rivestimento rammollito con una fiamma, mediante l’impiego di dispersioni (adatto al PVC),....
- I materiali da rivestimento più utilizzati sono:
- PVC;
- polietilene;
- polipropilene;
- teflon;
- ...
- CASO 4) ATTUARE
- Fra gli accorgimenti utilizzati per correggere gli ambienti corrosivi possiamo ricordare:
- l’essiccazione;
- l’assorbimento o l’aspirazione di anidride carbonica, dell’acido solfidrico e di altri eventuali gas aggressivi;
- depurazione delle acque industriali dai gas e dai sali disciolti;
- modifica dello stato elettrico;
- la diminuzione della temperatura;
- la diminuzione della velocità dell'elettrolita;
- la rimozione dell'ossigeno dall'elettrolita;
- la riduzione delle concentrazioni degli ioni aggressivi;
- l'aggiunta degli inibitori;
- ….
- MODIFICA DELLO STATO ELETTRICO
- La modifica dello stato elettrico di un’opera metallica è una difesa molto comune ed efficace per i materiali metallici interrati e anche, talvolta, per apparecchiature chimiche e serbatoi.
- Questa difesa consiste nel conferire, mediante appropriati collegamenti, un potenziale negativo alle strutture metalliche da proteggere.
- Fra i sistemi di protezione anticorrosiva di natura elettrica ricordiamo:
- protezione catodica attiva con anodo sacrificale;
- protezione catodica a corrente impressa.
- Protezione con anodo sacrificale: si tratta di interrare vicino alla struttura da proteggere delle masse di metalli fortemente elettropositivi quali magnesio, zinco e alluminio. In tal modo la struttura funge da catodo, mentre le masse dei metalli non nobili fungono da anodo e si dissolvono. Il collegamento elettrico fra i due poli viene assicurato per mezzo di conduttori di rame isolati elettricamente e impermeabilizzati; nel circuito si inserisce un sistema di regolazione capace di adattare la corrente della pila così formata alle esigenze dello stato elettrico del terreno: in tal modo si riesce a ridurre al minimo indispensabile il consumo delle masse anodiche. Gli anodi, cosiddetti sacrificali, devono essere periodicamente controllati e si devono facilmente sostituire se consumati. Gli anodi dovranno presentare, a parità di massa, la maggiore superficie possibile.
- Struttura metallica da proteggere
- anodo sacrificale
- Protezione con corrente impressa: viene prelevata dell’energia elettrica dalle normali reti di distribuzione, viene trasformata in corrente atta a proteggere le strutture metalliche per mezzo di un raddrizzatore, il cui polo negativo viene collegato alla struttura da proteggere e quello positivo a una presa a terra.
- Anche in questo caso la protezione è conseguenza del fatto che la struttura metallica che si vuole proteggere risulta catodica rispetto al terreno circostante.
- La protezione con immissione di corrente non viene applicata solo alle apparecchiature interrate, ma a qualunque apparecchio che tenda a fungere da anodo, dunque corroso, nei confronti dell’ambiente.
- Per esempio macchinari fatti di titanio possono essere resi resistenti ai principali acidi (solforico, cloridrico,...) facendoli risultare poli negativi (catodi) sotto una tensione di 1¸2 volt sacrificando contemporaneamente qualche rottame metallico.
conclusioni
VARIABILI OPERATIVE DA VALUTARE
- composizione e concentrazione dei reagenti e relativi prodotti di reazione;
- identificazione del quantitativo dei gas in soluzione;
- presenza di additivi e impurezze anche in tracce;
- pH;
- temperatura massima e minima ed eventuale frequenza del ciclo termico;
- pressione totale e pressioni parziali dei singoli costituenti;
- fasi presenti nel sistema;
- velocità o agitazione;
- eventuali fenomeni di condensazione o vaporizzazione e loro posizione;
- possibile presenza di depositi;
- tipo di sollecitazione e sua entità.
PROPRIETA' E DISPONIBILITA' DEI DIVERSI MATERIALI
- proprietà fisiche e meccaniche alle varie temperature;
- variazione delle proprietà in funzione del tempo;
- resistenza alla corrosione;
- forme e dimensioni disponibili in commercio;
- facilità di approvvigionamento;
- proprietà tecnologiche;
- disponibilità delle specifiche di lavorazione;
- necessità di trattamenti termici;
- compatibilità con altri materiali.
PROGETTAZIONE
Una corretta progettazione delle apparecchiature può essere importante per la prevenzione della corrosione tanto quanto la scelta dei materiali adatti. Ecco di seguito alcune regole generali:
- considerare quando si dimensiona lo spessore di materiale usato in base alle sollecitazioni meccaniche dell'effetto di assottigliamento delle pareti dovuto alla corrosione; questo è particolarmente importante per tubi e serbatoi che contengono fluidi;
- ricorrere alla saldatura piuttosto che alla chiodatura per ridurre la corrosione interstiziale; se occorre utilizzare chiodi scegliere quelli che hanno un comportamento catodico rispetto al materiale che deve essere giuntato;
- se possibile usare materiali galvanicamente simili per l'intera struttura; evitare materiali metallici diversi che possono causare corrosione per contatto galvanico. Se devono essere usati insieme materiali con caratteristiche diverse usare guarnizioni e rondelle non metalliche al fine di realizzare un efficace isolamento elettrico tra i diversi materiali;
- evitare eccessive sollecitazioni ed eccessive concentrazioni degli sforzi negli ambienti corrosivi, per prevenire la corrosione sotto sforzo; questo è molto importante quando si utilizzano materiali quali gli acciai inossidabili, gli ottoni,…, che, sebbene resistenti alla corrosione generalizzata, sono suscettibili di corrosione sotto sforzo in determinati ambienti corrosivi. Per quanto riguarda gli acciai al carbonio e basso legati, evitare per quanto possibile l'uso di acciai con resistenza meccanica molto elevata, suscettibili di corrosione sotto sforzo per infragilimento da idrogeno;
- evitare curve strette nelle tubazioni con fluidi in veloce movimento; la presenza di zone in cui il fluido cambia bruscamente direzione favorisce fenomeni di corrosione-erosione;
- progettare serbatoi e altri contenitori prevedendo un agevole drenaggio e una facile pulizia; le vasche in cui ristagnano liquidi corrosivi danno origine a celle di concentrazione che promuovono la corrosione;
- progettare i sistemi prevedendo una facile rimozione e sostituzione delle parti che si prevede vadano fuori servizio più rapidamente; per esempio, negli impianti chimici, le pompe dovrebbero essere facilmente sostituite;
- progettare impianti termici in cui non si formino zone surriscaldate o comunque più calde del necessario; per esempio gli scambiatori di calore dovrebbero essere progettati per ottenere gradienti uniformi di temperatura;
- progettare sistemi con caratteristiche le più uniformi possibili ed evitare eterogeneità.
IN DEFINITIVA
ACCORGIMENTI CONTRO I PERICOLI DI CORROSIONE
E’ necessario separare gli accorgimenti a disposizione del progettista e del fabbricante da quelli che debbono essere tenuti dall’utilizzatore e che dunque interessano la manutenzione.
In fase di progettazione i pericoli di corrosione possono essere eliminati con la scelta dei materiali adatti dopo un attento esame di tutte le condizioni di lavoro.
E’ possibile proteggere le superfici metalliche con una pittura, una vernice o uno smalto.
Protezioni superficiali sono pure quelle ottenute rivestendo un materiale metallico con un metallo come nel caso delle zincature, stagnature, cadmiature,…
Il progettista deve evitare l’unione di materiali dissimili e se ciò non è possibile deve prevedere un isolamento in modo da interrompere la continuità metallica.
Si deve poi aver calcolato attentamente lo stato di sollecitazione ed il tipo di geometria.
In fase esecutiva bisogna attenersi alle specifiche concordate con la progettazione.
Tutte le operazioni di deformazione plastica a caldo o a freddo (curvatura, bombatura, piegatura,…) e le saldature devono esser eseguite con la massima cura possibile.
Attenzione particolare deve essere posta nell’esecuzione di trattamenti termici generali e/o superficiali al fine di evitare l’insorgere di tensioni interne.
Quando è richiesta curare poi l’applicazione dei rivestimenti protettivi.
In fase di collaudo e di esercizio si dovranno correggere eventuali errori commessi nelle fasi di progettazione e di realizzazione.
Durante la manutenzione si dovranno eseguire ispezioni periodiche ad intervalli che dipenderanno dalla severità delle condizioni di funzionamento e dal grado di pericolosità dell’impianto stesso.
I controlli potranno essere eseguiti con metodi di controlli non distruttivi (liquidi penetranti, raggi X, magnetoscopia,…).
Si possono elencare alcuni interventi dal punto di vista generale:
- si modificano le condizioni ambientali;
- si possono operare variazioni della temperatura di esercizio e/o della velocità del fluido;
- si aggiungono inibitori;
- si interpongono ai contatti intermetallici guarnizioni isolanti;
- si “chiudono” eventuali interstizi;
- si possono utilizzare protezioni anodiche o catodiche;
- …
QUINDI
TECNICO DI CORROSIONE
Il tecnico di corrosione (corrosion engineer, tecnico corrosionista) ha il compito di studiare e suggerire i mezzi idonei sia a combattere i guasti che derivano agli impianti dalla corrosione, sia ad impedire alterazioni che si possono manifestare nei prodotti lavorati.
I requisiti che si richiedono a un buon tecnico di corrosione sono:
- conoscenza dei fenomeni di corrosione;
- conoscenza delle caratteristiche corrosive dei prodotti chimici;
- conoscenza delle proprietà fisiche-chimiche, meccaniche e tecnologiche dei materiali;
- conoscenza dei metodi di lavorazione;
- conoscenza delle caratteristiche dei materiali lavorati e delle influenze che su queste caratteristiche può esercitare l'ambiente di lavoro;
- conoscenza dei modi di preparare e condurre le prove di corrosione e la capacità di interpretare i risultati delle prove stesse;
- conoscenza dei materiali resistenti alla corrosione;
- conoscenza dei costi dei materiali e della maggiore o minore facilità di approvvigionamento;
- idoneità a collaborare con i vari componenti dell'azienda.
Il primo compito del tecnico che si occupa della corrosione è quello di prevenire il fenomeno; deve progettare dunque le strutture, studiarne i materiali e indicare come questi vanno lavorati in modo da ridurre al minimo i costi provocati dalla corrosione.
Dovrà essere in grado di diagnosticare il guasto prodottosi e decidere ciò che deve essere fatto per correggere la situazione in modo da evitare che il "guasto" possa riprodursi in breve tempo.
La diagnosi comporta ovviamente l'esecuzione di prove di laboratorio: esami metallografici, analisi chimiche,….
Dovrà prendere provvedimenti in modo tempestivo al fine di arrestare ogni sintomo di corrosione sin dal suo primo apparire e, se del caso, dovrà subito cercare di modificare le condizioni di lavoro, la composizione delle soluzioni che vengono trattate, le sollecitazioni meccaniche cui risultano soggette le apparecchiature,…; infine dovrà indirizzare con visione sicura il reparto manutenzioni sul modo più efficiente di riparare i guasti.
Per l'adozione delle decisioni finali dovrà basarsi:
- sull'efficienza del metodo;
- sulla facilità di applicazione del metodo prescelto;
- sul suo costo intrinseco e di riflesso, per esempio in ordine alle eventuali modifiche che apporta ai prodotti di lavorazione.
Dovrà curare il mantenimento di una raccolta di dati di esercizio delle attrezzature soggette a corrosione.
Infine il tecnico di corrosione non deve mai affidarsi pienamente alla descrizione che fanno i cataloghi dei prodotti industriali trattati dalla sua ditta sia in acquisto, sia in vendita.
Egli deve controllare o far controllare in modo responsabile i materiali prima della loro messa in opera e le attrezzature finite prima che vengano commerciate.
E' spesso possibile ottenere sostanziali risparmi curando che siano disponibili nel magazzino della fabbrica materiali, apparecchi, parti (pompe, valvole,…) e pezzi di ricambio adatti a fronteggiare rapidamente ogni emergenza che può verificarsi per guasto da corrosione.
Affinché i materiali di riserva possano assolvere appieno il loro compito devono rispondere a sagomature standard.
I maggiori risultati dell'opera di un buon tecnico di corrosione saranno del tipo:
- le nuove attrezzature avranno una massima durata;
- le attrezzature già operanti si conserveranno a lungo;
- saranno eliminate le costose interruzioni nella produzione;
- ridotte o eliminate le perdite dei prodotti conseguenti a perdite degli apparecchi o delle tubazioni;
- potranno essere ripristinate le attrezzature già escluse dal servizio a causa della corrosione;
- saranno migliorate le qualità dei prodotti così da renderli più facilmente vendibili e in modo da migliorare la posizione dell'azienda rispetto ai concorrenti;
- verrà incrementata la sicurezza sul lavoro;
- aumenteranno gli utili della azienda; i risparmi e maggiori profitti derivano dai minori costi di fabbricazione e di manutenzione degli impianti e da una migliore posizione concorrenziale.
BIBLIOGRAFIA
G. Bianchi - F. Mazza: "Corrosione e protezione dei metalli" Ed. Masson Italia Editori
A. Cacciatore - M. Fraccon - E. Stocchi: "Impianti Chimici Industriali" Vol. I Ed. La Prora
E. Ribaldone - G. Bianucci: "Chimica teorica e pratica" A. Mondadori Editore
A. Post Baracchi - A. Tagliabue: "Chimica Organica e Industriale" Ed. Lattes
A. Secciani - G. Villani: "Produzione Metalmeccanica" Vol. II Cappelli Editore
William F. Smith: "Scienza e Tecnologia dei Materiali" Ed. Mc Graw-Hill
W. Nicodemi - R. Zoia: "Metallurgia Applicata" Ed. Tamburini
Voci Enciclopedia SCIENZA E TECNICA (EST) Ed. Mondadori: - corrosione
- galvanotecnica
- ossidazione anodica
- passività
- rivestimenti protettivi
Normativa U.N.I.: 3564-65 3666-65 3667-68 3668-68 3951-68 4007-66
4008-66 4009-66 4261-66 4262-66 4263-65
Fonte: http://xoomer.virgilio.it/treclassi/corrosione.zip
Autore del testo: Ugo Apostolo
Corrosione dei metalli
COMPORTAMENTO A CORROSIONE DEI MATERIALI METALLICI. GENERALITA’ E CAMPI DI APPLICAZIONE
In questo paragrafo si intende delineare quali siano i principali campi di applicazione delle varie classi di materiali di uso ingegneristico, fornendo una guida di consultazione rapida. Nel seguito si entrarà più nel dettaglio delle caratteristiche resistenziali dei vari materiali sia in ambienti naturali che industriali.
FERRO, ACCIAIO, GHISE COMUNI
Sono i materiali più usati grazie al loro basso costo ed alle buone caratteristiche meccaniche, ampiamente migliorabili mediante trattamenti termici e meccanici. Per avere un'idea della loro economicità basti pensare che il loro costo è 1/3 dello Zn e Pb, 1/4 dell'Al, 1/10 del Cu, 1/20 del Sn e del Ni, 1/80 del Ti. La loro resistenza alla corrosione è comunque scarsa, anche in ambiente atmosferico, risultando soddisfacente solo in taluni ambienti alcalini e in soluzioni concentrate di H2SO4. L'impiego di questi materiali è tuttavia possibile ricorrendo a rivestimenti protettivi o imponendo adeguate protezioni catodiche. Per quanto riguarda il fenomeno della S.C.C. questi materiali ne sono soggetti soprattutto in presenza di nitrati, carbonati, bicarbonati alcalini e solfuri.
GHISE ALTOLEGATE
La Ghisa al Silicio di composizione approssimata 0,85% C, 14,5% Si, 0,65% Mn, esibisce un ottima resistenza agli acidi organici ed inorganici. Tuttavia, essendo difficilmente saldabile si può disporre solo sotto forma di getti. Se l'ambiente contiene cloruri viene aggiunto un 3% Mo che incrementa la resistenza al pitting.
Le Ghise Austenitiche che contengono il 1436% di Ni e 1,755,5 Cr devono alla loro struttura austenitica (conferita dal Ni) un'ottima resistenza agli ambienti alcalini, ma anche ad acido solforico e cloridrico. Questo materiale possiede anche buone caratteristiche meccaniche e quindi resistenza alla corrosione-erosione. La differenza tra le ghise austenitiche e le ghise grigie (più comuni) è pressappoco la stessa che tra un acciaio inox austenitico ed uno dolce al carbonio.
ACCIAI INOSSIDABILI
Questi acciai devono la loro caratteristica alla presenza del Cr che, se in tenori superiori al 12%, permette la formazione di un film di ossidi particolarmente aderente, compatto e protettivo. Affinché tale strato di ossidi possa formarsi è però necessario che l'ambiente aggressivo sia ossidante; quindi in in soluzioni solforiche disareate gli inox non hanno buona resistenza. All'aumentare del tenore in Cr aumenta la resistenza agli ambienti ossidanti e all'ossidazione a caldo. L'aggiunta di Ni(fino a 35%), Cu(2-3%), Mo(1-4%) incrementa la resistenza agli ambienti meno ossidanti.
La loro struttura puï essere ferritica o martensitica (serie AISI 400) o austenitica (serie AISI 300) o anche mista (duplex). Vista l'importanza ed il grande impiego di questi materiali, in Appendice A si descrivono i diagrammi di stato binari e ternari Fe-Cr-Ni e in Appendice B si riportano le composizioni chimiche dei tipi più comuni.
Ordinando per ordine crescente di resistenza alla corrosione, si ha:
- AISI 405 (Ferritico) 12% Cr Atmosfere poco aggressive
- AISI 430 (Ferritico) 17% Cr Atmosfere industriali
- AISI 304 (Austenitico) 18Cr-9Ni Ambienti chimici
mediamente aggressivi
- AISI 316 (Austenitico) 17Cr-13Ni-2Mo Ambienti chimici
aggressivi
- LEGHE 20 (20Cr-33Ni-2Mo-3Cu) Comportamento simile alle
superleghe
Queste leghe hanno però scarse caratteristiche resistenziali ssn < 35 Kg/mm2); per caratteristiche migliori si passa agli acciai inox martensitici e acciai pH (indurenti per precipitazione), ma in questi casi si deve accettare una resistenza alla corrosione minore:
LEGHE DI NICKEL
Queste leghe resistono bene in presenza di cloruri ed in ambienti riducenti e caustici ed anche all'HF disareato, ma hanno costo molto elevato, dati gli alti tenori di Ni. Aggiunte di Cu e Mo migliorano le caratteristiche citate.
Se si aggiunge Cr queste leghe resistono anche ad ambienti ossidanti (Inconel 600).
DENOMINAZIONE Cr Fe Ni
Inconel 600 15 7,2 Resto
Inconel 625 22 3 Resto
Inconel 718 19 18 Resto
Incoloy 800 20,5 46 Resto
Hastelloy C 15 Resto 54
ALLUMINIO E SUE LEGHE
L'Alluminio deve la sua buona resistenza alla corrosione alla formazione di un film passivante molto compatto e resistente, anch'esso prodotto in ambienti ossidanti (neutri o acidi). In ambienti riducenti l'Al viene rapidamente corroso.
Le leghe dell'Al con il Cu (durallumini serie 2000) sebbene abbiano caratteristiche meccaniche notevoli, subiscono un netto decremento di resistenza alla corrosione dovuto alla precipitazione della fase secondaria CuAl2, catodica rispetto alla matrice; nelle leghe contenenti Mg e Mn invece, precipitano composti anodici rispetto a quest'ultima. Eseguendo opportuni trattamenti termici o rivestendo con Al puro, anche queste leghe possono essere impiegate in molti ambienti corrosivi.
LEGHE DI RAME
Le leghe di rame più importanti sono i Bronzi, gli Ottoni e il Cupronikel. Questi materiali sono molto utilizzati nelle apparecchiature di scambio termico e resistono bene in qualsiasi tipo di ambiente (neutro, acido, alcalino), purché vi sia un minimo di areazione e non vi siano specie particolarmente ossidanti (HNO3, CrO4=) o complessanti (amb. ammoniacale) o in grado di reagire direttamente con il rame (H2S, S2, Hg). La migliore resistenza alla corrosione è comunque esibita dai Cupronikel.
TITANIO
Anche il Ti deve la sua resistenza alla corrosione in ambienti ossidanti alla formazione di uno strato d'ossido superficiale particolarmente compatto e resistente. In ambienti molto ossidanti il Ti resiste bene in ambienti anche molto concentrati in cloruri o cloro. In ambienti riducenti viene utilizzato in lega con piccole percentuali di Palladio.
METALLI PER TUBAZIONI
Ferro e acciaio al carbonio
Non devono essere impiegati per soluzioni diluite di acidi, soluzioni elettrolitiche areate per pH > 10. In assenza di liquidi fortemente corrosivi, i campi di temperatura permessi sono fra -10°C e 400 °C. Buona saldabilità. L’acciaio al C è ottimo per H2SO4 concentrato a freddo.
Acciai inossidabili (legati al Ni, tipo austenitico)
Tipi più importanti 304, 316, 321 e 347.
304. Buona resistenza alla corrosione.
Difetti: corrosione intergranulare dovuta a
precipitazione di carburi durante la saldatura.
Nel tipo "L" (saldabile) contenuto di C < 0.035% si ha
una minor tendenza alla precipitazione dei carburi.
316. Migliore resistenza alla corrosione del 304 con una
eccezione: agenti ossidanti come acido nitrico.
Ottima resistenza al pitting per effetto della
presenza di Mo (circa 2 %).
Ottimo nei casi (farmaceutica, alimentare) dove non si
desidera contaminazione dei prodotti da parte dei
metalli. Tipo L saldabile.
347. Come 304 con addizione di columbio. Minor corrosione
intergranualre.
321. Come 304 stabilizzato con addizione di titanio.
Minor corrosione intergranulare.
Gli acciai inossidabili lavorano bene anche in contatto con fluidi aerati. In generale resistono bene alla corrosione da:
- acido nitrico;
- acido solforico diluito a temperatura ambiente;
- quasi tutti gli acidi organici;
- alcali eccetto che a caldo e sotto tensione;
Non resistono a:
- HCl e HF concentrati o diluiti;
- soluzioni di cloruri areata o in presenza di ossidanti;
- acido ossalico, formico o lattico.
Alluminio
Le leghe di alluminio mostrano piccole differenze di comportamento alla corrosione. Tipi più comuni 3003, 5052, 6061, 6063. Tubazioni in alluminio sono molto impiegate nell'industria del freddo.
Tali leghe resistono a:
- idrato ammonico caldo o freddo;
- acido acetrico (caldo o freddo);
- acido citrico, tartanico, maleico;
- acidi grassi;
- acido nitrico 80% fino a 35C;
- acqua distillata;
- zolfo e suoi composti;
Non resistono a:
- acidi come H2SO4, HF, HCl;
- alcali forti;
- mercurio e suoi sali;
- solventi clorurati;
- acqua di mare (pitting);
Rame e sue leghe
Tubazioni facilmente aggiuntabili per saldatura e brasatura.
Il rame resiste bene a:
- acqua di mare;
- esposizione atmosferica;
- soluzioni diluite e non areate di H2SO4, H3 PO4, ed altri
- acidi non ossidanti;
Non resiste a:
- acidi ossidanti (es. acido nitrico);
- idrato ammonico + O2;
- H2S, zolfo e suoi composti.
Leghe Cu/Zn hanno migliori caratteristiche meccaniche del rame puro.
Nickel e leghe a base di Nickel
Tubazioni in nichel sono in commercio in Ni puro o basso legate < 0.02% in C.
Il Ni resiste a:
- alcali caldi e freddi;
- acidi organici e inorganici diluiti e non ossidanti;
- ossidazione in aria ad elevate temperature;
Non resiste a:
- acidi ossidanti (es. acido nitrico);
- sali ossidanti (es. Fe Cl3);
- idrato ammonico aerato;
- acqua di mare;
- zolfo o atmosfere riducenti da S (per T > 300°C).
Legato con Cu migliora le sue caratteristiche agli effetti di condizioni riducenti.
Il Monel 70% Ni 30% Cu resiste bene ad acqua di mare ad alta velocità, acido solforico bollente per concentrazioni minori del 20% ad HF non aerato. Non resiste ad alcali a caldo e concentrati.
L'Inconel, lega al Ni-Cr-Fe, è ottimo per la sua resistenza agli acidi organici. Non va bene per alcali o acidi solforosi o diluiti.
Fra gli Hastelloy (leghe a base di Ni-Mo-Cr-Fe(poco)) i più conosciuti ed impiegati sono il B ed il C.
Hastelloy B. Ottima resistenza ad agenti riducenti (es.HCl) resiste ad H2SO4 al 60% bollente, ma non resiste ad agenti ossidanti come HNO3.
Hastelloy C. Resiste a Cl2 umido, soluzioni di Na ClO e ClO2. ha una eccezionale resistenza per tutti gli agenti ossidanti forti.
Le tubazioni in Hastelloy possono essere saldate, ma attenzione a non indurre tensioni durante i montaggi (pericolo SCC).
Titanio. Resiste bene a soluzioni areate di cloruri, cloro umido, acqua regia a freddo. Buona resistenza HNO3 anche a temperature elevate. Non resiste ad HF e a composti clorurati secchi.
Zirconio. Buona resistenza alla corrosione per medi ossidanti e riducenti.
Resiste a:
- alcali in tutte le concentrazioni sino al punto
di ebolizzione;
- HCl;
- HNO3;
- H2SO4 < 70% (bollente);
- H3PO4 < 55% (bollente);
Non resiste a:
- Cl2 umido;
- HF;
- acqua regia;
- acido ossalico bollente.
MECCANISMI DI CORROSIONE E DATI RESISTENZIALI DELLE PRINCIPALI CLASSI DI MATERIALI METALLICI.
ACCIAI AL CARBONIO, BASSO LEGATI E ACCIAI INOX.
Classificazione grossolana degli acciai in 3 classi principali:
1- Ghise e acciai ordinari, senza aggiunta di elementi di lega ---- sensibili alla corrosione;
2- Acciai basso-legati, con il 2-3% di elementi di lega (Cr,Ni,Cu). Si arrugginiscono all'atmosfera in certe condizioni ambientali, ma la ruggine è più aderente e protettiva e quindi la velocità a corrosione è bassa (acciai "weathering");
3- Acciai inossidabili con 18%Cr-8%Ni-3%Mo. Se ben impiegati sono praticamente incorrodibili.
Acciai al carbonio. Normativa Italiana e Americana
La designazione convenzionale degli acciai in Italia è contenuta nella norma UNI EU 27/77. Gli acciai sono divisi in due gruppi.
I GRUPPO: Acciai designati in base alle loro caratteristiche meccaniche (sottogruppo I1). Acciai designati in base al loro impiego (sottogruppo I2).
II GRUPPO: Acciai designati in base alla loro composizione chimica, anch’essi divisi in due sottogruppi. II1, acciai non legati e II2, acciai legati o debolmente legati.
I GRUPPO.
- Sottogruppo I1.
Vengono designati con la sigla Fe (FeG per gli acciai per getti) seguita da tre cifre che rappresentano il valore minimo, espresso in MPa (N/mm2) di sR o sS (in quest’ultimo caso vengono precedute dalla lettera E) e dall’eventuale simbolo chimico volutamente aggiunto per migliorare alcune particolari proprietà.
Esempi:
Fe 450 Carico di rottura pari a 450 MPa.
Fe 410 Pb Carico di rotttura pari a 410 MPa e aggiunta di Pb in bassi tenori.
Fe E 355 Mn Carico di snerv. pari a 355 MPa e aggiunta di Mn in bassi tenori.
Sottogruppo I2.
Vengono indicati dalla sigla Fe seguita da una lettera caratterizzante le proprietà particolari seguita da un numero di due o più cifre (grado di qualità).
Esempio:
Fe P 03 Acciaio per imbutitura, grado di qualità 03.
II GRUPPO.
Sottogruppo II1.
Vengono designati con la lettera C (GC nel caso di acciai per getti) seguita dal tenore di carbonio moltiplicato per 100 ed eventualmente dal simbolo di un elemento la cui presenza (pur in bassi tenori) determina proprietà particolari, seguita a volte da una cifra.
Esempio:
C 40 S Acciaio legato con tenore medio di carbonio dello 0.4 % e con tenore minimo di zolfo garantito.
Sottogruppo II2.
Si distinguono in: acciai il cui tenore di ogni elemento di lega è minore del 5 % e acciai il cui tenore di almeno un elemento è maggiore del 5 %.
I primi vengono designati con una cifra indicante il tenore di carbonio moltiplicata per 100, seguita dai simboli chimici degli elementi di lega in ordine corrispondente a tenori decrescenti, e da un numero che corrisponde al prodotto del tenore dell’elemento di lega presente in quantità maggiore moltiplicato per un fattore convenzionale che è 4 per [Co, Cr, Mn, Ni, Si, W], 10 per [Al, Be, Cu, Mb, Nb, V, Pb, Ti, Ta], 100 per [N, P, S] e 1000 per [B].
Esempio: 18 Ni Cr 16 Acciaio debolmente legato con tenore medio di carbonio dello 0.18 %, tenore di Ni di circa il 4 % e tenore di Cr inferiore e imprecisato.
I secondi vengono designati con la lettera X (XG nel caso di acciai per getti) seguita dal tenore di carbonio moltiplicata per 100, dal simbolo degli elementi di lega caratterizzanti l’acciaio e dai loro tenori.
Esempio: X10 Cr Ni 18 8 Acciaio legato con tenore medi di carbonio dello 0.1 %, tenore di Cr di circa il 18 % e tenore di Ni di circa 8 %.
Normativa AISI.
Per gli acciai al carbonio o basso legati: sistema numerico formato da 4 o 5 cifre di cui le prime due individuano la classe di appartenenza dell’acciaio e le ultime due (o tre) il tenore di carbonio moltiplicato per 100. In aggiunta si può includere una lettera per indicare il processo di fabbricazione dell’acciaio.
Esempio 10 30 Acciaio al solo carbonio con tenore di carbonio dello 0.3 %.
Nella tabella seguente sono riportate le designazioni convenzionali degli acciai secondo AISI.
DESIGNAZIONE AISI |
ELEMENTI DI LEGA |
10XX |
Solo carbonio |
11XX |
Carbonio e zolfo per la lavorabilità |
13XX |
Manganese 1.5 % – 2.0 % |
23XX |
Nichel 3.25 % - 3.75 % |
25XX |
Nichel 4.75 % - 5.25 % |
31XX |
Nichel 1.10 % - 1.40 %, Cromo 0.55 % - 0.90 % |
33XX |
Nichel 3.25 % - 3.75 %, Cromo 1.40 % - 1.75 % |
40XX |
Molibdeno 0.20 % - 0.40 % |
41XX |
Cromo 0.40 % - 1.20 %, Molibdeno 0.08 % - 0.25 % |
43XX |
Ni 1.4 % - 2.0 %, Cr 0.4 % - 0.9 %, Mo 0.20 % - 0.30 % |
46XX |
Nichel 1.4 % - 2.0 %, Molibdeno 0.15 % - 0.30 % |
48XX |
Nichel 3.25 % - 3.75 %, Molibdeno 0.20 % - 0.30 % |
51XX |
Cromo 0.70 % - 1.20 % |
61XX |
Cromo 0.70 % - 1.10 %, Vanadio 0.10 % |
81XX |
Ni 0.2 % - 0.4 %, Cr 0.3 % - 0.55 %, Mo 0.08 % - 0.15% |
86XX |
Ni 0.3 % - 0.7 %, Cr 0.4 % - 0.85 %, Mo 0.08 % - 0.25% |
87XX |
Ni 0.4 % - 0.7 %, Cr 0.4 % - 0.6 %, Mo 0.2 % - 0.3 % |
92XX |
Silicio 1.80 % - 2.20 |
2XX |
Inox austenitici al Cr Mn Ni |
3XX |
Inox austenitici al Cr Ni |
4XX |
Inox martensitici o ferritici al Cr |
5XX |
Martensitici a medio tenore di Cr (5 % - 10 %) |
XX-X PH |
Inox indurenti per precipitazione |
Per finire vediamo la classificazione funzionale.
Secondo tale criterio gli acciai possono essere divisi nei seguenti gruppi:
- Acciai da costruzione per uso generale.
- Di base.
- Di qualità.
- Acciai speciali da costruzione.
- Da bonifica
- Da cementazione.
- Da nitrurazione.
- Autotempranti.
- Per molle.
- Per cuscinetti a rotolamento.
- Acciai per utensili.
- Acciai inossidabili.
- Acciai per usi speciali.
- Acciai per alte temperature.
- Acciai per basse temperature.
- Acciai maraging.
- Acciai per usi elettrici.
- Etc.
Meccanismo di formazione della ruggine in ambienti naturali.
La pellicola di ossido formata in aria secca non è protettiva nel caso degli acciai al C dolci e in acqua, terreno, aria si deteriora facilmente. Le reazioni catodiche sono:
i) in soluzioni deareate acide 2H+ + 2e- = H2;
ii) in soluzioni neutre e alcaline O2 + 2H2O + 4e- = 4OH-, con formazione di Fe(OH)2 che si ossida a Fe(OH)3 dando l'ossido rosso-bruno noto come ruggine (Fe2O3.H2O). Di quest'ultimo ne esistono varie forme (la più comune è la goetite forma a e la forma g lepidocrocite). Se l'apporto di ossigeno è limitato, può formarsi magnetite Fe3O4 o la forma g-Fe2O3. L'acciaio può tuttavia corrodersi anche in condizioni anareobiche, come nei terreni, ad opera di microrganismi (Desulfovibrio Desulfuricans - solfato-riduttore).
Effetto della composizione. Nel ciclo produttivo dell'acciaio (forgiatura e laminatura a caldo) si forma uno spesso film di ossidi sulla superficie (70%FeO, 20% Fe3O4, 10% Fe2O3) affatto protettivo (si scaglia facilmente), che dev'essere pertanto rimosso per decapaggio acido.
Le aggiunte di elementi di lega abbassano la velocità di corrosione: 0,2%Cu decrementa di 2-3 volte la c. e le aggiunte di C, Mn, Si (per le proprietà meccaniche) pure, anche se in misura molto minore. Importanti possono essere gli effetti delle lavorazioni meccaniche a freddo, soprattutto nel favorire il pitting.
Corrosione in aria. Fattori principali: umidità dell'aria e grado di contaminazione, meno importante la temperatura. Un velo di liquido può formarsi per effetto della pioggia, ma anche al di sotto della saturazione, a causa delle impurezze presenti nell'atmosfera. Su di una superficie pulita la ruggine incomincia a formarsi solo per valori dell'umidità relativa superiori ad un certo valore critico, ma una volta formata può continuare anche a valori ben inferiori, poiché in atmosfera inquinata possono formarsi sali igroscopici. Importante è l'azione di SO2 (atm. ind.), NH4+, Cl- (atm. marina).
Corrosione in acqua. Gli acciai ordinari al C ed anche i bassolegati si corrodono pressocché alla stessa velocità in acqua naturale. Occorrono tenori di Cr >3% per avere un effetto sensibile di riduzione della v.c.. Da segnalare è la diminuzione della tendenza al pitting con addizioni di Cu. Nella maggior parte delle applicazioni è importante rimuovere la scaglia di ossidi superficiali (buon conduttore elettronico) che facilita l'innesco del pitting.
Nelle tubazioni di acqua potabile o industriale, occorre sempre verificare il potere aggressivo/incrostante dell’acqua, tramite il computo dell’Indice di Langelier o dell’indice di Ryznard (vedi sezione caldaie). Le migliori condizioni di impiego di una tubazione in acciaio al C (zincato o meno) sono quelle con acqua in movimentazione di caratteristiche leggermente incrostanti. In tale situazione si favorisce la formazione di un deposito non troppo spesso di carbonato di calcio con frammisti prodotti di corrosione del ferro di buone caratteristiche protettive. Quando invece l’acqua ha caratteristiche di aggressività, i prodotti di corrosione del ferro si presentano sotto forma fioccosa e incoerente, venendo facilmente rimossi dal fluido in movimento e non esplicando alcun effetto protettivo. Le tubazioni che hanno movimentato acque aggressive appaioni in genere ricoperte da film molto porosi con formazione di ‘tubercoli’ al di sotto dei quali si osserva una localizzazione dell’attacco corrosivo con penetrazioni all’interno del materiale molto maggiori della penetrazione media. Una volta formati questi ‘tubercoli’ è molto difficile rimediare e l’attacco localizzato tende a proseguire.
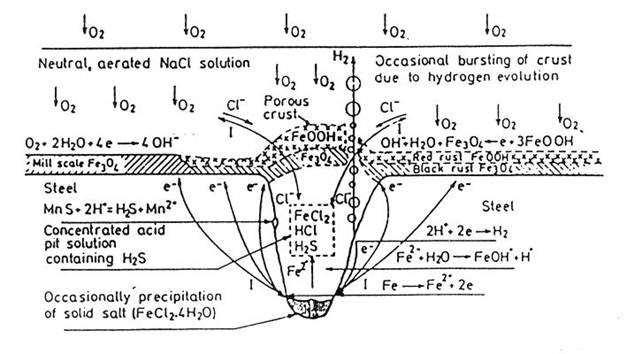
Wrangler ha proposto un meccanismo di innesco di corrosioni localizzate facilitato dalla presenza di inclusioni di zolfo come MnS (v.figura), con formazione di una cella occlusa. Il decremento di pH nel pit porta a dissoluzione di MnS +2H+ -- H2S + Mn2+; la presenza di S= e HS- decrementa la sovratensione di dissoluzione del Fe (e Ni) e aumenta localmente l'attività del metallo, così come la migrazione per elettroforesi del Cl-. Sulla superficie viene a formarsi una patina di FeOOH (rossa) e Fe3O4 (magnetite bruna) che impedisce il mescolamento delle soluzioni acide dentro e fuori il pit, mentre la depolarizzazione avviene per cessione di elettroni all'O2 e all'H+ con possibile formazione di H2 e probabile fessurazione della cappa di ossidi sovrastante. Al di fuori del pit la riduzione di O2 porta a condizioni locali basiche, con locale passivazione per riduzione della ruggine FeOOH a magnetite Fe3O4. Il rilevamento di FeCl2 sul fondo del pit ha portato a supporre il raggiungimento di condizioni di saturazione con pH intorno a 3,5. Questo meccanismo permetterebbe in qualche modo di spiegare l'effetto benefico del rame sulla resistenza alla corrosione degli acciai al C in atmosfera e in soluzioni acide e neutre. Infatti verrebbe, in questo caso, a formarsi Cu2S, che riduce moltissimo l'attività di HS- e S=, tanto da non catalizzare più la dissoluzione anodica del materiale.
Altra peculiarità delle acque naturali è la presenza di spore, microrganismi, alghe, ecc. che possono in certe condizioni innescare corrosioni biologiche.
Fattori che influenzano la v.c. degli acciai in acqua sono la presenza di gas, quali la CO2 e l'O2, il primo in termini di acidità indotta nell’acqua (come acido carbonico) e il secondo in qualità di potente depolarizzatore. Un buon afflusso di O2 in genere aumenta la v.c. (anche un basso apporto, se innesca il pitting), così come la presenza di cloruri (Cl-). Come valori indicativi, per immersione in mare si possono avere penetrazioni dell'attacco corrosivo di circa 0,2 mm/anno, anche se come pitting si arriva fino a circa 2 mm/anno. In condizioni di bagnasciuga si possono moltiplicare questi valori per 2-3.
Corrosione nel suolo. In genere non si impiegano acciai al C tal quali, ma previo opportuno rivestimento e protezione catodica. Pericolosi sono gli attacchi localizzati, causati da lacerazioni del rivestimento con pitting locale per correnti vaganti. La corrosività del suolo dipende molto dalla sua conducibilità elettrica. I meno pericolosi sono quelli secchi, sabbiosi o argillosi, i più aggressivi quelli salini.
ACCIAI BASSO-LEGATI.
Gli acciai basso-legati sono stati sviluppati per ottenere sensibili miglioramenti delle caratteristiche meccaniche degli acciai al solo C. Quelli di solito impiegati per resistere a corrosione hanno addizioni di Cr, Cu, Ni (weathering). Lo strato di ruggine che si forma è più scuro di quello su acciai non legati e le pitture protettive impiegate tengono meglio (prodotti di c. meno voluminosi e quindi minor spalling). Sono utili nelle applicazioni in cui si prevede la facilità di lacerazione della pittura e la lunga esposizione atmosferica. Il Cu e il Cr innalzano il potenziale del metallo favorendone anche la passivazione, e quindi anche il metallo esposto liberamente ha buona resistenza a c.. L'ossido formato è aderente e per cicli bagnamento/asciugatura i pori presenti sono chiusi da sali insolubili, con il risultato di creare una patina superficiale impermeabile all'esterno.
ACCIAI INOSSIDABILI.
Tenore minimo 12%Cr. Come per gli acciai/ghise si distinguono acciai inox/ghise altolegate, impiegate soprattutto per la resistenza a ossidazione ad alta temperatura e laddove sia richiesta una buona combinazione resistenza abrasione-corrosione. La paternità degli inox è usualmente attribuita a Brearly che intravide (1912-15) la possibilità commerciale degli inox martensitici (coltelli). Gli inox austenitici, come base 18Cr-8Ni, partirono dal '20. Si scoprì ben presto la migliore resistenza agli acidi con addizioni di Mo e Cu e subito dopo si misero a punto gli inox stabilizzati (contro la sensibilizzazione alla c.intergranulare).
NORMATIVA AISI si utilizzano tre cifre con eventuale aggiunta di alcune lettere, di cui la prima indica la classe. Gli Acciai austenitici appartengono alla Serie 2XX ed alla Serie 3XX. Gli inox ferritici e martensitici sono tutti nella Serie 4XX.
Acciai martensitici. Buona parte hanno come base il 13%Cr, come il 410/420, con vari tenori di C. Aggiunte di zolfo e selenio migliorano la lavorabilità (416). Con varie aggiunte di altri elementi di lega (base 410), quali Mo,Cu,Al,Nb e Ti, si producono acciai che, in funzione della loro composizione, esibiscono migliore resistenza meccanica, o tenacità, o saldabilità o resistenza a c. (non tutti insieme). Sono impiegati allo stato temprato e rinvenuto e in funzione della temperatura di rinvenimento hanno resistenze meccaniche diverse. Loro particolarità è la brusca variazione della transizione duttile-fragile (per T.T. che portano a circa 1000 MPa di carico di rottura, si ha transizione vicino a TAMB). Un miglioramento sensibile a tal riguardo si ottiene con gli acciai PH, che esibiscono una transizione meno netta (ma la resistenza all'impatto è molto scarsa a bassa T). Quando si desiderano alte durezze si impiegano basse T di rinvenimento, ma è necessario limitare l'applicazione a piccole sezioni.
Acciai ferritici. Aumentando il tenore di Cr e mantenendo basso quello di Ni, si producono miscele di ferrite+martensite e quindi solo ferrite. Ferrite d, meno dura della martensite ma sempre molto fragile, tanto da esibire transizioni duttile/fragile al di sopra della TAMB. Con le nuove tecnologie di produzione, tenendo molto basso il C e N e riducendo la grana cristallina si è in parte risolto il problema (acciai superferritici), anche se le applicazioni sono limitate alle basse sezioni.
Acciai austenitici. Basse caratteristiche meccaniche (s0,2 200 MPa, sR 500 MPa) nello stato ricotto. Migliorabili per deformazione plastica a freddo, grazie ad un'elevata velocità di incrudimento. Si lavorano spesso per stampaggio 'a caldo' (ma non a T>Tricr.) in modo da ridurre il lavoro richiesto e sfruttando la loro capacità di dare allungamenti uniformi prima di raggiungere la rottura. Un altro modo per aumentare la resistenza meccanica, senza peraltro ridurre quella a corrosione, è quello di aggiungere azoto come elemento di lega, raggiungendo s0,2 di circa 500 MPa.
Acciai duplex. Si intendono per duplex gli acciai inox austeno-ferritici, con migliori caratteristiche meccaniche rispetto agli austenitici.
Metodi di fabbricazione. Si possono lavorare tutti per forgiatura, stampaggio o estrusione, sebbene abbiano maggiore rigidità degli acciai al C, specialmente quelli con alto Ni (T dai 900-1200 °C). Naturalmente i martensitici dovranno poi essere temprati e rinvenuti, i ferritici ricotti a circa 800 °C e raffreddati in aria, gli austenitici riscaldati a 1000-1100 °C e raffreddati in aria o acqua (dipende dalla sezione), i duplex riscaldati a 1000-1100 °C e raffreddati in acqua per ridurre la fase s formata. Per le saldature, pochi problemi per gli austenitici (attenzione al weld decay), più difficili i martensitici (prevedere pre- e post-riscaldamento), i ferritici (rischiano di rompersi per i maggiori spessori), i duplex per i materiali giusti di apporto. Non ci sono problemi di lavorabilità alle macchine utensili, almeno se gli inox sono allo stato ricotto. Qualche problema per gli austenitici, che non hanno la rottura del truciolo e possono presentare difficoltà al taglio per la facilità all'incrudimento (addizioni di S per migliorarla, anche se decrementa la resistenza a trazione).
RESISTENZA ALLA CORROSIONE.
Gli acciai inossidabili esibiscono il fenomeno della passività superficiale in un gran numero di ambienti. Nei precedenti paragrafi è stata introdotta la curva di polarizzazione tipica di questi materiali a comportamento attivo-passivo.
Il potenziale di pitting Etr è fortemente decrementato dagli ioni degli alogenuri (in special modo Cl- e Br-). Altri anioni si comportano in modo differenziato, come NO3- che lo alza o S= che lo abbassa. La temperatura abbassa fortemente tale potenziale, il pH lo innalza.
In pratica, un acciaio inox si corrode velocemente se assume un valore di potenziale superiore a quello critico relativo alla soluzione con cui è a contatto. Per questo i sali ossidanti di alogenuri, come FeCl3 e CuCl2, sono particolarmente pericolosi. Non ha senso prevedere una protezione anodica, ma una protezione catodica sì.
E' diventato di uso comune un undice di resistenza al pitting di un acciaio, ottenuto come:
%Cr + 3,3% Mo +16% N
Corrosione atmosferica. Tutti gli inox resistono in ambienti da interno alla scolorazione, mantenendo una buona brillantezza. All'atm. esterna, invece, i martensitici ed alcuni ferritici perdono riflettività a causa di un fine pitting (invisibile ad occhio nudo) e diventano opachi. Le cause sono da ricercarsi nelle impurezze presenti nell'atmosfera (SO2, Cl-, ecc.). Molto importante agli effetti della resistenza al pitting è l'addizione di Mo. All’aumentare del Mo migliore sensibilmente la resistenza a pittino ed a corrosione interstiziale. Tenori crescenti di Mo si trovano da AISI 304 (0 %) ad AISI 316 (circa 2%) ad AISI 317 (circa 3%).
Corrosione in acque naturali. Uno dei fattori principali è il contenuto di Cl-. Importante è anche il contenuto di O2, la T, il pH e le condizioni di moto relativo. Gli inox martensitici non possono essere impiegati in mare, risultando efficaci quelli della Serie 300 in relazione al contenuto di Cr, Mo, N (v.indice). L'attacco è sempre per pitting, le condizioni stagnanti risultando le più gravose. La presenza di fessure, la formazione di microrganismi marini e di depositi vari, costituiscono facile innesco. Bisogna fare attenzione ai contatti galvanici: gli inox martensitici e gli acciai al C si corrodono facilmente al contatto con gli austenitici o leghe di rame. Se a contatto con gli austenitici si pongono leghe meno nobili come Al, Zn, Pb allora ne scaturisce una v.c. alta.
Per le acque potabili non ci sono particolari pb. a freddo, ma ve ne sono a caldo se in presenza di Cl- (>200 ppm).
Corrosione nel suolo. In genere non si interrano strutture in inox. Nelle rare applicazioni, bisogna fare attenzione al contenuto in Cl-.
RESISTENZA IN AMBIENTI CHIMICI
Acido solforico. I martensitici riescono a passivarsi in parte solo in sol. diluite, mentre gli austenitici, grazie al Ni e Mo, riescono meglio (anche perché la densità di corrente nel ramo attivo è fortemente ridotta e possono essere usati anche se si corrodono). Anche l'addizione di Cu è migliorativa. Nb e Ti aiutano, ma non vengono aggiunti per migliorare la resistenza a c. (uno stabilizzato si comporta all'incirca come un 304). La presenza di un agente riducente o ossidante può modificare fortemente la risposta dei materiali, come mostrato in figura dall'aggiunta di HNO3. La temperatura aggrava molto i problemi.
Acido cloridrico. Molto aggressivo per questi materiali, che possono essere usati solo per soluzioni diluite (v. figura).
Alcali. Nessun pb. con ammoniaca. Gli austenitici resistono bene in ambiente caustico fino a T moderate.
PRINCIPALI IMPIEGHI
MARTENSITICI. Applicazioni dove la resistenza a c. non è necessariamente molto alta, ma sono invece richieste caratteristiche meccaniche alte. Il più comune 410 è molto impiegato, un pò meglio per la c. è il 431 (17Cr2Ni0,15C) oppure gli acciai PH (0,04C-13Cr-5Ni-1,5Mo-1,6Cu-0,3Nb). Per le rotanti, dov'è richiesta un'alta resistenza ad abrasione, il 410 è rimpiazzato dal 12Cr% steel 2. L'impiego più diffuso per le lame è il 420 con più alti tenori di carbonio.
FERRITICI. Migliore resistenza alla corrosione dei precedenti. Maggiori applicazioni nella posaterian rifiniture auto, lavatrici. Molte applicazioni nell'industria chimica, anche se spesso rimpiazzati dagli austenitici non per pb. di c. ma per minori pbroblematiche costruttive. Allo scopo si stanno sviluppando ferritici saldabili a bassi interstiziali ed i super-ferritici.
AUSTENITICI. Impieghi architetturali, ingegneria marina, industria alimentare, di bevande ed alimenti, attrezzi chirurgici, industria tessile.
Fonte: http://www1.diccism.unipi.it/De_Sanctis_Massimo/Corrosione/Appunti%20di%20corrosione.doc
Sito web da visitare: http://www1.diccism.unipi.it/De_Sanctis_Massimo
Autore del testo: Massimo De Sanctis
Corrosione dei metalli
Visita la nostra pagina principale
Corrosione dei metalli
Termini d' uso e privacy