Termotecnica
Termotecnica
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
1. CONCETTI DI BASE DELLA TERMODINAMICA
La chimica e la tecnologia farmaceutiche sono particolarmente interessate allo studio dei processi fisici e chimici che possono avvenire quando un farmaco interagisce con l'organismo vivente. La termodinamica fornisce una teoria generale di questi processi. Come tutte le discipline la termodinamica usa un vocabolario di termini specializzati che descrivono concetti fondamentali come energia, calore, lavoro, equilibrio e così via. In questo primo capitolo si passano in rassegna questi concetti che saranno utilizzati nella successiva esposizione.
La termodinamica (dal greco termon = calore, dinamis = forza) è nata come scienza che studia le trasformazioni della materia e dell’energia nei processi chimico-fisici.
Si usa in molti testi distinguere la termodinamica classica da quella statistica. La termodinamica classica studia le trasformazioni da un punto di vista macroscopico, senza considerare la struttura atomica e molecolare della materia. Insieme con la teoria cinetica dei gas la termodinamica statistica studia le trasformazioni da un punto di vista microscopico, calcolando valori medi statistici delle proprietà molecolari.
La termodinamica non si occupa della velocità delle trasformazioni, che è invece oggetto di studio della cinetica chimica. In pratica la termodinamica chimica studia se una reazione chimica è possibile, e la cinetica chimica studia in quanto tempo avviene la reazione.
Energia
L’energia (dal greco energheia = laboriosità) è la capacità di fare un lavoro. Il lavoro fatto da una forza su una particella ne aumenta l’energia cinetica ½ mv2 . Il lavoro fatto dalla forza è altresì uguale alla diminuzione dell’energia del campo di forza corrispondente. L’energia del campo è per esempio:
l’energia potenziale di gravità
l’energia potenziale di una molla
l’energia del campo elettrico
l’energia elettromagnetica
Il principio di conservazione stabilisce che la somma dell’energia cinetica e dell’energia del campo è invariante.
Da queste definizioni risulta che il lavoro è praticamente un modo di trasferire energia. Per esempio comprimendo una molla facciamo su di essa un lavoro che ne aumenta l’energia potenziale.
Calore
L’esperienza indica che si può trasferire energia in modo alternativo al lavoro. Il caso classico è il motore a vapore: riscaldando il vapore d'acqua gli si dà energia (il gas infatti poi si espande compiendo lavoro). A questa forma alternativa di trasferimento di energia è stato dato il nome di calore.
Analogia: il conto in banca è una misura della nostra “energia” finanziaria; questa si può trasferire in vari modi, con un assegno oppure alternativamente con la carta di credito.
Dato che lavoro e calore sono modi di trasferimento dell’energia le unità di misura delle tre grandezze sono le stesse.
Unità di misura dell’energia
L'unità di misura dell'energia nel sistema internazionale è il Joule, ma nella letteratura scientifica vengono usate anche altre unità, come risulta in questo schema riassuntivo:
Nome Simbolo Conversioni
Joule J 1 J = 1 Newton ×1 m
Erg erg 1 J = 107 erg
Caloria cal 1 cal = 4,184 J
kcaloria kcal 1 kcal = 103 cal
Litro atmosfera L atm 1 L atm = 101.325 J
Elettron-volt eV 1 eV = 1.60219 ´ 10 -19 J = 96.485 kJ mol -1
Numero d’onda cm-1 1 cm-1 = 1.9864 ´ 10 -23 J = 11.96 J mol -1
Il sistema termodinamico
Il sistema termodinamico è la parte della realtà a cui facciamo riferimento, distinta dai suoi dintorni, ossia dall’ambiente che lo circonda.
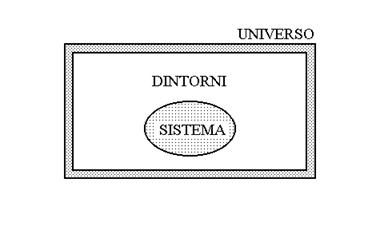
Il sistema consiste di una certa quantità di materia (misurata in numero n di moli) più una certa quantità di energia U, oppure di sola energia. Esempi di sistemi sono:
una bombola contenente un gas
una stufa di laboratorio sotto vuoto contenente solo raggi infrarossi, cioè solo energia
un reattore chimico
un motore d’automobile
un frigorifero
una cellula biologica
Classificazione dei sistemi in base agli scambi con i dintorni
Sistema isolato: non scambia con i dintorni né materia né energia. Dn = 0, DU = 0
Esempio: acqua in un thermos con tappo.
Sistema chiuso: scambia energia Dn = 0, DU ¹0
Esempio: un radiatore d’automobile a circuito chiuso.
Sistema aperto: scambia materia ed energia Dn ¹0, DU ¹0
Esempio: un impianto chimico, un organismo vivente.
Convenzione sul segno algebrico delle quantità scambiate D
Quantità positive sono quelle assorbite dal sistema ( e provenienti dai dintorni ).
Quantità negative sono quelle emesse dal sistema ( e assorbite dai dintorni ).
Analogia: nel bilancio di una azienda economica le entrate sono positive e le uscite sono negative
Classificazione fisica dei sistemi
Sistemi fisicamente omogenei: non hanno discontinuità nelle loro proprietà.
Esempi:
una bombola di aria;
una soluzione omogenea di zucchero in acqua;
una sbarra di ferro.
Sistemi fisicamente eterogenei: sono costituiti da più porzioni fisicamente e chimicamente omogenee, ma diverse e separate fra loro, dette fasi.
Esempi:
due liquidi immiscibili come acqua e cloroformio
zolfo rombico + zolfo monoclino
ghiaccio + acqua + vapore.
Composizione chimica dei sistemi
Ad un solo componente chimico
Esempio: acqua + ghiaccio
A più componenti
Esempio: un carburante auto formato da una miscela di vari idrocarburi
Stato termodinamico del sistema
Per descrivere lo stato dinamico di un sistema di N molecole sarebbe necessario definirne posizione e velocità. Questo significherebbe conoscere il valore di 6N variabili a livello microscopico, compito palesemente impossibile , considerato che per una mole di sostanza il numero N è dell’ordine di 10 23 . Una comoda alternativa a questa procedura è quella di descrivere il cosiddetto stato termodinamico del sistema, ossia la sua condizione macroscopica corrispondente ad un gran numero di microstati dinamici distinti ed equivalenti fra di loro. Lo stato dunque in termodinamica classica viene rappresentato tramite i valori di poche variabili chimico-fisiche facilmente misurabili, dette variabili di stato o coordinate termodinamiche. (Sarà invece còmpito della termodinamica statistica fissare i criteri per assegnare il numerodi microstati dinamici corrispondenti ad un dato macrostato). Si possono distinguere due tipi di variabili.
Variabili fisiche: temperatura T, pressione P, volume V
Variabili chimiche: quantità dei c componenti chimici (espresse in moli)
Temperatura
L’esperienza quotidiana ci suggerisce per questa variabile una definizione elementare: è la variabile che ci dà una misura quantitativa del senso fisiologico di caldo. Ma procedendo nello studio della termodinamica classica e statistica si approfondirà il significato di questa grandezza.
E` noto che la temperatura si esprime nella pratica corrente nella scala Celsius, cioè in gradi centigradi (°C). In questa scala sono stati fissati come punti di riferimento la temperatura del ghiaccio fondente (0°C) e quella dell’acqua bollente (100°C ). Invece in termodinamica la temperatura si esprime nella scala assoluta, cioè in gradi Kelvin (K). La scala Celsius e quella Kelvin differiscono solo per l’origine: lo zero della scala Kelvin corrisponde a - 273.15 °C e la temperatura del ghiaccio fondente è di 273.15 K.
Per dare un’idea degli ordini di grandezza si riportano qui di seguito alcune temperature caratteristiche:
T (in K)
Temperatura del nucleo del sole 107
Punto di ebollizione dell’uranio 4018
Punto di sublimazione del carbone 3700
Punto di fusione del tungsteno 3387
Punto di ebollizione del ferro 3023
Punto di fusione del ferro 1808
Punto triplo dell’acqua 273.16
Punto di sublimazione della CO2 194.7
Punto di ebollizione dell’ossigeno 90.2
Punto di ebollizione dell’azoto 77.4
Punto di ebollizione dell’elio 4.22
Pressione
La meccanica definisce la pressione come la forza rapportata alla superficie su cui agisce: P = F/S.
L'unità di misura della pressione nel sistema internazionale è il Pascal, ma altre unità vengono usate:
Nome Simbolo Conversioni
Pascal (SI) Pa 1 Pa = 1 Newton 1m -2
Bar bar 1 bar = 105 Pa
Atmosfera atm 1 atm = 1.01325 bar = 101325 Pa
Torr torr 1 torr = 133.3 Pa
Composizione chimica
La composizione chimica del sistema si può descrivere quantitativamente mediante le frazioni molari. La frazione molare dell’i-esimo componente è data da
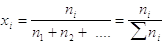
Si noti che 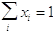 .
.
Il numero di componenti di un sistema è dato dal minimo numero di specie chimiche necessario per definire la composizione di tutte le fasi del sistema. In pratica il numero di componenti c si calcola come differenza tra il numero di specie S ed il numero di relazioni fra le specie, c = S - R.
Equazione di stato
L’esperienza indica che le variabili di stato non sono indipendenti tra loro.
Per esempio un gas puro è caratterizzato dalla pressione P, dalla temperatura T e dal volume V. Ma sperimentalmente si osserva che le tre variabili sono legate tra loro da una equazione di stato, caratteristica del gas
f (P,V,T) = 0
Così lo stato è definito sufficientemente da due variabili, dato che la terza dipende dalle altre due. Sono possibili tre scelte per la coppia di variabili indipendenti:
P = f (V,T) V = f (T,P) T = f (P,V)
In generale il numero di variabili indipendenti è uguale al numero di variabili totali meno il numero di relazioni che le legano, vi = vtot - nrelaz.
Rappresentazione grafica dello stato
Una comoda rappresentazione dello stato consiste nel riportare due variabili sugli assi di un diagramma cartesiano. Per esempio il cosiddetto piano di Clapeyron è un piano P - V .
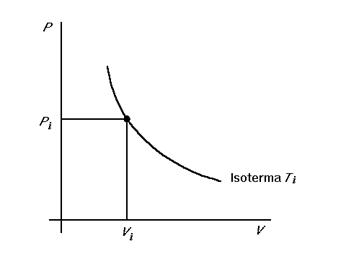
L’equazione di stato del gas ideale per una mole di gas è P = nRT/V. Si può rappresentare graficamente nel piano P - V, tenendo T = costante. L’insieme dei punti a temperatura costante forma la curva detta isoterma. Ogni punto i-esimo del piano rappresenta uno stato del sistema, corrispondente ad una terna di coordinate ( Pi , Vi , Ti ).
Stato di equilibrio
Fra gli stati possibili di un sistema si definiscono stati di equilibrio quelli che sono invarianti se non cambiano le condizioni esterne.
Esempio. Un gas in un volume V = costante è in equilibrio se la sua pressione P è costante ed omogenea e se la temperatura T è omogenea ed uguale a quella del recipiente.
L’equilibrio può essere di vari tipi:
- equilibrio meccanico: la risultante delle forze interne ed esterne al sistema è nulla.
- equilibrio termico: il sistema è tutto alla stessa temperatura, che è anche quella dei dintorni.
- equilibrio di fase: non avvengono spostamenti di materia da una fase all’altra del sistema.
- equilibrio chimico: nel sistema non avvengono reazioni chimiche.
Quando tutte queste condizioni sono soddisfatte il sistema è in uno stato di equilibrio termodinamico.
Principio numero zero della termodinamica
Due sistemi A e B in equilibrio termico con un terzo sistema C sono in equilibrio fra loro. In formule
se TA = TC e TB = TC allora TA = TB
Questo principio introduce la temperatura come funzione termodinamica dello stato del sistema. Sulla base del principio zero funziona il termometro. Infatti se A è un sistema di riferimento (per esempio acqua e ghiaccio) e C è un capillare di vetro contenente mercurio, cioè il termometro, la misura indica che il sistema B è alla temperatura del riferimento. Il sistema di misura C è si può tarare con altri riferimenti (per esempio acqua bollente) e dalla lunghezza del capillare di mercurio si valuta la temperatura per interpolazione.
Trasformazioni
In termodinamica si definisce trasformazione il passaggio di un sistema da uno stato iniziale ad un altro stato finale attraverso una successione continua di stati intermedi.
Una trasformazione è infinitesima se avviene con variazioni infinitesime delle variabili del sistema.
Classificazione delle trasformazioni secondo Planck
Tutte le trasformazioni infinitesime che si possono immaginare per un sistema termodinamico appartengono a tre classi.
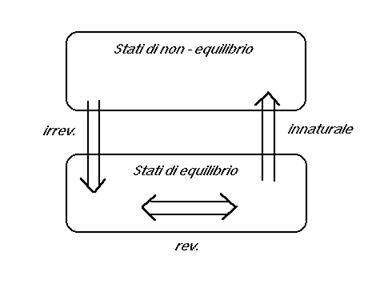
La stragrande maggioranza delle trasformazioni sono
- trasformazioni naturali: avvengono spontaneamente in natura e vanno a senso unico verso uno stato di mutuo equilibrio fra il sistema e i suoi dintorni. Una volta raggiunto, lo stato di equilibrio persiste fintanto che i dintorni non cambiano. In base a questo una designazione alternativa molto usata e suggestiva è quella di trasformazioni irreversibili.
Il contrario delle trasformazioni naturali sono le
- trasformazioni innaturali: non avvengono spontaneamente in natura e si allontanano dall’equilibrio.
Al limite fra le trasformazioni naturali e innaturali si hanno le
- trasformazioni reversibili: possono avvenire sia in una direzione che in quella contraria, attraverso una successione di stati di equilibrio.
Neanche questo tipo di trasformazione esiste in natura, ma si può approssimare sperimentalmente con la modifica infinitesimale di una variabile.
Nel vocabolario termodinamico i termini trasformazione naturale, irreversibile, spontanea, sono in generale usati come sinonimi.
Lo studio delle trasformazioni spontanee è oggetto della termodinamica di non equilibrio. La termodinamica classica si occupa principalmente dei processi reversibili. Il ricorso a questi tipi di processi, ipotetici e formali, è utile nel calcolare le variazioni delle funzioni dello stato termodinamico.
Nelle trasformazioni irreversibili, che avvengono spontaneamente in natura, può accadere che una delle variabili termodinamiche di stato non sia più definibile. Per esempio nell’espansione brusca del gas non ha senso di parlare di pressione, perché questa può essere disomogenea da un punto all’altro del gas e non in equilibrio con la pressione dei dintorni. Questo fatto invece non avviene nelle trasformazioni reversibili, che quindi possono essere comodamente descritte mediante la definizione delle coordinate termodinamiche di equilibrio e l’equazione di stato che le lega.
Esempi di trasformazioni irreversibili
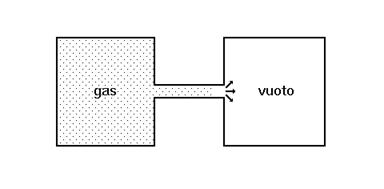
- un gas compresso si espande spontaneamente in uno spazio vuoto
- un sistema freddo si scalda se viene in contatto termico con un ambiente a temperatura più alta, per esempio un surgelato tirato fuori dal frigorifero
- un profumo diffonde nell’aria
- un farmaco si scioglie nel solvente
- la neve fonde al sole
- un bicchiere di cognac evapora (se nessuno lo beve ...)
- un pezzo di ghiaccio secco diventa CO2 gas
- il metano brucia, CH4 + 2 O2 ® CO2 + 2 H2O
- aggiungendo acido solforico ad una soluzione di bario cloruro precipita il solfato di bario,
Ba+ + + SO4- - ® BaSO4 ¯
Condizioni sperimentali per la reversibilità
In una trasformazione reversibile il sistema passa attraverso una successione di stati di equilibrio. Sperimentalmente questa trasformazione si approssima con due condizioni:
- 1. eliminando l’attrito; in tal modo il sistema evita di dissipare irreversibilmente energia meccanica in calore
- 2. facendo procedere la trasformazione molto lentamente, in condizioni quasi-statiche; così il sistema ha tempo di equilibrarsi sia internamente che rispetto ai dintorni.
Esempi di trasformazioni reversibili
-Trasferimento di calore reversibile fra sistema e dintorni in equilibrio termico. Se la temperatura del sistema è più alta di quella dei dintorni di un infinitesimo dT il sistema cede energia sotto forma di calore q ai dintorni. Ma se la temperatura del sistema è leggermente inferiore il sistema riceve il calore q dai dintorni.
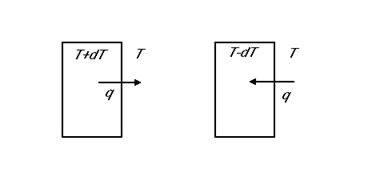
Dunque questo flusso di calore è reversibile, in quanto con variazioni piccolissime di temperatura può avvenire in direzioni contrarie. Si noti tuttavia che se fra sistema ed dintorni si avesse una differenza finita di temperatura allora una variazione infinitesima dT non consentirebbe di invertire il trasferimento di calore. La trasformazione sarebbe dunque irreversibile.
- Espansione e compressione di un gas in equilibrio meccanico con l’ambiente. Se la pressione del gas è superiore a quella esterna di un infinitesimo dP il gas si espande, se è inferiore di un dP il gas si comprime.
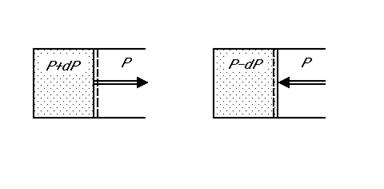
Quindi questa trasformazione con piccolissime variazioni di pressione si può realizzare nelle due direzioni opposte.
- Cambiamento di stato di aggregazione: ghiaccio in equilibrio di fase con l’acqua a T = 273.15 K.
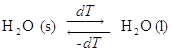
Se la temperatura si alza di un infinitesimo dT , H2O passa dalla fase solida a quella liquida, ma se invece la temperatura si abbassa di dT avviene il trasferimento di materia opposto.
- Cella galvanica reversibile di Daniell: Zn | ZnSO4 soluz. || CuSO4 soluz. | Cu. Applicando alla pila una differenza di potenziale (ddp) uguale alla sua forza elettromotrice (fem) non ha luogo nessuna reazione chimica, cioè il sistema è in equilibrio. Se la ddp applicata è infinitesimamente inferiore alla fem ha luogo la reazione
Zn + Cu++ ® Zn++ + Cu
viceversa se la ddp è infinitesimamente superiore alla fem ha luogo la reazione inversa.
Rappresentazione grafica delle trasformazioni
In un diagramma P-V le trasformazioni reversibili sono rappresentate dalle curve che collegano i due punti corrispondenti agli stati iniziale e finale. I punti che formano le curve corrispondono alle
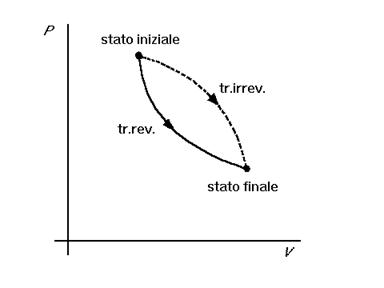
successioni di stati di equilibrio intermedi. Il fatto che le trasformazioni irreversibili non passano per stati di equilibrio viene da alcuni autori rappresentato graficamente con curve tratteggiate.
Trasformazioni tipiche
Delle infinite trasformazioni che può subire un sistema alcune sono denominate in base alle particolari condizioni in cui si realizzano.
Trasformazione isocora ( variazione di volume DV = 0 ). Si realizza in un contenitore chiuso a pareti rigide che assicura l’invarianza del volume. Per esempio autoclave, reattore in impianti chimici.
Trasformazione isobara (variazione di pressione DP = 0 ). Si realizza in un contenitore aperto a contatto con l’atmosfera, la quale agisce da pressostato. Le reazioni chimiche in laboratorio e le reazioni biochimiche negli esseri viventi sono i due esempi classici.
Trasformazione isoterma (variazione di temperatura DT = 0 ). Si realizza mettendo il sistema in contatto termico con un bagno termostatico. Un comune termostato a 273 K è il bagno di acqua e ghiaccio fondente.
Trasformazione adiabatica ( calore scambiato q = 0 ). Si realizza in un recipiente termicamente isolato dall’esterno, in modo che il sistema non può scambiare con i dintorni energia sotto forma di calore (ma può scambiare energia sotto forma di lavoro). Il thermos, o vaso di Dewar, è un esempio di contenitore adiabatico.
Fonte: http://www.uniurb.it/MedChem/Gatti/termodin/Termod1.doc
Autore del testo: non indicato nel documento di origine
Termotecnica
Visita la nostra pagina principale
Termotecnica
Termini d' uso e privacy