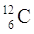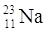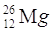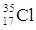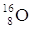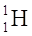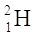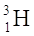Peso atomico - numero atomico
Peso atomico - numero atomico
ATOMO
MODELLI ATOMICI:
Il termine atomo (dal greco: indivisibile) fu ripreso dal filosofo greco Democrito che per primo, nel IV sec. a.C., aveva ipotizzato che la materia fosse costituita da particelle indivisibili. Quella di Democrito era una teoria filosofica, non si basava cioè su dati oggettivi e non incontrò daltronde un grande favore. Nei secoli che seguirono, infatti, le interpretazioni più seguite furono altre e fu necessario aspettare 2000 anni perchè queste idee riprendessero piede.
La materia è composta da atomi.
L’atomo è la più piccola particella che è formata la materie ed è indivisibile ed indistruttibile. Un insieme di atomi che hanno la stessa dimensione e la stessa massa (per cui hanno le stesse proprietà chimico fisiche) sono chiamati elementi.
Ogni elemento è rappresentabile da un simbolo.
IL MODELLO ATOMICO DI DALTON:
John Dalton (1766 – 1844), insegnante di matematica e filosofia naturale a Manchester, prese spunto dalle ricerche di Lavoisier e Proust per elaborare la prima teoria atomica nel 1803, che si basa sulle seguenti assunzioni
 La materia è fatta di atomi piccolissimi, che sono indivisibili e indistruttibili.
La materia è fatta di atomi piccolissimi, che sono indivisibili e indistruttibili.- Tutti gli atomi di uno stesso elemento sono identici e hanno la stessa massa.
- Gli atomi di un elemento non possono essere convertiti in atomi di altri elementi.
- Gli atomi non possono essere né creati né distrutti, ma si trasferiscono interi da un composto all’altro
Anche la teoria di Dalton tuttavia dovette ben presto essere modificata. Le nuove scoperte fatte tra la fine del 1800 e l'inizio del 1900 dimostrarono infatti che l'atomo è divisibile e costituito da particelle più piccole dette subatomiche. Rimane valida la seguente definizione di atomo:
LA NATURA ELETTRICA DELLA MATERIA
Fin dall'antichità erano note le proprietà di alcuni materiali quali l'ambra (nome greco "electron") di attirare, in seguito a strofinio, corpi di piccole dimensioni come pezzetti di carta o peli.W. Gilbert, nel XVI secolo, catalogò un vasto insieme di materiali che avevano proprietà simili e li definì elettrizzati. Non tutti i materiali elettrizzati sono però in grado di attirare gli stessi piccoli oggetti e ciò è dovuto al fatto che esistono due tipi diversi di elettricità: quella definita positiva e quella definita negativa. Convenzionalmente i materiali dal comportamento analogo al vetro si dice che acquistano carica elettrica negativa (-), mentre quelli che si comportano come l'ambra si dice che acquistano carica elettrica positiva (+).
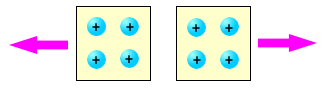
Tra due elementi elettrizzati dello stesso tipo, si manifesta sempre una forza repulsiva. Nella figura è mostrata la repulsione tra due corpi carichi positivamente; tra due corpi carichi negativamente si osserva il medesimo effetto.
Tra due elementi di diverso tipo, ad esempio vetro e ambra, si manifesta sempre una forza attrattiva
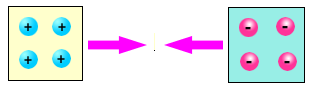
Queste esperienze rivelano una delle proprietà fondamentali della materia cioè la sua carica elettrica. Prima dello strofinio nella materia esiste un ugual numero di particelle positive e negative, la materia ci appare dunque neutra. Strofinando l'ambra alcune particelle di carica elettrica negativa le vengono tolte e rimangono sul panno di lana; per questo l'ambra si carica positivamente. Nel caso del vetro, invece, è la lana a rilasciare alcune particelle negative al materiale caricandolo quindi negativamente.
LE PARTICELLE SUBATOMICHE
Vari esperimenti condotti all'inizio del 1900 dimostrarono che gli atomi non sono indivisibili ma costituiti da particelle più piccole (elementari).
Se a due elettrodi posti alle estremità di un tubo di Crokes in cui è fatto il vuoto viene applicato un alto voltaggio (pila), dall'elettrodo negativo (catodo) si dipartono dei raggi detti raggi catodici.
Thomson dimostrò che tali raggi sono costituiti da un flusso di particelle cariche negativamente che chiamò elettroni.
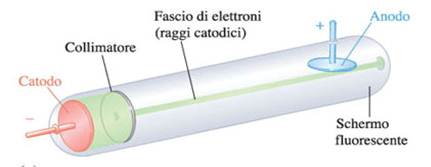
- I raggi catodici mettono in moto la ruota a pale (hanno natura corpuscolare).
- I raggi catodici vengono attratti dal piatto metallico carico positivamente (hanno carica negativa).
MODELLO ATOMICO DI THOMSON:
Nel 1897 Thomson identificò gli elettroni, particelle subatomiche con carica elettrica negativa e con massa trascurabile. Quindi la teoria atomica di Dalton fu messa in discussione. Thomson poi propose il primo modello di atomo in cui si facesse riferimento a particelle subatomiche, cioè a particelle più piccole dell’atomo: egli ipotizzò che l’atomo fosse una sferetta carica positivamente all’interno della quale erano disposti gli elettroni in modo tale da neutralizzare la carica positiva.
Il modello di Thomson rappresentò un importante passo avanti, ma non era del tutto convincente: infatti se c’erano delle particelle subatomiche negative dovevano esserci anche delle subparticelle positive. Difatti il modello atomico di Thomson si rappresenta :
 MODELLO ATOMICO DI RUTHERFORD
MODELLO ATOMICO DI RUTHERFORD
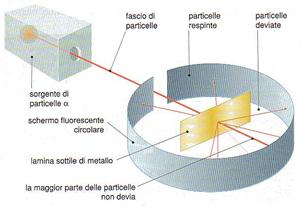
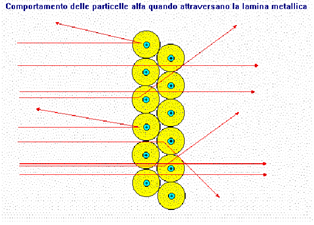
Rutherford propose un modello secondo cui protoni e neutroni erano disposti nel nucleo, mentre gli elettroni erano liberi di muoversi attorno al nucleo stesso. Questo scienziato bombardando una sottile lamina d’oro, con delle particella alfa (particelle positive), avevano osservato che la maggior parte delle particelle riuscivano a passare indisturbate e soltanto una su ottomila rimbalzava in direzione opposta.
Grazie a questo esperimento dedussero che l’atomo è per la maggior parte costituito da spazio vuoto. Il modello atomico di Rutherford considera l’atomo formato da un nucleo centrale, ne l quale risiede la quasi totalità della massa (poiché gli elettroni hanno una massa trascurabile) e dagli elettroni che ruotano intorno al nucleo descrivendo delle orbite, per la sua somiglianza con il sistema solare viene detto modello atomico planetario
Questo modello atomico non era, tuttavia, in grado di dare una valida spiegazione agli esperimenti che avevano messo in evidenza la capacità degli elettroni di assorbire e di emettere energia.
LE PARTICELLE SUBATOMICHE
|
CARICA |
MASSA |
DOVE SI TROVA NELL’ATOMO |
PROTONI |
+ 1C |
1 uma |
NEL NUCLEO |
ELETTRONI |
- 1C |
TRASCURABILE |
RUOTANO SU SETTE ORBITE |
NEUTRONI |
NON HANNO CARICA |
1 uma |
NEL NUCLEO |
LA SOMMA DELLE MASSE DI PROTONI E NEUTRONI DÀ LA MASSA ATOMICA.
Un atomo individuato da queste due grandezze (A e Z) si chiama nuclide:
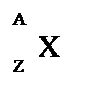
NUMERO ATOMICO (Z) indica il numero di protoni contenuti in un atomo. In un atomo neutro il numero atomico indica anche il numero di elettroni.
INUMERO DI MASSA (A) esprime il numero totale di protoni e neutroni contenuti in un atomo. Il numero di protoni può essere dato dalla differenza A–Z.
Il numero di neutroni è estremamente variabile da un atomo di un elemento all’altro; aumenta con l’aumentare del numero di protoni senza una regola fissa o di stretta proporzionalità.
Le proprietà chimichedell’ atomo sono legate al numero di elettroni, e precisamente a quelli più esterni (ELETTRONI DI VALENZA).
LE PROPRIETÀ CHIMICHE DELL’ATOMO SONO QUINDI LEGATE AL NUMERO ATOMICO.
|
|
|
|
|
|
PROTONI |
6 |
11 |
12 |
17 |
8 |
ELETTRONI |
6 |
11 |
12 |
17 |
8 |
NEUTRONI |
6 |
12 |
14 |
18 |
8 |
QUANTO PESA L’ATOMO? |
12 uma |
23 uma |
26 uma |
35 uma |
16 uma |
ISOTOPI sono atomi che presentano lo stesso numero atomico ma un diverso numero di massa cioè hanno tra di loro un diverso numero di neutroni. Gli elementi presenti in natura sono, di solito, un misto di vari isotopi.
(rispettivamente i nuclidi  H trizio).
H trizio).
|
|
|
|
PROTONI |
1 |
1 |
1 |
ELETTRONI |
1 |
1 |
1 |
NEUTRONI |
0 |
1 |
2 |
QUANTO PESA L’ATOMO? |
1 |
2 |
3 |
Z = numero di elettroni (e quindi di protoni) NUMERO ATOMICO
A = protoni + neutroni NUMERO DI MASSA
A - Z = numero di neutroni
M = peso atomico o MASSA ATOMICA (in uma)
La massa atomica non coincide col numero atomico per varie ragioni:
- le masse di protoni e neutroni non sono proprio uguali a 1
- in uno stesso elemento spesso ci sono isotopi diversi (diverso numero di neutroni, vedi sotto), che contribuiscono ognuno per una certa percentuale al peso atomico medio finale
- se si potesse pesare, un nucleo peserebbe meno della somma dei pesi dei protoni e neutroni che contiene: all’atto della sua formazione, si libera una grande quantità di energia (energia di legame nucleare), che comporta una perdita di massa (difetto di massa). L’energia che si libera all’atto della formazione dei legami tra nucleoni è la stessa che occorre per scindere il nucleo nei suoi componenti.
L’atomo nel suo complesso risulta elettricamente neutro, perché anche se protoni ed elettroni sono portatori di carica elettrica, queste sono della stessa entità, ma di segno opposto; infatti in un atomo il numero dei protoni è sempre uguale al numero degli elettroni
IONE
atomi o gruppi di atomi con carica elettrica positiva o negativa.
Tipici ioni sono, lo ione sodio Na+, lo ione Cl-. Gli ioni positivi sono chiamati cationi, quelli negativi anioni Cl-.
CATIONI: sono i metalli che hanno perso o uno o più elettroni di valenza per avere l’ultimo livello completo
ANIONI: sono non metalli che acquistano uno o più elettroni per avere l’ultimo livello completo
STRUTTURA DELL’ATOMO.
Al centro dell’atomo c’è il nucleo (109 volte più piccolo del diametro dell’atomo!). Il nucleo è formato da due tipi di particelle (nucleoni): i protoni (carica positiva) ed i neutroni (nessuna carica). Queste particelle, che immaginiamo sferiche, hanno massa di circa 1 uma (unità di massa atomica, è la massa dell’atomo di idrogeno).
Attorno al nucleo ruotano, a grandissima distanza e velocità (circa 1/100 della velocità della luce), gli elettroni: piccole particelle aventi carica negativa e massa 1837 volte più piccola dei nucleoni. Nell’insieme, l’atomo è elettricamente neutro.
Il volume dell’atomo corrisponde di fatto allo spazio in cui ruotano gli elettroni: il suo diametro è dell’ordine degli Angstrom (1 Å = 10-10 m). Il diametro del nucleo è invece molto più piccolo del diametro dell’atomo: circa 10.000 volte inferiore. Ciò significa che l’atomo è per la maggior parte spazio vuoto! Tutta la massa dell’atomo è praticamente situata nel nucleo (essendo la massa degli elettroni trascurabile rispetto a quella dei nucleoni)
La massa degli atomi dei vari elementi è compresa tra 10-24 e 10-22 g: per evitare numeri così piccoli, la massa dell’atomo si misura in unità di massa atomica (uma): 1 uma è per convenzione la dodicesima parte della massa del carbonio 12 (l’isotopo più comune del carbonio).
1 uma = 1.66 x 10-24 g
Massa protone: 1.00757 uma (circa 1)
Massa neutrone: 1.00893 uma (circa 1)
Massa elettrone: 0.000548 uma(circa zero)
La somma delle masse di protoni e neutroni dà la massa atomica.
Esempi: idrogeno 1 uma; carbonio 12 uma; ossigeno 16 uma; sodio 23 uma; cloro 35 uma.
La somma delle masse atomiche dei vari atomi in una molecola dà la massa molecolare.
Esempi: H2O 18 uma; NaCl 58 uma.
Il grammo-atomo è il peso atomico espresso in g (12g per il carbonio); la grammo-molecola è il peso molecolare espresso in g (18g per l’acqua). In un grammo-atomo e in una grammo-molecola è contenuto lo stesso numero di atomi o di molecole: il numero di Avogadro o mole.
L’ATOMO DI BOHR
Il modello di Bohr si basa su alcune ipotesi fondamentali:
PRIMA IPOTESI: Nell'atomo gli elettroni ruotano intorno al nucleo su 7 orbite circolari. Ognuna di queste orbite ha un raggio ben determinato
SECONDA IPOTESI: Il momento angolare degli elettroni é quantizzato. Esso può assumere soltanto certi valori (valori permessi), ma non può assumere i valori intermedi fra quelli permessi.
Dopo aver introdotto queste ipotesi, Bohr studia la situazione dell'elettrone utilizzando le leggi della fisica classica. L'elettrone é soggetto alla forza di attrazione del nucleo. Questa forza provoca il suo moto di rotazione e quindi costituisce la forza centripeta. Gli elettroni nelle loro orbite possiedono una certa quantità di energia; essi infatti sono in moto, e quindi hanno energia cinetica; inoltre hanno energia potenziale dovuta all'attrazione elettrostatica tra elettrone e nucleo.
TERZA IPOTESI: Finché un elettrone rimane nella sua orbita, non emette e non assorbe energia.
Per passare da un'orbita con energia minore a un'orbita con energia maggiore (cioè da un'orbita più interna a una più esterna), l'elettrone deve ricevere dall'esterno una quantità di energia corrispondente alla differenza di energia fra le due orbite; se invece passa da un'orbita con energia maggiore a un'orbita con energia minore, l'elettrone emette una quantità di energia pari alla differenza di energia fra le due orbite. L'energia viene emessa o assorbita sotto forma di radiazione elettromagnetica. Esiste una relazione matematica fra i valori di energia delle orbite di partenza e di arrivo e la frequenza della radiazioni:
L’ipotesi più accreditata rimane quella di Bohr, secondo cui gli elettroni si muovono attorno al nucleo (in cui sono contenuti protoni e neutroni) descrivendo delle orbite stazionarie ben delimitate.
Bohr considera l’atomo formato da un nucleo centrale, nel quale risiede quasi tutta la massa, e dagli elettroni che ruotano intorno al nucleo descrivendo orbite ben precise (stazionarie). Gli elettroni possono acquistare o cedere energia per passare da un orbita all’altra, la quantità di energia acquistata o ceduta è pari alla differenza di energia esistente tra le due orbite.
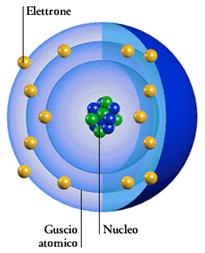
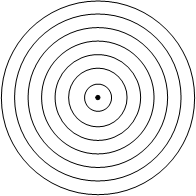 Nella figura accanto sono rappresentate le sette orbite stazionarie ipotizzate da Bohr. Secondo Bohr l’elettrone emette o assorbe energia soltanto se questa gli consente di passare daun orbita stazionaria all’altra. Attorno al nucleo possono esserci al massimo 7 gusci con elettroni orbitanti. Ogni guscio può contenere solo un numero limitato di elettroni
Nella figura accanto sono rappresentate le sette orbite stazionarie ipotizzate da Bohr. Secondo Bohr l’elettrone emette o assorbe energia soltanto se questa gli consente di passare daun orbita stazionaria all’altra. Attorno al nucleo possono esserci al massimo 7 gusci con elettroni orbitanti. Ogni guscio può contenere solo un numero limitato di elettroni
LA CONFIGURAZIONE ELETTRONICA:
Serve a conoscere gli elettroni esterni (di valenza) e quindi a sapere quali e quanti elettroni prenderanno parte alla formazione dei legami.
Di seguito elenchiamo alcune regole che servono a stabilire la configurazione elettronica degli elementi:
- Teoricamente il numero di livelli è infinito, ma per gli elementi noti è stato individuato un numero massimo di 7 strati (o livelli o gusci) di elettroni intorno al nucleo
- Gli strati o livelli possono contenere numeri differenti di elettroni. Questo numero aumenta andando dallo strato più vicino al nucleo alla periferia.
- Il numero di elettroni che ogni livello può contenere e dato dalla formula 2n2, n è il numero di livello
- Gli elettroni degli strati più vicini al nucleo possiedono energie minori degli elettroni appartenenti agli strati più lontani dal nucleo.
- Gli elettroni si dispongono sempre negli strati di minor energia e riempiono questi prima di occupare posizioni più lontane dal nucleo a maggiore energia; solamente l'ultimo strato può quindi essere incompleto.
Nella tabella che segue vengono indicati i numeri massimi di elettroni che possono occupare i primi quattro livelli. Ricordiamo che questo numero può essere calcolato dalla formula: 2n2 in cui n rappresenta il numero che contraddistingue il livello. Es: il livello numero 3 può contenere 2 x 9 =18 elettroni.
livello |
n° di elettroni |
1° |
2 |
2° |
8 |
3° |
18 |
4° |
32 |
SOTTOLIVELLI
Da un'analisi più approfondita dei dati sperimentali in ogni livello sono stati inoltre individuati dei sottolivelli che vengono indicati con le lettere s, p, d e f. Significa che all'interno di un singolo livello non tutti gli elettroni possiedono la stessa energia anche se le differenze fra di essi sono sicuramente minori che tra elettroni che occupano livelli differenti. Riassumiamo alcune informazioni riguardanti il riempimento elettronico dei sottolivelli:
- Nel 1° livello esiste solamente il sottolivello s.
- Nel 2° livello esistono i sottolivelli s e p.
- Nel 3° livello esistono i sottolivelli s, p e d.
- Nel 4° livello e in tutti quelli successivi esistono i sottolivelli s, p, d e f.
- Il sottolivello s può contenere 2 elettroni, il sottolivello p ne può contenere 6, il sottolivello d ne può contenere 10 e quello f 14.
- All'interno di ogni livello l'energia dei sottolivelli cresce nell'ordine s, p, d, f e questo quindi è anche l'ordine con cui vengono riempiti
L’ ORBITALE
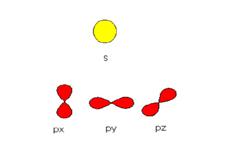
l’orbitale è la regione di spazio dove si ha il 90% della probabilità di trovare l’elettrone.
Gli orbitali possono essere rappresentati graficamente con superfici che rappresentano la nube di densità elettronica; essi comprendono il 90 % di probabilità che l’elettrone si trovi al loro interno.
n = 1 orbitale s
n = 2 orbitali s e p
n = 3 orbitali s, p e d
n = 4 orbitali s, p, d e f
.
spin (s): indica il senso di rotazione dell’elettrone. Assume solo valori che siano – ½ o + ½.
Il sottolivello s possiede un solo orbitale e può contenere due elettroni.
Il sottolivello p, possiede tre orbitali e può contenere sei elettroni.
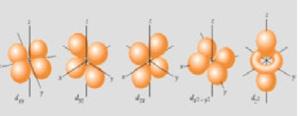
Il sottolivello d possiede cinque orbitali e può contenere dieci elettroni.
Il sottolivello f possiede sette orbitali e può contenere quattordici elettroni.
PRINCIPIO DI PAOLI: Ogni orbitale può contenere al massimo due elettroni che si disporranno con spin opposto. Quindi il primo livello energetico può contenere al massimo due elettroni, il secondo otto, il terzo sedici, il quarto trentadue. Gli elettroni occuperanno per primi gli orbitali di più bassa energia. L’energia cresce con il livello energetico e con la complessità della forma degli orbitali. In uno stesso livello energetico l’energia cresce nel seguente ordine: s < p < d < f, gli orbitali appartenenti allo stesso sottolivello energetico hanno la stessa energia ( orbitali degeneri ). Quando gli elettroni vanno ad occupare orbitali con uguale energia li riempiono prima parzialmente, disponendosi con lo stesso spin, e poi li completano
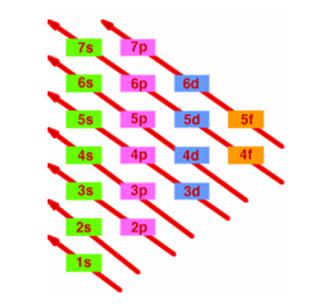
L’ordine di riempimento degli orbitali, che si può ricavare ricorrendo alla regola della diagonale, è il seguente:
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6, 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6,7s2, 5f14, 6d10, 7p6.
Il riempimento dei sottolivelli non avviene però sempre con la regolarità che abbiamo indicato sopra perchè nei livelli più lontani dal nucleo le differenze di energia fra i diversi sottolivelli tendono a diminuire sempre più e anzi in alcuni casi avvengono delle "sovrapposizioni" tra sottolivelli. Per poter stabilire le configurazioni elettroniche di tutti gli elementi chimici è però sufficiente seguire lo schema riportato sotto, chiamato anche
REGOLA DELLA DIAGONALE:
A volte può essere utile scrivere la struttura elettronica rappresentando gli orbitali con dei quadratini e gli elettroni con delle frecce orientate in modo da tenere conto dello spin.
IL PRINCIPIO DI INDETERMINAZIONE DI HEISENBERG:
Date le caratteristiche dell’elettrone, Heisemberg formulò il suo principio di indeterminazione, secondo cui è impossibile determinare con eguale precisione la velocità e la posizione dell’elettrone.Il principio di esclusione di Pauli (1925) afferma che gli elettroni di uno stesso atomo non possono a vere tutti e 4 i numeri quantici uguali (almeno uno deve essere diverso).
REGOLA DI HUND:
La regola di Hund, o principio della massima molteplicità afferma che gli elettroni si dispongono ad occupare il massimo numero di orbitali in un sottolivello.
PRINCIPIO DI AUFBAU:
Per il principio di Aufbau, gli elettroni tendono ad occupare gli orbitali seguendo l’ordine di energia crescente.
Lo stato fondamentale di un atomo è quello in cui questo è neutro e non eccitato
Fonte: http://www.liceocottini.it/documenti/FAD/chimica/modelli%20atomici.doc
Peso atomico - numero atomico
Da Wikipedia, l'enciclopedia libera.
Tabella degli elementi chimici ordinati per numero atomico colorati in funzione del tipo. È riportato anche il nome, il simbolo, il gruppo, la massa atomica e lo scopritore.
No. |
Nome |
Simbolo |
Periodo, |
Massa |
Densità |
temperatura |
temperatura |
Anno della |
Scopritore |
1 |
Idrogeno |
H |
1, 1 |
1.00794(7)[1] [2] [3] |
0.084 g/l |
-259.1 |
-252.9 |
1766 |
Cavendish |
2 |
Elio |
He |
1, 18 |
4.002602(2)[1] [3] |
0.17 g/l |
-272.2 (a 2.5 MPa) |
-268.9 |
1895 |
Ramsay e Cleve |
3 |
Litio |
Li |
2, 1 |
6.941(2)[1] [2] [3] [4] |
0.53 |
180.5 |
1317 |
1817 |
Arfwedson |
4 |
Berillio |
Be |
2, 2 |
9.012182(3) |
1.85 |
1278 |
2970 |
1797 |
Vauquelin |
5 |
Boro |
B |
2, 13 |
10.811(7)[1] [2] [3] |
2.46 |
2300 |
2550 |
1808 |
Davy e Gay-Lussac |
6 |
Carbonio |
C |
2, 14 |
12.0107(8)[1] [3] |
3.51 |
3550 |
4827 |
dall'antichità |
sconosciuto |
7 |
Azoto |
N |
2, 15 |
14.0067(2)[1] [3] |
1.17 g/l |
-209.9 |
-195.8 |
1772 |
Rutherford |
8 |
Ossigeno |
O |
2, 16 |
15.9994(3)[1] [3] |
1.33 g/l |
-218.4 |
-182.9 |
1774 |
Priestly e Scheele |
9 |
Fluoro |
F |
2, 17 |
18.9984032(5) |
1.58 g/l |
-219.6 |
-188.1 |
1886 |
Moissan |
10 |
Neon |
Ne |
2, 18 |
20.1797(6)[1] [2] |
0.84 g/l |
-248.7 |
-246.1 |
1898 |
Ramsay e Travers |
11 |
Sodio |
Na |
3, 1 |
22.98976928(2) |
0.97 |
97.8 |
892 |
1807 |
Davy |
12 |
Magnesio |
Mg |
3, 2 |
24.3050(6) |
1.74 |
648.8 |
1107 |
1755 |
Black |
13 |
Alluminio |
Al |
3, 13 |
26.9815386(8) |
2.70 |
660.5 |
2467 |
1825 |
Oersted |
14 |
Silicio |
Si |
3, 14 |
28.0855(3)[3] |
2.33 |
1410 |
2355 |
1824 |
Berzelius |
15 |
Fosforo |
P |
3, 15 |
30.973762(2) |
1.82 |
44 (P4) |
280 (P4) |
1669 |
Brand |
16 |
Zolfo |
S |
3, 16 |
32.065(5)[1] [3] |
2.06 |
113 |
444.7 |
dall'antichità |
sconosciuto |
17 |
Cloro |
Cl |
3, 17 |
35.453(2)[1] [2] [3] |
2.95 g/l |
-34.6 |
-101 |
1774 |
Scheele |
18 |
Argon |
Ar |
3, 18 |
39.948(1)[1] [3] |
1.66 g/l |
-189.4 |
-185.9 |
1894 |
Ramsay e Rayleigh |
19 |
Potassio |
K |
4, 1 |
39.0983(1) |
0.86 |
63.7 |
774 |
1807 |
Davy |
20 |
Calcio |
Ca |
4, 2 |
40.078(4)[1] |
1.54 |
839 |
1487 |
1808 |
Davy |
21 |
Scandio |
Sc |
4, 3 |
44.955912(6) |
2.99 |
1539 |
2832 |
1879 |
Nilson |
22 |
Titanio |
Ti |
4, 4 |
47.867(1) |
4.51 |
1660 |
3260 |
1791 |
Gregor e Klaproth |
23 |
Vanadio |
V |
4, 5 |
50.9415(1) |
6.09 |
1890 |
3380 |
1801 |
del Río |
24 |
Cromo |
Cr |
4, 6 |
51.9961(6) |
7.14 |
1857 |
2482 |
1797 |
Vauquelin |
25 |
Manganese |
Mn |
4, 7 |
54.938045(5) |
7.44 |
1244 |
2097 |
1774 |
Gahn |
26 |
Ferro |
Fe |
4, 8 |
55.845(2) |
7.87 |
1535 |
2750 |
dall'antichità |
sconosciuto |
27 |
Cobalto |
Co |
4, 9 |
58.933195(5) |
8.89 |
1495 |
2870 |
1735 |
Brandt |
28 |
Nichel |
Ni |
4, 10 |
58.6934(2) |
8.91 |
1453 |
2732 |
1751 |
Cronstedt |
29 |
Rame |
Cu |
4, 11 |
63.546(3)[3] |
8.92 |
1083.5 |
2595 |
dall'antichità |
sconosciuto |
30 |
Zinco |
Zn |
4, 12 |
65.409(4) |
7.14 |
419.6 |
907 |
dall'antichità |
sconosciuto |
31 |
Gallio |
Ga |
4, 13 |
69.723(1) |
5.91 |
29.8 |
2403 |
1875 |
Lecoq de Boisbaudran |
32 |
Germanio |
Ge |
4, 14 |
72.64(1) |
5.32 |
937.4 |
2830 |
1886 |
Winkler |
33 |
Arsenico |
As |
4, 15 |
74.92160(2) |
5.72 |
613 |
613 (subl.) |
ca. 1250 |
Albertus Magnus |
34 |
Selenio |
Se |
4, 16 |
78.96(3)[3] |
4.82 |
217 |
685 |
1817 |
Berzelius |
35 |
Bromo |
Br |
4, 17 |
79.904(1) |
3.14 |
-7.3 |
58.8 |
1826 |
Balard |
36 |
Kripton |
Kr |
4, 18 |
83.798(2)[1] [2] |
3.48 g/l |
-156.6 |
-152.3 |
1898 |
Ramsay e Travers |
37 |
Rubidio |
Rb |
5, 1 |
85.4678(3)[1] |
1.53 |
39 |
688 |
1861 |
Bunsen e Kirchhoff |
38 |
Stronzio |
Sr |
5, 2 |
87.62(1)[1] [3] |
2.63 |
769 |
1384 |
1790 |
Crawford |
39 |
Ittrio |
Y |
5, 3 |
88.90585(2) |
4.47 |
1523 |
3337 |
1794 |
Gadolin |
40 |
Zirconio |
Zr |
5, 4 |
91.224(2)[1] |
6.51 |
1852 |
4377 |
1789 |
Klaproth |
41 |
Niobio |
Nb |
5, 5 |
92.906 38(2) |
8.58 |
2468 |
4927 |
1801 |
Hatchett |
42 |
Molibdeno |
Mo |
5, 6 |
95.94(2)[1] |
10.28 |
2617 |
5560 |
1778 |
Scheele |
43 |
Tecnezio |
Tc |
5, 7 |
[98.9063][5] |
11.49 |
2172 |
5030 |
1937 |
Perrier e Segrè |
44 |
Rutenio |
Ru |
5, 8 |
101.07(2)[1] |
12.45 |
2310 |
3900 |
1844 |
Klaus |
45 |
Rodio |
Rh |
5, 9 |
102.90550(2) |
12.41 |
1966 |
3727 |
1803 |
Wollaston |
46 |
Palladio |
Pd |
5, 10 |
106.42(1)[1] |
12.02 |
1552 |
3140 |
1803 |
Wollaston |
47 |
Argento |
Ag |
5, 11 |
107.8682(2)[1] |
10.49 |
961.9 |
2212 |
dall'antichità |
sconosciuto |
48 |
Cadmio |
Cd |
5, 12 |
112.411(8)[1] |
8.64 |
321 |
765 |
1817 |
Strohmeyer e Hermann |
49 |
Indio |
In |
5, 13 |
114.818(3) |
7.31 |
156.2 |
2080 |
1863 |
Reich e Richter |
50 |
Stagno |
Sn |
5, 14 |
118.710(7)[1] |
7.29 |
232 |
2270 |
dall'antichità |
sconosciuto |
51 |
Antimonio |
Sb |
5, 15 |
121.760(1)[1] |
6.69 |
630.7 |
1750 |
dall'antichità |
sconosciuto |
52 |
Tellurio |
Te |
5, 16 |
127.60(3)[1] |
6.25 |
449.6 |
990 |
1782 |
von Reichenstein |
53 |
Iodio |
I |
5, 17 |
126.90447(3) |
4.94 |
113.5 |
184.4 |
1811 |
Courtois |
54 |
Xeno |
Xe |
5, 18 |
131.293(6)[1] [2] |
4.49 g/l |
-111.9 |
-107 |
1898 |
Ramsay e Travers |
55 |
Cesio |
Cs |
6, 1 |
132.9054519(2) |
1.90 |
28.4 |
690 |
1860 |
Kirchhoff e Bunsen |
56 |
Bario |
Ba |
6, 2 |
137.327(7) |
3.65 |
725 |
1640 |
1808 |
Davy |
57 |
Lantanio |
La |
6 |
138.90547(7)[1] |
6.16 |
920 |
3454 |
1839 |
Mosander |
58 |
Cerio |
Ce |
6 |
140.116(1)[1] |
6.77 |
798 |
3257 |
1803 |
von Hisinger e Berzelius |
59 |
Praseodimio |
Pr |
6 |
140.90765(2) |
6.48 |
931 |
3212 |
1895 |
von Welsbach |
60 |
Neodimio |
Nd |
6 |
144.242(3)[1] |
7.00 |
1010 |
3127 |
1895 |
von Welsbach |
61 |
Promezio |
Pm |
6 |
[146.9151][5] |
7.22 |
1080 |
2730 |
1945 |
Marinsky e Glendenin |
62 |
Samario |
Sm |
6 |
150.36(2)[1] |
7.54 |
1072 |
1778 |
1879 |
Lecoq de Boisbaudran |
63 |
Europio |
Eu |
6 |
151.964(1)[1] |
5.25 |
822 |
1597 |
1901 |
Demarçay |
64 |
Gadolinio |
Gd |
6 |
157.25(3)[1] |
7.89 |
1311 |
3233 |
1880 |
de Marignac |
65 |
Terbio |
Tb |
6 |
158.92535(2) |
8.25 |
1360 |
3041 |
1843 |
Mosander |
66 |
Disprosio |
Dy |
6 |
162.500(1)[1] |
8.56 |
1409 |
2335 |
1886 |
Lecoq de Boisbaudran |
67 |
Olmio |
Ho |
6 |
164.93032(2) |
8.78 |
1470 |
2720 |
1878 |
Soret |
68 |
Erbio |
Er |
6 |
167.259(3)[1] |
9.05 |
1522 |
2510 |
1842 |
Mosander |
69 |
Tulio |
Tm |
6 |
168.93421(2) |
9.32 |
1545 |
1727 |
1879 |
Cleve |
70 |
Itterbio |
Yb |
6 |
173.04(3)[1] |
6.97 |
824 |
1193 |
1878 |
de Marignac |
71 |
Lutezio |
Lu |
6, 3 |
174.967(1)[1] |
9.84 |
1656 |
3315 |
1907 |
Urbain |
72 |
Afnio |
Hf |
6, 4 |
178.49(2) |
13.31 |
2150 |
5400 |
1923 |
Coster e de Hevesy |
73 |
Tantalio |
Ta |
6, 5 |
180.9479(1) |
16.68 |
2996 |
5425 |
1802 |
Ekeberg |
74 |
Tungsteno |
W |
6, 6 |
183.84(1) |
19.26 |
3407 |
5927 |
1783 |
Elhuyar |
75 |
Renio |
Re |
6, 7 |
186.207(1) |
21.03 |
3180 |
5627 |
1925 |
Noddack, Tacke e Berg |
76 |
Osmio |
Os |
6, 8 |
190.23(3)[1] |
22.61 |
3045 |
5027 |
1803 |
Tennant |
77 |
Iridio |
Ir |
6, 9 |
192.217(3) |
22.65 |
2410 |
4130 |
1803 |
Tennant |
78 |
Platino |
Pt |
6, 10 |
195.084(9) |
21.45 |
1772 |
3827 |
1557 |
Scaliger |
79 |
Oro |
Au |
6, 11 |
196.966569(4) |
19.32 |
1064.4 |
2940 |
dall'antichità |
sconosciuto |
80 |
Mercurio |
Hg |
6, 12 |
200.59(2) |
13.55 |
-38.9 |
356.6 |
dall'antichità |
sconosciuto |
81 |
Tallio |
Tl |
6, 13 |
204.3833(2) |
11.85 |
303.6 |
1457 |
1861 |
Crookes |
82 |
Piombo |
Pb |
6, 14 |
207.2(1)[1] [3] |
11.34 |
327.5 |
1740 |
dall'antichità |
sconosciuto |
83 |
Bismuto |
Bi |
6, 15 |
208.98040(1) |
9.80 |
271.4 |
1560 |
1540 |
Geoffroy |
84 |
Polonio |
Po |
6, 16 |
[208.9824][5] |
9.20 |
254 |
962 |
1898 |
Marie e Pierre Curie |
85 |
Astato |
At |
6, 17 |
[209.9871][5] |
302 |
337 |
1940 |
Corson e MacKenzie |
|
86 |
Radon |
Rn |
6, 18 |
[222.0176][5] |
9.23 g/l |
-71 |
-61.8 |
1900 |
Dorn |
87 |
Francio |
Fr |
7, 1 |
[223.0197][5] |
27 |
677 |
1939 |
Perey |
|
88 |
Radio |
Ra |
7, 2 |
[226.0254][5] |
5.50 |
700 |
1140 |
1898 |
Marie e Pierre Curie |
89 |
Attinio |
Ac |
7 |
[227.0278][5] |
10.07 |
1047 |
3197 |
1899 |
Debierne |
90 |
Torio |
Th |
7 |
232.03806(2)[5] [1] |
11.72 |
1750 |
4787 |
1829 |
Berzelius |
91 |
Protoattinio |
Pa |
7 |
231.03588(2)[5] |
15.37 |
1554 |
4030 |
1917 |
Soddy, Cranston e Hahn |
92 |
Uranio |
U |
7 |
238.02891(3)[5] [1] [2] |
18.97 |
1132.4 |
3818 |
1789 |
Klaproth |
93 |
Nettunio |
Np |
7 |
[237.0482][5] |
20.48 |
640 |
3902 |
1940 |
McMillan e Abelson |
94 |
Plutonio |
Pu |
7 |
[244.0642][5] |
19.74 |
641 |
3327 |
1940 |
Seaborg |
95 |
Americio |
Am |
7 |
[243.0614][5] |
13.67 |
994 |
2607 |
1944 |
Seaborg |
96 |
Curio |
Cm |
7 |
[247.0703][5] |
13.51 |
1340 |
1944 |
Seaborg |
|
97 |
Berkelio |
Bk |
7 |
[247.0703][5] |
13.25 |
986 |
1949 |
Seaborg |
|
98 |
Californio |
Cf |
7 |
[251.0796][5] |
15.1 |
900 |
1950 |
Seaborg |
|
99 |
Einsteinio |
Es |
7 |
[252.0829][5] |
860 |
1952 |
Seaborg |
||
100 |
Fermio |
Fm |
7 |
[257.0951][5] |
1952 |
Seaborg |
|||
101 |
Mendelevio |
Md |
7 |
[258.0986][5] |
1955 |
Seaborg |
|||
102 |
Nobelio |
No |
7 |
[259.1009][5] |
1958 |
Seaborg |
|||
103 |
Laurenzio |
Lr |
7, 3 |
[260.1053][5] |
1961 |
Ghiorso |
|||
104 |
Rutherfordio |
Rf |
7, 4 |
[261.1087][5] |
1964/69 |
Flerov |
|||
105 |
Dubnio |
Db |
7, 5 |
[262.1138][5] |
1967/70 |
Flerov |
|||
106 |
Seaborgio |
Sg |
7, 6 |
[263.1182][5] |
1974 |
Flerov |
|||
107 |
Bohrio |
Bh |
7, 7 |
[262.1229][5] |
1976 |
Oganessian |
|||
108 |
Hassio |
Hs |
7, 8 |
[265][5] |
1984 |
GSI (*) |
|||
109 |
Meitnerio |
Mt |
7, 9 |
[266][5] |
1982 |
GSI |
|||
110 |
Darmstadtio |
Ds |
7, 10 |
[269][5] |
1994 |
GSI |
111 |
Roentgenio |
Rg |
7, 11 |
[272][5] |
1994 |
GSI |
|||
112 |
Copernicio |
Cn |
7, 12 |
[285][5] |
1996 |
GSI |
|||
113 |
Ununtrio |
Uut |
7, 13 |
[284][5] |
2004 |
JINR (*), LLNL (*) |
|||
114 |
Ununquadio |
Uuq |
7, 14 |
[289][5] |
1999 |
JINR |
|||
115 |
Ununpentio |
Uup |
7, 15 |
[288][5] |
2004 |
JINR, LLNL |
|||
116 |
Ununhexio |
Uuh |
7, 16 |
[292][5] |
1999 |
LBNL (*) |
|||
117 |
Ununseptio |
Uus |
7, 17 |
[5] |
2010 |
||||
118 |
Ununoctio |
Uuo |
7, 18 |
[5] |
1999 |
Peso atomico - numero atomico
Ossigeno Elemento gassoso di simbolo O e numero atomico 8, appartenente al gruppo VIB (o 16) della tavola periodica. Scoperto nel 1774 dal chimico britannico Joseph Priestley e, indipendentemente, dal chimico svedese Carl Wilhelm Scheele, fu riconosciuto come un gas semplice dal chimico francese Antoine-Laurent Lavoisier che gli diede il nome.
Proprietà e diffusione
L'ossigeno è un gas incolore, inodore, insapore e debolmente magnetico, che può essere condensato in un liquido blu pallido con spiccate caratteristiche magnetiche. Allo stato solido è di colore blu ed è prodotto comprimendo ad altissime pressioni il liquido. Ha peso atomico 15,9994 e densità 1,429 g per litro; a pressione atmosferica, solidifica alla temperatura di -218,8 °C e liquefa a -183,4 °C.
È l'elemento più abbondante del nostro pianeta e rappresenta il 21% in volume, o il 23,15% in peso, dell'atmosfera; l'85,8% degli oceani (nell'acqua pura la percentuale è 88,8%), e il 46,7% della crosta terrestre, sotto forma di rocce e minerali, è composto di ossigeno. Esso rappresenta il 60% del nostro corpo e, oltre a essere un costituente principale dell'acqua, è presente nei composti chimici che formano i tessuti degli organismi viventi; quasi tutte le piante e gli animali, tra cui l'uomo, hanno bisogno di ossigeno, allo stato libero o combinato, per mantenersi in vita.
Si conoscono tre strutture dell'ossigeno: l'ossigeno normale, contenente due atomi per molecola, con formula O2; l'ozono, contenente tre atomi per molecola, con formula O3; e una forma di colore blu pallido, non magnetica, O4, che contiene quattro atomi per molecola e che degrada immediatamente a ossigeno normale. Sono inoltre noti tre isotopi stabili, di cui il più abbondante è l'ossigeno -16 (massa atomica 16), che rappresenta il 99,76% dell'ossigeno normale e che è stato usato nella determinazione dei pesi atomici fino agli anni Sessanta.
L'ossigeno viene preparato in laboratorio da sali come il clorato di potassio, il perossido di bario e il perossido di sodio. Il metodo di preparazione industriale più importante è l'elettrolisi dell'acqua e la distillazione frazionata dell'aria liquida. In quest'ultimo processo, l'aria viene liquefatta e poi lasciata evaporare; l'azoto, più volatile, evapora prima, lasciando l'ossigeno che può essere raccolto, quindi trasportato sia in forma liquida sia gassosa.
Dal punto di vista chimico l'ossigeno interviene in un gran numero di composti organici e inorganici. Reagisce con quasi tutti gli elementi, tra cui anche i gas nobili, formando composti che vengono detti ossidi (una reazione chimica in cui si forma un ossido è detta ossidazione). La velocità di reazione è determinata dai vari elementi e può essere anche molto rapida, come avviene ad esempio nel caso della combustione. Nella combustione spontanea, il calore generato dalla reazione è sufficiente per innalzare la temperatura della sostanza fino al punto di generare fiamme. L'ossigeno si combina così vigorosamente con il fosforo che il calore liberato dalla reazione provoca la fusione di quest'ultimo. Alcune polveri estremamente fini, dette sostanze piroforiche, presentano una superficie esposta all'aria molto estesa e possono dar luogo istantaneamente a reazioni di combustione spontanea. Lo zolfo, l'idrogeno, il sodio e il magnesio reagiscono con l'ossigeno in modo meno energetico e bruciano solo dopo accensione. Alcuni elementi, ad esempio il rame e il mercurio, formano ossidi molto lentamente, anche se portati ad alta temperatura. Infine i metalli inattivi, come il platino, l'iridio e l'oro, reagiscono con l'ossigeno solo per mezzo di metodi indiretti.
Usi
L'ossigeno è usato in grandi quantità nelle saldature ad alta temperatura, in cui viene sfruttata la fiamma caldissima prodotta da una miscela con altri gas. Viene inoltre somministrato a pazienti con difficoltà respiratorie, o a persone che si trovano in condizioni particolari in cui la concentrazione di ossigeno è troppo bassa per permettere la normale respirazione. L'aria arricchita di ossigeno è utilizzata nelle fornaci per la manifattura dell'acciaio.
L'ossigeno a elevata purezza trova impiego nell'industria metallurgica ed è di estrema importanza come propellente liquido per missili e razzi.
fonte: http://web.romascuola.net/itaer/vaula/chimica/ossigeno.htm
Peso atomico - numero atomico
|
L'ATOMO NEUTRO GLI ATOMI SONO TUTTI UGUALI TRA LORO? GLI ATOMI HANNO UN NOME? I SIMBOLI DEGLI ELEMENTI CHIMICI |
||
QUANDO GLI ATOMI SI UNISCONO: LA MOLECOLA LE FORMULE CHIMICHE |
|||
| SOSTANZA | SIMBOLO | COME SI LEGGE | SIGNIFICATO |
| ANIDRIDE CARBONICA | C02 | ci-o-due | 1 atomo di carbonio e due atomi di ossigrno |
| GLUCOSIO | C6H1206 | ci-sei-acca-dodici-o-sei | 6 atomi di carbonio 12 atomi di idrogeno 6 atomi di ossigeno |
| ACQUA | H2O | accacue-o | 2 atomi di idrogeno 1 atomo di ossigeno |
| CLORURO DI SODIO | NaCl | enne-a-ci-elle | 1 atomo di sodio 1 atomo di cloro |
fonte: http://space.cinet.it/cinetclub/emmegi/Ripetizioni/atomomolecole/atomomolecole.htm
Peso atomico - numero atomico
Visita la nostra pagina principale
Peso atomico - numero atomico
Termini d' uso e privacy