Fotosintesis resumen y tema
Fotosintesis resumen y tema
Ayúdanos a hacernos saber Larapedia.com informó a un amigo / amiga o marcado nuestro sitio web en tu blog o foro marcadores sociales como Facebook eTwitter, gracias
Los siguientes textos son propiedad de sus respectivos autores y les damos las gracias por la oportunidad que nos brindan para presentar gratis a estudiantes, profesores y usuarios de la Web para sus textos ilustrativos con fines educativos y científicos.
La información en la medicina y la salud en este sitio es de carácter general y para propósitos informativos solamente y por lo tanto no puede sustituir en ningún caso el consejo de un médico (o una persona legalmente autorizada para la profesión).
Fotosintesis resumen y tema
DEFINICIÓN
La fotosíntesis toma su nombre de sus raíces griegas foto (luz) y síntesis (unión). Su definición más sencilla es la formación de oxígeno y glucosa a partir de CO2 un donador de hidrógeno y energía luminosa. Esta reacción en eucariontes puede ser resumida en la siguiente sencilla ecuación:
 CO2 + H2O + Energía luminosa C6H12O6 + O2
CO2 + H2O + Energía luminosa C6H12O6 + O2
Cabe mencionar que la definición no refleja el complicado proceso que soporta toda la vida en la Tierra como la conocemos.
Durante los millones de años de existencia de la Tierra en algún momento de la evolución celular aparecieron organismos procariontes capaces de utilizar energía solar captándola con moléculas capaces de utilizar moléculas sencillas como agua y bióxido de carbono para elaborar compuestos orgánicos más complejos como los carbohidratos. Esta aparición cambio paulatinamente nuestra atmósfera y las condiciones de vida de los primeros organismos, haciendo necesaria su adaptación a la presencia de O2 en ella. Actualmente los organismos que no tenemos la capacidad de captar la energía solar y producir glucosa somos heterótrofos pues requerimos de los autótrofos (los que producen su propio alimento) para vivir. Más aún los humanos necesitamos no solo del alimento sino de la energía acumulada por estos organismos en combustibles como el petróleo y la madera para fabricar satisfactores de nuestras necesidades.
Para la evolución biológica la presencia de estos organismos que sintetizan alimento es la base de todos los ecosistemas terrestres y marinos y sus mutaciones o modificaciones tendrán un impacto en la diversidad vegetal y animal que conocemos hasta ahora y que dejaremos a las futuras generaciones.
Por otro lado, en la actualidad el hombre está en posibilidad de manipular genéticamente a estos organismos para obtener ventajas en la producción de alimentos y beneficiarse de ello, pero a su vez esta intervención pudiera tener consecuencias no solo biológicas, sino políticas, culturales y económicas.
DATOS HISTÓRICOS
Desde principios del siglo XVIII (1727) se documenta el hecho de que los vegetales se nutren al menos parcialmente de algo contenido en la atmósfera, para fines del siglo Joseph Priestley descubre el oxígeno y describe que las plantas lo producen y los animales lo consumen. Cerca de la mitad del siglo XIX Henri Dutrochet encuentra que la clorofila es necesaria para la producción de oxígeno por las plantas y Julius von Sachs prueba que las plantas producen almidón en un proceso que depende de la luz (fotosíntesis) y que utiliza clorofila. En 1882 Theodor Englemann, utilizando un aparato modificado por Carl Zeiss para proyectar un espectro de luz separado por un prisma sobre una placa microscópica, describió que la luz roja es la más eficiente para que ocurra la fotosíntesis. En 1883 A. Meyer describe detalles de la estructura del cloroplasto y A. Schimper describió su replicación y que son similares a algunas bacterias fotosintéticas.
En los primeros años del siglo XX, Einstein sugirió que la luz y otras radiaciones del espectro electromagnético viajan en paquetes discretos llamados fotones que al interactuar con la materia se aniquilan de forma completa, nunca en partes. Según su teoría fotoeléctrica se necesita un fotón para desprender un electrón. M.S. Cvet (1906) separo mediante cromatografía los pigmentos de las hojas de las plantas; en 1913 R. Willsttäter y Stoll aislaron la clorofila que después caracterizarían. Hevesy en 1923 fué el primer investigador en usar isotopos radiactivos como técnica de seguimiento en fisiología vegetal. Un adelanto importante en el estudio de la fotosíntesis se dio en el año de 1927 cuando Warburg y Negelein desarrollaron la espectrofotometría y K. Lohmann describe el ATP.
En 1935 por primera vez se enuncia un modelo de membrana que incluye no solo lípidos sino también proteínas (Danielli y Davson) y en 1936 Wood y Werkman describen dos fases de la fotosíntesis, una requiere luz y otra no, dos años después Robert Hill aisla cloroplastos y descubre que desprender oxígeno al ser iluminados siempre y cuando tengan un aceptor de electrones. En 1941, Ruben, Randall, Kamen y Hyde muestran que el oxígeno desprendido en la fotosíntesis proviene del agua, hecho muy importante debido a que antes se tenía la idea que el oxígeno desprendido era lo que quedaba del CO2 al incorporarse el carbono en la glucosa y en este mismo año F. Lippmann y H. Kalckar definen la función general en el metabolismo del ATP. Calvin y Benson en 1948 informaron que el fosfoglicerato es uno de los primeros productos de fijación del CO2, principio de la descripción completa del destino del carbono que conforma el Ciclo de Calvin-Benson que les diera el premio Nobel en 1961.
En 1951, Robert Hill confirmó que la fotoproducción de oxígeno por los cloroplastos es independiente del uso del CO2 y que el oxígeno se produce por la presencia de sustancias solubles de la planta o de reactivos que puedan aceptar hidrógeno, lo que hasta ahora se conoce como la reacción de Hill.
En 1956, R. Emerson y sus colaboradores encontraron que dos haces de luz provocaban mas producción de oxígeno por fotón que la suma de del producido por cada haz de forma independiente, a lo que se le llamo Efecto Emerson.
Kortschak et al., además de Hatch y Slack (1965/66) describieron un mecanismo sumamente eficiente usado por las plantas tropicales para unir CO2 (Plantas C4). En 1970, L. Margulis presenta su teoría de la endosimbiosis donde propone que los cloroplastos son descendientes de bacterias fotosintéticas que vivían dentro de otras células y en 1971 Vernon resume el concepto de que los pigmentos se ensamblan en las membranas de los tilacoides de los cloroplastos formando un centro de reacción de moléculas de clorofila y pigmentos accesorios. En 1972, con la ayuda de la novedosa técnica de congelación-fractura para microscopía electrónica de barrido, Singer y Nicholson presentan el modelo del mosaico fluído para las membranas celulares en donde se propone más claramente la interacción de lípidos y proteínas en distintas zonas.
En 1988 se presentó un fuerte avance en el estudio de la fotosíntesis, la cristalización del centro de reacción de una bacteria fotosintética y su resolución por cristalografía de Rayos X, trabajo por el cual Deisenhofer, Huber y Michel recibieron el premio Nobel.
En la actualidad, además de cada vez mejores descripciones por cristalografía de rayos X de las diferentes moléculas involucradas, se ha dado una sucesión de investigaciones basadas en mutaciones de genes que codifican diferentes proteínas para analizar su participación en el proceso fotosintético; asimismo la utilización de técnicas de transferencia genética para fortalecer el rendimiento en la producción de carbohidratos.
ASPECTOS INTRODUCTORIOS
Es importante introducir algunos conceptos que nos ayudarán a comprender mejor el proceso de la fotosíntesis y sus formas de evaluación o demostración experimental.
Radiación electromagnética. La radiación electromagnética es una forma de energía radiante que es de naturaleza dual pues presenta propiedades tanto de onda como de partícula. Entre sus propiedades de onda posee una componente eléctrica y una componente magnética, que son perpendiculares, pero sólo la componente eléctrica interacciona comúnmente con la materia. Uno de sus parámetros es la frecuencia que se define como el número de ondas que pasan por un punto fijo en la unidad de tiempo, se puede expresar la frecuencia de otra forma como número de unidades de longitud de onda en 1 cm y se llama número de onda. Entre sus propiedades de partícula encontramos que las ondas viajan en paquetes discretos llamados fotones y que cuando interactúa con la materia lo hace mediante la aniquilación de fotones completos.
La radiación electromagnética puede considerarse como constituida por ondas de energía. En cada una de estas ondas, la distancia entre dos crestas (o valles) consecutivas es la longitud de onda. La radiación sólo se absorbe o emite en unidades definidas llamadas fotones. La energía de los fotones es proporcional a la frecuencia de la radiación.
La intensidad de un haz de radiación está caracterizada por su poder de radiación, que es proporcional al número de fotones por segundo que se propagan en el haz que transporte radiación de una sola longitud de onda o sea monocromático; un haz policromático contiene radiación de diversas longitudes de onda.
La gama completa de radiaciones del espectro electromagnético comprende diferentes longitudes de onda que de acuerdo a su tamaño poseen más o menos energía (Fig. 1). Las longitudes de onda correspondientes al espectro de luz visible (luz solar) es entre 400 y 700 nm aproximadamente, por debajo de 400 nm se encuentra la radiación ultravioleta y por encima de 700 nm la radiación infrarrojo.
Fig. 1. Radiaciones electromagnéticas. Es importante apreciar que entre mayor sea la longitud de onda, menor es la frecuencia y la energía.
Cuando una molécula, por ejemplo un pigmento fotosintético, absorbe un fotón de luz está absorbiendo un cuanto de energía y pueden suceder varias cosas:
- que la molécula la absorba y posteriormente la reemita como un fotón de longitud de onda mayor, al regresar a su estado fundamental,
- que produzca cambios y transiciones electrónicos, vibracionales y rotacionales, manifestados como calor o cambios en la molécula como puede ser la emisión de un electrón.
- que se disperse
- que se refleje
Uniones entre moléculas. Brevemente mencionaremos que pueden ser fuertes o débiles. Las uniones fuertes en este espacio se consideraran como sinónimo de enlaces covalentes. Un enlace covalente es una unión en que dos moléculas se unen compartiendo uno o más pares de electrones para estabilizarse y la energía requerida esta aproximadamente entre 30 y 110 KCal/Mol.
Entre las uniones débiles encontramos aquellas que requieren muy pocas kilocalorías por lo que se rompen relativamente fácil, proceso muy importante en los sistemas biológicos pues permiten cambios conformacionales rápidos que favorecen diferentes funciones de los organismos, ejemplos de ellas son los enlaces iónicos, los puentes de hidrógeno, las uniones hidrofóbicas y las uniones de corto alcance como lo son las fuerzas de Van der Walls.
Reacciones oxido-reducción. Una oxidación es la remoción de uno o más electrones de un átomo o de una molécula y una reducción es el proceso contrario, la adición de electrones. La oxidación requiere un aceptor y la reducción un donador de electrones y debido a que estas especies no se encuentran libres, siempre que haya una oxidación habrá una reducción asociada, a lo que se le llama reacción de óxido reducción o redox y las sustancias o átomos involucrados se llaman par redox. En los sistemas biológicos existen muchos ejemplos de este tipo de reacciones, muchas oxidaciones se llevan a cabo sustrayendo el mismo número de protones que de electrones, forma en la cual la carga neta no varía al oxidarse, a este tipo de oxidaciones se les llama deshidrogenaciones y al proceso de reducción hidrogenación. Es importante mencionar que existen un pequeño grupo de moléculas llamadas transportadores biológicos que pueden ser oxidados en un lugar y reducidos en otro, siendo capaces de transportar electrones de un lado a otro a través del citoplasma, un ejemplo es el NADP+.
ESTRUCTURAS CELULARES Y MOLECULARES PARTICIPANTES
Plantas superiores. Aunque la fotosíntesis se lleva a cabo no solo en plantas superiores sino también en algas eucariontes unicelulares y procariontes como bacterias y algas verde-azules, es importante mencionar la compleja estructura de las hojas de las plantas. De manera sencilla las hojas de las plantas han evolucionado de acuerdo al medio ambiente en el que viven, siendo triunfadoras en la selección natural aquellas con características que les permitan un funcionamiento idóneo. Las hojas e la mayoría de las plantas son de apenas unas cuantas células de espesor lo que permite que se expongan en una mayor extensión a la energía radiante del sol. En la superficie superior e inferior tienen una delgada capa de células que forman la epidermis y ambas capas están recubiertas por una cutícula que es una protección más fuerte de contiene ceramidas que les da cierta impermeabilidad y resistencia a la pérdida de la humedad. En la epidermis existen unos poros de apertura regulable llamados estomas que permiten la entrada de CO2, en el tiempo necesario y que convenientemente poseen cloroplastos. Dentro de la hoja existe una capa intermedia de células llamada mesófilo, las cuales contienen la casi totalidad de los cloroplastos por lo que la fotosíntesis se realiza en este lugar. Además, las hojas contienen una vascularización que suministra agua y sales minerales y transportan los carbohidratos a otras partes de las células. En las plantas que efectúan una vía alterna para la fotosíntesis, llamadas C4, existen unas células llamadas del parénquima vascular que poseen un tipo diferente de cloroplastos llamados dimórficos.
Cloroplastos. Las plantas superiores contienen una gran variedad de plástidos en donde se realizan funciones muy importantes, estos organelos derivan de un ancestro común, aunque después de su desarrollo presentan una variedad de tamaños, formas y funciones; este desarrollo está dirigido por genes de las células que los contienen.
De inicio fueron clasificados solo por su color en cloroplastos (verdes), cromoplastos (amarillos o rojos) y leucoplastos (blancos); en la actualidad se reconocen los cloroplastos (con gran proporción de clorofila), amiloplastos (reserva e almidón), cromoplastos (carotenos), oleinoplastos (aceites), proteinoplastos (proteínas), proplástidos (pequeños y no diferenciados, fundamentalmente en raíces) y etioplastos (plastos de las plantas que crecen en la oscuridad). Todos ellos poseen un genoma propio capaz de codificar un pequeño número de genes, por lo que muchas de sus proteínas son codificadas por el núcleo de la célula y las proteínas son importadas al plástido. Es importante recordar que la presencia de material genético y de una doble membrana son las bases de la teoría endosimbiótica que postula que estos plástidos y las mitocondrias entraron como organismos simbioticos en otra célula, los organismo procariontes más parecidos en la actualidad a los plástidos serían las algas verde-azules o cianobacterias.
En plantas superiores, los cloroplastos son cuerpos discoidales o elipsoidales que miden entre 2 y 10µm de diámetro y 1µm de grosor. En algas pueden ser más grandes y de forma más complicada. En plantas superiores puede haber docenas de cloroplastos en el citoplasma de cada célula verde, mientras que en organismos eucariontes unicelulares solo puede haber uno o dos.
Se han distinguido dos tipos de cloroplastos: el lamelar, característico de algas, y el formado por grana, característico de plantas superiores; esta rodeado por dos membranas, cada una de aproximadamente 5 nm de grosor con un espacio de aproximadamente 10 nm entre ellas. Aparentemente cada una presenta la estructura de una unidad de membrana, es decir, una bicapa de fosfolípidos entre dos de proteína. Las membranas tienen permeabilidad diferencial, lo cual favorece que entre materia prima para la fotosíntesis y después salgan los productos de ésta.
Dentro del cloroplasto hay un material semifluido incoloro que contiene proteínas DNA, RNA y ribosomas que participan en la síntesis de varias proteínas del cloroplasto; muy similar a la matriz mitocondrial llamado estroma. Aquí es donde se localiza la mayoría de las enzimas requeridas en las reacciones de la fase oscura.
La membrana interna se invagina formando dobleces apareados llamados lamelas. A ciertos intervalos las lamelas se ensanchan y forman bolsas o sacos planos llamados tilacoides, y éstos se acomodan uno sobre otro para formar los grana.
Según el modelo de Hodge, la clorofila se encuentra dentro de los tilacoides entre capas de moléculas de proteína y fosfolípidos. Se cree que los transportadores de electrones y enzimas fosforiladoras de los fotosistemas I y II están en la membrana de los tilacoides.
Pigmentos fotosínteticos. La clorofila es el pigmento responsable del color verde de las plantas. Sin embargo, una planta no verde no siempre carece de clorofila; a menudo ésta se encuentra enmascarada por los pigmentos accesorios no verdes. Todas las células fotosintéticas que producen oxigeno contienen 2 tipos de clorofila, una de las cuales siempre es la a. La otra puede ser clorofila b (plantas verdes), clorofila c (algas pardas, diatomeas, dinoflagelados), o clorofila d (algas rojas). Los organismos fotosintéticos que no producen oxigeno –bacterias fotosintéticas- nunca tienen clorofila a; contienen tipos sencillos de clorofila, que pueden ser bacterioclorofila o clorobium-clorofila o ambos tipos.
Cualquier forma de clorofila contiene la estructura porfirina consistente en 4 anillos pirrólicos unidos por sus átomos de nitrógeno a un átomo de magnesio. Cada clorofila tiene un quinto anillo con solo átomos de carbono. Exceptuando a la clorofila c, todas las clorofilas tienen una larga cadena fitol. La diferencia entre clorofilas es la estructura de las cadena laterales ligadas a los anillos pirrólicos. Por ejemplo, la clorofila a tiene un grupo metilo en el anillo 3, mientras que la clorofila b tiene un grupo aldehído en ese lugar.
Un análisis de la estructura de la clorofila y de su disposición en el cloroplasto muestra que están muy relacionadas con la función que desempeña. Por una parte, la molécula necesita poseer electrones que se exciten fácilmente, pero a la vez que no la inestabilicen lo suficiente como para buscar combinarse rápidamente con alguna sustancia inadecuada. La estructura de los anillos pirrólicos, con sus enlaces conjugados, tiene precisamente estas propiedades. Cualquier sistema conjugado posee electrones particularmente móviles que se excitan con poca cantidad de energía, como la que conforma la luz visible. Asimismo, la clorofila es muy estable, aunque fácilmente excitable, porque en su estructura de anillos cerrados en círculo los electrones exteriores no pertenecen a un átomo o enlace individual, sino al complejo alrededor del cual oscilan.
Cuando la clorofila recibe la estimulación por los fotones, desprende electrones que reducen el NADP+ por lo sería de esperarse que la eficiencia de la fotosíntesis acompañara los cambios realizados por la diferente absorción de la clorofila en distintas longitudes de onda; sin embargo, esto no sucede debido a que existen otros pigmentos capaces de absorber energía radiante en otros rangos de longitud de onda lo que hace a la fotosíntesis un proceso muy eficiente absorbiendo energía prácticamente en cualquier rango del espectro visible.
Aunque la energía es asimilada en un amplio espectro, parte de ella se pierde al transferirla de una molécula a otra hasta llegar al pigmento que absorbe a la mayor longitud de onda en el visible o sea, la de menor energía. Por lo anterior, es importante realizar la transferencia de energía de una molécula de clorofila a otras y de los pigmentos accesorios a la clorofila a con eficiencia. Esto se logra gracias a la disposición molecular de la clorofila en los cloroplastos. Puesto que la cadena fitol es soluble en lípidos y el resto es soluble en proteína, se crea un acomodo muy compacto de las moléculas, lo que les da cercanía física. Cuando una de las moléculas es excitada, rápidamente pasa su energía a la molécula vecina por resonancia.
Consecuentemente, debe existir algún sitio que acumule o guarde la energía de excitación para que no circule demasiado tiempo y se pierda como calor; esta trampa de energía debe absorber luz de la menor energía posible, esto es 700 nm en el espectro visible, lo que hace eficientemente la clorofila a, con distintas subfracciones que absorben desde 660 hasta cerca de 700, formando una unidad cooperativa, parte de un sistema de pigmentos o fotosistema llamado P700. P700 absorbe a mayor longitud de onda, y por tanto menor energía, que las moléculas que lo rodean. Entonces ellas le pueden pasar energía a P700 pero no viceversa, por lo que hay un flujo unidireccional.
Por último, el mecanismo de asimilación de energía mencionado no es suficiente para explicar el hecho de que luz monocromática de 700 es ineficiente para producir la fotosíntesis en cloroplastos y que la adición de un segundo haz de luz de longitud de onda menor (650) aumenta de forma sinérgica la eficiencia global. Este efecto de luz doble conocido como efecto Emerson llevo a postular la idea de que al menos existen dos trampas diferentes, a esta segunda se le conoce como P690. Resumiendo, los pigmentos en los cloroplastos parecen estar agrupados en dos partes o sistemas de pigmentos llamados sistema de pigmentos I o fotosistema I (PSI) y sistema de pigmentos II o fotosistema II (PSII). El mismo grupo del Dr. Emerson describió que ambos sistemas están acoplados químicamente, más que a través de la sola transferencia de energía, este acoplamiento comprende varias reacciones de oxidación-reducción similares a la cadena de transporte de electrones en mitocondrias. Al parecer los electrones que se sustraen del agua se transfieren a la cadena de transporte de electrones mediante PSII y de la cadena al NADP+ por el PSI.
REACCIONES DE FASE LUMINOSA
Consiste en la captura de fotones, cuya energía es utilizada finalmente para la producción por una parte de una molécula transportadora llamada, nicotinamida-adenin-dinucleótido fosfato reducida (NADPred) y por otra de energía química almacenada, adenosin-trifosfato (ATP). El reductor se produce cuando la clorofila atrapa fotones, los cuales excitan las moléculas de NADP de esta manera provocan el ascenso de electrones a un nivel de energía superior. Los electrones no regresan a la molécula de clorofila porque reducen moléculas de NADP+ a NADPH.
Por otra parte, la energía química almacenada se produce cuando la clorofila atrapa fotones que excitan las moléculas de NADP, con lo que provocan el ascenso de electrones a un nivel de energía superior, del que si regresan, mediante la liberación gradual del exceso de energía. Dicha energía se utiliza para acoplar fosfato inorgánico (Pi) con adenosin bifosfato (ADP) para producir ATP.
La molécula que recibe definitivamente al electrón excitado de la clorofila a y que por tanto queda reducida por el, es el NADPox. La clorofila no reduce al NADPox cuando su potencial es positivo, sino cuando, gracias a la absorción de la energía de un fotón, ha adquirido un potencial mas bajo que el del NADPox. La energía luminosa (fotones) captada por la clorofila “se utiliza” para disminuir el potencial redox de la clorofila, de tal manera que ésta pueda ser un agente reductor del NADPox.
Un fotón incide sobre un conjunto de moléculas del pigmento clorofila a transmitiéndole su energía, actuando como catalizador fotoquímico. Se cree que entre dichas moléculas hay una especializada en recibir y ceder electrones excitados, llamada P700 que es parte del PSI. P700 cede su electrón excitado y queda con una deficiencia electrónica. El electrón es recibido por una proteína transportadora de electrones que contiene azufre y hierro llamada ferredoxina. A su vez la ferredoxina cede el electrón a la ferredoxina- NADPox. El proceso continua con acumulación de NADPred hasta que se agota el NADPox. Dado que los electrones no regresan a la clorofila a, a este proceso se le ha llamado flujo de electrones no cíclico.
El mecanismo mediante el cual se regeneran las moléculas de clorofila a es igual a aquel mediante el que se produce el NADPred: la excitación de moléculas pigmentarias cuyos electrones pasan por varios compuestos hasta llegar a un aceptor final. El recorrido del electrón que regenera a la clorofila a es el siguiente: un fotón incide sobre un conjunto de moléculas del pigmento clorofila b y le trasmite su energía. Una molécula cede su electrón excitado a un aceptor aun no identificado Q, que queda de esta manera con una deficiencia electrónica. Q transfiere el electrón a una sustancia llamada plastoquinona. De la plastoquinona el electrón pasa al citocromo b599, compuesto que tiene fierro. De este citocromo el electrón pasa al citocromo f o c555 y de éste a la plastocianina, una proteína que tiene cobre. Es la plastocianina la que cede el electrón a la molécula P700 de clorofila a.
La clorofila b, al igual que la a, simplemente cede electrones temporalmente, y por tanto es un catalizador. Los electrones que corrigen las deficiencias electrónicas de la clorofila b provienen del agua y éste es el verdadero agente reductor del NADPox, pues se acumula en forma oxidada como O2
El flujo no cíclico de electrones es una reacción de óxido-reducción en la que el agua es el agente reductor y el NADPox es el agente oxidante; se acumulan el O2 como compuesto oxidado y el NADPred como compuesto reducido. Pero dado que es una oxido-reducción que ocurre en el sentido contrario al espontáneo requiere de una entrada de energía. Es la energía solar la que invierte el sentido natural de la reacción. La ecuación es:
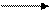 nhv + 2 Pi + 2ADP + H2O + NADP NADPH + ½ O2 + 2ATP + 2H2
nhv + 2 Pi + 2ADP + H2O + NADP NADPH + ½ O2 + 2ATP + 2H2
el flujo de electrones no cíclico es la combinación de dos métodos opuestos pero complementarios, para relacionar compuestos de diferente potencial redox: un método “brusco”, la excitación de electrones por absorción de energía luminosa, y un método gradual, la liberación de pequeñas cantidades de energía por la oxido-reducción de una serie de compuestos de potencial muy cercano entre si. Podría considerarse una falta de precisión del sistema que la excitación llevara al electrón a un potencial redox menor que el necesario para reducir al NADPox o a la clorofila a y después liberar el excedo de energía hasta llegar a un potencia adecuado. Sin embargo, el exceso de energía no se desperdicia, pues en sitios determinados se usa para acoplar ADP con Pi dando ATP, una forma más de energía química potencial, en otras palabras, hay una fosforilación no cíclica. Cuya principal función es la de producir un compuesto rico en energía y fuertemente donador de hidrogeno, como es el NADPred. Sin embargo, si hay un proceso dentro de las reacciones luminosas cuya única función es la producción de un compuesto que no es reductor pero si rico en energía, el ATP.
Al iluminar cloroplastos aislados se ha observado que en ausencia total de donadores o aceptores de electrones se forma ATP a partir de ADP y Pi, sin acumulación de un compuesto reducido. También se ha observado que la formación de ATP depende directamente de la intensidad y duración de la iluminación; entre más tiempo se iluminen los cloroplastos y mayor sea la intensidad, mas ATP se forma. Dado que no se detecta un producto reducido, se supone que no hay una transferencia neta de electrones. Sin embargo, la acumulación de un compuesto con un enlace de alta energía donde no lo había indica que aun cuando los electrones no están produciendo una reducción neta, si están fluyendo. Se supone que lo que sucede es que hay oxidación y reducción del mismo compuesto, a saber, la clorofila P700. Puesto que la única fuente posible de energía para unir Pi y ADP es la energía radiante dada a los cloroplastos, se supone que dicha energía genera electrones con un alto nivel energético. Esos electrones regresan a la clorofila a partir de la ferredoxina – vía citocromo b6 - en vez de continuar hacia el NADP a llenar las deficiencias electrónicas que ellos mismos dejaron. Si están presentes el ADP y el Pi, ocurre formación de ATP, es decir, una fosforilacion; si no están presentes el ADP y el Pi, la energía se pierde como fluorescencia y calor. La ecuación general del flujo cíclico de electrones es:
 nhv + Pi + ADP ATP + H20
nhv + Pi + ADP ATP + H20
Las reacciones luminosas las llevan a cabo ambos fotosistemas conectados en serie.
Los dos sistemas y el complejo citocromo están incluidos en la membrana tilacoide. Los electrones captados del agua en el fotosistema II se transfieren al fotosistema I a través de las quinonas (Q), el complejo citocromo b6f y la plastocianina (PC). En el fotosistema I, los electrones se excitan de nuevo por la luz, para su transferencia a través de una serie de intermediarios a la ferredoxina. La ferredoxina reducida reduce el NADP+.
En cada uno de los dos centros de reacción, P680 y P700, los electrones suben a un estado excitado mediante la absorción de fotones. En cada fotosistema, los electrones excitados pasan por una cadena de transporte electrónico, que impulsa el bombeo de iones hidrogeno al interior de la luz del tilacoide. El modo de conección de los dos fotosistemas se denomina a veces esquema Z, debido al patrón de cambios energéticos que se ha descrito.
Imagen simplificada de la fotosíntesis. Principales proteínas de la membrana tilacoides qur soportan el flujo lineal de electrones. (a) Organización transmembranal de las proteínas de los principales complejos fotosintéticos en su estado de oligomerización nativo, resuelto por cristalografía de rayos X (Daniel Picot). (b) Representación esquemática de la vía del flujo lineal de electrones y de la translocación de protones a través de grandes complejos de proteínas cuya estructura atómica se muestra en parte a. Los electrones son extraídos del agua en el lado lumenal
de las membranas y trasladado a NADP en el lado del estroma. La transferencia de electrones es impulsada por el centro de reacción de dos distintos fotosistemas -PSII y PSI- que constituyen el centro de separación de cargas inducida por la luz, entre la clorofila fotosensible y una
molécula receptora. El intersistema de acarreadores electrónicos consiste en un conjunto de moléculas de plastoquinona disueltas dentro de la bicapa lipídica, un complejo de proteínas transmembranal -complejo de citocromos b6f- que comprende un grupo de Fe-S y cuatro grupos hemo, una pequeña proteína que contiene llamada plastocianina, que esta disuelta en el lumen de los tilacoides y que es sustituida por un citocromo soluble, C6, en algunos organismos fotosintéticos. Los protones translocados a través de la membrana durante el flujo lineal de electrones son utilizados por la ATP sintasa transmembranal para impulsar la síntesis de ATP. Tomada de Eberhard, Finazzi, y Wollman.
Es importante mencionar que los electrones captados por el agua mencionados antes, son solo un caso especial del esquema general de la fotosíntesis, en 1937, Robert Hill descubrió que al iluminar cloroplastos que carecen de CO2 en presencia de un aceptor de electrones artificial, el ferricianuro [Fe(CN) 63-], se produce O2 con la reducción concomitante del aceptor. Demuestra que el CO2 no participa directamente en la reacción de producción de O2.
En 1941, cuando se pudo disponer del isótopo 18O, Samuel Ruben y Martin Kamen demostraron que la fuente del O2 que se forma en la fotosíntesis es el H2O:
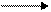 H218O + CO2 (CH2O) + 18O2
H218O + CO2 (CH2O) + 18O2
En el caso de las bacterias sulfurosas purpúreas se utiliza sulfuro de hidrogeno con la siguiente ecuación:
 H2S + CO2 S + 2H2 + 2e-
H2S + CO2 S + 2H2 + 2e-
Resumiendo la contribución de Hill a la ecuación general de la fotosíntesis es el esclarecimiento del origen del O2 enunciando la ecuación general:
 CO2 + H2A C6H12O6 + 2A + H2O
CO2 + H2A C6H12O6 + 2A + H2O
REACCIONES DE FASE OSCURA
Las síntesis del proceso fotosintético se llevan a cabo independientemente de la presencia o ausencia de luz. Mediante estas reacciones lo que ocurre son dos eventos: la fijación del CO2 y el ciclo de reducción del carbono.
La fijación del CO2 implica que su carbono se integra a otras moléculas con carbono para la construcción de cadenas más largas.
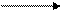 H2O + CO2 + Ribulosa-1,5-difosfato 2 ácido 3-difosfoglicérico
H2O + CO2 + Ribulosa-1,5-difosfato 2 ácido 3-difosfoglicérico
Ya que se ha fijado el CO2, relacionaremos los productos de la fase luminosa con las reacciones de la fase oscura integrando cada reacción hacia la síntesis de carbohidratos:
 Acido 3-fosfoglicérico + ATP acido difosfoglicérico + ADP + Pi
Acido 3-fosfoglicérico + ATP acido difosfoglicérico + ADP + Pi
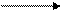 Acido difosfoglicerico + NADPH fosfogliceraldehído + NADP
Acido difosfoglicerico + NADPH fosfogliceraldehído + NADP
El fosfogliceraldehído (PGA) es un compuesto importante porque puede seguir en el ciclo de reducción del carbono o puede salir y seguir reduciéndose hasta producir carbohidratos sencillos o complejos, etc. Uno de los caminos que puede seguir es el siguiente:
 2 PGA hexosa fosfatada (un carbohidrato) + Pi
2 PGA hexosa fosfatada (un carbohidrato) + Pi
Otro papel muy importante del PGA es la reintegración de la ribulosa-1,5-difosfato y de esta manera evitar que se detenga la fijación de carbono por falta de un aceptor inicial. La manera en que esto se lleva a cabo es cíclica, pues las moléculas de PGA (C3, de tres carbonos) producen moléculas de ribosa-5-fosfato (de cinco carbonos), que con ATP se transforman en ribulosa-1,5-difosfato (cinco carbonos) la cual tras fijar CO2 vuelve a producir dos moléculas de PGA para volver a comenzar el ciclo.
Podemos caracterizar a las reacciones de la fase oscura como un proceso de oxido-reducción en la que el NADPH es el agente reductor y el CO2 el agente oxidante; se acumula NADP como compuesto oxidado y un carbohidrato como compuesto reducido. Esta reacción, al igual que las de los flujos cíclicos y no cíclico de electrones, ocurre en contra del sentido espontáneo, por lo que también requiere una entrada de energía. Pero en este caso no es la energía de un fotón la que invierte el sentido de la reacción, sino el ATP producido durante las reacciones luminosas.
En el ciclo descrito por Calvin-Benson entran 3 moléculas de ribulosa-1,5-difosfato, las cuales aceptan una molécula de CO2 cada una, o sea, 3 en total. Al reaccionar la ribulosa-1,5-difosfato y el CO2 se forman 3 moléculas de un compuesto de 6 carbonos, de estructura desconocida. Dicho compuesto, rápidamente se rompe en dos moléculas iguales de ácido 3-fosfoglicérico. Las 6 moléculas de acido 3-fosfoglicérico son reducidas por el NADPH y el ATP de las reacciones luminosas, lo que da como resultado 6 moléculas de fosfogliceraldehído. Cinco de ellas vuelven a entrar al ciclo para regenerar la ribulosa-1,5-difosfato y la sexta representa la ganancia del ciclo, que puede oxidarse en las mitocondrias o seguir reduciéndose. La fórmula general es:
 6-ribulosa-1,5-difosfato + 6CO2 + 18ATP + 12NADPH
6-ribulosa-1,5-difosfato + 6CO2 + 18ATP + 12NADPH
 6-ribulosa-1,5-difosfato + hexosa + 16Pi + 18ADP + 12NADP+
6-ribulosa-1,5-difosfato + hexosa + 16Pi + 18ADP + 12NADP+
La ribulosa-1,5-difosfato aparece a ambos lados de la ecuación solo para mostrar que es un componente necesario que se regenera al final del ciclo.
Alrededor de 1960, se describió un proceso llamado fotorrespiración que sucede en plantas que se encuentran sumamente iluminadas que en lugar de producir oxígeno, lo utilizan; de hecho, cuando el CO2 esta escaso y el O2 abunda el proceso de fororrespiración puede superar al de la fijación de CO2 en la fotosíntesis. La explicación resulto algo paradójico, la enzima que fija el CO2 en la ribulosa-1,5-difosfato no tiene una afinidad específica por el CO2, puede también captar O2 cuando éste se encuentra en abundancia, de hecho la enzima encargada que en un inicio se creyó que solo era carboxilasa ahora se renombro y se conoce como ribulosa-1,5 difosfato carboxilasa-oxigenasa o Rubisco.
En su acción como oxigenasa, la Rubisco cataliza la formación de 3- fosfoglicerato y 2-fosfoglicolato, éste último es hidrolizado a glicolato, por la glicolato fosfatasa, que es oxidado parcialmente formando CO2 a través de reacciones realizadas en peroxisomas especializados en las plantas llamados glioxisomas. Aunque la fotorrespiración aparentemente es un proceso que desperdicia el realizado por la fotosíntesis, parece ser que apareció cuando en la atmósfera primitiva había muy poco oxígeno y no causaba problema alguno; sin embargo, en la actualidad pudiera haber sobrevivido el proceso evolutivo al ser un mecanismo de protección del aparato fotosintético contra la foto-oxidación cuando no exista suficiente CO2 para disipar la energía absorbida.
Precisamente, en 1966 Hatch y Slack describieron otra vía para la fijación del carbono que utilizan plantas de climas calurosos y secos que evitan la fotorrespiración. Estas plantas poseen una anatomía característica en la cual sus finas venas están rodeadas por una capa muy fina de células de la vaina del haz que a su vez están rodeadas por células del mesófilo. Estas plantas poseen otro tipo de cloroplastos llamados dimórficos. En esta vía, el CO2 es captado por las células del mesófilo que no contienen cloroplastos, por lo que éste se condensa con el fosfoenolpiruvato (PEP) para formar oxaloacetato (OA) que es un compuesto de cuatro carbonos por lo que esta vía también se conoce como C4. El OA es reducido por el NADPH y convertido a malato que es transportado a cloroplastos comunes para por una descarboxilación convertirse en piruvato y liberar CO2 que entra al ciclo de Calvin o C3 y el piruvato regresa a las células del mesófilo para ser fosforilado y de nuevo formar PEP. El resultado de este proceso es la concentración de CO2 en las células de la vaina del haz a expensas de ATP, que aunque parezca más ineficiente que el proceso normal o C3, en realidad es una estrategia muy eficiente para adaptarse a las condiciones climáticas en las cuales abrir los estomas durante el día para captar CO2 podría ser fatal por la deshidratación causada por la temperatura.
Figura de flujo de carbono. Un aspecto general del flujo de carbono y equivalentes de reducción los cloroplastos de la vaina, que ilustra las conexiones entre NDH dependientes e independientes
del flujo de electrones cíclico, oxidasa alternativa (PTox), CCMs postuladas como NDH- dependientes y el flujo primario de carbono. Las proteínas mostradas en rojo están enriquecidos los cloroplastos de la vaina. El transporte malato-piruvato importa malato a los cloroplastos de las células de la vaina, donde se descarboxila por ME, liberando CO2 y reduciendo de NADP+ en NADPH. En condiciones favorables, el CO2 es utilizado por la Rubisco en el ciclo de Calvin. El NADPH se utiliza en el ciclo de Calvin y también puede usarse para conducir un flujo cíclico de electrones, el cual se asimila al complejo de NDH o a las proteínas PGR5 y
PGRL1 del PSI. El flujo cíclico de electrones ayuda a construir el gradiente de protones a través de la membrana del tilacoides y sirve para producir ATP por la ATP sintasa tipo f. Para la fotosíntesis C4 el CO2 se concentra alrededor de la Rubisco de los cloroplastos de la vaina, por lo que el ciclo C4 es más rápido que el ciclo C3. La mayor resistencia a la fuga de los cloroplastos aumentará la concentración de carbono inorgánico en torno a la Rubisco. Para reducir las fugas, el CO2 se puede convertir en
bicarbonato (HCO3+) lo que es una reacción lenta y espontánea (debido a que la anhidrasa carbónica está ausente en los cloroplastos de la vaina), además está conversión podría verse favorecida por un complejo NDH en forma de U que funciona en forma similar a los complejos de cianobacterias. Las proteínas asociadas a NDH en la cadena de aceptores de electrones (marcadas en líneas punteadas) son desconocidas en los cloroplastos de maíz y otras especies como A. thaliana. La oxidasa alternativa de los tilacoides
(PTox) puede servir para reducir el oxígeno molecular directamente y así evitar el exceso de reducción de la cadena de transporte de electrones. Cuatro proteínas del lumen se asocian con el complejo NDH. PGR5 y PGRL1 proporcionan una vía cíclica de flujo de electrones NDH independiente.
Abreviaturas: FNR, ferredoxina reductasa, PC, plastocianina, PQ (H2), plastoquinona o plastoquinol. Tomada de Majeran y van Wijk.
Micrografías electrónicas de células del mesófilo de hojas de plantas de maiz. BS: célula de la vaina, M: célula del mesófilo, Cp: cloroplasto. La escala representa 10 mm (a) y 1 mm (b). Imágenes de Turgeon, Medville y Jung. Tomadas de Majeran y van Wijk.
Figura comparativa C3 y C4. La distribución de las vías fotosintéticas, así como de los transportadores entre la vaina y las células del mesófilo. La característica clave de la fotosíntesis C4 es que la fijación primaria del carbono es llevada a cabo por PEPC (PEP citosólico) usando bicarbonato en lugar de CO2 como sustrato. Además, el producto resultante de la fijación de carbono es OA, un ácido C4, en lugar de 3-PGA, un ácido C3. OAAse reduce en el cloroplasto mesófilo por la malato deshidrogenasa (MDH) de malato (MA), que luego se
exporta a las células de la vaina, donde se descarboxila formando piruvato, CO2 y NADPH. El piruvato se regenera en PEP en los cloroplastos de las células del mesófilo por fosfopiruvato ortofosfato dicinasa (PPDK). Dentro del ciclo de Calvin, la fase reductiva se indica mediante una línea discontinua para subrayar que esto ocurre principalmente en los cloroplastos del mesófilo. Una cantidad citosólica de bicarbonato y de CO2 se mantienen en equilibrio por la expresión específica de la anhidrasa carbónica (AC) del cloroplasto (CPCA), como lo demuestran estudios proteómicos y de actividad. La actividad de PPDK es
regulada por proteínas bifuncionales cinasa / fosfatasa PPDK (PPDK-RP), la proteómica sugiere una interacción estable entre PPDK y PPDK-RP en varios complejos de alto peso molecular. El análisis proteómico comparativo mostró que enzimas específicas del ciclo de Calvin como Rubisco, Rubisco activasa, fructosabisfosfto aldolasa (FBA), fosforilribulokinase (PRK), sedoheptulosa-1 ,7-bisfosfatasa (PAS) y proteínas del cloroplasto de 12 kDa (CP12), están implicadas en el ensamblaje del supercomplejo y en la (in) activación de la PRK y de la gliceraldehído-3-fosfato deshidrogenasa (GAPDH) en los cloroplastos C3; tienen muy altos radios de expresión células de la vaina:mesófilo. Enzimas del Ciclo de Calvin implicadas en la reducción de la triosafosfato (fosfoglicerato cinasa [PGK], GAPDH-A y B y la isomerasa triosafosfato [TPI]) se localizan preferentemente en mesófilo o se distribuyen equitativamente entre la vaina y el mesófilo. Enzimas de la biosíntesis de almidón (almidón sintasa y subunidades de ADPglucosa pirofosforilasa) tienen niveles más altos de acumulación en el paquete de células de la vaina que en las del mesófilo. Se indican diversos transportadores en el interior del cloroplasto (MEP1-4, MEX1, DIT1, DIT2, PPT, PPT*, TPT, AATP1 y ANTR2). PPT* es probablemente una proteína PPT adaptada al metabolismo C4. Los signos de interrogación (para MEP1-4 y PPT *) indican asignaciones provisionales. Las enzimas y las vías enriquecidas en las células del mesófilo se muestran en color azul, mientras que aquellas de las células de la vaina se muestran en rojo. Abreviaturas: FBP, fructosa 1,6-bisfosfatasa, RCA, Rubisco activase; EPR, ribulosa-fosfato 3-epimerasa, RPI, ribosa-5P-isomerasa; TKL, transcetolasa. Tomadas de Majeran y van Wijk.
FOTOSINTESIS EN PROCARIONTES
La fotosíntesis también es realizada por organismos procariontes, bacterias y algas verde-azules. Existen grandes diferencias en el proceso fotosintético realizado por ambos tipos de procariontes. Las algas verde-azules cuentan con un doble sistema de pigmentos muy parecido al de los cloroplastos de plantas superiores, donde sus pigmentos son ficoeritrobilina o ficocianobilina (por eso su color) mientras que las bacterias solo utilizan un fotosistema (parecido al PSII) y sus pigmentos (P870 o P960) son diferentes. Comúnmente las bacterias utilizan otra fuente de electrones distinta al agua, como metano, monóxido de carbono, o donadores inorgánicos como azufre o hidrógeno.
Comparación de los diferentes tipos generales de centros de reacción para procariontes con los fotosistemas, según su análisis por cristalografía de rayos X. Tomado Heinnickel y Golbeck.
ASPECTOS IMPORTANTES PARA LA EVALUACIÓN DE LA FOTOSÍNTESIS
Finalmente, después de describir ampliamente el proceso fotosintético, es importante señalar cuales de estos elementos podrían ser útiles para evaluarlo de forma experimental. De forma sencilla podríamos decir que habría dos formas generales: Evaluar los elementos de entrada a la reacción como son la luz y el CO2 o los de salida como son la producción de carbohidratos o de oxígeno en el caso de plantas superiores. La forma más sencilla usada por muchos años es la gasometría para evaluar el consumo de CO2 o la liberación de O2, también la obtención y cuantificación de los carbohidratos. Para estudios más detallados comenzaron a usarse reacciones que detecten los cambios oxido-reducción en diferentes pasos con cloroplastos o complejos enzimáticos y proteicos aislados. Además se han aislado y caracterizado muchos de las moléculas participantes y con las nuevas técnicas de biología molecular se han logrado mutaciones sitio-específicas que nos han ayudado al mejor entendimiento del proceso. En la actualidad muchos esfuerzos se están realizando especialmente en la transferencia genética o tecnología transgénica para mejorar el rendimiento y calidad de productos en cultivos comerciales.
BIBLIOGRAFIA
Jiménez L., Merchant H. 2003. Biología Celular y Molecular. 1ª Edición. Ed. Pearson Educación. México.
Mathews R., vanHolde K. Bioquímica. 3ra. Edición. Ed. Pearson.
Voet D., Voet J. 2006. Biochemistry. Third edition. Ed. John Wiley & Sons, Inc.
ARTÍCULOS
Telma E. Scarpeci T., Zanor M., Carrillo N., Roeber B., Valle E .2008. Generation of superoxide anion in chloroplasts of Arabidopsis thaliana during active photosynthesis: a focus on rapidly induced genes. Plant Mol Biol 66: 361–378.
Piazza G., Gibbs M .1983. Influence of Adenosine Phosphates and Magnesium on Photosynthesis in Chloroplasts from Peas, Sedum, and Spinach. Plant Physiol 71: 680-687.
Fouad W., Altpeter F .2009. Transplastomic expression of bacterial L-aspartatea-decarboxylase enhances photosynthesis and biomass production in response to high temperature stress. Transgenic Res 18:707–718.
Shuvalov V .2008. New look on the formation and interaction of elementary particles in atoms and molecules including photoreaction centers. Photosynth Res 98: 219–227.
Bjorn L., Papageorgiou G., Blankenship R., Govindjee . 2009. A viewpoint: Why chlorophyll a?. Photosynth Res 99: 85–98.
Hand E. When Earth greened over. Nature 4609: 161.
Manning D., Chen T., Campbell A., Tolbert N., Smith E. 1984. Effects of Chemical Treatments upon Photosynthetic Parameters in Soybean Seedlings Plant Physiol. 76, 1055-1059.
Miller S., Wingard C., Castenholz R. 1998. Effects of Visible Light and UV Radiation on Photosynthesis in a Population of a Hot Spring Cyanobacterium,a Synechococcus sp., Subjected to High-Temperature Stress Applied and Environmental Microbiology 64: 3893–3899.
McLean S., Hunter C. 2009. An enzyme-coupled continuous spectrophotometric assay for magnesium protoporphyrin IX methyltransferases. Analytical Biochemistry: In press.
Mederski H., Streeter J. 1977. Continuous, Automated Acetilene Reduction Assays Using Intact Plants. Plant Physiol 59: 1076-1081.
Chen T., Brown R., Black C .1971. Related to Photosynthesis in Bermudagrass and Other Plants. Photosynthetic 14CO2 Fixation Products and Activities of Enzymes. Plant Physiol 47: 199-203.
Carpentier R., Larue B., Leblanc R. 1984. Photoacoustic Spectroscopy of Anacystis nidulans. III. Detection of Photosynthetic Activities. Archives of Biochemistry and Biophysics 228: 534-543.
Arigita L., Gonzalez A., Tame´s R. 2002. Influence of CO2 and sucrose on photosynthesis and transpiration of Actinidia deliciosa explants cultured in vitro. Physiologia Plantarum 115: 166–173.
Amunts A., Nelson N. 2009. Plant Photosystem I Design in the Light of Evolution. Structure 17: 637-650.
Fry K. 1970. Some Factors Affecting the Hill Reaction Activity in Cotton Chloroplasts. Plant Physiol 45: 465-469.
Arnon D. 1971. The Light Reactions of Photosynthesis Proc. Nat. Acad. Sci 68: 2883-2892.
Medina M. 2009. Structural and mechanistic aspects of flavoproteins: photosynthetic electron transfer from photosystem I to NADP+. FEBS Journal 276: 3942–3958.
Majeran W. van Wijk K. Cell-type-specific differentiation of chloroplasts in C4 plants. Trends in Plant Science 14: 100-109.
Heinnickel M., Golbeck J.2007. Heliobacterial photosynthesis. Photosynth Res 92:35–53.
Ohashi S., Miyashita H., Okada N., Lemura T., Watanabe T., Kobayash M. 2008. Unique photosystems in Acaryochloris marina. Photosynth Res 98:141–149.
Charles S., Halliwell B. 1981. Light activation of fructose bisphosphatase in photosynthetically competent pea chloroplasts. Biochem J 200: 357-363.
Hillmer P., Gest H. 1977. H2 Metabolism in the Photosynthetic Bacterium Rhodopseudomonas capsulata: Production and Utilization of H2 by Resting Cells. Journal of Bacteriology 129: 732-739.
Zeinalov Y. 2006. A brief history of the investigations on photosynthesis in Bulgaria. Photosynth Res 88: 195–204.
Knauth L., Kennedy M. 2009. The late Precambrian greening of the Earth. Nature 460: 728-732.
Anderson J., Chow W., De Las Rivas J. 2008. Dynamic flexibility in the structure and function of photosystem II in higher plant thylakoid membranes: the grana enigma. Photosynth Res 98:575–587.
Monson R., Stidham M., Williams III G., Edwards G., Uribe E. 1982. Temperature Dependence of Photosynthesis in Agropyron smithii Rydb. Factors affecting net CO2 uptake in intact leaves and contribution from ribulose 1,5-bisphosphate carboxylase measured in vivo and in vitro. Plant physiol 69: 921-928.
Roughan P., Holland R., Slack R. 1979. On the Control of Long-Chain-Fatty Acid Synthesis in Isolated Intact Spinach (Spinacia oleracea) Chloroplasts. Biochem. J 184: 193-202.
Schlodder E. 2009. Introduction to optical methods in photosynthesis. Photosynth Res 101: 93–104.
Crawford N., Yee B., Hutcheson S., Wolosiuk R., Buchanan B. 1986. Enzyme Regulation in C4 Photosynthesis: Purification, Properties, and Activities of Thioredoxins from C4 and C3 Plants. Archives of biochemistry and biophysics 244: l-15.
Murata N. 2009. The discovery of state transitions in photosynthesis 40 years ago. Photosynth Res 99: 155–160.
Gest H. 2002.Definition of photosynthesis History of the word photosynthesis and evolution of its definition.Photosynthesis Research73: 7–10.
Fuente del documento : http://bio-scientist.wikispaces.com/file/view/APUNTES+FOTOSINTESIS.doc
Sitio para visitar: http://bio-scientist.wikispaces.com/
Autor del texto: no especificado en el documento de origen o se indique en el texto
Palabras clave de Google: Fotosintesis resumen y tema Tipo de Archivo: doc
Si usted es el autor del texto anterior y se compromete a no compartir sus conocimientos para la enseñanza, la investigación, la erudición (para uso razonable como indicato en los Estados Unidos copyrigh bajo "for fair use as indicated in the United States copyrigh low"), por favor envíenos un e-mail, y procederemos a eliminar el texto rápidamente.
Fotosintesis resumen y tema
![]()
Si desea acceder rápidamente a páginas relacionadas con un tema específico, como Fotosintesis resumen y tema utilizar el motor de búsqueda siguiente:
Visite la página principal
Fotosintesis resumen y tema
Condiciones generales de "uso y aviso legal
Este sitio no es una agencia de noticias que se actualiza sin ningún tipo de periodicidad, únicamente sobre la base de la disponibilidad del material, por lo que no es un producto sujeto a la disciplina editorial en el arte. 1, párrafo III de la Ley no. 62 de 07.03.2001. Los resúmenes, notas, letras de canciones y citas contenidas en este sitio están disponibles de forma gratuita a los estudiantes, investigadores, profesores, técnicos ilustrativos con fines educativos y científicos con el concepto de uso justo y con miras al cumplimiento de la Directiva Europea 2001/29 / CE y del Derecho. Artículo 633. Dlg 70 y 68. El sitio está dirigido y coordinado por el autor únicamente con fines informativos y educativos. Si bien creemos que las fuentes utilizadas fiable, el autor de este sitio no puede garantizar la exactitud e integridad de la información y por lo tanto se exime de cualquier responsabilidad derivada de los problemas o daños causados por errores u omisiones, si tales errores u omisiones resultantes de negligencia , accidente u otra causa. Todas las notas, citas de los textos e imágenes son propiedad de sus respectivos autores o estudios que poseen los derechos, si los beneficiarios se consideraron dañados por la inclusión de los archivos anteriores en este sitio o se habían introducido inadvertidamente imágenes, información, texto o material con derechos será retirado de inmediato, y / o se hará referencia a las fuentes de la simple advertencia y 'e-mail en la página de contacto.
Los objetivos de este sitio son los avances de la ciencia y las artes útiles porque pensamos que son muy importantes para nuestro país los beneficios sociales y culturales de la libre difusión de la información. Toda la información e imágenes en este sitio se utilizan aquí únicamente con fines educativos, cognitivos e informativos. La información en la medicina y la salud en este sitio es de carácter general y para propósitos informativos solamente y por lo tanto no puede sustituir en ningún caso el consejo de un médico (o una persona legalmente autorizada para la profesión). En este sitio hemos hecho todo lo posible para garantizar la exactitud de herramientas, calculadoras e información, no podemos hacer una garantía ni se hace responsable de los errores que se han hecho, los textos utilizados fueron tomados de los sitios que han puesto en disponible de forma gratuita para darlas a conocer en la web con fines educativos. Si usted encuentra un error en esta página web, o si tiene un texto o herramienta que pueda violar las leyes aplicables de derechos de autor, por favor notifique a nosotros por e-mail y rápidamente lo eliminará.
Para más información importante acerca de los términos de "el uso del sitio y leer las políticas de privacidad cuidadosamente el texto en el siguiente enlace (en italiano):
