I silicati
I silicati
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
I silicati
I MINERALI SILICATICI
I silicati sono i minerali più abbondanti nella crosta terrestre e sono caratterizzati dalla presenza dello ione silicato (SiO4)4-, che rappresenta l'unità fondamentale del reticolo cristallino di questi composti.
Lo ione silicato ha una struttura tetraedrica, all’interno della quale ogni ione silicio Si4+ coordina 4 ioni O2-
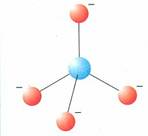
Lo ione silicio si trova al centro del tetraedro, mentre ai vertici sono collocati i 4 ioni ossigeno. Siccome lo ione silicato non è elettricamente neutro (possiede 4 cariche negative in eccesso, una per ogni atomo di ossigeno) il tetraedro può raggiungere la neutralità in tre modi:
- legandosi unicamente a cationi metallici, per cui i singoli tetraedri rimangono isolati non condividendo nessun atomo di ossigeno
- legandosi in parte a cationi metallici e in parte mettendo in comune gli atomi di ossigeno con tetraedri adiacenti; in questo caso, che è il più diffuso, se aumenta il numero di atomi di ossigeno condivisi, diminuisce quello degli ioni positivi che entrano nella struttura del minerale
- unicamente mettendo in comune tutti gli atomi di ossigeno con i tetraedri adiacenti (tettosilicati).
La classificazione all'interno del gruppo dei silicati non è di tipo chimico ma strutturale, in quanto dipende dal modo in cui i tetraedri si uniscono tra loro.
CLASSIFICAZIONE DEI MINERALI SILICATI
NESOSILICATI (silicati isolati)
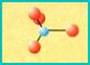
Nei nesosilicati i gruppi tetraedrici sono isolati. Le cariche negative dello ione silicato sono saturate da ioni metallici. Presentano generalmente durezza e peso specifico elevati. Esempio di nesosilicati sono le olivine, miscele di minerali con formula generale (Mg,Fe)SiO4. I cationi metallici che saturano le cariche negative sono di Magnesio o di Ferro.
 Forsterite (Mg2SiO4)
Forsterite (Mg2SiO4)
 OLIVINE
OLIVINE
Fayalite (Fe2SiO4)
SOROSILICATI (coppie di tetraedri)
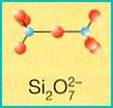
Sono costituiti da due tetraedri uniti per un vertice a formare un gruppo (Si2O7)6-. Le sei cariche negative sono bilanciate da cationi metallici. I rappresentanti più diffusi sono gli epidoti e la vesuviana, composti a formula complessa in cui troviamo vari cationi (Al, Ca, Mg ecc.), talora vicarianti tra loro (l’uno sostituisce l’altro).
CICLOSILICATI (tetraedri ad anello)
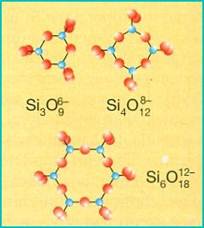
I ciclosilicati sono costituiti da anelli formati da 3, 4, 6 tetraedri, ognuno dei quali condivide 2 atomi di ossigeno con tetraedri dello stesso anello. Nella struttura gli anelli risultano sovrapposti l'uno sull'altro dando origine a cristalli di forma prismatica. Un esempio di ciclosilicato a 6 tetraedri è il berillo Be3Al2(Si6O18) una pietra preziosa che si presenta nelle varietà verde (smeraldo) e azzurra (acquamarina).
INOSILICATI: (tetraedri a catena)
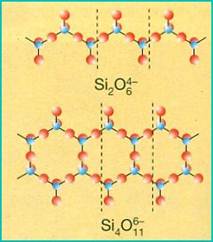
Negli inosilicati i tetraedri sono uniti tra loro a formare catene lineari indefinite; questa disposizione può essere di due tipi: semplice o doppia.
- Nel primo caso abbiamo i pirosseni: ogni tetraedro condivide due atomi di ossigeno con due tetraedri adiacenti;
- nel secondo caso abbiamo gli anfiboli: i tetraedri condividono alternativamente due o tre atomi di ossigeno.
Prevalgono forme allungate e fibrose di cristalli, in quanto i legami sono molto saldi all'interno delle catene e piuttosto deboli tra catene adiacenti.
FILLOSILICATI (piani di tetraedri)
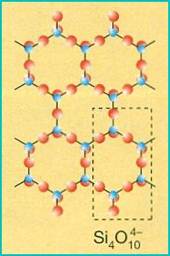
Nei fillosilicati un tetraedro condivide tre atomi di ossigeno con altrettanti tetraedri adiacenti a formare dei piani di esagoni; per questo motivo gli abiti dei cristalli sono lamellari e fogliacei con facile sfaldatura parallela ai piani. Il gruppo anionico che li caratterizza (Si4O10)4-, viene neutralizzato, tra un piano e l'altro, da quattro cariche positive fomite dai più comuni cationi metallici.
Le miche sono i minerali più rappresentativi del gruppo: tra esse ricordiamo la mica nera (biotite), contenente Ferro e Magnesio, e la mica bianca (muscovite), contenente Alluminio, nelle quali è molto accentuato il fenomeno della sfaldatura in sottili lamine parallele.
Sono silicati di questo tipo anche il talco ed i minerali argillosi (caolinite) che non si presentano mai in grossi cristalli, ma in masse porosa con struttura microcristallina o amorfa.
TECTOSILICATI (rete tridimensionale di tetraedri)
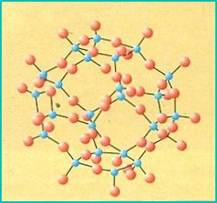
Nei tectosilicati i quattro atomi di ossigeno del tetraedro sono in comune fra tetraedri vicini, in modo che ogni atomo di ossigeno è legato a due atomi di silicio. La struttura che si forma è tridimensionale, continua e indefinita. In questo modo si genera un minerale molto diffuso nelle rocce della crosta terrestre continentale, il quarzo (SiO2).
L'alluminio può sostituire atomi di silicio all'interno dell'impalcatura tridimensionale, formando composti che sono definiti alluminosilicati:
la sostituzione di uno ione Si4+ con uno ione Al3+ permette l'inserimento nell'impalcatura cristallina di vari tipi di cationi monovalenti K+ o Na+ ; la sostituzione, invece, di due ioni Si4+ con due ioni Al3+, permette l’inserimento di cationi bivalenti come il Ca2+ .
Il gruppo di alluminosilicati che si ottiene costituisce i feldspati: feldspato potassico (ortoclasio), feldspato sodico (albite) ed il feldspato calcico (anortite).
L’albite e l’anortite sono isomorfi e per questo vengono riuniti nella serie (di feldspati) denominata plagioclasi (anortite = plagioclasio calcico, albite = plagioclasio sodico).
I feldspatoidi (simili ai feldspati) sono, invece, una classe di alluminosilicati che contiene, un minore numero di atomi di silicio rispetto ai feldspati.
Ritornando, infine, al quarzo (SiO2), si deve sottolineare che esso è l’unico tectosilicato che non presenta atomi di silicio sostituiti.
Ortoclasio (KAlSi3O8)

 AlSi3O8)
AlSi3O8)
 Plagioclasi
Plagioclasi
 Al2Si2O8)
Al2Si2O8)
Fonte: http://www.istitutovescovilenola.it/didattica/deangelis/appunti/geografia/I%20Minerali%20Silicatici.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : I silicati tipo file : doc
I silicati
Visita la nostra pagina principale
I silicati
Termini d' uso e privacy