Tabella calore specifico materiali
Tabella calore specifico materiali
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Misura del calore specifico di un corpo
Argomento
Il calore specifico di un corpo è una costante che dipende solo dalla sostanza di cui è costituito il corpo. Quantitativamente esso è espresso dalla formula:

Il calore specifico è il rapporto tra la quantità di calore scambiata da un corpo conseguentemente ad una variazione di temperatura (t) e il prodotto della massa per la variazione della temperatura.
Per le misure del calore specifico si usa il calorimetro, un recipiente costituito da materiali che minimizzano gli scambi di calore con l'ambiente esterno.
 Materiale occorrente
Materiale occorrente
- 300 cc di acqua
- 1 fornello
- 1 reticella amiantata
- 1 cilindro graduato da 100 cc
- 1 calorimetro con agitatore, coperchio
- 1 termometro da 0 a +110C, con sensibilità 0,1°C
- 1 termometro da 0° a 50 °C con sensibilità 0,1C
- 1 bicchiere da 400 cc circa
- campioni di ferro, ottone, alluminio, PVC
- 1 campione di vetro
- 1 pinza
- 1 cordicella
- bilancia
- calcolatrice
Esecuzione dell'esperimento
Nel corso dell'esperienza faremo riferimento alle figure precedenti.
1. Con una bilancia misuriamo la massa del campione mc = ............ .
2. Servendoci di una cordicella introduciamo il campione di ………………. nel bicchiere ove si trovi l’acqua e mettiamo a scaldare l'acqua con il campione e il termometro sul fornello. Lasciamo bollire l'acqua per un po' di tempo in modo che acqua, termometro e campione abbiano la stessa temperatura t2= .......... (intorno ai 100 C).
3. Nel frattempo, facendo uso del cilindro graduato, introduciamo nel calorimetro una massa ma = 100 g di acqua a temperatura ambiente e facciamo stabilizzare la temperatura dell'acqua e del calorimetro. Prendiamo nota di questa temperatura t1 = ............ .
4. Servendoci ancora della cordicella immergiamo rapidamente il campione tolto dall'acqua bollente nel calorimetro, richiudiamolo con il coperchio e mescoliamo con l'agitatore. Aspettiamo un paio di minuti, poi misuriamo la nuova temperatura di equilibrio te.
Se abbiamo avuto cura di chiudere bene il coperchio del calorimetro possiamo affermare che tutto il calore perso dal corpo è stato assorbito dall'acqua, quindi usando la relazione fondamentale della termologia Q = c m t, possiamo scrivere:
Q1 = 1 ma (te – t1) per il calore assorbito dall'acqua
Q2 = c mc (t2 – te) per il calore ceduto dal corpo
dove 1 cal/g C è il calore specifico dell'acqua e c quello incognito del corpo. Per quanto prima detto Q1 = Q2 e pertanto possiamo scrivere:
c mc(t2 – te ) = 1 ma (te – t1)
dalla quale possiamo ricavare il calore specifico incognito c del corpo:
 .
.
L'ultima formula è vera solo approssimativamente in quanto non si è tenuto conto che parte del calore perso dal corpo viene assorbito dal calorimetro, dal termometro e dall'agitatore. Per tener conto di questo fenomeno si osserva che tutto avviene come se inizialmente l'acqua avesse una massa ma+me dove il termine me viene definito equivalente in acqua del calorimetro Per i calorimetri in uso me= ……
In conclusione la formula corretta da applicare per il calcolo di c è :
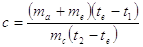 .
.
Per comodità riportiamo in ordine le grandezze misurate:
ma=.............. (massa dell'acqua)
mc = .............. (massa del campione)
me= ……… g (equivalente in acqua del calorimetro)
t1 = .............. (temperatura di equilibrio iniziale dell'acqua contenuta nel calorimetro)
t2 = .............. (temperatura del campione prima dell'immersione nel calorimetro)
te = .............. (temperatura finale di equilibrio tra acqua e campione immerso nel calorimetro)
c = .................................................................................................................................................……
Con gli strumenti a disposizione l'errore assoluto sulla misura del calore specifico deve essere in entrambi casi inferiore a 0,01 cal/ g C. Confrontare quindi i valori trovati con quelli riportati nella seguente tabella. C'è accordo tra le misure entro l'errore previsto? ...............
Sostanza |
Calore specifico (cal/g °C) |
Calore specifico trovato (cal/g °C) |
Ferro |
0,11 |
|
Alluminio |
0,21 |
|
Ottone |
0,09 |
|
PVC |
? |
|
Fonte: http://www.rtl.mcastelvi.ss.it/Esperienze%20non%20RTL/Scheda%20calore%20specifico.doc
autore del testo non indicato nel documento di origine del testo
Calore specifico di alcune comuni sostanze
Sostanza |
Stato |
Calore specifico |
Alluminio |
solido |
880 |
Acciaio inox |
solido |
502 |
Acqua |
liquido |
4186 |
Acqua (Ghiaccio) |
solido (0 °C) |
2260 |
Aria (secca) |
gassoso |
1005 |
Aria (100% umidità relativa) |
gassoso |
~ 1030 |
Azoto |
gassoso |
1042 |
Berillio |
solido |
1824 |
Diamante |
solido |
502 |
Elio |
gassoso |
5190 |
Etanolo |
liquido |
2460 |
Ferro |
solido |
444 |
Grafite |
solido |
720 |
Idrogeno |
gassoso |
25000 |
Litio |
solido |
3582 |
Mercurio |
liquido |
139 |
Olio |
liquido |
~ 2000 |
Ossigeno |
gassoso |
920 |
Oro |
solido |
129 |
Ottone |
solido |
378 |
Piombo |
solido |
130 |
Polistirene |
solido |
1450 |
Rame |
solido |
385 |
Silice (fuso) |
solido |
703 |
Silice |
gassoso |
2020 |
Zinco |
solido |
388 |
Condizioni standard (salvo diversa indicazione). |
||
fonte: http://it.wikipedia.org/wiki/Calore_specifico
CALORE E TEMPERATURA
La temperatura e la sua misura
Tutti conosciamo il concetto di temperatura e lo adoperiamo nella vita di tutti i giorni (la temperatura dell’aria, la temperatura dell’acqua della doccia, la temperatura corporea ecc.); anche noi lo abbiamo già incontrato, parlando dei passaggi di stato e delle leggi dei gas. Risulta tuttavia difficile darne una definizione: abbiamo già cercato di farlo nel corso dell’anno passato e quest’anno cercheremo di approfondire ed affinare le nostre conoscenze in materia. Poiché ognuno di noi avverte sensazioni di caldo e di freddo, potremmo intuitivamente definire la temperatura come un indice dello stato termico di un corpo. Tuttavia, per passare ad una definizione scientifica, potremmo iniziare a dare una definizione operativa della grandezza, indicando il modo in cui è possibile misurarla; a questo fine è necessario disporre di uno strumento di misura. Come sappiamo, i nostri sensi non sono di grande aiuto nella misura della temperatura; (ricordate l’esperienza delle bacinelle?); spesso infatti tra le persone c’è disaccordo sulla temperatura, ad esempio, dell’aria di un ambiente.
Per misurare realmente la temperatura dobbiamo utilizzare qualche fenomeno ad essa collegato ed in verità esistono molte proprietà fisiche che variano quando varia la nostra percezione fisiologica di temperatura. Tra queste possiamo citare il volume di un liquido, la lunghezza di una sbarra, la pressione di un gas mantenuto a volume costante, il volume di un gas mantenuto a pressione costante, il colore del filamento di una lampada o la resistenza elettrica di un filo. Una qualunque di queste proprietà può essere utilizzata per costruire un termometro, ovvero uno strumento per misurare la temperatura. I termometri che utilizziamo normalmente sono termometri a liquido. Essi si basano sul fatto che all’aumentare della temperatura i corpi si dilatano e sono costituiti da un tubicino di vetro riempito di un liquido (spesso mercurio) che, al crescere della temperatura, aumenta il proprio volume salendo. Essi devono essere tarati, scegliendo due temperature di riferimento, in modo tale che le tacche al loro interno corrispondano a multipli di una unità di misura della temperatura da definire.
Tale unità di misura venne fissata nel 1742 dall’astronomo svedese Anders Celsius, il quale pose arbitrariamente pari a 0°C la temperatura del ghiaccio in fusione ed a 100 °C la temperatura dell’acqua in ebollizione (da ricordare che durante i passaggi di stato la temperatura del sistema non varia); dividendo tale intervallo in 100 parti definì infine il grado centigrado o grado Celsius (°C) .
Una definizione operativa di temperatura potrebbe allora essere la seguente: si definisce temperatura la grandezza fisica che indica lo stato termico di un corpo e si misura mediante il termometro, ad esempio centigrado.

Fonte: http://www.liceodavincifi.it/_Rainbow/Documents/CALORE%20E%20TEMPERATURA.doc
Autore del testo: non indicato nel documento di origine
Tabella calore specifico materiali
Tabella I: tabella dei calori specifici (espressi in Cal/Kg°C) |
|||||||
Alluminio |
0.214 |
Amianto |
0.195 |
Argento |
0.056 |
Costantana |
0.098 |
Vetro Crown |
0.161 |
Ferro |
0.115 |
Vetro Flint |
0.117 |
Nichel |
0.108 |
Oro |
0.031 |
Ottone, Bronzo |
0.090 |
Piombo |
0.031 |
Platino |
0.032 |
Rame |
0.093 |
Stagno |
0.057 |
Zinco |
0.095 |
Acetone |
0.53 |
Acido Solforico |
0.33 |
Acqua |
0.999 |
Alcool etilico |
0.573 |
Glicerina |
0.58 |
Mercurio |
0.033 |
Benzolo, Benzina |
0.41 |
Olio d'oliva |
0.47 |
Petrolio |
0.51 |
Autore del testo: non indicato nel documento di origine
Tabella calore specifico materiali
Visita la nostra pagina principale
Tabella calore specifico materiali
Termini d' uso e privacy