Tavola periodica degli elementi completa da stampare
Tavola periodica degli elementi completa da stampare
TAVOLA PERIODICA E NOMENCLATURA
I NOMI E I SIMBOLI DEGLI ELEMENTI
Sono noti 109 elementi che differiscono per i diversi rapporti in cui si presentano elettroni, protoni e neutroni. A rendere diversi gli atomi di questi elementi è la diversa combinazione delle stesse tre particelle subatomiche che li costituiscono. Ogni elemento ha un preciso numero atomico e un preciso numero di massa. Ogni elemento ha una precisa massa che può essere espressa in grammi o uma. Ogni elemento può essere rappresentato nel modo seguente: ₁H PROTIO
Numero di massa A , Numero atomico Z
LA TAVOLA PERIODICA
I 109 elementi esistenti sono elencati secondo una particolare disposizione detta tavola periodica.
La posizione di un elemento nella tavola permette di prevedere le sue proprietà e il genere di composti cui può dare origine. Poiché la periodicità degli elementi riflette la periodicità delle loro configurazioni, Mendeleev scoprì lo schema delle configurazioni senza conoscere nulla circa la struttura degli atomi. Il grande intuito chimico di Mendeleev lo indusse a lasciare nello schema da lui proposto delle caselle vuote che dovevano accogliere elementi sconosciuti, ma necessari. Elementi con analoga disposizione negli strati più esterni mostrano proprietà chimiche simili. Il numero del periodo corrisponde al numero quantico principale del guscio più esterno occupato. Il numero del gruppo corrisponde al numero totale di elettroni del guscio più esterno occupato.
PERIODICITA’ DELLE PROPRIETA’ FISICHE
Energia di ionizzazione Affinita’ elettronica Comportamento
Bassa bassa forma cationi
Alta alta forma anioni
Elettronegatività = affinità elettronica + energia di ionizzazione
Elettronegatività bassa→ forma cationi
Elettronegatività alta → forma anioni
- I membri del blocco s sono i meno elettronegativi
- Il fluoro i membri dei gruppi VI e VII sono i più elettronegativi
- L’elettronegatività rappresenta una guida molto utile al tipo di composti che un elemento può formare
ANDAMENTO DELLE PROPRIETA’ CHIMICHE
- Gli elementi del blocco s:
- Sono metalli grigio argentei
- Gli elementi del I gruppo formano facilmente ioni E+
- Gli elementi del II gruppo formano facilmente ioni E2+
Relazioni diagonali: sono similitudini tra elementi adiacenti in diagonale nella tavola periodica
E’ una diagonale quella che divide i metalli dai non metalli!
Nel blocco s questa relazione sussiste tra Li e Mg e tra Be e Al.
- Gli elementi del blocco p:
- Gli elementi a sinistra della diagonale hanno energie di ionizzazione sufficientemente basse da presentare alcune delle caratteristiche metalliche degli elementi del blocco s
- Le energie di ionizzazione però sono piuttosto alte e quindi sono meno reattivi degli elementi del blocco s
- Gli elementi a destra della diagonale hanno la capacità di acquistare elettroni in modo da completare il livello elettronico esterno, quindi sono tipici non metalli
- Gli elementi del blocco d:
- Sono tutti metalli
- Quelli più a sinistra somigliano agli elementi del blocco s
- Quelli più a destra somigliano agli elementi del blocco p
- Le loro proprietà sono intermedie o di transizione tra quelle del blocco s e p
- Una loro peculiarità è quella di formare più cationi di carica differente
DALLE FORMULE ALLE REAZIONI CHIMICHE
Per capirsi e comunicare fra di loro, gli scienziati hanno sviluppato dei simboli appropriati per descrivere la natura microscopica della materia. I simboli degli elementi come oggi li conosciamo furono introdotti da Berzelius nel 1813.
La maggior parte dei composti ionici è formata da metalli combinati con non metalli (NaCl, MgO, Al2O3)
Gran parte dei composti molecolari deriva dalla combinazione di due o più elementi non metallici (CO2, NH3)
- La valenza rappresenta la capacità di combinazione di un elemento, dipende dal numero di elettroni più esterni detti appunto elettroni di valenza.
- La carica positiva o negativa degli ioni monoatomici è nota come numero di ossidazione
- In generale, i non metalli si trasformano in anioni mentre i metalli in cationi
Per i composti ionici:
- La formula chimica indica il numero relativo di atomi di ciascun elemento nel composto. Nel cloruro di sodio vi è uno ione Na+ per ogni ione Cl-
- Quando è necessario aggiungere un pedice ad uno ione poliatomico, lo ione deve essere scritto tra parentesi. (Es (NH4)2CO3
- Determinare il numero relativo dei cationi e degli anioni in un composto ionico è semplice, una volta che siano note le cariche degli ioni presenti
- Un’unità formula è un gruppo di ioni che coincide con la formula del composto
- Il peso formula (PF) di un composto ionico è la massa di un’unità formula
- Il peso formula si ricava come il peso molecolare
- PF (MgCl2) = 2 x PA (Cl) + PA (Mg)
Ricordiamo che esistono degli elementi che però esistono come molecole. Esempi sono l’idrogeno e l’ossigeno gassosi.
- Si definisce peso molecolare (PM) di un composto la massa media di una delle sue molecole.
- PM (NH3) = 3 x PA (H) + PA (N)
Per i composti molecolari:
- Una formula molecolare è una combinazione di simboli chimici e di pedici che indicano il tipo e il numero di atomi di ciascun elemento presente in una molecola.
- Una molecola biatomica è una molecola formata da due soli atomi.
- Una molecola poliatomica è una molecola formata da più di due atomi.
Molti composti hanno almeno due nomi
- Il nome comune non ha nulla a che vedere con la composizione del composto.
- Il nome sistematico indica quali elementi sono presenti e, talvolta, anche la disposizione degli atomi nel composto e viene definito in base a precise regole
Tradizionalmente viene fatta una distinzione tra i composti organici e i composti inorganici.
- I composti organici sono composti che contengono il carbonio e, di solito, l’idrogeno. Sono così chiamati perché si pensava erroneamente che potessero essere formati soltanto dagli organismi viventi.
- Tutti gli altri sono classificati come composti inorganici
In generale, quando si deve scrivere una formula:
- la parte iniziale è costituita dall’elemento più metallico o da un catione.
- la seconda parte è costituita da un elemento non metallico o da un anione.
- Ci sono tuttavia dei composti in cui sia la prima che la seconda parte sono costituite da non metalli.
- Quando, invece, si deve leggere la formula, il metallo si nomina per ultimo .
Per poter scrivere correttamente le formule occorre rispettare anche altre semplici regole:
- La somma delle valenze degli atomi metallici o assimilabili deve essere uguale e di segno opposto a quella degli elementi non metallici scritti a destra nel composto.
- Se le valenze sono diverse il metodo più veloce per arrivare alla formula è quello di usare la valenza del metallo come pedice del non metallo e viceversa (se gl’indici hanno un divisore comune la formula si semplifica).
- Un altro metodo consiste nel calcolo del minimo comune multiplo fra i numeri di ossidazione.
COME SI LEGGONO LE FORMULE
- La nomenclatura IUPAC usa dei prefissi che si riferiscono al numero di atomi che formano la molecola.
- La nomenclatura di Stock prevede l’indicazione della valenza dello ione metallico scritta tra parentesi a numero romano (non si usa nei composti formati da non metalli) .
- La nomenclatura tradizionale usa dei suffissi che si riferiscono al numero di ossidazione dello ione metallico: -oso per il numero di ossidazione più basso; -ico per il numero di ossidazione più alto.
COMPOSTI BINARI
I composti binari di tipo ionico sono costituiti da un catione metallico che si scrive sempre per primo e da un anione non metallico : Idruri, alogenuri, solfuri, ossidi basici
I composti binari di tipo molecolare sono costituiti da non metalli : ossidi acidi, idracidi
Gli idruri sono formati da cationi metallici e dallo ione H-
Gli alogenuri sono formati da cationi metallici e dagli ione negativi formati dagli elementi del gruppo VIIA (gli alogeni)
I solfuri sono formati da cationi metallici e dallo ione S2-
Gli ioni monoatomici negativi sono denominati aggiungendo il suffisso –uro al nome del non metallo
H- idruro, Cl- cloruro, I- ioduro……………………………………….
Nella denominazione di questi composti il nome dello ione positivo segue quello dell’anione
FeCl2
Nomenclatura IUPAC Di Stock Tradizionale
Dicloruro di ferro Cloruro di ferro(II) Cloruro ferroso
FeCl3
Tricloruro di ferro Cloruro di ferro (III) Cloruro ferrico
GLI OSSIDI
Sono composti formati dall’ossigeno con altri elementi della tavola periodica. Essi rappresentano un’importante classe di minerali . Si possono suddividere in due classi:
- Ossidi basici
- Ossidi acidi o anidridi
- Gli ossidi basici sono composti di tipo ionico , formati prevalentemente da ossigeno e da un metallo, reagendo con acqua danno i corrispondenti idrossidi che hanno reazione basica e sono caratterizzati dal gruppo ossidrile (OH): MeO + H2O → MeOH
Gli ossidi dei metalli di transizione e quelli di Al, Sn e Pb praticamente non reagiscono con l’acqua.
Esempi:
Li+ + O2- → Li2O
Al3+ + O2- → Al2O3
COME SI LEGGONO PbO2
IUPAC Stock Tradizionale
Diossido di Piombo Ossido di Piombo (IV) Ossido piombico
Alcuni metalli del gruppo IA, reagendo con O2 producono perossidi e superossidi :
Na2O2 perossido di sodio, H2O2 perossido di idrogeno KO2 superossido di potassio
- OSSIDI ACIDI…..Sono composti di tipo molecolare chiamati anche anidridi
- Sono formati prevalentemente da ossigeno e da un non metallo , reagendo con acqua danno i corrispondenti ossiacidi che hanno reazione acida NMeO + H2O→ HNMeO
-
Si ottengono per reazione diretta dei non metalli con l’ossigeno ad eccezione di quelli del cloro .
CO2
IUPAC diossido di carbonio TRADIZIONALE Anidride carbonica
Cl2O ossido di dicloro anidride ipo-clor-osa
Cl2O3 triossido di dicloro anidride clor-osa
Cl2O5 pentossido di dicloro anidride clor-ica
Cl2O7 eptossido di dicloro anidride per-clor-ica
GLI IDRACIDI
Sono composti binari di tipo molecolare che contengono atomi di idrogeno legati a non metalli . Gli unici radicali non metallici che si uniscono ad atomi di idrogeno sono: F⁻, Cl⁻, Br⁻, I⁻, S2⁻ ;HF, HCl, HBr, HI, H2S
Gli idracidi in soluzione acquosa si denominano aggiungendo il suffisso –idrico al nome del non metallo e facendolo precedere dalla dicitura acido ............................ACIDO CLORIDRICO
COMPOSTI TERNARI
Sono formati da 3 diverse specie di atomi:
- Idrossidi, composti ionici formati da un metallo e lo ione OH- (ossido basico+ acqua)
- Ossiacidi, composti molecolari formati da non metalli (ossido acido + acqua)
Fe(OH)3 triidrossido di ferro, idrossido di ferro(III), idrossido ferrico
H2SO4 acido tetraossosolforico (VI), acido solforico
Alcune anidridi possono reagire con l’acqua con modalità diverse:
P2O5 + H2O → 2HPO3 acido meta fosforico
P2O5 + 2H2O → H4P2O7 acido pirofosforico
P2O5 + 3H2O → H3PO4 acido orto fosforico
I SALI……………..sono composti ionici
Si possono preparare in tanti modi, ma la reazione più tipica è quella tra idrossido ed ossiacido:
H2SO3 + 2NaOH → Na2SO4 + H2O solfato di sodio
Nomenclatura tradizionale……..oso→ ito ico→ ato idrico→uro
Pb2+ CO32- → PbCO3 carbonato piomboso
Gli anioni che contengono atomi di idrogeno sono chiamati: HCO3- bicarbonato, HPO42- Idrogeno fosfato
fonte: http://www.lilybaeumtest.it/res/site58982/res409003_I-NOMI-E-I-SIMBOLI-DEGLI-ELEMENTI.doc
Tavola periodica degli elementi pdf

fonte: http://baciabbracci.forumcommunity.net/?t=14861622
Tavola periodica degli elementi completa da stampare
IL SISTEMA PERIODICO
La tavola periodica
Gli elementi chimici attualmente conosciuti sono 109, dei quali 92 sono presenti in natura, mentre i rimanenti sono stati preparati artificialmente a partire dalla fine degli anni ’30 del secolo scorso. Tra gli elementi naturali, nove (oro, argento, rame, ferro, piombo, stagno, mercurio, zolfo e carbonio) erano conosciuti fino dall’antichità, mentre altri cinque (arsenico, antimonio, bismuto, fosforo e zinco) vennero scoperti dagli alchimisti durante il medioevo. Nel corso del XVIII° secolo vennero scoperti alcuni importanti elementi gassosi (azoto, ossigeno, idrogeno e cloro), nonché diversi metalli ( tra cui platino, nichel, manganese, uranio, cromo e titanio); all’inizio del XIX° secolo poi, grazie all’impiego dell’elettrolisi, vennero scoperti altri sei importanti elementi metallici (potassio, sodio, calcio, magnesio, bario e stronzio). Nel corso di tutta la prima metà dell’800 le scoperte si susseguirono numerose , per cui intorno al 1850 si conoscevano circa 50 elementi, ciascuno dei quali possedeva caratteristiche proprie. I chimici dell’epoca cominciarono quindi a chiedersi perché fossero così tanti e quanti ancora restassero da scoprire; allo stesso tempo sorse l’esigenza di mettere ordine, cercando di classificare gli elementi stessi in base ad un qualche principio. Il primo criterio utilizzato fu quello del peso atomico , ma per tale via si ottennero classificazioni di utilità limitata. Risultati più interessanti si ottennero invece raggruppando gli elementi in base a proprietà chimiche simili, come fece nel 1869 il chimico russo Dimitri I. Mendeleev (1834 – 1907), il quale ordinò gli elementi allora conosciuti in una tabella formata da righe orizzontali, chiamate periodi, e colonne verticali dette gruppi. Successivamente alla scoperta dei numeri atomici , tale classificazione fu quindi perfezionata ed i vari elementi vennero classificati secondo il numero atomico crescente: si arrivò in questo modo alla moderna tavola periodica degli elementi.

All’interno di ogni periodo , spostandosi verso destra, il numero atomico degli elementi cresce di una unità alla volta; tutti gli elementi appartenenti ad un medesimo periodo hanno inoltre gli elettroni più esterni nello stesso livello energetico, il cui numero quantico principale corrisponde al numero del periodo stesso. Così nel primo livello energetico abbiamo un solo orbitale, 1S, che consente quindi solo due possibili configurazioni elettroniche, 1S1 e 1S2; nel primo periodo quindi possiamo avere due soli elementi, H con Z=1 e He con Z=2, cui corrispondono rispettivamente le due configurazioni indicate.
L’elemento con Z=3, il litio (Li), deve appartenere necessariamente al secondo periodo ed il suo elettrone in più rispetto all’elio va a finire nell’orbitale 2S. Col litio si apre dunque il secondo periodo, costituito da otto elementi, coi quali si riempiono progressivamente gli orbitali 2S e 2P, fino ad arrivare al neon (Ne), con Z=10 e configurazione elettronica 1S2 2S2 2P6. Gli elementi dell’ottavo gruppo, detti gas nobili, chiudono sempre il periodo, in quanto nella loro configurazione elettronica esterna tutti gli orbitali del periodo stesso sono riempiti. Gli elementi di qualsiasi periodo devono necessariamente avere completamento riempito tutti gli orbitali dei livelli precedenti all’ultimo, che corrisponde al numero del periodo cui appartengono. Ogni elemento ha quindi una configurazione elettronica interna corrispondente a quella del gas nobile che chiude il periodo precedente. A partire da questo fatto, per semplificare la scrittura delle configurazione elettroniche totali, esterna più interna, degli elementi dei periodo inferiori, che ad un certo punto diventano molto lunghe, si usa indicare la loro configurazioni elettronica interna col simbolo del gas nobile che termina il periodo precedente. In questo senso dunque la configurazione elettronica totale del litio può essere scritta come He 2S1, quella del berillio He 2S2 eccetera. Questa scrittura, utilizzata spesso nelle tavole periodiche, serve inoltre per evidenziare che la configurazione elettronica di maggior interesse è quella esterna, mentre quella interna può essere abbreviata per comodità. Da notare inoltre che nei primi due gruppi si riempiono gli orbitali S di ciascun livello energetico; tali gruppi costituisco pertanto il blocco S della tabella periodica. Nei gruppi dal terzo all'ottavo si riempiono i corrispondenti orbitali P, questi sei gruppi costituiscono quindi il blocco P della tabella.
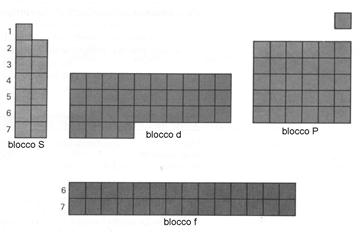 Il terzo periodo comincia col sodio (Na) e termina con l'argon (Ar). Il terzo livello energetico possiede però anche gli orbitali 3d; questi però sono preceduti nell'ordine di riempimento dagli orbitali 4S (confronta la serie in alto a pag. 7), per cui l'elemento successivo, il potassio (K) appartiene al quarto periodo ed è seguito dal calcio (Ca), col quale termina il riempimento dei 4S. Con lo scandio (Sc) inizia il riempimento dei 3d, che prosegue fino allo zinco (Zn). Si individua così una serie di dieci elementi coi quali si riempiono gli orbitali 3d, al termine di questa troviamo il gallio (Ga), col quale riprende il riempimento degli orbitali 4P.
Il terzo periodo comincia col sodio (Na) e termina con l'argon (Ar). Il terzo livello energetico possiede però anche gli orbitali 3d; questi però sono preceduti nell'ordine di riempimento dagli orbitali 4S (confronta la serie in alto a pag. 7), per cui l'elemento successivo, il potassio (K) appartiene al quarto periodo ed è seguito dal calcio (Ca), col quale termina il riempimento dei 4S. Con lo scandio (Sc) inizia il riempimento dei 3d, che prosegue fino allo zinco (Zn). Si individua così una serie di dieci elementi coi quali si riempiono gli orbitali 3d, al termine di questa troviamo il gallio (Ga), col quale riprende il riempimento degli orbitali 4P.
Nel quinto periodo si riempiono gli orbitali 5S, con il rubidio e lo stronzio, poi i 4d coi dieci elementi dall'ittrio al cadmio, quindi i 5P con gli elementi dall'indio allo xeno. Il sesto periodo inizia col riempimento dei 6S, con cesio e bario, quindi la tabella si interrompe e, successivamente al lantanio, inizia una serie di quattordici elementi, detti lantanidi o lantanoidi, corrispondenti al riempimento degli orbitali 4f; quest'ultima serie è staccata dal resto della tabella. Con gli elementi dall'afnio al mercurio si riempiono gli orbitali 5d, cui seguono i 6P con gli elementi dal tallio al rado. Inizia infine il settimo periodo col riempimento dei 7S, con francio e radio, successivamente all'attinio la tabella si interrompe di nuovo e si ha una nuova serie di quattordici elementi, detti attinidi o attinoidi, coi quali si riempiono i 5f e termina la tabella. Gli elementi delle tre serie di riempimento degli orbitali d vengono detti metalli di transizione e costituiscono il blocco d, mente attinoidi e lantanoidi formano il blocco f.
Le proprietà periodiche
Osservando attentamente la tabella si può notare che, nel susseguirsi degli elementi, periodicamente ricompaiono delle caratteristiche comuni. Innanzitutto gli elementi appartenenti allo stesso gruppo hanno la stessa configurazione elettronica esterna, anche se l'ultimo livello energetico è diverso. Se prendiamo, ad esempio, i primi cinque elementi del settimo gruppo osserviamo che possiedono le configurazioni elettroniche esterne riportate nella tabella a destra. Ciò è molto importante perché, per quanto già sappiamo, essi avranno un comportamento chimico simile; ciò si vede, ad esempio, confrontando le formule dei loro composto con l'idrogeno (vedi ultima riga a destra della tabella qui a fianco).

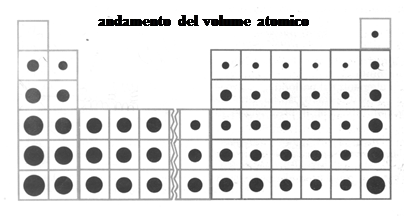 Passiamo adesso al volume atomico. Scendendo lungo un gruppo gli elementi aumentano di un livello energetico alla volta, è logico quindi che il loro volume aumenti. Spostandosi invece da sinistra verso destra in un periodo il livello energetico resta lo stesso, tuttavia aumentano sia i protoni, che gli elettroni, incrementando così la forza elettrostatica tra il nucleo e la nuvola elettronica: a causa di ciò il nucleo attira più fortemente gli elettroni ed il volume atomico diminuisce. A questa regola fanno eccezione i gas nobili, il cui volume aumenta rispetto a quello degli elementi del settimo gruppo, perché si è terminato il riempimento degli orbitali dell’ultimo livello energetico.
Passiamo adesso al volume atomico. Scendendo lungo un gruppo gli elementi aumentano di un livello energetico alla volta, è logico quindi che il loro volume aumenti. Spostandosi invece da sinistra verso destra in un periodo il livello energetico resta lo stesso, tuttavia aumentano sia i protoni, che gli elettroni, incrementando così la forza elettrostatica tra il nucleo e la nuvola elettronica: a causa di ciò il nucleo attira più fortemente gli elettroni ed il volume atomico diminuisce. A questa regola fanno eccezione i gas nobili, il cui volume aumenta rispetto a quello degli elementi del settimo gruppo, perché si è terminato il riempimento degli orbitali dell’ultimo livello energetico.
Il volume atomico è una caratteristica molto importante degli elementi, in quanto influenza la forza con la quale gli elettroni più esterni sono legati al nucleo. Negli atomi piccoli gli elettroni esterni sono infatti molto vicini al nucleo e ne sono attratti molto fortemente, risulterà quindi, ad esempio, difficile strapparglieli. Negli atomi grandi, invece, essendo gli elettroni esterni più lontani dal nucleo, ne saranno attratti in modo più blando e sarà così più facile strapparli. Quanto abbiamo appena detto risulterà molto utile quando tratteremo degli ioni e della loro formazione.
La regola dell’ottetto
Tutto in natura tende spontaneamente verso la maggiore stabilità ; come vedremo più avanti, parlando delle reazioni chimiche, le sostanze reagiscono spontaneamente per trasformarsi in altre sostanze più stabili. Più una sostanza è stabile e più difficilmente parteciperà a reazioni chimiche, viceversa sono le sostanze più instabili quelle che reagiscono più facilmente. In natura non è possibile incontrare atomi allo stato isolato; non si incontrano mai cioè atomi singoli di ossigeno o di sodio e questo perché gli atomi isolati sono talmente tanto instabili che reagiscono con qualsiasi altra sostanza vengano in contatto legandosi coi suoi atomi .
A quanto detto sopra fanno eccezione gli elementi dell’ottavo gruppo, i cosiddetti gas nobili, che invece esistono solo allo stato atomico. Infatti in una bombola di elio o in un tubo al neon noi troviamo singoli atomi di questi gas, che si definiscono nobili proprio perché non reagiscono praticamente mai con altri atomi, sia uguali a loro, che di altri elementi. Possiamo quindi affermare che i gas nobili sono gli elementi più stabili esistenti in natura. Questa loro importante caratteristica deriva dalla configurazione elettronica esterna nS2 nP6, nella quale risultano riempiti tutti gli orbitali S e P; a ciò fa eccezione l’elio, la cui configurazione elettronica esterna, pur essendo 1S2, ha comunque riempito l’unico orbitale presente nel livello. Una configurazione elettronica di questo tipo si definisce otteziale, in quanto nell’ultimo livello energetico sono presenti otto elettroni, ovvero un ottetto.
Nessun altro elemento della tabella presenta una simile configurazione elettronica, essa tuttavia, conferendo la massima stabilità possibile, costituisce il riferimento che tutti gli atomi cercano di raggiungere attraverso le reazioni chimiche. Ciò significa che tutti gli elementi della tabella periodica, reagendo tra loro e formando legami, cercano di raggiungere una configurazione elettronica otteziale. Quanto sopra descritto rappresenta la regola dell’ottetto, una legge di fondamentale importanza in quanto da la possibilità di spiegare e di prevedere il comportamento chimico dei vari elementi. Poiché tuttavia l’elio, pur non avendo l’ottetto, è sempre un gas nobile e rappresenta il riferimento di alcuni elementi che gli sono vicini nella tabella, la regola dell’ottetto può essere allargata nella formulazione seguente: tutti gli elementi reagiscono e formano legami per raggiungere la configurazione elettronica esterna del gas nobile più vicino.
Gli ioni
Gli atomi sono elettricamente neutri, in quanto possiedono lo stesso numero di elettroni e di protoni. E’ tuttavia possibile che un atomo acquisti o ceda qualcuno dei suoi elettroni più esterni , perdendo la sua neutralità elettrica e trasformandosi in uno ione. Se l’atomo cede elettroni assume una carica positiva e si trasforma in uno ione positivo o catione; a seconda che gli elettroni ceduti siano uno, due, tre o quattro, il catione potrà essere mono, bi, tri o tetravalente, esso si indica con lo stesso simbolo dell’elemento da cui deriva, ma con tanti segni + quante sono le sue cariche positive. Le dimensioni dei cationi sono minori di quelle degli atomi di partenza, in quanto i protoni sono adesso più degli elettroni residui e li attirano con maggior forza, facendo diminuire il volume atomico.
Se invece l’atomo acquista elettroni assume una carica negativa diventando uno ione negativo o anione; a seconda che gli elettroni acquisiti siano uno, due o al massimo tre, l’anione potrà essere mono, bi, o trivalente, esso si indica con lo stesso simbolo dell’elemento da cui deriva, ma con tanti segni − quante sono le sue cariche negative. Le dimensioni degli anioni sono maggiori di quelle degli atomi di partenza, in quanto i protoni sono adesso meno degli elettroni e li attirano con minor forza, gli elettroni possono quindi allontanarsi un poco dal nucleo, facendo aumentare il volume atomico.
Ma per quale motivo un atomo dovrebbe cedere o acquistare degli elettroni? La risposta è semplice: per raggiungere l’ottetto o comunque la configurazione elettronica del gas nobile più vicino. Prendiamo ad esempio il sodio, che avendo configurazione elettronica esterna 3S1 per raggiungere la configurazione di un gas nobile può acquistare 7 elettroni, diventando simile all’argon, oppure può cederne uno, diventando simile al neon. E’ evidente che la prima soluzione è improponibile ed infatti il sodio facilmente cede il suo elettrone più esterno, diventando un catione monovalente, secondo la reazione: Na → Na+ + e−. Prendiamo ora il cloro, di configurazione elettronica esterna 3S2 3P5 a cui manca un solo elettrone per assumere la configurazione dell’argon, il gas nobile a lui più vicino; la trasformazione è abbastanza semplice ed infatti frequentemente il cloro acquista un elettrone in più, trasformandosi in un anione monovalente, secondo la reazione: Cl + e−→ Cl−.
A questo punto risulta evidente che, se gli atomi si trasformano in ioni per raggiungere la configurazione elettronica del gas nobile più vicino, è possibile prevedere in quale tipo di ioni monoatomici un elemento si trasformerà, a seconda della sua posizione nella tabella periodica, secondo lo schema seguente:
gruppo |
Ioni monoatomici |
gruppo |
Ioni monoatomici |
I° |
Cationi monovalenti (Na+; K+ ecc.) |
V° |
raramente cationi trivalenti (Bi 3+) o anioni trivalenti(N3-) |
II° |
cationi bivalenti (Mg 2+; Ca 2+ ecc.) |
||
III° |
cationi trivalenti (Al 3+) |
VI° |
anioni bivalenti (O2-; S2-) |
IV° |
cationi tetravalenti (Sn 4+; Pb 4+ ) |
VII° |
anioni monovalenti (Cl-; F-; ecc.) |
Energia di ionizzazione
Si definisce energia di ionizzazione l’energia necessaria per strappare ad un atomo uno dei suoi elettroni più esterni. Da quanto detto nel paragrafo precedente si capisce che gli elementi dei primi gruppi a sinistra della tabella periodica, che si trasformano facilmente in cationi, avranno una bassa energia di ionizzazione, mentre gli elementi degli ultimi gruppi a destra, che si trasformano facilmente in anioni, avranno alta energia di ionizzazione. Infatti l’energia di ionizzazione aumenta spostandosi da sinistra verso destra in un periodo, mentre diminuisce scendendo lungo un gruppo.
Osservando attentamente l’andamento dell’energia di ionizzazione all’interno della tabella periodica si può osservare che esso è esattamente opposto a quello del volume atomico: le due grandezze sono infatti inversamente proporzionali tra loro. Gli atomi con grande volume hanno piccola energia di ionizzazione, mentre quelli con volume piccolo hanno grande energia di ionizzazione; la forza con cui il nucleo attrae gli elettroni esterni diminuisce infatti all’aumentare delle dimensioni atomiche, cioè all’aumentare della distanza tra nucleo ed elettroni medesimi, come avevamo già visto all’inizio di pagina 3.
Elettronegatività
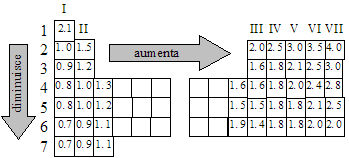 L’elettronegatività di un elemento è la forza con cui i suoi atomi attirano gli elettroni di legame. Abbiamo già detto che gli atomi, tranne quelli dei gas nobili, non si trovano mai isolati, nel senso che sempre reagiscono con altri atomi per formare dei legami chimici. I legami chimici sono i modi nei quali gli atomi si legano tra loro; in alcuni casi essi si realizzano grazie al fatto che i due atomi legati mettono in comune tra loro degli elettroni, che si muoveranno quindi nello spazio compreso tra i due nuclei. Ognuno dei due nuclei eserciterà quindi su di essi un’attrazione, la cui intensità è misurata dall’elettronegatività. Confrontando le due figure della pagina precedente possiamo vedere che l’elettronegatività ha un andamento analogo a quello dell’energia di ionizzazione. Infatti anche l’elettronegatività aumenta spostandosi da sinistra verso destra in un periodo, mentre diminuisce scendendo lungo un gruppo. Ancora una volta entra in gioco il volume atomico, in quanto gli atomi piccoli attraggono gli elettroni più fortemente di quelli grandi. Se andiamo a leggere sulla tabella periodica i valori di elettronegatività osserviamo che l’ossigeno è l’elemento più elettronegativo dopo il fluoro, elemento quest’ultimo relativamente raro. L’ossigeno è invece molto abbondante è la sua grande elettronegatività spiegherà molte caratteristiche sue e dei composti che forma.
L’elettronegatività di un elemento è la forza con cui i suoi atomi attirano gli elettroni di legame. Abbiamo già detto che gli atomi, tranne quelli dei gas nobili, non si trovano mai isolati, nel senso che sempre reagiscono con altri atomi per formare dei legami chimici. I legami chimici sono i modi nei quali gli atomi si legano tra loro; in alcuni casi essi si realizzano grazie al fatto che i due atomi legati mettono in comune tra loro degli elettroni, che si muoveranno quindi nello spazio compreso tra i due nuclei. Ognuno dei due nuclei eserciterà quindi su di essi un’attrazione, la cui intensità è misurata dall’elettronegatività. Confrontando le due figure della pagina precedente possiamo vedere che l’elettronegatività ha un andamento analogo a quello dell’energia di ionizzazione. Infatti anche l’elettronegatività aumenta spostandosi da sinistra verso destra in un periodo, mentre diminuisce scendendo lungo un gruppo. Ancora una volta entra in gioco il volume atomico, in quanto gli atomi piccoli attraggono gli elettroni più fortemente di quelli grandi. Se andiamo a leggere sulla tabella periodica i valori di elettronegatività osserviamo che l’ossigeno è l’elemento più elettronegativo dopo il fluoro, elemento quest’ultimo relativamente raro. L’ossigeno è invece molto abbondante è la sua grande elettronegatività spiegherà molte caratteristiche sue e dei composti che forma.
Metalli e non metalli
Gli elementi della tabella periodica possono essere divisi in due grandi gruppi da una linea spezzata che parte in alto a sinistra dal boro e scende verso il basso e verso destra fino al polonio ed all’astato. Gli elementi a sinistra e sotto tale linea si dicono metalli, mentre gli elementi a destra e sopra di essa si dicono non metalli. I metalli, allo stato elementare, sono tutti solidi a temperatura ambiente, tranne il mercurio, hanno bassa elettronegatività ed energia di ionizzazione e sono pertanto buoni conduttori di calore e di elettricità. Il calore e l’elettricità infatti nei solidi sono trasmessi grazie al movimento degli elettroni più esterni: solo gli elementi che legano tali elettroni in modo blando potranno quindi essere buoni conduttori. I non metalli possono essere a temperatura ambiente tanto solidi, che liquidi, che gassosi, possiedono alta elettronegatività ed energia di ionizzazione e sono pertanto cattivi conduttori di calore ed elettricità.
A cavallo della linea spezzata di separazione tra metalli e non metalli si trovano alcuni elementi evidenziati in grigio nella figura qui sopra, che, avendo caratteristiche intermedie tra metalli e non metalli, vengono chiamati semi metalli. Alcuni di essi, come silicio e germanio, essendo semi conduttori, vengono impiegati nell’industria elettronica per la produzione transistor e chip.
Il peso atomico
Parlando della struttura dell’atomo abbiamo visto che al suo interno si trovano due particelle sub atomiche: il protone e l’elettrone. In verità all’interno del nucleo, assieme ai protoni, troviamo un terzo tipo di particelle chiamate neutroni. I neutroni sono privi di carica elettrica, ma possiedono una massa circa uguale a quella del protone, pari a 1,66 x 10-24 grammi; la loro presenza all’interno del nucleo serve a “diluire” la carica positiva dei protoni, evitando che questi possano respingersi tra loro a causa di forze coulombiane. In questo senso quindi i neutroni svolgono un importante ruolo di stabilizzazione del nucleo medesimo.
Poiché protoni e neutroni hanno lo stesso peso, mentre gli elettroni sono circa 1837 volte più leggeri, il peso dell’atomo è determinato dal numero di protoni e di neutroni presenti nel nucleo. Tale numero è detto numero di massa, si indica comunemente con la lettera A e corrisponde ad un numero puro, privo cioè di dimensioni fisiche.
Ogni elemento della tabella periodica, oltre ad avere un numero atomico, indicato con la lettera Z , possiede quindi anche un numero di massa. In verità per ogni elemento esistono più tipi di atomi che, pur possedendo tutti lo stesso numero atomico, hanno differente numero di massa, avendo nel nucleo un diverso numero di neutroni; atomi con queste caratteristiche si definiscono isotopi. Per rappresentare i vari isotopi di un elemento si utilizza il simbolo dell’elemento stesso cui si aggiunge, in alto a sinistra, il numero di massa. Prendiamo ad esempio l’idrogeno, il cui atomico è 1; il 99,985% degli atomi di idrogeno ha nel nucleo solo un protone e nessun neutrone: il loro numero di massa è quindi 1 e si indicano con 1H. Il rimanente 0,015% presenta nel nucleo, oltre all’immancabile protone, anche un neutrone ed ha pertanto numero di massa 2; tale isotopo naturale dell’idrogeno prende il nome di deuterio e si indica con 2H. Esiste infine anche un isotopo artificiale che, avendo nel nucleo un protone e due neutroni, ha numero di massa 3; detto isotopo si chiama trizio e si indica con 3H.
Le proprietà chimiche, essendo determinate dalla sua configurazione elettronica, dipendono unicamente dal suo numero atomico, che costituisce quindi il maggior elemento identificativo di ciascun elemento. Il numero di massa non ha alcuna influenza sulle proprietà chimiche, esercitando invece un ruolo nelle reazioni nucleari, che si verificano, ad esempio, nelle centrali nucleari e nelle bombe atomiche. In conclusione possiamo quindi dire che due isotopi hanno le stesse proprietà chimiche.
Come abbiamo detto, il numero di massa è una grandezza adimensionale; in chimica tuttavia è importante poter conoscere anche il peso reale degli atomi, per riuscire a sapere, per esempio, quanti di essi sono presenti in un determinato peso di una certa sostanza. Per pesare un atomo non possiamo però certo utilizzare le unità di misura adoperate nella vita di tutti i giorni, come ad esempio il grammo o il chilogrammo; esse infatti sono troppo grosse per oggetti come gli atomi e ci costringerebbero quindi all’uso di molti zeri dopo la virgola oppure all’uso di esponenti negativi. Allo scopo è stata quindi creata una nuova unità di misura, chiamata Unità di Massa Atomica (UMA) o Dalton. Tale grandezza corrisponde, grosso modo, al peso in grammi di un nucleone e cioè 1,66 x 10-24 grammi.
Il peso atomico di un elemento dovrebbe quindi corrispondere ad un numero intero di Dalton, corrispondente al numero di nucleoni presenti nel nucleo. Se controlliamo sulla tabella periodica ci accorgiamo però che non è così: il peso atomico di ogni elemento è rappresentato infatti da un numero decimale. Questo accade perché è necessario prendere in considerazione tutti gli isotopi naturali di un elemento, con le loro proporzioni reciproche. Nel caso dell’idrogeno, ad esempio, si deve considerare che lo 0,015% dei suoi atomi naturali hanno massa pari a 2 Dalton, mentre tutti gli altri hanno massa 1 Dalton; in ragione di ciò, la massa media ponderata dell’atomo di idrogeno è 1,00797 Dalton.
Tra tutti e 106 gli elementi alcuni sono però più importanti e più diffusi di altri; nella nostra trattazione e nei nostri esercizi ne utilizzeremo infatti solo una quarantina, quelli elencati qui sotto, di cui è necessario conoscere il nome, il simbolo, e la posizione approssimativa nella tabella.
Nome |
Simbolo |
Nome |
Simbolo |
Nome |
Simbolo |
Nome |
Simbolo |
Idrogeno |
H |
Sodio |
Na |
Cromo |
Cr |
Stagno |
Sn |
Elio |
He |
Magnesio |
Mg |
Manganese |
Mn |
Antimonio |
Sb |
Litio |
Li |
Alluminio |
Al |
Ferro |
Fe |
Iodio |
I |
Berillio |
Be |
Silicio |
Si |
Rame |
Cu |
Xeno |
Xe |
Boro |
B |
Fosforo |
P |
Zinco |
Zn |
Oro |
Au |
Carbonio |
C |
Zolfo |
S |
Arsenico |
As |
Mercurio |
Hg |
Azoto |
N |
Cloro |
Cl |
Selenio |
Se |
Piombo |
Pb |
Ossigeno |
O |
Argo |
Ar |
Bromo |
Br |
|
|
Fluoro |
F |
Potassio |
K |
Kripton |
Kr |
|
|
Neo |
Ne |
Calcio |
Ca |
Argento |
Ag |
|
|
Tra gli elementi scoperti in questo periodo figurano, ad esempio, boro, silicio, berillio e selenio.
I numeri atomici vennero introdotti da un allievo di Rutherford, successivamente alla elaborazione del modello atomico planetario.
Durante la lettura di questo paragrafo è opportuno tenere aperta la tabella periodica, controllando con la legenda la descrizione delle caratteristiche dei vari elementi.
In ambito scientifico per stabilità dobbiamo intendere assenza di cambiamento; una situazione è quindi tanto più stabile quanto più difficilmente subirà delle modificazioni.
Questo principio viene utilizzato ad esempio in molti disinfettanti ossigenati, come l’acqua ossigenata, da cui si sviluppa ossigeno atomico, formato appunto da atomi singoli, che immediatamente reagiscono coi microbi che incontrano distruggendoli.
Non è invece possibile acquistare o cedere protoni, perché il nucleo resta sempre lontano dalle trasformazioni chimiche.
Vedremo più avanti che si possono formare anche ioni poliatomici, formati cioè dall’unione di più atomi diversi.
fonte: http://www.liceodavincifi.it/_Rainbow/Documents/IL%20SISTEMA%20PERIODICO3.doc
tavola periodica degli elementi stampabile
tavola periodica degli elementi completa
tavola periodica degli elementi da stampare
Tavola periodica e numero atomico
Numero atomico (Z)
Il numero atomico o numero protonico (indicato solitamente con Z, dal tedesco Zahl che significa numero ) corrisponde al numero di protoni contenuti in un nucleo atomico.
Si usa scrivere questo numero come pedice sinistro del simbolo dell'elemento chimico in questione: per esempio scrivere 6C significa che il carbonio (simbolo atomico C) ha sei protoni.
Ad ogni numero atomico corrisponde un diverso elemento chimico. Tutti gli elementi chimici sono ordinati nella Tavola periodica degli elementi secondo il loro numero atomico. (In figura XX, Z compare al di sopra del simbolo di ogni elemento).
La legge periodica asserisce che: le proprietà fisiche e chimiche degli elementi variano in modo periodico secondo i loro numeri atomici. In particolare gli elementi appartenenti ad uno stesso gruppo hanno caratteristiche chimiche simili.
Ione
La carica elettrica di un protone (+) è uguale e contraria a quella di un elettrone (–), mentre un neutrone è una particella neutra, ovvero priva di carica elettrica. In un atomo (normalmente neutro) il numero atomico, ovvero dei protoni, è dunque uguale al numero di elettroni; in caso contrario l'atomo è detto ione (dal greco ion = che si muove, in riferimento alla sua attitudine a muoversi all’interno di un campo elettrico) . In particolare si definisce catione uno ione di carica positiva e anione uno ione di carica negativa.
Numero di massa (A ) di un atomo
Il numero di massa (A) di un generico atomo X è dato dal numero di protoni (Z ) + il numero di neutroni (N ). Viene generalmente indicato in alto a sinistra del simbolo dell’elemento in questo modo: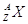 si può pertanto affermare che il numero di massa dell’atomo di carbonio in questione è 12 e che il suo numero atomico è 6. Il numero di neutroni N sarà N = A – Z = 6.
si può pertanto affermare che il numero di massa dell’atomo di carbonio in questione è 12 e che il suo numero atomico è 6. Il numero di neutroni N sarà N = A – Z = 6.
Il numero A, nel caso di un atomo, è sempre un numero intero e “piccolo”.
Isotopo
Se due atomi possiedono lo stesso numero atomico ma diverso numero di massa (cioè diverso numero di neutroni) si dicono isotopi. Tutti gli isotopi di uno stesso elemento occupano la stessa posizione (“isos”= uguale, “topos”=luogo) all’interno della tavola periodica (vedi fig. XX) in quanto presentano le stesse proprietà chimiche, proprietà che dipendono solo da Z. Variano invece le proprietà fisiche. Tutti gli isotopi hanno lo stesso nome dell’elemento che li contraddistingue ad eccezione dell’atomo di idrogeno che presenta anche dei nomi specifici per ogni isotopo. Esistono tre isotopi dell’idrogeno e i loro nomi specifici sono prozio 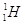 . Il trizio è un isotopo radioattivo.
. Il trizio è un isotopo radioattivo.
Isotopi radioattivi e tempo di dimezzamento (o emivita )
Un isotopo radioattivo ha la tendenza di espellere (o emettere) nel tempo una parte di sé e trasformarsi in un altro atomo più stabile. Il tempo di dimezzamento è il tempo trascorso il quale un isotopo radioattivo ha il 50% di probabilità di non esistere più nella sua forma originale. Nel caso si consideri una certa quantità di massa (cioè un numero elevato di isotopi tutti uguali), il tempo di dimezzamento esprime il tempo necessario affinché il 50% di questa massa iniziale non esista sicuramente più (la sicurezza è di tipo statistico e dunque tanto maggiore quanto maggiore è il numero iniziale di isotopi).
La conoscenza del tempo di dimezzamento di un particolare isotopo permette di conoscere approssimativamente l’età di una certa massa che lo contenesse a patto di riuscire a stimarne la quantità iniziale. Famoso è ad esempio l’utilizzo del carbonio-14 (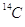 ) per la datazione di reperti organici.
) per la datazione di reperti organici.
L'ossigeno ha tre isotopi stabili e dieci isotopi radioattivi. Tutti i radioisotopi hanno tempi di decadimento inferiori a tre minuti.
Numero di Avogadro (NA)
È per definizione il numero di atomi contenuti in 12 g di carbonio 12 (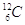 ). Tale definizione raggira abilmente il problema di sapere il valore numerico esatto, che, come è ovvio immaginare non è possibile quantificare con precisione elevata. Una stima accettabile è NA ≈ 6,022 ´ 1023.
). Tale definizione raggira abilmente il problema di sapere il valore numerico esatto, che, come è ovvio immaginare non è possibile quantificare con precisione elevata. Una stima accettabile è NA ≈ 6,022 ´ 1023.
Mole
Quantità di sostanza di un sistema che contiene un numero di entità elementari pari al numero di Avogadro. È la grandezza adottata dal Sistema Internazionale (S.I.) per identificare una quantità di materia.
Per meglio coglierne il significato, basti pensare alla sua analogia con il concetto di dozzina, esprimibile come la quantità di sostanza di un sistema che contiene un numero di entità elementari pari al numero 12. Se in 1 dozzina di uova ci sono 1 dozzina di tuorli e 1 dozzina di albumi (ovvero un numero di tuorli pari a 12 ed un numero di albumi pari a 12), così, in 1 mole di acqua, ad esempio, ci sono 1 mole di ossigeno atomico e 1´2 moli di idrogeno atomico (ovvero un numero di atomi di ossigeno pari a 6,022 ´ 1023 ed un numero di aromi di idrogeno pari a 2 ´ 6,022 ´ 1023.
Esprimere le reazioni chimiche attraverso la combinazione di moli di atomi, invece che di atomi, serve a facilitarci le espressioni numeriche e a renderci pratiche le misure. Voler ragionare in termini di atomi invece che di moli sarebbe un po’come entrare in una cartoleria e pretendere 1002 fogli di carta invece che due risme (una risma di carta equivale a 500 fogli ed un errore di 2 fogli su 1000 è assolutamente tollerabile).
Legge della conservazione di massa di Lavoisier
Nulla si crea e nulla si distrugge, ovvero, in una reazione chimica,la massa dei reagenti è esattamente uguale alla massa dei prodotti.
È la legge da cui nasce e su cui si basa la chimica moderna.
Se ad esempio 2 kg di gas idrogeno (H2) reagiscono con 16 kg di gas ossigeno (O2), questo significa che alla fine otterrò 2 + 16 = 18 kg di acqua (H2O). Da notare che se si ragiona unicamente in termini di massa invece che di moli si perde la correlazione tra quantità e realtà molecolare.
Massa (o peso ) atomica assoluta di un atomo
È la massa di un atomo espressa in grammi.
È una grandezza sperimentale misurabile con uno spettrometro di massa.
Massa atomica ( o peso atomico ) assoluta di un elemento
È la massa media di un elemento espressa in grammi.
Un elemento non rappresenta un singolo e specifico atomo ma la miscela di un certo numero di isotopi e pertanto la sua massa atomica assoluta m sarà la media pesata tra le masse mi dei vari isotopi che la compongono.
Tale valore può essere ricavato (a ritroso) come prodotto tra la massa atomica relativa dell’elemento (valore tabulato nella tavola periodica) e l’unità di massa atomica (vedi dopo XX).
Unità di massa atomica unificat a (u / Da (dalton) u.m.a. / a.m.u. )
Esprimere la massa di un atomo (o anche di una molecola) usando il grammo o ancor peggio il kg può essere poco pratico ed è per questo che è nata l’esigenza di una unità di massa più adatta. Nasce così l’unità di massa atomica unificata che è definita come la dodicesima parte della massa di un atomo di carbonio-12 (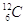 ).
).
Se per definizione, in 12 g di 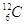 12/NA g e dunque 1 u equivale a 1/NA g ≈ 1,66 ´ 10-24 g.
12/NA g e dunque 1 u equivale a 1/NA g ≈ 1,66 ´ 10-24 g.
Essendo la massa di un atomo interamente concentrata nel suo nucleo (la massa degli elettroni è relativamente trascurabile) e poiché in un nucleo di 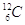 .
.
Si potrebbe erroneamente pensare che la massa media di un nucleone sia una costante universale e che quindi fosse possibile ricavare la massa assoluta di un qualsiasi atomo semplicemente moltiplicando u per il suo numero di massa A (calcolo lecito solo nel caso di 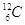 ). Quando dei protoni e dei neutroni reagiscono per formare un nucleo rilasciano una certa quantità di energia E e dunque, per la equivalenza tra massa ed energia espressa dalla nota legge di Einstein (E = m ´ c2) si ha anche una variazione di massa. Tale equivalenza è sempre valida ma se a reagire sono grandi quantità di atomi e/o le energie in gioco sono “piccole” (entrambi le condizioni sono sempre verificate nelle reazioni chimiche) essa è del tutto ininfluente, per cui resta sempre valida la legge della conservazione di massa di Lavoisier (vedi XX).
). Quando dei protoni e dei neutroni reagiscono per formare un nucleo rilasciano una certa quantità di energia E e dunque, per la equivalenza tra massa ed energia espressa dalla nota legge di Einstein (E = m ´ c2) si ha anche una variazione di massa. Tale equivalenza è sempre valida ma se a reagire sono grandi quantità di atomi e/o le energie in gioco sono “piccole” (entrambi le condizioni sono sempre verificate nelle reazioni chimiche) essa è del tutto ininfluente, per cui resta sempre valida la legge della conservazione di massa di Lavoisier (vedi XX).
Massa (o peso ) atomica relativa di un atomo (M.A.)
È il numero che esprime il rapporto tra la massa assoluta di un atomo (per la precisione del suo nucleo) e la unità di massa atomica u. Questo numero è quasi esattamente uguale al numero di massa A (esattamente uguale solo nel caso di 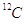 ).
).
Si dice, ad esempio, che la massa atomica (relativa) di 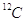 è 12 u o più semplicemente 12.
è 12 u o più semplicemente 12.
Massa atomica (peso atomico ) relativa di un elemento (M.A.)
È il numero che esprime il rapporto tra la massa assoluta di un elemento e la unità di massa atomica u.
Nella tavola periodica della figura XX, i vari numeri di massa degli elementi sono scritti sotto ciascun simbolo chimico e sono in genere dei numeri non interi.
Se ad esempio si trascura la presenza dell’isotopo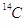 ( M.A. = 13,003354). Riferendosi al carbonio si potrà pertanto dire che la sua massa atomica relativa (media) è:
( M.A. = 13,003354). Riferendosi al carbonio si potrà pertanto dire che la sua massa atomica relativa (media) è:
M.A. = 12 ´ 0,98892 + 13,003354 ´ 0,1108 = 12,011
Come già detto in precedenza (vedi XX), la massa assoluta di un atomo sarà dunque m = M.A. ´ u e quindi nel caso del carbonio ad esempio, la sua massa assoluta (media) sarà m = 12,011 ´ 1,66 ´ 10-24 g = 1,995´ 10-23 g
Un generico atomo di H pesa mediamente: 1,00797 ´ 1,66 ´ 10-24 = 1,67 ´ 10-24 g.
Un generico atomo di O pesa mediamente: 15,9994 ´ 1,66 ´ 10-24 = 2,66 ´ 10-23 g.
Massa molecolare (peso molecolare)
Grandezza analoga alla massa atomica (sia assoluta sia relativa) ma riferita a una molecola.
Nel caso dell’acqua, ad esempio, la sua massa molecolare relativa (media) è:
2 ´ M.A. di H + M.A. di O = 2 ´ 1,00797 + 15,9994 = 18,01534
Più semplicemente, a livello pratico, si è solito scrivere che la massa molecolare dell’acqua è 2 ´ 1 + 16 = 18.
Peso formula
Equivale alla massa molecolare relativa ma è riferita a composti chimici non molecolari e in particolare ai composti ionici.
Ad esempio, la formula del cloruro di sodio è NaCl (sale da cucina). Non esiste una molecola di NaCl propriamente detta ma solo una struttura in cui, mediamente, per ogni atomo di sodio (Na) è presente un atomo di cloro (Cl). Non è pertanto corretto parlare di massa molecolare di NaCl ma è preferibile dire che il peso formula di NaCl è 23 + 35,5 = 58,5.
Massa molare (M.M.)
È la massa (peso) di 1 mole di qualsiasi sostanza.
Viene espressa in g·mol-1. È numericamente (ma non dimensionalmente!) uguale alla massa atomica (relativa).
Il concetto di mole e di massa molare permettono di passare agevolmente da una formula ai pesi dei reagenti e prodotti e viceversa. Vediamo un esempio.
La reazione chimica bilanciata per ottenere acqua a partire da idrogeno e ossigeno gassosi è:
2H2 + O2 à 2H2O
Leggendo la tavola periodica si evince che:
M.A. di H ≈ 1 per cui M.M.di H = 1 g·mol-1 e M.M. di H2 ≈ 2 g·mol-1 (2 = 1 ´ 2) il che significa che 1 mole di H2 pesa 2 grammi.
M.A. di O ≈ 16 per cui M.M.di O = 16 g·mol-1 e M.M. di O2 ≈ 32 g·mol-1 (32 = 16 ´ 2) il che significa che 1 mole di O2 pesa 2 grammi.
Dalla reazione (bilanciata!) io so che 2 molecole di idrogeno (gassoso) reagiscono con 1 molecola di ossigeno (gassoso) per dare 2 molecole di acqua. Questo significa anche che 2 moli di idrogeno (gassoso) reagiscono con 1 mole di ossigeno (gassoso) per dare 2 moli di acqua e quindi passando ai grammi posso dire che 4 g di H2 reagiscono con 32 g di O2 per avere 36 g di H2O.
Fonte: http://didattica-online.polito.it/CHIMICA/dismic/approfondimento/Riassunto%20numero%20atomico%20etc.doc
Tavola periodica degli elementi completa in italiano e elettronegatività da stampare
Tavola periodica degli elementi e elettronegatività
Tavola periodica degli elementi completa in italiano e elettronegatività da stampare tabella chimica elettronegatività
tavola_periodica_degli_elementi_pdf
Termini d' uso e privacy
 Ciao clicca qui per visitare la nostra pagina principale grazie
Ciao clicca qui per visitare la nostra pagina principale grazie