Biochimica della nutrizione
Biochimica della nutrizione
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Biochimica della nutrizione
La nutrizione è l’insieme delle operazioni che vanno dalla adeguata scelta degli alimenti all’utilizzo dei nutrienti in essa contenuti, allo scopo di mantenere la “massa” dell’organismo vivente, di accrescerla quando necessario e consentirne sul piano energetico il pieno esercizio delle funzioni.
Individuazione dei nutrienti
I nutrienti possono distinguersi in:
- plastici, necessari a sostenere i fabbisogni biosintetici
- energetici, necessari a sostenere i fabbisogni energetici
Nutrienti plastici
I principali componenti sono:
- acqua
- proteine
- carboidrati
- lipidi
- acidi nucleici
- sostanze minerali
L’acqua è il componente più abbondante, seguito da proteine, lipidi, acidi nucleici, carboidrati e minerali.
Le singole cell, i tessuti parenchimatosi e il t.muscolare hanno una elevata analogia composizionale con l’acqua che costituisce il 68-74% del peso fresco.
Il t.adiposo ha il più basso contenuto di acqua (10-12%) e il più elevato contenuto di lipidi (70-82%) in quanto addetto appunto al deposito di trigliceridi.
Il t.nervoso è il più ricco di acqua (75-78%) ed ha pure un elevato contenuto lipidico (10-15%), in particolare fosfolipidi e glicolipidi.
Il t.osseo contiene il 30% di acqua e il 60% di minerali.
Il contenuto di acqua negli organi e tessuti di soggetti in età infantile è più elevato (fino al 20% in più) che nell’adulto. L’acqua in soggetti adulti, è distribuita per circa il 65% intracellularmente e per il 35% extracellularmente ed il rimanente come acqua dei tessuti di sostegno.
Maggiore è lo sviluppo del t.muscolare maggiore è pure il contenuto di acqua.
Al contrario maggiore è lo sviluppo del t.adiposo, minore è il contenuto di acqua.
L’acqua e gli elementi inorganici sono di per se stessi nutrienti, cioè devono essere introdotti come tali.
Per quanto attiene gli elementi inorganici essi sono distinti in:
- macroelementi, presenti nell’organismo in relativamente elevate quantità
- microelementi, presenti in piccole quantità
- elementi traccia, presenti in piccolissime quantità
I nutrienti relativi alle proteine sono gli aminoacidi. Tra questi gli aminoacidi essenziali devono essere introdotti come tali.
Per quanto riguarda gli aminoacidi non essenziali è sufficiente disporre anche solo di uno di loro, in quantità sufficiente, per ottenere tutti gli altri!!
Per quanto riguarda i precursori metabolici dei carboidrati si potrebbe sostenere che non è necessario un nutriente dietetico, in quanto il glucosio può derivare dagli aminoacidi (e dal glicerolo di origine lipidica) per gluconeogenesi. Tuttavia nell’uomo, con eritrociti privi di nucleo e mitocondri, e con la necessità di continuo reclutamento di ossaloacetato per garantire il buon funzionamento del ciclo di Krebs, un flusso gluconeogenetico capace di fornire tutto il glucosio necessario per sostenere il metabolismo glicidico nella sua totalità senza pericolosa incentivazione della chetogenesi è di fatto impossibile!
Pertanto il glucosio è da considerarsi un nutriente plastico.
I nutrienti lipidici indispensabili sono:
- acido linoleico (18:2, ω-6)
- acido linolenico (18:3, ω-3)
e altri acidi grassi della serie ω-3 come:
- acido eicosapentanoico (20:5, ω-3)
- acido docosaesaenoico (22:6, ω-3)
Dall’acido linoleico si forma l’acido arachidonico (20:4, ω-6), precursore a sua volta degli eicosanoidi, essenziale in caso di assenza dell’acido linoleico.
Questi acidi grassi polinsaturi (cioè con due o più doppi legami) sono acidi grassi essenziali.
Va inoltre ricordato che il glicerolo, necessario alla biosintesi dei glicerolipidi (trigliceridi e fosfogliceridi) deriva metabolicamente dal glucosio e che la serina, necessaria per la biosintesi della sfingosina, e presente come tale o come suoi derivati nei fosfolipidi, non sono essenziali!
Gli acidi nucleici hanno solo il fosfato come nutriente indispensabile!
Il gruppo di nutrienti che non è possibile identificare sulla base di uno studio composizionale di massima quale quello riferito sopra è costituito dalle vitamine, per definizione essenziali.
Nutrienti energetici
Nutrienti energetici sono
- il glucosio (dai carboidrati)
- gli acidi grassi e il glicerolo (dai lipidi)
- gli aminoacidi (dalle proteine)
Ciascuno di questi nutrienti viene nelle cell completamente ossidato in acqua e anidride carbonica. Questo processo è una combustione che nell’ambiente biologico avviene con gradualità.
Glucosio, aminoacidi e acidi grassi producono rispettivamente 4.1, 5.4 e 9.3 Kcalorie/g.
La Kilocaloria è la quantità di calore (energia) necessaria per elevare da 14,5° a 15,5° 1Kg di acqua.
Basandosi sulla conoscenza degli equivalenti energetici la metodica comunemente usata per valutare i consumi (e quindi i fabbisogni) energetici è la calorimetria indiretta, o spirometria, con la quale si determina la quantità di O2 (consumato) e di CO2 prodotta in un determinato periodo di tempo, per la completa ossidazione di glucosio, acidi grassi, glicerolo e aminoacidi.
Il quoziente respiratorio (Q.R. = CO2 prodotta/O2 consumata) è
- 1.0 per i carboidrati
- 0.7 per gli acidi grassi
- 0.86 per il glicerolo
- 0.8 per gli aminoacidi (proteine in generale)
Il “combustibile” con il quale 1 litro di O2 fornisce la maggior quantità di energia (5,36 Kcal) è il glucosio!
Es. equazione di ossidazione totale del glucosio:
C6H12O6 + 6°2 à 6 CO2 + 6 H2O
Q.R. = 6 CO2/6°2 = 1
Equivalente calorico di 1 L di O2 = 5,36 Kcal
Criteri per la valutazione e soddisfazione dei fabbisogni nutrizionali
Il fabbisogno/Kg di peso varia col variare di condizioni generali e individuali: l’età, il sesso, la gravidanza, l’allattamento, il recupero a seguito di infermità gravi (convalescenza), l’attività e la tipologia lavorativa propria del soggetto, le condizioni ambientali particolari.
Il peso ideale o peso desiderabile consiste nel peso che il soggetto dovrebbe possedere per disporre della maggiore garanzia di salute.
È necessario valutare se il “peso reale” corrisponde a quello “ideale”.
Fabbisogni energetici
Il fabbisogno di energia di un individuo risulta dalla somma di tre componenti:
- il metabolismo basale (MB), che rappresenta la somma dell’energia utilizzata per mantenere lo stato di attività dell’organismo; è attribuibile principalmente alla massa magra dell’organismo. Fegato, cervello, cuore e reni sono responsabili del 60-70% del MB e la massa muscolare incide del 18-20% del MB.
- la termogenesi indotta dalla dieta (TID) o azione dinamico specifica degli alimenti, che è il dispendio energetico legato ai processi di digestione degli alimenti e assorbimento dei nutrienti con le stimolazioni neuroendocrine ad essi correlate. Il maggior effetto termo genico è dato dalle proteine.
- il livello di attività fisica (LAF), ovvero il dispendio energetico relativo all’attività del singolo individuo sull’intero arco della giornata. È essenzialmente legato all’esercizio fisico che l’individuo compie in rapporto alle attività svolte.
Il fabbisogno energetico del MB e dell’attività fisica individuale sono generalmente espressi in Kcal/min (o /ora)/Kg di peso.
Il fabbisogno energetico giornaliero totale è la somma fra l’MB e l’insieme dei dispendi parziali delle singole forme in cui si articola l’attività fisica del soggetto.
Il MB è determinato di solito nelle condizioni “cosiddette” basali: soggetto a digiuno da 12 ore, dopo un pasto serale non abbondante, stato di veglia ma a riposo, condizioni di neutralità termica, totale rilassamento psicologico e fisico.
Fabbisogni plastici
Acqua
L’acqua è il più critico di tutti i nutrienti. Per privazione di acqua gli animali, compreso l’uomo, muoiono molto prima che per digiuno. Essa fornisce infatti l’ambiente nel quale avvengono tutte le reazioni chimiche dell’organismo. L’acqua extracell è distribuita prevalentemente nel plasma ematico e nel liquido interstiziale.
Gli scambi di acqua tra plasma e liquido interstiziale seguono la pressione osmotica esistente nei due compartimenti. Una caduta della pressione
osmotica del plasma produce un flusso di acqua dal plasma al liquido interstiziale. L’accumulo patologico che ne può conseguire viene detto edema.
Solo meno dell’1% dell’acqua filtrata dai glomeruli renali viene eliminata con le urine (1-1,5 L al giorno circa). Accanto alle urine altre vie di eliminazione d’acqua sono attraverso la pelle (circa 400mL/giorno), l’espirazione polmonare (circa 350mL/giorno) e le feci (circa 150mL/giorno).
Proteine
Il normale metabolismo delle sostanze azotate comporta una perdita giornaliera sistematica di azoto, sotto forma di urea, acido urico, NH4+, creatinina, aminoacidi e urobilina nelle urine.
Piccole quantità di azoto originato dall’organismo (1-2% del totale) vengono anche eliminate con le feci, la saliva, la desquamazione della cute, i capelli, le unghie, le perdite mestruali nelle donne fertili.
Per assecondare la formazione di nuovi tessuti, l’ipertrofia del muscolo e la produzione di latte è necessario un apporto proteico alimentare superiore a quello necessario per riparare le perdite azotate: bilancio azotato positivo. Quando l’apporto proteico alimentare non è sufficiente a soddisfare il fabbisogno si ha un bilancio azotato negativo.
È indispensabile assicurare che ciascun aminoacido essenziale sia rifornito con gli alimenti nella quantità necessaria!
I fabbisogni di aminoacidi essenziali diminuiscono fortemente con l’avanzare dell’età: nel lattante ammontano al 43% del fabbisogno totale di aminoacidi, nei bambini di 10-12 anni ne costituiscono il 36% e negli adulti il 19%.
Il valore nutrizionale delle proteine alimentari dipende innanzitutto dal loro contenuto in aminoacidi essenziali, che è diverso da una proteina all’altra.
Maggiore è il contenuto relativo di tutti gli aminoacidi essenziali, maggiore è il valore nutrizionale delle proteine!
Digeribilità delle proteine à le proteine della carne, delle uova, del latte e del pesce sono digerite per il 94-97% e la loro digeribilità è posta come 100% nel paragone con proteine di altra origine. Rispetto a queste proteine animali, le proteine dei cereali hanno digeribilità del 85-95% e quelle delle leguminose del 75-80% e pertanto ne dovrà essere impiegata una quantità proporzionalmente maggiore.
Una terza cosa da non trascurare sull’uso delle proteine alimentari è che gli alimenti apportatori di proteine possono contenere altri nutrienti o sostanze importanti per la impostazione di un regime dietetico equilibrato, con particolare riferimento al contenimento delle calorie e al rischio di malattia.
Nel caso delle sorgenti alimentari vegetali il componente addizionale più rilevante è l’amido e, in alcuni casi, e in molto minore quantità, i lipidi; nel caso degli alimenti di origine animale, i lipidi e il colesterolo.
Le proteine plasmatiche hanno concentrazioni costanti ma tempi emivita diversi: 12 ore per la proteina legante il retinolo, 14-20 giorni per albumina. Se il fegato (adibito a produrre queste proteine) ha normale funzionalità, il mantenimento di un livello plasmatico costante di ciascuna di queste proteine è indice di soddisfazione delle esigenze di biosintesi.
Al contrario, un abbassamento del livello è indice di insoddisfacente disponibilità di aminoacidi e quindi di malnutrizione proteica.
La diminuzione del livello della proteina legante il retinolo significa uno stato di malnutrizione recente e a stadio precoce, mentre quella dell’albumina uno stato di malnutrizione proteica di più lunga durata e consolidata!
La malnutrizione proteica è un riscontro non raro in soggetti anziani non adeguatamente seguiti e in pazienti con lungodegenze ospedaliere, anche nei paesi con più florida economica e più efficiente organizzazione dei servizi sanitari.
Carboidrati. Indice glicemico
I carboidrati (in pratica il glucosio) hanno anche valore di nutrienti plastici in quanto prevengono l’insorgere della chetosi e conseguentemente acidosi.
La quantità di glucosio necessaria per questa azione preventiva è di 5g ogni 100 Kcal, ovvero non meno del 20% del fabbisogno calorico giornaliero deve essere coperto dai glicidi.
A seguito di un pasto glicidico, o della somministrazione per via orale di glucosio, la glicemia va incontro ad una escursione (iperglicemia postprandiale) fino a raggiungere un valore del 60-70% superiore a quello basale, per ritornare a valori di partenza (o leggermente più bassi) entro 2 ore dal pasto.
L’area complessiva di incremento della glicemia a seguito di un pasto glicidico entro le 2 ore dal pasto assume un significato importante; infatti, tanto maggiore è quest’area, tanto maggiore è l’esposizione dei tessuti insulino sensibili (fegato, muscolo, t.adiposo) a più elevate concentrazioni ematiche di glucosio e quindi a maggior impiego metabolico di glucosio, inclusa una maggiore incorporazione nei trigliceridi del t.adiposo.
Quanto minore è l’area, tanto minore, in particolare, è l’effetto lipogenetico dei carboidrati alimentari.
Su questa base è fondato il concetto di indice glicemico: posta come riferimento uguale a 100 l’area di incremento della glicemia entro le 2 ore dopo somministrazione di 50 gr di glucosio sciolti in acqua, il rapporto percentuale tra l’area ottenuta dopo la somministrazione di un pasto contenente 50 gr di carboidrati semplici o complessi, e l’area di riferimento è l’indice glicemico per quel carboidrato o meglio l’indice glicemico della forma alimentare con cui quel carboidrato è somministrato.
Un indice glicemico inferiore a 100 è espressione di minore disponibilità di glucosio e quindi di un minore effetto lipogenetico. In altre parole un indice glicemico inferiore a 100 significa che il glucosio contenuto nel pasto è reso disponibile in modo più graduale col risultato di avere una risposta iperglicemica meno accentuata e quindi un “effetto insulinico” meno intenso.
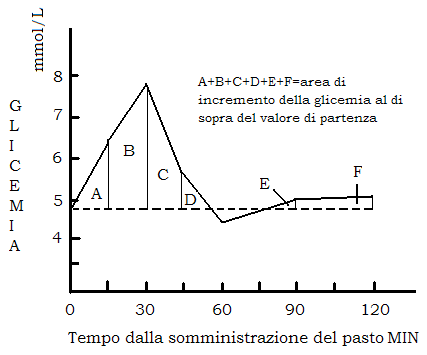
Esiste infatti un rapporto di linearità tra indice glicemico e aumento postprandiale della insulinemia (indice insulinico).
Es. Glucosio à 100
Fruttosio à 23
Saccarosio à 63
Lattosio à 47
Miele à 75 ect…
Lipidi
Un criterio importante nella definizione del fabbisogno è il dato epidemiologico che l’apporto di acidi grassi a lunga catena della serie ω-6 costituisce un fattore importante nella prevenzione di malattie aterosclerotiche, come pure che l’apporto di acidi grassi della serie ω-3 ha uguale valenza per quanto attiene le malattie tromboemboliche.
Un secondo criterio è quello di esprimere la copertura del fabbisogno come percentuale dell’apporto energetico giornaliero totale, che è diverso da un soggetto all’altro.
Pertanto si raccomanda che gli acidi grassi essenziali della serie ω-6 coprano non meno del 2-3% delle Kcal totali e quelli della serie ω-3 lo 0,3-0,8% nell’adulto.
Occorre tuttavia tener presente che una eccessiva assunzione di acidi grassi polinsaturi può essere dannosa sul piano metabolico e funzionale, in quanto la presenza dei doppi legami tra loro vicini facilità l’aggressione da parte dei radicali liberi dell’O2 con formazione di lipoperossidi potenzialmente tossici!
È quindi raccomandabile che gli acidi grassi della serie ω-6 e ω-3 non superino nel loro insieme il 7% delle Kcal giornaliere, con un rapporto ω-6/ ω-3 di 5/1.
La quota di acidi grassi saturi non dovrebbe superare il 7-8% del contenuto calorico totale della dieta.
Il contenuto di colesterolo non dieta non deve superare i 100mg/1000 Kcal giornalieri e 300mg/giorno.
Gli acidi grassi di configurazione non fisiologica “trans” (spesso riscontrabili nei cosiddetti “grassi idrogenati”) si consiglia di evitarli.
Componenti minerali
Nelle cell di ogni tessuto i minerali sono presenti allo stato ionico o in forma di composti (di solito con proteine) in una pressoché costante concentrazione. Questa relativa costanza è dovuta alla rigorosa regolazione del loro assorbimento intestinale e della loro eliminazione attraverso i reni, il sudore e la bile.
La omeostasi dei minerali è essenziale in quanto alcuni di essi, se in concentrazioni eccedenti i livelli normali, possono risultare tossici per l’organismo.
Sodio
È il principale catione dei liquidi extracellulari.
La sua omeostasi è regolata principalmente dall’aldosterone, che ne stimola il riassorbimento a livello dei tubuli renali.
Il contenuto in sodio nell’uomo adulto è di 1,1-1,4 g/Kg e la sua concentrazione nel siero è di circa 3,10-3,34 g/L.
Si ritiene che una eccessiva introduzione di sodio possa causare ipertensione.
Potassio
È il principale catione del liquido intracellulare ed è contenuto nell’organismo umano nella quantità di 2,6 g/Kg. La sua concentrazione nel siero del sangue può variare tra 0,4 e 0,20 g/L.
Al di sotto di queste concentrazioni si manifestano alterazioni della funzione muscolare e cardiaca.
Il riassorbimento del potassio a livello del tubulo renale è un processo molto efficace ma meno efficiente di quello del sodio.
Cloro
Sotto forma di cloruro (Cl¯) è il principale anione inorganico extracellulare distribuito per il 70% nel liquido extracell. (legato al sodio) e per il resto nel liquido intracell. (legato al potassio).
Nell’uomo adulto il contenuto di cloro è intorno a 1,2g/Kg. La cloremia è di 3,4-3,8 g/L.
Il cloro, nella forma di cloruro di sodio e di potassio, contribuisce a determinare la pressione osmotica e interviene nella regolazione del bilancio idro-elettrolitico e dell’equilibrio acido-base.
Il Cl¯ è il principale anione del succo gastrico e i canali del Cl¯ sono coinvolti nella neurotrasmissione di tipo inibitorio.
La principale fonte alimentare di cloro è il cloruro sodico, in piccola parte contenuto negli alimenti di origine animale e per la gran parte aggiunti ai cibi per insaporirli.
Il cloro di origine alimentare viene assorbito prevalentemente nel tratto prossimale dell’intestino tenue, seguendo il gradiente elettrochimico creato dal trasporto di cationi, prevalentemente Na+ e K+. Nel tratto distale è assorbito per scambio con il bicarbonato.
Il cloro viene in grandissima parte riassorbito nel tratto tubulare del rene, associato a Na+ e K+: la porzione eliminata con le urine può arrivare a 8,5g al giorno.
Il cloro è anche eliminato con il sudore e in piccola parte con le feci.
Calcio
È il più abbondante minerale delle ossa alle quali conferisce, in forma di fosfato (idrossiapatite) la caratteristica rigidità.
Un uomo di 70 Kg di peso possiede 1,5 Kg di calcio, il 99% dei quali è nello scheletro.
La concentrazione di calcio nel sangue è intorno a 0,10 g/L.
Nel sangue e negli altri liquidi biologici il calcio è presente in altre forme:
- legato alle proteine (46%)
- in forma di complesso con citrato, fosfato e solfato (6,5%)
- in forma di ione (47,5%)
Il calcio ionizzato (Ca²+) è l’attivatore di numerosi enzimi; inoltre gli ioni calcio partecipano alla trasmissione dei segnali nella cell.
La concentrazione ematica del calcio è sottoposta ad accurata omeostasi sotto il controllo del paratormone, la calcitonina e il 1,25-diidrossicalciferolo.
Una sufficiente introduzione di calcio con la dieta può portare, specie nelle persone anziane, ad osteoporosi, una condizione di progressiva demineralizzazione delle ossa che deriva da uno squilibrio tra riassorbimento dell’osso e sua formazione.
Le ossa più soggette ad osteoporosi sono le vertebre e il femore.
Si manifesta più frequentemente nelle donne e in particolare nell’età della menopausa.
Fosforo
L’organismo umano contiene circa 1Kg di fosforo, di cui l’85% nelle ossa sotto forma di idrossiapatite, il 10% nei muscoli e il resto nel cervello, nel sangue e in altri organi e tessuti.
Nelle soluzioni acquose (come il siero ematico e le urine) è in equilibrio tra le seguenti forme: H3PO4, H2PO4¯, HPO4²¯, PO4³¯, a seconda della concentrazione protonica.
A pH neutro la forma predominante è HPO4²¯, a pH basso è in forma di H3PO4 (acido fosforico).
Nei fosfati organici, il gruppo fosforico aumenta la idrofilicità del composto riducendo di molto la sua tendenza a penetrare nell’interno delle membrane. Per questo motivo il passaggio delle molecole fosforilate attraverso le membrane è sempre mediato da trasportatori specifici.
Nel sangue e nelle urine il sistema “fosfati inorganici” gioca un ruolo importante nella regolazione del pH dell’organismo e dell’equilibrio idroelettrolitico.
L’escrezione dei fosfati è controllata dal paratormone che diminuisce il riassorbimento tubulare e aumenta la fosfaturia, e dagli ormoni tiroidei e della crescita che, invece, aumentano il riassorbimento tubulare.
L’apporto giornaliero raccomandato di fosfato è tra 1 e 1,2 g.
Magnesio
Il contenuto di magnesio nell’organismo umano è di 0,5 g/Kg, di cui il 60% è localizzato nelle ossa in forma di fosfato.
Il 35% circa del magnesio del sangue e dei liquidi extracell. è legato specificamente alle proteine, il restante 65% in gran parte ionizzato (Mg²+) costituisce la frazione funzionalmente attiva.
Il magnesio è eliminato giornalmente con l’emuntorio renale (ovvero con la pipì J): la perdita è, nell’adulto, di circa 100mg al giorno.
Il magnesio è richiesto per l’attività di numerosi enzimi e l’ATP stesso viene spesso utilizzato in forma di complessi con gli ioni Mg.
Ferro
Il contenuto in ferro dell’uomo adulto è di circa 50mg/Kg e della donna 40mg/Kg. Questa differenza è ascrivibile alla diversa “massa magra” nei due sessi.
Il ferro è associato a due tipi di composti: eme e non eme.
I primi, rappresentati fondamentalmente da emoglobina, mioglobina e citocromi, contengono i ¾ del ferro totale.
Il ferro non eme (¼ del ferro totale) è rappresentato dai complessi “Fe-S”, dagli enzimi a ferro (fra cui aconitasi, xantina ossidasi, fenilalanina idrossilasi) e dai composti di deposito e trasporto (emosiderina e ferritina).
La ferritina è la proteina associata alla quale il ferro si deposita nei tessuti. Il ferro entra nella ferritina in forma ferrosa (bivalente) e viene ossidato nell’ambito della ferritina con un meccanismo non ancora chiaro.
Altra proteina di deposito del ferro è la emosiderina, presente nei lisosomi e considerata prodotto di parziale degradazione della ferritina.
La transferrina è la proteina che trasporta il ferro da organo a organo, rilasciandolo alla cell dopo essersi legata ad uno specifico recettore.
Le migliori sorgenti alimentari di ferro sono le carni, i legumi e i cereali. Il latte, invece, è alimento piuttosto povero di ferro.
Rame
Il contenuto di rame nel corpo umano adulto è stimato nell’ambito di 50-120mg, con maggior concentrazione nel fegato e nel cervello.
Viene assorbito nello stomaco e nella prima porzione dell’intestino tenue attraverso il legame con la metallotioneina presente nelle cell della mucosa intestinale.
Appena entrato nel sangue si lega all’albumina e da essa viene trasferito dal fegato che in parte lo utilizza e in parte lo restituisce all’intestino, tramite la bile.
Fra l’altro il fegato incorpora il rame nella apoceruloplasmina per formare la ceruloplasmina, una proteina di grandi dimensioni che ha la funzione di ossidare il Fe²+ in Fe³+, il quale si lega alla transferrina che lo trasporta in periferia.
Iodio
La funzione dello iodio deriva dall’essere componente degli ormoni tiroidei. L’organismo umano ne contiene 10-12g per l’80% presenti nella tiroide, la quale ha la capacità di concentrare lo iodio da 20 a 40 volte rispetto al contenuto plasmatico, il quale oscilla, a seconda dell’apporto con gli alimenti, tra 0,4 e 5µg/L.
Lo iodio (I2) della dieta viene convertito in ioduro (I¯) nel tratto intestinale e come tale assorbito e captato dalla tiroide.
Alimenti ricchi di iodio sono i pesci di mare, i molluschi e i crostacei. La dose raccomandata di assunzione giornaliera è di 150µg.
Fluoro
Il fluoro si accumula nelle ossa e nei denti scambiandosi con gli ioni ossidrilici della idrossiapatite.
Quello che arriva all’organismo attraverso gli alimenti, viene assorbito rapidamente ed efficacemente (oltre il 90%). L’assorbimento è facilitato dai lipidi e ridotto da calcio e sodio.
Il fluoro promuove la neoformazione dell’osso stimolando gli osteoblasti, serve per la conversione del calciofosfato in apatite e promuove la cristallizzazione della apatite stessa. Previene la carie dentaria esercitando azione di rinforzo sullo smalto con conseguente protezione dei denti dall’attacco di batteri e acidi.
L’acqua è spesso ricca di fluoro e oltre ad essa, le foglie di thé, il pollame, uova, pesci e frutti di mare.
È raccomandata una assunzione giornaliera di 1,5-4mg.
Digestione e assorbimento dei nutrienti
Solo raramente il nutriente contenuto negli alimenti è utilizzato totalmente: la quota effettivamente assunta e metabolizzata a livello cell. è detta quota biodisponibile.
La biodisponibilità di un nutriente è la risultante di 3 processi:
- la digeribilità
- l’assorbimento
- la utilizzazione cellulare
Digestione degli alimenti
I distretti in cui avviene la digestione sono:
- il cavo orale con una superficie mucosale di contatto di circa 0,07m², contenente la secrezione delle g.parotidee e linguali (saliva) di pH 7.0
- lo stomaco, con superficie di contatto di 0,11m² e un secreto (succo gastrico) di pH 1.5-3.5
- l’intestino tenue con superficie di contatto di alcune migliaia di m² ed un secreto (succo intestinale) di origine in parte intestinale e in parte pancreatica (succo pancreatico) ed epatica (bile) di pH 5-7.
I processi digestivi sono assoggettati ad un fine controllo nervoso ed endocrino:
- la secrezione salivare, che produce enzimi digestivi e mucine (glicoproteine che conferiscono scorrevolezza al bolo alimentare) è stimolata attraverso il sistema nervoso parasimpatico (colinergico) nella fase cefalica (stimoli visivi e olfattivi) e postcefalica (stimoli tattili e gustativi)
- la secrezione gastrica, contenente mucine protettive, acido cloridrico e pepsinogeno, è in stretta relazione con l’ingestione di cibo e il suo arrivo allo stomaco
- la secrezione di acido cloridrico, da parte delle cell parietali delle fossette gastriche è promossa da 3 fattori, uno nervoso, uno endocrino e uno paracrino
- la stimolazione nervosa, mediata dall’acetilcolina, è in parte cefalica e in parte post-cefalica, quest’ultima basata su stimoli gustativi e meccanici (distensione della parete gastrica a seguito dell’arrivo di cibo)
- la stimolazione endocrina è dovuta alla gastrina, secreta dalle cell enteroendocrine delle fossette gastriche, in risposta alla presenza nel lume gastrico di materiale di origine alimentare (alcuni aminoacidi liberi, peptidi, caffeina, alcool e Ca²+)
- la stimolazione paracrina è affidata all’istamina che è liberata dalle cell della parete gastrica a contatto con il materiale alimentare e agisce sulle cell parietali attraverso recettori-H2.
La gastrina stimola anche la secrezione di pepsinogeno da parte delle cell principali. La denaturazione delle proteine alimentari, provocata dall’acidità del succo gastrico, facilita fortemente il loro attacco da parte della pepsina.
Il passaggio del chimo (prodotto della digestione gastrica) nel duodeno, attraverso lo sfintere pilorico, stimola recettori duodenali che innescano il riflesso enterogastrico. Questo riflesso consiste da un lato nella attenuazione della secrezione gastrica dovuta a riduzione dell’attività parasimpatica e, dall’altro, nella contrazione dello sfintere pilorico dovuta a stimolazione nervosa simpatica.
In questo modo il transito del chimo nel duodeno è tenuto sotto controllo mentre si innesca la digestione a livello intestinale. Infatti l’acidità del chimo e la distensione delle pareti duodenali provocano la secrezione di 3 ormoni da parte delle cell endocrine del duodeno e del digiuno:
- la secretina, che induce la secrezione di succo pancreatico ricco in bicarbonati ed inibisce la contrazione e la secrezione gastrica
- la colecistochinina che stimola la secrezione di succo pancreatico ricco in enzimi digestivi e la contrazione della cistifellea con conseguente immissione di bile nel duodeno
- il peptide inibitore gastrico che pure inibisce la contrazione e secrezione gastrica.
Terminato lo svuotamento dello stomaco le stimolazioni del chimo gradualmente si attenuano ed anche l’assetto digestivo dell’intestino volge verso lo stato di riposo.
Assorbimento dei nutrienti
Circa l’80% delle cell della mucosa dell’intestino tenue, tutte provviste di orletto a spazzola, sono addette all’assorbimento, offrendo una superficie assorbente di migliaia di m².
L’assorbimento avviene:
- via transcellulare, per diffusione, sostenuta dal gradiente di concentrazione, attraverso la membrana apicale (dal lume intestinale alla cell) e la membrana basolaterale (dalla cell ai capillari sanguigni). La diffusione può essere passiva e non specifica, nel caso di molecole idrofobiche (acidi grassi, colesterolo..), o facilitata con intervento di proteine-pori, e quindi saturabile e specifica, praticata da molecole idrofiliche (fruttosio, alcune vitamine..);
- via paracellulare, attraverso le giunzioni strette tra cell adiacenti, con diffusione dipendente dal gradiente di concentrazione di tipo passivo o facilitato. È praticata da alcuni minerali e oligopeptidi;
- via transcitotica, mediata da specifici recettori presenti sulla membrana apicale, con formazione di vescicole che migrano verso la membrana basolaterale, con la quale si fondono riversando il loro contenuto all’esterno, ovvero verso il letto vasale. È utilizzata da alcuni minerali, vitamine e oligopeptidi ed il processo è specifico e saturabile;
- via del trasporto attivo, mediata da trasportatori specifici, dipendente da ATP e saturabile. È utilizzata da aminoacidi, glucosio, galattosio, alcune vitamine idrosolubili e alcuni minerali.
Particolarmente attenzione merita l’assorbimento dell’acido folico e della vitamina B12.
Il primo richiede il previo distacco dei residui dell’acido glutammico contenuti nei γ-oligoglutammati (le forme sotto le quali l’acido folico è presente negli alimenti vegetali) fino a produrre acido pteroil-monoglutammico. Il distacco avviene sulla superficie dell’orletto a spazzola degli enterociti, particolarmente di quelli del digiuno prossimale, ed è catalizzato dalla pteroil-poliglutammato idrolasi.
L’assorbimento della B12 (cobalamina) è un processo alquanto complesso. La cobalamina è liberata dalle proteine alimentari che la contengono a livello dello stomaco, ad opera della pepsina e si lega alla cobalofillina (o transcobalamina I), una proteina presente nella saliva e attivata dall’ambiente acido dello stomaco.
Il complesso vitamina-cobalofillina passa nel duodeno dove la cobalofillina viene degradata e la cobalamina si aggancia al fattore intrinseco, una glicoproteina secreta dalle cell parietali della mucosa gastrica.
Il complesso vitamina-fattore intrinseco interagisce quindi con un recettore specifico che si trova sulla superficie apicale delle cell mucosali dell’ileo e viene internalizzato per endocitosi.
Le vescicole endocitotiche si fondono quindi con la membrana basale e la vitamina è secreta nel sangue. In quest’ultima fase del processo la cobalamina si lega ad un’altra proteina sintetizzata dall’epitelio, la transcobalamina II, ed il complesso formatosi viene trasportato nel sangue.
A livello periferico il complesso interagisce con un recettore specifico attraverso il quale la vitamina viene assunta dalle cell per endocitosi ed utilizzata.
Le vitamine liposolubili vengono assorbite con meccanismo passivo, in associazione con i prodotti della digestione dei lipidi.
L’assorbimento dei minerali dipende innanzitutto dalla loro forma chimica:
- minerali ionizzati solubili quali Na+, K+, Cl¯, F¯, I¯ sono facilmente assorbiti
- minerali che formano chelati di vario tipo possono essere più o meno facilmente assorbiti a seconda del tipo di chelante
- chelanti solubili sono facilmente assorbiti
- chelanti insolubili (con fibre o altri ligandi) sono poco o nulla assorbiti
- lo stato di ossidazione può influenzare l’assorbimento dei minerali; Fe, Cu, Se sono più facilmente assorbiti nella forma meno ossidata
- il pH può pure giocare un ruolo rilevante; infatti il pH acido del succo gastrico facilita la ionizzazione e quindi l’assorbimento del Ca e del Fe
- l’associazione del minerale a proteine può favorirne o impedirne l’assorbimento: il Fe-eme viene più facilmente assorbito del Fe non eme
Discorso a parte merita il Ca il cui assorbimento, nella forma di Ca ione avviene attraverso
- un processo di trasporto attivo, più efficace alle più basse concentrazioni del lume, a livello degli enterociti del duodeno e del digiuno prossimale intestinale
- un processo passivo paracellulare operativo a livello del digiuno distale e dell’ileo più efficace alle alte concentrazioni luminari di Ca.
Il processo attivo inizia con il legame del Ca con una proteina locata nella membrana apicale, chiamata IMCAL, con conseguente trasporto del calcio, presumibilmente per endocitosi, all’interno dell’enterocita.
All’interno della cell il Ca si ancora ad un’altra proteina, la calbindina che lo porta verso la membrana vaso laterale dove la pompa Ca²+ - ATPasi sposta il calcio entro il letto capillare.
La espressione della IMCAL e della calbindina è indotta dalla 1,25 (OH)2-calciferolo che, inoltre, attiva la pompa del calcio, donde il concetto che l’assorbimento del calcio è vitamina D dipendente.
L’intestino crasso nei processi di digestione e assorbimento
L’intestino crasso, lungo circa 1,5 m nei soggetti adulti, ha innanzitutto il ruolo di assorbire la maggior parte dell’acqua ingerita con gli alimenti (formazione di feci compatte).
È pure sede di una grande varietà di batteri, la flora batterica intestinale, la quale idrolizza materiale saccaridico e proteico che è sfuggito alla digestione o è resistente alla digestione e promuove processi fermentativi con produzione di gas (CO2, idrogeno, metano..) e acidi grassi a breve catena (acetato, propionato..) nonché etanolo. Tutti questi composti sono assorbiti e metabolizzati.
I batteri intestinali producono inoltre vitamine (la K e alcune del gruppo B), trasformano i sali biliari da primari a secondari (rimozione dell’ossidrile in C7; distacco di glicina e taurina), favorendone il riassorbimento, e trasformando la bilirubina negli urobilinogeni e coprobilinogeni.
Componenti alimentari fisiologicamente utili ma privi di valore nutrizionale
Fibre alimentari
Sono i polisaccaridi non amidacei e non digeribili. Si tratta di polisaccaridi vegetali con funzione strutturale, presenti nelle parti lignee dei vegetali e nella frutta, oppure con funzione di deposito e di riserva in alternativa all’amido, e presenti nei semi.
Fibre strutturali sono:
- la cellulosa
- le pectine
- le emicellulose
- i β-glucani e arabinoxilani o pentosani
- la chitina
Fibre di riserva sono:
- i glucomannani e galattomannani
- i galattani
- gli xiloglucani
- l’inulina
Di questi polisaccaridi non disponibili, facilmente acquisibili con diete ricche di cereali, legumi, verdura e frutta, alcuni sono solubili (come l’inulina e le pectine) e altri insolubili (come la cellulosa).
Le fibre alimentari sono resistenti agli enzimi digestivi e quelle insolubili anche agli enzimi propri della flora batterica intestinale.
Nell’ambiente intestinale associano acqua e assumono una consistenza collosa, sollecitando così la peristalsi intestinale e conferendo quindi maggiore consistenza e scorrevolezza alle feci. Inoltre associano sali biliari facilitandone l’eliminazione, facilitano poi la crescita di batteri intestinali non putrefacenti e assorbono prodotti vari del metabolismo microbico intestinale ad azione citotossica, proteggendo così le cell intestinali da insulti lesivi.
Esercitano pure un ruolo importante nell’abbassare l’indice glicemico di alimenti contenenti saccaridi semplici o complessi.
Un buon contenuto di fibre solubili e insolubili nella dieta determina:
- una riduzione significativa dei livelli ematici di colesterolo totale e legato alle LDL
- un significativo abbassamento del rischio di neoplasia al grosso intestino (crasso)
- un miglioramento del controllo del metabolismo glicidico nei soggetti diabetici
Probiotici e prebiotici
Tra i microorganismi presenti normalmente nell’intestino tenue e crasso una posizione dominante hanno i lattobacilli e i bifidobatteri.
Essi, che partecipano alla sintesi di vitamine e vari metaboliti utilizzabili, e alla trasformazione degli acidi biliari primari in secondari, svolgono anche un ruolo primario nel mantenimento dell’equilibrio microbico intestinale, inibendo la crescita di microorganismi patogeni mediante la liberazione di potenti sostanze ad azione battericida selettiva, le batteriocine.
Il riequilibrio della flora batterica intestinale può essere facilitato con l’introduzione di alimenti ricchi di lattobacilli e bifidobatteri. Vere e proprie colture arricchite di questi microorganismi sono le varie forme di latti fermentati spontaneamente secondo antiche tradizioni (es. yogurt). Alimenti di questo tipo si dicono probiotici.
Altre sostanze alimentari che contengono sostanze capaci di facilitare la crescita di questi batteri fino a riequilibrare la flora batterica intestinale sono chiamate probiotici.
Probiotici à microorganismi vivi
Prebiotici à non sono microorganismi viventi ma ingredienti alimentari non digeribili che costituiscono un substrato di crescita per alcuni microorganismi utili (lattobacilli e bifidobatteri) di cui riescono a potenziare l’attività e quindi la numerosità
Sostanze antiossidanti
Gli antiossidanti sono sostanze in grado, anche a concentrazioni molto basse, di inibire processi ossidativi causati dalle specie radicaliche dell’O2 in virtù della loro idoneità a partecipare a reazioni di ossido-riduzione.
La loro azione è basata sulla capacità di
- eliminare le specie radicaliche dell’O2, impedendo così l’insorgenza del processo radicalico
- chelare metalli impedendo loro di andare incontro a modificazioni del proprio assetto elettronico e quindi di partecipare a reazioni radicaliche
- interrompere la propagazione di reazioni radicaliche
Antiossidanti sono presenti in alimenti sia vegetali che animali.
Le vitamine A, C ed E hanno potente azione antiossidante.
Le più note famiglie antiossidanti di origine vegetale sono:
- carotenoidià di natura idrofobica
- polifenoli e flavonoidià di natura idrofilica
I carotenoidi comprendono l’α- e il β-carotene, progenitori della vitamina A, il γ-carotene, il licopene, la luteina, le aldeidi polieniche a lunga catena (C30 e C40) e altre sostanze simili, tutte capaci di sequestrate l’ossigeno singoletto.
Il licopene dispone della più potente azione sequestrante ed è particolarmente abbondante nel pomodoro, anguria, pompelmo rosa e papaia.
I flavonoidi, riscontrati negli alimenti sono una famiglia di sostanze che posseggono una struttura base catechinica (combinazione di una porzione flavinica con una polifenolica) idonea a chelare metalli ed a partecipare a reazioni di ossidoriduzione attraverso la transizione chinone à idrochinone.
Possono pertanto impedire, attraverso la chelazione, l’innesco di reazioni radicaliche da parte di metalli o la propagazione radicalica riappaiano elettroni spaiati.
Particolarmente ricchi di bioflavonoidi e polifenoli sono il pepe verde, la cipolla, gli agrumi, i broccoli, il prezzemolo, l’uva, la carota, il pomodoro, il kiwi, la patata, l’anguria, la pesca, il cetriolo, le olive e il the.
Assetto metabolico a seguito di un pasto
Si consideri un pasto tipo con un contenuto calorico di 500-700Kcal di cui il 55-60% come glicidi, il 25-30% come lipidi e il 12-15% come proteine e si esaminino le variazioni postprandiali di concentrazione ematica di insulina, glucosio, acido lattico, acidi grassi liberi e trigliceridi legati ai chilomicroni o alle lipoproteine totali.
Già dopo 30 minuti dal termine del pasto la concentrazione ematica di insulina subisce un aumento di 8-10 volte fino a raggiungere valori di 500-600 pmol/L, valori che si mantengono elevati fino a 1 ora per poi decrescere rapidamente fino a riportarsi a livelli iniziali dopo 5-6 ore.
Dopo 3-4 ore dal pasto, al contrario, il livello di glucagone incomincia ad aumentare fino a raggiungere i valori massimi al termine del giornaliero digiuno notturno.
Parallelamente al comportamento dell’insulina, la glicemia subisce un aumento rispetto ai valori di partenza (80-90mg/100mL) del 60-70% con massimo dopo 30-60 min, per ritornare ai valori iniziali entro le 2 ore dal termine del pasto.
Anche la concentrazione ematica di acido lattico aumenta di oltre 2,5 volte con massimo di 1,2 mmol/L dopo 1 ora e ritorna ai valori di partenza dopo 4-5 ore.
Al contrario la concentrazione degli acidi grassi liberi nel sangue (0,5-0,55 mmol/L) si abbassa rapidamente e drasticamente fino a valori di 1/10 ad 1 ora dal termine del pasto per poi aumentare gradualmente e raggiungere i valori di partenza dopo 6 ore.
I trigliceridi legati ai chilomicroni incominciano a comparire nel sangue dopo 1 ora dalla fine del pasto ed aumentano fino a raggiungere il massimo di concentrazione (0,2-0,25 mmol/L) a 4 ore per poi diminuire fino a scomparire del tutto alla fine del digiuno notturno.
I trigliceridi plasmatici totali hanno un comportamento simile a quello dei chilocromi passando da 0,6-0,7 a 1,4-1,5 mmol/L, dopo 4-5 ore dal pasto, per ritornare ai valori di partenza dopo 7-8 ore.
Subito dopo il pasto con l’incremento del rapporto insulina/glucagone prevalgono gli effetti dell’insulina su enzimi e trasportatori operanti nel metabolismo glicidico e lipidico. Tali effetti si fondano principalmente:
- sul prevalere della de fosforilazione a carico di quegli enzimi la cui attività dipende dalla presenza o meno di esteri fosforici
- sulla induzione di enzimi e trasportatori che, precedentemente, non erano o erano poco espressi.
Nel caso del fegato, l’organo che per primo risponde all’azione dell’insulina, l’ingresso di glucosio dal circolo portale, è governato dal trasportatore del glucosio GLUT2. L’elevata Km di questo trasportatore (7-10mM) consente facile assunzione di glucosio che, durante l’assorbimento intestinale, raggiunge nel circolo portale concentrazioni anche 3-4 volte superiori a quelle del circolo generale: sono quindi l’elevato gradiente di concentrazione di glucosio e la bassa affinità del trasportatore a “spingere” il glucosio negli enterociti.
La glicolisi decorre ai massimi regimi in quanto enzimi chiave del processo (F-6-P-chinasi e piruvato-chinasi) raggiungono le massime velocità in condizioni di defosforilazione. Anche la piruvato deidrogenasi è attiva nella forma defosforilata, consentendo pronta formazione di acetil-CoA il cui aumento stimola la piruvato carbossilasi con produzione di ossaloacetato. Si raggiunge pertanto un assetto metabolico in cui il rifornimento del ciclo di Krebs avviene per il tramite dell’ossaloacetato di origine glucidica, e l’acetil-CoA è anche di origine glucidica.
Di conseguenza l’approvvigionamento energetico avviene, pressoché per intero, a carico del glucosio!
L’insulina attiva l’acetil-CoA carbossilasi che porta alla formazione di malonil-CoA, stimola l’espressione degli enzimi della biosintesi ex-novo degli acidi grassi, con produzione di acidi grassi a lunga catena, e attiva la β-idrossi-β-metilglutaril-CoA reduttasi, favorendo la produzione di mevalonato e quindi di composti isoprenoidi e colesterolo.
Finché malonil-CoA è presente nel citosol viene esercitata potente azione inibitoria sulla carninita-acil-CoA transferasi del complesso carnitina-dipendente ubicato sulla membrana mitocondriale interna e addetto al trasferimento degli acil-CoA dal citosol al mitocondrio.
Di conseguenza il rifornimento di acil-CoA entro il mitocondrio viene a mancare, il processo della β-ossidazione degli acidi grassi rimane silente e l’unica sorgente di acetil-CoA è il glucosio.
L’insulina gioca infine un ruolo chiave nel fegato nella biosintesi del glicogeno. La glicogeno sintetasi, infatti, è attiva nella forma defosforilata, forma prevalente in presenza di insulina.
Il flusso della glicogenosintesi aumenta ulteriormente quando il citrato, esportato dal mitocondrio al citosol, raggiunge concentrazioni tali da inibire allo stericamente la F-6-P chinasi; in queste circostanze, che si realizzano 1-2 ore dal pasto, il flusso glicolitico si riduce e il quadro metabolico tende ad avviarsi verso l’innesco della gluco(neo)genesi che si attua dopo 3-4 ore dal pasto.
Per quanto attiene gli organi e tessuti extraepatici gli effetti dell’insulina sono particolarmente evidenti a livello del t.adiposo e del muscolo scheletrico, ove l’ormone provoca innanzitutto il passaggio del trasportatore del glucosio GLUT4 dal citosol alla membrana plasmatica.
L’aumento dei trasportatori sulla membrana, in concomitanza con la maggiore disponibilità di glucosio nel sangue, facilita l’ingresso di glucosio, con incremento del flusso glicolitico.
L’incremento è tale che in parte la glicolisi decorre in condizioni anaerobiche con forte produzione di acido lattico che passa nel sangue: donde la forte iperlatticidemia nelle prime due ore dopo il pasto. Sarà compito del fegato di assumere l’acido lattico, ossidarlo ad acido piruvico e utilizzarlo, particolarmente, per la gluconeogenesi.
Nel muscolo scheletrico il deposito principale è il glicogeno, la cui massima concentrazione si raggiunge dopo 4-5 ore dal pasto; piccola invece è la quantità di glucosio incorporata nei trigliceridi.
Nel t.adiposo invece il deposito è costituito dai trigliceridi e l’azione dell’insulina è imponente. L’effetto più precoce dell’insulina in questo tessuto è la defosforilazione della lipasi con immediato blocco della sua azione e del rilascio nel sangue di acidi grassi; è questa la causa della drastica caduta dei livelli ematici degli acidi grassi liberi osservabili già entro 1 ora dalla fine del pasto.
Il t.adiposo è il più ricco di lipoproteine lipasi, del tipo suscettibile all’attivazione e induzione da parte dell’insulina: gran parte degli acidi grassi quivi formatisi sono direttamente assunti dagli adipociti ed avviati alla biosintesi dei trigliceridi, il rimanente distribuendosi nel circolo sanguigno.
Gli acidi grassi liberatisi passano prevalentemente in circolo determinando l’innalzamento dei livelli di acidi grassi liberi nel sangue, che si fa sempre più cospicuo dopo 3-4 ore dal pasto.
Gli aminoacidi liberatisi vengono assorbiti a livello intestinale, raccolti nel circolo portale e avviati nel fegato. La composizione amminoacidica del sangue portale è diversa da quelle delle proteine alimentari: il contenuto percentuale di alanina è aumentato e quello della glutammina diminuito.
Nel fegato gli aminoacidi vengono metabolizzati, interconvertiti tra di loro, in parte trattenuti per soddisfare il fabbisogno proteico epatico e, per il resto, restituiti al circolo venoso refluo e distribuiti in periferia. La composizione del “pool” di aminoacidi nel circolo portale è differente da quella del “pool” del sangue venoso refluo dal fegato; quest’ultimo è caratterizzato da un elevato contenuto dei 3 aminoacidi a catena ramificata: leucina, isoleucina e valina.
Assetto metabolico al termine del digiuno fisiologico notturno
Dopo 4-5 ore dal pasto o sopravviene un nuovo pasto, oppure si entra nel digiuno notturno, della durata di 5-7 ore.
Questo periodo è caratterizzato da livelli ematici molto bassi di insulina (50-60 pmol/L), più elevati di glucagone (20-25pmol/L) e da una moderata stimolazione della midollare del surrene con liberazione di adrenalina nonché della più bassa concentrazione di glucosio (4-5 mmol/L) e di lattato (0,45-0,5 mmol/L) e la più elevata di acidi grassi liberi (0,5-0,6 mmol/L).
Basso rapporto insulina/glucagone à prevalere degli enzimi nella forma fosforilata e scomparsa degli effetti di induzione selettiva di alcune proteine esercitati dall’insulina.
In queste condizioni il glucosio che entra nel torrente circolatorio proviene pressoché esclusivamente dal fegato, per glicogenolisi (per circa 2/3) e per gluconeogenesi (per 1/3).
Al termine del digiuno notturno il fabbisogno energetico basale è soddisfatto dalla ossidazione degli aminoacidi per l’8-10%, dal glucosio per il 35-40% e dagli acidi grassi per il 48-55%.
L’ATP prodotto è utilizzato prevalentemente nella biosintesi proteica (circa 23%), nell’esercizio delle pompe Na+/K+ (circa il 21%) e Ca²+ (circa 10%), nella gluconeogenesi (circa 10%) e quindi nella ureogenesi (circa 5%), nella funzione della ATPasi miosinica ed altre attività metaboliche.
Assetto metabolico nel digiuno prolungato
Per digiuno prolungato si intende la massima durata di astensione dal cibo che un soggetto inizialmente in buone condizioni nutrizionali (ovvero normopeso e in stato di salute) può sopportare.
In questa condizione deve essere reso possibile un adeguato apporto di:
- glucosio o altro combustibile al t.nervoso
- glucosio agli eritrociti e alla midollare renale e surrenale
- acidi grassi al t.muscolare
Deve essere cioè garantito l’esercizio delle funzioni fondamentali: vigilanza nervosa, trasporto dell’ossigeno, escrezione renale delle scorie metaboliche, secrezioni endocrine, attività muscolare.
Il digiuno prolungato ha inizio dopo 10-12 ore dall’ultimo pasto!
Carboidrati e proteine possono essere utilizzati anche al completo e le proteine al 50% in quanto oltre un certo limite la riduzione delle proteine muscolari (e quindi della massa muscolare) porta a insufficienza respiratoria, e quella della proteine plasmatiche ad abbassamento delle difese immunitarie, con inesorabile comparsa di complicanze mortali (es. polmoniti).
Per un soggetto di 65Kg sarebbero disponibili circa 144.000Kcal che coprono teoricamente il fabbisogno di 72 giorni (circa 2000Kcal al giorno).
L’assetto endocrino del digiuno prolungato è caratterizzato da un sempre più basso rapporto insulina/glucagone, da una certa attivazione del sistema adrenergico, dalla graduale diminuzione dell’ormone tiroideo T3 nel sangue e aumento di cortisolo.
Di conseguenza la prevalenza della fosforilazione delle proteine sostenuta da glucagone e adrenalina si accentua, mantenendo attiva la glicogenolisi (fino ad esaurimento del glicogeno che avviene entro al seconda giornata) e la lipolisi.
L’associazione glucagone-cortisolo, agendo a livello dell’espressione genica in senso induttivo, provoca rilevanti modificazioni del quadro enzimatico tessutale.
Nel muscolo aumentano le catepsine, enzimi proteolitici che liberano aminoacidi i quali, a seguito di processi di transaminazione, vengono immessi in circolo, prevalentemente sotto forma di alanina e glutammina.
Nel fegato aumentano:
- le transaminasi, la glucosio-6-P fosfatasi, la fruttosio 1,6-difosfato fosfatasi, la piruvato carbossilasi e la fosfoenolpiruvato-carbossilchinasi col risultato di incentivare la gluconeogenesi da α-chetoacidi di origine aminoacilica;
- la piruvato deidrogenasi-chinasi, responsabile della fosforilazione (e quindi inattivazione) dell’enzima con blocco della decarbossilazione ossidativa del piruvato e conseguente avvio di piruvato e lattato alla gluco(neo)genesi;
- la carnitina-palmitoiltransferasi e la β-idrossi-β-metilglutaril-CoA sintetasi (nei mitocondri) con stimolo del processo β-ossidativo degli acidi grassi e della formazione di corpi chetonici;
- la glutamminasi e gli enzimi del ciclo dell’urea che incentivano la rimozione dei gruppi aminici, rilasciati dagli aminoacidi, sotto forma di urea.
La prima fase, che occupa le prime due giornate dall’ultimo pasto, è caratterizzata da un consumo costante di glucosio di 7-8 g/ora. Il glucosio trae origine dalla glicogenolisi epatica e muscolare e dalla gluconeogenesi da lattato, glicerolo e chetoacidi di origine aminoacilica.
È la proteolisi muscolare la fonte degli aminoacidi la cui catena carboniosa è avviata alla formazione di glucosio. Il muscolo cede al sangue alanina e glutammina. L’alanina è assunta direttamente dal fegato e la glutammina prevalentemente dall’intestino dove viene convertita in alanina che, immessa nel circolo portale, giunge al fegato.
Dopo la seconda giornata si entra nella seconda fase detta di “preparazione all’adattamento al digiuno” che dura circa 3 settimane. In questa fase si raggiunge un assetto metabolico tale da risparmiare il più possibile proteine pur producendo glucosio e garantendo la soddisfazione del fabbisogno energetico.
Questo nuovo assetto è fondato sulla riduzione del metabolismo basale dovuto alla diminuzione della T3 e all’abbondanza di acidi grassi derivante dalla incentivazione della lipolisi.
Nel fegato il maggior flusso della β-ossidazione, che ne consegue, produce una quantità di acetil-CoA eccedente rispetto a quella che può essere ossidata nel ciclo di Krebs.
Pertanto una sempre crescente quantità di acetil-CoA viene avviata alla biosintesi dei corpi chetonici, la cui concentrazione ematica sale da 0,2-0,2 mmol/L al secondo giorno a 6-6,5 mmol/L dopo 22-24 giorni.
L’aumento in circolo dei corpi chetonici e quindi di H+, stimola la escrezione di H+ a livello renale, anche nella forma di NH4+.
Questo processo è sostenuto da maggior assunzione da parte del rene di glutammina (di origine prevalentemente muscolare) e di altri aminoacidi con drenaggio dei gruppi amminici e avvio delle catene carboniose verso la gluconeogenesi: il rene quindi si aggiunge al fegato nel sostenere la gluconeogenesi!!
Il t.nervoso in particolare assume i corpi chetonici in notevole quantità e, al termine del periodo di adattamento, quasi la metà del proprio fabbisogno energetico è coperto dai corpi chetonici.
Dopo le prime 3 settimane di digiuno il consumo totale di glucosio si è ridotto al 40-50% rispetto a quello esistente all’inizio del digiuno.
Si entra così nella terza fase del digiuno caratterizzata dall’adattamento alla privazione di cibo. In questa condizione il t.nervoso viene a soddisfare per 2/3 il proprio fabbisogno calorico con i corpi chetonici, e per solo 1/3 con glucosio.
Gli eritrociti continuano a funzionare con glucosio di riciclo, in quanto assumono glucosio dal sangue restituendo lattato che, captato dal fegato e ossidato a piruvato, viene ricondotto a glucosio.
La midollare del rene e del surrene funziona pure a glucosio quindi è dipendente dalla gluconeogenesi.
Il muscolo cardiaco ossida acidi grassi e corpi chetonici e il muscolo scheletrico acidi grassi.
Anche il fegato continua a funziona ad acidi grassi. La gluconeogenesi epatica utilizza acido lattico, glicerolo e chetoacidi di origine aminoacidica e quella renale solo le catene carboniose aminoacidi che.
Questa situazione è un “estremo metabolico” e può protrarsi per qualche settimana di più o di meno a seconda dell’abbondanza iniziale delle scorte lipidiche del t.adiposo.
Quando però le proteine dell’organismo cominciano ad essere degradate per oltre il 50%, la debolezza muscolare è tale che sopravviene il decesso.
Fonte: http://www.medwiki.it/sites/default/files/Biochimica%20della%20nutrizione.doc
Sito web da visitare: http://www.medwiki.it/
Autore del testo: non indicato nel documento di origine
Parola chiave google : Biochimica della nutrizione tipo file : doc
Visita la nostra pagina principale
Biochimica della nutrizione
Termini d' uso e privacy