Biologia appunti parte 2
Biologia appunti parte 2
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Struttura primaria
Ogni proteina si differenzia dalle altre essenzialmente per la sua struttura primaria, cioè per la particolare sequenza di amminoacidi che la caratterizza.
Struttura secondaria
Non appena un filamento proteico viene sintetizzato esso passa subito in struttura secondaria. Tale struttura si produce grazie alla possibilità di rotazione dei gruppi CH rispetto ai gruppi peptidici (CONH) lungo tutto il filamento.
La rotazione è invece impedita lungo il legame peptidico C-N che presenta un parziale carattere di doppio legame (vi è risonanza tra il doppio legame C=O ed il legame singolo C-N).
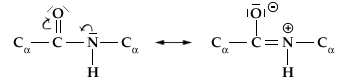
Gli atomi del gruppo peptidico (CONH) giacciono tutti su di un medesimo piano. Questi piani possono ruotare rispetto al carbonio-alfa. In questo modo, ogni piano delle unità peptidiche ha due rotazioni possibili: una intorno al legame tra il carbonio-alfa e l’atomo di azoto del gruppo peptidico Ca-N (angolo di rotazione Φ, fi), l’altra intorno al legame tra l’atomo di carbonio-alfa e l’atomo di carbonio del gruppo peptidico Ca-C' (angolo di rotazione ψ, psi).
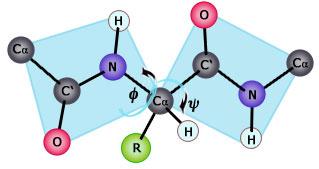
Tali rotazioni permettono al filamento proteico di avvolgersi su se stesso secondo schemi diversi, raggiungendo una struttura finale stabile.
Vi sono diversi tipi di configurazioni secondarie, tutte rese stabili da ponti idrogeno che si instaurano tra i gruppi peptidici che la torsione interna del filamento porta uno di fronte all'altro (l'idrogeno fa da ponte tra due elementi molto elettronegativi: l'azoto e l'ossigeno).
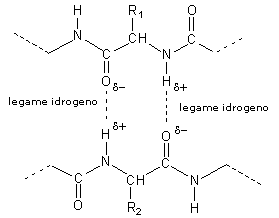
Ma per motivi di reciproco ingombro sterico dei grossi gruppi laterali R e affinché sia ottimizzata la stabilizzazione del filamento attraverso la formazione di legami Idrogeno intracatena, gli angoli ψ e Φ possono assumere solo determinati valori e di conseguenza il filamento proteico assume solo certe configurazioni secondarie. In altri termini, ogni struttura secondaria è caratterizzata da particolari valori degli angoli ψ e Φ.
In sintesi, sono dunque due i fattori che determinano la struttura secondaria di una proteina e che hanno l'effetto di rendere minima l'energia potenziale della molecola:
- minimizzazione dell'ingombro sterico fra i gruppi R
- ottimizzazione della formazione di legami H intracatena
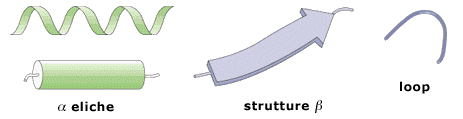
Il risultato di queste restrizioni fa sì che gli elementi di struttura secondaria si possano ricondurre sostanzialmente a tre sole diverse tipologie stabili: alfa-elica, foglietto-beta e ripiegamenti (loop). Nelle rappresentazioni proteiche schematiche questi tre elementi strutturali vengono visualizzati rispettivamente come spirali (o cilindri), frecce e fili curvilinei
a) Struttura secondaria ad elica (helix)
Nelle proteine possono esistere diverse conformazioni ad elica, ma tra queste la più rappresentativa è certamente l’alfa-elica (a elica).
L'alfa-elica è il risultato della conformazione secondaria probabilmente più "naturale" che una catena peptidica possa assumere e rappresenta pertanto l'elemento di struttura secondaria più comune nelle proteine.
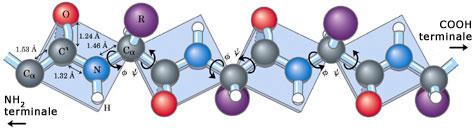
Il filamento proteico si avvolge a formare una spirale (una specie di molla) resa stabile dai ponti idrogeno che si formano tra spira e spira. In un'alfa-elica, i legami ad idrogeno dello scheletro sono organizzati in modo che il C=O dell'ennesimo gruppo peptidico punti verso l’N-H del (n+4)mo gruppo peptidico. Ciò produce un forte ponte ad idrogeno che presenta una lunghezza N---O quasi ottimale di 2,8 Å
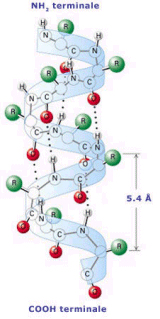
I residui amminoacidici (-R) sporgono esternamente al filamento spiralizzato (elica). La distanza tra spira e spira (passo) è di 5,44 Å, il raggio dell'elica è di 2,3 Å ed in ogni spira sono presenti 3,67 amminoacidi (Pauling e Corey). L' alfa-elica presente nelle proteine è quasi sempre destrorsa
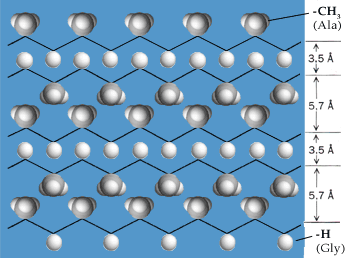
b) Struttura secondaria a foglietto beta (b-sheet)
Nella struttura secondaria beta il filamento proteico (strand) presenta un andamento a zig-zag Le configurazioni beta per il loro andamento caratteristico vengono anche dette a foglio pieghettato(pleated sheet). I gruppi peptidici formano le pagine del foglio, mentre gli atomi di carbonio tetraedrico (Ca) formano le pieghe con i residui amminoacidici che si presentano alternati sempre in corrispondenza della parte convessa della piega.
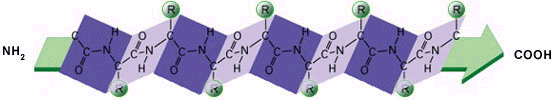
Molto spesso nelle proteine, due o più filamenti beta (β-strands) tendono ad affiancarsi lateralmente ed a legarsi tramite ponti a idrogeno, generando strutture estese, pieghettate, dette foglietti β.
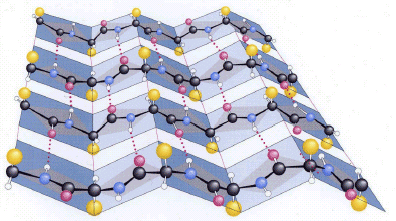
Nei foglietti β, i filamenti possono essere orientati reciprocamente in senso antiparallelo o parallelo. In quest'ultimo caso, i foglietti sono meno stabili e si incontrano pertanto più raramente nella struttura delle proteine.
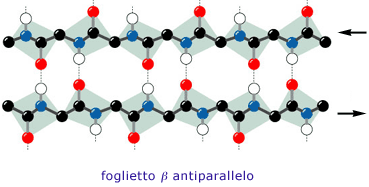
La "geometria" dei legami a idrogeno è diversa a seconda che questi uniscano filamenti con orientamento antiparallelo o parallelo. Nel primo caso sono perpendicolari all'asse dei filamenti (e risultano quindi ottimali per direzionalità) e più corti.
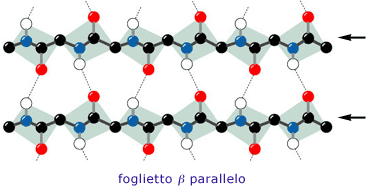
L'orientamento indicato dalle frecce è quello convenzionale, ovvero nella direzione NH2 → COOH
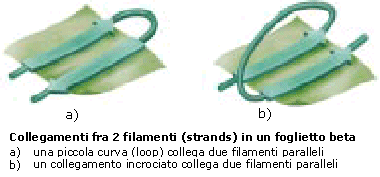
Normalmente i foglietti β non sono planari, ma tendono ad assumere nell'insieme una forma incurvata e lievemente "avvitata".
Torsione destrorsa di due
filamenti in un foglietto beta
c) Strutture secondarie: Ripiegamenti (turn) ed anse (loop)
Oltre ai due elementi regolari di struttura secondaria appena descritti, nelle proteine sono presenti tratti di catena coinvolti in ripiegamenti "a gomito" che invertono la direzione della catena polipeptidica permettendole di ripiegarsi nella struttura terziaria.
Questi tratti, definiti ripiegamenti ed anse, fanno da collegamento fra alfa-eliche o filamenti β ed hanno un ruolo assai importante nella organizzazione 3D della catena peptidica (struttura terziaria). Nelle proteine in struttura terziaria queste configurazioni curvilinee arrivano a rappresentare circa un terzo delle strutture secondarie presenti.
Molto comuni sono le brevi curve di 3-5 residui (β-turns) che collegano due filamenti β consecutivi, orientati in modo antiparallelo.
In queste strutture secondarie curvilinee è quasi costante la presenza degli amminoacidi glicina e/o prolina.
La glicina, presentando un Idrogeno come gruppo R e quindi un limitato ingombro sterico, può assumere angoli ψ e Φ non consentiti ad altri amminoacidi. La glicina può così avere un ruolo importante nella struttura proteica, potendo far assumere alla catena angolazioni "insolite".
La prolina è in realtà un imminoacido poichè al posto del gruppo amminico -NH2, presenta il gruppo imminico -NH-. Quando la prolina entra a far parte di una proteina il gruppo imminico perde il suo unico idrogeno nella formazione del legame peptidico. In questo modo non si forma un gruppo peptidico CONH, ma un gruppo CON. In tali condizioni non può dunque formarsi il legame idrogeno e le strutture secondarie regolari (eliche e foglietti) risultano instabili in corrispondenza dei punti in cui si trova la prolina.
Le proteine filamentose o fibrose
Le proteine sono state classificate storicamente in fibrose (o filamentose) e globulari, in relazione alla loro morfologia generale. Questa suddivisione è legata ai vecchi metodi utilizzati per la determinazione della struttura della proteina su scala atomica e non fa giustizia delle proteine che contengono sia regioni estese e filamentose che regioni più compatte, altamente ripiegate e globulari. Tuttavia tale classificazione permette di sottolineare le proprietà delle proteine fibrose, insolubili, che hanno spesso un ruolo protettivo, connettivo o plastico negli organismi viventi. Le proteine fibrose meglio caratterizzate, la cheratina, la miosina, la fibroina ed il collagene, sono molecole allungate la cui conformazione è dominata da un singolo tipo di struttura secondaria. Sono quindi esempi utili di questi elementi strutturali.
Le cheratine sono il componente fondamentale degli annessi cutanei degli animali (capelli, peli, unghie, corna strati superficiali della pelle, piume, etc.)
L'unità della cheratina è costituita da una coppia di alfa-eliche destrorse strettamente superavvolte (coiled-coil) in senso sinistrorso e rinforzate da numerosi ponti disolfuro intercatena.
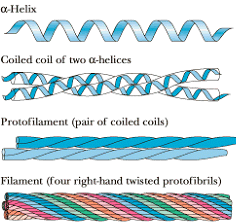
A loro volta queste unità si avvolgono fra loro a formare strutture di ordine superiore ( protofilamenti, protofibrille e filamenti).
Uno schema tipico è il "9 + 2", con due protofibrille centrali circondate in modo regolare da nove protofibrille a formare un filamento. Un singolo capello è formato da numerosi di questi filamenti.
Il collagene è una proteina che per le sue eccezionali doti di resistenza alla trazione va a costituire gran parte del tessuto connettivo (tendini, cartilagini, derma, etc). L'unità fondamentale del collagene, il tropocollagene, è una struttura elicoidale superavvolta (coiled-coil) con andamento destrorso, formata da tre catene polipeptidiche (tripla elica), ciascuna delle quali ha una struttura secondaria ad elica sinistrorsa (elica del collagene), diversa dall'alfa-elica.
L'elica del collagene, oltre ad essere sinistrorsa, è infatti più "stirata" (ha un passo quasi doppio rispetto all'alfa-elica) ed ha un diametro inferiore, avendo solo tre residui amminoacidici per giro.
Ogni singola catena è formata da circa 1000 amminoacidi ed è pressoché completamente avvolta ad elica.
|
La torsione opposta delle eliche (simile a quella di una fune ritorta) conferisce al collagene notevoli proprietà di rigidità, un elevato carico di rottura e la possibilità di mantenere costante la sezione sotto tensione. |
La struttura tipica dell'elica del collagene è dovuta alla particolare sequenza amminoacidica delle catene, che è costituita per oltre un terzo da glicina e per almeno un quinto da prolina e idrossiprolina.
Esistono diversi tipi di collageno, ma in tutti quanti si ritrova una ripetizione monotona di triplette con sequenza Gly-X-Y, in cui X è spesso Prolina e Y è spesso Idrossiprolina.
Ogni "terzo" residuo della catena è quindi una glicina e solo questa presenza, in questa posizione, rende possibile il superavvolgimento estremamente compatto della tripla elica.
Le unità del tropocollagene si organizzano in fibre, disponendosi in maniera sfalsata, parallelamente, lungo l'asse della fibra. La fibra è resa ancor più resistente e rigida dalla formazione di legami crociati, di tipo covalente, che si instaurano fra residui di lisina o di istidina delle unità e anche all'interno della stessa unità, tra le singole catene polipeptidiche.
Il collagene cambia facilmente di forma se riscaldato, Diventa solubile e forma facilmente soluzioni colloidali (collagene = che genera colla).
La fibroina è la proteina della seta. A differenza di collagene e cheratina, la fibroina ha una struttura beta, organizzata in estesi foglietti, pieghettati a ventaglio.
La fibroina è ricchissima di alanina e glicina, che si alternano nella sequenza primaria.
Ciò consente ai foglietti β di disporsi in piani sovrapposti, ravvicinati e compatti, tenuti insieme da deboli interazioni apolari fra i residui laterali di alanina e glicina. Questa particolare organizzazione rende la seta morbida e flessibile.
La miosina, una delle due proteine che costituiscono le fibre muscolari, ha una struttura mista: è costituita da due catene pesanti, che si organizzano in una lunga coda fibrosa (costituita da due alfa-eliche superavvolte) e in due teste globulari, alla cui composizione concorrono anche quattro catene leggere.

Strutture supersecondarie: motivi e dominii
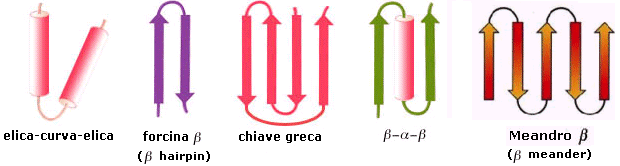
Praticamente in tutte le proteine di cui sia nota la struttura 3D, gli elementi fondamentali di struttura secondaria si trovano combinati in particolari motivi strutturali di struttura supersecondaria.
I motivi strutturali più ricorrenti sono i seguenti:

Le catene proteiche che contengono più di 200 residui amminoacidici si piegano solitamente in due o più agglomerati globulari noti come dominii, che danno a queste proteine un aspetto bi- o multilobato.
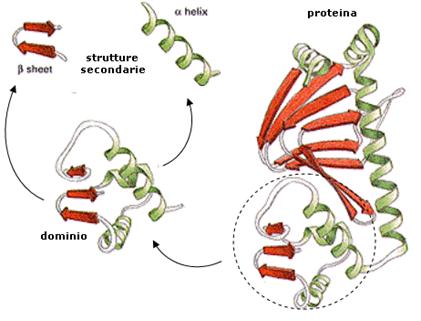
I dominii sono in genere formati dall’aggregazione di diverse strutture secondarie ed hanno spesso una funzione specifica come il riconoscimento sterico di una piccola molecola.
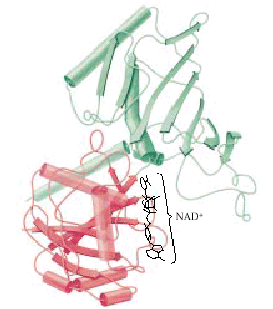
Gliceraldeide 3-fosfato deidrogenasi
Il dominio in rosso lega il NAD+
Il dominio in verde lega la gliceraldeide
Struttura terziaria: le proteine globulari
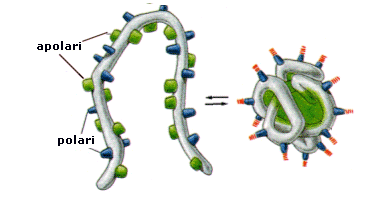
La maggior parte delle proteine, dopo aver raggiunto la struttura secondaria, subisce un ulteriore processo di torsione. Avvolgendosi ulteriormente su se stesse, tali proteine formano una specie di matassa globulare, caratteristica della struttura terziaria. detta struttura nativa. Per la loro configurazione compatta le proteine in struttura terziaria vengono dette proteine globulari.
Il processo di ripiegamento (folding) dei filamenti secondari è reso possibile dalla formazione di snodi lungo il filamento stesso.
Come abbiamo visto, tra le cause alla base della formazione di tali snodi o gomiti vi è la presenza dell'amminoacido prolina. La prolina è in realtà un imminoacido poichè al posto del gruppo amminico -NH2, presenta il gruppo imminico -NH-. Quando la prolina entra a far parte di una proteina il gruppo imminico perde il suo unico idrogeno nella formazione del legame peptidico. In questo modo non si forma un gruppo peptidico CONH, ma un gruppo CON. In tali condizioni non può dunque formarsi il legame idrogeno e la struttura secondaria risulta quindi instabile in corrispondenza dei punti in cui si trova la prolina.
Le articolazioni che in tal modo si formano (ripiegamenti ed anse) consentono a tratti diversi del filamento secondario di avvicinarsi reciprocamente interagendo attraverso i residui amminoacidici. Le interazioni idrofile ed idrofobiche tra i residui, e tra questi e l'acqua in cui le proteine normalmente si trovano, costringono il filamento proteico a contorcersi. La proteina si aggroviglia fino a raggiungere una forma a globulo, in cui i residui amminoacidici polari si trovano alla superficie (a contatto con l'acqua), mentre i residui amminoacidici apolari si introflettono all'interno del globulo. Tale disposizione, diminuendo il rapporto superficie/volume e concentrando i gruppi polari sulla superficie esterna, rende in genere solubile la proteina.
La struttura globulare viene poi ulteriormente stabilizzata da legami interni alla molecola. Tra questi tipi di interazioni, le più frequenti sono:
- L'effetto idrofobico, che induce le sostanze non polari a minimizzare i loro contatti con l’acqua, è la causa principale della stabilità della struttura nativa della proteina.
- Formazione di legami ionici tra residui amminoacidici carichi positivamente (lisina, istidina, arginina) e residui carichi negativamente (ac. aspartico, ac. glutammico). Circa il 75% dei residui elettricamente carichi nelle proteine appartengono a coppie ioniche e sono localizzati prevalentemente sulla superficie della proteina con formazione di coppie ioniche
- Formazione di “ponti salini” dati da un catione metallico coordinato da due o più ioni carbossilati
- Legami ad idrogeno
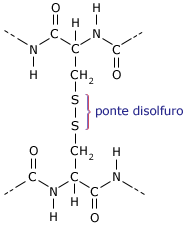
- Ponti disolfuro
Particolarmente diffusi sono i ponti disolfuro (-S-S-) che si formano tra due gruppi solfidrilici -SH (il gruppo solfidrile è presente solo nell'amminoacido cisteina).
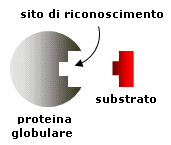
In tal modo una proteina globulare risulta particolarmente irregolare, presentando una superficie ricca di incavi, anfrattuosità e sporgenze. Ogni proteina globulare presenta delle irregolarità caratteristiche (sito attivo o sito di riconoscimento) che utilizza in modo peculiare per riconoscere una specifica sostanza chimica (substrato) ed effettuare su di essa azioni biologiche specifiche. Il riconoscimento è altamente selettivo ed avviene secondo un modello chiave-serratura.
E' per questo motivo che ogni cambiamento di struttura e quindi di forma può sconvolgere completamente la funzionalità proteica. Ad esempio le variazioni di pH, modificando la distribuzione di polarità nei residui amminoacidici, possono influenzare drasticamente il modo in cui una proteina si ripiega su se stessa, modificandone la struttura.
Per le loro caratteristiche di solubilità e per l'azione di riconoscimento altamente specifica, le proteine globulari svolgono negli organismi importantissime funzioni di regolazione, di controllo e di trasporto. Vediamone alcuni esempi.
1) Gli anticorpi, prodotti da particolari globuli bianchi (linfociti), sono in grado di riconoscere ed agganciare sostanze estranee e potenzialmente pericolose (antigeni), consentendo all'organismo di eliminarle.
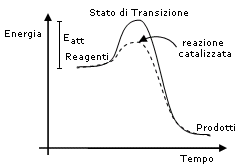
2) Gli enzimi sono dei catalizzatori biologici, molecole in grado di riconoscere, agganciare e modificare chimicamente una sostanza chimica (reagenti), aumentando la velocità con cui la reazione avviene.
Come tutti i catalizzatori anche gli enzimi non si consumano durante la reazione, ma si ritrovano inalterati al termine di ciascun ciclo di catalisi. E' per questo motivo che essi risultano efficaci anche in piccolissime concentrazioni.
Ogni enzima riconosce in modo specifico il suo substrato ed esiste quindi un enzima specifico per ogni reazione che deve avvenire in una cellula.
Senza gli enzimi la maggior parte delle reazioni all'interno delle cellule sarebbe talmente lenta da non essere compatibile con la sopravvivenza dell'organismo.
Attraverso gli enzimi inoltre, la cellula controlla in un dato momento quali reazioni devono essere eseguite e quali no. In tal modo gli enzimi funzionano come veri e propri interruttori biologici: quando l'enzima è presente la reazione avviene, quando l'enzima è eliminato la reazione rallenta al punto da produrre effetti trascurabili.
In genere gli enzimi catalizzano le reazioni legandosi temporaneamente con altre molecole dette coenzimi o cofattori. Molto spesso i coenzimi non sono molecole proteiche. La parte non proteica di una proteina composta è detta gruppo prostetico. Molti coenzimi derivano chimicamente dalle vitamine, molecole indispensabili al nostro metabolismo che dobbiamo giornalmente introdurre in piccole dosi tramite l’alimentazione.
Mentre gli enzimi riconoscono la sostanza da catalizzare (specificità di substrato), il coenzima effettua su di essa la modificazione chimica (specificità di azione). Uno stesso coenzima può legarsi ad enzimi diversi, conservando la sua specificità di azione ed effettuando così la stessa reazione su substrati diversi. Gli enzimi hanno desinenza –asi.
Famiglia |
Reazione catalizzata |
Ossidoreduttasi |
Ossidoriduzioni |
Transferasi |
Trasferimento gruppi chimici |
Idrolasi |
Idrolisi |
Liasi |
Addizione a doppio legame |
Isomerasi |
Conversione tra isomeri |
Ligasi |
Formazione legami con consumo ATP |
|
Catalisi |
3) Gli ormoni sono molecole secrete nel sangue dalle nostre ghiandole endocrine (le ghiandole esocrine secernono fuori dal sangue). Esistono ormoni proteici ed ormoni steroidei (derivati dal colesterolo). Gli ormoni hanno il compito di regolare svariate funzioni di cellule, tessuti ed organi, inibendole o stimolandole. Ogni ormone deve essere in grado di “riconoscere” specificatamente il tipo di cellule sulle quali agire (cellule bersaglio). Per questo motivo le cellule presentano sulla loro membrana esterna particolari molecole di riconoscimento (recettori di membrana) che rappresentano il substrato al quale si lega il sito attivo dell’ormone.
4) Le proteine di trasporto (carriers) sono in grado di agganciare e trasportare specifiche sostanze chimiche. Alcune di queste proteine sono disciolte nel sangue e trasportano sostanze per via ematica. Altre sono immerse nella membrana cellulare (proteine transmembraniche o integrali) e permettono alla cellula di scambiare sostanze con l’ambiente esterno. Queste ultime si dividono in pompe e canali. Le pompe consumano energia per effettuare il trasporto (trasporto attivo), mentre i canali sono in grado di trasportare sostanze attraverso la membrana senza consumare energia (trasporto passivo).
La Mioglobina è un esempio classico di proteina globulare di trasporto. Svolge la propria funzione nel muscolo, dove costituisce una riserva di ossigeno, prontamente disponibile per le fibre muscolari. E’ un esempio di proteina coniugata che, a differenza delle proteine semplici, contiene un gruppo prostetico di natura non proteica: il gruppo ferro-eme, deputato al legame dell'O2.
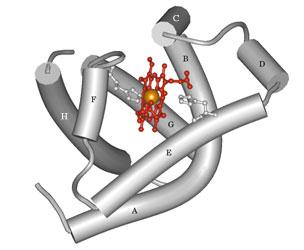
La mioglobina è una proteina relativamente piccola, costituita da 153 amminoacidi. Quasi l'80% della catena polipeptidica ha una struttura ad a-elica.
Nella conformazione 3D sono riconoscibili otto distinte strutture ad a-elica (A, B, C, D, E, F, G, H, in direzione N →C), ripiegate in modo apparentemente irregolare, ma caratteristico e tale da creare una tasca idrofobica che accoglie il gruppo prostetico ferro-eme.
È probabile che l'idrofobicità della tasca che ospita il gruppo eme sia di estrema importanza per il mantenimento dello stato ridotto dello ione Fe2+ e quindi della funzionalità della proteina. Lo ione Fe3+ è infatti incapace di legare l'ossigeno ed è stato osservato che il Fe2+-eme libero in soluzione ha una spiccata tendenza ad ossidarsi spontaneamente a Fe3+.
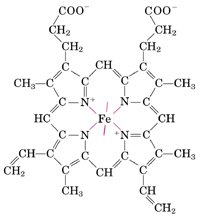
Il gruppo eme è un complesso coordinato, formato da una porfirina sostituita (protoporfirina IX) e lo ione Fe2+.
La porfirina presenta una struttura planare costituita da quattro anelli di pirrolo (un eterociclo pentatomico contenente un atomo di azoto), uniti da ponti metinici (-CH-).
Lo ione Fe2+ si trova al centro della struttura, legato con quattro dei suoi sei legami di coordinazione ai quattro atomi di azoto del tetrapirrolo.
Legandosi con un altro legame di coordinazione ad un residuo di istidina (detta F8, perché è nell'ottava posizione dell'elica F), il Fe àncora saldamente alla proteina l'intero gruppo eme.
Il sesto legame di coordinazione del Fe è quello che lega la molecola di O2. Al legame dell'ossigeno contribuisce anche una istidina (E7), mediante un ponte Idrogeno.
Oltre che nella mioglobina, l'eme è presente nell’emoglobina e nei citocromi (proteine che trasportano elettroni nella catena respiratoria), nella clorofilla e nella vitamina B12. In queste due ultime molecole il Fe è tuttavia sostituito rispettivamente da Mg e Co.
Il gruppo eme
5) I marcatori ed i recettori sono particolari proteine di membrana, che permettono alla cellula di scambiare segnali chimici con l’ambiente esterno. I recettori sono in grado di ricevere informazioni agganciandosi con molecole esterne come gli ormoni o i neurotrasmettitori secreti dalle cellule nervose (neuroni). I marcatori sono molecole che le cellule espongono come segnali chimici per altre cellule. Ne sono un tipico esempio i marcatori che le cellule del nostro organismo espongono per farsi riconoscere e non farsi attaccare dalle cellule del nostro sistema immunitario.
Struttura quaternaria
Per buona parte delle proteine, la struttura terziaria rappresenta l'ultimo livello di organizzazione strutturale.
È il caso delle proteine cosiddette monomeriche, costituite cioè da un'unica unità funzionale, biologicamente attiva.
Molte altre proteine (ad esempio, un gran numero di enzimi), nella loro forma attiva sono invece costituite dall'associazione di due o più unità di struttura terziaria (dette monomeri o subunità), uguali (proteine omo-oligomeriche) o diverse (proteine etero-oligomeriche).
Si parla in tal caso di struttura quaternaria, per riferirsi all'organizzazione multimerica della proteina.
Nella struttura quaternaria, le subunità sono tenute insieme da interazioni generalmente non covalenti, spesso di natura idrofobica.
Raramente, più catene peptidiche sono unite da legami covalenti, come accade ad esempio nelle immunoglobuline (una classe di anticorpi), in cui le catene leggere e pesanti sono tenute insieme da ponti disolfuro.
Altrettanto insolito è il coinvolgimento diretto di legami a ponte di idrogeno nell'associazione di più subunità. Nella struttura quaternaria infatti, le subunità tendono ad affiancarsi in modo da contrapporre l'una all'altra le loro porzioni idrofobiche, rivolgendo verso l'esterno le regioni polari, idrofile.
L' emoglobina è un esempio classico di una proteina in struttura quaternaria. La proteina è un tetramero costituito dall'associazione di due catene a (141 amminoacidi) e due catene β (146 amminoacidi), ciascuna delle quali lega un gruppoeme. Il gruppo eme contiene un atomo di ferro in grado di legarsi debolmente ed in modo reversibile con l’ossigeno (O2). L’emoglobina è una proteina di trasporto in grado di trasferire i gas respiratori dai polmoni ai tessuti e viceversa.
emoglobina
Le subunità sono tenute insieme da numerose interazioni idrofobiche e da diversi legami a idrogeno che rendono la struttura quaternaria assai stabile.
Contenendo quattro gruppi eme, l'emoglobina può legare fina a 4 molecole di O2. Ma il fatto notevole è che essa ha la capacità di modulare la propria affinità per l'ossigeno in funzione della concentrazione (pressione parziale) dell'ossigeno stesso.
Ciò è possibile grazie alla struttura oligomerica della proteina. Il legame di una molecola di O2 ad una subunità provoca infatti una variazione conformazionale nelle subunità adiacenti, tale da far aumentare la loro affinità per l'ossigeno (la loro capacità di legare l'ossigeno). Maggiore è il numero di subunità che legano l'ossigeno, più cresce l'affinità degli altri siti di legame.
Questo fenomeno, comune a molti enzimi oligomerici, prende il nome di cooperatività.
L’emoglobina si caratterizza per il fatto di produrre una curva di saturazione in funzione della concentrazione del substrato con un caratteristico andamento sigmoide (a forma di esse). La mioglobina, proteina monomerica, non può ovviamente presentare il fenomeno della cooperatività e, legando l'ossigeno sempre con la stessa affinità, obbedirà ad una cinetica classica, con una tipica curva di saturazione iperbolica.
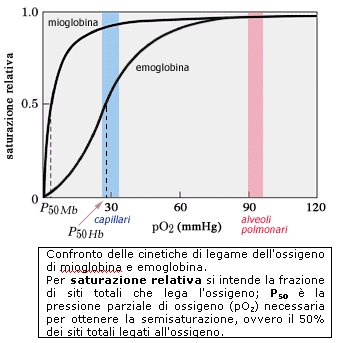
La differente cinetica di legame dell'ossigeno rende le due proteine particolarmente adatte allo specifico ruolo che esse devono svolgere come trasportatori di O2.
L'emoglobina ha il compito di "fare il pieno" di ossigeno in un distretto dove la pO2 (pressione parziale dell’ossigeno) è elevata (alveoli polmonari) e rilasciarlo facilmente in quei distretti in cui la pO2 è relativamente bassa (tessuti periferici).
Se avesse le caratteristiche della mioglobina, fosse cioè in grado di legare l'O2 con affinità elevata, ma costante, l'emoglobina potrebbe assolvere bene il primo compito, ma non il secondo. Come si può desumere dal grafico, un trasportatore come la mioglobina (P50 = ca. 3 mmHg), raggiungerebbe una saturazione pressoché completa (ca. 97%) negli alveoli polmonari, ma resterebbe saturo per circa il 90% nei capillari e quindi non potrebbe cedere facilmente l'ossigeno ai tessuti.
L'aspetto veramente critico dell'intera questione risiede nel fatto che la differenza della pressione parziale dell'ossigeno nei due distretti non è poi così rilevante: varia infatti solo di un fattore tre fra alveoli polmonari e capillari.
Solo una proteina con una cinetica cooperativa potrebbe assolvere in maniera ottimale la funzione di trasportatore di ossigeno dai polmoni ai tessuti periferici.
Qualche numero servirà a rendere più evidente la straordinaria efficienza dell'emoglobina nello svolgere il compito che le è assegnato.
L'emoglobina ha una P50 pari a ca. 30 mmHg, più o meno la pO2 presente nei capillari, dove l'emoglobina ha pertanto una saturazione intorno al 50%. Se la sua affinità rimanesse costante, negli alveoli polmonari essa raggiungerebbe a malapena il 75% di saturazione; viceversa, grazie al fenomeno della cooperatività, è in grado di raggiungere una saturazione quasi completa.
D'altro canto, la mioglobina, mantenendo costantemente elevata la propria affinità, può svolgere adeguatamente il ruolo di riserva di ossigeno, prontamente disponibile, nei tessuti periferici.
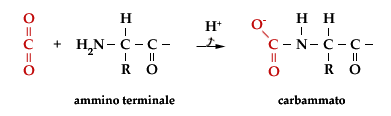
L'emoglobina ha anche l'importante funzione di trasportatore di CO2. La CO2 viene trasportata come carbammato, legato all'-NH2 del gruppo N-terminale di ciascuna catena
Esistono anche proteine in struttura quaternaria in cui le subunità si aggregano a formare, come le perle di una collana, strutture filamentose che svolgono in genere funzioni strutturali. Ne sono tipici esempi l’actina e la tubulina.
L'actina è costituita da numerosi monomeri globulari (G-actina), associati a formare una coppia di lunghi filamenti, avvolti a spirale fra loro (F-actina).

Nel sarcomero, l'unità contrattile delle fibre muscolari, diverse molecole di miosina si associano in fasci, con le teste sfalsate, a costituire i cosiddetti filamenti spessi; mentre le molecole di actina, associate con altre due proteine (tropomiosina e troponina) formano i filamenti sottili.
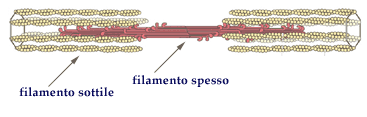
Lo scorrimento reciproco dei filamenti di actina e di miosina producono l’accorciamento del sarcomero e la conseguente contrazione muscolare
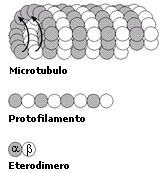
La tubulina è una proteina costituita da un eterodimero formato da una subunità a ed una subunità b. L’unità dimerica polimerizza a spirale formando dei microtubuli. Ciascun microtubulo risulta formato da 13 protofilamenti paralleli in cui le subunità alfa e beta si alternano. La cellula è in grado di montare e smontare i microtubuli molto rapidamente, aggiungendo o togliendo le unità dimeriche. I microtubuli vengono utilizzati dalla cellula per scopi diversi (ciglia, flagelli, fuso mitotico, citoscheletro) che verranno trattati in seguito.
Acidi nucleici: DNA ed RNA
Gli acidi nucleici sono l’acido desossiribonucleico (DNA) e l’acido ribonucleico (RNA). Prendono il loro nome dal fatto di essere presenti nel nucleo delle cellule.
La loro funzione è quella di contenere l’informazione genetica e renderla disponibile per guidare il metabolismo cellulare. Ogni organismo viene costruito e fatto funzionare a partire da un “progetto genetico” scritto nel suo DNA e reso operativo tramite il suo RNA.
Gli acidi nucleici presentano una struttura molecolare per molti versi analoga a quella delle proteine. Infatti, come le proteine, anche gli acidi nucleici sono costituiti da “collane” formate dalla successione ordinata di molecole più piccole. Ma mentre i mattoni che formano le proteine sono i 20 tipi di amminoacidi, gli acidi nucleici si formano a partire da 4 tipi di nucleotidi.
L’analogia tra la struttura molecolare delle proteine e quella degli acidi nucleici non è casuale. Le informazioni genetiche sono infatti “codificate” negli acidi nucleici come “successione dei nucleotidi”. La cellula trasforma poi la successione dei nucleotidi in una ben precisa successione di amminoacidi. In altre parole, la particolare sequenza dei nucleotidi negli acidi nucleici rappresenta le informazioni genetiche necessarie per definire la struttura primaria di tutte le proteine di un organismo.
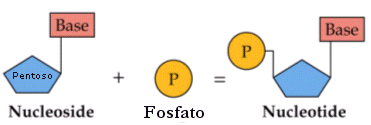
Un nucleotide è formato dall’unione di un pentoso che si lega ad una molecola di acido fosforico H3PO4 (gruppo fosfato) e ad una base azotata con legami di condensazione. In particolare si definisce nucleoside l’unione di un pentoso con una base azotata, mentre l’unione di un nucleoside con un gruppo fosfato genera un nucleotide (o nucleoside monofosfato).
Base + Pentoso = Nucleoside
Nucleoside + Fosfato = Nucleotide
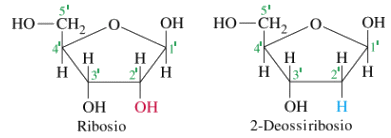
Il DNA è costituito da 4 tipi di nucleotidi diversi da quelli che formano l’RNA
Nei 4 nucleotidi del DNA il pentoso è il desossiribosio (o deossiribosio), una molecola di ribosio che ha perso un atomo di ossigeno, mentre nell’RNA il pentoso è il Ribosio.
I 4 nucleotidi si differenziano tra di loro per le basi azotate (le basi azotate sono in questo analoghe ai gruppi R nelle proteine)
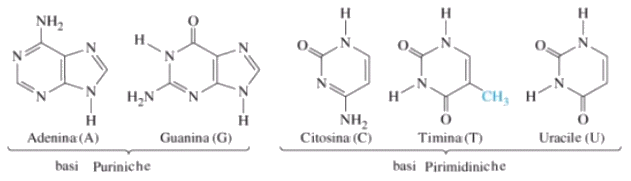
Le basi azotate del DNA sono:
Adenina (A) Timina (T) Citosina (C) Guanina (G)
Le basi azotate dell’RNA sono:
Adenina (A) Uracile (U) Citosina (C) Guanina (G)
In altre parole i nucleotidi dell’RNA si differenziano da quelli del DNA solo per lo zucchero (ribosio al posto di deossiribosio) e per l’Uracile che sostituisce la Timina.
Adenina e Guanina sono basi puriniche
Citosina Timina ed Uracile sono basi pirimidiniche
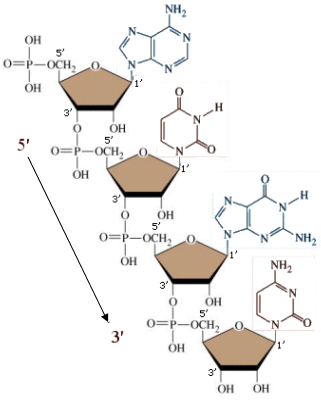
Lo zucchero lega la base azotata in posizione 1’ (uno-primo) ed il gruppo fosfato in posizione 5’ (cinque-primo).
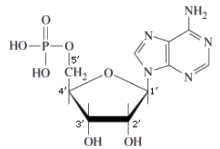
I 4 nucleotidi del DNA in forma libera (non legati nella catena del DNA) vengono indicati con le seguenti sigle: I 4 nucleotidi dell’RNA in forma libera vengono indicati con le seguenti sigle: I nucleotidi si legano tra loro in successione tramite legami fosfo-diesterei. L’ossidrile libero in posizione 3’ (tre-primo) del pentoso viene utilizzato per legare il gruppo fosfato del nucleotide successivo. In questo modo si forma una catena in cui si succedono zucchero e fosfato, mentre le basi azotate rimangono sporgenti. La catena presenta quindi una precisa direzionalità, presentando ad un estremo il carbonio 5’ (impegnato con un gruppo fosfato) ed all’altro estremo il carbonio 3’ libero (non legato al gruppo fosfato). Le catene degli acidi nucleici vengono sempre montate in direzione 5’ → 3’. |
|
La struttura secondaria del DNA: la doppia elica
In natura il DNA si presenta con una struttura secondaria a doppia elica frutto dell’associazione di due singoli filamenti.
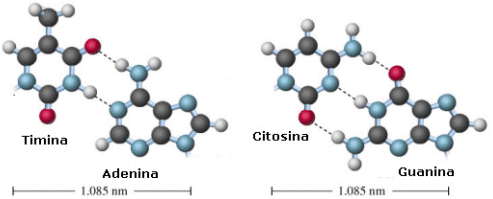
L’accoppiamento delle due catene si realizza attraverso la formazione di ponti a idrogeno tra le rispettive basi azotate, che vengono quindi a situarsi nella porzione centrale della struttura.
L’abbinamento fra i nucleotidi può realizzarsi soltanto tra basi cosiddette complementari, cioè fra adenina e timina, mediante due ponti a idrogeno (A=T), o tra citosina e guanina, mediante tre ponti a idrogeno (C≡G).
Le due catene, per fronteggiarsi, devono opporre una direzionalità inversa, essendo l’una diretta da 3’ a 5’, e l’altra, necessariamente, da 5’ a 3’, da cui è nato il termine di eliche antiparallele.
Le basi presentano una struttura planare e sono disposte in maniera parallela tra loro, come i gradini di una scala a chiocciola.
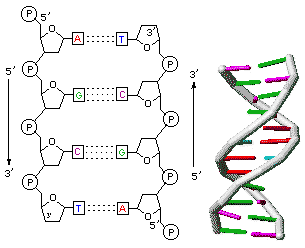
La complementarietà dei due filamenti ha una conseguenza fondamentale. Infatti, qualora sia stabilita l’esatta successione di basi di un filamento, si può ricavare, seguendo semplicemente le leggi della complementarietà, la serie di nucleotidi del filamento corrispondente.
In questa conformazione ciascuna coppia di basi dista dalle contigue 0,34 nm. Un giro completo dell’elica, o passo dell’elica, misura 3,4 nm, per cui sono presenti 10 coppie di basi per un giro completo. Il diametro dell’elica è di 2nm. L’avvitamento è destrorso, ossia, immaginando di guardare lungo l’asse, i due filamenti si avvolgono in senso orario.
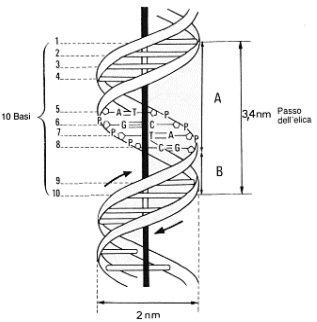
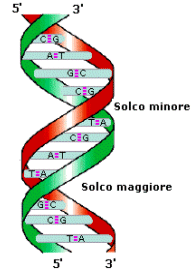
La struttura del DNA in natura ed in condizioni normali viene detta di tipo B con le basi perpendicolari all’asse dell’elica. La struttura B è la più frequente ed è quella a cui ci si riferisce in generale. Rappresenta il DNA in una soluzione acquosa e forma al suo esterno due solchi di diverse dimensioni chiamati solco maggiore e solco minore.
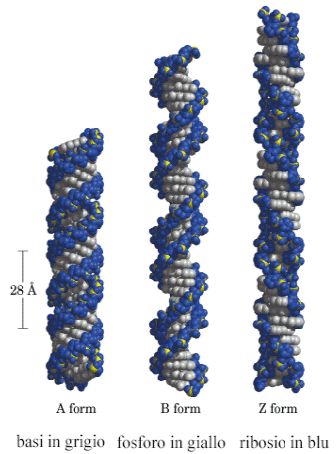
In condizioni particolari esistono altre due strutture dette A e Z.
La struttura A non esiste in vivo e corrisponde alla molecola disidratata ed è più compatta. Contiene 11 basi per giro, presenta un diametro di 2,4 nm ed un passo di 2,6 nm.
La struttura Z è un elica sinistrorsa con lo scheletro che presenta un andamento ondulato (Z = Zig-zag).
Contiene 12 basi per giro, presenta un diametro di 1,8 nm ed un passo di 3,7 nm. Questa struttura si può formare in brevi tratti costituiti da una alternanza delle basi G e C ripetute più volte. Si pensa che possa avere delle funzioni strutturali e di informazione in alcuni processi cellulari e inoltre una sua eccessiva presenza sembra essere correlata alla comparsa di malattie autoimmuni.
Funzioni biologiche del DNA
Come abbiamo già detto il DNA contiene il “progetto costruttivo” ed i “programmi di gestione e manutenzione” di un organismo, codificati nella sua struttura primaria (sequenza basi). Le sue funzioni, strettamente correlate alla sua natura di deposito di informazioni, sono:
- Rendere disponibili le informazioni genetiche per la costruzione ed il corretto funzionamento dell’organismo. Tale funzione viene mediata da molecole di RNA che copiano le informazioni genetiche (trascrizione) e le trasformano (traduzione) in proteine (sintesi proteica). Le diverse sequenze di nucleotidi, caratteristiche del DNA di un organismo, definiscono infatti quali amminoacidi debbano succedersi nella costituzione delle sue proteine. Tra le proteine sintetizzate vi sono naturalmente anche gli enzimi, prodotti per controllare le reazioni di cui la cellula necessita. In questo modo il DNA controlla, attraverso la sintesi degli enzimi, tutto il metabolismo cellulare
- Generare copie delle informazioni genetiche (duplicazione o replicazione del DNA) in modo da rendere disponibile l’intero progetto genetico per le nuove cellule che si formano. Ogni essere vivente pluricellulare nasce infatti a partire da una sola cellula (zigote), la quale ha il compito di moltiplicarsi fino a formare i miliardi di cellule di cui è composto l’organismo adulto. Al momento di ogni divisione cellulare (mitosi) devono dunque essere già predisposte due copie del materiale genetico (DNA) in modo che ogni nuova cellula possieda per intero tutte le informazioni per funzionare correttamente.
Tutte le funzioni svolte dal DNA sono rese possibili grazie alla complementarietà delle basi azotate.
Duplicazione del DNA
Nel processo di duplicazione (o replicazione) del DNA, il doppio filamento viene attaccato e tagliato in un punto dall’enzima topoisomerasi. La doppia elica viene successivamente aperta come una cerniera-lampo dall’enzima elicasi che, rompendo i ponti ad idrogeno che tengono unite le basi azotate complementari, separa i due filamenti e forma una struttura ad Y detta forcella di replicazione. La forcella di replicazione viene stabilizzata dalle proteine SSB. Un altro enzima (DNA-polimerasi) provvede poi ad agganciare su ognuno dei due filamenti esposti (filamenti-genitori o parentali) dei nucleotidi complementari. In questo modo su ciascun filamento viene ricostruito il filamento mancante (filamento-figlio) e si generano due copie della doppia elica originaria. Poiché in ciascuna di queste due copie sopravvive metà della molecola originaria, tale processo è anche noto come sintesi semiconservativa.
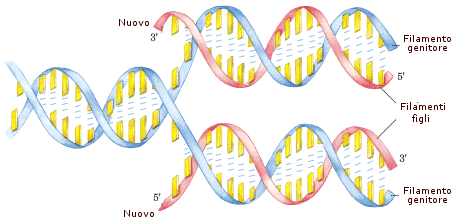
Per le caratteristiche intrinseche al legame stesso, la costruzione dei nuovi filamenti avviene solo in direzione 5'→3'. Ed avendo il DNA due filamenti antiparalleli, la sintesi dei due nuovi filamenti avviene necessariamente in direzioni opposte.
Un filamento, detto filamento veloce (leading strand) viene sintetizzato in modo continuo, poiché la DNA-Polimerasi avanza nella stessa direzione dell’elicasi.
L'altro filamento, detto filamento lento (lagging strand) viene sintetizzato in modo discontinuo, con la formazione di segmenti di DNA detti frammenti di Okazaki, che vengono successivamente saldati dall’enzima DNA-ligasi.
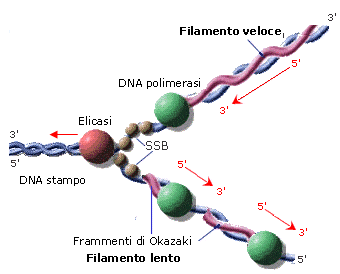
La DNA-polimerasi necessita di un innesco, cioè di una breve sequenza di RNA (RNA primer) da cui partire per sintetizzare il nuovo filamento, dal momento che è in grado solo di aggiungere nucleotidi a una catena preesistente, che fornisca una estremità 3’-ossidrilica libera. Inoltre la DNA-polimerasi possiede un secondo sito attivo in grado di controllare che l’attività di appaiamento delle basi sia avvenuta correttamente e di correggere eventuali errori. Nel caso vengano individuati errori nel processo di duplicazione la DNA-polimerasi torna indietro a correggerli. Questa funzione di correzione è definita attività 3’-5’ esonucleasica (proofreading activity = correzione di bozze).
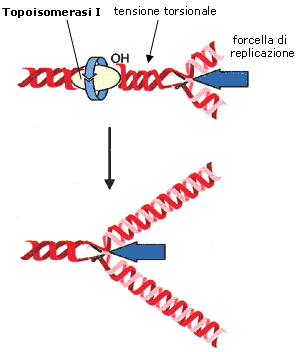
La duplicazione del DNA avviene contemporaneamente in più punti della molecola, con le forcelle di replicazione che si allontanano in direzioni opposte formando bolle di replicazione, destinate ad estendersi ed a fondersi.

Mentre la bolle di replicazione crescono i filamenti di DNA non ancora aperti tendono a manifestare una tensione torsionale aumentando il numero di spire per unità di lunghezza (si pensi a cosa accade ad una treccia se tiriamo le estremità dei fili divaricandoli). Le topoisomerasi di classe I risolvono il problema della tensione causato dall'avanzamento dell’elicasi tagliando periodicamente uno dei due filamenti e permettendo all’elica di girare, per svolgere gli avvolgimenti in eccesso. Quando il DNA si è rilassato, la topoisomerasi riconnette il filamento rotto, ripristinando il DNA a doppia elica.
I frammenti di Okazaki vengono successivamente saldati dalla DNA ligasi, mentre i primers di RNA vengono rimossi e sostituiti da analoghi filamenti di DNA da un enzima della famiglia delle DNA-polimerasi.
La struttura secondaria dell’RNA
Come abbiamo già visto l’RNA è costituito da una catena di nucleotidi in cui lo zucchero è il ribosio e la Timina è sostituita dall’Uracile. La complementarietà delle basi è in questo caso Adenina-Uracile e Citosina-Guanina.
Mentre il DNA è una molecola di grandi dimensioni e notevolmente stabile, gli RNA sono più piccoli, hanno vita limitata e inoltre sono caratterizzati da una struttura a singolo filamento.
Le molecole di RNA possono ripiegarsi su se stesse in modo tale da permettere la formazione di legami ad idrogeno tra basi complementari appartenenti a tratti diversi e distanti della medesima catena con formazione di zone a struttura secondaria elicoidale.
Piccole molecole di RNA sono quindi in grado di acquisire una struttura tridimensionale regolare, spesso responsabile della loro funzione specifica, mentre RNA più grandi presentano zone a struttura tridimensionale definita, congiunte fra loro da parti non strutturate.
Le molecole di RNA vengono sintetizzate utilizzando un filamento di DNA come stampo sul quale vengono appaiati i singoli nucleotidi complementari dell’RNA (trascrizione).
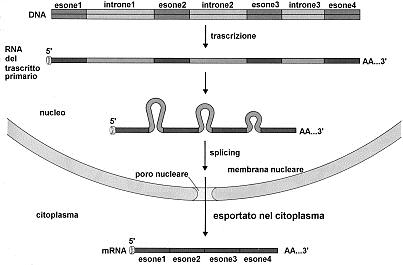
Spesso la forma funzionale di un RNA è più corta rispetto al trascritto primario. Il passaggio dalla forma primaria inattiva a quella finale funzionale avviene ad opera di enzimi specifici che rimuovono alcune zone della molecola (introni) e saldano quelle rimanenti (esoni) attraverso un processo di taglia-incolla detto splicing.
Funzioni biologiche dell’RNA
L’RNA permette al DNA di trasformare le informazioni in esso contenute in proteine. Esistono 3 tipi di RNA, tutti coinvolti nella sintesi proteica.
- RNA ribosomiale (rRNA) che va a formare i ribosomi, organuli cellulari che “traducono” le sequenze nucleotidiche in sequenze proteiche
- RNA messaggero (mRNA) che copia le informazioni contenute nel DNA (trascrizione) e le trasferisce ai ribosomi per la traduzione
- RNA di trasporto o transfer (tRNA) che porta gli amminoacidi ai ribosomi affinché li saldino in catene proteiche (sintesi proteica)
Sintesi proteica
Come abbiamo già detto il DNA contiene le informazioni necessarie per posizionare nella giusta successione gli amminoacidi di una proteina. Il tratto di DNA che “codifica” per una particolare proteina si definisce “gene”. Le informazioni “genetiche” sono codificate nella struttura primaria del DNA, sono cioè scritte nella successione delle sue basi azotate.
Nel descrivere la sintesi proteica si utilizza una metafora linguistica, in cui esistono due linguaggi: quello del DNA con un alfabeto di 4 lettere (le basi azotate) e quello delle proteine con un alfabeto di 20 lettere (gli amminoacidi).
Le informazioni devono pertanto essere “tradotte” da un linguaggio ad un altro. Ovviamente per effettuare la traduzione e “decifrare” un “messaggio codificato” è necessario possedere il “codice” che fornisce la corrispondenza tra i simboli dei due linguaggi.
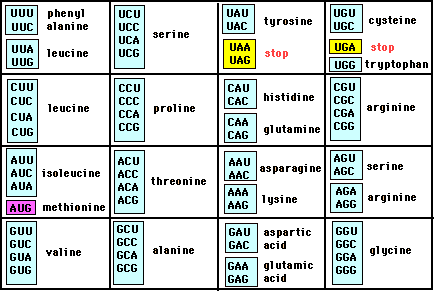
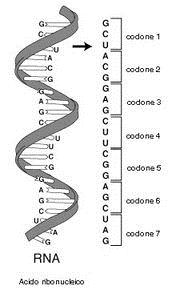
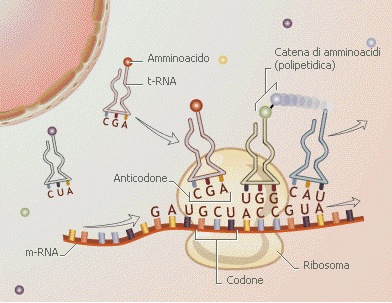
Il “codice genetico” definisce dunque il modo in cui la successione delle basi azotate del DNA deve essere tradotta nella corretta successione di amminoacidi di una proteina. Ovviamente non vi può essere una corrispondenza biunivoca tra basi azotate ed amminoacidi (4 contro 20). Si è scoperto che il “vocabolario” del DNA è formato da 64 “parole”, formate dalla combinazione delle quattro “lettere” A T C G (basi azotate) prese a gruppi di tre (43 = 64).
Ciascun amminoacido viene dunque “codificato” da una particolare tripletta di basi o codone. I codoni sono le triplette già trascritte nella molecola dell’RNA messaggero e quindi con l’Uracile al posto della Timina.
Esistono più triplette che codificano per il medesimo amminoacido (ridondanza del codice genetico), ma ciascuna tripletta non può, ovviamente, codificare per amminoacidi diversi.
Esistono anche triplette che non codificano per alcun amminoacido, dette triplette “not-sense”, che la cellula utilizza come “segni di interpunzione” durante la traduzione dell’informazione per segnalare la fine (stop) della sintesi della proteina.
Il processo di sintesi proteica si articola in due fasi: trascrizione e traduzione dell’informazione genetica. Nella fase di trascrizione l’informazione viene trasferita dal DNA all’RNA, mentre nella fase di traduzione l’informazione passa dall’RNA alle proteine
Trascrizione – sintesi dell’RNA
In questa fase l’informazione genetica viene copiata (trascritta) dal DNA su di una molecola di RNA. Il processo di trascrizione avviene grazie all’enzima RNA-polimerasi. Nelle cellule eucarioti ci sono tre diverse molecole di RNA-polimerasi, che occupano diversi siti. Ciascuno di questi enzimi è responsabile della trascrizione di una differente classe di geni.
L’RNA-polimerasi I, che risiede nel nucleolo, è responsabile della trascrizione dei geni per la produzione di tutto l’RNA ribosomiale (o rRNA). Questo è l’enzima con la più elevata attività di sintesi.
L’RNA-polimerasi II, localizzata nel nucleoplasma (la parte di nucleo che esclude il nucleolo), responsabile della sintesi del precursore dell’RNA messaggero (mRNA).
l’RNA-polimerasi III, l’enzima con l’attività minore, anch’essa presente nel nucleoplasma, che sintetizza l’RNA di trasporto (tRNA).
Nella fase di inizio l’RNA-polimerasi si lega alla doppia catena del DNA, aprendola in corrispondenza di una particolare sequenza, chiamata promotore. Il promotore è una speciale sequenza di nucleotidi che non verrà trascritta, situata sul DNA all’inizio del gene.
Successivamente l’RNA-polimerasi scorre lungo il DNA rompendo i ponti Idrogeno tra le basi azotate complementari ed aprendo la doppia elica come una cerniera. In questo modo una delle due catene viene esposta alla copiatura e fa da stampo per la sintesi di una molecola di RNA messaggero ad essa complementare. Mentre l’RNA-polimerasi scorre sul filamento-stampo del DNA vengono agganciati ad esso dei ribonucleotidi complementari. Quando, durante la trascrizione, nel DNA si incontreranno particolari sequenze di basi alla fine del gene (terminatore) si avrà il termine della trascrizione. Il filamento di RNA messaggero si stacca ed il DNA si richiude e si riavvolge
Poiché i due filamenti si legano tramite appaiamento delle basi azotate complementari, questi sono tra loro antiparalleli. La direzione di lettura del DNA è 3'→5' mentre quella di trascrizione è 5'→3'.
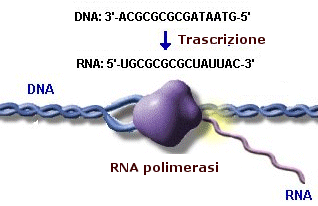
Il prodotto della trascrizione è denominato trascritto primario e consiste probabilmente in un filamento di RNA che si estende dal promotore al terminatore. Non si ha dimostrazione di ciò perché esso è molto instabile e quindi difficile da isolare.
La fase cruciale della produzione delle diverse forme di RNA è la maturazione a partire dai precursori.
I complessi trascritti primari degli rRNA e tRNA di procarioti ed eucarioti vengono modificati in forme mature più semplici. Gli mRNA dei procarioti non subiscono quasi mai modificazioni, mentre l’assemblaggio dell’mRNA degli eucarioti è piuttosto complesso.
Negli eucarioti la trascrizione genera dei precursori nucleari degli mRNA (trascritti primari) caratterizzati dalla presenza di modificazioni chimiche all’estremità 5' e dalla presenza di zone non codificanti (introni). Tali precursori vengono in seguito convertiti negli mRNA maturi attraverso un processo (splicing) che prevede la rimozione degli introni e il ricongiungimento delle parti codificanti (esoni). Lo splicing avviene grazie a un apparato enzimatico complesso in grado di riconoscere sequenze specifiche presenti nelle zone di giunzione esone-introne, di rimuovere gli introni e di ricongiungere correttamente tra loro i vari esoni
Una volta maturati, gli mRNA, come le subunità ribosomiche e i tRNA, passano nel citoplasma per svolgere la loro funzione nella sintesi proteica.
L’RNA messaggero (mRNA) rappresenta la classe di RNA più eterogenea; infatti è costituita da filamenti contenenti tanti codoni quanti sono gli amminoacidi delle proteine da loro codificate.
RNA messaggeri codificanti per piccole proteine sono costituiti da alcune centinaia di nucleotidi, quelli codificanti per proteine grandi ne comprendono varie migliaia. Ogni mRNA è caratterizzato dal codone d’inizio (spesso AUG, specifico per l’amminoacido metionina). I tre codoni UAA, UGA e UAG rappresentano invece il segnale di terminazione della sintesi della catena polipeptidica. La precisione nell’andamento lineare dei ribonucleotidi in gruppi di tre, non solo determina il corretto allineamento degli amminoacidi in una proteina, ma anche un esatto punto di inizio e di conclusione della sua sintesi.
L’RNA di trasporto (tRNA) trasferisce ai ribosomi i vari amminoacidi che, uniti tra loro con legame peptidico, formano le proteine. Molti trascritti primari che originano dai geni per i tRNA sono discretamente più lunghi rispetto alle piccole molecole mature che si riversano nel citoplasma e che contengono molte basi modificate. Come tutte le macromolecole trasportate dal nucleo al citoplasma, anche i tRNA maturi vengono trasportati attraverso i pori nucleari, probabilmente associati a proteine specifiche che ne facilitano il passaggio. Una volta giunti nel citoplasma, i tRNA maturi si presentano come molecole piccole, costituite da 75-80 nucleotidi che si appaiano tra loro in zone specifiche con ponti idrogeno tra basi complementari, interrotte da tratti a singolo filamento. Tale situazione determina una particolare conformazione a “trifoglio”, caratteristica per tutti i tRNA. Nella cellula, tuttavia, questa molecola ha una complessa organizzazione a forma di L rovesciata e contorta a spirale, poiché le due anse laterali del trifoglio si avvicinano tra loro formando l’angolo fra i bracci della L. L’estremità 3' del filamento polinucleotidico di tutti i tRNA sopravanza quella 5' di tre nucleotidi uguali (C-C-A): tale sequenza rappresenta il sito accettore dell’amminoacido che, una volta attivato dall’enzima amminoacilsintetasi, si posiziona sul tRNA. Si distinguono circa venti tRNA, ciascuno specifico per un determinato amminoacido.
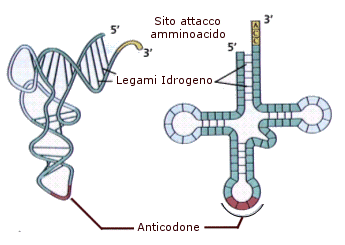
La parte più caratteristica della molecola del tRNA è l’ansa terminale, detta anticodone poiché porta tre basi complementari ai codoni degli mRNA.
Gli RNA ribosomiali (rRNA) costituiscono una famiglia di molecole che, assemblate insieme a più di 50 diverse proteine, formano i ribosomi. I ribosomi sono gli organuli citoplasmatici che utilizzano le informazioni genetiche dell’RNA messaggero e gli amminoacidi portati dagli RNA di trasporto per assemblare le proteine. Sono costituiti da due subunità classificate in termini di Svedberg (S), una misura del coefficiente di sedimentazione di particelle in sospensione sottoposte a centrifugazione (gli organuli cellulari vengono separati tramite centrifugazione in base alla loro diversa densità). La lunghezza delle molecole di rRNA, la qualità delle proteine costituenti ciascuna subunità e di conseguenza la grandezza di queste ultime varia tra procarioti ed eucarioti.
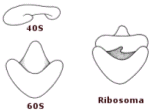
In base ai loro coefficienti di sedimentazione, i ribosomi sono stati suddivisi in due classi:
- I ribosomi 70 S sono caratteristici dei procarioti e sono formati da una subunità 30 S e da una 50 S.
- I ribosomi 80 S sono caratteristici degli eucarioti e sono formati da una subunità 40 S e da una 60 S
Negli eucarioti i geni che codificano per gli rRNA sono localizzati nel nucleolo, che si evidenzia come un corpicciolo sferico situato nel nucleo. Tale conformazione è dovuta all’intensa attività trascrizionale che si attua al livello di questi geni e dal quasi contemporaneo assemblaggio degli RNA alle proteine ribosomiali.
Traduzione
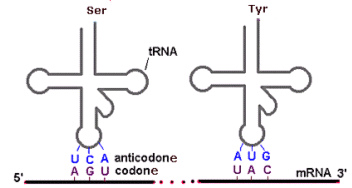
Nella fase di traduzione, l’informazione genetica, contenuta nell’RNA messaggero come sequenza di codoni (triplette di basi), viene letta dai ribosomi in direzione 5’ → 3’ e trasformata nella corrispondente sequenza di amminoacidi (proteina) grazie al codice genetico.
- Il filamento di mRNA contenente l’informazione si inserisce tra le due subunità del ribosoma, il quale si posiziona sui primi due codoni.
- Due molecole di tRNA, aventi gli anticodoni complementari si agganciano ai codoni, posizionando in tal modo gli amminoacidi trasportati uno accanto all’altro. Gli amminoacidi vengono saldati con legame peptidico ed il primo tRNA esce dal ribosoma lasciando il suo amminoacido sulla catena proteica in via di formazione
- Il ribosoma scivola sul filamento di mRNA, scalando di un codone e posizionandosi sul secondo e terzo codone. Una terza molecola di tRNA si aggancia al terzo codone permettendo l’aggancio del suo amminoacido ai due precedenti. Il secondo tRNA si sgancia lasciando il suo amminoacido sulla catena proteica in via di formazione
- La traduzione procede con il medesimo meccanismo, con il ribosoma che avanza di un codone per volta ed un tRNA che entra carico del suo amminoacido ed uno che esce scarico del suo amminoacido.
- Il processo termina quando il ribosoma trova un codone not-sense. Il filamento proteico si stacca e viene liberato nel citoplasma dove assume la sua conformazione nativa.
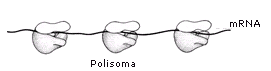
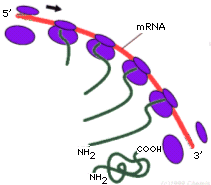 Un filamento di mRNA può essere letto e tradotto più volte in modo da ottenere più copie della medesima proteina. La traduzione può essere fatta contemporaneamente da più ribosomi che si infilano sul medesimo filamento come le perle di una collana. La struttura che ne deriva prende il nome di poliribosoma (o polisoma). Ciascun ribosoma appartenente ad un polisoma si trova ovviamente in una fase diversa della sintesi della medesima proteina
Un filamento di mRNA può essere letto e tradotto più volte in modo da ottenere più copie della medesima proteina. La traduzione può essere fatta contemporaneamente da più ribosomi che si infilano sul medesimo filamento come le perle di una collana. La struttura che ne deriva prende il nome di poliribosoma (o polisoma). Ciascun ribosoma appartenente ad un polisoma si trova ovviamente in una fase diversa della sintesi della medesima proteina
Derivati dei nucleotidi: ATP e NAD
ATP e NAD sono due nucleotidi modificati che la cellula utilizza per il suo metabolismo energetico.
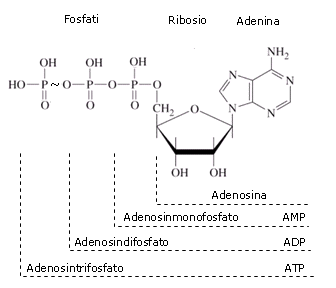
L’ATP (Adenosin Trifosfato) viene utilizzato dalle cellule come contenitore e trasportatore di energia. L’ATP deriva dall’AMP (Adenosin Monofosfato = Adenina-Ribosio-Fosfato) per aggiunta di due molecole di acido fosforico.
Nel primo passaggio si forma ADP (Adenosin Difosfato = Adenina-Ribosio-Fosfato-Fosfato) secondo la seguente reazione di condensazione che avviene tra il gruppo fosfato dell’AMP e la molecola di acido fosforico
AMP + H3PO4 → ADP + H2O
Spesso nei composti organici il gruppo fosfato viene indicato, in modo abbreviato, con il simbolo Pi (Fosforo inorganico). La reazione di formazione dell’ADP può quindi essere scritta in forma sintetica
AMP + Pi → ADP
L’ATP si forma dalla reazione di condensazione di una molecola di ADP con un’altra molecola di acido fosforico. La reazione è fortemente endoergonica e richiede circa 7,3 kcal/mol (30,5 kJ/mol)
ADP + Pi + 7,3 kcal → ATP
L’ATP risulta in tal modo una molecola altamente energetica. L’energia è fissata nel legame tra il secondo ed il terzo gruppo fosfato, legame che viene rappresentato con un tratto circonflesso
Adenina-Ribosio-Pi-Pi~Pi
La cellula utilizza l’energia estratta dai suoi combustibili (carboidrati e lipidi) per sintetizzare ATP. In questo modo l’energia non viene dissipata sotto forma di calore, ma viene fissata come energia di legame in molecole, come l’ATP, rapidamente utilizzabili per fornire energia. Ad esempio, la combustione di una molecola di glucosio permette alla cellula di caricare 36 ATP
C6H12O6 + 6O2 → 6CO2 + 6H2O + Energia (36ATP)
Quando la cellula ha bisogno di energia può ottenerla in modo rapido semplicemente idrolizzando ATP
ATP → ADP + Pi + 7,3 kcal
Durante il metabolismo cellulare questa molecola oscilla dunque continuamente tra la forma carica (ATP) e la forma scarica (ADP)
Il NAD (Nicotinammide AdeninDinucleotide) è una ossidoreduttasi, un coenzima che catalizza reazioni di ossidoriduzione. Il NAD è quindi in grado di trasferire elettroni (ed Idrogeno) da una molecola che si ossida ad una molecola che si riduce. Ovviamente quando il NAD acquista elettroni da una molecola A che si ossida il NAD passa in una forma ridotta (NADH o NAD ridotto), mentre quando cede elettroni ad una molecola B che si riduce passa in una forma ossidata (NAD+ o NAD ossidato)
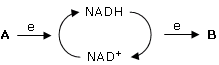
La reazione di riduzione del NAD richiede 2 elettroni, uno ione H+ e 52,4 kcal/mol (220 kj/mol)
NAD+ + 2e + H+ + 52,4 kcal → NADH
In modo analogo a quanto accade per l’ATP, anche il NAD oscilla quindi tra una forma scarica (NAD+) ed una forma carica (NADH).
Altre importanti ossidoreduttasi analoghe al NAD sono il FAD (Flavin Adenin Dinucleotide) e il NADP (NAD fosfato).
Analogamente al NAD esistono entrambi nella forma ossidata e ridotta
FAD ossidato (FAD) e FAD ridotto (FADH2)
NADP ossidato (NADP+) e NADP ridotto (NADPH)
Il FAD è in grado di assorbire un po’ meno energia del NAD
FAD + 2e + 2H+ + 46,0 kcal → FADH2
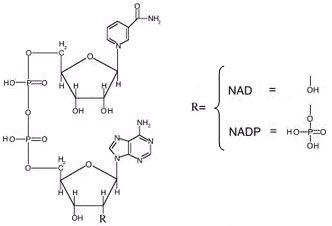
NAD e FAD hanno come precursori alcune vitamine del gruppo B. Il NAD deriva dalla vitamina B3 (o niacina o vitamina PP = Prevenzione Pellagra), il FAD dalla vitamina B2.
Citologia
La citologia è la branca della biologia che studia la cellula. La cellula è l’unità elementare di ogni vivente e costituisce la più piccola porzione di un organismo in grado di conservare le caratteristiche della vita. Tutti gli esseri viventi sono costituiti da una o più cellule (teoria cellulare).
Negli organismi pluricellulari le cellule si coordinano e formano livelli di organizzazione superiori:
- i tessuti, caratterizzati da cellule morfologicamente e funzionalmente specializzate
- gli organi, composti da più tessuti tra loro integrati per svolgere specifiche funzioni
- gli apparati (o sistemi), nei quali diversi organi interagiscono e si integrano per il compimento di funzioni superiori
- l’organismo formato dall’insieme di tutti gli apparati e sistemi.
Ogni elemento di un livello è dotato di capacità che l'elemento del livello inferiore non possiede. Così una singola cellula nervosa è capace di trasmettere impulsi nervosi a un'altra cellula, ma non è in grado di elaborare pensieri.
Strutture come i virus e i prioni non vengono considerati viventi perché mancano di una organizzazione cellulare.
I biologi studiano le cellule per comprendere le modalità con cui esse si formano a partire dalle molecole e per chiarire i meccanismi del loro funzionamento ed i modi con i quali esse cooperano alla costruzione di organismi complessi come gli esseri umani. La conoscenza delle cellule è alla base, dunque, della comprensione dei processi fisiologici, delle modalità di sviluppo e dei fenomeni di invecchiamento dell'organismo.
In tutti i viventi le cellule condividono alcune caratteristiche fondamentali. Tutte le cellule sono delimitate da una membrana esterna, detta membrana plasmatica (o plasmalemma) che racchiude il citoplasma. Quest’ultimo è formato da una componente liquida, il citosol, contenente acqua, sali minerali e molecole organiche, in cui si trovano immerse strutture dette organuli (o organelli) ciascuna preposta ad una particolare funzione.
Cellule procarioti ed eucarioti
Le cellule, in base alla loro organizzazione interna, possono essere distinte in due grandi categorie: cellule procarioti e cellule eucarioti.
La cellula procariote forma gli organismi unicellulari appartenenti al regno delle monere (batteri ed alghe azzurre). Esse sono relativamente piccole con dimensioni dell’ordine di 1 µm (1 µm = 1 micron = 10-6 m = un milionesimo di metro) ed hanno una struttura interna alquanto semplice quasi priva di organuli. Gli unici organuli presenti sono i ribosomi. Il termine procariote deriva dal greco e significa "prima del nucleo". Il loro DNA si trova infatti libero nel citoplasma senza essere racchiuso da una membrana nucleare. Le cellule procarioti formano solo organismi unicellulari detti anch’essi procarioti. Le cellule procarioti sono le prime forme di vita comparse sulla terra (le prime tracce di attività procariote risalgono a circa 3,9 miliardi di anni fa)
La cellula eucariote costituisce tutti gli altri organismi viventi, unicellulari e pluricellulari: i protozoi, le piante, i funghi e gli animali. La sua dimensione è dell’ordine di 10 µm. Il loro volume è quindi dell’ordine di 103 micron cubici, contro un volume di 1 micron cubico delle cellule procarioti. In altre parole una cellula eucariote è mediamente 1000 volte più grande di una cellula procariote. In essa il DNA è racchiuso da una membrana, formando così un particolare organulo chiamato nucleo. Il termine eucariote significa "nucleo ben formato". Possiede organuli immersi nel citoplasma, ognuno deputato a svolgere una particolare funzione che la rendono enormemente più complessa rispetto ad una cellula procariote. D’altra parte le cellule eucarioti si sono evolute a partire da antenati procarioti ed hanno impiegato un intervallo di tempo enorme per formarsi: le prime tracce di organismi unicellulari eucarioti risalgono a circa 1,4 miliardi di anni fa. Gli organismi formati da cellule eucarioti sono detti eucarioti.
Nel corso dell’evoluzione le dimensioni delle cellule si sono conservate relativamente piccole per la necessità di mantenere elevata la loro efficienza attraverso un rapporto ottimale con l’ambiente, da cui la cellula trae le sostanze nutritizie ed al quale cede le sostanze di rifiuto
Quando infatti una cellula si accresce, il volume aumenta più rapidamente della superficie. Se, per esempio, si ipotizza che la cellula abbia una forma sferica, il rapporto superficie/volume diminuisce rapidamente all’aumentare del raggio. Il volume cresce infatti in ragione della terza potenza del raggio (4/3пR3), mentre la superficie in ragione della seconda potenza (4пR2).
Ciò determina uno squilibrio nutrizionale sempre maggiore perché la superficie non riesce più a garantire scambi con l’ambiente adeguati alla massa cellulare.
Inoltre in una cellula troppo grande, le sostanze nutritizie richiederebbero tempi troppo lunghi per diffondere dalla superficie all’interno e altrettanto inefficace risulterebbe l’allontanamento delle sostanze di rifiuto. Si è visto infatti che, nella maggior parte delle cellule l’attività biochimica si limita a 15-25 micron al di sotto della superficie cellulare. La stessa attività di controllo metabolico da parte del nucleo sul citoplasma circostante risulta inefficiente oltre una certa distanza.
Trova così una spiegazione il fatto che le cellule caratterizzate da una intensa attività metabolica, che presentano quindi rapidi scambi con l’ambiente e con il loro nucleo, sono tendenzialmente più piccole rispetto alle cellule meno attive.
Esistono eccezioni che confermano la regola. Le cellule muscolari (fibre muscolari), ad esempio, presentano una lunghezza di alcuni centimetri, ma conservano l’efficienza mantenendo un buon rapporto superficie/volume grazie alla loro forma allungata ed inoltre sono cellule polinucleate (ogni nucleo gestisce la regione di citoplasma circostante).
Il microscopio
Le dimensioni delle cellule sono al di sotto del potere risolutivo del nostro occhio (0,1 mm). Il potere risolutivo di uno strumento è la distanza minima al di sotto della quale due punti non possono essere “risolti”, cioè visti come separati. Per poter risolvere e quindi ‘vedere’ oggetti le cui dimensioni siano inferiori al potere risolutivo dell’occhio, dobbiamo ricorrere a strumenti ottici dotati di un potere risolutivo maggiore.
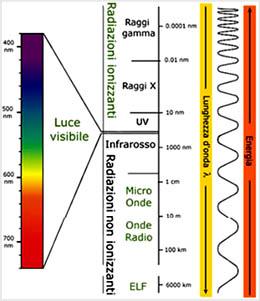
Il più semplice tra essi è il microscopio ottico. Il potere di risoluzione del microscopio ottico è di 0,2 mm, con un aumento del potere di risoluzione rispetto a quello dell'occhio umano di circa 3 ordini di grandezza (1000 x). Questo limite non è di natura tecnico-costruttiva, ma dipende essenzialmente dalla lunghezza d’onda della luce visibile (0,4-0.7 mm). Per poter vedere un oggetto noi dobbiamo infatti “illuminarlo”, inviargli cioè una radiazione luminosa, la quale deve essere riflessa dall’oggetto e quindi colpire il nostro occhio. La radiazione luminosa è un’onda (elettromagnetica) le cui caratteristiche dipendono dalla sua lunghezza d’onda λ (λ = lambda = distanza tra due creste successive).
Le lunghezze d’onda che vanno da 0,4 a 0,7 micron risultano visibili all’occhio umano e vengono percepite come colori diversi (dal rosso con λ = 0,7 mm fino al violetto con λ = 0,4 mm). Lunghezze d’onda maggiori del rosso non sono visibili all’occhio umano e sono gli infrarossi, le microonde e le onde radio.
Anche le lunghezze d’onda minori del blu non sono visibili all’occhio umano e sono gli ultravioletti, i raggi X ed i raggi gamma.
La radiazione elettromagnetica trasporta energia che risulta essere inversamente proporzionale alla sua lunghezza d’onda (i raggi X sono più energetici e quindi più pericolosi delle onde radio)
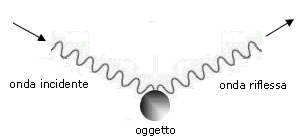
Un oggetto, investito da un’onda, la riflette solo se le sue dimensioni sono maggiori della lunghezza d’onda utilizzata per illuminarlo. Questo è il motivo per il quale il microscopio ottico non ci permette di vedere oggetti più piccoli della lunghezza d’onda della luce visibile.
Il microscopio elettronico si basa essenzialmente sugli stessi principi di quello ottico, ma fornisce ingrandimenti maggiori, anche se le tecniche di impiego, allestimento dei preparati e interpretazione sono più complessi e costosi.
La sorgente luminosa è sostituita da un fascio di elettroni accelerati nel vuoto. Le lenti sono sostituite da campi magnetici che hanno un effetto convergente sugli elettroni. Gli elettroni si associano ad una lunghezza d'onda molto più piccola rispetto a quella dello spettro visibile e ciò determina un aumento del potere di risoluzione fino a circa 10 Å con un aumento del potere di risoluzione rispetto a quello dell'occhio umano di circa 6 ordini di grandezza (1.000.000 x). Dal momento che il materiale da esaminare è posto sotto vuoto, esso deve essere preventivamente disidratato e ciò impedisce l'uso del microscopio elettronico su preparati viventi. Inoltre le sezioni di tessuto devono essere sottilissime per consentire il passaggio degli elettroni il cui potere di penetrazione è molto basso. L'immagine fornita è invisibile all'occhio umano, ma può essere fotografata e raccolta su uno schermo fluorescente che emette luce visibile sotto l'urto degli elettroni provenienti dal preparato. Essa risulta in bianco e nero con varie tonalità di grigio in corrispondenza della maggiore o minore trasparenza agli elettroni delle strutture cellulari (ma sono possibili tecniche di colorazione in falsi colori).
Il microscopio elettronico può essere a trasmissione (TEM) o a scansione (SEM)
Nel microscopio elettronico a trasmissione gli elettroni attraversano il preparato e vengono deviati diversamente dagli atomi del corpo da esaminare, portando alla formazione di un’immagine differenziata. Poiché i preparati biologici sono spesso costituiti da atomi più o meno tutti dello stesso peso è necessario aggiungere particolari coloranti contenenti atomi pesanti in grado di deviare il fascio di elettroni.
Nel microscopio elettronico a scansione gli elettroni incidono sulla materia, determinando l'emissione di elettroni secondari che, raccolti, forniscono immagini dettagliate della superficie degli oggetti. Dalle zone in rilievo vengono emessi più elettroni secondari che dalle zone depresse. Ne deriva un’immagine tridimensionale della superficie del campione. Il microscopio a scansione permette di analizzare in superficie cellule non sezionate il cui spessore è quindi notevolmente più elevato di quello dei campioni usati negli altri tipi di microscopi elettronici. La qualità delle immagini in 3D ripaga ampiamente del più ridotto potere risolutivo (0.01 mm) di questo microscopio.
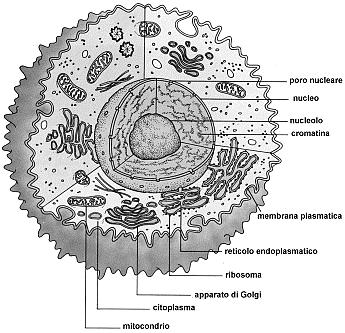
La cellula eucariote animale
La cellula eucariote animale è formata da una membrana plasmatica esterna che racchiude il citoplasma ed il nucleo.
Il citoplasma è costituito da una frazione liquida, il citosol, e dagli organuli cellulari in essa sospesi.
Membrana plasmatica
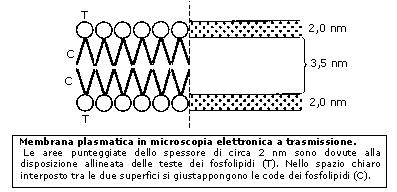
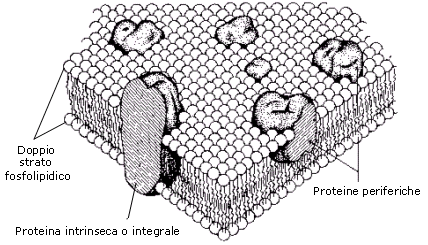
La membrana plasmatica (o plasmalemma) racchiude il contenuto della cellula e costituisce una barriera fra l'ambiente intracellulare (ambiente interno) e quello extracellulare (ambiente esterno). È costituita da un doppio strato continuo di fosfolipidi, dello spessore di 8-10 nm (un nanometro corrisponde a un miliardesimo di metro = 10-9 m), attraversata in parte o completamente da numerose proteine. È inoltre presente una piccola percentuale di glucidi, in forma di glicoproteine e glicolipidi, e di molecole di colesterolo che la stabilizzano, I fosfolipidi sono lipidi formati da una "testa" di glicerolo legato ad un gruppo fosfato e a due "code" di acidi grassi. Come conseguenza della presenza di acqua sia all’interno che all’esterno della cellula, i fosfolipidi rivolgono le teste polari verso le due superfici della membrana, mentre le code apolari sono rivolte verso la parte interna del doppio strato
In condizioni fisiologiche, sia le molecole lipidiche sia quelle proteiche in esse immerse sono in grado di muoversi liberamente (modello a mosaico fluido). Le caratteristiche di fluidità consentono alla membrana di manifestare proprietà autosigillanti attraverso le quali può autoripararsi, ossia richiudersi rapidamente ed automaticamente qualora in essa si produca un foro, automaticamente. La capacità autosigillarsi permette inoltre alle membrane di fondersi e scindersi, senza che si abbiano perdite di materiale cellulare, nel corso di processi fondamentali per la vita e l’attività delle cellule (divisione cellulare, esocitosi, endocitosi).
La membrana rappresenta l’interfaccia della cellula con l’ambiente esterno, attraverso la quale avvengono e vengono regolati tutti gli scambi di materiali ed informazioni. Essa ha dunque funzione di trasporto, di interazione ed integrazione con l’ambiente e di locomozione.
membrana: trasporto
La membrana plasmatica è una barriera selettivamente permeabile. Il doppio strato fosfolipidico permette infatti il libero passaggio solo dell'acqua, di gas come O2 e CO2 e di piccole molecole liposolubili, mentre risulta impermeabile per ioni e molecole idrosolubili.
Il trasporto dei materiali per i quali la membrana non è permeabile viene effettuato dalla cellula utilizzando particolari proteine trasportatrici transmembraniche (carriers) e/o attraverso fenomeni di motilità della membrana (esocitosi ed endocitosi).
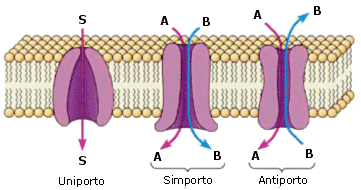
Le proteine trasportatrici sono proteine in struttura terziaria in grado di riconoscere in modo specifico la sostanza chimica da trasportare (substrato).. Esistono tre modalità di trasporto:
Uniporto: una sola molecola in un unico verso
Simporto: due molecole in un stesso verso
Antiporto: due molecole in versi opposti, una in ingresso e l'altra in uscita
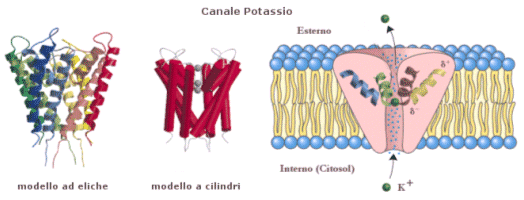
Le proteine trasportatrici si dividono in pompe e canali
1) Le pompe presiedono al trasporto attivo di molecole. Nel trasporto attivo il passaggio di una molecola avviene con consumo di energia (idrolisi ATP), anche contro il gradiente di concentrazione.
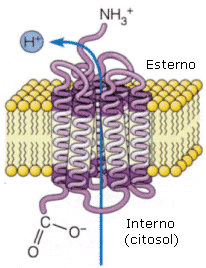
Batteriorodopsina
La batteriorodopsina è una pompa protonica (protone = ione H+) che alcuni batteri utilizzano per catturare l’energia luminosa. È una proteina transmembranica costituita da 7 alfa-eliche in associazione con una molecola di retinale
2) I canali presiedono al trasporto passivo di molecole. Nel trasporto passivo il passaggio di una molecola avviene per diffusione senza consumo di energia, secondo il gradiente di concentrazione, La diffusione è il fenomeno fisico per il quale un fluido (gas o liquido), come conseguenza del moto disordinato delle molecole che lo costituiscono, tende a “sparpagliarsi” occupando tutto lo spazio disponibile. La conseguenza, a livello macroscopico, è la tendenza spontanea di un fluido a muoversi (diffondere) da zone a maggior concentrazione verso zone a minor concentrazione. Si dice appunto che tale movimento avviene “secondo il gradiente di concentrazione”. Il fenomeno si giustifica in termini di probabilità.
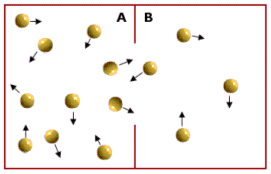
Le particelle si muovono in tutte le direzioni e quindi in ogni istante alcune passeranno dalla regione A alla regione B e viceversa. Ma poiché vi sono più particelle in A che in B vi sarà una maggior probabilità che si muovano da A verso B, piuttosto che da B verso A. Dunque, finché le particelle non saranno distribuite omogeneamente vi saranno più particelle che passano da A verso B che particelle che passano da B verso A. Ciò genera un movimento netto verso B (diffusione) che porta ad eliminare la distribuzione spaziale non omogenea.
Ovviamente i canali possono funzionare solo se tra l’interno e l’esterno della cellula esiste una differenza di concentrazione.
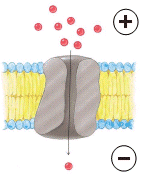
La cellula è in grado di aprire o chiudere i suoi canali a seconda delle necessità.
Avvalendosi di questi meccanismi di trasporto, la cellula può mantenere la concentrazione interna delle sostanze chimiche su valori diversi da quelli che caratterizzano l'ambiente esterno.
Come conseguenza delle caratteristiche di semipermeabilità della sua membrana, la cellula è soggetta a fenomeni osmotici. L’osmosi è un fenomeno che si manifesta quando una membrana selettivamente permeabile (semipermeabile) separa due soluzioni a diversa concentrazione. La membrana è tale per cui solo le molecole dell’acqua possono liberamente diffondere, mentre la diffusione del soluto è impedita. In queste condizioni l’acqua tende a diffondere dalla soluzione più diluita (dove è presente in quantità maggiore) alla soluzione più concentrata (dove è presente in quantità minore). Il flusso dell’acqua verso la soluzione più concentrata produce una vera e propria pressione (pressione = forza/superficie = forza che agisce sull’unità di superficie), detta pressione osmotica. Il valore della pressione osmotica è direttamente proporzionale alla differenza di concentrazione tra le due soluzioni. Nel caso le due soluzioni poste a contatto siano contenute in recipienti aperti il flusso d’acqua dall’una all’altra produrrà un dislivello che potrà essere utilizzato come misura della pressione osmotica (ricordiamo che 10 metri d’acqua equivalgono alla pressione di 1 atmosfera).
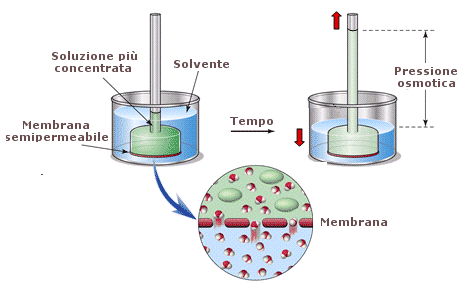
I fenomeni osmotici possono creare problemi alle cellule animali. Poste in un ambiente ipertonico (tono = concentrazione; ipertonico = a concentrazione maggiore) possono facilmente disidratarsi. Poste in un ambiente ipotonico (a concentrazione minore) possono assorbire acqua fino alla lisi cellulare. Ne sono un esempio i nostri globuli rossi che sono immersi in un mezzo isotonico (plasma). Le cellule vegetali che, esternamente alla loro membrana plasmatica, sono rivestite di una robusta parete di cellulosa, sono invece in grado di sfruttare i fenomeni osmotici. Le cellule vegetali mantengono infatti il loro citosol leggermente ipertonico rispetto all’ambiente circostante. In questo modo richiamano acqua per osmosi e risultano soggette ad una leggera pressione, detta turgore cellulare, che le mantiene gonfie. Il turgore cellulare è fondamentale per mantenere distesi i tessuti vegetali verdi, come le foglie, che non presentano strutture di sostegno efficaci.
3) Alcune cellule eucarioti sono in grado di importare ed esportare considerevoli quantità di materiali sfruttando la motilità e la fluidità della loro membrana, la quale è in grado di “deformarsi” producendo introflessioni ed estroflessioni. Tali deformazioni della membrana sono note come movimenti ameboidi (l’ameba è un organismo unicellulare in cui tale caratteristica è particolarmente sviluppata).
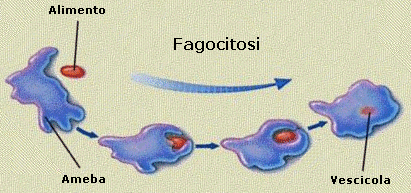
Il processo di importazione è detto endocitosi ed avviene grazie alla capacità della cellula di avvolgere il materiale da introdurre con una piccola porzione di membrana che si stacca come una goccia (vescicola di endocitosi o endosoma) all’interno del citosol. Si parla di endocitosi mediata da recettori quando la sostanza che deve essere inglobate nella cellula, viene riconosciuta e legata da specifici recettori situati sulla superficie della membrana. Si viene a formare in questo modo un complesso recettore-ligando che funge da attivatore del processo di endocitosi. Se il materiale da introdurre è solido si parla di fagocitosi, se è liquido di pinocitosi.
La fagocitosi avviene grazie alla crescita di due estroflessioni, dette pseudopodi (pseudopodio = falso piede), attorno al materiale da inglobare. I pseudopodi crescono fino ad avvolgere il materiale e a fondersi alle sue spalle inglobandolo in una vescicola di fagocitosi. In questo modo, ad esempio, i macrofagi, un particolare tipo di globuli bianchi del nostro organismo inglobano e distruggono i batteri ed eliminano cellule morte e strutture estranee.
La pinocitosi si produce grazie alla formazione di minuscole introflessioni della membrana all’interno delle quali viene risucchiato il liquido da introdurre. La membrana successivamente si richiude liberando nel citosol la vescicola di pinocitosi
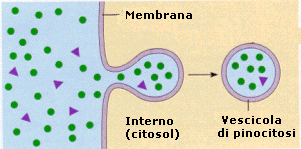
Il processo di esportazione è detto esocitosi ed avviene grazie alla capacità della cellula di avvolgere il materiale da espellere con una piccola porzione di membrana (vescicola di esocitosi) che si stacca dai sistemi interni di membrana (apparato del Golgi) e si va a fondere con la membrana plasmatica. In tal modo il contenuto delle vescicole di esocitosi viene versato all’esterno.
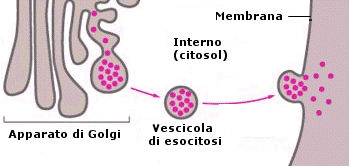
La cellula utilizza l’esocitosi sia per eliminare le sostanze di rifiuto (escrezione), ma anche per effettuare la secrezione di sostanze utili, come segnali chimici (neurotrasmettitori, ormoni etc) o sostanze aggressive per attaccare altre cellule (enzimi digestivi, tossine etc)
Membrana: locomozione
La cellula può utilizzare la motilità di membrana anche per la locomozione, per muoversi cioè su di un supporto. In questo caso il movimento ameboide avviene con la crescita di uno pseudopodio nella direzione del movimento. Una volta raggiunta la sua massima estensione lo pseudopodio fa presa sul supporto e la cellula viene richiamata in avanti (un po’ come fanno le lumache, per intenderci).

Ovviamente la locomozione è una caratteristica che si trova prevalentemente in organismi unicellulari. Le cellule appartenenti ad un organismo pluricellulare sono strettamente addossate l’una all’altra e non si muovono. Fanno comunque eccezione alcune cellule del sistema immunitario (macrofagi e granulociti).
I movimenti ameboidi non sono l’unica possibilità di locomozione per la cellula. Alcune cellule presentano infatti sulla loro membrana delle estroflessioni citoplasmatiche filiformi (ciglia e flagelli) che possono essere utilizzate per la locomozione. Di tali strutture parleremo più avanti.
Membrana: interazione ed integrazione con l’ambiente
La membrana rappresenta anche il mezzo con cui la cellula si "fa riconoscere" dalle altre cellule, tramite molecole dette marcatori, riconosce segnali chimici, tramite molecole dette recettori, è “sensibile” agli stimoli tramite la sua eccitabilità e si collega ad altre cellule negli organismi pluricellulari tramite giunzioni proteiche.
1) I marcatori di membrana sono in genere proteine legate a carboidrati (glicoproteine), che funzionano come una sorta di "carta d'identità" in base alla quale la cellula viene riconosciuta come facente parte del sé (self), ossia dell'organismo stesso, e non viene attaccata dal sistema immunitario, oppure come estranea (not self) e come tale, da distruggere. L'insieme delle molecole che caratterizzano i diversi tipi di cellule e di tessuti dell'organismo viene chiamato complesso maggiore di istocompatibilità (MHC). Esso è responsabile del fatto che i tessuti trapiantati agiscono da antigeni e vengono attaccati dall'organismo ricevente (fenomeno del rigetto).
2) I recettori di membrana sono in genere anch’essi costituiti da molecole proteiche in grado di riconoscere e legarsi in modo specifico e selettivo a particolari sostanze chimiche che operano come segnali, principalmente nervosi (acetilcolina, adrenalina, serotonina etc) ed ormonali. Una volta legati, il complesso recettore-segnale innesca un meccanismo di amplificazione dovuto all'azione di un enzima legato al recettore che provoca una cascata di reazioni all’interno della cellula.
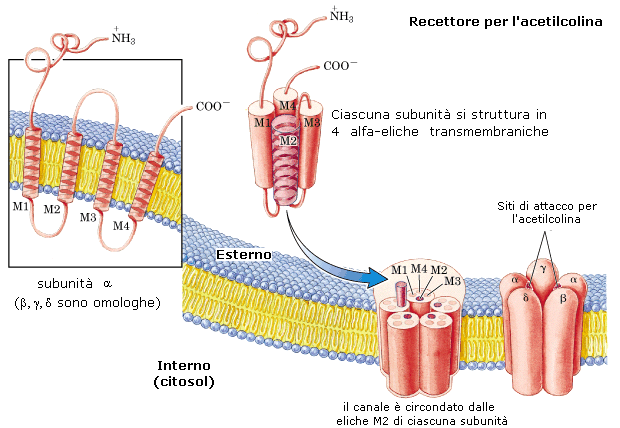
3) Eccitabilità. In condizioni normali la membrana cellulare risulta polarizzata, con un eccesso di ioni positivi sulla superficie esterna ed un eccesso di ioni negativi sulla superficie interna. La differenza di potenziale tra le due facce è di circa -70 milliVolt, (il segno negativo è convenzionale) ed è chiamato potenziale di riposo. Questa stato di polarizzazione è alla base della capacità della cellula di percepire stimoli esterni e di reagire ad essi. Questa “sensibilità” della cellula viene definita eccitabilità. La membrana si eccita quando, come conseguenza di uno stimolo, inverte il suo potenziale (depolarizzazione) da -70 a circa +30 mV (potenziale di azione). L’eccitabilità di membrana è alla base del funzionamento delle cellule nervose e muscolari. Il potenziale di riposo viene generato dall’azione congiunta della pompa Sodio-Potassio e dei relativi canali.
La pompa Na+/K+ é una proteina intrinseca che lavora associata ad una ATPasi che, idrolizzando ATP, libera l'energia necessaria per il trasporto (trasporto attivo). In presenza di ATP, la pompa cambia conformazione e si lega internamente con 3 ioni Na+ ed esternamente con 2 ioni K+. Ad ogni idrolisi di una molecola di ATP, 3 ioni sodio vengono pompati verso l'esterno della cellula, mentre 2 ioni potassio verso l'interno. La membrana cellulare è praticamente impermeabile allo ione sodio (i canali del Sodio sono chiusi), che rimane quindi per lo più segregato nello spazio extra-cellulare, mentre è permeabile allo ione potassio (i canali del potassio sono aperti), che è quindi libero di ridiffondere all’esterno. Questa distribuzione ineguale di cariche elettriche fa si che l'interno della cellula sia carico negativamente rispetto all'esterno caricato positivamente.
4) In un organismo pluricellulare le cellule si collegano l'una all'altra mediante giunzioni intercellulari. Nelle piante superiori le cellule sono connesse mediante "ponti" di citoplasma denominati plasmodesmi.
Nella maggior parte degli animali, le cellule sono legate fra loro mediante una rete a maglie relativamente larghe, costituita da grosse molecole organiche (la cosiddetta matrice extracellulare) e mediante punti di adesione fra le membrane plasmatiche (giunzioni cellulari).
Si classificano tre tipi di giunzioni cellulari: giunzioni ancoranti, giunzioni comunicanti e giunzioni occludenti.
a) Le giunzioni ancoranti (o giunzioni adesive) provvedono a mantenere le cellule in posizioni fisse all'interno dei tessuti tramite connessioni proteiche. Ne esistono di tre tipi: i desmosomi, le giunzioni intermedie e le giunzioni settate. Queste ultime sono tipiche degli invertebrati.
I desmosomi (chiamati anche macula adherens) sono in genere strutture di forma circolare o ellittica. Nella regione contenente un desmosoma è possibile osservare uno spesso strato di materiale denso, la placca, posta immediatamente al di sotto della membrana plasmatica sui due versanti della giunzione. A partire dalla placca, e per una certa distanza in direzione del citoplasma sottostante, si dipartono strutture citoscheletriche ben definite, ifilamenti intermedi, dettitonofilamenti, che fungono da ancora citoplasmatica per la giunzione. A seconda del tipo di cellula, essi possono essere costituiti da citocheratina o da vimentina. Le membrane plasmatiche delle cellule che hanno in comune un desmosoma sono tra loro parallele, più o meno allineate e separate da uno spazio di ampiezza costante. Lo spazio extracellulare che le separa è occupato da un fitto intreccio di filamenti sottili e di materiale granulare che va sotto il nome di nucleo del desmosoma. I desmosomi di animali e tessuti diversi contengono proteine rappresentative che sono riscontrabili in modo costante. Tra queste, due delle più grandi, le desmoplachine I e II sono molecole strutturalmente correlate e risultano essere associate alle placche. Un altro gruppo di glicoproteine, le desmogleine, che sono membri della famiglia delle caderine , fungono da ponte citoplasmatico tra le placche ed il materiale extracellulare. Negli animali pluricellulari, i desmosomi congiungono molti tipi diversi di cellule. Queste strutture sono particolarmente abbondanti nei tessuti che sono comunemente sottoposti a stress meccanici in senso laterale o da stiramento, come le cellule dell'epidermide e quelle degli epiteli che rivestono la superficie interna delle cavità corporee.
Le giunzione intermedie (o giunzioni aderenti o zonulae adherens), congiungono le cellule di alcuni tessuti animali, come ad esempio quelle del muscolo cardiaco e delle membrane che avvolgono gli organi e che rivestono le cavità corporee. Come nel caso dei desmosomi, anche nella giunzione aderente la regione sottostante la membrana plasmatica è ispessita e dà origine ad una placca. Le placche delle giunzioni aderenti non hanno l'aspetto di uno strato denso e compatto ma piuttosto quello di un reticolo a struttura irregolare. Dalle placche si dipartono in direzione del citoplasma sottostante dei microfilamenti di actina che ancorano la giunzione al citoscheletro. Le placche contengono elevate concentrazioni divinculina e di altre proteine che normalmente hanno un ruolo di collegamento tra elementi presenti nella membrana plasmatica ed i microfilamenti di actina. Le due placche si saldano nello spazio intercellulare attraverso una maglia proteica di caderina.
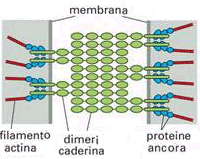
Le giunzioni settate (da septum = parete) hanno questo nome in quanto, in sezione trasversale, le membrane che costituiscono le giunzioni risultano essere collegate, nella regione extracellulare, da segmenti trasversali, o setti, a spaziatura regolare. Lo spazio che separa le membrane è caratterizzato da una distanza estremamente regolare, variabile da 15 a 17 nm, dovuta alla presenza di segmenti densi che si alternano a zone chiare, per tutta la lunghezza della giunzione. Tutte le giunzioni settate sono dotate, nella regione extracellulare, di questi segmenti trasversali caratteristici, ma la morfologia dettagliata dei setti, le loro dimensioni e le distanze di spaziatura assumono valori caratteristici in ciascun phylum degli invertebrati.
b) Le giunzioni comunicanti (o giunzioni serrate o gap junction) costituiscono un passaggio aperto attraverso cui ioni e piccole molecole possono direttamente passare da una cellula all'altra. In questo tipo di giunzioni, le membrane plasmatiche delle due cellule adiacenti sono separate da uno spazio molto regolare di 2,7 nm. Il termine usato in inglese, gap, sta a indicare questa separazione sorprendentemente regolare. In queste strutture è stata messa in evidenza la presenza di un grande numero di cilindri cavi disposti con l'asse maggiore perpendicolare alla superficie delle cellule che attraversano lo spazio intercellulare delle giunzioni comunicanti.
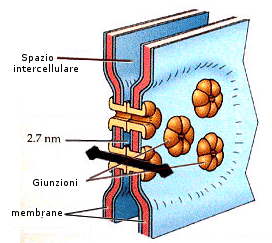
Nei vertebrati, lo stretto canale che si trova al centro del cilindro ha un diametro di circa 1,5 nm nel punto più stretto, dimensione sufficiente a permettere il libero transito di ioni e di piccole molecole. Nelle giunzioni i cilindri appartenenti a due membrane plasmatiche adiacenti si incontrano coda contro coda, e costituiscono un passaggio diretto tra una cellula e l'altra, ma isolano la giunzione rispetto ai liquidi extracellulari. Ogni cilindro della giunzione, definito connessone, è costituito da un numero variabile da 4 a 6 molecole di una proteina detta connessina. A seconda del tipo di cellula dal quale vengono isolate, il peso molecolare delle connessine varia. Le giunzioni comunicanti di un determinato tipo di tessuto possono contenere un unico tipo di connessina o una miscela di due o più tipi diversi. Nonostante le differenze di dimensioni, tutte le connessine hanno una struttura analoga che comprende quattro regioni transmembraniche ad alfa-elica. L’apertura e la chiusura dei canali è regolata dalle cellule. Il sottile strato tra le due cellule impedisce il passaggio di grosse molecole. Sono presenti nel muscolo cardiaco e nei tessuti muscolari lisci.
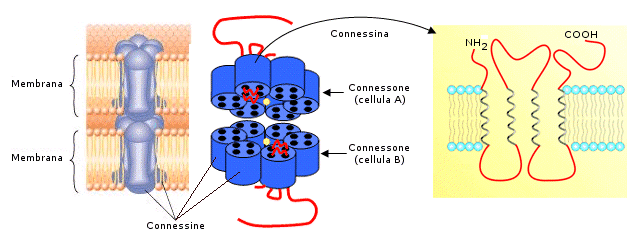
c) Le giunzioni occludenti (o giunzioni strette o tight junction) hanno il compito di chiudere gli spazi intercellulari alla diffusione, in quanto formano una specie di barriera che impedisce il flusso diretto di molecole e di ioni da una cellula all'altra. Le due membrane cellulari sono strettamente cucite insieme da una proteina di membrana (claudina). Sono le giunzioni più forti perché, oltre a solidità meccanica, impediscono il passaggio di acqua e soluti tra le cellule, formando un sigillo che impedisce il passaggio di sostanze fra il dominio extra-cellulare apicale e il dominio basolaterale. Sono poste ad esempio tra le cellule che rivestono l’apparato digerente, impedendo agli acidi ed agli enzimi di danneggiare i tessuti sottostanti.
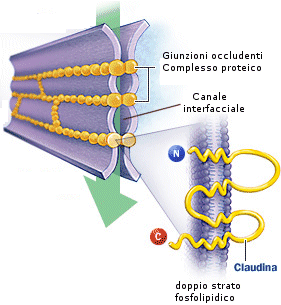
.
Spesso le giunzioni si trovano coordinate in complessi giunzionali. Un singolo complesso giunzionale è formato da una giunzione occludente, da una giunzione intermedia, da un desmosoma e da una giunzione serrata.
Nelle cellule animali, la membrana plasmatica non presenta generalmente strati esterni di rivestimento. Nei batteri e nei vegetali, invece, all'esterno della membrana si trova una parete rigida, alquanto spessa e robusta, costituita da polisaccaridi complessi (nel caso delle piante superiori, soprattutto da cellulosa). Tale struttura nei batteri ha soprattutto una funzione protettiva; nei vegetali, oltre a questa funzione, la parete svolge un ruolo di sostegno e serve a mantenere la forma tipica della cellula. La parete limita i movimenti della cellula, come pure l'ingresso e la fuoriuscita di materiali.
Citoplasma e citosol
L'intero volume della cellula, con esclusione del nucleo, è occupato dal citoplasma. Questo comprende una soluzione acquosa concentrata, denominata citosol, nella quale si trovano sospesi gli organuli cellulari.
Il citosol è un gel acquoso, contenente molecole di varie dimensioni. Costituisce il sito di molte funzioni importanti, come la demolizione delle molecole e la sintesi di numerose macromolecole che sono le unità costitutive della cellula. Molte molecole presenti nel citosol sono libere di muoversi per tutte le regioni della cellula; altre hanno una minore libertà di movimento, poiché fanno parte di strutture ordinate, gli organuli, che determinano nella cellula una compartimentazione utile allo svolgimento delle reazioni metaboliche.
Organuli della cellula eucariote
Nel citoplasma troviamo diversi organuli cellulari i quali possono essere raggruppati in sistemi di membrana, mitocondri, ribosomi, sistema citoscheletrico
Sistemi di membrane
Il citosol è invaso da una complessa rete di membrane e vescicole membranose. Costituiscono il sistema interno di membrane (endomembrane) della cellula eucariote: il reticolo endoplasmatico, l’apparato di Golgi, i lisosomi ed i perossisomi
Reticolo endoplasmatico
Il reticolo endoplasmatico (RE) è il sistema di membrane più esteso della cellula ed è costituito da una fitta rete di cisterne e tubuli tra loro interconnessi che parte ed è collegato alla membrana nucleare.
Grazie alla presenza sulle sue membrane di proteine enzimatiche il Reticolo è sede di una intensa attività metabolica. La struttura fittamente ripiegata del Reticolo consente alla cellula di avere a disposizione una elevata superficie di lavoro e di tenere separati i diversi processi metabolici. Si distingue un Reticolo endoplasmatico liscio (REL), privo di ribosomi ancorati alle sue membrane ed un Reticolo endoplasmatico rugoso o ruvido (RER) caratterizzato da membrane cosparse di ribosomi sulla faccia citosolica.
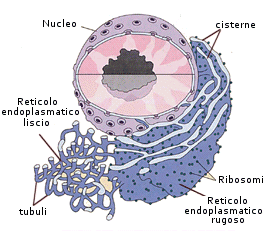
il Reticolo endoplasmatico rugoso è costituito da un sistema di sacculi appiattiti impilati, detti cisterne, tra loro connesse. I ribosomi adesi al RER sono responsabili della sintesi delle proteine destinate a far parte delle membrane o ad essere secrete. Inoltre le proteine prodotte vengono ulteriormente rielaborate, con formazione di strutture quaternarie multimeriche o glicosilate (aggiunta di oligosaccaridi) con formazione di glicoproteine. Alla fine di tali processi le molecole prodotte vengono espulse del RER attraverso vescicole raggiungendo i siti di competenza intracellulare (tipicamente l’apparato di Golgi) o extracellulare. Il RER è particolarmente abbondante nelle cellule che presentano attività secretrice (pancreas).
Il Reticolo endoplasmatico liscio si struttura in forma di tubuli e canali ricurvi. ha come compito quello di detossificare sostanze altrimenti dannose per l'organismo, come ad esempio l'etanolo contenuto nelle bevande alcoliche. Per questo motivo è molto diffuso nelle cellule epatiche. Il REL inoltre è sede del metabolismo di fosfolipidi, acidi grassi, steroidi ed è un sito di deposito degli ioni Ca2+. Il REL è infine in grado di degradare gli organuli cellulari per rinnovarli avvolgendoli nelle sue membrane e generando una vescicola di autofagocitosi (o autofagosoma) il cui contenuto verrà successivamente digerito.
Apparato di Golgi
L'Apparato di Golgi (o dittiosoma) si trova tra il reticolo endoplasmatico e la membrana cellulare (da 10 a 20 dittiosomi per cellula). Esso è costituito da una pila di cisterne schiacciate (da 4 a 8 cisterne per dittiosoma), curvate a scodella, con i bordi leggermente rigonfi. Ciascuna cisterna è indipendente dalle altre ed è costituita da una struttura chiusa delimitata da una singola membrana ininterrotta.
L'apparato di Golgi è polarizzato. Il lato rivolto verso il reticolo è detto faccia cis (o CGN = Cis Golgi Network), mentre il lato rivolto verso la membrana è detto faccia trans (o TGN = Trans Golgi Network).
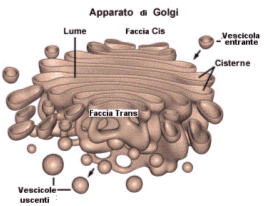
Le proteine che sono state sintetizzate e modificate nel Reticolo endoplasmatico, e da questo rilasciate in vescicole, entrano nel Golgi fondendosi con la faccia Cis. Nel Golgi subiscono ulteriori modifiche mentre sono trasportate verso la faccia trans. Le modalità di migrazione delle sostanze dalla faccia cis verso la faccia trans non sono ancora completamente chiarite.
Secondo l’ipotesi delle “cisterne stazionarie”, ogni cisterna possiede il suo corredo enzimatico e dopo aver modificato le sostanze in entrata le cedono, generando vescicole che si fondono con la cisterna successiva.
Secondo l’ipotesi della “maturazione delle cisterne” ogni cisterna modifica gradualmente il suo corredo enzimatico trasformandosi da cisterna cis in cisterna trans ed andando a sostituire la cisterna successiva.
La cisterna trans, completata la trasformazione delle sostanze, le rilascia attraverso vescicole che si formano dalla sua membrana per gemmazione. Le vescicole generate dal Golgi possono essere utilizzate all’interno della cellula, in genere per processi digestivi con formazione di lisosomi o possono essere secrete esternamente (vescicole di esocitosi).
Lisosomi
Il lisosoma è una vescicola contenente enzimi idrolitici che si attivano a pH 5. È formato dalla fusione di vescicole idrolasiche del Golgi con vescicole di endocitosi (endosomi). Nelle vescicole idrolasiche del Golgi (o lisosomi primari) sono già presenti gli enzimi litici, ma il pH non è sufficientemente acido perché questi si attivino. Quando si fondono con gli endosomi, i quali sono dotati di pompe protoniche sulla propria membrana in grado di abbassare il pH, gli enzimi vengono attivati e si forma il vero e proprio lisosoma. Esso è ricco di enzimi digestivi in grado di degradare molecole e strutture presenti all'interno della cellula nei loro costituenti elementari per poi venire riutilizzati in altro modo o essere espulsi.
Il lisosoma può degradare macromolecole come proteine, lipidi e carboidrati o anche molecole estranee ingerite dalla cellula. Attraverso questo stesso processo i globuli bianchi sono in grado di digerire i microrganismi patogeni o cellule morte precedentemente fagocitate. La membrana del lisosoma contiene proteine di trasporto per esportare nel citosol i prodotti della digestione e grandi quantità di glucidi legati a lipidi o a proteine della faccia non citosolica come protezione contro i propri enzimi.
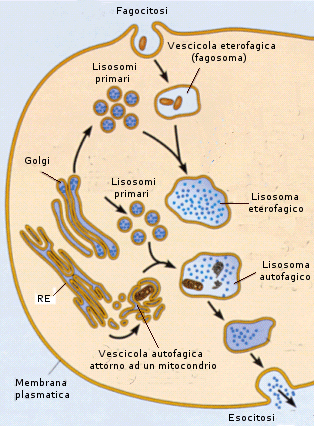
Perossisomi
I perossisomi sono organuli vescicolari di circa 0,5-1 μm di diametro, delimitati da una singola membrana, presenti in tutte le cellule eucarioti, ma particolarmente abbondanti nelle cellule renali ed epatiche. Svolgono diverse funzioni metaboliche, la più rappresentativa delle quali è senz’altro l’attività ossidativa (respiratoria) a carico di substrati di tipo diverso (soprattutto acidi grassi, ma anche sostanze nocive come l’etanolo con conseguente azione detossificante), che avviene in presenza di una famiglia di enzimi noti come ossidasi. L’attività delle ossidasi avviene con consumo di ossigeno molecolare (O2) e formazione di perossido di idrogeno (o acqua ossigenata H2O2). Il perossido di idrogeno è una molecola altamente reattiva che può facilmente produrre radicali liberi tossici e che i perossisomi rimuovono attivamente usando l’enzima catalasi attraverso la seguente reazione
2H2O2 → O2 + 2H2O
In generale i perossisomi sono in grado di preservare le strutture cellulari dall’azione nociva del perossido di idrogeno (l’acqua ossigenata può essere utilizzata come disinfettante contro i batteri essendo questi privi di perossisomi).
L’appartenenza dei perossisomi al sistema interno di membrane è in realtà ancora oggetto di discussione. I nuovi perossisomi non si formano infatti per scissione dalle membrane del Reticolo o del Golgi, ma si ingrandiscono e si scindono in modo analogo a quanto fanno i mitocondri ed i cloroplasti. Per questo motivo è stata proposta anche per essi (come per i mitocondri ed i cloroplasti) una origine endosimbiontica. Dell’ipotesi endosimbiontica diremo più dettagliatamente quando descriveremo il mitocondrio. Tuttavia, in sintesi, essa ipotizza che alcuni organuli cellulari possano essere antichi microrganismi fagocitati dalla cellula eucariote primordiale in fase di evoluzione che poi stabilì con essi un rapporto di simbiosi. Recentemente è stato tuttavia dimostrato che cellule private dei perossisomi possono generarne di nuovi a partire dal Reticolo. Questa ed altre osservazioni portano oggi a considerare meno probabile l’origine endosimbiontica dei perossisomi a favore di una origine dal sistema interno di membrane.
Sistema citoscheletrico
Il sistema citoscheletrico è costituito dal citoscheletro e da strutture di derivazione citoscheletrica quali ciglia, flagelli, fuso mitotico e dai relativi centri di organizzazione di tali strutture quali centrioli e corpi basali.
Il citoscheletro
Il citoscheletro è un sistema di filamenti proteici presente nel citosol di tutte le cellule animali e vegetali. È costituito da tre tipi principali di filamenti proteici: microtubuli, microfilamenti e filamenti intermedi, connessi sia tra di loro che con altre strutture cellulari grazie a numerose proteine accessorie. Della struttura quaternaria dei microtubuli (tubulina) e dei microfilamenti (actina) abbiamo già detto (vedi capitolo sulle proteine)
I filamenti intermedi presentano un diametro di circa 10 nm, intermedio appunto tra quello dei microfilamenti (circa 5 nm) e dei microtubuli (circa 25 nm). A seconda del tipo di cellule in cui si trovano possono essere costituiti da proteine di tipo diverso: citocheratina nelle cellule epiteliali, desmina nelle cellule muscolari, neurofilamenti negli assoni delle cellule nervose, vimentina nei fibroblasti del connettivo.
L’elemento di base è un dimero formato da due catene ad alfa elica superavvolte (coiled-coil). I dimeri si appaiano in modo sfalsato ed antiparallelo (estremità ammino-terminale contro estremità carbossi-terminale) a formare tetrametri. I tetrametri si succedono a formare un protofilamento. 2 protofilamenti appaiati formano una protofibrilla. 8 protofilamenti (o 4 protofibrille) si avvolgono a spirale a formare un filamento intermedio
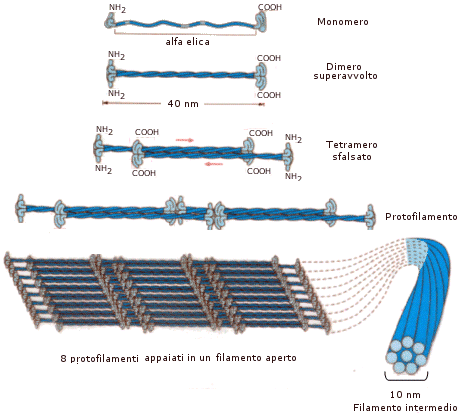
Nelle cellule animali, che mancano di una parete cellulare rigida, il citoscheletro ha un'importanza particolare, in quanto contribuisce a mantenere la struttura e la forma della cellula. Il citoscheletro fornisce infatti un'impalcatura per l'organizzazione interna della cellula e un punto di ancoraggio per organuli ed enzimi.
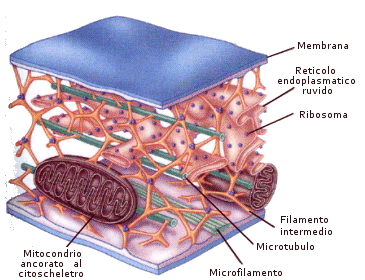
Il citoscheletro è una struttura dinamica, che viene continuamente scomposta e riassemblata. In questo modo è in grado di supportare i movimenti sia dell’intera cellula (pseudopodi, ciglia e flagelli) che degli organuli al suo interno.
Durante la formazione degli pseudopodi, ad esempio, la cellula costruisce dei microfilamenti nella direzione di avanzamento dell’estroflessione, per dirigerne e sostenerne la crescita. I microfilamenti di actina sono polarizzati (estremità + e -) e si riconoscono non solo da un punto di vista biochimico, ma anche morfologico, perché l’estremità + è appuntita, quella – è sfrangiata. Entrambe le estremità sono siti di crescita con velocità diverse: maggiore nella estremità + e inferiore nella estremità -. La porzione + del filamento di actina rappresenta la zona di attiva crescita e per questo necessita di energia sotto forma di ATP. Se nell’estremità +, i monomeri si legano velocemente, nell’estremità – vengono sottratti monomeri di G-actina che, caricati con ATP si spostano all’estremità positiva per essere assemblati: il risultato è che il filamento, mentre cresce, si sposta. Questo processo viene usato per la formazione di pseudopodi. Quindi, l’avanzamento di un filamento può essere fatto non solo con i monomeri ex-novo, ma anche con unità che derivano dal decremento dell’estremità negativa.
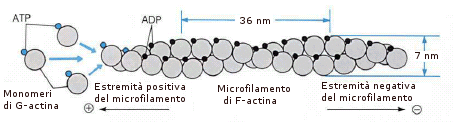
L’actina interviene anche durante la fase finale della divisione cellulare (citodieresi). La cellula eucariote animale si scinde nelle due cellule-figlie grazie ad un anello contrattile di actina (e di miosina, l’actina manifesta proprietà contrattili in presenza di miosina), posto appena sotto la membrana che strozza la cellula-madre nella regione equatoriale.
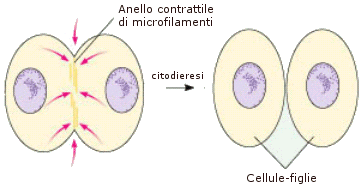
I microtubuli, come i microfilamenti, sono una componente del sistema citoscheletrico fondamentale per i movimenti cellulari. Essi costituiscono infatti una rete interna di binari sui quali possono spostarsi gli organuli e le vescicole cellulari grazie alla presenza di molecole di chinesina e dineina, proteine che fungono da “carrelli trasportatori”, trasformando l'energia derivante dall'idrolisi di ATP in energia motrice. Inoltre, sempre grazie alla dineina, microtubuli, disposti parallelamente, possono scorrere uno rispetto all’altro consentendo il movimento di ciglia e flagelli. Dineina e chinesina sono una classe di proteine associate ai microtubuli o MAP (Microtubule associated proteins). Dineina e chinesina sono MAP motorie, motori proteici, così chiamate perché usano ATP per guidare il trasporto di vescicole ed organelli o per creare forze di scorrimento tra i microtubuli.
Anche i microtubuli, come i microfilamenti, sono polari , in quanto presentano un'estremità positiva (+), dove la crescita avviene velocemente ed una estremità negativa (-) che influisce poco sull'accrescimento. Le chinesine si muovono verso l’estremità (+) del microtubulo, mentre le dineine verso l’estremità (–).
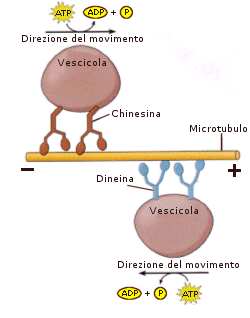
Centro organizzatore dei microtubuli (MTOC)
Nella cellula eucariote animale i microtubuli si formano a partire da un centro organizzatore dei microtubuli o COMT (o MTOC, Microtubule-organizing center) che possiede un punto di innesco per la crescita dei microtubuli costituito da una molecola di tubulina-γ a forma di anello. I microtubuli rivolgono sempre al MTOC la loro estremità (-) e si accrescono allontanandosi da esso con la loro estremità (+). Esistono due MTOC nella cellula animale (la cellula vegetale ne è sprovvista): i centrioli ed il corpo basale.
I centrioli sono due piccoli organuli a cilindretto disposti perpendicolarmente l'uno rispetto all'altro, situati vicino alla membrana nucleare e circondati da un materiale proteico amorfo a formare una struttura denominata centrosoma. I centrioli sono formati da 9 triplette di microtubuli saldate tra loro da filamenti proteici.

Questa struttura è comune anche ai corpi basali. Ogni tripletta di un MTOC presenta la seguente struttura
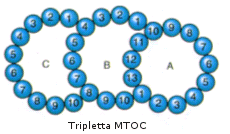
Quando la cellula non è in fase di divisione cellulare (interfase) la funzione dei centrioli è quella di organizzare la componente microtubulare del citoscheletro. In ogni cellula il movimento delle vescicole non è caotico. Esse si muovono in maniera controllata lungo binari di microtubuli.
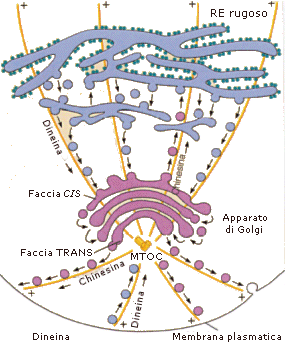
Nel neurone questi binari assumono un significato funzionale cruciale. Le vescicole di neurotrasmettitori costruite nel corpo cellulare vengono trasportate lungo l'assone al bottone terminale (dove trasmettono segnali ad altre cellule) proprio camminando lungo questi microtubuli.
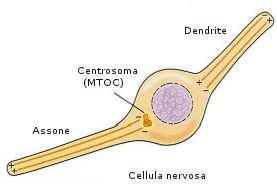
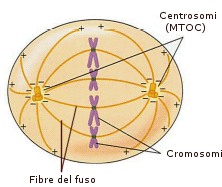 Quando la cellula è in fase di divisione cellulare (mitosi) la funzione dei centrioli è quella di organizzare il fuso mitotico, un fascio di microtubuli che fungono da binari per la ordinata e corretta divisione del materiale genetico (DNA sottoforma di cromosomi) alle due cellule figlie. I due centrioli si duplicano e migrano ai poli opposti della cellula tendendo fra di essi un fascio di microtubuli ai quali successivamente aderiranno i cromosomi.
Quando la cellula è in fase di divisione cellulare (mitosi) la funzione dei centrioli è quella di organizzare il fuso mitotico, un fascio di microtubuli che fungono da binari per la ordinata e corretta divisione del materiale genetico (DNA sottoforma di cromosomi) alle due cellule figlie. I due centrioli si duplicano e migrano ai poli opposti della cellula tendendo fra di essi un fascio di microtubuli ai quali successivamente aderiranno i cromosomi.
Il corpo basale è un MTOC strutturalmente e funzionalmente simile ad un centriolo. La sua funzione è quella di assemblare e coordinare i microtubuli che formano il citoscheletro di ciglia e flagelli.
Ciglia e flagelli
Ciglia e flagelli sono estroflessioni filiformi e flessibili della membrana plasmatica, simili a peli, presenti sulla superficie di alcune cellule animali (ciglia e flagelli sono assenti nella cellula eucariote vegetale). Le ciglia sono generalmente corte e numerose sulla superficie cellulare, mentre i flagelli sono più lunghi e presenti nel numero di uno o due per cellula.
La struttura citoscheletrica interna (assonema) di ciglia e flagelli è identica ed è costituita da 9 coppie di microtubuli disposti ad anello attorno a due microtubuli non accoppiati al centro. Questa struttura, detta 9+2, si ritrova in quasi tutte le forme di ciglia e flagelli eucariotici, dai protozoi all'uomo e funziona da motore del movimento. Le coppie esterne di microtubuli sono collegate tra loro da due braccia di dineina e da connessioni proteiche di nexina.
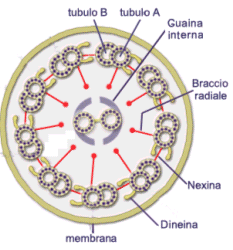
Ogni coppia periferica di microtubuli presenta la seguente struttura

Ciglia e flagelli si flettono dando luogo a un battito regolare come conseguenza dell'energia che si libera quando la dineina idrolizza l’ATP, promuovendo lo scorrimento reciproco dei microtubuli.
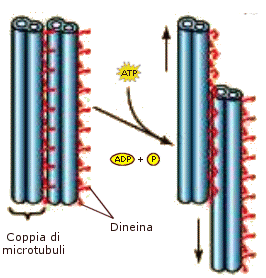
L'assonema si connette al corpo basale che penetra nel citosol come una radice e che, come abbiamo visto, presenta la medesima struttura a 9 triplette di microtubuli di un centriolo.
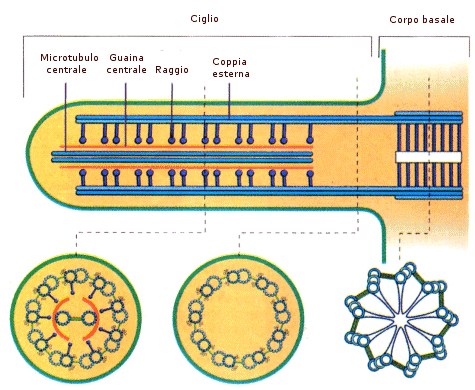
Poiché l’assonema è rigidamente ancorato alla base al corpo basale, lo scorrimento reciproco delle coppie di microtubuli una rispetto all’altra genera la curvatura dell’assonema e quindi il movimento.
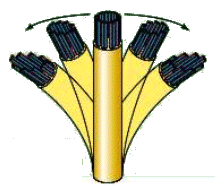
Le ciglia si muovono con un movimento simile a quello delle braccia di un nuotatore

Il flagello si muove con un movimento ondulatorio simile al colpo di una frusta

Negli organismi unicellulari ciglia e flagelli hanno principalmente funzioni di locomozione, permettendo alla cellula di “nuotare” all’interno di un substrato liquido (protozoi ciliati e flagellati). In alcuni casi possono essere utilizzati con funzioni trofiche per creare correnti nel liquido intorno alla cellula in modo da “aspirare” ed indirizzare il cibo verso il luogo in cui verrà digerito, come succede per esempio nelle vorticelle.
Negli organismi pluricellulari sono presenti epiteli ciliati che rivestono organi cavi. Le cilia che rivestono la trachea, ad esempio, hanno una funzione “spazzina”. Intercettano le particelle di impurità sospese nell’aria che inspiriamo e, attraverso un ritmico e coordinato movimento verso l’alto (tipo quello della “ola” in uno stadio) le sospingono verso l’imboccatura dell’esofago, dove vengono deglutite.
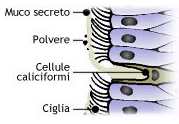
Nell’orecchio esistono epiteli ciliati con funzione di trasduzione di segnali. Nella coclea, ad esempio, le ciglia che rivestono l’epitelio interno, messe in movimento dalle vibrazioni sonore, stimolano le terminazioni nervose i cui impulsi vengono interpretati dal cervello come suoni.
Ribosomi
I ribosomi sono granuli scuri presenti nel citosol oppure sulla membrana nucleare e sul reticolo endoplasmatico rugoso. Sono composti da RNA ribosomiale e materiale proteico e sintetizzano le proteine. La loro disposizione all'interno della cellula è collegata alla funzione di quest'ultima. Se la cellula secerne le proteine prodotte possiede solo ribosomi attaccati al reticolo endoplasmatico (che occupa gran parte del citosol) e alla membrana nucleare. Se la cellula immagazzina le proteine che sintetizza possiede ribosomi liberi. Sono definiti ‘liberi’ i ribosomi che si trovano nel citoplasma cellulare o che fanno parte dei mitocondri o dei cloroplasti.
Un ribosoma batterico ha un coefficiente di sedimentazione di 70 S ed è costituito da una subunità grande di 50 S ed una subunità piccola di 30 S.
Lo svedberg (simbolo S) è un'unità di misura del tasso di sedimentazione. Uno svedberg è pari a 10-13 secondi.
L'unità prende il nome dal quello del fisico e chimico svedese Theodor Svedberg, vincitore del Premio Nobel per la chimica nel 1926 per il suo lavoro sulla chimica dei colloidi e l'invenzione dell'ultracentrifuga.
Nell'ultracentrifugazione, il tasso di sedimentazione di una particolare macromolecola è calcolato dividendo la velocità di sedimentazione costante (espressa in m/s) per l'accelerazione applicata (espressa in m/s2) e moltiplicando poi per 1013
Il ribosoma della cellula eucariote, invece (fatta eccezione per quelli contenuti nei mitocondri e nei cloroplasti), è più grande ed ha un coefficiente di sedimentazione di 80 S. Anch'esso è composto da due subunità (60 S e 40 S) che nel complesso presentano più di 80 proteine.
Le due subunità del ribosoma sono sintetizzate in una regione interna al nucleo detta nucleolo. Migrano poi nel citoplasma attraverso i pori della membrana nucleare e successivamente si uniscono tra loro ed operano insieme per tradurre un RNA messaggero in una catena polipeptidica durante la sintesi proteica.
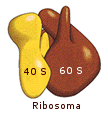
Mitocondri
Un mitocondrio è un organulo cellulare di forma allungata, presente in tutti gli Eucarioti (con alcune eccezioni). I mitocondri sono gli organelli addetti alla respirazione cellulare. Nei procarioti sono sostituiti da sacchette contenenti enzimi respiratori. Sono costituiti da due membrane: la membrana interna e la membrane esterna. Lo spazio fra queste due membrane è detto spazio intermembrana. Lo spazio delimitato dalla membrana interna è detto matrice mitocondriale. La membrana interna si estende nella matrice formando delle pieghe dette creste mitocondriali, dove si concentrano gli enzimi respiratori. La membrana mitocondriale esterna è simile a quella del Reticolo Endoplasmatico ed è piuttosto permeabile grazie alla presenza di canali proteici (porine), mentre quella interna è simile alla membrana plasmatica dei batteri, è quasi del tutto priva di colesterolo e presenta trasportatori di membrana altamente selettivi che la rendono assai poco permeabile.
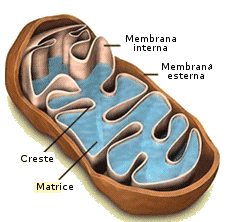
Dopo una breve fase di accrescimento, i mitocondri si dividono per scissione in mitocondri più piccoli. Una volta invecchiati sono eliminati mediante autofagia. Vengono inglobati nella membrana del REL e poi degradati ad opera degli enzimi litici lisosomiali. I mitocondri possiedono un DNA proprio sotto forma di molecole circolari, non legate a proteine, agganciate alla membrana delle creste mitocondriali.
Il mitocondrio è in grado di svolgere molteplici funzioni. La più importante tra esse consiste tuttavia nell'estrarre energia dai substrati organici (respirazione cellulare) per produrre un gradiente ionico che viene sfruttato per sintetizzare ATP. Nel mitocondrio si completano le ultime due fasi della respirazione cellulare.
Fonte: http://rexmagister.altervista.org/downloads/BiologiaDOC.zip
sito web: http://rodomontano.altervista.org/biologia.php
Autore del testo: Rodomontano
Biologia appunti parte 2
Visita la nostra pagina principale
Biologia appunti parte 2
Termini d' uso e privacy