Calore specifico acqua
Calore specifico acqua
La capacità termica è una quantità caratteristica di un dato sistema.
Calore specifico = Capacità termica per unità di quantità di materia. Il calore specifico si esprime in gradi/grammi o in gradi/ mole a seconda che la quantità di materia si misuri in grammi o moli. In questo secondo cas si parla di calore specifico molare.
Il calore specifico dell’acqua, 1 Cal/g °C a 14.5 °C e 1 atm, è superiore a quello della maggior parte delle altre sostanze. In Fig. 1 è rappresentato il calore specifico dell'acqua nell'intervallo di temperature 0 °C - 100 °C. Si osservi la sua dipendenza dalla temperatura (la scala delle ordinate è molto amplificata!); mediamente il suo valore si attesti intorno a circa 1 cal/g °C.
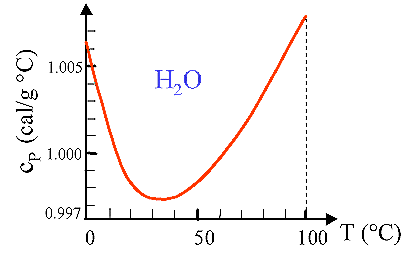 Fig. 1 Fig. 1 |
Mari e grandi laghi, a causa dell’alta capacità termica dell’acqua, stabilizzano la temperatura dell’ambiente. |
Il calore specifico c è una quantità caratteristica del materiale che costituisce il corpo
Il calore specifico c, al pari della capacità termica C, dipende anche dal particolare tipo di processo che il sistema subisce.
Processi in cui il sistema è soggetto a pressione esterna idrostatica costante: cP calore specifico a pressione costante. Processi in cui il volume del sistema non cambia: cV calore specifico a volume costante.
Per un sistema magnetico si parla di: cH calore specifico a campo magnetico costante e di cM calore specifico a magnetizzazione costante.

Calore specifico di alcune sostanze espresso in Cal/g °C, a 25 °C e 1 atm
Calori specifici di alcune sostanze
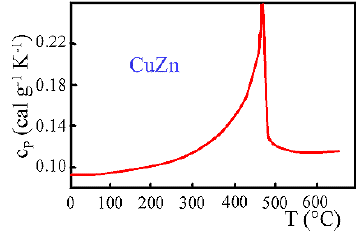
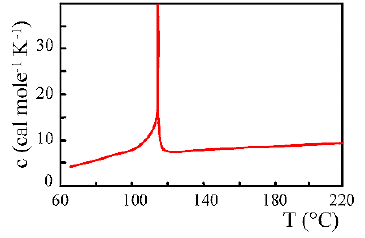
L'andamento del calore specifico in funzione della temperatura fornisce importanti informazioni sulle proprietà di una sostanza. Per esempio la presenza di discontinuità è indice di transizioni di fasi. Nelle figure seguenti sono rappresentati i calori specifici di varie sostanze.
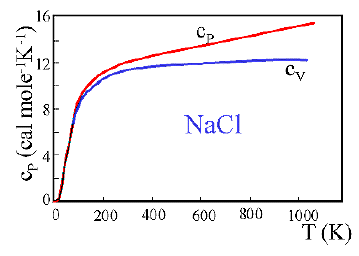 Fig. 3 Calore specifico molare del cloruro di sodio a pressione, cP, ed a volume costante, cV, al variare della temperatura. |
|
|
|
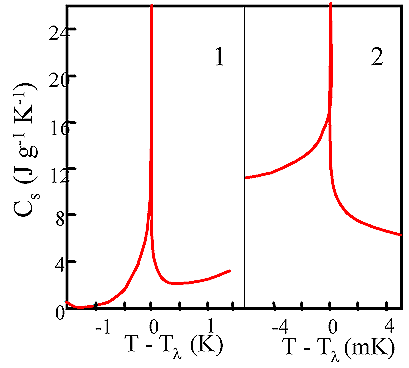
Fig. 7
Calore specifico dell’elio lungo la linea di saturazione. Il picco in Fig. 7 illustra la tarnsizione dell'elio dalla fase normale a quella superfluida. La temperatura di transizione Tl prende il nome di "punto l". I dati in Fig. 7 sono espressi in funzione della differenza fra la temperatura di misura T e quella di transizione Tl sotto la quale l’elio diventa superfluido. In fig. 7 (a destra) la scala della temperatura è espansa di circa 5000 volte rispetto a quella della fig. 7 (a sinistra) per evidenziare l’estrema acutezza del picco del calore specifico a Tl = 2.172 K.
Fonte: http://www.science.unitn.it/~fisica1/fisica1/appunti/termo/cap_3/cap_3_2_1.htm
Calore specifico acqua
CALORE SPECIFICO
Il calore specifico indica quanta energia bisogna cedere ad un corpo per innalzarne la temperatura di un grado.
Il calore specifico di un gas dipende dal numero dei gradi di libertà delle molecole che lo compongono (occorrerà meno energia per scaldare un gas monoatomico che uno biatomico, in quanto per il secondo sono in gioco altri gradi di libertà oltre quelli di tipo traslazionale).
Si definisce calore specifico a volume costante:
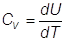 (molare)
(molare)
dove con U rappresenta l’energia interna molare.
Il prodotto del calore specifico per la massa è detto capacità termica.
Per un gas monoatomico:
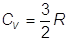 (servono 3 cal per alzare di 1 °K la temperatura di una mole di gas)
(servono 3 cal per alzare di 1 °K la temperatura di una mole di gas)
In prima approssimazione il Cv non dipende quindi dalla temperatura.
Per il calore specifico a pressione costante si deve aggiungere anche il lavoro svolto dal gas nella sua espansione durante il riscaldamento:
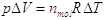
che, per nmoli = 1 e DT = 1°K, vale proprio R.
Pertanto, l’energia che occorre fornire ad una mole di gas per innalzarne la temperatura di un grado a pressione costante risulta :
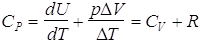 (molare)
(molare)
Per un gas monoatomico:
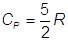 (le due calorie in più servono a far espandere il gas)
(le due calorie in più servono a far espandere il gas)
Per un gas biatomico i gradi di libertà sono 5, in quanto vanno aggiunti i due rotazionali, pertanto:
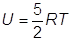
Si definisce coefficiente adiabatico del gas il rapporto dei due calori specifici appena definiti:
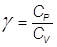 (per un gas biatomico)
(per un gas biatomico)
Es.: Quanta energia serve per innalzare di un grado la temperatura dell’aria di una stanza di 5x5x3 m3?
La pressione della stanza rimane costante (1 atmosfera) durante il riscaldamento; dunque avremo:
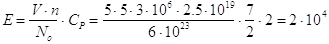 cal
cal
è la stessa quantità di energia necessaria per alzare di un grado la temperatura di 20 litri d’acqua; in realtà serve molta più energia in quanto bisogna riscaldare anche gli oggetti contenuti nella stanza…
fonte:http://www.df.unipi.it/~giuliett/DISPENSE_STRUTTURA/1.4-CALORE%20SPECIFICO.doc
Calore specifico acqua
Visita la nostra pagina principale
Calore specifico acqua
Termini d' uso e privacy

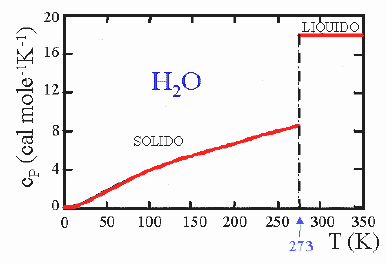 Fig. 4 Calore specifico a pressione costante, cP, dell’acqua in funzione della temperatura
Fig. 4 Calore specifico a pressione costante, cP, dell’acqua in funzione della temperatura