Reazioni chimiche
Reazioni chimiche
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Reazioni chimiche
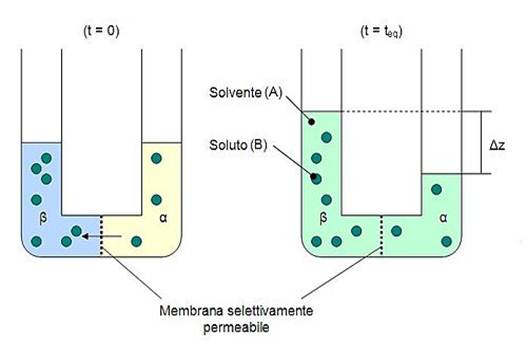
LA PRESSIONE OSMOTICA
La pressione osmotica rappresenta la pressione idrostatica che bisogna esercitare su una soluzione, separata da un’altra soluzione da una membrana semipermeabile, perché in essa non entri un altro solvente.
È un processo di diffusione che interessa le cellule vegetali e animali e, in generale, le soluzioni separate da un membrana semipermeabile. La membrana permette il passaggio del solvente verso la soluzione più concentrata.
Quanto maggiore è il numero di particelle disciolte, tanto più alta è la pressione osmotica.
∏∙ V = n ∙ R ∙ T ∏ = n ∕ V ∙ R ∙ T = M ∙ R ∙ T
M = Molarità.
R = Costante di proporzionalità pari a 0,082 L ∙ atm/mol ∙ K
T = Temperatura assoluta.
∏ = Pressione Osmotica.
Le soluzioni che presentano uguale concentrazione e pressione osmotica sono dette Isotoniche. Se due soluzioni hanno una concentrazione e una pressione osmotica diverse allora quella con concentrazione minore viene detta Ipotonica; e quella con concentrazione maggiore Ipertonica.
LE REAZIONI CHIMICHE
Sono trasformazioni che comportano una variazione della composizione chimica delle sostanze originarie.
reagenti → prodotti
Quando i reagenti si trasformano in prodotti, gli atomi dei reagenti si ricombinano tra loro in modo diverso e modificano così la loro posizione reciproca nello spazio.
Davanti alle formule dei reagenti e dei prodotti, si introducono a questo scopo numeri opportuni chiamati coefficienti stechiometrici; a tale operazione si dà il nome di bilanciamento.
Come bilanciare uno schema di reazione:
H3PO4 + Ca(OH)2→ Ca3(PO4)2 + H2O
- Bilanciamo il calcio ponendo coefficiente 3 davanti alla formula dell’idrossido di calcio.
H3PO4 + 3Ca(OH)2→ Ca3(PO4)2 + H2O
- poiché compare il gruppo PO3-4 lo bilanciamo ponendo il coefficiente 2 davanti alla formula dell’acido.
2H3PO4 + 3Ca(OH)2→ Ca3(PO4)2 + H2O
- sistemiamo gli atomi di idrogeno, che a sinistra sono 12 in totale, introducendo il coefficiente 6 davanti alla formula dell’acqua.
2H3PO4 + 3Ca(OH)2→ Ca3(PO4)2 + 6H2O
così facendo risultano bilanciati anche gli atomi di ossigeno non contenuti nei gruppi PO3-4: infatti 6 sia a destra che a sinistra della freccia.
RICORDA CHE:
- Bisogna bilanciare per prima i Metalli e poi i NON metalli.
- Se nello schema appaiono nei reagenti e nei prodotti gruppi poliatomici, bilanciarli come gruppo di atomi.
- Bilanciare per ultimi gli atomi di Idrogeno e Ossigeno se presenti.
CALCOLI STECHIOMETRICI
Sono i calcoli relativi ai rapporti di reazione e si impostano sempre a partire dall’equazione di reazione che rappresenta la trasformazione chimica.
I coefficienti di reazione presenti nell’equazione chimica indiacano i rapporti secondo cui si combinano i reagenti e si formano i prodotti.
Infatti: i coefficienti di una reazione bilanciata indicano sia il numero di molecole delle sostanze coinvolte, sia il loro numero di moli.
Come calcolare:
- scrivere l’equazione di reazione del processo.
- determinare le masse molari delle sostanze coinvolte.
- calcolare il numero di moli dei reagenti e/o prodotti richiesti.
- calcolare la massa dei prodotti e/o dei reagenti richiesti.
REAGENTE LIMITANTE E REAGENTE IN ECCESSO
Consideriamo:
O2 + 2H2→ 2H2O
Essa ci informa che, per trasformare 1 mol di O2 in acqua sono necessarie 2 mol di H2; il rapporto tra ossigeno e idrogeno, quindi deve essere di 1 : 2. Se mettiamo a reagire 1 mol di O2 con 3 mol di H2 si ha un rapporto 1 : 3 (diverso da quello previsto nell’equazione di reazione), soltanto due di esse possono trasformarsi mentre una rimane inalterata. In tal caso, la quantità di idrogeno utilizzata risulta in eccesso rispetto alla quantità di ossigeno che è in difetto o reagente limitante.
Il reagente limitante è il reagente che si esaurisce per primo durante una reazione chimica e che limita la quantità di prodotto da essa ottenibile.
Il reagente in difetto: se il numero di moli dei reagenti da trasformare non rispetta il rapporto di reazione , si ha sempre un reagente di difetto, la cui quantità limita la quantità di prodotto che si forma dalla reazione.
LA RESA DI REAZIONE
La resa teorica di un prodotto è la quantità massima di quel prodotto che può essere ottenuta da una certa massa di reagente in base alla stechiometria della reazione.
Conoscendo la resa teorica e quella effettiva, possiamo calcolare la resa percentuale (RP).
La resa percentuale (RP) di un prodotto è il rapporto, espresso in forma percentuale, tra la quantità di prodotto effettivamente ottenuta (resa effettiva RE) e quella massima ottenibile (Resa teorica RT).
La resa percentuale può essere pertanto espressa nel seguente modo:
RP = RE / RT ∙ 100
Quando la trasformazione è incompleta o è accompagnata da reazioni secondarie, la resa percentuale è sempre inferiore al 100%
Fonte: http://soluzztutto2d.altervista.org/alterpages/files/reazionichimiche_chimica.doc
Sito web: http://soluzztutto2d.altervista.org/
Autore del testo: non indicato nel documento di origine
Parola chiave google : Reazioni chimiche tipo file : doc
LE REAZIONI CHIMICHE
Il meccanismo delle reazioni
In natura, ma anche nel mondo delle attività umane, si verificano di continuo tantissime trasformazioni chimiche, dette anche reazioni, consistenti in fenomeni durante i quali le sostanze in gioco cambiano la loro natura, variando le loro proprietà caratteristiche. Le reazioni chimiche sono rappresentate con delle equazioni contenenti, al posto dei numeri, le formule delle sostanze. Ad esempio la sintesi dell’acqua viene schematizzata dalla seguente equazione: 2H2 + O2 ⇆2H2O. Le sostanze alla sinistra della freccia (H2 e O2 in questo caso) sono quelle che si hanno all'inizio della trasformazione e si chiamano reagenti; viceversa quelle a destra della freccia (H2O nell'esempio) rappresentano ciò che si ottiene dalla reazione e sono chiamate prodotti. La legge di Lavoisier, o della conservazione della massa, ci dice inoltre che durante una reazione la massa totale dei reagenti deve essere uguale alla massa totale dei prodotti; dunque nelle reazioni la materia non si crea, né si distrugge, ma solo si trasforma. Come sappiamo, questo fatto comporta la necessità di bilanciare le equazioni chimiche attraverso i coefficienti, facendo in modo che sia a sinistra, quanto a destra della freccia compaiono lo stesso numero di atomi di ogni elemento.
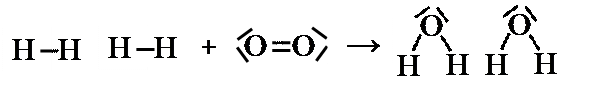 Dovendo interpretare a livello atomico ciò che succede durante una reazione possiamo dire che i legami presenti all'interno dei reagenti si rompono e se ne formano di nuovi nei prodotti di reazione. Durante una reazione quindi gli atomi cambiano il modo con cui sono legati tra loro, originando sostanze del tutto nuove rispetto a quelle di partenza. Nella sintesi dell’acqua, ad esempio, il legami presenti all’interno delle molecole di idrogeno ed ossigeno si rompono, mentre un atomo di ossigeno ne lega a se due di idrogeno, secondo lo schema sotto riportato:
Dovendo interpretare a livello atomico ciò che succede durante una reazione possiamo dire che i legami presenti all'interno dei reagenti si rompono e se ne formano di nuovi nei prodotti di reazione. Durante una reazione quindi gli atomi cambiano il modo con cui sono legati tra loro, originando sostanze del tutto nuove rispetto a quelle di partenza. Nella sintesi dell’acqua, ad esempio, il legami presenti all’interno delle molecole di idrogeno ed ossigeno si rompono, mentre un atomo di ossigeno ne lega a se due di idrogeno, secondo lo schema sotto riportato:
Sappiamo del resto che gli stessi atomi legati in modo diverso, o con differenti proporzioni reciproche, originano sostanze diverse per natura e proprietà. Ad esempio. dal legame tra idrogeno ed ossigeno si può formare l’acqua, ma anche l’acqua ossigenata (H2O2), due composti di formula simile, ma di proprietà assai differenti, così come sono differenti tra loro i due composti che si formano dalla reazione di ossigeno e carbonio: l’anidride carbonica (CO2) è uno dei gas presenti nel ciclo vitale di ogni organismo, mentre il monossido di carbonio (CO) è un gas mortale.
Perché avvengono le reazioni
Con il cambiamento dei legami tra gli atomi coinvolti possiamo dunque spiegare cosa succede durante una reazione chimica, non abbiamo però ancora detto perché una reazione chimica avvenga. Sappiamo che gli atomi, ad eccezione dei gas nobili, non possono esistere allo stato isolato; essi sarebbero infatti instabili e tenderebbero a reagire con altri atomi per raggiungere l'ottetto. Nei composti e negli elementi però, in cui gli atomi non sono più isolati, essi hanno formalmente già raggiunto l'ottetto, tuttavia nelle reazioni chimiche sia composti che gli elementi reagiscono tra di loro per formare nuove sostanze. La regola dell'ottetto può dunque aiutarci a capire perché gli atomi isolati reagiscono tra loro, ma non perché lo facciano gli elementi o i composti.
In natura, comunemente, i sistemi naturali si evolvono spontaneamente verso stati di minore energia e di maggiore stabilità . Se per stabilità intendiamo assenza di cambiamento, in effetti sono tantissimi gli esempi di trasformazioni guidate dal raggiungimento di una situazione più stabile di quella di partenza; il sistema cerca cioè di raggiungere una situazione di equilibrio in cui rimanere il più a lungo possibile. Basti pensare alla caduta degli oggetti, con la quale essi si spostano verso stati di energia minore , che rappresentano però anche stati di maggiore stabilità: un oggetto in bilico spontaneamente cade a terra dove, se nessuno lo va a toccare, si ferma e rimane.
La stabilità chimica delle sostanze è direttamente proporzionale all’energia del legame che tiene uniti gli atomi che le compongono. Nella molecola dell’azoto elementare (N2), ad esempio, i due atomi sono legati da un legame fortissimo e l’azoto elementare è infatti una sostanza inerte, in quanto assai raramente reagisce con altre sostanze. Viceversa, nei combustibili, ed ancora più negli esplosivi, i legami sono deboli; tali sostanze reagiscono infatti molto facilmente, come avviene ad esempio per la nitroglicerina, la cui reazione esplosiva viene innescata anche solo da un urto della sostanza. Dunque le reazioni che avvengono spontaneamente sono di solito quelle in cui si passa da legami più deboli, nei reagenti, a legami più forti, nei prodotti. In tali reazioni si passa inoltre da una situazione di stabilità minore ad un'altra di stabilità maggiore. Queste reazioni producono anche dell'energia, che è data dalla differenza tra l'energia di legame nei prodotti, meno l'energia di legame dei reagenti, in ossequio al I° principio della termodinamica. Ciò avviene esattamente come nel caso di un oggetto posto in alto che libera energia mentre cade, ovvero mentre passa da uno stato gravitazionalmente più instabile, ad un altro più stabile. Per tale motivo queste reazioni sono dette esoergoniche e come esempio tipico possiamo prendere tutte le reazioni di combustione.
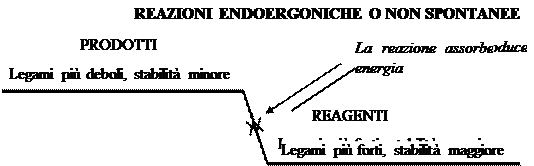 Viceversa le reazioni che vanno nella direzione opposto, ovvero da composti più stabili (perché con legami più forti) a composti meno stabili (perché con legami più deboli), non avvengono spontaneamente, ma richiedono un intervento esterno. Richiedono cioè che sia fornita loro dell'energia pari alla differenza tra l'energia di legame dei prodotti e quella dei reagenti; dette reazioni si dicono per questo endoergoniche. Come esempi in questo caso possiamo prendere la fotosintesi clorofilliana, ma anche l’elettrolisi dell’acqua, la reazione inversa alla sintesi dell’acqua stessa, durante la quale, impiegando energia elettrica, riusciamo a scindere l’acqua in ossigeno ed idrogeno secondo la reazione: 2H2O⇆2H2 + O2. Le reazioni endoergoniche possono quindi essere paragonate allo spostamento, con spesa di energia, di un oggetto da un punto gravitazionalmente più basso e più stabile, ad esempio il pavimento, verso uno più alto e meno stabile, ad esempio uno scaffale.
Viceversa le reazioni che vanno nella direzione opposto, ovvero da composti più stabili (perché con legami più forti) a composti meno stabili (perché con legami più deboli), non avvengono spontaneamente, ma richiedono un intervento esterno. Richiedono cioè che sia fornita loro dell'energia pari alla differenza tra l'energia di legame dei prodotti e quella dei reagenti; dette reazioni si dicono per questo endoergoniche. Come esempi in questo caso possiamo prendere la fotosintesi clorofilliana, ma anche l’elettrolisi dell’acqua, la reazione inversa alla sintesi dell’acqua stessa, durante la quale, impiegando energia elettrica, riusciamo a scindere l’acqua in ossigeno ed idrogeno secondo la reazione: 2H2O⇆2H2 + O2. Le reazioni endoergoniche possono quindi essere paragonate allo spostamento, con spesa di energia, di un oggetto da un punto gravitazionalmente più basso e più stabile, ad esempio il pavimento, verso uno più alto e meno stabile, ad esempio uno scaffale.
Tuttavia in natura esistono anche alcune trasformazioni spontanee che sono però endoergoniche, ne sono esempi l’evaporazione dell’acqua, o dell’alcol, e la fusione del ghiaccio. L’acqua evapora spontaneamente a qualsiasi temperatura superiore a 0°C ; in tale processo assorbe però energia dai corpi con cui è in contatto, come possiamo facilmente osservare quando usciamo bagnati da una piscina. Anche il ghiaccio fonde spontaneamente; anch’esso però passando di stato assorbe calore, raffreddando ciò che lo circonda. Altro esempio di trasformazione endoergonica spontanea e la solubilizzazione in acqua di alcuni soluti solidi, come ad esempio il nitrato di ammonio (NH4NO3), che sciogliendosi raffreddano il liquido, come avviene nelle confezioni di ghiaccio istantaneo per pronto soccorso. In questi casi il sistema non evolve verso stati di energia minore, perché l’energia assorbita dall’esterno resta immagazzinata nei prodotti finali della trasformazione. La tendenza che guida tali trasformazioni è quella verso l’aumento del disordine, ovvero dell’entropia. I sistemi naturali infatti evolvono spontaneamente sia verso la massima stabilità (e la minima energia), che verso il massimo disordine (e la massima entropia).
Per valutare la variazione di entropia di un sistema possiamo seguire i seguenti semplici principi:
- Nel passaggio da solido a liquido e da liquido a gas l’entropia aumenta, andando nella direzione opposta l’entropia invece diminuisce, semplicemente perché lo stato liquido è più disordinato di quello solido e lo stato gassoso è più disordinato di quello liquido. Nello stesso senso aumenta infatti il numero delle possibili configurazioni del sistema: una sola per il solido, molte per il liquido, ancora di più per il gas.
- Nella dissoluzione di un solido in un liquido l’entropia aumenta, perché la soluzione è più disordinata dello stato iniziale, formato dal solido e dal liquido separati. Nella dissoluzione di un gas in un liquido l’entropia viceversa diminuisce, perché il sistema finale, formato da una soluzione liquida, è più ordinato di quello iniziale formato da un liquido e da un gas.
- Nelle reazioni chimiche in cui sono coinvolti i gas se il numero delle molecole di gas aumenta durante la reazione, anche l’entropia aumenta, viceversa se il numero di molecole gassose diminuisce, anche l’entropia diminuisce. Quindi nella reazione N2(g)+3H2(g) ⇆2NH3(g) l’entropia diminuisce, mentre nella reazione CaCO3(s) ⇆CaO(s) + CO2(g) l’entropia aumenta.
Riepilogando possiamo quindi dire che per valutare la spontaneità di una trasformazione dobbiamo prendere in considerazione tanto il contributo ergonico, quanto quello entropico, cosa che può essere fatta seguendo il semplice schema seguente:
- Se la trasformazione conduce sia ad una diminuzione dell’energia (reazione esoergonica), che ad un aumento dell’entropia, essa sarà sempre spontanea a qualunque temperatura.
- Se viceversa la trasformazione conduce sia ad un aumento dell’energia (reazione endoergonica), che ad una diminuzione dell’entropia, essa non sarà mai spontanea a qualunque temperatura.
- Se invece la trasformazione conduce ad una diminuzione dell’energia (reazione esoergonica), ma anche ad una diminuzione dell’entropia, essa sarà spontanea solo a bassa temperatura. Una reazione di questo tipo è ad esempio N2(g) + 3H2(g) ⇆2NH3(g)
- Se infine la trasformazione conduce sia ad un aumento dell’energia (reazione endoergonica), che ad un aumento dell’entropia, essa sarà spontanea solo ad alta temperatura. Una reazione di questo tipo è invece CaCO3(s) ⇆CaO(s) + CO2(g)
Cinetica chimica
La cinetica chimica è quella parte della chimica che studia la velocità delle reazioni. Quest’ultima può variare di molto da reazione a reazione: le esplosioni sono ad esempio reazioni di combustione velocissime, mentre la formazione della ruggine, causata dalla reazione tra il ferro e l’aria, è invece un processo lento. Determinare se una reazione avviene velocemente o lentamente è una cosa molto importante per i chimici; molte reazioni infatti, anche se sono spontanee, cioè avvengono senza necessità di fornire energia al sistema, si verificano così lentamente per cui di fatto è come se non avvenissero. I composti del carbonio, ad esempio, bruciano spontaneamente, si combinano cioè spontaneamente con l'ossigeno dell'aria, sviluppando molto calore (la reazione infatti è esoergonica); ma se noi non forniamo all'inizio un po' di energia, ad esempio con un fiammifero, il carbone o la carta non bruciano affatto. Carbone e carta possono infatti rimanere per anni a contatto con l'ossigeno senza reagire in modo apprezzabile con esso. In verità l’ingiallimento della carta è dovuto ad un processo di ossidazione, cioè di combinazione con l’ossigeno e quindi di combustione, ma la lentezza con cui si verifica lo fa apparire un fenomeno del tutto diverso dalla combustione. D'altra parte sappiamo che, quando vogliamo far bruciare della legna in un camino, dobbiamo iniziare il falò con dei pezzi piccoli, perché bruciano più facilmente e più velocemente di quelli grossi. Come altro esempio immaginiamo di voler sintetizzare una determinata sostanza attraverso una certa reazione ed immaginiamo di voler realizzare questo processo industrialmente, ovvero di voler sfruttare nell'industria chimica la reazione di cui stiamo trattando. Si può comprendere come sia importante, per i tecnici dell'industria, sapere se questa reazione avviene velocemente oppure lentamente e magari studiare dei metodi per accelerarla.
Si comprende così l’importanza di conoscere non solo la spontaneità o meno di una reazione, ma anche la sua velocità. Basti ricordare che le reazioni chimiche vengono sfruttate in quasi tutte le forme di produzione dell'energia, nell'industria chimica, che produce la maggior parte delle sostanze che utilizziamo nella vita di ogni giorno, ma anche nelle attività biologiche di tutti gli esseri viventi.
La velocità delle reazioni
In generale possiamo definire la velocità come la variazione di una grandezza, diviso il tempo in cui tale variazione si realizza. La velocità di un mezzo di trasporto, ad esempio, è data dalla variazione della sua posizione diviso il tempo in cui tale variazione si verifica, mentre la velocità di crescita di un organismo è rappresentata dalla variazione delle sue dimensioni, fratto il tempo in cui tale variazione si realizza.
Nel corso di una reazione chimica i reagenti si trasformano in prodotti; la quantità dei primi quindi diminuisce, mentre quella dei secondi aumenta e proprio queste sono le variazioni prese in esame per misurarne la velocità. Dire ad esempio che la velocità della reazione C + O2 ⇆ CO2 è di 5 moli al minuto, vuol dire che in un minuto si consumano 5 moli di C e di O2 e si formano 5 moli di CO2.
La velocità di una reazione chimica indica il numero delle moli di reagente consumato, oppure il numero delle moli di prodotto formato, nell'unità di tempo.
La teoria degli urti
Come sappiamo, gli atomi si legano attraverso le loro superfici esterne, attraverso le quali, bene o male, debbono entrare in contatto. Perché si formi un legame tra i reagenti, e dunque perché avvenga una reazione, è necessario che i reagenti stessi si urtino. La teoria degli urti è alla base del meccanismo ipotizzato a livello atomico per spiegare come avvengano le reazioni. Tenendo presente tale meccanismo cercheremo ora di elencare i vari fattori che influiscono sulla velocità delle reazioni.
Fattori che influiscono sulla velocità delle reazioni
La concentrazione dei reagenti: in un autoscontro il numero degli urti aumenta all’aumentare del numero delle auto presenti in pista, così come in autostrada il rischio di incidenti è tanto maggiore quanto più intenso è il traffico. Allo stesso modo nel recipiente in cui avviene una reazione il numero degli urti tra le molecole dei reagenti cresce all'aumentare del numero di particelle presenti per unità di volume, cioè all'aumentare della concentrazione dei reagenti stessi.
Prendendo ancora ad esempio la reazione C + O2⇆CO2 , se chiamiamo K il fattore di proporzionalità, possiamo dire che V=K[C][O2], ricordando che quando inseriamo una specie chimica tra parentesi quadre vogliamo indicare la sua concentrazione molare, cioè il numero di moli per litro di volume. Se consideriamo invece la reazione 2H2 + O2 ⇆2H2O, in cui l’idrogeno ha coefficiente stechiometrico due, abbiamo che V=K[H2] [H2] [O2], cioè V=K[H2]2 [O2].
Possiamo quindi dire che la velocità delle reazioni è direttamente proporzionale al prodotto delle concentrazioni molari dei reagenti, ognuna elevata al corrispondente coefficiente stechiometrico.
Poiché nel corso della reazione le concentrazioni dei reagenti diminuiscono, nel tempo diminuirà anche la velocità della reazione stessa. Possiamo quindi dire che la velocità delle reazioni chimiche diminuisce nel tempo.
La geometria delle molecole dei reagenti: perché due sostanze reagiscano non basta che le loro molecole si urtino, ma è anche necessario che lo facciano nel modo giusto. Se ad esempio deve formarsi un legame covalente tra determinati atomi di due molecole, essendo quello covalente un legame direzionale, è necessario che l’urto coinvolga proprio quegli orbitali che fondendosi danno luogo al legame stesso. Solo gli urti di quest’ultimo tipo, che si dicono pertanto urti efficaci, daranno luogo al legame, e quindi alla reazione, mentre se le molecole si urtano nel modo sbagliato la reazione non ha luogo.
![]() Per esemplificare questo concetto prendiamo in esame la reazione tra l’anidride carbonica e l’acqua per la formazione dell’acido carbonico C O2 + H2O ⇆H2CO3. Perché la reazione avvenga effettivamente è necessario che l’ossigeno dell’acqua si inserisca esattamente sull’atomo di carbonio, altrimenti la reazione non ha luogo.
Per esemplificare questo concetto prendiamo in esame la reazione tra l’anidride carbonica e l’acqua per la formazione dell’acido carbonico C O2 + H2O ⇆H2CO3. Perché la reazione avvenga effettivamente è necessario che l’ossigeno dell’acqua si inserisca esattamente sull’atomo di carbonio, altrimenti la reazione non ha luogo.
Anche la geometria delle molecole influisce quindi sulla velocità delle reazioni, in quanto il numero degli urti efficaci si riduce quanto più la molecola è complessa. Possiamo pertanto concludere che la velocità delle reazioni diminuisce all’aumentare delle dimensioni e della complessità delle molecole di interesse.
La suddivisione dei reagenti: tutti sappiamo che per avviare un fuoco dobbiamo utilizzare pezzi di legna piccoli, mentre per aggiungere i pezzi più grossi dobbiamo attendere che il fuoco abbia preso bene. Non tutti sanno viceversa che anche il ferro brucia, solo che per osservare tale combustione dobbiamo utilizzare filamenti di ferro molto sottili, tipo quelli utilizzati nella lana di ferro. Alla base di questi fenomeni sta il fatto che gli urti tra le molecole dei reagenti avvengono solo alla superficie di questi ultimi, per cui, nei corpi solidi, solo la superficie è realmente interessata dalla reazione. Se infatti togliamo dal fuoco un pezzo di legno, e lo spegniamo, possiamo osservare che la sua parte più interna non è stata bruciata. Tanto maggiore è dunque la superficie esposta alla reazione e tanto maggiore sarà la velocità di quest’ultima. Il metodo migliore per aumentare la superficie di reazione è proprio quello di suddividere i reagenti, ad esempio polverizzandoli, come si fa col carbone che deve essere bruciato nelle centrali elettriche.
Tuttavia anche un granello di sostanza è sempre formato da centinaia di migliaia o da milioni di atomi (le dimensioni dell’atomo sono infatti dell’ordine dei decimilionesimi di millimetro); se dunque riuscissimo a frammentare ulteriormente i reagenti fino a livello atomico o molecolare accelereremmo ulteriormente le reazioni. L’unico sistema per suddividere le sostanze fino a tale livello è quello, se possibile, di scioglierle in una soluzione. La solubilizzazione infatti è una reazione fisica, nella quale soluto e solvente si mescolano a livello delle loro particelle costituenti ed in effetti le reazioni in soluzione sono molto veloci. E’ proprio questo il motivo per cui gli esseri viventi sono costituiti in abbondanza di acqua, che, come sappiamo, è un ottimo solvente. Viceversa volendo rallentare delle reazioni che normalmente avvengono in acqua è possibile disidratare le sostanze. Questo avviene ad esempio per la conservazione degli alimenti in polvere oppure sotto sale, in cui la parziale o totale disidratazione rallenta enormemente le reazioni di decomposizione.
In conclusione possiamo dire che la velocità delle reazioni aumenta all'aumentare della suddivisione dei reagenti.
L’energia di attivazione: già sappiamo che la reazione C + O2⇆CO2 è spontanea ed esotermica; sappiamo però che qualsiasi combustibile non brucia se non iniziamo il processo con un fiammifero, un scintilla o del calore. Questo è dovuto al fatto che nella fase iniziale della reazione dobbiamo rompere i legami tra gli atomi dei reagenti, in modo tale che possano poi legarsi in modo diverso per formare i prodotti: gli atomi isolati infatti sono molto più reattivi di quelli legati. Anche per far avvenire molte reazioni spontanee quindi è necessario fornire inizialmente dell'energia ai reagenti, sotto forma di una fiamma, una scintilla, di calore, o di altri tipi ancora.
Si definisce energia di attivazione di una reazione la quantità minima di energia che i reagenti debbono avere (o ricevere) perché la reazione possa avvenire. Se la reazione è poi esoergonica, ovvero produce energia, una volta iniziato il processo, l'energia che da esso si libera fornisce l'energia necessaria per attivare le successive reazioni tra le particelle. Ovviamente l'energia spesa all'inizio per avviare il processo è molto minore di quella che otteniamo dallo sviluppo successivo della reazione.
 Possiamo anche dire che per passare dallo stato iniziale a quello finale, contraddistinto da un livello di stabilità maggiore, si deve superare un dosso energetico, corrispondente ad uno stadio intermedio nel quale gli atomi dei reagenti sono liberi da ogni legame; l'energia di attivazione è appunto quella richiesta per superare tale dosso. Come esempio consideriamo nuovamente la reazione 2H2 + O2 ⇆2H2O, nel cui stadio intermedio si hanno 4 atomi di idrogeno e 2 di ossigeno privi di ogni legame. Se non si fornisce ai reagenti l’energia necessaria per arrivare a questo stadio intermedio la reazione non avrà luogo.
Possiamo anche dire che per passare dallo stato iniziale a quello finale, contraddistinto da un livello di stabilità maggiore, si deve superare un dosso energetico, corrispondente ad uno stadio intermedio nel quale gli atomi dei reagenti sono liberi da ogni legame; l'energia di attivazione è appunto quella richiesta per superare tale dosso. Come esempio consideriamo nuovamente la reazione 2H2 + O2 ⇆2H2O, nel cui stadio intermedio si hanno 4 atomi di idrogeno e 2 di ossigeno privi di ogni legame. Se non si fornisce ai reagenti l’energia necessaria per arrivare a questo stadio intermedio la reazione non avrà luogo.
La presenza di questo meccanismo è molto utile: infatti se non esistesse energia di attivazione tutte le reazioni spontanee avverrebbero liberamente, senza controllo alcuno; il legno brucerebbe mano a mano che si forma ed anche gli esseri viventi, essendo formati da materia combustibile, non potrebbero esistere. L'energia di attivazione fornisce dunque un meccanismo di controllo delle reazioni, una specie di interruttore che consente di stabilire se e quando farle avvenire.
La temperatura: come sappiamo, all’aumentare della temperatura di una sostanza aumenta l'energia cinetica delle sue particelle, aumenta quindi il numero degli urti che si verificano tra di esse ed aumenta anche l’energia con cui avviene ogni singolo urto. Del resto, ritornando all’esempio dell’autoscontro, aumentando la velocità delle macchine in pista aumenta la frequenza e la violenza degli urti. Al crescere del numero e dell’energia degli urti cresce anche il numero degli urti efficaci e pertanto cresce anche la velocità delle reazioni; generalmente la velocità di reazione raddoppia per ogni aumento di 10°C della temperatura. Possiamo quindi concludere che la velocità delle reazioni aumenta all’aumentare delle temperatura.
Riassumendo quanto abbiamo detto finora una reazione chimica avviene spontaneamente se:
- Si ha un aumento di stabilità e/o di entropia;
- Le particelle si urtano nel modo giusto e con energia adeguata;
- Viene fornita l’energia di attivazione.
Per quanto riguarda l’aspetto cinetico possiamo concludere che:
la velocità delle reazioni diminuisce nel tempo ed aumenta all’aumentare della temperatura, della concentrazione e della suddivisione dei reagenti.
I catalizzatori
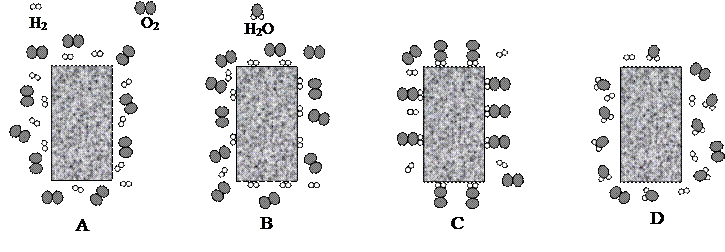 Per accelerare una reazione chimica non sempre è possibile scaldare i reagenti, suddividerli oppure averli in elevate concentrazioni. Tuttavia se si riesce ad abbassare l’energia di attivazione e ad avvicinare tra loro i reagenti in modo che entrino in contatto le zone che effettivamente reagiscono, la velocità della reazione aumenta ugualmente, senza che si realizzino le condizioni sopra indicate. Consideriamo nuovamente la reazione tra ossigeno ed idrogeno, che, come abbiamo visto, necessita per svilupparsi della fornitura dell’energia di attivazione. Se mettiamo in un recipiente molecole di H2 e O2, fino a che non accendiamo un fiammifero queste rimangono insieme senza reagire per un tempo indefinito. Se però introduciamo nel recipiente una spugna di platino, la reazione comincia ad avvenire, a freddo, ed a una certa velocità, senza che il platino si consumi. Il platino infatti attira alla sua superficie le molecole di H2, per cui in tale zona abbiamo un’alta concentrazione di idrogeno. La rapidità con cui l’idrogeno si concentra gli fa inoltre aumentare la temperatura, come se si comprimesse; l’energia termica così sviluppata serve per rompere i legami all’interno della molecola, formando idrogeno atomico. Le molecole di ossigeno che urtano contro la spugna vi trovano un’elevata concentrazione di atomi di idrogeno, con cui reagiscono per formare molecole di acqua. In tale trasformazione il platino non viene consumato, in quanto di fatto non partecipa alla reazione stessa.
Per accelerare una reazione chimica non sempre è possibile scaldare i reagenti, suddividerli oppure averli in elevate concentrazioni. Tuttavia se si riesce ad abbassare l’energia di attivazione e ad avvicinare tra loro i reagenti in modo che entrino in contatto le zone che effettivamente reagiscono, la velocità della reazione aumenta ugualmente, senza che si realizzino le condizioni sopra indicate. Consideriamo nuovamente la reazione tra ossigeno ed idrogeno, che, come abbiamo visto, necessita per svilupparsi della fornitura dell’energia di attivazione. Se mettiamo in un recipiente molecole di H2 e O2, fino a che non accendiamo un fiammifero queste rimangono insieme senza reagire per un tempo indefinito. Se però introduciamo nel recipiente una spugna di platino, la reazione comincia ad avvenire, a freddo, ed a una certa velocità, senza che il platino si consumi. Il platino infatti attira alla sua superficie le molecole di H2, per cui in tale zona abbiamo un’alta concentrazione di idrogeno. La rapidità con cui l’idrogeno si concentra gli fa inoltre aumentare la temperatura, come se si comprimesse; l’energia termica così sviluppata serve per rompere i legami all’interno della molecola, formando idrogeno atomico. Le molecole di ossigeno che urtano contro la spugna vi trovano un’elevata concentrazione di atomi di idrogeno, con cui reagiscono per formare molecole di acqua. In tale trasformazione il platino non viene consumato, in quanto di fatto non partecipa alla reazione stessa.
Questo è un esempio di catalisi, in cui il platino svolge il ruolo di catalizzatore, cioè di sostanza che accelera una reazione chimica senza parteciparvi e quindi senza essere consumato. In presenza di un catalizzatore una reazione avviene dunque ad una temperatura più bassa e più velocemente, per cui tali sostanze hanno un larghissimo impiego. Esistono catalizzatori che catalizzano diverse reazioni ed altri che sono invece specifici per una sola reazione; viceversa vi sono reazioni che possono essere catalizzate da diversi catalizzatori ed altre che invece ne richiedono uno specifico. Di particolare importanza per gli esseri viventi sono gli enzimi, i catalizzatori biologici. Essi sono costituiti da proteine e sono molto specifici, nel senso che generalmente catalizzano una reazione soltanto.
La reversibilità delle reazioni chimiche
Se mettiamo in un recipiente aperto del carbonato di calcio (CaCO3) e scaldiamo a diverse centinaia di gradi di temperatura il carbonato si decompone secondo la reazione: CaCO3⇆CaO + CO2 (1). Se si mantiene aperto il recipiente e si continua a fornire calore per il tempo necessario tutto il carbonato si decompone fino ad esaurirsi. Tale reazione viene utilizzata industrialmente per la produzione della calce (CaO), un prodotto largamente utilizzato nell’edilizia, utilizzando le rocce calcaree quale fonte di CaCO3.
Viceversa se mettiamo in un recipiente chiuso, ed a bassa temperatura, del CaO cui aggiungiamo CO2 ad alta pressione, le due sostanze reagiscono tra loro formando carbonato di calcio secondo la reazione: CaO + CO2 ⇆CaCO3 (2), che è esattamente l’opposto della decomposizione termica del carbonato. Le due reazioni sono quindi l’una l’inverso dell’altra; ambedue sono possibili ed infatti, al variare delle condizioni sperimentali, è possibile sia decomporre il carbonato che riformarlo: reazioni di questo tipo si dicono pertanto reversibili. Il fenomeno della reversibilità si rappresenta collegando reagenti e prodotti di ambo le reazioni con una doppia freccia, secondo la notazione seguente: CaCO3 ⇆CaO + CO2 (3).
L’equilibrio chimico
Se ora mettiamo del CaCO3 in un recipiente chiuso, e scaldiamo ad una temperatura opportuna, questo inizia a decomporsi producendo CaO e CO2, secondo la reazione (1). Mano a mano però che tali prodotti si formano iniziano a reagire tra loro per riformare carbonato di calcio, secondo la reazione (2): le due reazioni opposte avvengono cioè contemporaneamente, nello stesso recipiente. Cerchiamo di calcolare la velocità delle due reazioni, utilizzando la formula di pagina 4, relativa alla concentrazione dei reagenti. Per la (1) possiamo scrivere che V1 = K1 [CaCO3], mentre per la (2) possiamo scrivere che V2 = K2 [CaO] [CO2]. La (1) quindi decresce nel tempo, mano a mano che la concentrazione del carbonato diminuisce; nello stesso tempo però, via via che si formano l’ossido di calcio e l’anidride carbonica, la velocità della (2) aumenta, riformano CaCO3. Il sistema raggiunge un equilibrio quando le velocità delle due reazioni si eguagliano. Una simile condizione si dice di equilibrio dinamico, nel senso che le reazioni non si arrestano: entrambe continuano ad avvenire, ma essendo le loro velocità uguali, la quantità di CaCO3 che si decompone per la (1) è uguale alla quantità che si forma per la (2); a questo punto dentro il recipiente di reazione le concentrazioni di tutte le sostanze non variano più. Il sistema ha raggiunto quindi una condizione stabile, dunque di equilibrio, dove i valori delle singole concentrazioni dipendono dalla temperatura.
Una situazione analoga si ha in un recipiente chiuso in cui una parte del volume sia occupata da un liquido, acqua ad esempio. Scaldando il sistema l’acqua inizia ad evaporare ed il vapore, mano a mano, va ad occupare lo spazio sovrastante il liquido in quantità via via crescenti. Nello stesso tempo però, una parte delle molecole di vapore urteranno la superficie del liquido e ritorneranno ad esso, ricondensando. Ad una certo momento si raggiunge una condizione di equilibrio dinamico in cui il numero delle molecole che evaporano è uguale a quello delle molecole che condensano e le due fasi presenti non varieranno più le loro proporzioni reciproche. Anche in questo caso il quantitativo di vapore formato e quello di liquido residuo dipendono dalla temperatura.
L’equilibrio chimico può anche essere paragonato ad un sistema di vasi comunicanti come quelli rappresentati qui sotto. Se mettiamo acqua nel recipiente A (vedi figura 1), ed apriamo il tubo di comunicazione, il liquido inizia ad affluire verso B molto velocemente, perché vi è una notevole differenza di livello. Via via che il dislivello diminuisce (vedi figura 2) la velocità di deflusso cala progressivamente, fino ad annullarsi quando nei due recipienti il livello del liquido è lo stesso (vedi figura 3). A questo punto il sistema ha raggiunto una condizione di equilibrio nella quale il livello nei due recipienti rimane costante nel tempo. Il raggiungimento dell’equilibrio non vuole però dire che il movimento delle particelle di acqua tra i due recipienti si sia arrestato; esso infatti continua, ma il numero di particelle transitano da A verso B è uguale a quello delle particelle che transitano nel senso opposto. La medesima condizione finale di equilibrio si realizzerebbe se mettessimo la quantità  di acqua iniziale nel recipiente B anziché in A.
di acqua iniziale nel recipiente B anziché in A.
La legge di azione delle masse
Come abbiamo visto, all’equilibrio la velocità della reazione diretta è uguale a quella della reazione inversa; in tale situazione le concentrazioni di tutte le sostanze presenti restano costanti a temperatura costante. Consideriamo nuovamente le reazioni (1) e (2); all’equilibrio abbiamo che V1 = V2 ovvero che K1 [CaCO3] = K2 [CaO] [CO2]. Ridistribuendo matematicamente i fattori tra i due membri dell’equazione otteniamo che:
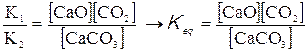
Keq è una nuova costante, definita come costante di equilibrio della reazione, il suo valore è caratteristico per ogni reazione e dipende unicamente dalla temperatura a cui la reazione medesima avviene.
La Keq è indipendente dal cammino seguito per raggiungere l’equilibrio e dalle quantità di sostanze coinvolte. La stechiometria della reazione (1) ci dice, ad esempio, che ogni mole di CaCO3 che si decompone si formano una mole di CaO ed una mole di CO2. Ipotizziamo di avere all’inizio 2 moli di CaCO3, scaldiamo poi il sistema fino ad una certa temperatura ed immaginiamo che si raggiunga una condizione di equilibrio quando una mole di carbonato di calcio si decompone originando 1 mole di CaO ed 1 mole di CO2. All’equilibrio finale abbiamo dunque 1 mole residua di CaCO3 ed 1 mole ciascuno di CaO e di CO2, quantità che utilizzo per il calcolo della costante di equilibrio della reazione a quella data temperatura. Lo stesso risultato finale si sarebbe raggiunto partendo da 2 moli di CaO e 2 moli di CO2 e portando il sistema alla stessa temperatura finale. A quella temperatura infatti 1 mole di CaO reagirebbe con una mole di CO2, originando 1 mole di CaCO3: alla fine avremmo sempre 1 mole di ciascuna delle tre sostanze ed anche la Keq avrebbe quindi il medesimo valore. Partendo da quantità ancora diverse otterremo concentrazioni finali differenti, ma la Keq rimarrebbe la medesima. Indipendentemente dunque dalle condizioni iniziali e dal percorso seguito, una reazione raggiunge ad una data temperatura una condizione di equilibrio caratterizzato da una certa Keq. Pertanto, ad una data temperatura, la Keq di ogni reazione è una proprietà caratteristica della reazione medesima.
 L’espressione a destra della Keq, che coinvolge le concentrazioni delle specie chimiche presenti all’equilibrio, prende il nome di legge di azione delle masse ed è data dal rapporto tra le concentrazioni molari dei prodotti di reazione ed il prodotto delle concentrazioni molari dei reagenti all’equilibrio, ciascuna concentrazione essendo elevata ad una potenza uguale al coefficiente stechiometrico con cui la specie compare nella reazione. Nella legge di azione delle masse compaiono quindi le concentrazioni molari delle sostanze all’equilibrio e non quelle iniziali.
L’espressione a destra della Keq, che coinvolge le concentrazioni delle specie chimiche presenti all’equilibrio, prende il nome di legge di azione delle masse ed è data dal rapporto tra le concentrazioni molari dei prodotti di reazione ed il prodotto delle concentrazioni molari dei reagenti all’equilibrio, ciascuna concentrazione essendo elevata ad una potenza uguale al coefficiente stechiometrico con cui la specie compare nella reazione. Nella legge di azione delle masse compaiono quindi le concentrazioni molari delle sostanze all’equilibrio e non quelle iniziali.
Il valore della Keq di una reazione indica quale sia il valore della concentrazione dei prodotti di reazione rispetto a quella dei reagenti alla fine della reazione. Se il suo valore è molto minore di uno, ad esempio 10-1, 10-2 o inferiore, questo vuol dire che, all’equilibrio, si hanno ancora moltissimi reagenti e pochissimi prodotti: la reazione quindi è avvenuta pochissimo o, come si sul dire, l’equilibrio è molto spostata a sinistra. Se viceversa il valore della Keq è molto maggiore di 1, questo vuol dire che, all’equilibrio, si hanno molti prodotti e pochi reagenti: la reazione è quindi avvenuta molto e l’equilibrio è molto spostato a destra.
Il valore della Keq indica quindi fino a che punto è avvenuta una reazione
Il principio dell’equilibrio mobile o di Le Chatelier – Braun
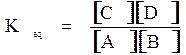 Immaginiamo ora una generica reazione reversibile A+B⇆C+D; sia quindi A+B⇆C+D la reazione diretta (1), mentre C+D ⇆A+B sia la reazione inversa (2). Come sappiamo la velocità della (1) è: V1=[A][B], la velocità della (2) è: V2=[C][D], mentre la costante di equilibrio è
Immaginiamo ora una generica reazione reversibile A+B⇆C+D; sia quindi A+B⇆C+D la reazione diretta (1), mentre C+D ⇆A+B sia la reazione inversa (2). Come sappiamo la velocità della (1) è: V1=[A][B], la velocità della (2) è: V2=[C][D], mentre la costante di equilibrio è
 Proviamo ora a perturbare lo stato di equilibrio per verificare come reagisce il sistema. Proviamo innanzitutto ad aggiungere uno dei reagenti, ad esempio A. Tale aggiunta fa aumentare la velocità della reazione (1), per cui altre molecole di reagente si trasformeranno per dare molecole di prodotti. Mano a mano che ciò avviene V1 diminuisce, mentre, per l’aumentare dei prodotti, cresce la velocità della reazione (2). Ad un certo punto le due velocità si eguagliano di nuovo e si raggiunge un nuovo equilibrio complessivo, più spostato a destra del precedente, in cui sono variate le concentrazioni di tutte le sostanze presenti, anche se la Keq è rimasta immutata. Nello schema soprastante riportiamo un analogo idraulico, in cui immaginiamo che i reagenti siano nel recipiente A, mentre i prodotti siano in B.
Proviamo ora a perturbare lo stato di equilibrio per verificare come reagisce il sistema. Proviamo innanzitutto ad aggiungere uno dei reagenti, ad esempio A. Tale aggiunta fa aumentare la velocità della reazione (1), per cui altre molecole di reagente si trasformeranno per dare molecole di prodotti. Mano a mano che ciò avviene V1 diminuisce, mentre, per l’aumentare dei prodotti, cresce la velocità della reazione (2). Ad un certo punto le due velocità si eguagliano di nuovo e si raggiunge un nuovo equilibrio complessivo, più spostato a destra del precedente, in cui sono variate le concentrazioni di tutte le sostanze presenti, anche se la Keq è rimasta immutata. Nello schema soprastante riportiamo un analogo idraulico, in cui immaginiamo che i reagenti siano nel recipiente A, mentre i prodotti siano in B.
Se viceversa aggiungiamo uno dei prodotti incrementiamo inizialmente la V2, la reazione (2) riparte e spostiamo la reazione complessiva a sinistra (parte dei prodotti si trasformano in reagenti), fino a che non si raggiunge un nuovo equilibrio, con la medesima Keq. Se invece all’equilibrio sottraiamo un prodotto, la V2 diminuisce, per cui la reazione (1) riparte e l’equilibrio si risposta a sinistra. Nella figura sottostante riportiamo un analogo idraulico di quest’ultima situazione.
 Ricapitolando possiamo dire che aggiungendo un reagente, o allontanando un prodotto, le reazioni ripartono e l’equilibrio si sposta a destra; viceversa, aggiungendo un prodotto, o allontanando un reagente, l’equilibrio si sposta a sinistra. Possiamo a questo punto enunciare il Principio di Le Chatelier – Braun,che dice: un sistema chimico all’equilibrio, reagisce alle variazioni effettuate sui suoi componenti cercando di annullarne gli effetti. In pratica il sistema fa l’opposto di quanto facciamo noi, nel tentativo di mantenersi all’equilibrio.
Ricapitolando possiamo dire che aggiungendo un reagente, o allontanando un prodotto, le reazioni ripartono e l’equilibrio si sposta a destra; viceversa, aggiungendo un prodotto, o allontanando un reagente, l’equilibrio si sposta a sinistra. Possiamo a questo punto enunciare il Principio di Le Chatelier – Braun,che dice: un sistema chimico all’equilibrio, reagisce alle variazioni effettuate sui suoi componenti cercando di annullarne gli effetti. In pratica il sistema fa l’opposto di quanto facciamo noi, nel tentativo di mantenersi all’equilibrio.
Possiamo perturbare l’equilibrio anche agendo sulla pressione, qualora tutte le specie chimiche siano allo stato aeriforme ed il numero delle molecole dei reagenti sia diverso da quello dei prodotti.
Prendiamo ad esempio la reazione N2(g)+3H2(g) ⇆2NH3(g), in cui nei reagenti abbiamo 4 molecole, mentre tra i prodotti ne abbiamo solo tre; andando quindi da sinistra verso destra il numero delle molecole diminuisce. Se all’equilibrio aumentiamo la pressione, il sistema reagisce spostando verso destra la reazione, perché diminuendo il numero delle molecole nel recipiente si oppone all’incremento di pressione. Se viceversa diminuiamo la pressione l’equilibrio si sposta verso sinistra.
Nel caso infine di reazioni endotermiche o esotermiche, possiamo modificare l’equilibrio anche fornendo o sottraendo calore.
Consideriamo nuovamente la reazione N2+3H2 ⇆2NH3, che è esotermica. Raffreddando il sistema spostiamo l’equilibrio verso destra, mentre fornendo calore lo spostiamo verso sinistra. In definitiva possiamo affermare che in un sistema chimico all’equilibrio un aumento della temperatura sposta l’equilibrio stesso nel senso della reazione endotermica, mentre una diminuzione di temperatura lo sposta nel senso della reazione esotermica.
In questo contesto spontaneamente vuol dire senza che nessuno dall’esterno del sistema fornisca energia
Fonte: Fonte: http://www.liceodavincifi.it/_Rainbow/Documents/Reazioni%20chimiche.doc
Sito web da visitare: http://www.liceodavincifi.it/
Autore del testo: non indicato nel documento di origine
Parola chiave google : Reazioni chimiche tipo file : doc
Visita la nostra pagina principale
Reazioni chimiche
Termini d' uso e privacy