Chimica elementi del gruppo 16
Chimica elementi del gruppo 16
O, S, Se, Te, Po
Proprietà
Comportamento chimico
Preparazione degli elementi
Principali composti
Principali usi
Abbondanza sulla crosta terrestre
Ossigeno: 46,1%
Zolfo: 0,05%
Se: poco abbondante
Te: molto raro
Po: molto raro (tutti gli isotopi sono radioattivi)
L’ossigeno è l’elemento più diffuso sulla croste terrestre, si trova presente in un numero altissimo di composti (ossidi, idrossidi, ossiacidi, etc.), mentre nell’aria è presente come molecola biatomica, O2 (21 % dell’aria). Lo zolfo, in natura, si trova sotto forma di solfati e di solfuri, tuttavia si può presentare anche allo stato elementare, in grandi giacimenti per lo più in zone vulcaniche; si ritiene che derivi dalla reazione tra anidride solforosa e acido solfidrico, presenti nei gas vulcanici:
 SO2 + H2S 3S + H2O
SO2 + H2S 3S + H2O
Il selenio è presene come impurezza in molti solfuri sotto forma di seleniuri. Tellurio e polonio sono elementi estremamente rari.
Gli elementi di questo gruppo hanno configurazione elettronica esterna: ns2 np4; l’atomo di ossigeno è bivalente (può formare un terzo legame a spese di un suo doppietto), mentre gli altri possono espandere la loro valenza, promuovendo uno o due elettroni sugli orbitali d, a quattro o a sei. Ossigeno e zolfo sono non metalli, selenio e tellurio sono semimetalli (anche se il tellurio è un modesto conduttore) , mentre il polonio ha carattere metallico (buon conduttore); quindi,scendendo lungo il gruppo, come prevedibile, diminuiscono i potenziali di ionizzazione e le elettronegatività.
Il comportamento chimico dell’ossigeno si differenzia notevolmente da quello degli altri componenti il gruppo e questo dipende dalla sua elevata elettronegatività (3,5) e dalla sua alta forza ossidante, seconda solo a quella del fluoro. Ad esempio, tutti gli idruri degli elementi del gruppo, tranne naturalmente l’acqua, sono gassosi, maleodoranti e tossici; inoltre sono acidi in acqua e la loro acidità aumenta da H2S a H2Po. Tutti gli elementi, tranne l’ossigeno, formano un’ampia gamma di alogenuri, la stabilità e la struttura dei quali dipende dal raggio dell’atomo centrale e da quello degli alogeni che lo circondano; lo zolfo forma fluoruri, cloruri e un bromuri, ma non forma ioduri, essendo troppo piccolo per legare gli ingombranti atomi di iodio, cosa che, al contrario, riesce agli atomi più grandi, tellurio e polonio, per i quali sono noti gli ioduri.
I primi due elementi, i più elettronegativi, possono dare gli anioni O2- e S2-, in composti con elementi fortemente metallici (CaO, Na2S, etc.); la loro formazione richiede notevoli quantità di energia, che risulta poi ampiamente ricompensata dagli alti valori di energia reticolare dei cristalli ionici derivanti.
Preparazione degli elementi
L’ossigeno industrialmente viene ottenuto dalla distillazione frazionata dell’aria liquida; in laboratorio si può ottenere per:
- decomposizione termica di ossidi e perossidi:
 2PbO2 (s) 2PbO (s) + O2
2PbO2 (s) 2PbO (s) + O2
 2BaO2 (s) 2BaO (s) + O2
2BaO2 (s) 2BaO (s) + O2
- per decomposizione termica di sali:
 2KNO 3 (s) 2KNO2 (s) + O2
2KNO 3 (s) 2KNO2 (s) + O2
- per elettrolisi dell’acqua.
Lo zolfo per usi industriali viene attualmente ottenuto per fusione dello zolfo, presente in immensi depositi naturali (di origine vulcanica), con vapor d’acqua surriscaldato (160°C) e quindi pompaggio alla superficie con aria compressa (processo Frash):
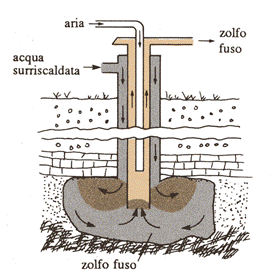
Processo Frasch
Lo zolfo, così ottenuto, viene poi purificato o per sublimazione o per successive cristallizzazione usando solfuro di carbonio, come solvente. In realtà, attualmente, oltre il 50% dello zolfo prodotto, viene dalla raffinazione dei derivati del petrolio, che, contenendo mediamente il 3% di zolfo, devono essere trattati prima di venire usati, ad esempio, per autotrazione o in centrali termiche (la mancata purificazione significherebbe immettere nell’atmosfera grandissime quantità di anidride solforosa, considerando le immense quantità di combustibili usate ogni giorno; il fenomeno finale sarebbe la formazione delle devastanti “piogge acide”, derivanti dalla formazione di acido solforico).
Il selenio viene ottenuto come sottoprodotto della raffinazione elettrolitica del rame o da trattamenti chimici di solfuri seleniferi.
OSSIGENO
L’ossigeno è l’elemento più abbondante della crosta terrestre, e allo stato libero costituisce il 23% della massa dell’atmosfera. E’ un gas incolore, insapore ed inodore, costituito da molecole biatomiche, O2. Pressoché tutto l’ossigeno libero è di origine biologica, derivando, nel corso di miliardi di anni, da alghe e piante attraverso processi di fotosintesi.
Pur contenendo un numero pari di elettroni, O2 ne presenta due spaiati, cosa che lo rende paramagnetico; questa proprietà non è facilmente giustificabile descrivendo la molecola con la teoria del legame di valenza:
. .
:O = O : ↔ : O — O :
queste due strutture d risonanza non rendono conto dell’alta energia di legame (498 kj/mol) e della distanza di legame (0,121 nm) della molecola. Anche in questo caso risulta molto più convincente la teoria degli orbitali molecolari, che calcola un ordine di legame due e propone due orbitali molecolari contenenti ciascuno un solo elettrone (p 2pz* e p 2py*).
Allo stato elementare, l’ossigeno presenta una seconda forma allotropica, l’ozono: O3 . L’ozono gassoso è bluastro, ha un odore pungente, è diamagnetico ed è tossico per le varie forme di vita. E’ un forte ossidante, secondo solo al fluoro. La sua struttura può essere descritta ricorrendo a strutture di risonanza:
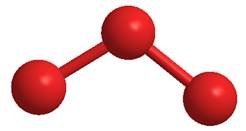
Struttura della molecola di ozono
La struttura osservata è descrivibile attraverso la risonanza delle due seguenti strutture limite:

Nella molecola di ozono l’atomo di ossigeno centrale è ibridatp sp2 .
L’ozono viene prodotto facendo passare scariche elettriche in O2:
scariche elettr.
 O2 2O .
O2 2O .
 O . + O2 O3
O . + O2 O3
L’ozono per le sue energiche capacità ossidanti trova diverse applicazioni industriali e i campo medico.
L’ozono forma nell’alta atmosfera (tra i 15 e i 28 Km) una fascia protettiva che assorbe le radiazioni dell’ultravioletto (lunghezza d’onda: 250-350 nm), che se giungessero sulla terra sarebbero estremamente dannose per gli esseri viventi (tumori della pelle e mutazioni genetiche).
L’ozono, che costituisce la fascia protettiva, deriva dal bilanciamento di due processi competitivi, uno di formazione ed uno di decomposizione:
 O2 + hv 2O .
O2 + hv 2O .
 O . + O2 O3
O . + O2 O3
il processo di formazione è bilanciato dalla continua decomposizione dell’ozono stesso, indotta dall’assorbimento di fotoni energetici:
 O3 + hv O . + O2
O3 + hv O . + O2
Tra queste due reazioni si è stabilito un equilibrio che mantiene costante la concentrazione di ozono nel tempo.
Negli ultimi anni questo equilibrio è stato profondamente alterato dalla presenza nell’alta atmosfera di sostanze chimiche che, attraverso una meccanismo catalitico, sono in grado di decomporre l’O3 .
Tra i principali catalizzatori della decomposizione dell’ozono vi sono l’NO e i fluorocloro carburi, il più diffuso dei quali è il CF2Cl2 (freon-12).
Meccanismi d’azione di NO e di CF2Cl2
L’ossido d’azoto è prodotto nell’atmosfera da scariche elettriche (fulmini), ma anche per combustione nei motori dei jet. In sua presenza inizia un ciclo catalitico di decomposizione di O3:
 O3 + NO NO2 + O2
O3 + NO NO2 + O2
 NO2 + O . NO + O2
NO2 + O . NO + O2
prodotto dalle radiaz. solari
I fluorocloro carburi sono stati diffusamente usati in diverse tecnologie, come liquidi refrigeranti, come propellenti per bombole spray, come fluidi espandenti (produzone polistirene espanso), etc..
Sono chimicamente inerti, ma non nell’alta atmosfera dove, colpiti da radiazioni energetiche, liberano atomi di cloro, i quali, sempre con azione catalitica, decompongono l’ O3:
 CF2Cl2 + hv . CF2Cl + Cl .
CF2Cl2 + hv . CF2Cl + Cl .
 Cl . + O3 ClO + O2
Cl . + O3 ClO + O2
 ClO + O . Cl . + O2
ClO + O . Cl . + O2
I fluorocloro carburi sono stati internazionalmente messi al bando, per questo effetto negativo concentrazione dell’ozono.
Mentre la presenza dell’ozono è necessaria nell’atmosfera, esso è dannoso nella troposfera. Come già detto l’ozono è un forte ossidante, quindi è un agente inquinante per le specie viventi (l’ozono è estremamente dannoso per il sistema respiratorio); la sua concentrazione è particolarmente alta nei centri urbani, dove si forma per azione degli ossidi d’azoto:
perossidi di metalli pesanti
 NO NO2
NO NO2
 NO2 + hv NO + O .
NO2 + hv NO + O .
 O . + O2 O3
O . + O2 O3
Il risultato di questi processi è la presenza di elevate concentrazioni di ozono nelle zone ad alta intensità di traffico.
L’ossigeno reagisce con tutti gli elementi, eccettuati i gas nobili più leggeri (He, Ne, Ar), formando ossidi, che per la loro variabilità presentano un ampio spettro di proprietà: stabili, non stabili, gassosi o solidi, etc. In base al comportamento chimico gli ossidi si dividono in ossidi acidi, nei quali l’ossigeno è legato, con legame covalente, ad un elemento di elevata elettronegatività (ad esempio il cloro), e in ossidi basici, nei quali è legato, con legame ionico, ad elementi elettropositivi (ad esempio il litio); i primi , in soluzione acquosa formano acidi, i secondi formano basi. L’ossigeno, quando è legato ad un elemento di elettronegatività media (ad esempio l’allumunio), forma una terza categoria di ossidi, gli ossidi anfoteri.
Un ossido acido ed un ossido basico possono reagire tra loro per dare un sale:
 CaO + SiO2 CaSiO3
CaO + SiO2 CaSiO3
Tra gli innumerevoli composti dell’ossigeno consideriamo i sui composti binari con l’idrogeno: l’acqua e l’acqua ossigenata.
H2O
L’acqua è certamente la sostanza più importante presente sulla terra; le sue proprietà chimico-fisiche, peculiari ed uniche, derivano dalla natura degli atomo che costituiscono la sua molecola, l’ossigeno, caratterizzato da una elevata elettronegatività e da dimensioni ridotte, e l’idrogeno, che per le ridottissime dimensioni presenta proprietà assolutamente anomale (già descritte).
La sua struttura è angolare, con angolo di legame di 104° 30’, e quindi si deve ipotizzare per l’ossigeno una ibridazione sp3 (l’angolo di legame risulta ridotto rispetto al 109°27’del tetraedro regolare per l’azione delle due coppie di elettroni libere, che tendono a respingere le coppie di legame):

Struttura dell’acqua
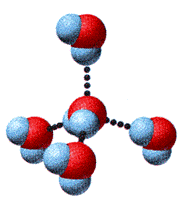
Legami a idrogeno tra molecole di acqua
Analizzando la struttura della molecola si vede che ciascun atomo raggiunge un livello esterno pieno condividendo elettroni in legami covalenti singoli, mentre rimangono due coppie solitarie sull’atomo di ossigeno. La notevole differenza di elettronegatività dei due atomi rende i legami O-H fortemente polarizzati; inoltre si hanno le condizioni affinché si possa realizzare un forte legame a idrogeno trale molecole di acqua; in particolare ciascuna molecola partecipa alla formazione di quattro legami a idrogeno con altre molecole di acqua vicine.
Da queste proprietà atomiche e molecolari deriva un comportamento macroscopico unico e notevole; in particolare l’acqua risulta caratterizzata da:
- un elevato momento dipolare;
- una elevata costante dielettrica;
- alti punti di fusione ed ebollizione;
- grande potere solvente nei confronti di sostanze ioniche e sostanze polari;
- alto calore specifico;
- alta tensione superficiale e alta capillarità;
- densità dello stato solido inferiore alla densità dello stato liquido;
- possibilità di esibire un comportamento anfotero.
Tutte queste proprietà hanno un effetto fondamentale su di un numero incredibile di fenomeni chimico-fisici e biologici che si realizzano sulla Terra; non è possibile sovrastimare l’importanza dell’acqua nell’evoluzione del nostro pianeta e nello sviluppo delle varie forme di vita passate, presenti e future.
Anche dal punto di vista industriale l’acqua gioca un ruolo importantissimo; i suoi usi sono numerosissimi e massicci, fra questi va ricordato l’uso come solvente, come refrigerante, e per la produzione di vapore impiegato come vettore di energia negli impianti industriali.
Acqua ossigenata
L’acqua ossigenata è il più importante dei perossidi; è un liquido incolore, con una elevata densità, viscosità e temperatura di ebollizione (150,2 C°), in virtù dei molti legami idrogeno che si realizzano tra le varie molecole. Nei perossidi, l’ossigeno ha numero di ossidazione -1, intermedio tra quello di O2 (zero) e quello negli ossidi (-2); questo giustifica il fatto che H2O2 dia spontaneamente una reazione di disproporzione:
 H2O2(l) H2O(l) + ½ O2(g)
H2O2(l) H2O(l) + ½ O2(g)
In laboratorio può essere ottenuta acidificando soluzioni acquose di perossidi salini (perossido di bario, ad esempio):
 O22- + 2H3O+ H2O2 + 2H2O
O22- + 2H3O+ H2O2 + 2H2O
Industrialmente l’acqua ossigenata viene ottenuta per riduzione di ossigeno gassoso da parte del 2-etilantrachinolo, a sua volta ottenuto per riduzione del 2-etilantrachinone:
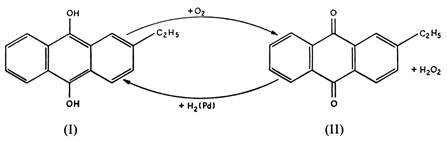
Il 2-etilantrachinolo, in soluzione benzenica, riduce l’ossigeno molecolare a H2O2, ossidandosi a 2-etilantrachinone; quest’ultimo viene poi ridotto, mediante idrogeno e catalizzatore a base di palladio, nuovamene a 2-etilantrachinolo. Questo processo fornisce, mediante estrazione con acqua, soluzioni all’1% di H2O2 ; sono necessarie, quindi, successive distillazioni per portare la concentrazione al valore desiderato (fino al 90%).
La molecola di H2O2, che presenta gli ossigeni con ibridazione sp3, non presenta gli atomi di idrogeno in opposizione, ma assume una forma obliqua, giustificabile considerando le interazioni repulsive tra i legami O-H e le coppie liberi dei due atomi di ossigeno:
a
b
a= 97°; b=94°
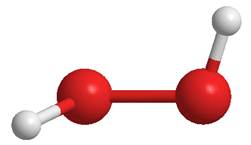
Struttura dell’acqua ossigenata allo stato solido
ZOLFO
Lo zolfo, a temperatura ambiente, si presenta come un solido giallo trasparente (se ben cristallizzato), costituito da molecole ad anello, non planari (a corona), contenenti otto atomi (S8). Lo zolfo può presentare molte forme allotropiche (oltre dieci), la forma termodinamicamente stabile a temperatura ambiente è la forma Sa ortorombica, costituita esclusivamente da molecole cicliche a otto atomi.
Lo zolfo, nei suoi composti, presenta diversi stati di valenza; nello stato fondamentale presenta la bivalenza, avendo due elettroni spaiati su due orbitali 3p:
[Ne] 3s2 3p4
esempi di composti dello zolfo bivalente sono H2S e SCl2 .
Per promozione di uno dei due elettrone dall’orbitale 3p completamene occupato ad un orbitale 3d, lo zolfo raggiunge la tetravalenza:
[Ne] 3s2 3p3 3d1
esempi di composti dello zolfo tetravalente sono SO2, H3SO3 e SF 4 .
Per promozione di un ulteriore elettrone sugli orbitali 3d (dal 3s) lo zolfo raggiunge l’esavalenza:
[Ne] 3s1 3p3 3d2
Esempi di composti dello zolfo esavalente sono SO3, H2SO4 e SF6 .
Composti dello zolfo
Acido solfidrico
L’acido solfidrico, o solfuro di idrogeno, è una specie gassosa, incolore, maleodorante estremamente tossica (forma solfuri insolubili con i metalli degli enzimi). Può essere prodotto per reazione di un solfuro metallico con un acido non ossidante, ad esempio, HCl:
 FeS + HCl FeCl2 + H2S
FeS + HCl FeCl2 + H2S
Questa è la reazione che si sfrutta nel “Kipp” (apparecchiatura usata in laboratorio per produrre H2S)
Molto puro può essere ottenuto per reazione diretta tra idrogeno e zolfo in presenza di catalizzatori a base di Co e Mo:
350°C
 H2 + S H2S
H2 + S H2S
La molecola presenta una struttura angolare con angolo di legame pari a 92,2°, si ipotizza quindi che lo zolfo usi per dare legame gli orbitali 3p puri:
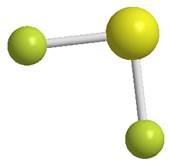
Struttura dell’acido solfidrico
In soluzione acquosa è un acido debole diprotico; per reazione con aria, a 250°C, viene ossidato o a zolfo elementare o a anidride solforosa, in base alla quantità di aria usata.
Ossidi di zolfo
Il diossido di zolfo è una specie gassosa stabile; è uno dei principali inquinanti atmosferici, derivando dalla combustione di carbone o derivati del petrolio, che contengono zolfo in percentuali varianti dallo 0,5 al 4 % ; la sua molecola, che presenta lo zolfo tetravalente, ha struttura angolare con un angolo di legame di circa 120°; questo implica una ibridazione dello zolfo sp2, con l’utilizzo di due orbitali ibridi sp2 per formare i due legami s con gli atomi di ossigeno, mentre il terzo orbitale ibrido (disposto sullo stesso piano) è occupato da una coppia non condivisa di elettroni. I restanti orbitali non ibridati, p e d, dello zolfo formano due legami p con i due atomi di ossigeno:
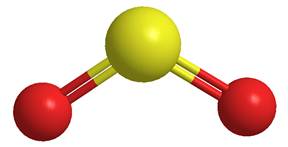
Struttura del diossido di zolfo
Il diossido di zolfo si può preparare laboratorio in per reazione dell’acido solforico con rame:
 Cu + 2 H2SO4 CuSO4 + 2H2O + SO2
Cu + 2 H2SO4 CuSO4 + 2H2O + SO2
Industrialmente viene prodotta per combustione dello zolfo o per arrostimento della pirite.
 S + O2 SO2
S + O2 SO2
 4FeS2 +11O2 2Fe2O3 + 8SO2
4FeS2 +11O2 2Fe2O3 + 8SO2
Disciolta in acqua porta alla formazione di acido solforoso, che è un acido debole diprotico.
La sua reazione più importante è la sua ossidazione a SO3 :
 SO2 + ½ O2 SO3
SO2 + ½ O2 SO3
Il triossido di zolfo allo stato solido si presenta come costituito molecole trimere (S2O9); allo stato gassoso si hanno molecole singole, aventi struttura trigonale piana con l’atomo di zolfo al centro nello stato di esavalenza:
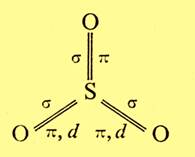
Lo zolfo, che presenta ibridazione sp2, forma tre legami s con i tre orbitali ibridi e tre legami p, utilizzando l’orbitale p e i due orbitali d occupati ciascuno da un elettrone.
I laboratorio può essere ottenuta disidratando acido solforico con anidride fosforica:
 H2SO4 + P2O5 2 HPO3 + SO3
H2SO4 + P2O5 2 HPO3 + SO3
Usi industriali degli elementi del gruppo 16
OSSIGENO
Il 60-70% dell’ossigeno puro viene usato nella produzione dell’acciaio; l’ossigeno, fatto passare attraverso la ghisa fusa, ossida le impurezze presenti (derivati di Si, S, P) e l’eccesso di carbonio (a CO e CO2).
Notevoli quantità di ossigeno vengono usate per il taglio e la saldatura dei metalli (fiamma ossidrica e fiamma ossiacetilenica; temperature raggiungibili, rispettivamente di circa 2800° e 3400° C).
Viene usato nella produzione di acido solforico e acido nitrico (anche se spesso si preferisce la più economica aria).
Viene usato come ossidante nei propulsori di razzi.
L’ozono viene usato per le sue proprietà di forte ossidante in molte applicazioni, quali la sterilizzazione delle acque potabili (circa 1g/m3); l’ozono è un battericida nettamente migliore rispetto al cloro e non lascia alcun odore e sapore, viene usato per sterilizzare in campo rimedico (ad esempio per i ferri chirurgici).
Viene usato per l’ossidazione e rottura di doppi legami di acidi grassi, per ottenere acidi di minor peso molecolare.
Derivato di enorme importanza dell’ossigeno è l’acqua ossigenata, che viene prodotta in quantità dell’ordine del milione di tonnellate. Viene usata come ossidante industriale, ad esempio nella produzione di perborato e nell’imbianchimento di un gran numero di materiali naturali, quali lana, seta, cotone, pellami, avorio, etc.; si pensa che operi per rottura dei doppi legami, i quali sono spesso all’origine della colorazione.
Per usi sanitari viene venduta in concentrazione del 3-6%.
L‘isotopo 18O viene usato come marcatore di molecole di sostanze organiche per lo studio di meccanismi di reazione.
ZOLFO
La produzione mondiale di zolfo elementare raggiunge le decine di milioni di tonn/anno; oltre l’85% di questa quantità viene usata per produrre acido solforico e solfiti.
Grandi quantità di zolfo vengono usate nella vulcanizzazione della gomma naturale. Nel processo di vulcanizzazione si creano ponti zolfo, tra le varie catene polimeriche, derivanti dalla reazione di zolfo con i doppi legami presenti nella gomma. Questo rende la gomma insolubile in solventi, elastica e resistente all’abrasione.
Lo zolfo viene usato anche nella produzione di antiparassitari.
Il derivato più importante dello zolfo, l’acido solforico, è un prodotto essenziale nella economia mondiale. Viene prodotto nel mondo in quantità pari alle centinaia di milioni di tonn/anno, ed usato nei più disparati campi; ad esempio, viene usato nella fabbricazione di fertilizzanti (50%)(il più importante dei quali è il solfato di ammonio), nella raffinazione dei petroli (10%), nella produzione di detersivi, di coloranti, di BaSO4:
Molto importanti sono anche e solfiti e i bisolfiti, usati come sbiancanti e nella produzione della carta, ed anche come conservanti alimentari.
SELENIO
L’importanza tecnologica del selenio sta diminuendo a causa del suo costo; veniva usato nella produzione di acciai speciali e nella vulcanizzazione della gomma, come agente accelerante.
Oggi trova impiego nella costruzione di pile fotovoltaiche (con il silicio) e di cellule fotovoltaiche; il selenio grigio è un semiconduttore intrinseco, che si attiva per fotoeccitazione con lunghezze d’onda comprese nel visibile. Questo fa si che se una lamina di selenio, su cui è chiusa una pila elettrica, viene illuminata, si ha un brusco aumento di passaggio di corrente nel circuito; questo aumento di intensità di corrente può essere amplificato ed usato per attivare un qualsiasi dispositivo (antifurto, sistema di sicurezza, etc.).
Fonte: http://dicasm.ing.unibo.it/staff/berti/chimica%20LS/gruppo16.doc
Chimica elementi del gruppo 16
Visita la nostra pagina principale
Chimica elementi del gruppo 16
Termini d' uso e privacy
