Cristallizzazione
Cristallizzazione
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Cristallizzazione
la cristalizzazione
La cristallizzazione è una operazione unitaria i cui obiettivo è quello di ottenere un solido allo stato cristallino a partire da una soluzione più o meno concentrata. Il principio su cui si basa la cristallizzazione è quello di provocare la sovrassaturazione delle soluzioni e la conseguente precipitazione dei cristalli di soluto.
Il processo
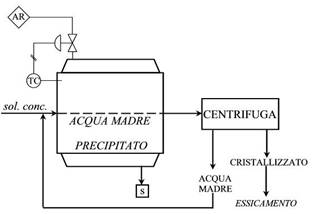 La soluzione che entra nel cristallizzatore proveniente dal concentratore, deve avere una concentrazione tale da far precipitare il soluto per semplice raffreddamento. La soluzione all’interno del cristallizzatore, si miscela con l’acqua di raffreddamento che abbassa la sua temperatura e di conseguenza, il soluto precipita. Ora la soluzione è divisa in due fasi: l’acqua madre e il soluto. Tutto questo viene mandato ad una centrifuga che separa l’acqua madre e il cristallizzato. L’acqua madre viene riciclata in testa al cristallizzatore per due motivi: perché contiene ancora soluto e anche perché contiene microcristalli per l’inseminazione. Il cristallizzato viene sottoposto ad essiccamento per eliminare l’umidità ancora presente.
La soluzione che entra nel cristallizzatore proveniente dal concentratore, deve avere una concentrazione tale da far precipitare il soluto per semplice raffreddamento. La soluzione all’interno del cristallizzatore, si miscela con l’acqua di raffreddamento che abbassa la sua temperatura e di conseguenza, il soluto precipita. Ora la soluzione è divisa in due fasi: l’acqua madre e il soluto. Tutto questo viene mandato ad una centrifuga che separa l’acqua madre e il cristallizzato. L’acqua madre viene riciclata in testa al cristallizzatore per due motivi: perché contiene ancora soluto e anche perché contiene microcristalli per l’inseminazione. Il cristallizzato viene sottoposto ad essiccamento per eliminare l’umidità ancora presente.
La solubilità e la temperatura
Rappresentando le reazioni di solubilizzazione, possiamo scrivere: solido + n · H2O → soluzione ± calore. Questo tipo di reazioni possono essere esotermiche o endotermiche, nella maggior parte dei casi le reazioni di dissoluzione sono endotermiche (richiedono calore). La solubilità, quindi, dipende dalla temperatura. Nella maggior parte dei casi la solubilità cresce al crescere della temperatura. Le curve della solubilità sono il luogo dei punti che rappresentano le concentrazioni di saturazione al variare della temperatura. Una soluzione si dice satura quando si è in presenza del precipitato.
 Tecniche di cristallizzazione
Tecniche di cristallizzazione
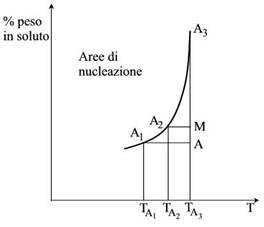
Considerando una qualunque curva di solubilità, i punti a destra della curva (es.: A), sono relativi a soluzione insature, in cui è possibile sciogliere ancora il soluto.
Partendo da una soluzione insatura (A), la cristallizzazione può essere ottenuta nei seguenti modi:
- Raggiungendo la saturazione per raffreddamento. In questo caso ci si sposta dal punto A, di temperatura Ta, al punto A1, di temperatura Ta1.
- Si può raggiungere la curva si saturazione per evaporazione del solvente effettuata alla stessa temperatura Ta. In questo modo si provocherà un aumento della concentrazione fino ad arrivare al punto A2.
- Combinando le due tecniche precedenti si raggiunge il punto A3, attraverso il percorso A-M-A3. In questa maniera si evapora parte del solvente e si raffredda la soluzione. Questa tecnica è chiamata evaporazione adiabatica.
La formazione e la crescita dei cristalli
Il processo di cristallizzazione è il risultato di due fasi consecutive: la formazione dei germi cristallini (nucleazione) e la fase di accrescimento dei cristalli.
Le due fasi sono caratterizzate rispettivamente da una velocità di nucleazione e da una velocità di accrescimento. Il rapporto tra queste due velocità è in relazione con le dimensioni dei cristalli ottenuti. Se si verifica che Vnucl > Vaccr, allora otterremo un elevato numero di cristalli, ma di dimensioni relativamente piccole. Nel caso che Vaccr > Vnucl, avremo relativamente pochi cristalli di grandi dimensioni. Nel caso in cui le due velocità siano comparabili, il precipitato sarà ovviamente di medie dimensioni.
Il fenomeno della nucleazione è influenzato direttamente dalla sovrassaturazione della soluzione. Infatti, tanto è maggiore la sovrassaturazione della soluzione tanto è più facilmente si aggregano le molecole del soluto per formare centri di aggregazione.
Il grado di sovrassaturazione influenza anche le dimensioni dei cristalli. Nel caso di elevate sovrassaturazione, si formeranno molti centri di aggregazione, e di conseguenza i cristalli raggiungeranno dimensioni ridotte; invece se abbiamo una sovrassaturazione modesta si formeranno pochi centri di nucleazione che formeranno cristalli di elevate dimensioni.
Altri accorgimenti atti a fornire cristalli di grandi dimensioni possono essere utilizzati in casi particolari:
- Nella cristallizzazione del NaHCO3 si lavora a temperature molte elevate in modo da favorire la formazione di pochi cristalli, quindi si diminuisce la temperatura, favorendo l’accrescimento, che avvenendo su pochi cristalli, darà luogo a cristalli di grandi dimensioni.
- Introducendo nella soluzione sovrassatura germi di cristallizzazione, essi fungono da centri di accrescimento.
- L’agitazione può favorire l’aggregazione dei microcristalli.
La presenza di impurezze può in centri casi modificare la forma dei cristalli ottenuti (modificazioni reticolari).
Resa di cristallizzazione
Il rendimento dell’operazione di cristallizzazione si calcola effettuando un bilancio di materia. I cristalli che si formano possono essere anidri o idratati. Il bilancio sarebbe: soluzione conc. = acqua madre + cristallizzato, in formula matematica: Ms = C + Mr.
Ms = soluto in ingresso
C = cristallizzato
Mr = soluto nell’acqua madre
Per il calcolo della massa residua si ha:
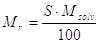
S = solubilità = g soluto / 100 g solvente
Da cui si può calcolare C:
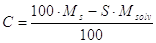
se non si è verificata evaporazione di solvente la Msolv sarà identica a quella iniziale, in caso contrario Msolv dovrà essere sostituita con Mf, massa all’uscita del cristallizzatore (finale).
Alcuni sali inglobano molecole di H2O (si idratano) nelle molecole di cristallizzazione, quindi si ha una massa maggiore di quella iniziale. C diventerà:
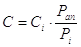
Ci = crist. Idrato
Pan = PM del sale anidro
Pi = PM del sale idrato
La resa di cristallizzazione è il rapporto tra la massa si soluto cristallizzato e la massa di soluto iniziale:
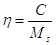
Apparecchiatura utilizzate per la cristallizzazione
Le apparecchiature usate per la cristallizzazione possono essere classificate in base alle tecniche di cristallizzazione impiegate in:
- Cristallizzatori a raffreddamento: i più comini sono i cristallizzatori a paniere, costituiti da un recipiente in cui la soluzione calda sovrassatura viene posta a raffreddare; ed i cristallizzatori Swenson-Walker. Il c. S.-W. è un cristallizzatore continuo munito di un sistema di agitazione a oscillamento. L’oscillazione serve per evitare l’impaccamento dei cristalli, in modo da ottenere cristalli di dimensioni volute.
- Cristallizzatori ad evaporazione: il più impiegato è il c. Oslo. È costituito da un evaporatore a circolazione forzata con fascio tubiero esterno. La soluzione entra nel fascio tubiero, lo attraversa e viene immessa nell’evaporatore tramite una pompa. Il vapore viene eliminato dalla parte superiore dell’èvaporatore, mentre la soluzione sovrassatura passa nel separatore sottostante da dove è costretta risalire attraverso un letto di cristalli già formati, che continuano a ingrossarsi a spese del soluto. I cristalli di dimensioni più piccole vengono trascinati dalla corrente e riciclati allo scambiatore, mentre quelli di dimensioni grandi vengono scaricati da un’uscita laterale. Dalla parte inferiore dell’evaporatore vengono scaricati i cristalli che non riescono ad attraversare il letto.
- Cristallizzatori sotto vuoto: si basano sul principio della evaporazione flash, (ev. per diminuzione di pressione). Infatti, facendo passare una soluzione satura al punto di ebollizione in un ambiente a pressione inferiore, questa si troverà in una condizione di surriscaldamento. Quindi la soluzione tenderà immediatamente ad evaporare e a raffreddarsi contemporaneamente. Infatti, essendo il processo adiabatico, il calore latente di vaporizzazione sarà fornito dalla soluzione liquida che si dovrà raffreddare. Quindi si avrà contemporaneamente una evaporazione ed un raffreddamento con conseguente cristallizzazione del soluto. Questi cristallizzatori sono di forma cilindrica a fondo conico,; possono anche funzionare anche a stadi multipli, in questo caso si avrà una diminuzione di temperatura e grado di vuoto passando da uno stadio all’altro .
Fonte: http://members.xoom.it/alberto_chim/la%20cristallizzazione.doc
Sito web da visitare: http://members.xoom.it/alberto_chim/index.htm
Autore del testo: non indicato nel documento di origine
Parola chiave google : Cristallizzazione tipo file : doc
Visita la nostra pagina principale
Cristallizzazione
Termini d' uso e privacy