Acidi
Acidi
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Acidi
acido abietico
acido abietinico
acido acetico
acido acetico glaciale
acido acetilacetico
acido acetonico
acido aceturico
acido aconitico
acido acrilico
acido adipico
acido agarico
acido aldonico
acido alginico
acido alifatico
acido alogenico
acido alogenidrico
acido ammidosolforico
acido amminico
acido amminobenzoico
acido amminosuccinico
acido anisico
acido antimonico
acido antranilico
acido arachico
acido arachidico
acido arilpropionico
acido aristolochico
acido arsanilico
acido arsenico
acido arsenioso
acido arsinico
acido arsonico
acido atossilico
acido azelaico
acido azotidrico
acido barbiturico
acido beenico
acido behenico
acido benzenarsonico
acido benzencarbossilico
acido benzendisolfonico
acido benzensolfonico
acido benzilico
acido benzoico
acido betulinico
acido binario
acido bismutico
acido borico
acido borico
acido bosvellico
acido brassidico
acido brassilico
acido bromanilico
acido bromico
acido bromidrico
acido bromoacetico
acido bromoaurico
acido bromobenzoico
acido butandioico
acido butanoico
acido butendioico
acido butenico
acido butenoico
acido butirrico
acido cacodilico
acido caffeico
acido caincinico
acido canforico
acido canfosolfonico
acido cannabidiolico
acido caprico
acido caprilico
acido caprinico
acido caproico
acido capronico
acido carbolico
acido carbonico
acido carbossilico
acido carminico
acido carnaubico
acido cerotico
acido chelidonico
acido chetocarbossilico
acido chinico
acido cianacetico
acido cianico
acido cianidrico
acido cianurico
acido ciclammico
acido cicloesancarbossilico
acido cinnamico
acido citraconico
acido cloranilico
acido clorendico
acido clorico
acido cloridrico
acido cloridrico anidro
acido cloroacetico
acido clorobenzoico
acido clorofenossiacetico
acido cloroplatinico
acido cloroso
acido clorosolfonico
acido clorosolforico
acido coccerico
acido cogico
acido concentrato
acido coniugato
acido corrosivo
acido cresotinico
acido crisofanico
acido cromico
acido cromotropico
acido crotonico
acido cumarico
acido debole
acido decanoico
acido deidroacetico
acido deidroascorbico
acido delle camere di piombo
acido destrosico
acido di Brönner
acido di Brönsted
acido di Caro
acido di contatto
acido di decapaggio
acido di Lewis
acido di Piloty
acido diallilbarbiturico
acido dialurico
acido diamminobenzoico
acido diamminopimelico
acido dicarbossilico
acido dicloroacetico
acido diclorofenossiacetico
acido dicloropropionico
acido dicromico
acido difenico
acido difenilacetico
acido difenilglicolico
acido digallico
acido diglicolico
acido diidrofolico
acido diidrossimaleico
acido diiodosalicilico
acido dilinoleico
acido diluito
acido dinitrobenzoico
acido disolfonico
acido disolforico
acido ditiocarbammico
acido ditionico
acido DL.-tartarico
acido docosanoico
acido docosapentanoico
acido dodecanoico
acido duro
acido edetico
acido eicosanoico
acido elaidico
acido eleostearico
acido ellagico
acido emimellitico
acido enantico
acido eneicosanoico
acido eptadecanoico
acido eptandioico
acido eptanoico
acido equisetico
acido eritorbico
acido eritronico
acido erucico
acido esacloroplatinico
acido esacosanoico
acido esadecanoico
acido esafluorosilicico
acido esaidrobenzoico
acido esaidroftalico
acido esandioico
acido esanoico
acido esausto
acido etanoico
acido etilcrotonico
acido etilendiamminotetracetico
acido etilenlattico
acido etilesanoico
acido etilfosforico
acido etilsolforico
acido etionico
acido fenico
acido fenilacetico
acido fenilantranilico
acido fenilarsonico
acido fenilbutirrico
acido feniletilbarbiturico
acido fenilglicolico
acido fenoldisolfonico
acido fenolsolfonico
acido ferricianidrico
acido ferrocianidrico
acido ferulico
acido fluoborico
acido fluoridrico
acido fluoroacetico
acido fluorofosforico
acido fluosilicico
acido fluosolfonico
acido formammidensolfinico
acido formico
acido forte
acido fosfatidico
acido fosfinico
acido fosfomolibdico
acido fosfonico
acido fosforico
acido fosforoso
acido fosfotungstico
acido ftalico
acido fulminico
acido fulminurico
acido fulvico
acido furoico
acido G
acido gadoleico
acido gallico
acido gallotannico
acido gamma
acido gentisico
acido gentisinico
acido ginocardico
acido glicidico
acido glicolico
acido gliossalico
acido glucarico
acido gluconico
acido glutamminico
acido gorlico
acido H
acido hard
acido idantoico
acido idnocarpico
acido idossicinnamico
acido idracrilico
acido idrazoico
acido idrobromico
acido idrocianico
acido idrocinnamico
acido idroclorico
acido idrofluorico
acido idrosolforoso
acido idrossammico
acido idrossiacetico
acido idrossibenzoico
acido idrossibutirrico
acido idrossiesanoico
acido idrossinaftoico
acido imminodiacetico
acido imminodietanoico
acido iodico
acido iodidrico
acido iodoacetico
acido ipocloroso
acido ipofosforoso
acido ipoiodoso
acido iponitroso
acido iposolforico
acido iposolforoso
acido isetionico
acido isobutirrico
acido isocianico
acido isocianurico
acido isoftalico
acido isonicotinico
acido isopentanoico
acido isovalerianico
acido isovalerico
acido itaconico
acido J
acido K
acido kojico
acido laurico
acido lauroleico
acido levulinico
acido lignocerico
acido linolico
acido M
acido magico
acido maleico
acido malonico
acido mandelico
acido manganico
acido mannonico
acido margarico
acido meconico
acido melissico
acido mellitico
acido mercaptoacetico
acido mesaconico
acido mesossalico
acido mesotartarico
acido metacrilico
acido metafosforico
acido metanarsonato monosodico
acido metanarsonico
acido metanilico
acido metanoico
acido metansolfonico
acido metasilicico
acido metatitanico
acido metendisolfonico
acido metilacetico
acido metilarsonico
acido metilensuccinico
acido metilfumarico
acido metilmaleico
acido metilpentanoico
acido metilsalicilico
acido metilsolfonico
acido metionico
acido metossiacetico
acido mevalonico
acido miristico
acido miristoleico
acido mironico
acido molibdico
acido molle
acido monocarbossilico
acido muriatico
acido naftalinsolfonico
acido naftenico
acido naftilacetico
acido naftilftalamico
acido naftionico
acido naftoico
acido naftossiacetico
acido nervonico
acido niobico
acido nitrico
acido nitrico fumante
acido nitrilacetico
acido nitrilotriacetico
acido nitrobenzoico
acido nitrosalicilico
acido nitroso
acido nonandioico
acido nonanoico
acido nonilfenossiacetico
acido nonilico
acido nonoico
acido nordidroguaiaretico
acido oleico
acido orto
acido osmico
acido ossalacetico
acido ossalurico
acido ossanilico
acido ossiacetico
acido ossibenzoico
acido ossibutirrico
acido ossigenato
acido ottadecanoico
acido ottandioico
acido ottanoico
acido palmitico
acido palmitoleico
acido parabanico
acido paramminobenzoico
acido pectinico
acido pelargonico
acido pentanoico
acido peracetico
acido perbenzoico
acido perclorico
acido performico
acido peri
acido periodico
acido permanganico
acido perossiacetico
acido perossibenzoico
acido perossidisolforico
acido perossimonosolforico
acido perrenico
acido persolforico
acido petroselinico
acido picolinico
acido picrammico
acido picrico
acido picrolonico
acido pimarico
acido pimelico
acido pinico
acido piroacetico
acido pirofosforico
acido pirogallico
acido pirolegnoso
acido piromellitico
acido pirosolforico
acido poliacrilico
acido policarbossilico
acido polifosforico
acido poliglicolico
acido poliinsaturo
acido polisilicico
acido politionico
acido poliuronico
acido propandioico
acido propanoico
acido propenoico
acido propiolico
acido propionico
acido protocatechico
acido prussico
acido pteroico
acido pteroilglutammico
acido quercitannico
acido racemico
acido resinico
acido resinolico
acido resorcilico
acido retinoico
acido ricinoleico
acido rubianico
acido salicilico
acido sebacico
acido selenico
acido selenidrico
acido selenioso
acido selenonico
acido silicico
acido silicotungstico
acido silvico
acido soft
acido solfammico
acido solfanilico
acido solfenico
acido solfidrico
acido solfinico
acido solfocianico
acido solfocromico
acido solfonico
acido solforico
acido solforico fumante
acido solforoso
acido solfosalicilico
acido solfossilico
acido sorbico
acido stannico
acido stearico
acido stearidonico
acido stifnico
acido stricnico
acido suberico
acido tannico
acido tartarico
acido tellurico
acido telluroso
acido terebico
acido tereftalico
acido tetracloroftalico
acido tetrafosforico
acido tiglico
acido tioacetico
acido tiobarbiturico
acido tiobenzoico
acido tiocarbammico
acido tiocarbonico
acido tiocianico
acido tiodiglicolico
acido tiodipropionico
acido tioglicolico
acido tiolattico
acido tiomalico
acido tionico
acido tiosalicilico
acido tiosolfonico
acido tiosolforico
acido titanico
acido toluensolfonico
acido toluico
acido treonico
acido tricarbossilico
acido tricloroacetico
acido triclorobenzoico
acido triclorofenossiacetico
acido tricloroisocianurico
acido trifluoroacetico
acido triiodobenzoico
acido trimesinico
acido trinitrobenzoico
acido tritionico
acido tropico
acido truxillico
acido tungstico
acido umico
acido undecanoico
acido undecilenico
acido undecilico
acido uronico
acido valerianico
acido valerico
acido vanadico
acido veratrico
acido violurico
acido vitriolico
acido wolframico
acido xantico
acido xantogenico
acido xilonico
ACIDI E BASI
La dissociazione elettrolitica
Parlando dei legami abbiamo visto che tra gli ioni di un composto ionico e le molecole polari dell’acqua si forma un legame ione - dipolo, grazie al quale l’acqua riesce a sciogliere i composti ionici stessi. Un meccanismo analogo avviene anche coi composti che presentano un legame covalente fortemente polarizzato. Prendiamo ad esempio la molecola di HCl, in cui l’atomo di cloro, più elettronegativo, rappresenta la parte negativa, mentre l’atomo di idrogeno rappresenta quella positiva. In soluzione le molecole d’acqua si dispongono intorno al cloro rivolgendogli la parte con polarità positiva, mentre rivolgono verso l’idrogeno la parte con polarità negativa. Tale interazione elettrica crea uno scompenso nell’acido, le molecole di acqua si legano agli atomi di cloro e di idrogeno, favorendo una totale separazione delle cariche elettriche per cui il legame tra di essi si rompe e vanno in soluzione ioni H+ e ioni Cl-, secondo la reazione HCl → H+ + Cl-.
Tutte le sostanze che sciogliendosi in acqua danno luogo a ioni si dicono elettroliti, la dissociazione cui sono sottoposti prende il nome di dissociazione elettrolitica, mentre le soluzioni che si formano sono dette soluzioni elettrolitiche. Sono elettroliti tutti gli acidi, tutte le basi e tutti i sali. Le soluzioni elettrolitiche conducono la corrente. Come per qualsiasi altra reazione reversibile, anche per quelle di dissociazione elettrolitica è possibile scrivere una costante d’equilibrio. Se tale costante è alta, quasi tutte le molecole dell’elettrolita si sono dissociate in ioni, l’equilibrio è molto spostato verso destra e la sostanza è definita un elettrolita forte. Viceversa, se solo poche molecole si dissociano, l’equilibrio è spostato a sinistra, la costante di equilibrio della reazione di dissociazione è bassa e la sostanza viene definita un elettrolita debole.
Acidi e basi
Le sostanze acide sono conosciute ed utilizzate da moltissimi secoli. La più antica, e la prima per la quale è stato utilizzato il termine di origine latina “acido”, sembra essere l’acido acetico, che si ottiene dalla trasformazione del vino in aceto. Altri acidi, come l’acido solforico e l’acido nitrico, sono conosciuti fin dal tardo medioevo e sono utilizzati in un numero così elevato di processi industriali che, ancora oggi, il grado d’industrializzazione di un paese si misura anche in base alla quantità di H2SO4 prodotta. Gli acidi reagiscono coi metalli, producendo idrogeno, e con il calcare, producendo CO2, ed hanno un sapore aspro.
Anche le basi, un tempo dette alcali, sono sostanze conosciute fin dall’antichità; esse reagiscono con gli acidi, neutralizzandone le proprietà, sono untuosi al tatto ed hanno un sapore amaro. Tuttavia, fino alla seconda metà dell’800 non si era riusciti a comprendere quale relazione esistesse tra la formula di un composto e le sue proprietà acide o basiche. Nel ‘700 Lavoisier riteneva che tutti gli acidi contenessero ossigeno, tanto che, essendo stato tra gli scopritori di questo elemento, lo volle chiamare proprio ossigeno, dal greco oxsus, (acido) e ghennao (generare). Successivamente ci si accorse che i tutti gli acidi contenevano idrogeno e non ossigeno, ma non tutti i composti dell’idrogeno sono acidi.
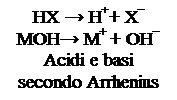 La prima vera teoria chimica sulla natura degli acidi appartiene a Svante Arrhenius, chimico svedese premio nobel, il quale, alla fine dell’800, mostrò che tutti gli acidi liberano in acqua ioni H+, mentre le basi liberano in acqua ioni OH-. Gli acidi binari e gli acidi ternari che già conosciamo rientrano quindi nella definizione di acido data da Arrhenius, mentre gli unici composti che rientrano nella sua definizione di base sono gli idrossidi. La teoria di Arrhenius aveva però molti limiti, primo tra tutti quello di non riuscire a spiegare il comportamento acido o basico al di fuori delle soluzioni acquose. Negli anni ’20 il danese Bronsted e l’inglese Lowry proposero una nuova interpretazione del comportamento acido e basico delle sostanze. La formulazione di tale teoria, che porta il loro nome, è la seguente: si definisce acido una sostanza capace di donare uno ione H+ ad un’altra sostanza; si definisce base una sostanza che accetta questo ione H+ da un acido. Tale teoria svincola quindi il comportamento acido – base dal mezzo acquoso, ed evidenzia come un acido possa esistere solo in presenza di una base e viceversa. Un acido isolato, o contenuto in un recipiente inerte, non può cedere ioni H+ a nessuno e quindi non può manifestare le sue proprietà; lo stesso dicasi per una base. Gli ioni H+ non possono infatti esistere da soli, ma possono solo passare da un acido ad una base, durante una reazione chimica. Difatti, se noi togliamo ad un atomo di idrogeno l’unico elettrone che possiede, ciò che rimane è solo il protone presente nel nucleo. Lo ione H+ è quindi una particella dotata di una carica positiva, ma con dimensioni ridottissime, in quanto il nucleo è circa 10.000 volte più piccolo dell’atomo nel suo insieme. La presenza di una carica elettrica su di un volume così piccolo rende lo ione estremamente instabile e reattivo. Esso cercherà pertanto di legarsi con la prima molecola che incontra.
La prima vera teoria chimica sulla natura degli acidi appartiene a Svante Arrhenius, chimico svedese premio nobel, il quale, alla fine dell’800, mostrò che tutti gli acidi liberano in acqua ioni H+, mentre le basi liberano in acqua ioni OH-. Gli acidi binari e gli acidi ternari che già conosciamo rientrano quindi nella definizione di acido data da Arrhenius, mentre gli unici composti che rientrano nella sua definizione di base sono gli idrossidi. La teoria di Arrhenius aveva però molti limiti, primo tra tutti quello di non riuscire a spiegare il comportamento acido o basico al di fuori delle soluzioni acquose. Negli anni ’20 il danese Bronsted e l’inglese Lowry proposero una nuova interpretazione del comportamento acido e basico delle sostanze. La formulazione di tale teoria, che porta il loro nome, è la seguente: si definisce acido una sostanza capace di donare uno ione H+ ad un’altra sostanza; si definisce base una sostanza che accetta questo ione H+ da un acido. Tale teoria svincola quindi il comportamento acido – base dal mezzo acquoso, ed evidenzia come un acido possa esistere solo in presenza di una base e viceversa. Un acido isolato, o contenuto in un recipiente inerte, non può cedere ioni H+ a nessuno e quindi non può manifestare le sue proprietà; lo stesso dicasi per una base. Gli ioni H+ non possono infatti esistere da soli, ma possono solo passare da un acido ad una base, durante una reazione chimica. Difatti, se noi togliamo ad un atomo di idrogeno l’unico elettrone che possiede, ciò che rimane è solo il protone presente nel nucleo. Lo ione H+ è quindi una particella dotata di una carica positiva, ma con dimensioni ridottissime, in quanto il nucleo è circa 10.000 volte più piccolo dell’atomo nel suo insieme. La presenza di una carica elettrica su di un volume così piccolo rende lo ione estremamente instabile e reattivo. Esso cercherà pertanto di legarsi con la prima molecola che incontra.
Secondo Bronsted e Lowry può quindi avere comportamento acido solo una sostanza nella cui molecola vi sia almeno un atomo di idrogeno legato ad un altro atomo molto elettronegativo: solo così, infatti, si può avere un legame covalente polare, dalla cui rottura possono formarsi ioni H+. Viceversa possono comportarsi da basi solo quelle sostanze che abbiano almeno una coppia di elettroni non impegnata in legami: con tale coppia difatti la sostanza formerà un legame covalente dativo con lo ione H+. La teoria di Bronsted e Lowry ingloba al suo interno anche quella di Arrhenius, infatti in soluzione acquosa un acido, come ad esempio HCl, cede uno ione H+ all’acqua, che in questo caso si comporta da base, formando lo ione H3O+, secondo la reazione:
 HCl +H2O Cl- + H3O+.
HCl +H2O Cl- + H3O+.
L’acqua, in effetti, presenta due coppie di non legame, una delle quali viene impiegata per formare un legame dativo con H+. Viceversa quando mettiamo in acqua una base, ad esempio NH3, questa acquista un elettrone dall’acqua, che in questo caso si comporta da acido, secondo la reazione:
 NH3 + H2O NH+4 + OH-.
NH3 + H2O NH+4 + OH-.
Poiché tutte le reazioni acido – base sono riconducibili ad uno scambio di protoni, esse possono essere rappresentate dalla reazione generica
 HA + B BH+ + A-.
HA + B BH+ + A-.
 Da quest’equazione si può osservare come i prodotti del passaggio dello ione H+ siano a loro volta un acido ed una base. BH+ è in realtà un acido, in quanto può cedere uno ione H+, mentre A- è una base, perché possiede una coppia di non legame con cui può legare uno ione H+. La sostanza BH+ prende quindi il nome di acido coniugato della base B, mentre la sostanza A- si dice base coniugata dell’acido HA. La nuova coppia acido – base che si forma può dare luogo alla reazione inversa finché il sistema raggiunge l’equilibrio, come viene evidenziato dalla presenza della doppia freccia nell’equazione chimica corrispondente. Alla luce di questa nuova considerazione possiamo rianalizzare anche le due reazioni con l’acqua precedentemente citate:
Da quest’equazione si può osservare come i prodotti del passaggio dello ione H+ siano a loro volta un acido ed una base. BH+ è in realtà un acido, in quanto può cedere uno ione H+, mentre A- è una base, perché possiede una coppia di non legame con cui può legare uno ione H+. La sostanza BH+ prende quindi il nome di acido coniugato della base B, mentre la sostanza A- si dice base coniugata dell’acido HA. La nuova coppia acido – base che si forma può dare luogo alla reazione inversa finché il sistema raggiunge l’equilibrio, come viene evidenziato dalla presenza della doppia freccia nell’equazione chimica corrispondente. Alla luce di questa nuova considerazione possiamo rianalizzare anche le due reazioni con l’acqua precedentemente citate:
 In ogni reazione acido base vi sono quindi due acidi e due basi, mentre le coppie HCl/Cl- e NH3/NH4+, costituite da due sostanze che differiscono solo per uno ione H+, si definiscono coppie coniugate acido – base.
In ogni reazione acido base vi sono quindi due acidi e due basi, mentre le coppie HCl/Cl- e NH3/NH4+, costituite da due sostanze che differiscono solo per uno ione H+, si definiscono coppie coniugate acido – base.
In entrambe le reazioni è presente l’acqua, che si comporta da base alla presenza di un acido, mentre si comporta da acido alla presenza di una base; tale comportamento si definisce anfotero.
Nella trattazione successiva considereremo solamente acidi e basi in soluzione acquosa. Pur avendo presenta la teoria di Bronsted e Lowry, e le considerazioni sulla natura di H+, nelle pagine che seguono utilizzeremo i concetti di Arrhenius. Descriveremo quindi le dissociazioni degli acidi e delle basi senza contarvi l’acqua. In tal senso le soluzioni degli acidi conterranno ioni H+, mentre quelle delle basi conterranno ioni OH-.
Carattere acido e basico di un composto
Elencheremo di seguito alcune semplici considerazioni che possono aiutarci a capire, dalla sua formula chimica, quale sia il comportamento acido – base di un composto. A tale fine 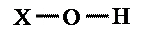 consideriamo un composto generico dell’idrogeno di formula XOH. L’ossigeno è molto elettronegativo ed ha quindi una forte tendenza ad attrarre su di se sia gli elettroni del legame con X, sia quelli del legame con H.
consideriamo un composto generico dell’idrogeno di formula XOH. L’ossigeno è molto elettronegativo ed ha quindi una forte tendenza ad attrarre su di se sia gli elettroni del legame con X, sia quelli del legame con H.
F Se anche X è un elemento molto elettronegativo, come quelli posti in alto a destra nella tabella periodica, l’ossigeno ha difficoltà ad attirare su di se gli elettroni del legame X─O ed attirerà pertanto solo gli elettroni del legame O−H. In tal modo il legame con l’idrogeno diviene fortemente polarizzato, s’indebolisce, e facilmente si rompe a contatto con H2O o con una base; il composto è allora una acido ed in acqua darà luogo alla seguente reazione:
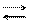 X−O−H X−O– + H+.
X−O−H X−O– + H+.
Il composto è quindi un acido. Tanto più il legame O─H è debole, perché molto polarizzato, tanto maggiore sarà la tendenza a cedere ioni H+, tanto più forte sarà il carattere acido della sostanza. Composti di questo tipo sono, ad esempio, HClO, HNO3, H2SO4 e tutti gli altri acidi ternari.
F Se viceversa X è un metallo dei primi due gruppi, oppure è un metallo di transizione, il suo valore d’elettronegatività è basso, inferiore a quello dell’idrogeno; in questo caso l’ossigeno attira gli elettroni del legame X−O più fortemente di quelli del legame O−H. Il primo legame sarà quindi più debole del secondo ed in acqua si romperà secondo la reazione:
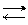 X−O−H X+ + O−H–
X−O−H X+ + O−H–
In tal caso il composto è chiaramente una base. Si comportano in questo modo sostanze come NaOH, Ca(OH)2, Fe(OH)3 e tutti gli altri idrossidi.
F Se infine X è un elemento di elettronegatività intermedia, il composto XOH è un elettrolita anfotero, si comporta cioè da base in presenza di un acido e da acido in presenza di una base. Un esempio di composti di questo tipo è proprio l’acqua, nella quale l’elemento X è appunto l’idrogeno.
Possiamo riassumere dicendo che: un generico composto X−O−H assume un comportamento acido, basico o anfotero, a seconda che l’elemento X abbia un valore d’elettronegatività alto, basso o intermedio (più precisamente maggiore, minore o uguale a quello dell’elettronegatività dell’idrogeno).
Negli acidi binari non c’è ossigeno, ma l’idrogeno è direttamente legato ad un elemento molto elettronegativo con un legame covalente polare. In presenza di una base tale legame si rompe e l’acido cede lo ione H+ alla base. Reazioni di questo tipo sono già state descritte nelle pagine precedenti.
La forza degli acidi e delle basi
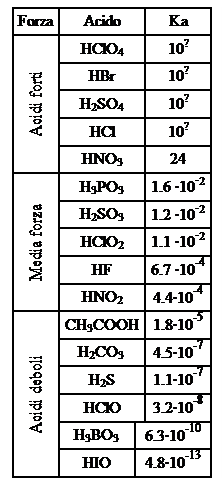
 Gli acidi e le basi sono elettroliti, in quanto in acqua danno luogo ad ioni, e possono essere elettroliti forti o deboli, a seconda che si dissocino molto o poco. Poiché nella loro dissociazione liberano rispettivamente ioni H+ e OH-, misurando la loro forza come elettroliti misuriamo anche la loro forza come acidi o basi. Infatti un acido, o una base, è forte se in acqua dissocia un’alta percentuale delle sue molecole ovvero se l’equilibrio della sua reazione di dissociazione è completamente spostato a destra e quindi il valore della costante di equilibrio è alto. Viceversa un acido, o una base, è debole se in acqua dissocia poche molecole ovvero se l’equilibrio di dissociazione è spostato a sinistra ed ha una costante bassa. Vediamo adesso se è possibile trarre qualche conclusione sulla forza di un composto acido o basico dall’analisi della sua formula chimica.
Gli acidi e le basi sono elettroliti, in quanto in acqua danno luogo ad ioni, e possono essere elettroliti forti o deboli, a seconda che si dissocino molto o poco. Poiché nella loro dissociazione liberano rispettivamente ioni H+ e OH-, misurando la loro forza come elettroliti misuriamo anche la loro forza come acidi o basi. Infatti un acido, o una base, è forte se in acqua dissocia un’alta percentuale delle sue molecole ovvero se l’equilibrio della sua reazione di dissociazione è completamente spostato a destra e quindi il valore della costante di equilibrio è alto. Viceversa un acido, o una base, è debole se in acqua dissocia poche molecole ovvero se l’equilibrio di dissociazione è spostato a sinistra ed ha una costante bassa. Vediamo adesso se è possibile trarre qualche conclusione sulla forza di un composto acido o basico dall’analisi della sua formula chimica.
FPartiamo dagli acidi ternari, cominciando col prenderne in esame tre, di formula simile, appartenenti a tre elementi del settimo gruppo: H−O−Cl, H−O−Br e H−O−I. La loro forza è determinata dall’elettronegatività del non metallo: tanto più fortemente quest’elemento attirerà gli elettroni di legame con l’ossigeno, tanto più l’ossigeno stesso scaricherà la sua tendenza attrattiva sul legame H−O indebolendolo e rendendo così la sostanza facilmente dissociabile.
 Consideriamo adesso i quattro acidi ternari del cloro: HClO; HClO2; HClO3 e HClO4;
Consideriamo adesso i quattro acidi ternari del cloro: HClO; HClO2; HClO3 e HClO4;
In questi quattro acidi legato al gruppo OH vi è sempre il cloro, il quale però lega a sua volta un numero differente di atomi di ossigeno non protonati, cioè non legati direttamente con atomi di idrogeno. Gli atomi d’ossigeno non protonati attirano gli elettroni dei legami col cloro, provocando una diminuzione della densità di carica elettrica su quest’elemento, il quale si rifà, attirando con maggior forza gli elettroni che lo legano all’ossigeno del gruppo OH. A sua volta l’ossigeno del gruppo OH finisce per scaricare tutta la propria forza attrattiva sul legame con l’idrogeno, che diventa molto polarizzato e s’indebolisce, rendendo l’acido più forte.
Riassumendo possiamo dire che: la forza degli acidi ternari aumenta all’aumentare dell’elettronegatività del non metallo e del numero di atomi di ossigeno non protonati che si legano ad esso. La forza degli acidi pertanto diminuisce nell’ordine seguente:
HClO>HBrO>HIO
HClO4> HClO3>HClO2> HClO
FNegli acidi binari invece la situazione può essere riassunta in questa maniera: la forza degli acidi binari aumenta spostandosi da sinistra a destra lungo un periodo e scendendo lungo un gruppo. Per ciò che riguarda gli elementi del settimo gruppo, la forza degli acidi aumenta pertanto nel modo seguente:
HI>HBr>HCl>HF
Ciò è determinato dal fatto che per gli elementi più in alto nel gruppo entra in azione il legame idrogeno, che stabilizza la molecola, rendendo più difficile la cessione del protone.
 FOccupiamoci infine degli idrossidi, le basi più diffuse, e le uniche di cui ci occuperemo specificatamente. Al diminuire dell’elettronegatività del metallo, aumenta la tendenza a cedere all’ossigeno gli elettroni del legame M−OH; da ciò deriva che il composto si dissocerà più facilmente secondo la reazione M−O−H M+ + O−H– e sarà dunque una base più forte. Ricordando come varia l’elettronegatività all’interno della tabella periodica, possiamo riassumere dicendo che: la forza degli idrossidi come basi aumenta scendendo lungo un gruppo, mentre diminuisce spostandosi da sinistra verso destra in un periodo. Nel primo gruppo quindi la forza basica degli idrossidi aumenta come segue:
FOccupiamoci infine degli idrossidi, le basi più diffuse, e le uniche di cui ci occuperemo specificatamente. Al diminuire dell’elettronegatività del metallo, aumenta la tendenza a cedere all’ossigeno gli elettroni del legame M−OH; da ciò deriva che il composto si dissocerà più facilmente secondo la reazione M−O−H M+ + O−H– e sarà dunque una base più forte. Ricordando come varia l’elettronegatività all’interno della tabella periodica, possiamo riassumere dicendo che: la forza degli idrossidi come basi aumenta scendendo lungo un gruppo, mentre diminuisce spostandosi da sinistra verso destra in un periodo. Nel primo gruppo quindi la forza basica degli idrossidi aumenta come segue:
KOH>NaOH>LiOH
Gli equilibri acido - base
Anche per le reazioni acido – base è possibile scrivere una costante d’equilibrio, che misura quanto la reazione sia avvenuta. La posizione dell’equilibrio (a destra o a sinistra) dipende simultaneamente sia dalla tendenza dell’acido a cedere lo ione H+(che è poi la forza dell’acido), che dalla tendenza della base ad accettarlo (che è poi la forza della base); naturalmente l’equilibrio è tanto più spostato a destra quanto maggiori sono tali tendenze. Quindi, essendo due le sostanze che con le loro caratteristiche influenzano l’andamento dell’equilibrio, non esiste una tendenza assoluta a cedere o ad accettare ioni H+, non è pertanto possibile misurare neppure una forza assoluta degli acidi o delle basi. Del resto, a pagina due abbiamo già visto che un acido può esistere solo in presenza di una base e viceversa, mentre i composti anfoteri si comportano da acido o da base a seconda delle sostanze con cui vengono messi a confronto. La determinazione della forza di un acido o di una base viene dunque fatta misurando la tendenza delle sostanze a donare o ad acquistare un protone nei confronti di una medesima sostanza presa come riferimento. Poiché gli acidi e le basi si sciolgono in acqua, e la maggior parte delle reazioni acido – base avviene in soluzione acquosa, l’acqua è stata presa come sostanza di riferimento per misurare la forza di un acido o di una base. Questo del resto concorda con quanto abbiamo detto all’inizio del paragrafo precedente, quando abbiamo posto l’accento sulla natura elettrolitica degli acidi e delle basi, per cui la costante d’equilibrio della reazione di dissociazione in acqua di un acido o di una base viene presa come misura della forza di quell’acido o di quella base in acqua.
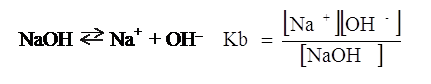 Dato quindi un generico acido, HNO3 ad esempio, ed utilizzando la notazione di Arrhenius, la Keq della sua reazione di dissociazione in acqua prende il nome di costante di dissociazione acida o meglio di costante acida e s’indica con Ka.
Dato quindi un generico acido, HNO3 ad esempio, ed utilizzando la notazione di Arrhenius, la Keq della sua reazione di dissociazione in acqua prende il nome di costante di dissociazione acida o meglio di costante acida e s’indica con Ka.
 Data invece una base generica, NaOH ad esempio, la Keq della sua reazione di dissociazione in acqua prende il nome di costante di dissociazione basica o meglio di costante basica e s’indica con Kb.
Data invece una base generica, NaOH ad esempio, la Keq della sua reazione di dissociazione in acqua prende il nome di costante di dissociazione basica o meglio di costante basica e s’indica con Kb.
Un gran valore di Ka o Kb (>1) significa che la reazione di dissociazione è spostata a destra: si parla in questi casi di acidi o basi forti o fortissimi; viceversa, valori piccoli di Ka o Kb (<10-4) indicano acidi o basi deboli o debolissimi. Nei casi intermedi si hanno acidi o basi di media forza.
La dissociazione dell’acqua
Come già sappiamo l’acqua è un composto anfotero, che come tale quindi si comporta da acido con le basi, donando loro uno ione H+, mentre si comporta da base con gli acidi, accettandone lo ione H+. Per potersi comportare così l’acqua deve avere sia le caratteristiche delle basi, sia quelle degli acidi, così come sono state descritte nei paragrafi precedenti. Limitiamoci ancora una volta alla trattazione di Arrhenius. In effetti l’acqua spontaneamente da luogo alla seguente reazione di dissociazione:
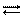 H2O H++ OH–
H2O H++ OH–
per la quale è possibile scrivere la seguente costante d’equilibrio:
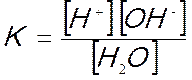 L’equilibrio è completamente spostato a sinistra, le molecole di acqua che si dissociano sono infatti pochissime, circa una ogni 10 milioni; la concentrazione molare dell’acqua resta quindi praticamente sempre costante e pertanto anche il suo prodotto con la costante di dissociazione è costante:
L’equilibrio è completamente spostato a sinistra, le molecole di acqua che si dissociano sono infatti pochissime, circa una ogni 10 milioni; la concentrazione molare dell’acqua resta quindi praticamente sempre costante e pertanto anche il suo prodotto con la costante di dissociazione è costante:
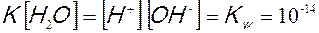
questa espressione prende il nome di prodotto ionico dell’acqua.
Il carattere anfotero dell’acqua può essere dunque spiegato dal fatto che essa sempre presenta al suo interno quantità, sia pur piccolissime, di ioni H+ e OH–. Poiché dalla dissociazione di una molecola di acqua otteniamo uno ione H+ ed uno ione OH-, la loro concentrazione nell’acqua pura è costante ed uguale a 10-7molare.
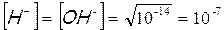
Tale uguaglianza è valida solo per l’acqua pura, se infatti mettiamo nell’acqua un acido la concentrazione degli ioni H+ aumenta, viceversa se mettiamo una base aumenta invece la concentrazione degli ioni OH–. Tuttavia in qualunque soluzione acquosa, acida, basica o neutra, il prodotto della concentrazione molare degli ioni H+ per la concentrazione molare degli ioni OH- è costante e vale 10-14. [H+] e [ OH–] sono infatti inversamente proporzionali ed il fattore di proporzionalità è 10-14; il loro prodotto è infatti costante, indipendentemente dal valore assunto dai due fattori. A questo punto, nota la concentrazione di uno dei due ioni è facile calcolare la concentrazione dell’altro, matematicamente risulta infatti che :
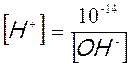
Soluzioni acide, neutre e basiche. Il pH.
Lo ione H+ viene chiamato idrogenione, mentre lo ione OH– viene chiamato ossidrilione. Poiché i valori della concentrazione idrogenionica e ossidrilionica sono legati tra loro dall’espressione del prodotto ionico dell’acqua, per caratterizzare le proprietà acido base di una soluzione acquosa è sufficiente fare riferimento ad una sola delle due concentrazioni. A tale scopo viene convenzionalmente utilizzata la concentrazione idrogenionica.
F Se in una soluzione la concentrazione idrogenionica è uguale a quella ossidrilionica, ed entrambe valgono 10-7M, cioè se [H+]=[ OH–]=10-7, la soluzione si dice neutra.
F Se viceversa la concentrazione idrogenionica è maggiore di quella ossidrilionica, ed è pertanto maggiore di 10-7M, cioè se [H+]>[ OH–] e [H+]>10-7, la soluzione si dice acida.
 F Se infine la concentrazione idrogenionica è minore di quella ossidrilionica, ed è pertanto minore di 10-7M, cioè se [H+]< [ OH–] e [H+]<10-7, la soluzione si dice basica.
F Se infine la concentrazione idrogenionica è minore di quella ossidrilionica, ed è pertanto minore di 10-7M, cioè se [H+]< [ OH–] e [H+]<10-7, la soluzione si dice basica.
Per evitare di utilizzare le potenze negative di 10, oppure numeri preceduti da tanti zeri, nel misurare la concentrazione idrogenionica di una soluzione si utilizza una scala logaritmica in base 10. Ricordiamo che matematicamente si definisce logaritmo in base 10 di un numero X l’esponente che dobbiamo dare a 10 per avere X, risulta cioè che:
se Log10 X = a allora 10a = X
in questo senso quindi Log10 10-7 = -7 Log10 10-14 = -14 e Log10 1 = 0
Fonte: estratto da http://www.liceodavincifi.it/_Rainbow/Documents/ACIDI%20E%20BASI2.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Acidi tipo file : doc
Acidi
Visita la nostra pagina principale
Acidi
Termini d' uso e privacy