Acidi e basi
Acidi e basi
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Acidi e basi
ACIDI E BASI
La dissociazione elettrolitica
Parlando dei legami abbiamo visto che tra gli ioni di un composto ionico e le molecole polari dell’acqua si forma un legame ione - dipolo, grazie al quale l’acqua riesce a sciogliere i composti ionici stessi. Un meccanismo analogo avviene anche coi composti che presentano un legame covalente fortemente polarizzato. Prendiamo ad esempio la molecola di HCl, in cui l’atomo di cloro, più elettronegativo, rappresenta la parte negativa, mentre l’atomo di idrogeno rappresenta quella positiva. In soluzione le molecole d’acqua si dispongono intorno al cloro rivolgendogli la parte con polarità positiva, mentre rivolgono verso l’idrogeno la parte con polarità negativa. Tale interazione elettrica crea uno scompenso nell’acido, le molecole di acqua si legano agli atomi di cloro e di idrogeno, favorendo una totale separazione delle cariche elettriche per cui il legame tra di essi si rompe e vanno in soluzione ioni H+ e ioni Cl-, secondo la reazione HCl → H+ + Cl-.
Tutte le sostanze che sciogliendosi in acqua danno luogo a ioni si dicono elettroliti, la dissociazione cui sono sottoposti prende il nome di dissociazione elettrolitica, mentre le soluzioni che si formano sono dette soluzioni elettrolitiche. Sono elettroliti tutti gli acidi, tutte le basi e tutti i sali. Le soluzioni elettrolitiche conducono la corrente. Come per qualsiasi altra reazione reversibile, anche per quelle di dissociazione elettrolitica è possibile scrivere una costante d’equilibrio. Se tale costante è alta, quasi tutte le molecole dell’elettrolita si sono dissociate in ioni, l’equilibrio è molto spostato verso destra e la sostanza è definita un elettrolita forte. Viceversa, se solo poche molecole si dissociano, l’equilibrio è spostato a sinistra, la costante di equilibrio della reazione di dissociazione è bassa e la sostanza viene definita un elettrolita debole.
Acidi e basi
Le sostanze acide sono conosciute ed utilizzate da moltissimi secoli. La più antica, e la prima per la quale è stato utilizzato il termine di origine latina “acido”, sembra essere l’acido acetico, che si ottiene dalla trasformazione del vino in aceto. Altri acidi, come l’acido solforico e l’acido nitrico, sono conosciuti fin dal tardo medioevo e sono utilizzati in un numero così elevato di processi industriali che, ancora oggi, il grado d’industrializzazione di un paese si misura anche in base alla quantità di H2SO4 prodotta. Gli acidi reagiscono coi metalli, producendo idrogeno, e con il calcare, producendo CO2, ed hanno un sapore aspro.
Anche le basi, un tempo dette alcali, sono sostanze conosciute fin dall’antichità; esse reagiscono con gli acidi, neutralizzandone le proprietà, sono untuosi al tatto ed hanno un sapore amaro. Tuttavia, fino alla seconda metà dell’800 non si era riusciti a comprendere quale relazione esistesse tra la formula di un composto e le sue proprietà acide o basiche. Nel ‘700 Lavoisier riteneva che tutti gli acidi contenessero ossigeno, tanto che, essendo stato tra gli scopritori di questo elemento, lo volle chiamare proprio ossigeno, dal greco oxsus, (acido) e ghennao (generare). Successivamente ci si accorse che i tutti gli acidi contenevano idrogeno e non ossigeno, ma non tutti i composti dell’idrogeno sono acidi.
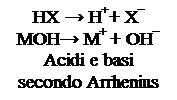 La prima vera teoria chimica sulla natura degli acidi appartiene a Svante Arrhenius, chimico svedese premio nobel, il quale, alla fine dell’800, mostrò che tutti gli acidi liberano in acqua ioni H+, mentre le basi liberano in acqua ioni OH-. Gli acidi binari e gli acidi ternari che già conosciamo rientrano quindi nella definizione di acido data da Arrhenius, mentre gli unici composti che rientrano nella sua definizione di base sono gli idrossidi. La teoria di Arrhenius aveva però molti limiti, primo tra tutti quello di non riuscire a spiegare il comportamento acido o basico al di fuori delle soluzioni acquose. Negli anni ’20 il danese Bronsted e l’inglese Lowry proposero una nuova interpretazione del comportamento acido e basico delle sostanze. La formulazione di tale teoria, che porta il loro nome, è la seguente: si definisce acido una sostanza capace di donare uno ione H+ ad un’altra sostanza; si definisce base una sostanza che accetta questo ione H+ da un acido. Tale teoria svincola quindi il comportamento acido – base dal mezzo acquoso, ed evidenzia come un acido possa esistere solo in presenza di una base e viceversa. Un acido isolato, o contenuto in un recipiente inerte, non può cedere ioni H+ a nessuno e quindi non può manifestare le sue proprietà; lo stesso dicasi per una base. Gli ioni H+ non possono infatti esistere da soli, ma possono solo passare da un acido ad una base, durante una reazione chimica. Difatti, se noi togliamo ad un atomo di idrogeno l’unico elettrone che possiede, ciò che rimane è solo il protone presente nel nucleo. Lo ione H+ è quindi una particella dotata di una carica positiva, ma con dimensioni ridottissime, in quanto il nucleo è circa 10.000 volte più piccolo dell’atomo nel suo insieme. La presenza di una carica elettrica su di un volume così piccolo rende lo ione estremamente instabile e reattivo. Esso cercherà pertanto di legarsi con la prima molecola che incontra.
La prima vera teoria chimica sulla natura degli acidi appartiene a Svante Arrhenius, chimico svedese premio nobel, il quale, alla fine dell’800, mostrò che tutti gli acidi liberano in acqua ioni H+, mentre le basi liberano in acqua ioni OH-. Gli acidi binari e gli acidi ternari che già conosciamo rientrano quindi nella definizione di acido data da Arrhenius, mentre gli unici composti che rientrano nella sua definizione di base sono gli idrossidi. La teoria di Arrhenius aveva però molti limiti, primo tra tutti quello di non riuscire a spiegare il comportamento acido o basico al di fuori delle soluzioni acquose. Negli anni ’20 il danese Bronsted e l’inglese Lowry proposero una nuova interpretazione del comportamento acido e basico delle sostanze. La formulazione di tale teoria, che porta il loro nome, è la seguente: si definisce acido una sostanza capace di donare uno ione H+ ad un’altra sostanza; si definisce base una sostanza che accetta questo ione H+ da un acido. Tale teoria svincola quindi il comportamento acido – base dal mezzo acquoso, ed evidenzia come un acido possa esistere solo in presenza di una base e viceversa. Un acido isolato, o contenuto in un recipiente inerte, non può cedere ioni H+ a nessuno e quindi non può manifestare le sue proprietà; lo stesso dicasi per una base. Gli ioni H+ non possono infatti esistere da soli, ma possono solo passare da un acido ad una base, durante una reazione chimica. Difatti, se noi togliamo ad un atomo di idrogeno l’unico elettrone che possiede, ciò che rimane è solo il protone presente nel nucleo. Lo ione H+ è quindi una particella dotata di una carica positiva, ma con dimensioni ridottissime, in quanto il nucleo è circa 10.000 volte più piccolo dell’atomo nel suo insieme. La presenza di una carica elettrica su di un volume così piccolo rende lo ione estremamente instabile e reattivo. Esso cercherà pertanto di legarsi con la prima molecola che incontra.
Secondo Bronsted e Lowry può quindi avere comportamento acido solo una sostanza nella cui molecola vi sia almeno un atomo di idrogeno legato ad un altro atomo molto elettronegativo: solo così, infatti, si può avere un legame covalente polare, dalla cui rottura possono formarsi ioni H+. Viceversa possono comportarsi da basi solo quelle sostanze che abbiano almeno una coppia di elettroni non impegnata in legami: con tale coppia difatti la sostanza formerà un legame covalente dativo con lo ione H+. La teoria di Bronsted e Lowry ingloba al suo interno anche quella di Arrhenius, infatti in soluzione acquosa un acido, come ad esempio HCl, cede uno ione H+ all’acqua, che in questo caso si comporta da base, formando lo ione H3O+, secondo la reazione:
 HCl +H2O Cl- + H3O+.
HCl +H2O Cl- + H3O+.
L’acqua, in effetti, presenta due coppie di non legame, una delle quali viene impiegata per formare un legame dativo con H+. Viceversa quando mettiamo in acqua una base, ad esempio NH3, questa acquista un elettrone dall’acqua, che in questo caso si comporta da acido, secondo la reazione:
 NH3 + H2O NH+4 + OH-.
NH3 + H2O NH+4 + OH-.
Poiché tutte le reazioni acido – base sono riconducibili ad uno scambio di protoni, esse possono essere rappresentate dalla reazione generica
 HA + B BH+ + A-.
HA + B BH+ + A-.
 Da quest’equazione si può osservare come i prodotti del passaggio dello ione H+ siano a loro volta un acido ed una base. BH+ è in realtà un acido, in quanto può cedere uno ione H+, mentre A- è una base, perché possiede una coppia di non legame con cui può legare uno ione H+. La sostanza BH+ prende quindi il nome di acido coniugato della base B, mentre la sostanza A- si dice base coniugata dell’acido HA. La nuova coppia acido – base che si forma può dare luogo alla reazione inversa finché il sistema raggiunge l’equilibrio, come viene evidenziato dalla presenza della doppia freccia nell’equazione chimica corrispondente. Alla luce di questa nuova considerazione possiamo rianalizzare anche le due reazioni con l’acqua precedentemente citate:
Da quest’equazione si può osservare come i prodotti del passaggio dello ione H+ siano a loro volta un acido ed una base. BH+ è in realtà un acido, in quanto può cedere uno ione H+, mentre A- è una base, perché possiede una coppia di non legame con cui può legare uno ione H+. La sostanza BH+ prende quindi il nome di acido coniugato della base B, mentre la sostanza A- si dice base coniugata dell’acido HA. La nuova coppia acido – base che si forma può dare luogo alla reazione inversa finché il sistema raggiunge l’equilibrio, come viene evidenziato dalla presenza della doppia freccia nell’equazione chimica corrispondente. Alla luce di questa nuova considerazione possiamo rianalizzare anche le due reazioni con l’acqua precedentemente citate:
 In ogni reazione acido base vi sono quindi due acidi e due basi, mentre le coppie HCl/Cl- e NH3/NH4+, costituite da due sostanze che differiscono solo per uno ione H+, si definiscono coppie coniugate acido – base.
In ogni reazione acido base vi sono quindi due acidi e due basi, mentre le coppie HCl/Cl- e NH3/NH4+, costituite da due sostanze che differiscono solo per uno ione H+, si definiscono coppie coniugate acido – base.
In entrambe le reazioni è presente l’acqua, che si comporta da base alla presenza di un acido, mentre si comporta da acido alla presenza di una base; tale comportamento si definisce anfotero.
Nella trattazione successiva considereremo solamente acidi e basi in soluzione acquosa. Pur avendo presenta la teoria di Bronsted e Lowry, e le considerazioni sulla natura di H+, nelle pagine che seguono utilizzeremo i concetti di Arrhenius. Descriveremo quindi le dissociazioni degli acidi e delle basi senza contarvi l’acqua. In tal senso le soluzioni degli acidi conterranno ioni H+, mentre quelle delle basi conterranno ioni OH-.
Carattere acido e basico di un composto
Elencheremo di seguito alcune semplici considerazioni che possono aiutarci a capire, dalla sua formula chimica, quale sia il comportamento acido – base di un composto. A tale fine 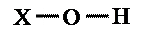 consideriamo un composto generico dell’idrogeno di formula XOH. L’ossigeno è molto elettronegativo ed ha quindi una forte tendenza ad attrarre su di se sia gli elettroni del legame con X, sia quelli del legame con H.
consideriamo un composto generico dell’idrogeno di formula XOH. L’ossigeno è molto elettronegativo ed ha quindi una forte tendenza ad attrarre su di se sia gli elettroni del legame con X, sia quelli del legame con H.
F Se anche X è un elemento molto elettronegativo, come quelli posti in alto a destra nella tabella periodica, l’ossigeno ha difficoltà ad attirare su di se gli elettroni del legame X─O ed attirerà pertanto solo gli elettroni del legame O−H. In tal modo il legame con l’idrogeno diviene fortemente polarizzato, s’indebolisce, e facilmente si rompe a contatto con H2O o con una base; il composto è allora una acido ed in acqua darà luogo alla seguente reazione:
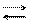 X−O−H X−O– + H+.
X−O−H X−O– + H+.
Il composto è quindi un acido. Tanto più il legame O─H è debole, perché molto polarizzato, tanto maggiore sarà la tendenza a cedere ioni H+, tanto più forte sarà il carattere acido della sostanza. Composti di questo tipo sono, ad esempio, HClO, HNO3, H2SO4 e tutti gli altri acidi ternari.
F Se viceversa X è un metallo dei primi due gruppi, oppure è un metallo di transizione, il suo valore d’elettronegatività è basso, inferiore a quello dell’idrogeno; in questo caso l’ossigeno attira gli elettroni del legame X−O più fortemente di quelli del legame O−H. Il primo legame sarà quindi più debole del secondo ed in acqua si romperà secondo la reazione:
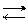 X−O−H X+ + O−H–
X−O−H X+ + O−H–
In tal caso il composto è chiaramente una base. Si comportano in questo modo sostanze come NaOH, Ca(OH)2, Fe(OH)3 e tutti gli altri idrossidi.
F Se infine X è un elemento di elettronegatività intermedia, il composto XOH è un elettrolita anfotero, si comporta cioè da base in presenza di un acido e da acido in presenza di una base. Un esempio di composti di questo tipo è proprio l’acqua, nella quale l’elemento X è appunto l’idrogeno.
Possiamo riassumere dicendo che: un generico composto X−O−H assume un comportamento acido, basico o anfotero, a seconda che l’elemento X abbia un valore d’elettronegatività alto, basso o intermedio (più precisamente maggiore, minore o uguale a quello dell’elettronegatività dell’idrogeno).
Negli acidi binari non c’è ossigeno, ma l’idrogeno è direttamente legato ad un elemento molto elettronegativo con un legame covalente polare. In presenza di una base tale legame si rompe e l’acido cede lo ione H+ alla base. Reazioni di questo tipo sono già state descritte nelle pagine precedenti.
La forza degli acidi e delle basi
 Gli acidi e le basi sono elettroliti, in quanto in acqua danno luogo ad ioni, e possono essere elettroliti forti o deboli, a seconda che si dissocino molto o poco. Poiché nella loro dissociazione liberano rispettivamente ioni H+ e OH-, misurando la loro forza come elettroliti misuriamo anche la loro forza come acidi o basi. Infatti un acido, o una base, è forte se in acqua dissocia un’alta percentuale delle sue molecole ovvero se l’equilibrio della sua reazione di dissociazione è completamente spostato a destra e quindi il valore della costante di equilibrio è alto. Viceversa un acido, o una base, è debole se in acqua dissocia poche molecole ovvero se l’equilibrio di dissociazione è spostato a sinistra ed ha una costante bassa. Vediamo adesso se è possibile trarre qualche conclusione sulla forza di un composto acido o basico dall’analisi della sua formula chimica.
Gli acidi e le basi sono elettroliti, in quanto in acqua danno luogo ad ioni, e possono essere elettroliti forti o deboli, a seconda che si dissocino molto o poco. Poiché nella loro dissociazione liberano rispettivamente ioni H+ e OH-, misurando la loro forza come elettroliti misuriamo anche la loro forza come acidi o basi. Infatti un acido, o una base, è forte se in acqua dissocia un’alta percentuale delle sue molecole ovvero se l’equilibrio della sua reazione di dissociazione è completamente spostato a destra e quindi il valore della costante di equilibrio è alto. Viceversa un acido, o una base, è debole se in acqua dissocia poche molecole ovvero se l’equilibrio di dissociazione è spostato a sinistra ed ha una costante bassa. Vediamo adesso se è possibile trarre qualche conclusione sulla forza di un composto acido o basico dall’analisi della sua formula chimica.
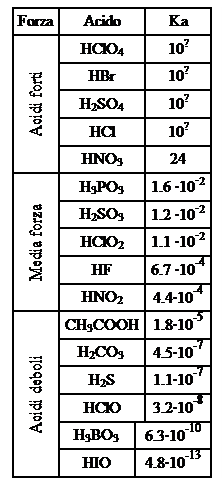
FPartiamo dagli acidi ternari, cominciando col prenderne in esame tre, di formula simile, appartenenti a tre elementi del settimo gruppo: H−O−Cl, H−O−Br e H−O−I. La loro forza è determinata dall’elettronegatività del non metallo: tanto più fortemente quest’elemento attirerà gli elettroni di legame con l’ossigeno, tanto più l’ossigeno stesso scaricherà la sua tendenza attrattiva sul legame H−O indebolendolo e rendendo così la sostanza facilmente dissociabile.
 Consideriamo adesso i quattro acidi ternari del cloro: HClO; HClO2; HClO3 e HClO4;
Consideriamo adesso i quattro acidi ternari del cloro: HClO; HClO2; HClO3 e HClO4;
In questi quattro acidi legato al gruppo OH vi è sempre il cloro, il quale però lega a sua volta un numero differente di atomi di ossigeno non protonati, cioè non legati direttamente con atomi di idrogeno. Gli atomi d’ossigeno non protonati attirano gli elettroni dei legami col cloro, provocando una diminuzione della densità di carica elettrica su quest’elemento, il quale si rifà, attirando con maggior forza gli elettroni che lo legano all’ossigeno del gruppo OH. A sua volta l’ossigeno del gruppo OH finisce per scaricare tutta la propria forza attrattiva sul legame con l’idrogeno, che diventa molto polarizzato e s’indebolisce, rendendo l’acido più forte.
Riassumendo possiamo dire che: la forza degli acidi ternari aumenta all’aumentare dell’elettronegatività del non metallo e del numero di atomi di ossigeno non protonati che si legano ad esso. La forza degli acidi pertanto diminuisce nell’ordine seguente:
HClO>HBrO>HIO
HClO4> HClO3>HClO2> HClO
FNegli acidi binari invece la situazione può essere riassunta in questa maniera: la forza degli acidi binari aumenta spostandosi da sinistra a destra lungo un periodo e scendendo lungo un gruppo. Per ciò che riguarda gli elementi del settimo gruppo, la forza degli acidi aumenta pertanto nel modo seguente:
HI>HBr>HCl>HF
Ciò è determinato dal fatto che per gli elementi più in alto nel gruppo entra in azione il legame idrogeno, che stabilizza la molecola, rendendo più difficile la cessione del protone.
 FOccupiamoci infine degli idrossidi, le basi più diffuse, e le uniche di cui ci occuperemo specificatamente. Al diminuire dell’elettronegatività del metallo, aumenta la tendenza a cedere all’ossigeno gli elettroni del legame M−OH; da ciò deriva che il composto si dissocerà più facilmente secondo la reazione M−O−H M+ + O−H– e sarà dunque una base più forte. Ricordando come varia l’elettronegatività all’interno della tabella periodica, possiamo riassumere dicendo che: la forza degli idrossidi come basi aumenta scendendo lungo un gruppo, mentre diminuisce spostandosi da sinistra verso destra in un periodo. Nel primo gruppo quindi la forza basica degli idrossidi aumenta come segue:
FOccupiamoci infine degli idrossidi, le basi più diffuse, e le uniche di cui ci occuperemo specificatamente. Al diminuire dell’elettronegatività del metallo, aumenta la tendenza a cedere all’ossigeno gli elettroni del legame M−OH; da ciò deriva che il composto si dissocerà più facilmente secondo la reazione M−O−H M+ + O−H– e sarà dunque una base più forte. Ricordando come varia l’elettronegatività all’interno della tabella periodica, possiamo riassumere dicendo che: la forza degli idrossidi come basi aumenta scendendo lungo un gruppo, mentre diminuisce spostandosi da sinistra verso destra in un periodo. Nel primo gruppo quindi la forza basica degli idrossidi aumenta come segue:
KOH>NaOH>LiOH
Gli equilibri acido - base
Anche per le reazioni acido – base è possibile scrivere una costante d’equilibrio, che misura quanto la reazione sia avvenuta. La posizione dell’equilibrio (a destra o a sinistra) dipende simultaneamente sia dalla tendenza dell’acido a cedere lo ione H+(che è poi la forza dell’acido), che dalla tendenza della base ad accettarlo (che è poi la forza della base); naturalmente l’equilibrio è tanto più spostato a destra quanto maggiori sono tali tendenze. Quindi, essendo due le sostanze che con le loro caratteristiche influenzano l’andamento dell’equilibrio, non esiste una tendenza assoluta a cedere o ad accettare ioni H+, non è pertanto possibile misurare neppure una forza assoluta degli acidi o delle basi. Del resto, a pagina due abbiamo già visto che un acido può esistere solo in presenza di una base e viceversa, mentre i composti anfoteri si comportano da acido o da base a seconda delle sostanze con cui vengono messi a confronto. La determinazione della forza di un acido o di una base viene dunque fatta misurando la tendenza delle sostanze a donare o ad acquistare un protone nei confronti di una medesima sostanza presa come riferimento. Poiché gli acidi e le basi si sciolgono in acqua, e la maggior parte delle reazioni acido – base avviene in soluzione acquosa, l’acqua è stata presa come sostanza di riferimento per misurare la forza di un acido o di una base. Questo del resto concorda con quanto abbiamo detto all’inizio del paragrafo precedente, quando abbiamo posto l’accento sulla natura elettrolitica degli acidi e delle basi, per cui la costante d’equilibrio della reazione di dissociazione in acqua di un acido o di una base viene presa come misura della forza di quell’acido o di quella base in acqua.
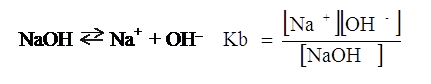 Dato quindi un generico acido, HNO3 ad esempio, ed utilizzando la notazione di Arrhenius, la Keq della sua reazione di dissociazione in acqua prende il nome di costante di dissociazione acida o meglio di costante acida e s’indica con Ka.
Dato quindi un generico acido, HNO3 ad esempio, ed utilizzando la notazione di Arrhenius, la Keq della sua reazione di dissociazione in acqua prende il nome di costante di dissociazione acida o meglio di costante acida e s’indica con Ka.
 Data invece una base generica, NaOH ad esempio, la Keq della sua reazione di dissociazione in acqua prende il nome di costante di dissociazione basica o meglio di costante basica e s’indica con Kb.
Data invece una base generica, NaOH ad esempio, la Keq della sua reazione di dissociazione in acqua prende il nome di costante di dissociazione basica o meglio di costante basica e s’indica con Kb.
Un gran valore di Ka o Kb (>1) significa che la reazione di dissociazione è spostata a destra: si parla in questi casi di acidi o basi forti o fortissimi; viceversa, valori piccoli di Ka o Kb (<10-4) indicano acidi o basi deboli o debolissimi. Nei casi intermedi si hanno acidi o basi di media forza.
La dissociazione dell’acqua
Come già sappiamo l’acqua è un composto anfotero, che come tale quindi si comporta da acido con le basi, donando loro uno ione H+, mentre si comporta da base con gli acidi, accettandone lo ione H+. Per potersi comportare così l’acqua deve avere sia le caratteristiche delle basi, sia quelle degli acidi, così come sono state descritte nei paragrafi precedenti. Limitiamoci ancora una volta alla trattazione di Arrhenius. In effetti l’acqua spontaneamente da luogo alla seguente reazione di dissociazione:
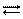 H2O H++ OH–
H2O H++ OH–
per la quale è possibile scrivere la seguente costante d’equilibrio:
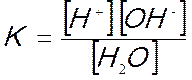 L’equilibrio è completamente spostato a sinistra, le molecole di acqua che si dissociano sono infatti pochissime, circa una ogni 10 milioni; la concentrazione molare dell’acqua resta quindi praticamente sempre costante e pertanto anche il suo prodotto con la costante di dissociazione è costante:
L’equilibrio è completamente spostato a sinistra, le molecole di acqua che si dissociano sono infatti pochissime, circa una ogni 10 milioni; la concentrazione molare dell’acqua resta quindi praticamente sempre costante e pertanto anche il suo prodotto con la costante di dissociazione è costante:
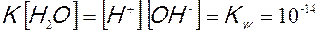
questa espressione prende il nome di prodotto ionico dell’acqua.
Il carattere anfotero dell’acqua può essere dunque spiegato dal fatto che essa sempre presenta al suo interno quantità, sia pur piccolissime, di ioni H+ e OH–. Poiché dalla dissociazione di una molecola di acqua otteniamo uno ione H+ ed uno ione OH-, la loro concentrazione nell’acqua pura è costante ed uguale a 10-7molare.
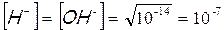
Tale uguaglianza è valida solo per l’acqua pura, se infatti mettiamo nell’acqua un acido la concentrazione degli ioni H+ aumenta, viceversa se mettiamo una base aumenta invece la concentrazione degli ioni OH–. Tuttavia in qualunque soluzione acquosa, acida, basica o neutra, il prodotto della concentrazione molare degli ioni H+ per la concentrazione molare degli ioni OH- è costante e vale 10-14. [H+] e [ OH–] sono infatti inversamente proporzionali ed il fattore di proporzionalità è 10-14; il loro prodotto è infatti costante, indipendentemente dal valore assunto dai due fattori. A questo punto, nota la concentrazione di uno dei due ioni è facile calcolare la concentrazione dell’altro, matematicamente risulta infatti che :
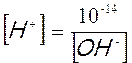
Soluzioni acide, neutre e basiche. Il pH.
Lo ione H+ viene chiamato idrogenione, mentre lo ione OH– viene chiamato ossidrilione. Poiché i valori della concentrazione idrogenionica e ossidrilionica sono legati tra loro dall’espressione del prodotto ionico dell’acqua, per caratterizzare le proprietà acido base di una soluzione acquosa è sufficiente fare riferimento ad una sola delle due concentrazioni. A tale scopo viene convenzionalmente utilizzata la concentrazione idrogenionica.
F Se in una soluzione la concentrazione idrogenionica è uguale a quella ossidrilionica, ed entrambe valgono 10-7M, cioè se [H+]=[ OH–]=10-7, la soluzione si dice neutra.
F Se viceversa la concentrazione idrogenionica è maggiore di quella ossidrilionica, ed è pertanto maggiore di 10-7M, cioè se [H+]>[ OH–] e [H+]>10-7, la soluzione si dice acida.
 F Se infine la concentrazione idrogenionica è minore di quella ossidrilionica, ed è pertanto minore di 10-7M, cioè se [H+]< [ OH–] e [H+]<10-7, la soluzione si dice basica.
F Se infine la concentrazione idrogenionica è minore di quella ossidrilionica, ed è pertanto minore di 10-7M, cioè se [H+]< [ OH–] e [H+]<10-7, la soluzione si dice basica.
Per evitare di utilizzare le potenze negative di 10, oppure numeri preceduti da tanti zeri, nel misurare la concentrazione idrogenionica di una soluzione si utilizza una scala logaritmica in base 10. Ricordiamo che matematicamente si definisce logaritmo in base 10 di un numero X l’esponente che dobbiamo dare a 10 per avere X, risulta cioè che:
se Log10 X = a allora 10a = X
in questo senso quindi Log10 10-7 = -7 Log10 10-14 = -14 e Log10 1 = 0
I logaritmi vengono comunemente utilizzati quando si ha a che fare con grandezze che hanno una ampia scala di variazione, proprio per evitare di utilizzare numeri esponenziali.
F In chimica si definisce pH di una soluzione il logaritmo cambiato di segno della sua concentrazione idrogenionica ovvero pH = - Log10 [H+].
 Utilizzando il pH possiamo quindi affermare che una soluzione è:
Utilizzando il pH possiamo quindi affermare che una soluzione è:
 acida se il suo pH è minore di 7
acida se il suo pH è minore di 7- neutra se il suo pH è uguale a 7
- basica se il suo pH è maggiore di 7
Il pH può assume anche valori decimali, come risulta dalla tabella in cui si riportano i valori del pH per alcuni prodotti di uso comune.
Il pH si misura attraverso delle sostanze, dette indicatori, che variano il proprio colore a seconda dell'acidità o della basicità della soluzione o della sostanza con cui vengono messe a contatto. Esistono vari tipi di indicatori, ognuno dei quali viene utilizzato per misurare uno specifico valore di pH, detto punto di viraggio, a cui avviene il cambiamento di colore. Uno degli indicatori più diffusi è il tornasole, sostanza colorata di origine naturale, che assume il colore azzurro in ambiente basico (cioè per pH>7), mentre diventa rossa in ambiente acido (cioè per pH<7). Essa viene comunemente utilizzata per impregnare strisce di carta, dette per questo cartine al tornasole, che risultano molto pratiche per misure di pH rapide, anche se grossolane: con esse infatti si può stabilire solo se il pH è maggiore o minore di 7, senza ottenerne però una misura precisa. Molto più preciso è invece l'indicatore universale, costituito da una miscela di vari indicatori, con differenti punti di viraggio, che assume quindi colori differenti al variare del pH. Ancora più pratico e preciso è il pH - metro, uno strumento elettronico dotato di una sonda, che si immerge nella soluzione, e di un display sul quale si legge il valore di pH misurato.
Il calcolo del pH di una soluzione
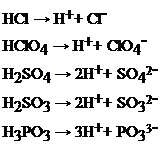 Il pH di una soluzione dipende dalla concentrazione degli ioni H+ presenti al suo interno. Se la soluzione contiene al suo interno un acido, il suo pH sarà <7, mentre se contiene una base il suo pH sarà invece >7. I vari acidi possono liberare un numero variabile di ioni H+ a seconda del numero di atomi di idrogeno presenti nella loro formula. Così, ad esempio, acidi come HCl, HNO3 o HClO4 liberano uno ione per molecola e si definiscono monoprotici, acidi come H2SO4 o H2SO3 liberano due ioni H+ per molecola e si definiscono biprotici, mentre acidi come H3PO4 liberano tre ioni H+ per molecola e si definiscono triprotici. Per gli acidi poliprotici (biprotici e triprotici) si debbono scrivere tanti equilibri diversi quanti sono gli ioni H+ ceduti; per ognuno di essi si definisce una Ka, il cui valore diviene progressivamente più basso, mano e mano che si sono già ceduti ioni H+. La cosa diverrebbe a questo punto piuttosto complessa, per cui nella trattazione successiva ci limiteremo a considerare solo acidi monoprotici.
Il pH di una soluzione dipende dalla concentrazione degli ioni H+ presenti al suo interno. Se la soluzione contiene al suo interno un acido, il suo pH sarà <7, mentre se contiene una base il suo pH sarà invece >7. I vari acidi possono liberare un numero variabile di ioni H+ a seconda del numero di atomi di idrogeno presenti nella loro formula. Così, ad esempio, acidi come HCl, HNO3 o HClO4 liberano uno ione per molecola e si definiscono monoprotici, acidi come H2SO4 o H2SO3 liberano due ioni H+ per molecola e si definiscono biprotici, mentre acidi come H3PO4 liberano tre ioni H+ per molecola e si definiscono triprotici. Per gli acidi poliprotici (biprotici e triprotici) si debbono scrivere tanti equilibri diversi quanti sono gli ioni H+ ceduti; per ognuno di essi si definisce una Ka, il cui valore diviene progressivamente più basso, mano e mano che si sono già ceduti ioni H+. La cosa diverrebbe a questo punto piuttosto complessa, per cui nella trattazione successiva ci limiteremo a considerare solo acidi monoprotici.
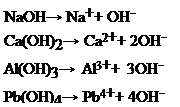 e si definiscono monoacide, idrossidi come Ca(OH)2 o Mg(OH)2 liberano due ioni OH- per unità di formula e si definiscono biacide , infine idrossidi come Al(OH)3 o Pb(OH)4 liberano rispettivamente tre e quattro ioni OH- per unità di formula e si definiscono quindi triacide o tetracide. Anche per le basi poliacide si debbono scrivere tanti equilibri diversi quanti sono gli ioni OH- ceduti, per ognuno di essi si definisce una Kb, il cui valore diviene progressivamente più basso, mano e mano che si sono già ceduti ioni OH-. Tuttavia, per quanto già detto a proposito degli acidi poliprotici, nella trattazione successiva ci limiteremo a considerare solo idrossidi monoacidi.
e si definiscono monoacide, idrossidi come Ca(OH)2 o Mg(OH)2 liberano due ioni OH- per unità di formula e si definiscono biacide , infine idrossidi come Al(OH)3 o Pb(OH)4 liberano rispettivamente tre e quattro ioni OH- per unità di formula e si definiscono quindi triacide o tetracide. Anche per le basi poliacide si debbono scrivere tanti equilibri diversi quanti sono gli ioni OH- ceduti, per ognuno di essi si definisce una Kb, il cui valore diviene progressivamente più basso, mano e mano che si sono già ceduti ioni OH-. Tuttavia, per quanto già detto a proposito degli acidi poliprotici, nella trattazione successiva ci limiteremo a considerare solo idrossidi monoacidi.
Tanto gli acidi, quanto le basi, possono essere forti o deboli, a seconda del valore assunto rispettivamente dalla loro Ka o Kb. Per gli acidi e le basi forti o fortissimi si può ritenere che essi siano completamente dissociati nella soluzione, ciò significa che per ogni molecola di acido che si scioglie nella soluzione si ottiene uno ione H+, mentre per ogni unità di formula dell'idrossido che si scioglie in soluzione si ottiene uno ione OH-. Per gli acidi e le basi intermedi o deboli la trattazione diviene più complessa, per cui, da ora in avanti, ci limiteremo a considerare solo acidi e basi forti o fortissimi.
Proviamo adesso a calcolare il pH di una soluzione, ricordando che esso rappresenta una grandezza intensiva della soluzione, in quanto dipende solo dalla concentrazione degli ioni H+ e non dal quantitativo di soluzione preso in esame.
Acidi forti o fortissimi
Come abbiamo già detto, essi risultano completamente dissociati in soluzione, pertanto la concentrazione molare dello ione H+ è identica a quella dell'acido stesso. Data quindi una soluzione 0,1 M di HCl, si ha che [H+]= 0,1 = 10-1 e conseguentemente il pH della soluzione è 1.
Basi forti e fortissime
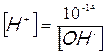 Anch'esse risultano completamente dissociate in soluzione, stavolta però la concentrazione dell'idrossido è equivalente a quella degli ioni OH-; per ottenere quindi la concentrazione degli ioni H+ è necessario utilizzare l'equazione introdotta a pagina 6. Data quindi una soluzione 0,1 M di NaOH, si ha che [OH-] = 0,1 = 10-1, da ciò deriva che [H+] = 10-13 e conseguentemente il pH della soluzione è 13.
Anch'esse risultano completamente dissociate in soluzione, stavolta però la concentrazione dell'idrossido è equivalente a quella degli ioni OH-; per ottenere quindi la concentrazione degli ioni H+ è necessario utilizzare l'equazione introdotta a pagina 6. Data quindi una soluzione 0,1 M di NaOH, si ha che [OH-] = 0,1 = 10-1, da ciò deriva che [H+] = 10-13 e conseguentemente il pH della soluzione è 13.
La neutralizzazione e le titolazioni
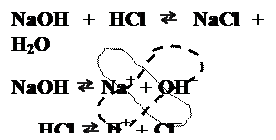 Facendo reagire un acido con una base i due composti tendono ad annullarsi a vicenda; se tale reazione avviene in soluzione acquosa, da essa si originano, come sappiamo, un sale e dell'acqua. Lo ione OH–, proveniente dalla dissociazione della base, si combina infatti con lo ione H+, proveniente dalla dissociazione dell'acido, formando così l'acqua; allo stesso modo il catione proveniente dalla base si combina con l'anione derivante dall'acido, formando il sale.
Facendo reagire un acido con una base i due composti tendono ad annullarsi a vicenda; se tale reazione avviene in soluzione acquosa, da essa si originano, come sappiamo, un sale e dell'acqua. Lo ione OH–, proveniente dalla dissociazione della base, si combina infatti con lo ione H+, proveniente dalla dissociazione dell'acido, formando così l'acqua; allo stesso modo il catione proveniente dalla base si combina con l'anione derivante dall'acido, formando il sale.
Consideriamo di utilizzare da ora in poi acidi e basi forti, che quindi in soluzione risultano completamente dissociati; se nella soluzione abbiamo uno stesso numero di molecole di acido e di base , esse vicendevolmente si neutralizzeranno e la soluzione risultante sarà così neutra (pH =7). Se invece le molecole di acido sono più di quelle della base, la soluzione finale sarà acida e con pH tanto minore quanto più l'acido supera la base; se al contrario le molecole di base sono più di quelle dell'acido, la soluzione è basica e con pH tanto maggiore quanto più la base sovrasta l'acido. Reazioni di questo tipo prendono il nome di reazioni di neutralizzazione.
 Le reazioni di neutralizzazione vengono utilizzate anche per determinare la concentrazione incognita di una soluzione; in questo caso la reazioni di neutralizzazione prende il nome di titolazione, in quanto con essa si cerca di determinare la concentrazione o titolo di una soluzione.
Le reazioni di neutralizzazione vengono utilizzate anche per determinare la concentrazione incognita di una soluzione; in questo caso la reazioni di neutralizzazione prende il nome di titolazione, in quanto con essa si cerca di determinare la concentrazione o titolo di una soluzione.
![]()
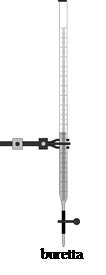 Immaginiamo ad esempio di voler determinare il titolo incognito di una soluzione di un acido forte; poiché quest'ultimo è completamente dissociato, la sua concentrazione corrisponde a quella dello ione H+. Prendiamo quindi un determinato volume della soluzione da titolare ed aggiungiamoci alcune gocce di un indicatore che cambi colore intorno a pH 7. Aggiungiamo poi, goccia a goccia, una soluzione a titolo noto di una base forte; per far ciò utilizziamo una buretta, cioè un tubo graduato, chiuso in basso da un rubinetto, che ci consente di conoscere il volume via via aggiunto. Poiché la base forte è completamente dissociata, con la sua aggiunta, di fatto, aggiungiamo ioni OH- alla soluzione da titolare. Questi si legano agli ioni H+ dell'acido, formando acqua e facendone diminuire la concentrazione, conseguentemente il pH della soluzione aumenta. Continuiamo l'aggiunta fino a quando il pH non raggiunge il valore 7, fatto testimoniato dal viraggio dell'indicatore. Conoscendo il volume e la concentrazione della soluzione basica che abbiamo aggiunto, conosciamo anche le moli di OH- aggiunte grazie alla relazione (1):
Immaginiamo ad esempio di voler determinare il titolo incognito di una soluzione di un acido forte; poiché quest'ultimo è completamente dissociato, la sua concentrazione corrisponde a quella dello ione H+. Prendiamo quindi un determinato volume della soluzione da titolare ed aggiungiamoci alcune gocce di un indicatore che cambi colore intorno a pH 7. Aggiungiamo poi, goccia a goccia, una soluzione a titolo noto di una base forte; per far ciò utilizziamo una buretta, cioè un tubo graduato, chiuso in basso da un rubinetto, che ci consente di conoscere il volume via via aggiunto. Poiché la base forte è completamente dissociata, con la sua aggiunta, di fatto, aggiungiamo ioni OH- alla soluzione da titolare. Questi si legano agli ioni H+ dell'acido, formando acqua e facendone diminuire la concentrazione, conseguentemente il pH della soluzione aumenta. Continuiamo l'aggiunta fino a quando il pH non raggiunge il valore 7, fatto testimoniato dal viraggio dell'indicatore. Conoscendo il volume e la concentrazione della soluzione basica che abbiamo aggiunto, conosciamo anche le moli di OH- aggiunte grazie alla relazione (1):
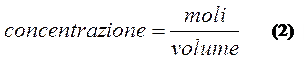 Questo numero corrisponde al numero di moli di ioni H+ presenti inizialmente, il pH infatti raggiunge il valore 7 perché gli ioni OH- addizionati hanno completamente neutralizzato gli ioni H+ iniziali; tale numero corrisponde quindi anche al numero di moli di acido nella soluzione da titolare. Adesso sappiamo il numero di moli dell'acido ed il volume iniziale della soluzione, possiamo quindi ricavarci la sua concentrazione dalla relazione (2):
Questo numero corrisponde al numero di moli di ioni H+ presenti inizialmente, il pH infatti raggiunge il valore 7 perché gli ioni OH- addizionati hanno completamente neutralizzato gli ioni H+ iniziali; tale numero corrisponde quindi anche al numero di moli di acido nella soluzione da titolare. Adesso sappiamo il numero di moli dell'acido ed il volume iniziale della soluzione, possiamo quindi ricavarci la sua concentrazione dalla relazione (2):
![]() In verità esiste un metodo più semplice per risolvere il problema: come abbiamo già detto, quando si raggiunge il pH 7 il numero di moli di OH- aggiunte è uguale a quello di H+ iniziali e quindi le moli aggiunte della base sono uguali a quelle iniziali dell'acido da titolare; applicando la relazione (1) ad entrambi questi numeri di moli otteniamo la relazione (3):
In verità esiste un metodo più semplice per risolvere il problema: come abbiamo già detto, quando si raggiunge il pH 7 il numero di moli di OH- aggiunte è uguale a quello di H+ iniziali e quindi le moli aggiunte della base sono uguali a quelle iniziali dell'acido da titolare; applicando la relazione (1) ad entrambi questi numeri di moli otteniamo la relazione (3):
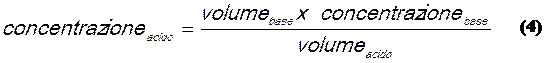 che possiamo utilizzare per trovare la concentrazione incognita dell'acido in funzione delle altre tre grandezze:
che possiamo utilizzare per trovare la concentrazione incognita dell'acido in funzione delle altre tre grandezze:
La relazione (3) è di fondamentale importanza per la soluzione degli esercizi sulle titolazioni acido base, in essa infatti compaiono quattro grandezze, ognuna delle quali è ricavabile se conosco le altre tre.
Gli esercizi sulle titolazioni acido base
Nell'esercizio appena svolto conoscevamo il volume della soluzione acida, il volume e la concentrazione della soluzione basica, mentre l'incognita era la concentrazione della soluzione acida. In verità possiamo incontrare altri tre tipi di esercizi nei quali, utilizzando l'espressione (3), ricaviamo una grandezza incognita dalla conoscenza delle altre tre.
Immaginiamo ad esempio di avere una soluzione basica di concentrazione incognita e di volerla titolare con una soluzione acida di concentrazione nota. In questo caso la situazione è esattamente opposta alla precedente e la formula da applicare è la seguente:- Immaginiamo ad esempio di avere un volume noto di una soluzione di un acido di concentrazione nota e di voler sapere quanti millilitri di soluzione di una base di concentrazione nota sono necessari per titolarla. :
Immaginiamo infine di avere un volume noto di una soluzione basica di concentrazione nota e di voler sapere quanti millilitri di soluzione acida di concentrazione nota sono necessari per titolarla. In questo caso l'incognita è il volume della soluzione acida utilizzata per titolare e la formula da utilizzare è la seguente:
ESERCIZI PER CASA
Calcolo del pH
- Quale è la concentrazione di ioni H+ in una soluzione che contiene 0.1825 g di acido cloridrico in 500 mL di soluzione. (R: 0.01M)
- Calcolare la concentrazione di ioni H+ in una soluzione che contiene 0.63 g di acido nitrico in 2000 mL di soluzione. (R: 0.05 M)
- Calcolare la concentrazione di ioni H+ in una soluzione che contiene 0,12 g di idrossido di litio in 500 mL di soluzione (R: 10-12M)
- Indicare la concentrazione di ioni H+ di una soluzione che contiene 0,112 g di idrossido di potassio in 2000 mL di soluzione (R: 10-11M)
- Calcolare il pH di una soluzione ottenuta sciogliendo 10 g di acido cloridrico in 700 mL di soluzione. (PM HCl 36.5 g) (R: 0.4)
- Calcolare il pH di una soluzione ottenuta sciogliendo 5 g di idrossido di sodio in 80 cL di acqua. (R: 13.2)
- Calcolare il pH di una soluzione che contiene 0.365 g di acido cloridrico in 1 L di soluzione (R: 2)
- Calcolare il pH di una soluzione che contiene 0.1825 g di acido cloridrico in 0.5 L di soluzione (R: 2).
- Calcolare il pH di una soluzione che contiene 5.56 g di acido cloridrico in 600 mL di soluzione (R: 0.60).
- Calcolare il pH di una soluzione che contiene 0.08 g di idrossido di sodio in 2 L di soluzione (R: 11).
- Calcolare il pH di una soluzione che contiene 0.063 g di acido nitrico in 100 mL di soluzione (R: 2).
- Calcolare il pH di una soluzione 3.9·10- 3M di idrossido di sodio (R:11.59)
- Calcolare il pH di una soluzione ottenuta sciogliendo 0.378 g di acido nitrico in 60 mL di soluzione. (R: 1).
- Calcolare il pH di una soluzione ottenuta sciogliendo 20 g di idrossido di sodio in 500 cc di soluzione. (R: 14)
- Calcolare i milligrammi di idrossido di potassio contenuti in 100 mL di soluzione a pH 11
(R: 5.6 mg).
- Calcolare i milligrammi di idrossido di sodio contenuti in 200 mL di soluzione a pH 11
(R: 8 mg).
- Calcolare i grammi di idrossido di sodio contenuti in 1 L di soluzione a pH 13 (R: 4 g).
- Calcolare i grammi di acido cloridrico contenuti in 0.5 L di soluzione a pH 3 (R: 0.182 g).
Titolazioni acido base
- Per titolate 25 mL di una soluzione di idrossido di potassio sono necessari 35mL di acido cloridrico 0.15 M. Calcolare la molarità della soluzione di idrossido di potassio. (R:0.21 M)
- Se 40 mL di acido cloridrico 1 M vengono neutralizzati da 25 mL di NaOH, quale sarà la concentrazione della soluzione di idrossido di sodio? (R: 1.6 M)
- Per neutralizzare 25.4 mL di idrossido di sodio 0.15 M quanti mL di acido cloridrico 0.18 M occorrono? (R: 21.2mL)
- Calcolare il volume di una soluzione di acido cloridrico 0.2 M necessario per neutralizzare 200 cm3 di una soluzione 0.2M di idrossido di sodio. (R:200 cm3)
- Calcolare il volume di acido cloridrico 0.5 M necessario per titolare 70 mL di idrossido di potassio 1M. (R:140 mL).
- Calcolare il volume di idrossido di sodio 0.25 M necessario per titolare 60 mL di acido bromidrico 0.35 M (R: 84 mL).
- Calcolare il volume di idrossido di sodio 1.25 M necessario per titolare 80 mL di acido nitrico 1.5 M (R: 96 mL).
- Calcolare il volume di idrossido di sodio 0.1 M necessario per titolare 40 mL di acido nitrico 0.15 M (R: 60 mL).
- Calcolare quanti grammi di acido cloridrico sono contenuti in 25 mL di una soluzione che richiedono per la titolazione 50 mL di idrossido di sodio 0.05 M. (R:0.091g)
- Calcolare la molarità di una soluzione di acido cloridrico sapendo che 25 mL di essa sono stati titolati con 100 mL di idrossido di potassio 0.025 M (R: 0.1M)
- Titoliamo 100 mL di acido cloridrico 0.1 M con una soluzione di idrossido di potassio 0.1 M. Calcolare:
- Il pH della soluzione dopo l’aggiunta di 99 mL della soluzione di idrossido di potassio. (R: 3.3)
- Il pH della soluzione dopo l’aggiunta di 101 mL della soluzione di idrossido di potassio. (R: 10.7)
- Calcolare il volume di acido cloridrico 0.05 M necessario per titolare 20 mL di idrossido di sodio 0.1 M (R: 40 mL)
- Per titolare 30 mL di una soluzione di idrossido di potassio 0.25 M quanti mL di soluzione 0.15 M di acido iodidrico occorrono? (R: 50 mL)
- Se 30 mL di soluzione 0,02 M di acido nitrico vengono titolati da 10 mL di una soluzione di idrossido di litio, quale sarà la concentrazione della soluzione basica? (R: 0,06 M)
- Calcolare quanti grammi di acido perclorico sono contenuti in 250 mL di una soluzione che viene titolata da 700 mL di una soluzione di idrossido di sodio 0.2 M. (R: 14,07 g)
- Quanti grammi di acido bromidrico vi sono in 350 mL di una soluzione che viene titolata da 400 mL di una soluzione 0.3 M di idrossido di litio? (R: 9,72 g)
Note e commenti
1) pag. 1: è possibile inserire la conducibilità elettrica degli elettroliti, tanto nel testo, quanto nella presentazione. E’ possibile inoltre realizzare esperienze dal banco ed in laboratorio.
2) pag. 1: durante la lezione è possibile far osservare lo sviluppo di idrogeno e CO2, la conducibilità e la colorazione del tornasole
Fonte: http://www.liceodavincifi.it/_Rainbow/Documents/ACIDI%20E%20BASI2.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Acidi e basi tipo file : doc
ACIDI E BASI
Il concetto di acidi e basi si è evoluto nel tempo.
- 1887 La prima definizione di acido e di base è stata data dal chimico svedese S. Arrhenius (premio Nobel). Egli definì
- ACIDI à le sostanze che in soluzione acquosa si dissociano liberando ioni H+ (protoni)
Ad esempio acido solforico H2SO4 à 2H+ + SO4-
- BASI à le sostanze che in soluzione acquosa si dissociano liberando ioni OH- (ossidrili)
Ad esempio soda caustica NaOH à Na+ + OH-
- 1923 J.N. Bronsted e T.M Lowry ampliarono il concetto definendo:
- ACIDI à qualsiasi sostanza che cede un protone (H+)
- BASI à qualsiasi sostanza che accetta un protone
Ad esempio
NH3 (ammoniaca), messa in acqua acquista un protone, mentre l’acqua lo cede
NH3 + H2O à NH4+ + OH-
In questo caso l’ammoniaca (gas) si comporta da base, mentre l’acqua si comporta da acido.
- 1923 G.N. Lewis (americano) estese ulteriormente il concetto di acido e base con una teoria valida anche per sistemi non acquosi.
- ACIDO à qualsiasi sostanza che può accettare una coppia di elettroni (perchè ha almeno un orbitale vuoto)
- BASE à qualsiasi sotanza che può cedere un doppietto elettronico (dell’ultimo strato o strato di valenza)
In questo caso il protagonista della reazione acido-base non è più l’H+ ceduto o acquistato, nè tanto meno l’OH-, ma un doppietto o coppia di elettroni non condivisa che una sostanza può avere nell’ultimo strato elettronico.
Ad esempio
NH3 + H+ à NH4+
H+ ha un orbitale vuoto e può accettare un doppietto, mentre l’azoto dell’ammoniaca ha un doppietto non condiviso che può cedere all’ H+, legandolo a sè con un legame detto “dativo” (cioè quando entrambi gli elettroni di legame provengono dallo stesso atomo e non uno e uno come nel normale legame covalente).
Tutte e tre le teorie sono esatte, l’una non esclude l’altra, ma certe reazioni (esempio nella chimica organica) si spiegano bene con la teoria di Lewis, mentre per la nostra esperienza quotidiana concreta che abbiamo di sostanza acida (esempio il succo di limone) e basica (ad esempio il “ranno” per le olive) va benissimo la teoria di Arrhenius.
Fonte: http://89.97.218.226/web1/aiutochem/Modulo_6/acidibasi.rtf
Autore del testo: non indicato nel documento di origine
Parola chiave google : Acidi e basi tipo file : doc
Acidi e basi
Visita la nostra pagina principale
Acidi e basi
Termini d' uso e privacy