Chimica supramolecolare
Chimica supramolecolare
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Chimica supramolecolare
Concetti Base
Tratto dalle dispense del Prof. G. Ciani e della Dr. L. Carlucci
Introduzione
La Chimica Supramolecolare è stata definita da uno dei suoi fondatori, Jean-Marie Lehn (Premio Nobel 1987), come la ‘chimica degli aggregati molecolari e del legame intermolecolare’. In modo più semplice potremmo definire la chimica supramolecolare come ‘la chimica oltre le molecole’ o anche come ‘la chimica dei legami non covalenti’. La Figura illustra con un esempio la differenza tra chimica molecolare e chimica supramolecolare in termini strutturali.
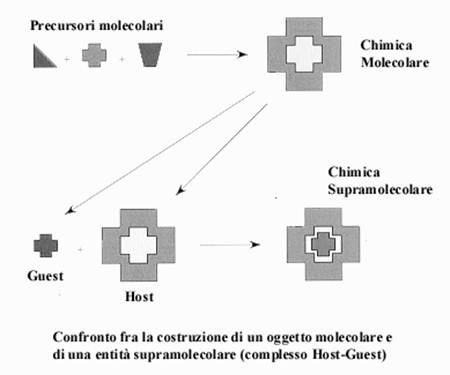
Queste definizioni sono piuttosto ampie e tali da includere una grande varietà di situazioni. Nel corso degli ultimi 10 anni poi i sistemi oggetto di studio della chimica supramolecolare sono divenuti sempre più numerosi. Definizioni diverse di ‘supramolecolare’ sono state adottate in aree più specifiche: per esempio, in fotochimica supramolecolare un ‘oggetto supramolecolare’ è costituito da un gruppo di componenti molecolari individuali che portano le loro specifiche proprietà all’intera architettura (covalente o non). Nel contesto di questa disciplina sono entrati in tempi più recenti concetti quali l’ ‘ingegneria cristallina’, cioè la costruzione deliberata mediante ‘self-assembly’ di materiali solidi cristallini con strutture e componenti pre-programmati per specifiche applicazioni, e l’utilizzo della chimica di coordinazione ed organometallica per la formazione di aggregati supramolecolari e di polimeri di coordinazione (anche se le interazioni metallo-legante possono possedere un significativo grado di covalenza). Da qui un dibattito in corso al giorno d’oggi nella comunità scientifica internazionale volto a ridefinire l’ambito proprio della Chimica Supramolecolare (vedi ad esempio, I. Dance ‘What is supramolecular?’ New J. Chem., 2003, 27, 1).
Sistemi host-guest
Nella sua forma più semplice la chimica supramolecolare studia sistemi in cui si verifica una interazione non covalente o una forma di complessazione tra una molecola (un ‘host’) che ‘lega’ una seconda molecola (un ‘guest’) per dare un complesso ‘host-guest’ ossia una ‘supramolecola’. Comunemente l’host è una grossa molecola o un aggregato (come un enzima o una molecola ciclica sintetica) che presenta una grossa cavità centrale. Il guest può essere un catione monoatomico, un semplice anione inorganico o una molecola più sofisticata (come un ormone, un neurotrasmettitore, ecc.). Si usa anche definire l’host come una entità molecolare che possiede siti di legame convergenti (atomi donatori basici di Lewis, donatori nel legame di idrogeno, ecc.) mentre il guest possiede siti di legame divergenti (come un catione metallico sferico, che funziona da acido di Lewis, o un anione alogenuro, o un accettore di legame di idrogeno).
Donald Cram (D.J. Cram, ‘Preorganisation - from solvents to spherands’, Angew. Chem. Int. Ed. Engl., 1986, 25, 1039) ha suggerito le seguenti definizioni relative ai complessi ‘host-guest’:
"I complessi sono costituiti da due o più molecole o ioni tenuti assieme in una unica relazione strutturale da forze di natura elettrostatica diverse da quelle che caratterizzano i legami covalenti puri (…) I complessi molecolari sono di solito tenuti assieme da legami d’idrogeno, da interazioni ioniche, da interazioni π-acide o π-basiche, da legami metallo-legante, da forze attrattive di van der Waals, da riorganizzazione del solvente e da legami covalenti parziali (stati di transizione) (…) Una alta organizzazione strutturale è raggiunta di solito grazie alla presenza di siti multipli di legame (...) Una interazione host-guest implica una disposizione complementare stereoelettronica di siti di legame nell’ host e nel guest (...) La componente host è una molecola o ione organico i cui siti di legame convergono nel complesso … La componente guest è ogni molecola o ione i cui siti di legame divergono nel complesso …. "
Attualmente la chimica supramolecolare è divenuta una disciplina largamente interdisciplinare e possiamo quindi generalizzare i concetti sopra esposti rimuovendo la parola ‘organico’. Infatti le ricerche più recenti hanno messo in evidenza una grande varietà di host inorganici, come le zeoliti, i poliossoanioni (es. i poliossovanadati), o come i composti di coordinazione metallo-organici con struttura polimerica (MOF = Metal-Organic Frameworks), che presentano simili funzionalità.
L’interazione ‘host-guest’ può essere assimilata ad ‘una mano che tiene una palla’. La mano (host) trattiene la palla (guest) e rappresenta una barriera fisica che impedisce alla palla di cadere (dissociazione). L’analogia cade a livello elettronico, perché non esiste in realtà alcuna forza attrattiva tra i due costituenti, ma serve a introdurre il concetto di ‘chimica di inclusione’, cioè l’inclusione di una entità molecolare in una seconda entità molecolare.
Una distinzione che viene usata in chimica host-guest supramolecolare è legata alla stabilità o meno del complesso in soluzione (quando è possibile). Il campo dei clatrati o più in generale dei composti di inclusione contiene specie host che sono stabili solo allo stato solido cristallino, mentre dissociano per solubilizzazione in un solvente (clatrati idrati, clatrati dell’urea, vari solvati cristallini). D’altro canto host molecolari per i cationi, come gli eteri a corona (crown ethers), i criptandi e gli sferandi, o host molecolari per molecole neutre, come i carcerandi e i criptofani, presentano legami significativamente stabili sia allo stato solido che in soluzione.
Sviluppi storici
La chimica supramolecolare, nella sua definizione attuale, è una disciplina giovane che risale agli ultimi anni sessanta. Tuttavia, i sui primi principi e le sue basi, così come alcuni più o meno semplici sistemi chimici supramolecolari, possono essere ricondotti alle origini della stessa chimica moderna. La seguente Tavola illustra in modo necessariamente sommario la sequenza cronologica degli eventi fondamentali.
Cronologia della Chimica Supramolecolare |
|
1810 - Sir Humphrey Davy: scoperta del clatrato idrato di cloro. |
1823 - Michael Faraday: formula del clatrato idrato di cloro. |
1841 - C. Schafhäutl: studi degli intercalati di grafite. |
1849 - F. Wöhler: clatrato di H2S del β-chinolo. |
1891 - Villiers e Hebd: composti di inclusione della ciclodestrina. |
1893 - Alfred Werner: chimica di coordinazione. |
1894 - Emil Fischer: il concetto ‘lock and key’. |
1906 - Paul Ehrlich: introduzione del concetto di ‘recettore’. |
1937 - K.L. Wolf: viene coniato il termine ‘Übermoleküle’ per descrivere entità organizzate derivanti dalla associazione di specie coordinativamente sature (e.g. il dimero dell’acido acetico). |
1939 - Linus Pauling: i legami d’idrogeno sono introdotti nel famoso testo ‘The Nature of the Chemical Bond’. |
1940 - M.F. Bengen: composti di inclusione nei canali dell’urea. |
1948 - H.M. Powell: strutture cristalline ai raggi X dei composti di inclusione del β-chinolo; viene introdotto il termine ‘clatrato’ per descrivere specie in cui un componente è incluso nel reticolo di un altro. |
1949 - Brown e Farthing: sintesi del [2.2]paraciclofano. |
1953 - Watson e Crick: struttura del DNA. |
1956 - Dorothy Crowfoot Hodgkin: struttura cristallina ai raggi X della vitamina B12. |
1959 - Donald Cram: tentativo di sintesi dei complessi a trasferimento di carica del ciclofano con (NC)2C=C(CN)2. |
1961 - N.F. Curtis: prima base di Schiff macrociclica da acetone ed etilendiammina. |
1964 - Busch e Jäger: basi di Schiff macrocicliche. |
1967 - Charles Pedersen: eteri a corona. |
1969 - Jean-Marie Lehn: sintesi del primo criptando. |
1969 - Jerry Atwood: clatrati liquidi dai sali di alchil-alluminio. |
1973 - Donald Cram: sferandi host prodotti per verificare l’importanza della ‘preorganizzazione’. |
1978 - Jean-Marie Lehn: introduzione del termine ‘Chimica Supramolecolare’ definita come la ‘chimica degli aggregati molecolari e del legame intermolecolare’. |
1979 - Gokel e Okahara: sviluppo degli ‘eteri lariat’ come una sottoclasse di composti host. |
1981 - Vögtle e Weber: ‘podandi’ e sviluppo della nomenclatura. |
1987 - Premio Nobel per la Chimica a Donald J. Cram, Jean-Marie Lehn e Charles J. Pedersen per il loro lavoro in chimica supramolecolare. |
1996 - Atwood, Davies, MacNicol & Vogtle: pubblicazione del volume ‘Comprehensive Supramolecular Chemistry’ con contributi dei gruppi più significativi e aggiornato agli sviluppi più recenti. |
1996 - Premio Nobel per la Chimica a Kroto, Smalley e Curl per il loro lavoro sulla chimica dei fullereni. |
Gran parte della chimica supramolecolare ha avuto origine dagli sviluppi della chimica dei macrocicli negli anni sessanta, in particolare i leganti macrocicli per cationi metallici. Possiamo identificare quattro classi di composti di fondamentale importanza, preparate dai gruppi di Curtis, Busch, Jäger e Pedersen (vedi Schema), tre delle quali basate sulla reazione di condensazione delle basi di Schiff di una aldeide con una ammina a dare una immina.
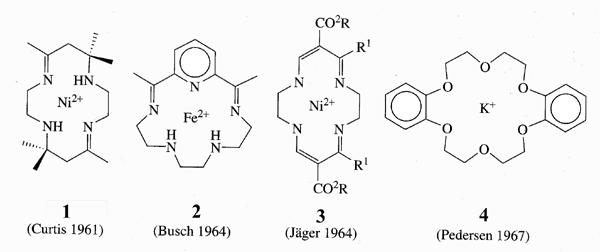
Questi sistemi si possono considerare uno sviluppo dai macrocicli naturali (ionofori, eme, ftalocianine etc.). A questi possiamo aggiungere i ciclofani (che risalgono ai primi anni cinquanta) e i più recenti sferandi e carcerandi di Donald Cram. Il grande contributo di Jean-Marie Lehn, che preparò alla fine degli anni sessanta i criptandi, ha portato a molti dei recenti sviluppi nell’area.
Al giorno d’oggi la chimica supramolecolare rappresenta uno dei campi della ricerca più attivi e in espansione. Il suo carattere interdisciplinare ha portato ad ampie collaborazioni tra fisici, chimici teorici e computazionali, cristallografi, chimici inorganici e dello stato solido, chimici organici sintetisti, biochimici e biologi.
Classificazione dei composti ‘Host – Guest’ supramolecolari
 Uno dei primi esempi di complesso supramolecolare host-guest ‘a gabbia’ molecolare fu proposto H.M. Powell all’Università di Oxford nel 1948. Venne allora coniato il termine ‘clatrato’ definito come un tipo di composto di inclusione ‘in cui due o più componenti sono associati senza presentare una unione chimica comune, ma per incapsulamento di un set di molecole in una opportuna struttura formata da una diversa specie’.
Uno dei primi esempi di complesso supramolecolare host-guest ‘a gabbia’ molecolare fu proposto H.M. Powell all’Università di Oxford nel 1948. Venne allora coniato il termine ‘clatrato’ definito come un tipo di composto di inclusione ‘in cui due o più componenti sono associati senza presentare una unione chimica comune, ma per incapsulamento di un set di molecole in una opportuna struttura formata da una diversa specie’.
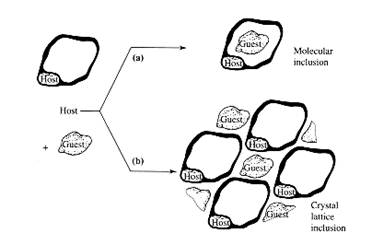
Nel descrivere la moderna chimica ‘host-guest’ è utile dividere i composti host in due classi principali a seconda della relazione topologica relativa tra guest e host.
I cavitandi [(a) in Figura] possono essere descritti come specie host che possiedono cavità intramolecolari. Ciò significa che la cavità disponibile è una proprietà molecolare intrinseca dell’host, ed esiste sia in soluzione che allo stato solido.
Diversamente i clatrandi [(b) in Figura] sono specie host con cavità extramolecolari (la cavità è essenzialmente una spazio tra due o più molecole host) ed esiste solo allo stato solido cristallino.
Il complesso host-guest formato da un cavitando è detto cavitato mentre i clatrandi formano clatrati.
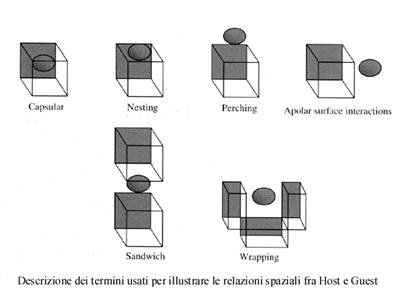
Una ulteriore suddivisione fondamentale può essere ricondotta alle forze che agiscono tra molecole host e guest. Se l’aggregato host-guest è principalmente tenuto assieme da forze elettrostatiche (ione-dipolo, dipolo-dipolo, legame d’idrogeno etc.) si usa il termine complesso. Se invece si tratta di forze meno specifiche (spesso di minore entità), interazioni non direzionali, di tipo idrofobico, di van der Waals, o effetti di impacchettamento cristallino, si usano più appropriatamente i termini cavitato e clatrato.
Esempi sono riportati nella seguente Tabella. Si noti che nella letteratura corrente si tende ad utilizzare sempre il termine ‘complesso’.
Classificazione dei comuni composti host-guest con host neutro |
||||
Host |
Guest |
Interazione |
Classe |
Esempio |
etere a corona |
catione metallico |
ione-dipolo |
complesso |
[K+ -[18]crown-6] |
Sferando |
catione alchil-ammonio |
legame d’idrogeno |
complesso |
Sferando-(CH3NH3+) |
ciclodestrina |
molecola organica |
Idrofobica/ van der Waals |
cavitato |
α-ciclodestrina/ acido p-idrossi-benzoico |
Acqua |
molecola organica, alogeni |
van der Waals/ impaccamento |
clatrato |
(H2O)6.(CH4) |
Calixarene |
molecola organica |
van der Waals/ impaccamento |
cavitato |
p-But-calix[4]arene. toluene |
ciclotriveratrilene |
molecola organica |
van der Waals/ impaccamento |
clatrato |
(CTV).0.5acetone |
Recettori, coordinazione e l’analogia ‘lock and key’
La chimica host-guest (o anche recettore-substrato) fa riferimento a tre concetti storici che citiamo brevemente.
1- L’assunto di Paul Ehrlich nel 1906 che le molecole non agiscono se non si legano: ‘Corpora non agunt nisi fixata’; così Ehrlich introdusse il concetto di recettore biologico.
2- Il riconoscimento nel 1894 da parte di Emil Fischer che il legame deve essere selettivo (nell’ambito dello studio del legame recettore-substrato da parte degli enzimi). Egli introdusse ciò mediante una immagine di fitting sterico come l’analogia ‘lock and key’ (toppa e chiave), in cui la specie ospite ha una dimensione e forma geometrica complementari a quelle del recettore (host). Questo concetto ha posto le basi del riconoscimento molecolare, cioè la discriminazione da parte della specie host nell’ambito di una varietà di potenziali molecole guest.
3- Il fatto che un legame selettivo implica attrazione o mutua affinità tra host e guest. Questa è una generalizzazione della teoria della coordinazione di Alfred Werner (1893) in cui ioni metallici sono coordinati da una sfera di leganti.
Queste idee nate indipendentemente in aree diverse hanno contribuito insieme molti anni dopo alla nascita di una disciplina altamente interdisciplinare come la chimica supramolecolare.
L’analogia ‘lock and key’ ha subito diverse modificazioni successive, con i concetti di chelazione, preorganizzazione e complementarità etc., che vedremo in seguito.
J.P. Behr, "The Lock-and-Key Principle. The State of the Art-100 years on", J. Wiley & Son: Chichester, 1994.
Fonte: citazione estratta per uso didattico da ftp://dipcia.unica.it/pub/didattica/CdL_Chimica/CSI/Dispense/Parte%20I_Concetti_Base_doc.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Chimica supramolecolare tipo file : doc
Chimica supramolecolare
Visita la nostra pagina principale
Chimica supramolecolare
Termini d' uso e privacy