Termodinamica trasformazione di lavoro in calore
Termodinamica trasformazione di lavoro in calore
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Termodinamica trasformazione di lavoro in calore
TERMODINAMICA: TRASFORMAZIONE DI LAVORO IN CALORE E VICEVERSA.
E' noto che si può fornire calore ad un corpo, cioè riscaldarlo, in due modi:
-
ponendolo a contatto con un altro a temperatura più elevata
-
spendendo lavoro meccanico (le mani strofinate insieme si riscaldano, la punta di un trapano scotta dopo essere stata usata)
Il processo a) è ben descrivibile dalla termologia,cioè dalla parte della fisica che studia gli scambi di calore tra i corpi, mediante la legge fondamentale (1) e quella dell’equilibrio termico (2) :
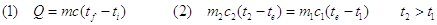
Se il corpo sta modificando lo stato di aggregazione si ha che: (3) Q = mL dove L è il calore latente; per l’acqua Lf = 330 000 J/kg Le = 2 250 000 J/kg
Il processo b), più complesso, fa parte dei cosiddetti fenomeni termodinamici, ossia delle connessioni esistenti tra fenomeni termici e fenomeni meccanici.
In tali fenomeni si assiste a una produzione di calore contemporaneamente alla scomparsa di energia meccanica. Ma è possibile anche assistere al fenomeno inverso, nei motori a scoppio, ad esempio, il calore come tale scompare, come se venisse distrutto per dar luogo alla produzione di lavoro meccanico. Noi siamo abituati a pensare ad una sostanza come a qualcosa che non si può né creare né distruggere, mentre il calore e il lavoro non sembrava ubbidire a questo "principio di conservazione". Le esperienze descritte suggeriscono che deve esistere una sorta di legame tra queste due entità fisiche, in quanto la scomparsa dell'una è sempre accompagnata dall'apparizione dell'altra.
In effetti i due casi di "non conservazione" si possono eliminare salvando al tempo stesso il principio di conservazione dell'energia e quello dell'indistruttibilità del calore, intendendo questo non come un'entità distinta ma come una forma particolare di energia. Nei processi sopra descritti quello che avviene è semplicemente una trasformazione reciproca tra due forme di energia: il calore e il lavoro. Pertanto tra lavoro e calore vi è equivalenza nel senso che dopo una trasformazione la quantità di lavoro dissipato e la corrispondente quantità di calore prodotto stanno sempre nello stesso rapporto costante e viceversa:
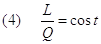
Una serie di esperienze condotte da Carnot e da Joule nell’800 confermarono l'esistenza di tale rapporto. Il suo valore, indicato con J, fu detto equivalente meccanico del calore. Se misuriamo L in Joule e Q in chilocalorie si ha che J = 4186 Joule/Kcal . Allora la (4) diventa:
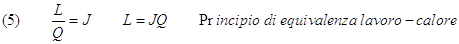
Se il calore, essendo una forma di energia, viene essere espresso direttamente in Joule la (1) può essere scritta semplicemente così:
(6)
L = Q
CALORE E LEGGE DI CONSERVAZIONE DELL'ENERGIA (dimostrazione della (2))
Solo quando apparve chiaro che fra lavoro e calore c'è equivalenza, poté essere formulata la legge generale di conservazione dell'energia. A noi è già noto il principio di conservazione dell'energia meccanica (cioè cinetica + potenziale gravitazionale). In realtà l'energia meccanica di un qualsiasi corpo in moto diminuisce sempre a causa dell'attrito e non si conserva se non nel caso ideale, cioè in assenza di attrito. Nasce quindi spontanea la domanda: dove va a finire l'energia meccanica ? Un sasso in caduta libera possiede un'energia cinetica che dipende dalla sua velocità e un'energia potenziale gravitazionale che dipende dalla sua distanza dal suolo. Queste sono caratteristiche esterne o, come anche si dice, macroscopiche, che possono essere osservate. Nel sasso stesso, però, gli atomi che la compongono hanno un'energia interna definibile nel seguente modo:
def: Si chiama energia interna U di un corpo la somma delle energie cinetica interna e potenziale interna di tutti i suoi costituenti, atomi e molecole
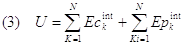
Oss1: L'energia cinetica interna è causata dal movimento di agitazione termica alla quale sono soggetti tutti i corpi per il solo fatto di avere una temperatura superiore a = 0 K. Per ogni molecola di un gas ideale abbiamo visto che: Ecint =3/2KT
Oss2: L'energia potenziale, o energia di posizione, dipende dalle posizione reciproche di elettroni e nuclei in ciascuna molecola e dalle forze di attrazione che coinvolgono le molecole stesse. Essa è anche definita energia chimica del corpo perché cambia solo quando avvengono delle reazioni chimiche.
Quindi in realtà quello che si conserva è l'energia totale macroscopica e microscopica. Per esempio quando il corpo raggiunge il suolo sembra che tutta l'energia cinetica vada perduta. Invece, a conferma del principio di conservazione generale dell'energia, la perdita di energia meccanica è compensata da un uguale aumento di energia interna del sasso e del ambiente (suolo, aria). La reciproca posizione delle molecole di tutti i corpi che partecipano al processo cambia ( i corpi si deformano) ed aumenta l'energia cinetica del movimento termico delle molecole (i corpi si riscaldano).
Es1:Un proiettile di piombo il cui calore specifico è c=0.03 Kcal/Kg°C in moto con velocità v=400 Km/s, colpisce un bersaglio e vi si ferma. Nell'ipotesi che tutto il calore prodotto nell'urto viene impiegato per aumentare la temperatura del proiettile, di quanti gradi salirà la sua temperatura ?
Energia Totale macr. e micr. iniziale = Energia Totale macr.e micr. finale
Energia macroscopica i + energia microscopica i = Energia macroscopica f + Energia microscopica f
Eci + Epi + Ui = Ecf + Epi + Uf
Eci + Epi + åEint ci+ åEint pi = Ecf + Epi + åEint cf + åEint pi
Eci = Uf - Ui
Eci = Eint cf - Eint eci + Eint pf - Eint epi
Nell'ipotesi che tutto il calore prodotto va ad incrementare solo la temperatura del proiettile , e quindi l'energia cinetica delle sue molecole, e che non vi siano trasformazioni chimiche si ha che
epf -epi = 0 perciò:
Eci = Eint cf - Eint ci
Per calcolare le energie cinetiche interne di tutte le molecole dovremmo conoscere il numero delle molecole N e la loro velocità, impresa impossibile ! Possiamo risolvere questo problema ricordandoci che la temperatura è la misura dell'energia cinetica delle molecole e che il calore è quella forma di energia che dipende da una differenza di temperatura, oppure che è lo stesso , da un differente stato di agitazione termica molecolare, pertanto dalla (1) si ha che:
Eci = JQ
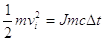 da cui:
da cui:
Il fattore J viene introdotto se esprimo il calore in calorie o Kcal. Poiché la velocità è espressa in m/s dobbiamo utilizzare per il calore specifico il valore c= 0.03 Kcal/Kg°C e porre J = 4186 J/Kcal
Oppure, se utilizziamo per il calore specifico c = 126 J/KgK, dobbiamo porre J=1. Risultato Dt = 320 °C
Dopo aver dimostrato che quando un corpo non subisce una deformazione permanente e non è sede di reazioni chimiche la variazione dell'energia interna equivale al calore scambiato dal corpo si possono risolvere i problemi sull'equivalenza calore- energia mediante la seguente relazione
energia macroscopica iniziale = energia macroscopica finale + calore
Es2: Calcolare da quale altezza deve cadere una goccia d'acqua di massa m=3g perché essa nell'urto col suolo si riscaldi di 2°C, nell'ipotesi che tutto il calore prodotto viene utilizzato per aumentare la temperatura della goccia?
Nell'urto con il suolo la goccia si deforma e si riscalda per attrito interno delle sue molecole. Il calore prodotto equivale al lavoro fatto dalla forza peso ovvero all'energia potenziale della goccia. Per il principio di equivalenza si deve avere:
L = JQ Ph = JQ
Se il calore viene espresso in calorie si ha: mgh = JcmDt
Es3: Attorno al cratere formato dall'impatto di un meteorite , si è fusa una massa rocciosa di 75 Kg. La roccia ha un calore specifico di 0.8 Kcal/Kg°C, il punto di fusione a 500 °C ed una calore latente di fusione di 48 Kcal/Kg. La temperatura iniziale del terreno era di 0 °C. Se il meteorite ha colpito il suolo con una velocità di 600 m/s, qual era la massa minima del meteorite ? Si trascurino le perdite di calore durante l'impatto con le rocce circostanti, non fuse, e con l'atmosfera. Si trascuri la capacità termica del meteorite.
Il calore richiesto per fondere la roccia è Q = mcDt + mL = 1.41x108 J
Questo calore è stato ottenuto trasformando l'energia cinetica del meteorite Ec = 1/2m6002 da cui m=781 Kg
Es4: Un missile (c=0.2 Kcal/Kg°C) dopo aver raggiunto l'altezza di 150 Km, dove la temperatura è di 50 °C, per un guasto si ferma. Rientrando nell'atmosfera terrestre tocca terra alla velocità di 600 m/s e il calore generato per attrito con l'aria resta immagazzinato nel missile. Se la metà del calore generato per attrito con l'aria resta immagazzinato nel missile, quale sarà la sua temperatura nell'istante in cui colpisce il suolo ?
mghi = 1/2mvf2 + mcDt tf = 1500 °C
Fonte: http://www.fisicaweb.org/doc/termodinamica/introduzione.doc
Sito web da visitare: http://www.fisicaweb.org/
Autore del testo: non indicato nel documento di origine
Parola chiave google : Termodinamica trasformazione di lavoro in calore tipo file : doc
Visita la nostra pagina principale
Termodinamica trasformazione di lavoro in calore
Termini d' uso e privacy