Trasformazioni fisiche della materia
Trasformazioni fisiche della materia
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
LE TRASFORMAZIONI FISICHE DELLA MATERIA
GLI STATI FISICI DELLA MATERIA
Il mondo che ci circonda è costituito da materia, che si presenta a noi in forme diversissime. Essa, infatti può esistere in tre stati fisici diversi, denominati anche “stati di aggregazione della materia”: lo stato solido, lo stato liquido e ,o stato aeriforme (cioè sotto forma di gas o vapore).
Stato solido
Sono definiti solidi tutti quei corpi che hanno una massa, un volume e una forma definiti; sono incomprimibili se sottoposti a pressioni elevate. Essi si suddividono in solidi cristallini, i quali possiedono una composizione chimica ordinata e distinta (es: granito) e solidi amorfi, che, al contrario, possiedono una composizione chimica disordinata (es: pomice).
Stato liquido
I corpi liquidi possiedono una massa e un volume definiti, come i solidi, ma assumono la forma della parte di recipiente che li contiene. Inoltre, se sottoposti a pressioni elevate, sono incomprimibili.
Stato aeriforme
I corpi aeriformi hanno una massa propria ma si espandono fino ad occupare tutto il volume disponibile e ad assumere la forma del recipiente che li contiene. A differenza dei primi due stati fisici possono essere compressi se sottoposti a pressioni elevate.
Bisogna precisare, però, che lo stato aeriforme comprende sia i gas che i vapori. Infatti, un gas è una sostanza aeriforme che si trova al di sopra della propria temperatura critica, cioè a quella temperatura in cui è impossibile liquefarlo, anche sottoponendolo a pressioni altissime. Al di sotto di tale valore di temperatura, che è caratteristico per ogni sostanza, l’aeriforme prende il nome di vapore.
L’esistenza di un quarto stato
Possiamo individuare un altro stato fisico, denominato quarto stato o stato di plasma, il quale è uno stato degenerativo della materia poiché i nuclei degli atomi sono staccati dagli elettroni. Questo stato, però, si trova solo a temperature molto elevate, pari a 15.000.000 °C, come, ad esempio, all’interno del nucleo delle stelle.
I PASSAGGI DI STATO
Le sostanze e i materiali possono passare, per effetto delle variazioni di temperatura o di pressione, da uno stato fisico all’altro.
Il passaggio che trasforma una sostanza dallo stato solido a quello liquido prende il nome di fusione, invece quello dalla fase liquida a quella aeriforme è chiamato evaporazione. Alcune sostanze solide, per riscaldamento, si trasformano direttamente in vapore, senza passare per lo stato liquido. Questo processo è denominato sublimazione: fra le sostanze che sublimano ci sono la naftalina e, molto spesso, anche la neve.
Sottraendo energia termica, i passaggi di stato avvengono in senso inverso, infatti la trasformazione di una sostanza da aeriforme a solido si chiama brinamento, mentre il passaggio da stato liquido a solido è denominato solidificazione e quello dalla fase aeriforme a quella liquida prende il nome di condensazione o liquefazione.
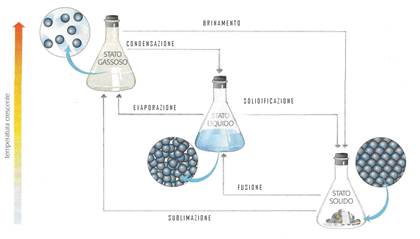
Volume e densità nei passaggi di stato
Consideriamo un generico materiale che, a parità di massa, passa dallo stato liquido allo stato aeriforme. Consideriamo, inoltre la formula della densità
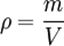
Dove m è la massa e V il volume del materiale.
Poiché il volume aumenta notevolmente, la densità diminuirà; mentre se consideriamo un materiale che, sempre a parità di massa, passa dello stato liquido alla stato solido, noteremo una leggera diminuzione del volume e, quindi, un piccolo aumento della densità.
L’acqua costituisce un’importante eccezione: il volume allo stato solido (ghiaccio), infatti, è maggiore del volume della stessa quantità di acqua allo stato liquido. Di conseguenza, la densità del ghiaccio è minore di quella dell’acqua.

Il ghiaccio è meno denso dell’acqua e quindi galleggia; il benzene solido, invece, è più denso del benzene liquido, per cui affonda .
La curva di riscaldamento di una sostanza pura
Definiamo sostanza pura una sostanza con proprietà caratteristiche e con una composizione costante.
Un metodo eccellente per verificare il grado di purezza di un solido consiste nel determinare la sua temperatura di fusione, denominata anche punto di fusione.
Lasciamo riscaldare a temperatura ambiente un recipiente contenente ghiaccio e, con l’uso di un termometro annotiamo le temperature che leggiamo: riportando su un grafico cartesiano le temperature in funzione del tempo, otterremo la così detta curva di riscaldamento.
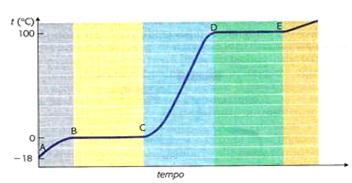
La temperatura dapprima cresce in modo regolare, passando da -18 °C a 0 °C. Quando il ghiaccio comincia a fondere, anche se l’ambiente continua a cedere calore al miscuglio di acqua e ghiaccio, la temperatura non aumenta (tratto BC) e rimane costante fino a quando tutto il ghiaccio non si trasforma in acqua. La temperatura a cui coesistono acqua e ghiaccio è denominata temperatura di fusione: ogni sostanza pura, quindi, possiede una temperatura di fusione caratteristica.
La lunghezza del segmento BC, chiamato sosta termica, dipende dalla quantità di ghiaccio che deve fondere: maggiore è la quantità di ghiaccio, più lunga sarà la sosta termica.
Terminata la fusione di tutto il ghiaccio, la temperatura ricomincia a salire con regolarità fino a 100 °C, dove ha inizio un’altra sosta termica.
A questo punto, bisogna fare una distinzione tra evaporazione ed ebollizione. Infatti, dal momento in cui inizia a formarsi, il vapore esercita una pressione chiamata tensione di vapore: finché la tensione di vapore è inferiore alla pressione atmosferica, si ha l’evaporazione; quando la tensione di vapore eguaglia la pressione atmosferica si ha l’ebollizione.
La temperatura a cui l’acqua bolle è detta temperatura di ebollizione.
La durata della sosta termica nel caso dell’ebollizione è circa sette volte maggiore della sosta termica della fusione poiché è più facile che l’acqua passi dallo stato solido allo stato liquido anziché dallo stato liquido a quello solido.
Ogni sostanza pura ha la sosta termica della fusione e la sosta termica dell’ebollizione, mentre i passaggi di stato delle soluzioni e dei miscugli in generale non avvengono a temperature costanti e, di conseguenza, cambia anche la forma del grafico.
La curva di raffreddamento di una sostanza pura
Immaginiamo ora di raffreddare un recipiente pieno di vapore acqueo; se riportiamo su un grafico i valori della temperatura in funzione del tempo, otterremo una curva inversa a quella di riscaldamento, chiamata curva di raffreddamento.
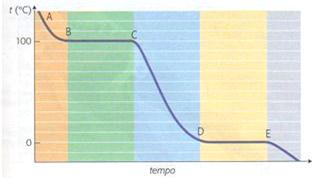
Osserveremo che la temperatura si abbasserà gradualmente, fin quando il vapore comincerà a trasformarsi in liquido. Da questo punto in poi la temperatura rimane costante anche se il vapore continua a cedere calore all’ambiente. Questa temperatura è denominata temperatura di condensazione. Se i due passaggi (condensazione e ebollizione) avvengono alle stesse condizioni di pressione, la temperatura di condensazione sarà uguale a quella di ebollizione.
Continuando il raffreddamento, la temperatura del liquido ricomincia a scendere con regolarità fino ad una nuova sosta termica, in cui la temperatura è costante. Questa temperatura è chiamata temperatura di solidificazione. Se i due passaggi di stato (solidificazione e fusione) avvengono alle stesse condizioni di pressione, la temperatura di solidificazione sarà uguale a quella di fusione.
Tutte le sostanze pure hanno una curva di raffreddamento simile a quella dell’acqua, con temperature di condensazione e solidificazione caratteristiche per ogni sostanza.
Calore latente
Il calore latente è il calore che deve essere fornito o rimosso da 1 kilogrammo di sostanza per trasformarla da una fase ad un’altra. In termini matematici possiamo dire che il calore Q necessario per far passare una massa m da una fase all’altra è mL. Questo porta alla seguente relazione:
Q = mL
Il calore latente dipende dalle fasi coinvolte, infatti il calore latente necessario a fondere una sostanza è detto calore latente di fusione. Analogamente il calore latente necessario per trasformare un liquido in un gas è chiamato calore latente di vaporizzazione.
I passaggi di stato e la pressione
La temperatura di ebollizione dipende molto dalla pressione. Infatti se la pressione esterna si abbassa, l’acqua bolle ad una temperatura inferiore ai 100 °C; se, invece, la pressione esterna aumenta, l’acqua bolle ad una temperatura superiore ai 100 °C. Per esempio, in alta montagna, dove la pressione è inferiore a 1 atmosfera, l’acqua bolle a circa 80 °C e, per questo motivo, di solito, in montagna la pasta cuoce peggio.
La pentola a pressione, al contrario, aumenta la temperatura di ebollizione, rendendo più veloce la cottura dei cibi. L’innalzamento è reso possibile dall’aumento di pressione del vapore all’interno della pentola sigillata. In questo modo l’acqua bollirà a più di 100 °C.
Le temperature di fusione di solidificazione, invece, sono poco influenzate dalle variazioni esterne di pressione.
Infatti, quando un liquido si trasforma in vapore, deve aumentare di circa 1000 volte il proprio volume. Una pressione esterna elevata tende a contestare questa espansione e quindi, l’ebollizione avverrà ad una temperatura più alta. Al contrario, una riduzione di pressione favorisce l’espansione e fa abbassare il punto di ebollizione.
Nel passaggio da solido a liquido, invece, l’aumento di volume è molto piccolo e quindi non viene ostacolato da una pressione elevata.
L’acqua rappresenta una delle poche eccezioni: la pressione elevata
tende a favorire la fusione del ghiaccio, poiché durante la trasformazione il volume si riduce.
Autore : FEDERICA AGLIANO
V G
Fonte: http://www.francescozumbo.it/zumbo/lavori-studenti/2008/cd-5g-2007-2008/lavori/agliano%20LE%20TRASFORMAZIONI%20FISICHE%20DELLA%20MATERIA.doc
Trasformazioni fisiche della materia
LE TRASFORMAZIONI DELLA MATERIA
Nelle ultime esperienze di laboratorio abbiamo effettuato due trasformazioni di sostanze pure: la fusione – solidificazione del paradiclorobenzene e la decomposizione del clorato di sodio. Proviamo adesso a vedere quali somiglianze e quali differenze vi siano tra queste due esperienze.
Somiglianze:
- In entrambe le trasformazioni si aumenta la temperatura.
Differenze:
- Nella fusione/solidificazione all’aumentare della temperatura il solido passa a liquido; nella decomposizione il solido inizialmente fonde, ma poi si riforma un solido.
- Nella fusione/solidificazione non si sviluppa gas; nella decomposizione si sviluppa ossigeno.
- La fusione/solidificazione è reversibile al variare della temperatura; la decomposizione non è reversibile.
- Nella fusione/solidificazione le sostanze non cambiano le loro (proprietà) caratteristiche: il paradiclorobenzene all’inizio ed alla fine della trasformazione era rimasto lo stesso; nella decomposizione la sostanza cambia le sue (proprietà) caratteristiche.
Questi argomenti sono sufficienti per concludere che le due trasformazioni sono assai differenti tra loro, generalizzando questi esempi possiamo dire che in natura esistono due tipi differenti di trasformazioni:
Trasformazioni fisiche
Le sostanze non cambiano la loro natura e non cambiano quindi le loro proprietà caratteristiche.
Esempi: tutti i passaggi di stato; un sasso che cade; un oggetto che si rompe; un corpo scaldato che si dilata.
Trasformazioni chimiche
Le sostanze cambiano la loro natura e cambiano quindi le loro proprietà caratteristiche.
Esempi: decomposizione del clorato di sodio; tutte le combustioni; il ferro che si arrugginisce; l’acido che corrode; un petardo che esplode, l’acqua che si decompone per elettrolisi.
Le trasformazioni chimiche si chiamano anche reazioni chimiche o semplicemente reazioni e con questo nome da ora in poi noi le indicheremo. In una reazione chimica noi partiamo con delle sostanze iniziali, che si chiamano reagenti, ed otteniamo delle sostanze finali, che si formano cioè in seguito alla reazione, che si chiamano invece prodotti. Una reazione chimica inoltre può essere rappresentata attraverso una equazione chimica in cui, a primo membro, si scrivono le formule delle sostanze reagenti, mentre a secondo membro si scrivono le formule delle sostanze prodotte. I due membri, invece che da un segno di uguale, sono collegati da una freccia con la punta rivolta verso destra, come nello schema seguente: reagenti → prodotti.
Le trasformazioni nella vita di tutti i giorni
Nella vita di ogni giorno assistiamo o effettuiamo un gran numero di trasformazioni sia fisiche, che chimiche. Ognuno provi a fare un elenco.
TRASFORMAZIONI FISICHE |
TRASFORMAZIONI CHIMICHE |
In verità tutti i fenomeni naturali, ma anche i processi di trasformazione inventati dall’uomo (nell’industria, nell’agricoltura ecc.) corrispondono a trasformazioni chimiche o fisiche.
Proprietà chimiche e proprietà fisiche

Abbiamo definito sostanza (pura) un corpo omogeneo che mantiene tutte le sue caratteristiche quando viene sottoposto sia a perturbazioni fisico meccaniche, che a passaggi di stato. In due esperienze di laboratorio (decomposizione di una sostanza pura ed elettrolisi) abbiamo invece verificato che, attraverso una reazione chimica, le sostanze possono anche cambiare la loro natura. Non tutte le sostanze però si trasformano (reagiscono) allo stesso modo: sottoposto a riscaldamento il paradiclorobenzene fonde, mentre il clorato di sodio si decompone; messo in contatto con un acido il marmo si corrode, mentre il vetro no; esposto agli agenti atmosferici il ferro arrugginisce, mentre l’oro no. Si definiscono proprietà chimiche di una sostanza i modi in cui essa si comporta nei confronti di altre sostanze (come reagisce, con chi reagisce, a quali prodotti da luogo). Poiché si manifestano attraverso un comportamento, le proprietà chimiche si possono definire e misurare solo confrontando la sostanza da analizzare con altre sostanze diverse. Tutte le altre proprietà dei corpi fin qui studiate (massa, volume, temperatura di fusione ecc.), che sono dette proprietà fisiche, si definiscono e si misurano invece in modo diretto, ossia attraverso uno strumento di misura (bilancia, metro, termometro ecc.). In base a questa differenza possiamo introdurre una nuova suddivisione delle proprietà:
Le proprietà chimiche sono di tipo intensivo, costituiscono un nuovo gruppo di proprietà caratteristiche di una sostanza e possono quindi essere impiegate per la sua identificazione, come avviene in tutte le analisi chimiche.
Sostanze elementari e sostanze composte
Le due reazioni che abbiamo effettuato in laboratorio (decomposizione del clorato di sodio, elettrolisi dell'acqua) si definiscono reazioni di analisi (o di decomposizione), in quanto consentono di ottenere sostanze più semplici di quelle di partenza. Non tutte le sostanze però si possono decomporre, alcune sono infatti talmente tanto semplici da non essere ulteriormente suddivisibili. Esistono pertanto due tipi di sostanze pure: quelle che si lasciano ulteriormente suddividere in una trasformazione chimica e quelle che non lo fanno. Le prime si dicono sostanze composte (o composti), mentre le seconde si dicono sostanze elementari (o elementi). Ogni composto è ovviamente formato dall’unione di due o più elementi: l’acqua, ad esempio, è un composto formato dall’elemento ossigeno e dall’elemento idrogeno. Gli elementi attualmente conosciuti sono poco più di un centinaio: 92 naturali e gli altri ottenuti artificialmente. Aggregandosi tra loro in vario modo essi formano alcuni milioni di composti, dando così origine a tutto ciò che esiste in natura.
A questo punto possiamo dire di aver concluso il nostro tentativo di mettere ordine all’interno dei corpi materiali (ricordate l’esperienza dei 100 barattoli?)
Materia |
Sistemi eterogenei |
|
|
Sistemi omogenei |
Sostanze pure |
Elementi |
|
Composti |
|||
Soluzioni |
|
||
Osservazioni preliminari |
||||||||
Aspetto eterogeneo |
||||||||
Perturbazioni fisico – meccaniche |
||||||||
|
Decantazione |
Centrifugazione |
Filtrazione |
Separazione magnetica |
Estrazione con solvente |
|
||
Aspetto omogeneo
|
||||||||
Perturbazioni dello stato di aggregazione
|
||||||||
|
Evaporazione del solvente |
|||||||
|
Sostanza pura
|
|
||||||
Sostanza composta |
||||||||
Trasformazione chimica |
||||||||
Sostanza elementare |
||||||||
La conservazione della massa
Dall’esperienza effettuata in laboratorio abbiamo osservato che durante le reazioni la massa si conserva . La ripetizione di tantissimi esperimenti di questo tipo ed il raggiungimento dei medesimi risultati, condussero Lavoisier, un chimico francese della fine del ‘700 alla formulazione della legge della conservazione della massa (detta anche legge di Lavoisier) il cui enunciato è il seguente: in una reazione la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti.
Il concetto di legge fisica
Una legge è un’espressione che ci dice come avviene un certo fenomeno, senza spiegarci perché esso avvenga.
L’energia
Si definisce energia la capacità di compiere qualcosa, posseduta da un oggetto o da un corpo. I fisici, più rigorosamente, parlano di energia in termini di produzione di lavoro e scambi di calore. Non possiamo vedere l’energia, ma possiamo solo osservare gli effetti, in termini di calore e lavoro, che si verificano quando essa viene scambiata tra corpi diversio, come sarebbe meglio dire, tra sistemi ed ambienti.
L'energia è un aspetto fondamentale dell’attività sia degli organismi, che del mondo non vivente. Senza energia infatti non può avvenire niente ed il mondo che ci circonda, così come del resto tutto l'universo, esiste grazie a continui scambi di energia.
Esistono molti tipi di energia, che possono trasformarsi l'uno nell'altro, ed ognuno dei quali è collegato ad una particolare caratteristica del corpo o della sostanza che questa energia possiede. Proviamo qui di seguito a farne l'elenco.
Energia di posizione: deriva appunto dalla posizione del corpo che la possiede. Nelle centrali idroelettriche, ad esempio, l'acqua posta nel bacino in alto possiede energia perché cadendo è in grado di far girare un generatore e produrre elettricità; viceversa l'acqua che sta nel bacino in basso non possiede questa energia, perché non è più in grado di muovere il generatore.
Energia di movimento: il vento possiede energia perché può, ad esempio, far girare le pale di un mulino. In questo caso l'energia del vento dipende dal suo movimento, perché quando l'aria è ferma non è in grado di muovere niente.
Energia elettrica: una pila possiede energia perché è capace di far funzionare una radio. Questa energia è di natura elettrica ed è provocata da un flusso di elettroni, detto corrente elettrica, che fuoriesce dalla pila. Una pila è scarica quando non riesce più a produrre corrente elettrica.
Energia termica (o del calore): un termosifone possiede energia perché può scaldare una stanza ed in questo caso l'energia è determinata dal suo calore.
Energia luminosa: ogni giorno il sole, illuminando la terra, ci rifornisce di energia luminosa; anche questa è un'altra forma di energia ed è ovviamente dello stesso tipo di quella posseduta da una lampadina o da una candela accesa.
Energia chimica: anche un bidone di benzina possiede energia, perché bruciando può sia, ad esempio, scaldare qualcosa, sia far marciare una macchina. L'energia posseduta dalla benzina, come quella di tutti gli altri combustibili (sostanze cioè in grado di bruciare), è energia chimica, perché è determinata dalla sua natura chimica, che si manifesta nella combustione.
Quella chimica è un tipo di energia molto importante, in quanto può essere facilmente immagazzinata e conservata, per essere utilizzata al momento più opportuno, cosa che non avviene invece col movimento, col calore, con la luce o con l'elettricità. Tutti i paesi industrializzati vivono in maggioranza dell'energia chimica immagazzinata nel petrolio. Anche gli esseri viventi tuttavia vivono dell'energia chimica contenuta negli alimenti di cui si nutrono, che utilizzano in gran parte come dei combustibili, esattamente come avviene per le automobili con la benzina.
Molte sono quindi le possibili forme dell'energia, ovvero i modi in cui questa si presenta, i quali possiedono inoltre la capacità di trasformarsi l'una nell'altra. Nelle centrali idroelettriche l'acqua trasforma l'energia dovuta alla sua posizione in energia di movimento, che si manifesta con la velocità dell'acqua che cade; questa, a sua volta, trasforma il suo movimento in energia elettrica, tramite il generatore L'energia elettrica può poi trasformarsi in calore, attraverso una stufa, in movimento, come avviene nei treni oppure in energia luminosa, come accade nelle lampadine.
Nelle calcolatrici e negli orologi solari l'energia luminosa si trasforma in energia elettrica, che fa funzionare questi apparecchi; con la fotosintesi l'energia luminosa del sole si trasforma nell'energia chimica contenuta negli zuccheri che, come sappiamo, sono i combustibili utilizzati dagli esseri viventi. Nei motori l'energia chimica dei combustibili si trasforma in energia di movimento, nelle stufe si trasforma in energia termica, nei lumi a petrolio in energia luminosa.
Comunque, in qualsiasi trasformazione sia fisica, che chimica, l’energia non può mai essere creata dal nulla, ne distrutta nel nulla; essa infatti può solo essere trasformata da una forma in un’altra, senza aggiunte, né perdite. Questo principio generale prende il nome di principio di conservazione dell’energia ed è una delle leggi fondamentali tanto della chimica, quanto della fisica.
Da non confondere con le forme di energia sono le fonti energetica, che rappresentano invece i modi con i quali produciamo l’energia di cui abbiamo bisogno. Per chiarezza riassumiamo di seguito le principali fonti energetiche: carbone, petrolio e metano sono combustibili fossili e possiedono energia chimica; l’energia idroelettrica è invece una forma di energia di posizione; l’energia solare è energia luminosa, l’energia eolica è energia di movimento, l’energia geotermica è energia termica, l’energia nucleare è infine un particolare tipo di energia fisica.
Osservando l’andamento dei consumi energetici nel corso degli ultimi 45 anni del 20° secolo possiamo facilmente capire quanto enorme sia stato l’aumento del consumo di energia, anche se, in verità, esso non è stato omogeneamente distribuito tra tutte le popolazioni del pianeta. Le cause che lo hanno determinato sono complesse, così come complessi sono gli effetti che da esso si sono prodotti; tra di essi possiamo però certamente annoverare alcuni gravi problemi ambientali, ma anche tante guerre, recenti e meno recenti.
Le relazioni tra sistema e ambiente
 Abbiamo già definito cosa si intende per sistema e cosa si intende per ambiente. Quando un sistema non scambia con l'ambiente ne' materia ne' energia si definisce isolato. Nella realtà un tale sistema non esiste o comunque non è di nostro interesse.Un sistema si dice invece chiuso quando scambia con l'ambiente energia, ma non materia. Sistemi di questo tipo sono molto più comuni, basti pensare, ad esempio, ad un qualsiasi corpo contenuto in un recipiente chiuso: la chiusura del recipiente impedisce gli scambi di materia, ma non impedisce gli scambi di energia, in particolare di quella termica. Un sistema si dice infine aperto quando scambia con l'ambiente sia materia che energia. Una pentola senza coperchio è un recipiente aperto, ma lo è anche un essere vivente oppure il motore di un’auto.
Abbiamo già definito cosa si intende per sistema e cosa si intende per ambiente. Quando un sistema non scambia con l'ambiente ne' materia ne' energia si definisce isolato. Nella realtà un tale sistema non esiste o comunque non è di nostro interesse.Un sistema si dice invece chiuso quando scambia con l'ambiente energia, ma non materia. Sistemi di questo tipo sono molto più comuni, basti pensare, ad esempio, ad un qualsiasi corpo contenuto in un recipiente chiuso: la chiusura del recipiente impedisce gli scambi di materia, ma non impedisce gli scambi di energia, in particolare di quella termica. Un sistema si dice infine aperto quando scambia con l'ambiente sia materia che energia. Una pentola senza coperchio è un recipiente aperto, ma lo è anche un essere vivente oppure il motore di un’auto.
Fonte: http://www.liceodavincifi.it/_Rainbow/Documents/trasformazioni,%20composti%20ed%20elementi%20.doc
Autore del testo: non indicato nel documento di origine
LE TRASFORMAZIONI FISICHE (cap.2) E CHIMICHE (cap.3) DELLA MATERIA
Gli stati fisici della materia
• Come abbiamo già detto, la materia è tutto ciò che è dotato di massa e occupa uno spazio.
• La materia può esistere in 3 stati fisici diversi: liquido, solido e aeriforme. Gli stati della materia dipendono dalla costituzione della materia stessa, dalla temperatura e dalla pressione.
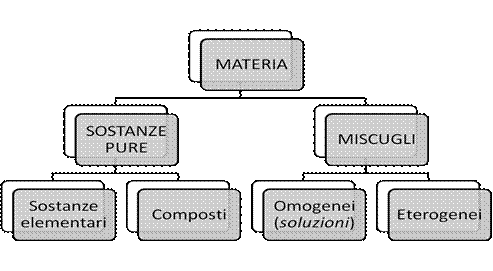
SOSTANZE PURE: Una sostanza viene detta pura quando possiede specifiche proprietà uguali in ogni punto (come, p.e., la densità, il punto di fusione, il punto di ebollizione, che si ripetono costantemente in ogni suo campione), e ha una composizione chimica costante .
Le sostanze si dividono in 2 gruppi in base alla possibilità di scinderle mo meno in sostanze più semplici:
- ELEMENTI O SOSTANZE ELEMENTARI: non possono essere scomposti in sostanze più semplici, perché formate da atomi uguali (p.e.: l’H, il Fe, l’O, il Na, ecc.)
- COMPOSTI: sostanze formate da 2 o più elementi, combinati secondo un rapporto costante. I composti possono essere scissi (con procedimenti chimici) negli elementi costituenti (p.e.: l’H2O, l’NaCl, ecc.).
MISCUGLI (o miscele): sono insiemi fisici di 2 o più sostanze e hanno una composizione variabile. Un composto si può indicare con una specifica formula chimica, una miscela no. (p.e.: l’acqua e il sale sono sostanze pure, ma quando il sale è sciolto in acqua si ottiene una miscela (l’acqua salata) la cui composizione chimica è variabile e dipende da quanto sale è stato sciolto nell’acqua.)
• Un miscuglio di due o più sostanze può essere omogeneoquando i suoi componenti sono mescolati in modo uniforme; se formato da particelle con dimensione inferiore a 1 nm il miscuglio prende il nome di soluzione(per esempio, acqua e sale) [vedi esempi].
Tipo di soluzione |
Esempio |
Componenti principali |
solido-solido |
acciaio |
Fe, C |
liquido-liquido |
grappa |
acqua, alcol |
liquido-solido |
acqua di mare |
acqua, Sali |
liquido-gas |
acqua gasata |
acqua, CO2 |
gas-gas |
aria |
N, O |
• Un miscuglio è eterogeneoquando le sostanze che lo formano si trovano mescolate in modo non uniforme (per esempio, acqua e olio).
Esistono vari tipi di miscugli eterogenei: (schiuma è un miscuglio ottenuto dalla dispersione di un gas in un liquido (panna montata); emulsione è un m.e. tra 2 liquidi immiscibili(maionese [olio e tuorlo d’uovo]); fumo è un m.e. tra un solido e un gas; nebbia è un m.e. tra un liquido e un gas).
I colloidisono sospensioni di particelle di diametro compreso tra 20.000 e 100.000 nm in un solvente. I colloidi rappresentano una situazione intermedia tra miscugli e soluzioni, e si dividono in sol (se prevale la fase disperdente, liquida o gas, su quella solida) e gel (se prevale la fase solida).
I passaggi di stato
• I passaggi di statocomportano la trasformazione della materia da uno stato fisico all'altro (per esempio da liquido a solido) grazie a variazioni della temperatura e della pressione.

Bisogna precisare che gas e vapori non sono la stessa cosa.
Con il termine vapore si indica un aeriforme che, nelle condizioni date di T, può passare allo stato liquido o solido per sola compressione (vapore proveniente dall’acqua, dalla benzina, dall’alcol, dalla canfora); con il termine gas si indica una sostanza che, in quelle stesse condizioni di T, è stabilmente aeriforme (metano, aria, elio, ossigeno, ecc.) .
IN PRATICA, ogni aeriforme ha una particolare T detta “Tcritica”.
Se la Tesercizio > Tcritica l’aeriforme viene chiamato gas e non può essere trasformato in liquido, qualunque sia la P che si esercita su di esso.
Se la Tesercizio < Tcritica l’aeriforme viene chiamato vapore ed è trasformabile in liquido per sola compressione.
Aria |
- 141 °C |
H2 |
- 240 °C |
CO2 |
+ 31,1 °C |
Ne |
- 228 °C |
Cl2 |
+ 144 °C |
O2 |
- 118,7 °C |
He2 |
- 267,9 °C |
H2O |
+ 374 °C |
P.e.: l’O2 ha un Tc di -118,7°C. A Tambiente, quindi, l’O2 è un gas e rimane tale anche se viene compresso. Per farlo liquefare bisogna raffreddarlo sotto i -119°C. Questo è il motivo per cui non esiste O2 allo stato liquido sul nostro pianeta: tali temperature così basse non sono state mai registrate.
L’aria è un vapore solo a T< - 141 °C ; il vapore d’acqua è un gas solo a T>+374 °C.
LE TRASFORMAZIONI CHIMICHE DELLA MATERIA
Le trasformazioni fisiche provocano un cambiamento fisico reversibile della materia; nelle trasformazioni fisiche non si formano nuove sostanze.
(Passaggio di stato, dissoluzione di un sale in acqua, magnetizzazione di un ago con una calamita, ecc.)
Le trasformazioni chimiche (che avvengono attraverso reazioni chimiche) sono cambiamenti che comportano la formazione di nuove sostanze (prodotti) aventi proprietà profondamente diverse da quelle dei materiali originari (reagenti).
(Combustione, formazione di ruggine, produzione di yogurt e formaggio, ecc.)
La tavola periodica permette di classificare gli elementi.
I chimici hanno stabilito di usare apposite abbreviazioni per indicare gli elementi. Tali abbreviazioni prendono il nome di simboli e sono costituiti da 1 o 2 lettere, di cui la prima è maiuscola.
LA classificazione degli elementi all’interno della tavola periodica si basa sulle loro differenti proprietà fisiche e chimiche. In base a questa classificazione distinguiamo tre classi di elementi: metalli, non metalli e semimetalli.
METALLI: lucenti, buoni conduttori di calore ed elettricità, duttili (ridurre in fili o lamine sottili), malleabili (modellati a pressione o con martello)
NON METALLI: proprietà opposte.
SEMIMETALLI: proprietà intermedie.
Fonte: http://www.istitutomagistralefonseca.it/public/file/Cap%202%20&%203_LE%20TRASFORMAZIONI%20FISICHE%20(cap_2)%20E%20CHIMICHE%20(cap_3)%20DELLA%20MATERIA.doc
Autore del testo: non indicato nel documento di origine
Trasformazioni fisiche della materia
Visita la nostra pagina principale
Trasformazioni fisiche della materia
Termini d' uso e privacy