Considerazioni generali sui fenomeni corrosivi
Considerazioni generali sui fenomeni corrosivi
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Considerazioni generali sui fenomeni corrosivi
Con il termine corrosione si indica il complesso dei fenomeni chimico-fisici che comportano il degrado dei materiali metallici ad opera dell'ambiente a cui sono esposti. La corrosione è un lento attacco chimico promosso dall'affinità chimica tra il metallo o lega ed alcuni componenti dell'ambiente (O2, acidi, ecc.). Si parla in tal senso di ANTIMETALLURGIA, poiché il metallo torna alle forme termodinamicamente più stabili, dalle quali era stato sottratto mediante somministrazione di lavoro elettrico o chimico (estrazione, raffinazione).
La maggior parte dei materiali metallici di impiego industriale è di fatto TD-nte instabile in ambiente naturale. La spontaneità (e quindi irreversibilità) di una reazione dallo stato metallico allo stato ossidato Me° = Mez+ + z e- è quantificata dalla diminuzione di Energia Libera (di Gibbs) associata alla reazione. Se una reazione chimica ha associato un DG <0, vuol dire che la reazione è favorita TD-nte e si svolge irreversibilmente nel verso in cui è scritta. Quando il DG per la reazione ha segno positivo, vuol dire che la reazione non avviene nel verso in cui è scritta ma è spontanea nel verso opposto. Il DG di una reazione ad una data temperatura e con certe concentrazioni (attività) delle specie coinvolte si può calcolare da dati termodinamici tabulati.
Gli ambienti naturali sono in genere caratterizzati dalla presenza di ossigeno e nell’acqua sono sempre presenti ioni H+ che possono, in linea di principio, ossidare molti metalli. Nella Tabella 1 si riportano i valori di DG relativi alle reazioni di ossidazione di alcuni metalli con quest’ultime specie. Si osserva come K, Zn e Fe abbiano tutti DG negativi in corrispondenza di entrambe le reazioni, mentre il rame metallico può passare alla forma ossidata solo se presente ossigeno. Infine l’oro metallico non viene ossidato spontaneamente né dall’ossigeno né dall’ambiente acido.
Reazione DG = DH - TDS (KCal/mol.)
|
|||
|
Evoluzione H2, (pH = 0) 2H+ + 2e- = H2 |
Assorbimento O2 (pH =7) O2 + 2H2O + 4e- = 4OH- |
|
K <-> K+ |
-67.4 |
-86.2 |
|
Zn <-> Zn++ |
-17.9 |
-36.7 |
|
H <-> H+ |
0.0 |
-18.8 |
|
Fe <-> Fe++ |
-11.6 |
-30.4 |
Fe, Zn -> metalli attivi |
Cu <-> Cu++ |
7.8 |
-11.02 |
Cu, Ag -> metalli seminobili |
Au <-> Au++ |
34.5 |
15.7 |
Au, Pt, Pd -> metalli nobili |
Tabella 1.
Da questi dati si può capire come mai non possono esistere miniere di ferro o zinco metallico, presenti normalmente sotto forma di ossidi/minerali. Esistono invece filoni di oro e platino metallici.
I materiali di uso ingegneristico, quando esposti in atmosfere naturali o industriali, tendono quindi ad ossidarsi, cioé corrodersi. Quando ciò accade si dice che il materiale è in condizioni di attività. Tuttavia, la condizione termodinamica non è la sola a dover essere considerata. Ha infatti enorme interesse sapere anche a quale velocità procederà il danneggiamento, cioè quale sarà la cinetica dei processi corrosivi.
I danni causati dalla corrosione sono enormi. Il danneggiamento corrosivo spesso non si limita alla semplice sostituzione del componente interessato (costi diretti), ma possono comprendere una serie di danni indiretti, quali ad es. perdite di prodotto attraverso condutture o apparecchiature, fermi impianto non programmati, incidenti agli operatori ecc. Un caso frequente è la perdita di prodotto conseguente alla foratura di un'apparecchiatura di scambio termico; il prodotto entra così nel circuito di raffreddamento e viene scaricato all'esterno con scarse probabilità di individuazione. Danni indiretti sono anche la perdita di efficienza di apparecchiature in conseguenza ad accumuli di prodotti di corrosione; questi fanno aumentare le perdite di carico ed obbligano ad accrescere la potenza di pompaggio, o diminuiscono i rendimenti degli scambi termici modificando i bilanci energetici, le temperature di processo, la qualità e la resa in prodotto finito. Danni indiretti sono da considerare quelli provocati dall'inquinamento dei prodotti (industria alimentare e farmaceutica) e dai conseguenti fermi impianto per permettere la sostituzione delle apparecchiature deteriorate.
Il problema della corrosione deve essere affrontato già in sede di progettazione delle apparecchiature, predisponendo un'oculata scelta dei materiali ed un'efficace sistema di protezione; deve essere inoltre previsto un adeguato sistema di conduzione e manutenzione dell'impianto durante la sua vita operativa seguendo il principio generale di ottenere un grado di affidabilità per i singoli componenti tanto maggiore quanto più vitale è il ruolo da essi ricoperto.
Esistono due tipi di corrosione: a) corrosione a secco, cioè ossidazione dei metalli ad alta temperatura con cinetiche dipendenti dalla Termodinamica Chimica, b) corrosione ad umido, cioè corrosione in ambiente acquoso attraverso processi di natura elettrochimica dipendenti dalla termodinamica e cinetica elettrochimica. Nella corrosione a umido l'ambiente corrosivo è costituito da soluzioni acquose, con funzionamento di sistemi galvanici in cui il processo corrosivo è la risultante di un processo anodico di dissoluzione del materiale in congiunzione a un parallelo processo catodico. Queste semireazioni avvengono entrambe in stretta prossimità della superficie metallica.
Consideriamo, ad esempio, il processo di corrosione di un metallo immerso in acqua contenente ossigeno disciolto.
Il processo corrosivo può essere suddiviso in due processi indipendenti, concomitanti e complementari:
1) processo anodico (ossidazione). Trasferimento del metallo in ioni idratati, con un numero equivalente di elettroni "lasciati" sulla superficie del metallo. Me -> Me++(nH2O) + 2e-
2) processo catodico (riduzione). Assimilazione dell'eccesso di elettroni da parte di depolarizzatori (atomi, molecole o ioni capaci di essere ridotti al catodo), in questo esempio ossigeno, tramite la semireazione O2 + 2e- + H2O -> 2OH-
Questi due processi sono indipendenti ma complementari, nel senso che il numero di elettroni nell’unità di tempo lasciati sulla superficie metallica dalla reazione anodica deve essere uguale al numero di elettroni nell’unità di tempo consumati dal depolarizzatore nella semireazione catodica [ vox = vred]. Infatti, se così non fosse, si avrebbe un accumulo di carica elettrica nel metallo.
Queste relazioni avvengono entrambe all’interfaccia metallo-soluzione acquosa, zona nella quale esse possono comportare modificazioni sensibili dell'ambiente acquoso (ad esempio un sensibile aumento di pH). Le reazioni secondarie che avvengono quando i prodotti delle reazioni anodiche e catodiche vengono a contatto fra loro o con altre sostanze ambientali, portano alla separazione di ossidi, idrossidi, sali basici. In funzione delle caratteristiche chimico-fisiche e costitutive degli eventuali strati superficiali formati (continuità, compattezza, conducibilità elettronica, ecc. ecc.) si possono avere sensibili riflessi sulla velocità con cui proseguono nel tempo i processi corrosivi.
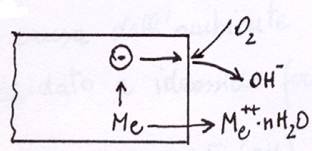
Ad esempio, nel caso del ferro in ambiente acquoso a pH = 7 (acqua naturale).
Reazione anodica |
Fe à Fe+++ 2e- |
Reazione catodica |
0.5 O2 + 2e- + H2O à 2OH- |
In soluzione |
Fe++ + 2OH-à Fe(OH)2 |
Reazione globale di corrosione ad umido |
Fe + 0.5 O2 + H2O à Fe(OH)2 |
A causa dell'ambiente esterno l'idrossido ferroso può a sua volta essere ossidato a idrossido ferrico (ma anche direttamente Fe2+àFe3+):
2 Fe(OH)2 + 0.5 O2 à Fe2 O3 . H2O + H2O (Fe2O3 ematite)
Viene così a formarsi la ben nota ruggine di colore rosso-bruno. Tuttavia, in funzione delle caratteristiche ambientali, sono possibili diversi stati di ossidazione del ferro. Di solito, la ruggine spessa è formata da strati successivi di FeO (Wustite), Fe3O4 .H2O (Magnetite idrata verde), Fe3 O4 (Magnetite Anidra Nera), Fe2O3 .H2O (Ematite rosso-bruna). Il deposito di ruggine è per sua natura discontinuo, poroso e scarsamente protettivo. Sebbene la sua presenza rallenti in qualche misura la velocità di corrosione del metallo sottostante, il danneggiamento prosegue comunque a velocità apprezzabili e dipendenti dall’ambiente corrosivo.
Vi sono anche strati superficiali di prodotti di corrosione abbastanza protettivi, come nel caso dello zinco esposto all'azione atmosferica, dove vengono a formarsi miscugli di ossidi/idrossidi di zinco e vari altri sali basici, capaci di proteggere almeno parzialmente il metallo sottostante; oppure strati spessi e compatti di solfato di ferro per acciai in contatto con acido solforico concentrato.
Nel caso in cui l’interazione tra metallo e ambiente comporti la formazione di composti assai protettivi, capaci cioè di ridurre in modo drastico la velocità di corrosione, si parla di stato di passività del metallo (ad esempio acciai inox, titanio, superleghe base nichel, alluminio in ambienti naturali ).
Fonte: http://www1.diccism.unipi.it/De_Sanctis_Massimo/Corrosione/Appunti%20di%20corrosione.doc
Sito web da visitare: http://www1.diccism.unipi.it/De_Sanctis_Massimo
Autore del testo: Massimo De Sanctis
Parola chiave google : Considerazioni generali sui fenomeni corrosivi tipo file : doc
Considerazioni generali sui fenomeni corrosivi
Visita la nostra pagina principale
Considerazioni generali sui fenomeni corrosivi
Termini d' uso e privacy