Nefrologia
Nefrologia
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione)
Rene
Tre funzioni principali.
-
Mantenimento dell’omeostasi dei liquidi
-
Eliminazione dell’urea e di altre sostanze
-
Funzioni endocrine (eritropoietina, vitamina D in forma attiva, renina)
La percentuale di acqua nel corpo varia con il variare dell’età, nel feto si avvicina al 100%, nel neonato è circa l’80%, nell’adulto il 70% e nell’anziano il 50%. Negli obesi la percentuale di acqua è inferiore rispetto ai normopeso (il tessuto adiposo contiene poca acqua). 2/3 di quest’acqua si trova nel compartimento intracellulare.
L’edema è un eccesso di liquido nell’interstizio. L’edema periferico si localizza nelle zone declivi dell’organismo.
Le “gambe gonfie”, possono essere dovute ad un problema locale (infiammazione, insufficienza venosa, linfedema, farmaci come i calcio antagonisti) o generale, ed è importante discriminare tra questi due ordini di cause.
Il “pitting edema” è un edema che, dopo digitopressione, lascia una fovea, e corrisponde ad una ritenzione di almeno 5 kg di acqua.
Soluti (mMol/L) |
Plasma |
Liquido interstiziale |
Liquido intracellulare |
Na+ |
140 |
144 |
10 |
Ca++ |
2 |
2 |
10-4 |
Cl- |
100 |
115 |
3 |
HCO3- |
28 |
30 |
10 |
Proteine |
16 |
10 |
55 |
K+ |
4 |
4 |
160 |
La concentrazione di soluti nel liquido extracellulare rispecchia la concentrazione degli stessi nel mare attuale, in cui si sono evoluti gli organismi pluricellulari, il liquido intracellulare, invece, rispecchia la composizione del mare primordiale in cui si sono evolute le prime cellule (ed in cui abbondava il potassio, ma non il cloruro di sodio, trasportato successivamente dai fiumi).
Il volume extracellulare è determinato esclusivamente dal contenuto totale di Na+ nell’organismo.
Nel rene circa il 99% del sodio filtrato viene riassorbito.
Un’espansione del VEC (Volume ExtraCellulare) innesca un circuito che, alla fine, tende a ripristinare l’omeostasi.
L’insufficienza renale, sia cronica che acuta, può causare edema, poiché aumenta il VEC.
Il rene può essere “ingannato” da un volume circolante ridotto in presenza di VEC non diminuito, come accade nello scompenso cardiaco, in cui il volume efficace che perfonde i reni è ridotto, mentre i liquidi totali corporei sono aumentati.
Edema
- scompenso cardiaco
Teoria anterograda: un ridotto volume efficace causa un aumentato riassorbimento, con aumento del VEC.
Teoria retrograda: l’aumento della pressione idrostatica e la riduzione della pressione oncotica (a causa dell’emodiluizione) nel compartimento venoso provoca uno stravaso di liquido.
Diagnosi: un ECG non può dire con certezza se c’è uno scompenso, ma può dire se c’è ipertrofia, gli enzimi possono essere utili per un eventuale infarto (ma non è l’unica causa di scompenso), l’ecocardio risulta molto utile, tranne nel caso di uno scompenso diastolico, in cui la frazione di eiezione resta normale (semplicemente non arriva abbastanza sangue, è il caso di una pericardite costrittiva o di una cardiopatia ipertrofica).
L’unica opzione valida è visitare il paziente per confermare l’origine dell’edema; nello scompenso cardiaco si possono trovare: turgore delle giugulari, cute pallida e fredda da vasocostrizione ed epatomegalia da stasi. E’ importante auscultare i polmoni per gli eventuali rantoli. Le giugulari possono pulsare (non si confondono con le carotidi poiché queste ultime non sono mai visibili) in modo dicroto (prima pulsazione, pausa, seconda pulsazione) e ciò ha un significato prognostico negativo (la prima pulsazione corrisponde alla sistole atriale, la seconda alla chiusura della valvola tricuspide). Auscultando il cuore si può sentire un ritmo di galoppo.
Se è presente edema polmonare è necessario intervenire rapidamente con morfina o cardiostenolo (calmano subito i sintomi e riducono l’ipertensione polmonare), successivamente con diuretici per ridurre il volume plasmatico (in particolare lo spironolattone, un anti-aldosteronico), ACE inibitori e digitale.
Vanno assolutamente evitati i plasma expanders poiché non riducono né il precarico né il postcarico.
- cirrosi epatica
Molteplici fattori concorrono nella formazione dell’edema nella cirrosi epatica:
- la riduzione della concentrazione dell’albumina che provoca una riduzione della pressione oncotica
- l’ipertensione portale che dilata i vasi di capacitanza con conseguente sequestro di sangue alla volemia efficace
- l’aumento della pressione idrostatica del circolo splancnico che causa ascite
- i numerosi shunts periferici che equivalgono ad una grossa fistola A-V che riduce la volemia efficace
Nella cirrosi sono presenti spider nevi, eritema palmare, addome batraciano, neuropatia ed ittero.
A causa di vie metaboliche normalmente non importanti, vi è produzione di octopamina (così chiamata perché estratta per la prima volta dai polpi), che è un vasodilatatore e favorisce la formazione di shunts.
- sindrome nefrosica
I quattro sintomi cardinali di questa sindrome sono: proteinuria, ipo-disprotidemia, edema ed iperlipidemia.
Diversamente da quanto erroneamente si può credere, ipertensione ed ematuria non sono sintomi di sindrome nefrosica.
La sindrome è generata da un’abbondante proteinuria, superiore a 3 g nelle 24 ore (la normale proteinuria è di 250 mg/die).
La concentrazione delle proteine nel plasma è ridotta e, essendo ciò dovuto ad una alterazione del filtro renale, sono perse le proteine più piccole, in particolare l’albumina che, con i suoi 70.000 Da di peso, è la più piccola. Le a2 globuline aumentano percentualmente, essendo più grosse.
Normale distribuzione percentuale delle proteine: albumina 50%, a1 3%, a2 10%, b 12-15%, g 19%.
L’ipoalbuminemia favorisce l’edema, ma non è sufficiente (tutto il plasma normalmente presente nel circolo, da solo, non basterebbe a generare un edema), il vero motore è l’ipovolemia efficace che provoca un aumento del riassorbimento di acqua e sale, con prevalenza di acqua e, di conseguenza, iposodiemia.
L’ipoprotidemia stimola il fegato ad iperprodurre grandi molecole proteiche che non passano il filtro renale, tra cui lipoproteine, per questo motivo nella sindrome nefrosica è presente iperlipidemia.
Cause di sindrome nefrosica: nefriti, nefropatia diabetica (prima causa nei paesi avanzati di uremia terminale), amiloidosi, malaria quartana (prima causa nel mondo, comprendendo anche i paesi poveri).
- insufficienza renale
L’ipervolemia è direttamente causata da un’insufficiente eliminazione di sale ed acqua. Valutare l’azotemia.
Contenuto di sodio corporeo totale e VEC
La sodiemia non è un indice dello stato del VEC, poiché essa è una concentrazione e non rispecchia la quantità totale di sodio. Le variazioni della sodiemia rispecchiano invece la quantità di acqua, ragion per cui non si deve somministrare sodio ad un paziente in iposodiemia.
Per valutare guadagni e perdite di liquidi, un buon sistema è pesare regolarmente il paziente ogni giorno (difficilmente a causa di un aumentato catabolismo si possono avere perdite superiori ad un kg in qualche giorno, la differenza di peso è quindi pressoché interamente imputabile ai liquidi corporei). L’edema anasarcatico è un sicuro indice di espansione del VEC, anche l’ipertensione può indicare un aumento del VEC.
L’edema tende ad accumularsi nelle parti declivi, per cui dopo un prolungato ortostatismo (di sera) si troverà nelle gambe, mentre dopo prolungato clinostatismo (al mattino o negli allettati) si troverà in regione sacrale.
Segni di deplezione del VEC sono: ipotensione ortostatica (fisiologicamente passando da clino ad orto, la pressione diastolica aumenta, è quindi necessario misurare la pressione a paziente supino da un certo tempo e poi rapidamente subito dopo che lo si è fatto alzare; questa misura è falsata se il paziente fa uso di farmaci anti-ipertensivi), sete (stimolata dalla renina), emoconcentrazione (aumento dell’ematocrito, dei leucociti e della protidemia, in casi gravi persino nella sindrome nefrosica si può avere iperprotidemia), oliguria.
L’ematocrito non aumenta in caso di perdita di acqua pura (ad esempio nell’iperventilazione) perché la deplezione coinvolge tanto il compartimento extracellulare (il plasma), quanto quello intracellulare (gli eritrociti).
Esaminando la lingua, nei casi gravi vi si può notare la comparsa di solchi trasversali, mentre non hanno valore diagnostico né la secchezza né le eventuali patine.
Sollevando la cute in pliche si può testare il turgore cutaneo: se ha perso elasticità, essa resta sollevata alcuni istanti, invece di ritornare immediatamente alla forma iniziale.
Il respiro cerebrale, iperventilando, porta all’alcalosi ed alla perdita di molti liquidi.
Sodiemia ed osmolarità plasmatica
In assenza di un osmometro, si può valutare in maniera abbastanza precisa l’osmolarità plasmatica (normale: 290-300 mOsm/L) con la sodiemia.
L’osmolarità è un valore dipendente dal numero di molecole in soluzione (indipendentemente dalle loro dimensioni).
Le alterazioni dell’osmolarità riflettono sempre alterazioni del contenuto di acqua e mai alterazioni dei soluti.
Un metodo per introdurre per via endovenosa acqua pura nel corpo e ridurre l’osmolarità senza provocare emolisi consiste nel somministrare soluzione glucosata al 5%: il glucosio è rapidamente metabolizzato e resta solo acqua pura.
Il paziente in ipersodiemia va quindi trattato facendogli bere acqua o somministrando glucosata.
Il rene regola l’osmolarità modificando il contenuto corporeo di acqua, essendo impossibile regolare tutti i singoli soluti contemporaneamente.
L’ADH riduce l’eliminazione di acqua modificando il riassorbimento della stessa nel tubulo distale e nel dotto collettore.
Nel tratto spesso ascendente dell’ansa di Henle i soluti vengono pompati fuori, ma il tratto è impermeabile all’acqua; il liquido nel tubulo distale è quindi ipotonico e si forma un gradiente osmotico midollare (l’osmolarità varia da 300 mOsm/L alla superficie della midollare a circa 1400 mOsm/L in profondità) che permette il riassorbimento di acqua nel tubulo distale.
Se il tubulo distale è impermeabile, le urine prodotte saranno diluite, se l’ADH ha reso il tubulo permeabile, potrà aversi il riassorbimento e le urine saranno più concentrate.
I nuclei sopraottici e paraventricolari dell’ipotalamo percepiscono l’osmolarità plasmatica e regolano la produzione di ADH da parte della neuroipofisi.
Avendo l’ADH anche un effetto vasocostrittivo, è anche sotto controllo circolatorio. Quando il volume circolante efficace si riduce vi è un forte stimolo alla produzione di ADH; questo controllo ha un’origine molto antica: nei rettili l’ADH controlla fortemente la circolazione. Per questa ragione nello scompenso cardiaco, nella cirrosi e nella sindrome nefrosica vi è una ipoosmolarità plasmatica.
La sodiemia rispecchia l’osmolarità plasmatica: il valore normale della sodiemia è 140 mOsm/L, gli anioni necessari a neutralizzare le cariche del sodio saranno altrettanti, quindi sodio + anioni = 280 mOsm/L (basta aggiungere 20 mOsm/L per avere l’osmolarità plasmatica totale che è di 300 mOsm/L).
L’osmolarità extracellulare determina il volume intracellulare. Le cellule del SNC sono molto sensibili a rapide e marcate alterazioni dell’osmolarità, ma hanno un meccanismo di difesa contro le alterazioni sul lungo periodo.
Nell’edema anasarcatico è presente iposodiemia a causa della ritenzione idrica, sebbene il sodio totale corporeo sia molto aumentato.
Pseudoiposodiemia: si verifica in presenza di enormi quantità di lipidi o proteine che fanno molto volume mimando una iposodiemia perché la concentrazione di sodio appare ingannevolmente ridotta, ma proteine e trigliceridi hanno un effetto trascurabile sull’osmolarità. Ciò avviene ad esempio nell’ipertrigliceridemia familiare e nel mieloma multiplo.
In presenza di iperglicemia, la sodiemia non è più un ottimo indicatore di osmolarità perché il glucosio estrae acqua dalle cellule e si ha iposodiemia anche in presenza di aumentata osmolarità (a causa dello zucchero).
Cause di iposodiemia: scompenso cardiaco, sindrome nefrosica, insufficienza renale, assunzione di diuretici in paziente che beve (si ha perdita di sale ed acqua ed ingresso di sola acqua), sindrome paraneoplastica da inappropriata secrezione di ADH.
Una eccessiva sudorazione causa ipersodiemia poiché il sudore è un liquido ipotonico. La perdita insensibile di acqua pura da cute e polmoni varia da 600 a 1000 ml/die nell’adulto normale.
Potassio
Valori normali: 3,5 - 5 mEq/L. Emergenza se <3 mEq/L o >6 mEq/L.
Segni di ipopotassiemia: astenia, stanchezza, paralisi flaccida, crampi muscolari.
Segni di iperpotassiemia: contrazioni muscolari, irrequietezza.
Per capire la ragione di questi sintomi è necessario considerare il potenziale di membrana nell’Equazione di Nernst.
Quindi, all’aumentare della concentrazione di potassio nel compartimento extracellulare, la membrana si depolarizza, avvicinandosi alla soglia di eccitabilità e, viceversa, al diminuire della concentrazione di potassio nel compartimento extracellulare la membrana si allontana dalla soglia di eccitabilità.
Segni ECG da ipopotassiemia: onda T abbassata ed arrotondata, onda U prominente con onda T negativa, tratto S-T sottoslivellato “a scodella” (come accade con la digitale), intervallo P-R allungato e onda P prominente.
Segni ECG da iperpotassiemia: onda T elevata, onda P in diminuzione fino alla scomparsa, complesso QRS ed onda T difasici e fusi assieme (rischio di morte improvvisa per arresto cardiaco).
Il potassio è liberamente filtrato dal glomerulo, è poi riassorbito nel tubulo prossimale e secreto, infine, dal tubulo distale in scambio con il sodio. Una maggiore delivery distale di sodio comporterà una maggiore quantità di sodio a contatto con il tubulo distale e, conseguentemente, un maggior riassorbimento di sodio e secrezione di potassio.
In sintesi, più sodio arriva al tubulo distale, più potassio viene secreto.
L’aldosterone, inoltre, aumenta il riassorbimento di sodio comportando una maggior secrezione di potassio.
La glicosuria aumenta la secrezione di potassio poiché il glucosio trascina con sé acqua e sale, determinando un’aumentata delivery distale di sodio.
In generale, tutte le cause di poliuria osmotica prossimale provocano perdita di potassio.
La potassiemia dipende anche dal pH sanguigno a causa della pompa sodio potassio (che scambia 2 ioni potassio in entrata con 3 ioni sodio in uscita), che “confonde” i protoni con il potassio.
Se aumenta la concentrazione di protoni, una maggior percentuale di essi verrà scambiato con il sodio e più potassio resterà nel compartimento extracellulare.
Acidosi à iperpotassiemia. Alcalosi à ipopotassiemia.
Nell’insufficienza renale non vengono eliminati né i protoni né il potassio, entrambe le cause determinano iperpotassiemia.
L’angiotensina II stimola la produzione di aldosterone ed aumenta l’eliminazione di potassio, per questo motivo gli ACE-inibitori e gli anti-aldosteronici determinano iperpotassiemia.
Correggendo il diabete scompensato si normalizza il pH (si eliminano i chetoacidi), riducendo la potassiemia (inoltre la poliuria dovuta all’iperglicemia ha causato perdite di potassio).
Terapia per l’iperpotassiemia
Inizialmente si somministra calcio gluconato in glucosata per contrastare la depolarizzazione così da mettere il paziente in sicurezza e prevenire l’arresto cardiaco. Successivamente si alcalinizza il pH per spostare il potassio all’interno delle cellule, poi si somministrano insulina e glucosio (l’insulina porta glucosio e potassio nelle cellule e lo fissa al loro interno perché, aumentando il glicogeno, il potassio si ancora ad esso; l’insulina, quindi, aumenta la capacità potassica delle cellule).
Infine si elimina il potassio somministrando molto diuretico o attraverso la dialisi se il paziente è in insufficienza renale.
E’ possibile anche far perdere potassio dall’intestino somministrando resine a scambio ionico che cedono calcio e trattengono potassio e non sono assorbibili.
Alterazioni del pH
pH normale: 7,4 o 40 nMol/L. pH = costante • Log [HCO3-]/[CO2]
Acidità volatile: 15.000-20.000 nMol/die
Acidi fissi: 70-100 nMol/die
La concentrazione del bicarbonato è maggiore nel sangue venoso perché l’anidrasi carbonica nel globulo rosso compie la reazione H2O + CO2 = H2CO3 = H+ + HCO3- che viene compensata da un’uscita di bicarbonato ed un ingresso di cloro, ma il sangue venoso resta comunque più acido di quello arterioso.
Il riassorbimento del bicarbonato nel rene è mediato dall’anidrasi carbonica presente sull’orletto a spazzola nel tubulo prossimale. Sono scambiati protoni (in uscita) con sodio (in entrata). Nel tubulo distale, all’interno delle cellule intercalate, l’anidrasi carbonica media l’espulsione pura di protoni per rigenerare il bicarbonato che è stato utilizzato per tamponare gli acidi forti. Il sistema tampone nel tubulo è l’ammoniaca NH3 (prodotta nel prossimale) che nel distale forma ione ammonio NH4+ a causa dell’eccesso di protoni e passa così dallo stato gassoso ad uno stato non più diffusibile, restando intrappolata nel tubulo.
Il tamponamento è necessario per la sopravvivenza delle cellule. 2/3 dei protoni sono tamponati, il terzo restante è escreto come acidità titolabile.
La secrezione di protoni nel tubulo è sodio-dipendente e da ciò dipende anche il riassorbimento di bicarbonato.
I termini acidosi ed alcalosi si riferiscono ad un meccanismo patogenetico a prescindere dal pH sanguigno, mentre i termini acidemia ed alcalemia si riferiscono all’effetto sul pH sanguigno.
Ad esempio, se è presente insufficienza renale (acidosi) e polmonite (alcalosi dovuta all’iperventilazione per compensare la riduzione dell’ossigeno nel sangue che elimina molta anidride carbonica essendo quest’ultima 20 volte più diffusibile dell’ossigeno), le due situazioni coesistono e si può avere acidemia o alcalemia a seconda di quale delle due prevale.
Acidosi metabolica
Meccanismi patogenetici: perdita di bicarbonato, mancata rigenerazione del bicarbonato, ingresso di protoni.
Se è ridotto il riassorbimento di bicarbonato, per poter assorbire sodio e mantenere l’elettroneutralità è necessario riassorbire più cloro e l’acidosi è detta ipercloremica.
Se invece il cloro è sostituito da un altro anione (ad esempio un chetoacido) che riduce la bicarbonatemia, l’acidosi è detta normocloremica.
La sola cloremia non è un indice affidabile perché dipende dalla concentrazione dei cationi.
Per distinguere i due tipi si calcola quindi il gap anionico = Na+ + K+ - (Cl- + HCO3-) = + 20 mEq/L
Il risultato è a favore degli ioni positivi, invece di essere 0 come atteso, poiché non sono stati conteggiati molti anioni quali le proteine, l’acido urico, ecc.
Se aumenta la cloremia il gap anionico non varia, se, invece, il bicarbonato perduto non è stato compensato dal cloro ma da altri anioni, il gap aumenta.
Si ha perdita di bicarbonato in situazioni come diarrea, ridotto riassorbimento tubulare prossimale o ridotta rigenerazione tubulare distale.
Vi sono 4 tipi di acidosi tubulari:
1) acidosi tubulare prossimale o di tipo 2
Può essere ereditaria o acquisita (infiammazioni tubulari). Si ha bicarbonaturia con bicarbonatemia > 15 mEq/L, mentre nel soggetto normale la soglia è 26 mEq/L.
Caratteristiche: bicarbonatemia bassa, pH basso, cloremia alta, bicarbonaturia bassa (a meno che non si somministri bicarbonato, nel qual caso si avrà bicarbonaturia alta ed urine alcaline anche se il paziente è ancora sotto la soglia dei 26 mEq/L). La bicarbonaturia è più bassa del normale perché il rene rigenera tutto il bicarbonato possibile per compensare la perdita ed espelle protoni.
Somministrare solo bicarbonato ha il risultato di aumentare la delivery distale dello stesso, ma legato al sodio. Quest’ultimo viene riassorbito in scambio con il potassio determinando ipopotassiemia in una situazione di acidosi, nella quale normalmente ci dovrebbe essere iperpotassiemia: ciò indica una grave deplezione di potassio. È quindi necessario somministrare potassio assieme al bicarbonato, possibilmente per os, dato che endovena si rischia una flebite se la soluzione ha una concentrazione > 20 mEq/L e vi è inoltre il pericolo di una iperpotassiemia transitoria.
acidosi tubulare distale o di tipo 1
Dovuta ad un difetto di pompa o di permeabilità delle cellule intercalate, può essere causata da pielonefriti.
Il riassorbimento prossimale di bicarbonato è normale ma vi è un’incapacità a secernere protoni, quindi il pH urinario sarà elevato.
acidosi mista o di tipo 3
4) acidosi tubulare generalizzata o di tipo 4
È un difetto generalizzato delle tre funzioni del tubulo distale: riassorbimento di sodio, secrezione di potassio e di protoni.
Il controllo centrale di queste funzioni è mantenuto dall’aldosterone che moltiplica il numero di pompe di escrezione di H+ nelle cellule intercalate e modula la pompa Na+/K+ nelle cellule principali.
Il meccanismo patogenetico è da ricercare quindi in un ipoaldosteronismo, in difetti congeniti dei recettori dell’aldosterone o nell’uso di farmaci anti-aldosteronici (spironolattone) ed ACE-inibitori.
Caratteristiche: iperpotassiemia, iposecrezione di protoni con pH delle urine normale perché l’iperpotassiemia inibisce la produzione di ammoniaca che, quindi, non può tamponare i protoni.
In generale, i sintomi di queste acidosi sono: alterazioni del SNC (iperventilazione, confusione, coma), scompenso cardiaco, decalcificazioni se l’acidosi è cronica (si perde calcio a causa della calciuria, si possono avere rachitismo, difetti di crescita, calcoli, nefrocalcinosi che esita in insufficienza renale).
Per sapere quanto bicarbonato somministrare, è necessario conoscere il suo volume di distribuzione, che corrisponde circa a metà del peso corporeo.
Ad esempio: paziente di 70 kg con bicarbonatemia = 16 mEq/L (normale 26 mEq/L).
In questo caso il deficit è di 10 mEq/L, che va moltiplicato per 35 L (la metà di 70) à bisogna somministrare in totale 350 mEq nell’arco di 4-5 giorni.
Non bisogna dare il bicarbonato troppo rapidamente, per più motivi.
Dato che si somministra NaHCO3 ed il sodio causa un’espansione del VEC che può precipitare uno scompenso cardiaco se è presente anche una insufficienza renale.
L’emoglobina cede più facilmente l’ossigeno se il pH è basso (effetto Bohr: la dissociazione dell’ossigeno dall’emoglobina dipende dal pH) proprio perché i tessuti ne hanno un maggior bisogno. Il globulo rosso, però, attua un meccanismo di compenso inibendo la produzione di acido difosfoglicerico all’ingresso di protoni, quindi nell’acidosi cronica l’effetto Bohr è molto smorzato (il pH esterno al globulo rosso è acido, ma al suo interno è normale). Se si corregge l’acidosi rapidamente, il globulo rosso non fa in tempo a sintetizzare acido difosfoglicerico e si alcalinizza il citoplasma, spostando a sinistra la curva di dissociazione dell’emoglobina e determinando ipossiemia periferica fino al coma.
Il calcio, a pH normale, ha una concentrazione di circa 10 mg/dL di cui 5 mg/dL sono ioni liberi ed attivi ed i restanti 5 mg/dL sono legati alle proteine plasmatiche. Nell’acidemia diminuisce soprattutto il calcio complessato con le proteine, quindi, ri-alcalinizzando rapidamente il paziente, il calcio libero si lega alle proteine determinando ipocalcemia e conseguente tetania. Inoltre nell’insufficienza renale vi è una ridotta sintesi di vitamina D cui segue ridotto assorbimento intestinale di calcio che aggrava l’ipocalcemia. Quando si dà bicarbonato bisogna dare anche calcio, ma in un’altra vena, per evitare la formazione di carbonato di calcio, che precipita ed è inattivo.
Acidosi normocloremiche (elevato gap anionico):
• diabete di tipo 1
causata dalla presenza di chetoacidi
• acidosi lattica
in paziente con problemi circolatori, shock, scarsa ossigenazione, vasocostrizione (con ischemie distali, necessaria per mantenere la pressione nello shockato); la lattico deidrogenasi (LDH) trasforma il piruvato in lattato non essendo disponibile ossigeno per la fosforilazione ossidativa mitocondriale (la presenza di ossigeno inibisce l’LDH)
• tossica
causata dal polietilenglicole, un liquido contenuto nelle tavolette da utilizzare nelle borse termiche per mantenerle fredde.
Somministrare bicarbonato in queste acidosi aumenta la mortalità perché gli acidi sono prodotti con un meccanismo a feedback basato sul pH, se lo si alcalinizza si interrompe questo feedback e si ha un ulteriore aumento degli acidi.
Alcalosi metabolica
Infondendo bicarbonato di sodio si satura in fretta la capacità massima di riassorbire bicarbonato e si ha bicarbonaturia, che difende l’organismo dall’alcalosi.
La soglia di trasporto massimo si alza se è necessario riassorbire più sodio. Di conseguenza, per poter avere e per mantenere un’alcalosi è necessario che vi sia un maggior riassorbimento di sodio, dovuto ad una deplezione del VEC.
Ad esempio, il vomito contiene molto sodio e può portare a deplezione del VEC. Per abbassare la soglia di riassorbimento basta semplicemente infondere soluzione fisiologica.
La deplezione del VEC (cui consegue un aumento di riassorbimento di sodio nel tubulo prossimale) è una condizione necessaria per mantenere un’alcalosi metabolica.
L’ipopotassiemia determina alcalosi perché aumenta sia l’ingresso di protoni nelle cellule, sia la secrezione di protoni nel rene (le cellule intercalate del tubulo distale utilizzano i protoni al posto del potassio nella pompa Na+/K+ in mancanza di quest’ultimo).
L’iperaldosteronismo aumenta la secrezione renale di protoni: se è primario si ha un aumento del VEC e l’alcalosi non può verificarsi; se, invece, è secondario ad una deplezione del VEC, vi può essere ipopotassiemia ed alcalosi.
Condizioni determinanti l’alcalosi:
• deplezione del VEC
sindrome di Bartter (alterazione congenita della pompa del sodio nell’ansa di Henle, la pompa bersaglio del furosemide), sindrome di Gitelman (alterazione della pompa che riassorbe sodio nel tubulo distale), vomito, diuretici (secrezione di protoni)
• iperaldosteronismo
• difetti, ereditari o acquisiti, dell’enzima 11 b idrossisteroidodeidrogenasi
l’enzima (inibito dalla liquirizia) si occupa di demolire il cortisolo nel tubulo distale, poiché il cortisolo ha effetto sui recettori dell’aldosterone e deve essere eliminato localmente, essendo in concentrazioni molto maggiori dell’aldosterone
• ipopotassiemia
I sintomi dell’alcalosi metabolica sono: confusione mentale, obnubilamento, crampi e convulsioni (una parte del calcio libero, all’aumentare del pH, si lega alle proteine, così, sebbene la calcemia sia normale, la quota attiva è ridotta), aritmie (a causa della differente distribuzione del potassio tra l’intra e l’extracellula).
Insufficienza renale acuta (IRA)
Il 42% dei pazienti colpiti recupera la funzione renale, il 51% muore e la quota restante evolve in insufficienza renale cronica.
Vi sono tre meccanismi patogenetici: pre-renale, renale, post-renale (da uropatia ostruttiva).
Pre-renale: funzionale e circolatoria
La causa non è un danno del tessuto renale ma è dovuta allo stato della circolazione: il rene non riceve abbastanza sangue e non può, quindi, filtrare una quantità sufficiente di plasma.
Disordini circolatori generali alla base di una bassa portata plasmatica sono:
• deplezione del VEC à vomito, diarrea, emorragie, ustioni, colpi di calore, scarsa assunzione di liquidi
• deficit di pompa à ridotto volume circolante efficace (scompenso)
• shock da vasodilatazione periferica.
Se il rene è ischemico, il peso specifico delle poche urine prodotte sarà abnormemente elevato e la loro osmolarità sarà > 500 mOsm/Kg, mentre la sodiuria sarà < 20 mEq/L per cercare di conservare il VEC.
La diagnosi deve essere tempestiva perché il rene consuma moltissima energia per riassorbire e l’ischemia può portare alla tubulonecrosi con degenerazione vacuolare (nel qual caso all’insufficienza pre-renale si somma quella renale, inizialmente ancora reversibile).
Se è presente tubulonecrosi, le urine avranno un’osmolarità alta, la sodiuria sarà > 40 mEq/L ed il loro peso specifico eguaglierà quello plasmatico.
Renale: organica
Patologia intrinseca a carico del parenchima renale (strutture glomerulari, tubulari, interstiziali, vascolari), oppure una alterazione della emodinamica intrarenale (insufficienza renale intrinseca). In questa categoria sono incluse la tossicità da farmaci e le reazioni su base allergica in grado di provocare necrosi tubulare acuta.
Può essere caratterizzata da 1-2 settimane di oligo-anuria o da poliuria.
Farmaci nefrotossici: poiché alcune cellule sopravvivono, avviene la filtrazione ma non può avvenire il riassorbimento, la necrosi tubulare ha una prognosi eccellente sul lungo termine (recupero del 100%), la dialisi si continua fino alla normalizzazione della creatininemia. Vi può essere tossicità diretta, come nel caso di aminoglicosidi quali la gentamicina, che nel paziente normale danno un aumento della creatininemia, mentre nel paziente con problemi renali o in caso di sovradosaggio possono provocare una grave insufficienza renale; oppure può essere dovuta ad ipersensibilità che dà manifestazioni allergiche molto spiccate a causa dell’elevata concentrazione di farmaco nel rene (es. penicilline quali l’ampicillina).
Danno anatomico: una micropoliangioite o poliarterite microscopica causa necrosi fibrinoide delle piccole arterie con infiltrato comprendente linfociti, monociti e pochi neutrofili che finisce per interessare poi tutto il glomerulo; si tratta di una malattia esclusivamente renale.
Il 50% dei pazienti con Lupus Erythematosus Sistemico presentano manifestazioni renali che li portano alla dialisi; è presente necrosi fibrinoide con molti neutrofili, sono assenti gli ANCA, ma si trovano numerosi immunocomplessi.
La pre-eclampsia comporta un danno endoteliale renale, si sviluppa solo nel terzo trimestre di gravidanza e guarisce rapidamente dopo il parto. La malattia è strettamente legata alla placenta. Poiché sono colpiti soprattutto gli endoteli, si ha edema generalizzato, proteinuria (endotelio glomerulare), vasocostrizione spiccata con ipertensione (sempre presente a causa della liberazione di endotelina da parte dell’endotelio danneggiato); è anche detta gestosi EPH (sigla inglese di Edema, Proteinuria, Ipertensione). Esordisce quasi esclusivamente nel terzo trimestre di gravidanza (a causa della presenza della placenta) con ipertensione, vi è rischio di coagulazione intravascolare disseminata (CID) a causa del danno endoteliale, perdita del feto e dell’utero (emorragia e distacco placentare). Insorgenza favorita da malattie renali ed ipertensione.
Vasculite di Churg-Strauss: associata ad asma.
Vasculite di Wegener: necrosi dei seni paranasali, condrite del padiglione auricolare, necrosi polmonare.
Glomerulonefriti: presentano le caratteristiche semilune endoteliali, ossia proliferazioni eccentriche e pluristratificate della capsula di Bowman (normalmente monostratificata e molto sottile). Successivamente proliferano fibroblasti che depositano collagene, portando alla sclerosi irreversibile.
Mortalità dell’IRA
Molti pazienti muoiono per cause indirette, ma le cause dirette sono: edema polmonare da sovraccarico idrosalino ed iperpotassiemia.
Mentre il sovraccarico salino ha una sintomatologia progressiva, l’iperpotassiemia può essere subdola e rapida (catabolismo muscolare, riassorbimento di sangue dall’intestino, acidosi lattica, somministrazione di soluzioni polisaline, citolisi) e va prontamente fronteggiata somministrando calcio.
Glomerulonefriti (GN)
A volte esordiscono con presenza di sangue nelle urine (glomerulonefrite acuta emorragica). Se il sangue è chiaro, esso origina dalle basse vie urinarie, se il sangue è scuro (colore Coca-Cola), ha origine renale e contiene emoglobina ossidata che gli conferisce il colore scuro.
All’esame microscopico, il sedimento evidenzia globuli rossi e cilindri (la presenza di questi ultimi è diagnostica di un’origine renale del sangue).
Emoglobinuria (emolisi) e mioglobinuria (rabdomiolisi) conferiscono un colore simile all’urina. Se anche il siero ha colore rossastro si tratta di emoglobinuria poiché, a differenza della mioglobina, non tutta l’emoglobina passa il filtro renale.
Sintomi di accompagnamento sono: un moderato edema al volto, soprattutto palpebrale, l’ipertensione e l’oliguria.
Molte glomerulonefriti, però, esordiscono con una sindrome nefrosica il cui unico segno visibile è rappresentato dagli edemi declivi. Utile ricordare i quattro sintomi della sindrome nefrosica: proteinuria, ipo-disprotidemia, edema ed iperlipidemia.
Parecchie glomerulonefriti provocano soltanto una modesta proteinuria ed un’ematuria microscopica, il paziente si presenta già con una grave insufficienza renale, pressoché asintomatica fino alla soglia della dialisi (si nota solo un moderato pallore anemico). La sindrome nefritica cronica si associa ad ematuria microscopica, proteinuria (< 3 g/die), ipertensione, anemia, nausea, segni di insufficienza renale cronica. Gli unici segni costantemente presenti sono l’anemia e la nausea.
Tipo |
Istologia |
Patogenesi |
Quadro clinico |
Mesangio-membrano proliferativa |
Proliferazione endocapillare |
IC sottoendoteliali |
Microematuria e proteinuria |
Malattia di Berger (nefropatia da IgA) |
GN intracapillare |
IC sottoendoteliali di tipo IgA |
Sindrome nefritica acuta, microematuria, proteinuria |
Post-streptococcica |
GN essudativa (humps) |
IC sottoepiteliali |
Sindrome nefritica acuta |
Membranosa |
Membrana basale spessa |
IC sottoepiteliali (spikes) |
Sindrome nefrosica |
Sindrome di Goodpasture |
GN extracapillare (semilune) |
Ab anti membrana basale |
Sindrome nefritica acuta, necrosi polmonare |
A lesioni minime |
Fusione dei pedicelli |
Fattore circolante |
Sindrome nefrosica |
Glomerulosclerosi focale segmentaria |
Sclerosi glomerulare |
Fattore circolante |
Sindrome nefrosica |
Gli immunocomplessi (IC) possono essere circolanti, come nel caso della GN mesangio-membrano proliferativa, o in situ, come nel caso delle GN post-streptococcica e membranosa.
Poiché ogni antigene (Ag) ha più siti di attacco per gli anticorpi ed ogni anticorpo (Ab) ha più siti di attacco per gli antigeni, si genera una rete di complessi Ag-Ab.
 Il mesangio è a diretto contatto con l’endotelio, poiché la membrana basale, con le sue riflessioni, non riesce a coprire contemporaneamente tutti i capillari. Funzioni del mesangio: regola la filtrazione glomerulare attraverso un’azione contrattile e svolge attività monocito-macrofagica (cellule immunocompetenti producono collagene e citochine).
Il mesangio è a diretto contatto con l’endotelio, poiché la membrana basale, con le sue riflessioni, non riesce a coprire contemporaneamente tutti i capillari. Funzioni del mesangio: regola la filtrazione glomerulare attraverso un’azione contrattile e svolge attività monocito-macrofagica (cellule immunocompetenti producono collagene e citochine).
Gli IC passano l’endotelio ma non la membrana basale e si collocano, quindi tra membrana ed endotelio o nel mesangio. Il mesangio si attiva e prolifera, cercando con gli pseudopodi gli IC tra la membrana e l’endotelio.
GN mesangio-membrano proliferativa
Aumenta il deposito di matrice ed il glomerulo diventa sclerotico, compresso dalla proliferazione e dal collagene.
Gli pseudopodi, che si infiltrano tra la membrana basale e l’endotelio capillare alla ricerca degli IC, scollano i due foglietti, dando al microscopio l’aspetto di un falso ispessimento della membrana basale. Si tratta della GN più comune.
Malattia di Berger (nefropatia da IgA)
Causata da immunocomplessi circolanti, non lascia segni evidenti a parte, talvolta, ematuria microscopica.
GN post-streptococcica
È una GN essudativa, gli Ag passano sia l’endotelio che la membrana basale (entrambi carichi positivamente) e si arrestano sui podociti (fuori dalla membrana basale, tra quest’ultima e l’epitelio), provocando un accumulo di Ab.
In questo caso si tratta di IC in situ. Vi è infiltrazione di neutrofili richiamati dai giganteschi depositi di IC (humps). La sindrome nefritica è acuta ed emorragica. Preceduta da una scarlattina o una tonsillite da Streptococcus b-emolitico di gruppo A (alcuni giorni dopo la malattia compare ematuria e sindrome nefritica). Lo streptococco è la principale causa di GN essudativa.
GN membranosa
Cronica, causata da virus o neoplasie. Si ha accumulo di Ag tra epitelio e membrana basale. I podociti sono stimolati, come se la membrana fosse danneggiata, a produrre nuova membrana basale, ma ciò avviene in modo anomalo (formazione di spikes visibili al microscopio). Gli spikes inglobano gli antigeni e la membrana basale risulta molto ispessita a causa della deposizione di collagene. Gli IC, in questo caso, sono in situ.
GN nella sindrome di Goodpasture
È una GN extracapillare, riguardante la capsula di Bowman, provoca una sindrome nefritica acuta e progredisce rapidamente verso l’insufficienza renale irreversibile. Le cellule della capsula di Bowman proliferano velocemente e diventano simili a fibroblasti: producono collagene ed occupano la capsula, dapprima con la loro proliferazione, poi con il collagene. I capillari sono atrofici. La sindrome di Goodpasture interessa anche i capillari alveolari, è una malattia autoimmune con Ab diretti contro epitopi presenti nel glomerulo (Ab anti membrana basale glomerulare), non dovuta ad IC.
Glomerulopatia a lesioni minime
Invisibile sia alla microscopia ottica che all’immunofluorescenza. Non sono presenti IC, il glomerulo appare morfologicamente normale, ma, in realtà, è molto alterato nella permeabilità (sindrome nefrosica). Si manifesta soprattutto nei bambini ed è molto responsiva al cortisone (in genere guarisce dopo qualche mese di terapia). Esiste anche una forma inguaribile, cronicamente dipendente dalla somministrazione di cortisone (trattandosi spesso di bambini, gli effetti collaterali di questa terapia sono ancora più gravi).
Glomerulosclerosi focale segmentaria
Non sono presenti né IC né cellule mediatrici dell’infiammazione, ma segni di sclerosi focale (con insufficienza renale progressiva) che si trasmette anche ai reni trapiantati. Il 50% dei casi risponde al cortisone, negli altri casi non esiste una terapia valida. È focale, poiché interessa solo alcuni glomeruli, risparmiando gli altri, e segmentaria, poiché interessa solo un segmento di glomerulo (il segmento ha un peduncolo mesangiale comune). La malattia evolve verso una sclerosi globale diffusa. La causa è un fattore circolante, ancora non noto. Questo lo si è supposto sulla base del fatto che in alcuni casi si ha una momentanea remissione dopo plasmaferesi (a volte non si verifica, sia in soggetti diversi, sia in diverse occasioni nello stesso soggetto, il che complica ulteriormente la ricerca per individuarne la patogenesi). Probabilmente si tratta di una malattia dei podociti.
Insufficienza renale cronica (IRC)
L’insorgenza è talvolta così subdola che nello stesso momento in cui si pone la diagnosi si deve annunciare al paziente che è necessario iniziare la dialisi. I sintomi sono molti, ma spesso i molti meccanismi di compenso fanno sì che il paziente non si accorga di nulla. Il rene riesce comunque a mantenere il bilancio per un lungo periodo di tempo (eliminazione del sodio introdotto con la dieta). Per raggiungere questo pareggio è necessario un momentaneo disequilibrio, di minima entità e di breve durata, che attiva i sistemi di compenso che “informano” il rene delle modificazioni del VEC.
La frazione escreta del sodio filtrato si può calcolare sapendo che, in condizioni normali, il filtrato è 120 ml/min e la sodiemia è 140 mEq/L: introducendo 5 g di sodio in eccesso essa sarà 0,3%, introducendone 10 sarà 0,6% e così via.
Grazie a questo sistema, basta aumentare o ridurre di poco il riassorbimento per mantenere l’omeostasi, è questa la ragione per cui il rene filtra enormi quantità di plasma per poi riassorbirle quasi interamente.
Introducendo però grandi quantità di sodio (ad esempio 50 g), il VEC subisce un’espansione superiore a quella considerata fisiologica. La frazione di filtrazione arriverà a 3% ed il rene riuscirà ad eliminare il sodio in eccesso se ciò avviene acutamente, ma se l’introduzione di esagerate quantità di sodio è cronica, il VEC si espanderà patologicamente.
Questa situazione sperimentale è del tutto identica a ciò che avviene nella IRC.
Il rene riesce ancora ad eliminare il sodio in eccesso, ma non riesce più a mantenere normale il VEC, perché senza l’iperstimolazione del VEC elevato, il rene non può correggerlo.
Una frazione di escrezione del sodio (FE Na) > 1% è un indicatore di IRC. Il bilancio, invece, è conservato.
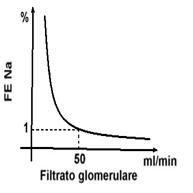 Il paziente in IRC si comporta come un animale sperimentale in cui si elimini un rene e parte dell’altro, lasciando solo una parte di rene sano. Ciò avviene nonostante, in realtà, istologicamente tutti i nefroni siano colpiti dalla malattia.
Il paziente in IRC si comporta come un animale sperimentale in cui si elimini un rene e parte dell’altro, lasciando solo una parte di rene sano. Ciò avviene nonostante, in realtà, istologicamente tutti i nefroni siano colpiti dalla malattia.
La filtrazione glomerulare, di conseguenza, è ridotta e la FE Na deve aumentare rispetto al normale a parità di sodio in eccesso da eliminare.
Il bilancio è raggiunto ugualmente, ma a spese di un’espansione del VEC che stimola i nefroni ad aumentare la FE Na. Il rene, in pratica, rinuncia a pareggiare il VEC pur di mantenere il bilancio.
Inizialmente, a grandi diminuzioni del filtrato glomerulare corrispondono piccole variazioni della FE Na.
Perdendo il 50% della funzione renale si mantiene comunque la sufficienza renale.
L’insufficienza renale inizia al di sotto di 50 ml/min di filtrato e la FE Na aumenta patologicamente, indicando un patologico aumento del VEC.
Sintomi di presentazione della IRC
• da alterato metabolismo del sodio: ipertensione (frequente, assente se sono diminuite le resistenze), dispnea (da scompenso cardiaco determinato dall’aumento di carico), edema (raro)
• isostenuria: il rene perde la capacità di concentrare o diluire le urine; esse avranno quindi sempre lo stesso peso specifico in ogni momento della giornata e il paziente si troverà in uno stato di iposodiemia
• da alterata escrezione di metaboliti: iperazotemia (inversamente proporzionale al filtrato glomerulare), iperuricemia
• da ritenzione di medie molecole: si tratta di frammenti di proteine normalmente filtrati, possono causare gastrite uremica (poco grave in sé, ma annuncia l’uremia), pericardite uremica (indice di grave uremia, ormai rara grazie all’avvento della dialisi, ma si può sviluppare se la dialisi è insufficiente; si presenta come un dolore pleurico in sede sottosternale con sfregamento pericardico che copre i toni ed è presente un caratteristico versamento emorragico con rischio di tamponamento), neuropatia periferica (dolore bruciante alla pianta del piede, “burning foot”)
• da alterata funzione endocrina:
- anemia à frequente causa di sintomi di presentazione (pallore, astenia, dispnea da sforzo), dovuta ad un deficit di eritropoietina; si tratta con la somministrazione di eritropoietina ricombinante
- ipocalcemia à dovuta alla incapacità di sintetizzare la forma attiva della vitamina D (dal 25 idrossi-colecalciferolo il rene produce 1,25 di-idrossi-colecalciferolo che è enormemente più attivo); se sommata ad iperfosfatemia è causa dell’osteodistrofia uremica; ipocalcemia + iperfosfatemia à aumento PTH à aumento escrezione di fosfati; il paratormone (PTH) stimola l’osso a liberare calcio, ma la calcemia resta bassa perché è assente la vitamina D che stimola l’assorbimento intestinale; i fosfati, inoltre, non possono essere eliminati con il risultato che il feedback non funziona e il PTH resta a valori elevati causando la formazione di cisti ossee (osteopatia fibrocistica, tumori bruni dell’osso); l’osteomalacia da carenza di vitamina D si somma a questa situazione determinando il quadro dell’osteodistrofia uremica.
Valori massimi normali
Azotemia: 40 mg/dL, è la somma dell’azoto dell’urea, degli amminoacidi liberi, della creatinina, ecc.
Urea plasmatica: 35 mg/dL (peso molecolare dell’urea: 60; peso molecolare dell’azoto ureico: 28)
Azoto ureico o BUN (sigla inglese per “azoto ureico del sangue): 20 mg/dL, è l’azoto contenuto nell’urea (NH2)2C=O
L’uremia è la condizione clinica dell’IRC terminale e non è un valore.
L’uricemia è la concentrazione plasmatica dell’acido urico, prodotto terminale del catabolismo delle purine.
Rene e gravidanza
Il flusso plasmatico renale aumenta fino alla ventesima settimana, poi mantiene un plateau attorno a 160-170 ml/min (aumento del 50-60%). Di conseguenza, la creatininemia deve essere bassa ed è già considerata patologica a livelli alti nell’intervallo di normalità (ad esempio 1,2 mg/dL); la si considera normale tra 0,6 e 0,7 mg/dL.
Vi è un’indispensabile ritenzione di sale ed acqua e si espande sia il plasma singolarmente che il sangue (in previsione di una possibile emorragia post-partum). In totale sono ritenuti 900 mEq di sodio, corrispondenti a circa 6 L di VEC.
La placenta può essere considerata una grande fistola artero-venosa.
Si sono fatti studi con micropuntura nel ratto: si anestetizza il ratto e si espone il rene, poi con un micromanipolatore si prelevano gocce di liquido per misurarne i parametri. Da questi studi si è scoperto che in gravidanza l’arteriola afferente si dilata enormemente (crollo delle resistenze) ed aumenta la pressione sanguigna glomerulare (normalmente l’arteriola ha una pressione di 80 mmHg ed il glomerulo di 50 mmHg). La dilatazione è dovuta a: prostaglandina E, callicreina-bradichinina, progesterone, ossido nitrico e relaxine. Infatti, la gravida è ipotesa nonostante l’espansione del VEC a causa della vasodilatazione. Se la pressione supera i 125 mmHg si deve sospettare una pre-eclampsia.
In gravidanza, l’attività reninica è altissima, persino superiore ai pazienti con stenosi renale: esiste quindi un’insensibilità all’angiotensina. Test di Gant: se la sensibilità all’angiotensina non è bassa, vi è rischio di pre-eclampsia.
È presente anche una grande quantità di aldosterone, che favorisce la ritenzione di sodio.
Essendo presenti sia meccanismi natriuretici che anti-natriuretici, esiste un potenziale rischio di perdita di sodio se i meccanismi ritentivi non funzionano.
Autoregolazione renale: incrementando la pressione di perfusione renale, il flusso plasmatico renale e la filtrazione glomerulare non cambiano. Alla base di questa regolazione vi è la contrazione dell’arteriola afferente.
La macula densa, parte del tubulo distale posta a contatto con le arteriole, è un sensore del sodio e regola a monte il rene per mantenere l’omeostasi.
Nella gravida ipertesa questa regolazione viene a mancare e si ha perdita di sale ed acqua.
Modello sperimentale: ratto femmina con ipertensione renale (clipping dell’arteria) viene ingravidata e studiata con micropuntura renale. Aumentando la pressione arteriosa si osserva una perdita di sale.
In tutti gli ipertesi avviene questo fenomeno: somministrando un carico di sale, il rene risponde con una natriuresi esagerata per eliminare più rapidamente il sale. Nella gravida, essendo l’arteriola afferente già dilatata, questo fenomeno è potenziato.
Essendoci una relazione inversa tra pressione diastolica e volume plasmatico, la gravida ipertesa è in ipovolemia.
La gravida è edematosa, accumula liquidi nel sottocute sia per cause renali, sia per la compressione sulla vena cava operata da parte dell’utero.
Per tutte queste ragioni, l’ipertensione in gravidanza non va sottovalutata e non deve essere trattata con diuretici o limitando l’assunzione di sodio (tranne nel caso di edema polmonare acuto).
Dialisi e trapianto
L’Italia è al secondo posto in Europa nei trapianti di rene, seconda solo alla Spagna (in cui si fanno molti più trapianti da vivente).
Poiché la presenza di anticorpi preformati distrugge in pochi minuti i vasi sanguigni del trapianto, è impossibile utilizzare reni di provenienza animale, di esseri umani con gruppo sanguigno incompatibile o il cui HLA sia già bersaglio di anticorpi anti-HLA (ciò avviene se il ricevente è un politrasfuso o ha già subito trapianti; per scongiurare questa evenienza si esegue un test).
Il rigetto mediato da cellule, invece, è controllabile con la terapia immunosoppressiva.
L’anastomosi del rene donato è fatta con i vasi iliaci ed il rene è posto in fossa iliaca e fuori dal peritoneo per essere facilmente accessibile chirurgicamente. Delayed graft function: è il 28-30% dei casi, la funzionalità renale non riparte immediatamente a causa di una tubulonecrosi ischemica; è quindi necessario fare la dialisi in attesa che il rene si rigeneri (qualche settimana). Generalmente, terminata l’anastomosi, dall’uretere fuoriesce subito urina ed il paziente non necessita di dialisi.
La dialisi, concettualmente, si basa sulla diffusione: due soluzioni separate da una membrana semipermeabile che scambiano. È possibile rimuovere o introdurre sostanze nel sangue, ad esempio si elimina l’urea e si aggiunge bicarbonato.
Per mantenere il VEC normale, si applica una pressione positiva al compartimento sanguigno, così da eliminare i liquidi in eccesso sfruttando il gradiente pressorio.
Il tempo di dialisi è di 12 ore alla settimana, suddivise in tre sedute da quattro ore ciascuna, ma pazienti con una maggiore superficie corporea necessitano di tempi maggiori. Si utilizza una bilancia per misurare il guadagno o la perdita di liquidi.
La velocità di uscita del sangue deve essere di 300 ml/min, troppo grande per poter essere sostenuta da una vena periferica.
È necessario, quindi, creare uno shunt con una fistola artero-venosa chirurgica tra l’arteria radiale e la vena cefalica, che si arterializza, migliorando la propria capacità emostatica. Ora la vena può essere punta più volte e può sopportare tale portata.
L’ago d’uscita è puntato in direzione della fistola ed è molto vicino ad essa, quello di entrata guarda verso il cuore ed è situato più prossimalmente.
L’alto flusso garantisce che l’ago non peschi in sangue già depurato.
La macchina è costituita da due pompe, un riscaldatore ed un allarme per avvisare se del sangue ha passato il filtro.
Dialisi peritoneale
Il peritoneo si comporta come una membrana di dialisi, basta introdurre in cavità peritoneale il liquido di dialisi attraverso un catetere permanente inserito chirurgicamente e mantenuto sterile.
Il paziente può scaricare una sacca di liquido in peritoneo autonomamente e deve tenerlo per 4 ore, durante le quali gode di piena libertà. Terminate le quattro ore, svuota la cavità peritoneale all’interno di una sacca apposita. Va ripetuto 4 volte/die.
Esiste anche una macchina che compie questi cicli automaticamente durante la notte, garantendo ancora maggior libertà.
La dialisi peritoneale risolve il problema della ultrafiltrazione con una sostanza osmoticamente attiva e poco assorbibile (il glucosio) che sottrae liquidi sfruttando l’osmosi.
Questa dialisi equivale a quella tradizionale, con il vantaggio che si può eseguire a casa o in viaggio/vacanza, ma è presente un rischio di peritonite.
Ipertensione e rene
L’ipertensione danneggia il rene, ma il rene a sua volta può esserne la causa.
Nefroangiosclerosi: aumento del collagene dovuto all’ipertensione che ischemizza il rene a causa della contrazione dell’arteriola afferente.
È anche presente aterosclerosi dei piccoli vasi renali, oltre al distacco di piccoli emboli di grasso dall’aorta (il tratto di aorta pre-renale è molto lungo) e dalle arterie renali..
Il rene dell’iperteso è più piccolo (il diametro longitudinale normale è di 10-12 cm, quello del rene grinzo è di 6-7 cm) e presenta incisure sul bordo esterno, che rappresentano cicatrici di pregressi infarti.
Ipertensione maligna: perdita progressiva e rapida di funzione renale (IRA progressiva), danni retinici con papilledema, pressione diastolica > 120 mmHg.
I piccoli vasi renali vanno incontro a necrosi fibrinoide.
Le ischemie renali attivano il sistema renina-angiotensina che aumenta la pressione à circolo vizioso.
La perdita obbligata di sale attiva ulteriormente il sistema renina-angiotensina. Il modo migliore per spezzare questo circolo vizioso è aumentare il VEC somministrando soluzione fisiologica e potenti anti-ipertensivi per salvare il rene e la vita del paziente. Se è già presente una malattia che danneggia il rene, l’ipertensione ne accelera la perdita di funzione (incapacità del rene ad autoregolarsi).
Nella IRC l’ipertensione dipende dal volume e la dialisi la risolve.
Ipertensione essenziale
In natura il cloruro di sodio è molto raro, soprattutto per gli erbivori, che quindi hanno un’alta appetibilità verso il sale.
L’uomo, che è quasi erbivoro, ma che nella società moderna ha a disposizione molto sale, ha un VEC cronicamente iperespanso rispetto ai suoi antenati.
In alcuni individui, l’espansione del VEC provoca vasocostrizione in risposta all’iperperfusione ed i reni trattengono una quantità leggermente superiore di sale.
Ipertensione vascolare renale
Stenosi dell’arteria renale (modello di Goldblatt con clip che stringe una o entrambe le arterie renali di una cavia).
Due possibili cause.
- Fibrodisplasia: tipica delle giovani donne, è caratterizzata dalla presenza di tessuto fibroso tra le tuniche arteriose che causa una stenosi che provoca un’ipertensione dipendente dalla renina (5% delle ipertensioni); nei giovani ipertesi va sempre sospettata e bisogna fare un’angiografia.
- Aterosclerosi: stenosi in una o entrambe le arterie renali, in genere all’inizio di esse, presso l’ostio (“saracinesca” nell’aorta); tipica di pazienti di età superiore a 60 anni.
Appunti di nefrologia dalle lezioni del professor Dal Canton
Fonte: http://medicinapavia.altervista.org/appunti/Nefro.rtf
Autore del testo: non indicato nel documento di origine
Nefrologia
Visita la nostra pagina principale
Nefrologia
Termini d' uso e privacy