Microbiologia orale
Microbiologia orale
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
MICROBIOLOGIA ORALE:
CAVITA' ORALE
La cavità orale costituisce un ecosistema formato da habitat molto diversi tra loro. E' caratterizzata inoltre da un'elevata dinamicità dovuta alla continua eliminazione ed introduzione di batteri e alimenti. Pertanto anche se, come si vedrà, esiste una popolazione batterica residente, occasionalmente non deve sorprendere il fatto di ritrovare nella cavità orale microorganismi che di solito colonizzano altri siti dell'ospite.
Tra i fattori che influenzano l'ecosistema orale, i più importanti sono: la presenza della placca, l'igiene orale, i trattamenti odontostomatologici, le condizioni fisiche personali (non dimentichiamo che sull'epitelio è presente la fibronectina che incide sulla qualità dei batteri adesi e che il livello di tale glicoproteina dipende dalle condizioni di salute), ed infine la dieta alimentare che sicuramente porta sostanze che incidono sulla velocità di proliferazione dei batteri.
La cavità orale è popolata da microorganismi opportunisti perfettamente adattati all'ambiente. L'ambiente è formato dalle labbra, guance, palato, denti e solco gengivale. I microorganismi variano dai Protozoi, Miceti, Virus ai dominatori in termini numerici che sono i Batteri.
Nella cavità orale gioca un ruolo importante la saliva: è prodotta dalle ghiandole omonime in quantità di 0.8-1,5 l. al giorno (la produzione di saliva si riduce notevolmente durante le ore notturne) e con andamento antero-posteriore viene deglutita.
Questa contiene ioni Na, K, Cl, Fosfati, Carbonati ad un pH di 6.75 con un modesto potere tamponante che ha lo scopo di limitare l'attività cariogena dei batteri. Contiene inoltre glicoproteine (che rappresentano un potenziale nutrimento per molti microorganismi), lisozima, lattoperossidasi, lattoferrina, immunoglobuline, viene inoltre liberato lo ione tiocianato OSCN- e H2O2 .
La saliva fornisce la cosiddetta pellicola acquisita che ha uno spessore di 0.1-0.3mm, fattori aggreganti che in qualche modo possono anche mediare l'adesione ed esercitare una certa funzione di protezione dello smalto.
Il liquido crevicolare fluisce attraverso l'epitelio nel solco gengivale, ha una composizione chimica molto simile a quella del siero: albumina, emina, a-2-globuline, IgG, IgM, IgA e cellule del sistema immunitario.
La produzione di liquido crevicolare aumenta durante i processi infiammatori e malattie periodontali ed in tal caso può arricchirsi di acidi grassi ed enzimi di origine batterica, fattori che possono essere di aiuto per la diagnosi.
I denti presentano una superficie dura che contrariamente a molte altre superfici corporee, non è soggetta a sfaldamento.
Questo è un aspetto importante poiché molti batteri che hanno la possibilità di aderire a questa superficie possono essere rimossi solo meccanicamente.
Il dente presenta facce prossimali dove l'ambiente è privo di ossigeno e quindi vi è una situazione di anaerobiosi, facce vestibolari e linguali poco colonizzate poiché ripulite dall'azione meccanica della lingua mentre il margine gengivale è più facilmente colonizzato.
La temperatura si aggira sui 35-36°C ed è piuttosto stabile mentre il pH oscilla tra 5 ed 8 in funzione del sito, tamponato ove possibile dalla saliva. Le zone acide come la placca sono difficilmente raggiunte dalla saliva ed il numero elevato di batteri nonché i metaboliti influiscono sensibilmente sul grado di acidità.
Il solco gengivale, grazie al liquido crevicolare è generalmente alcalino.
La tensione di ossigeno è alta a livello della lingua e bassa nel solco gengivale. Come anticipato i microorganismi hanno possibilità di captare sostanze nutrienti dalla saliva, dal liquido crevicolare, da prodotti del metabolismo batterico di altre specie e dal materiale ingerito durante l'alimentazione dell'ospite.
Fattori aggreganti: sono composti che facilitano l'aggregazione dei batteri e sono IgA e glicoproteine. Le masse batteriche che non sono in qualche modo già adese sono più facilmente rimosse rispetto ai singoli organismi. I fattori aggreganti sono estremamente importanti poiché nella cavità orale le masse batteriche coaggregate e poi adese alle superfici rappresentano il primo passo per la formazione della placca.
In breve, alcune specie hanno predilezione per i seguenti epiteli:
Streptococcus salivarius -> lingua;
S.mutans e S.sanguis -> superficie dei denti
S.mitior -> denti e mucosa
B.gingivalis -> altri batteri
Come già accennato la cavità orale ospita più di 300 diverse specie batteriche residenti
Tabella 1.1 Specie batteriche prevalenti nella cavità orale di individui sani
GRAM-POSITIVI |
GRAM-NEGATIVI |
Actinomyces |
Actinobacillus |
L'adesività dei microorganismi agli epiteli e ai denti è mediata da strutture batteriche, da prodotti extracellulari e da componenti della pellicola acquisita.
S.mutans produce un polimero extracellulare denominato glucano che risulta praticamente insolubile in acqua a causa dei legami 1-3 piuttosto che al 1-6. Il glucano svolge un ruolo importantissimo come mediatore dell'adesività di S.mutans sia anche come molecola cementante per altri microorganismi, sia per creare un sito protetto ove il microorganismo può proliferare indisturbato.
Lo stesso enzima catalizzatore della formazione del glucano, la glucosil- transferasi (GTF), è liberato da S.mutans e svolge anch'esso il ruolo di mediatore dell'adesività perché è in grado di legarsi alla superficie dei denti, a quella di cellule batteriche e ad altri glucani.
Una semplificazione dei mediatore dell'adesività può essere la seguente:
GTF - batterio
smalto - GTF - glucano - batterio
Smalto - glucano - GTF - batterio
Gli acidi lipoteicoici (LTA), componenti della parete dei gram-positivi, sono anch'essi in grado di mediare l'adesione:
- alle cellule epiteliali - mediante il ponte con la fibronectina
- ai denti - mediante la formazione di legami ionici con il Ca dell'idrossiapatite, anche in questo caso il rapporto che viene instaurato si può semplificare:
LTA - glucano
LTA - GTP
- LTA - glicoproteine salivari ( quando la quantità di saliva è modesta la pellicola acquisita ha caratteristiche tali per cui è facilitata l'adesione dei batteri, mentre in presenza di molta saliva le probabilità di aderire da parte dei batteri si riducono.
- Le fimbrie sono le strutture più adatte per mediare l'adesività. Sono presenti sia nei gram-positivi sia nei gram-negativi, tali appendici contengono le lectine che interagiscono con i carboidrati sia presenti nella pellicola acquisita sia sugli epiteli. I microorganismi che più di altri si servono delle fimbrie per aderire sono: B.gingivalis, B.loescheii, F.nucleatum, A.naeslundii, A.viscosus e S.sanguis.
- Altre adesive includono strutture presenti sulla superficie della cellula batterica che agiscono con sostanze extracellulari presenti sulla superficie degli epiteli.
- S.sanguis e S.mutans hanno adesine che legano glicoproteine salivari o della pellicola acquisita sia direttamente o attraverso il glucano. Vi sono inoltre enzimi quali il lisozima che lega alcune Ig che sono in grado di mediare l'adesione al dente.
- Le cariche di superficie, come quelle possedute dallo ione Ca, producono inoltre delle interazioni elettrostatiche che favoriscono l'adesione, ad esempio le cariche della pellicola acquisita mediante il calcio che si lega ai batteri favoriscono l'interazione batteri - pellicola acquisita. Composti che includono EDTA, fluoro o polifosfato sono antagonisti di tale interazione.
INTERAZIONI TRA BATTERI
L'interazione tra i batteri nella cavità orale produce due tipici fenomeni la coaggregazione che porta al sinergismo batterico e l'antagonismo.
Coaggregazione è un tipico fenomeno dell'ecosistema orale ove i batteri traggono vantaggio di aderire ad altri microorganismi già inseriti sfruttando le diverse strutture o molecole ponte:
unione mediata da molecole come glucano e glicoproteine
unione diretta tra i batteri mediate molecole della superficie esterna (in pratica le stesse che mediano l'adesività diretta (lectine-carboidrati, fimbrie)
La coaggregazione favorisce le sviluppo della placca e i processi infiammatori e infettivi della cavità orale.
Le infezioni della cavità orale sono usualmente polimicrobiche.
Le infezioni polimicrobiche possono essere più gravi di quelle causate da un singolo patogeno, quando le interazioni tra le singole specie
trasformano un'infezione mista in un'infezione sinergica (vedi patogenicità e virulenza)
Tabella 1.3 Esempi di infezioni orali e sistemiche associate all'infezione orale
Genere Infezione orale Infezione sistemica
Lactobacillus Carie Basse vie respiratorie
Fusobacterium Gengivite ulcerativa Setticemia, alte vie respiratorie
Actinobacillus Parodontite giovanile Endocardite
Peptostreptococcus Parodontite, pulpite Ascessi polmonari/cerebrali
Eubacterium Parodontite, pulpite Ascessi polmonari/cerebrali
Haemophilus Epiglottite Polmonite, sinusite, meningite
Eikenella Parodontite Infezioni ai tessuti molli
Capnocytophaga Parodontite giovanile Polmonite, endocardite
Wolinella Ascessi dentali Infezioni addominali
Adattata da Willett et al., 1991
Per quando riguarda infine la protezione reciproca dei batteri nei confronti degli antibiotici, oltre agli esempi già citati, è noto che il B.fragilis e altre specie anaerobie producono b-lattamasi che nelle infezioni miste proteggono le specie sensibili ai b-lattamici inattivando tali antibiotici. Il fenomeno è ben documentato e denominato patogenicità indiretta (protezione di S.pyogenes)
B.fragilis e altri Clostridi possono aminofenilare il cloramfenicolo rendendolo inefficace sulla restante popolazione batterica presente.
I fenomeni di antagonismo batterico, pur presenti nella cavità orale come è facile intuire per un ambiente popolato da un così vasto e diverso numero di microorganismi, non sembrano giocare un ruolo particolare al di la della competizione alimentare sul territorio tuttavia possono esser così riassunti:
Bacteriocine sostanze che uccidono altri microorganismi sono in genere attive su poche specie. Fanno eccezione gli streptococchi che liberano batteriocine ad ampio spettro (gram-positivi e gram-negativi)
L'abbassamento del valore del pH, come abbiamo visto, favorisce la proliferazione di molti acidofili ma risulta deleterio per molte altre specie.
S.sanguis, S. mutans, e S.salivarius, producono acido lattico e acido acetico che risulta tossico per molti microorganismi.
S.sanguis e S.mitior elaborano H2O2 che è letale per moltissimi batteri.
Infine i batteriofagi, che sono i virus attivi sui batteri, possono causare una gran moria di microorganismi.
Appare chiaro da quanto riportato sino ad ora che le infezioni miste, così tipiche della cavità orale, sono più gravi di quelle causate da un singolo patogeno.
Sono possibili due fondamentali strategie terapeutiche la prima mirata all'eliminazione selettiva di un componente della popolazione mista in modo da far fallire il sinergismo batterico. Questo risultato si ottiene con antibiotici a spettro ristretto. Questa potrebbe essere la soluzione più opportuna considerando il fatto che gli antibiotici non discriminano tra patogeni e popolazione batterica comune che subirebbe un inutile e dannoso effetto ecologico.
La seconda soluzione si propone di eliminare tutti i patogeni in causa mediante uso di antibiotici ad ampio spettro che usualmente sono i b-lattamici ed in caso di allergie i macrolidi.
Tabella 1.4 Antibiotici in uso nelle infezioni del cavo orale
Antibiotico Caratteristiche
Penicilline: Ampio spettro: gram-positivi e gram-negativi, aerobi ed anaerobi
amoxicillina: uso orale, buona diffusione nei tessuti di interesse odontostomatologico. Augmentin (amoxicillina+ac.clavulanico)
bacampicillina: profarmaco di ampicillina (simile ad amoxicillina)
inattivate dalle più comuni b-lattamasi
Cefalosporine: La più utilizzata per spettro e caratteristiche farmacocinetiche è la
cefazolina, in alternativa alle penicilline e ai macrolidi nei casi più gravi
Macrolidi Spiramicina, eritromicina, josamicina e miocamicina i più usati.
Spiramicina: più elevata concentrazione nei tessuti gengivali e nella saliva rispetto a eritromicina.
Josamicina e miocamicina sono più simili a eritromicina
Lincosamidi Clindamicina e lincomicina, attive anche su specie
anaerobie, a volte superano la resistenza ai macrolidi
Fosfomicina poco utilizzata
Tetracicline Nella parodontite giovanile, doxiciclina e minociclina,
poiché legano il calcio si ha ingiallimento dei denti.
Metronidazolo E' utilizzato nelle infezioni sostenute da anaerobi
in associazione con spiramicina.
PLACCA
Dopo accurata pulizia dei denti lo smalto risulta ricoperto dalla pellicola acquisita. Aderiscono le specie pioniere che sono cocchi gram-positivi e gram-negativi aerobi: S.sanguis, S.gordonii , Actinomyces naeslundii e Neisseria sicca mediante fimbrie che si legano alla pellicola acquisita. Da 2 a 8 ore la colonizzazione diventa "dura" o per meglio dire consolidata. Si hanno quindi 16 ore di relativamente crescita rapida con formazione di colonie che con l'aumentare del numero tendono a confluire. Risultano tutte immerse in polimeri batterici, che sono essenzialmente polisaccaridi extracellulari e glicoproteine salivari. Dopo 24 ore gli streptococchi, soprattutto S.sanguis, rappresentano il 95% dei microorganismi presenti. I bastoncini gram-positivi ammontano a pochi esemplari (ci si riferisce alle specie) che sono Actinomyces viscosus e Rothia dentocariosa. Gli anaerobi sono in questa fase pochissimi. I pochi bastoncini appaiono uniti in ammassi perpendicolari allo smalto, simili a palizzate.
La maturazione della placca avviene con il trascorrere dei giorni e si realizza senza un aumento consistente del numero dei batteri. Il metabolismo di quelli presenti modifica l'ambiente, si abbassa la tensione di ossigeno e quindi si crea la situazione favorevole per la colonizzazione degli anaerobi. L'intera struttura che si è formata facilita l'adesione di altri microorganismi. Dopo 7 giorni gli streptococchi iniziano a calare mentre aumentano in modo considerevole i filamenti. Al microscopio risulta una struttura stratificata di cocchi che si alternano ai bastoncini. Si ha un'ulteriore stratificazione di batteri S.sanguis un preformato costituito da una gran quantità di materiale intercellulare, germi filamentosi in particolare F.nucleatum e B.matruchotii, disposti a pannocchia di granturco, un filamento centrale con cocchi adesi intorno.
La pellicola acquisita è da tempo degenerata e i microorganismi si ritrovano a contatto con lo smalto dei denti. La placca che si forma nei solchi è più semplice ed è formata da bastoncini corti e cocchi. Le formazioni a palizzata e a pannocchia sono assenti. La placca subgengivale è simile a quella delle superfici lisce. Gli spirochete sono presente nelle placche più vecchie e nelle parodontopatie.
Composizione della placca.
Comunità composta da 200-300 specie di microrganismi (le stesse che abitualmente popolano la cavità orale). 1 mg di placca contiene ± 108 batteri, si stima che la placca individuale si all'incirca 100 mg. La distribuzione ed il sito ove sono distribuiti i microorganismi appare difficile da valutare.
Alcuni esempi:
Streptococchi, Haemophilus, Eiknella, Capnocytophaga crescono bene in ambiente ricco di CO2, mentre Wolinella è un anaerobio.
Haemophilus, coccobacilli, ma spesso la forma è variabile, gram-negativi, crescono bene su sangue lisato e cotto a 80°C (noto come agar cioccolato per via del colore) o su un terreno detto HTM, formano colonie piccolo grigiastre. E' presente nella placca nella saliva e sugli epiteli, può dare infezioni alle basse vie respiratorie, meningiti, ecc. H.parainfluenzae può emolizzare il sangue evidenziando un'emolisi simile a quella degli streptococchi.
Eikenella corrodens, anaerobio facoltativo. Cellule piccole, non sporigeno, coccobacillo gram-negativo. Si isola particolarmente dalle tasche periodontali, deve il suo nome al fatto di produrre una zona corrosa sulle piastre di agar.
Capnocytophaga, bastoncini fusiformi gram-negativi, formano colonie che tendono ad allargarsi come le dita di una mano, grigiastre, rosa o gialle, richiedono CO2 .Si ritrovano nella parodontite giovanile.
Wolinella (ex Campylobacter), cellule curve con flagello polare (mobili) crescita stimolata da formato o fumarato non utilizzano né fermentano i carboidrati.
W.recta è spesso isolata da liquido crevicolare, ma la patogenicità è incerta mentre W.succinogenes è isolato da ascessi dentali nei canali della radice.
Eubacterium, sono variabili alla colorazione di gram, anaerobi, filamentosi. E.alactolyticum e E.saburreum isoalti da carie e da polpa dentale necrotica.
Lactobacillus, bastoncini gram-positivi non sporigeni, producono acido lattico o gas da altri acidi organici. Rappresentano circa 1% della popolazione microbica coltivabile dalla placca. L.acidophilus e L.casei sono coinvolti sul fronte di avanzamento della carie senza svolgere un ruolo primario in questo processo.
Fusobacterium, bastoncini gram-negativi anaerobi non mobili. F.nucleatum produce piccole lucenti colonie S.sanguis piastre di sangue di cavallo. Spesso coinvolto nelle infezioni delle vie respiratorie e del cavo orale. Da gengiviti ulcerative insieme a Spirochete nelle malattie parodontali.
Peptostreptococchi, frequentemente isolati da infezioni di anaerobi P. anaerobius, P. micros e P. intermedius sono in grado di indurre lesioni si ritrovano infatti spesso nelle infezioni necrotiche dela polpa.
Protozoi. Non ospiti abituali Entamoeba gengivalis, Trichomonas tenax si ritrovano soprattutto in situazioni di scarsità di igiene orale. Non svolgono un ruolo diretto nelle parodontopatie ma sono spesso associati a germi opportunisti.
CARIE
Sequestro di calcio da parte degli acidi liberati dai batteri (azione chelante). Utilizzo dei fosfati da parte dei batteri. Queste due azioni combinate portano ad una più facile decalcificazione del dente.
La carie è un fenomeno estremamente complesso ed è considerato da molti una malattia infettiva multifattoriale che dipende:
- Sensibilità dell'ospite
- Dieta alimentare
- Microorganismi
Per quanto riguarda la sensibilità dell'ospite sono senz'altro importanti i fattori genetici (non noti), la forma dei denti, lo spazio interdentale, la composizione ed il volume della saliva, la qualità del sistema immunitario.
Altri fattori molto importanti riguardano l'età dei denti nel senso che più il dente è vecchio meno facilmente si caria ed il contenuto di fluoro nel regime alimentare.
La dieta è importante in quanto cibi che contengono saccarosio favoriscono la formazione di carie così come la frequenza dei pasti.
Per quanto riguarda i microorganismi sono state formulate due ipotesi di carie come malattia infettiva
1) Eziologia specifica (dovuta ad un singolo microorganismo)
2) Eziologia non specifica (dovuta a più microorganismi)
Streptococcus mutans.
Identificato nel 1924 da Clark isolato da lesioni cariose e da placca di individui con carie diffuse. Popolazioni poco favorevoli alla formazione di carie - scarsa presenza di S. mutans, sono state adottate misure preventive atte a ridurre la presenza di S. mutans (vaccini) riducendo la probabilità che si formi carie. S.mutans produce un insolubile polisaccaride extracellulare dal saccarosio, mentre altri microorganismi non ne sono in grado; inoltre presenta un'adesività spiccata per lo smalto. Un pH di 5 o inferiore è mantenuto dalla placca per ore (il sistema tampone della saliva non è operativo) Gli streptococchi S.mitior, S.salivarius, S.sanguis e A.viscosus non producono acidi dal saccarosio mentre S.mutans e L.casei ne sono dei forti produttori e sono attivi ai bassi pH. In questo contesto l'ingestione di saccarosio causa una forte proliferazione di questi microorganismi più capaci di metabolizzarlo e di tollerare il grado di acidità prodotto.
Altri microorganismi coinvolti nella carie come già accennato sono i Lattobacilli. Sono considerati degli opportunisti secondari la loro consistenza nella placca e da 10 a 100 volte inferiore a quella degli streptococchi. Come microorganismi sono stati in grado di
- causare carie nel ratto germ-free
- indurre carie nell'uomo
- diminuire il numero quando si cura la carie
- in individui predisposti sono presenti in grande numero nella formazione della carie
L.acidophilus e L.casei produttori di ac. lattico sono risultati più cariogeni che altri microorganismi non produttori (CO2 e ac. formico), tollerano bassi pH, sopravvivono sia nella placca che nella carie (sinergismo).
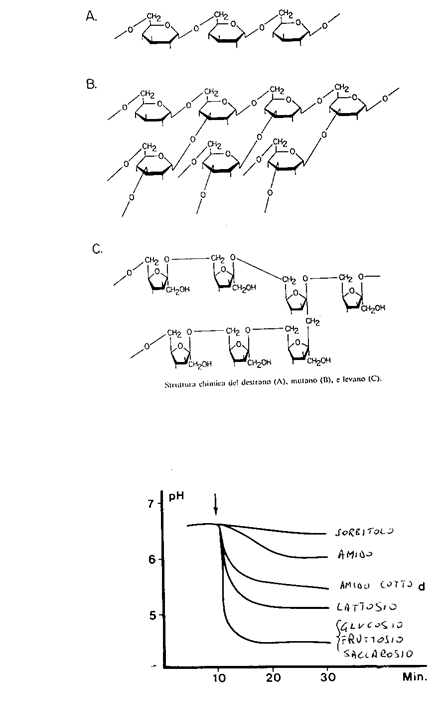
Figura 1.1 Rappresentazione del glucano e del mutano e curva di Stephan
MALATTIA PARODONTALE
La malattia parodontale può essere così schematizzata:
- La gengivite si sviluppa con l'aumento dell'accumulo della placca
- Il tessuto infiammato nella gengivite è portato alla normalità se la placca viene rimossa
- Alcuni agenti antimicrobici prevengono la gengivite e possono dare benefici nel trattamento della parodontite
- Alcuni animali da laboratorio infettati sperimentalmente con specifici microorganismi orali sviluppano malattia parodontale
- Animali da laboratorio mantenuti in un ambiente libero da batteri non sviluppano parodontite.
La parodontite si sviluppa in un preciso sito di infezione e generalmente appare dopo la formazione della placca. Sono state formulate due ipotesi quella cosiddetta non specifica associata ad un vasto numero di microorganismi ed una specifica associata ad una sola specie.
Considerando che appare piuttosto difficile identificare un microorganismo coinvolto in un ambiente ove sono presenti almeno 300 specie di batteri diversi da un punto di vista microbiologico è più logico pensare ad un coinvolgimento di più specie di microorganismo.
FATTORI DI VIRULENZA DELLA PARODONTOPATIA
Nella placca supragengivale sono presenti soprattutto S.sanguis e A.viscosus e successivamente si aggiunge S.mutans. E' un sito poco esposto all'azione detergente della saliva, è dominato dai gram-positivi e si ha espansione della placca nel solco gengivale, si crea uno stato infiammatorio con ulteriore espansione dei microorganismi con facile colonizzazione e subentro da parte dei gram-negativi: F. nucleatum E. corrodens V. parvula, C. ochracea, B. gengivalis. B.intermedius, B.melaninogenicus.
L'adesione tra i batteri, la coaggregazione ed il sinergismo che si crea è il meccanismo principale come fattore di virulenza.
I batteri hanno uno sviluppo a limiti insostenibili per le difese dell'ospite, con conseguente produzione di grandi quantità di metaboliti. Insieme a questi vi sono le tossine più specifiche prodotte dai gram-positivi e l' endotossina dai gram-negativi .
Nell'ambito delle esotossine va ricordata la leucotossina (LT) prodotta da Actinobacillus actinomycetemcomitans che uccide i PMN ed i monociti.
LPS è espressione di citotossicità, di attivazione del complemento, del grado di tossicità dipendente dal microorganismo, dalla distruzione del tessuto.
LPS può interferire con la riadesione dei fibroblasti alla superficie del dente.
ENZIMI:
Molti prodotti extracellulari dei batteri hanno attività enzimatica sui tessuti. Il ruolo di questi enzimi è incerto a causa di analoghi prodotti liberati da PMN e macrofagi, in breve:
fosfolipasi, lecitinasi, fosfatasi, proteasi, neuraminidasi (attiva sulla membrana della cellule).
collagenasi attiva sul tessuto connettivo e sulle fibre del collageno.
ialuronidasi enzima che scinde l'acido ialuronoco , un mucopolisaccaride che agisce come cemento intracellulare nell'epitelio gengivale; la distruzione di questo polimero facilita la diffusione nei tessuti dei microorganismi.
Effetti sul midollo:
è un tessuto dinamico ove deposizione e riassorbimento delle sostanze si alternano continuamente. Si ha riduzione della massa midollare (squilibrio) i batteri attivano il complemento, osteoclast activating factor (OAF), la prostaglandina E (PGE) che è secreta dai macrofagi, e che attiva i linfociti e promuove l'assorbimento del midollo così come fanno LPS e LTA.
I metaboliti batterici inibiscono in particolare la crescita dei fibroblasti. Tali metaboliti sono: H2S eNH4OH e acidi organici.
I fattori di virulenza dei batteri gram-positivi.
(A.naeslundii, israeli, odontolyticcus, meyeri) sono presenti in gran numero nella placca sopragengivale, nel solco nonché nelle tasche parodontali favoriscono l'adesività ai gram-negativi (coaggregazione con S.sanguis e S.mitis).
Distruzione del tessute del parodonto, Produzione di sostanze che inducono infiammazione, liberazione di sostanze che promuovono la chemiotassi per i PMN, vengono attivati i linfociti B e si hanno danni cellulari dovuti alla liberazione di neuraminidasi.
Nell'ambito dei gram-negativi Actinobacillus actinomycetemcomitans che è coinvolto nella parodontite giovanile, come già accennato libera una leucotossina attiva sui PMN e monociti con sensibili riduzioni nelle difese attive, si ha inibizione della chemiotassi, liberazione di LPS (tossico per i macrofagi), assorbimento del midollo, aggregazione delle piastrine con danni significativi al tessuti.
Il Bacteroides melaninogenicus (Prevotella) detto anche Black Pigmented Bacteroides (BPB), B.gingivalis, B.intermedius e B.denticola, sono gram-negativi anaerobi che sono presenti in gran numero nelle tasche parodontali, producono collagenasi, emoagglutinazione, proteasi (IgA, IgG, fibrina), acidi grassi, indolo ammoniaca, H2S, mercaptani, tutti composti tossici per le cellule, LPS tossico sui fagociti e tutti quei fenomeni citati a propositi delle infezioni miste e del sinergismo batterico.
Capnocytophaga ochracea, C.gingivalis, e C.sputigena sono presenti anch'essi in gran numero nelle tasche parodontali, stimolano la proliferazione dei fibroblasti, liberano una proteasi che scinde IgA e IgA e producono LPS con i relativi fenomeni di tossicità.
Fusobacterium, produce proteasi, acidi organici LPS ed infine Eikenella e Wolinella stessi meccanismi di altri gram-negativi.
L’ecologia microbica della cavità orale è, insieme a quella del tratto intestinale, una delle più ricche e complesse del nostro organismo. I batteri abitano questo sito dalla nascita al termine dei nostri giorni. Oltre 300 specie sono in grado di colonizzare la bocca e nei singoli individui è possibile dimostrarne in media 150-200 (Socransky e Haffajee, 1994). Subito dopo l’eruzione, ogni dente diviene la sede di affollata vita microbica. I germi sono essenzialmente Gram-positivi, aerobi facoltativi, con qualche anaerobio Gram-negativo. Le concentrazioni sono usualmente modeste, dell’ordine di 103 e nella regione parodontale predominano Streptococcus sanguis, S. mitis, Veillonella parvula, Actinomyces naeslundii, A. viscosus e Rothia dentocariosa (Listgarten, 1994). Rispetto ad altre zone fortemente colonizzate dell’organismo, il dente esprime alcune importanti caratteristiche differenziali. Esso è primariamente un sito esterno all’organismo, il che spiega come raramente i batteri possano causare, per invasione, infezioni sistemiche. D’altra parte, proprio questo posizionamento periferico esclude la superficie dentale dal pattugliamento immunitario, così efficiente nella contenzione della vita batterica altrove. Teleologicamente ancor più determinante per le modalità di aggregazione delle comunità microbiche è il fatto che la superficie dei denti non è in grado di desquamare e si presta pertanto a fenomeni di accumulo. Tali condizioni spiegano la genesi della placca.
Struttura della placca dentale
La placca dentale è stata definita come un accumulo di cellule microbiche, non mineralizzato, che aderisce tenacemente alla superficie dei denti e mostra un’organizzazione strutturale con predominio di forme filamentose. Essa è composta da una matrice organica che deriva dalle glicoproteine salivari e da prodotti microbici extracellulari e, per sua natura, non può essere rimossa da semplici applicazioni meccaniche come il lavaggio (Listgarten, 1994). Nel biofilm supragengivale normale la carica batterica è bassa (102-103), le specie Gram-positive predominano e quelle Gram-negative sono rare. In condizioni normali questo tipo di placca non tende ad acquisire i patogeni tipici delle parodontopatie e il fenomeno è verosimilmente ascrivibile a meccanismi di competizione biologica per ora malconosciuti. La popolazione microbica mista del biofilm esprime caratteristiche innovative rispetto alla vita planctonica, quella condotta dai batteri in sospensione in un liquido, molto spesso erroneamente identificata come il modo naturale di essere dei germi (Darveau, Tanner e Page, 1997). Le dimensioni cellulari tendono infatti a miniaturizzarsi, esito di rimaneggiamenti strutturali importanti negli enzimi che formano il peptidoglicano parietale primo responsabile della morfologia microbica. Queste piccole cellule formano microcolonie che risultano tenacemente avvolte in una abbondante matrice adesiva extracellulare solitamente non prodotta in altre condizioni. Tale biofilm, per sua natura chimica, ha proprietà selettive nei confronti di molecole di medie e grandi dimensioni e si comporta come uno schermo filtrante e una resina a scambio anionico (Darveau, Tanner e Page, 1997). In questo ambiente ovattato, dove i metaboliti penetrano con difficoltà, i batteri della placca mostrano una velocità di replicazione assai modesta. Tali caratteristiche fisiologiche condizionano lo stabilirsi di un ambiente segregato, a lento ma inesorabile sviluppo.
La crescita di un biofilm che non contenga patogeni orali riconosciuti e in soggetti senza fattori di rischio è contrastabile da parte dell’organismo. Infatti, questo tipo di placca, prevalentemente impiantata su microorganismi Gram-positivi, è poco percepito dal soggetto in quanto emana scarsi segnali clinici sotto forma di enzimi ed endotossine (Page et al., 1997). Il risultato netto è il reclutamento modesto degli elementi che mediano l’infiammazione tissutale. Di conseguenza l’epitelio gengivale non viene intaccato e lo spazio a disposizione per l'’espansione del biofilm non aumenta. Agevolano la contenzione l'attivazione, da parte di specifici prodotti batterici, dell’endotelio e le congenite proprietà antimicrobiche del fluido crevicolare che includono il lisozima, il complemento, la lattoferrina e tutte le chinine facilitatrici della permeabilità vasale. D’altra parte la E-selettina e altre adesine intracellulari reclutano i polimorfonucleati circolanti capaci di contrastare la crescita batterica. Prodotti microbici elaborati a basso livello dai germi non patogeni della placca attivano anche i monociti in modo diretto e consentono la produzione locale di scarse quantità di mediatori dell’infiammazione, tra cui principalmente interleuchina-8 (Gemmel, Marshall e Seymour, 1997). Il risultato di queste interazioni è un sostanziale equilibrio che, nell’ospite normoergico e privo di fattori di rischio, mantiene l’integrità dell’epitelio gengivale contenendo l’espansione della placca, senza tuttavia mai eliminarla.
Le parodontopatie sono malattie infettive
La gengivite (infiammazione della gengiva) e le parodontiti (gengivite con perdita di attacco del dente) sono le più comuni patologie osservabili a carico dei tessuti orali. Mentre la gengivite è un fatto che riguarda praticamente tutta la specie umana, le parodontopatie sono alquanto più limitate e colpiscono in media il 10-15 % della popolazione (Winkelhoee, Rams e Slots, 1996). Appare evidente che, al di là dell’acquisizione di patogeni microbici che rimangono alla base delle manifestazioni cliniche, queste condizioni si avverano più facilmente in soggetti predisposti a causa di particolari fattori di rischio. Al di là di una ancor mal definita compartecipazione di elementi genetici (Hart e Korman, 1997) vengono considerati, seppur con pesi assai diversi, cause predisponenti alla genesi di parodontopatie la cattiva igiene orale, il tabagismo, il diabete, lo stato di stress, l’allergia, l’osteoporosi, le deficienze nell’attività dei polimorfonucleati e l’infezione evolutiva sostenuta dal virus dell’HIV (Salvi et al., 1997). Queste restano pur sempre concause in un processo patogenetico che vede nell’acquisizione di specifici agenti eziologici batterici il primum movens di un’infezione caratterizzata da ampia risposta immunitaria e da distruzione dei tessuti. La classificazione, dal punto di vista clinico, prevede non una sola entità nosografica ma una suddivisione in parodontopatie giovanili, progressive dell’adulto, associate a malattie di tipo sistemico, necrotizzanti e, infine, refrattarie al trattamento (Haffajee e Socransky, 1994)
Gli agenti eziologici delle parodontopatie
Si è già fatto cenno alla complessità della popolazione microbica della cavità orale. Delle oltre 300 specie che la compongono è possibile che da un minimo di 10 a un massimo di 30 possano essere considerate quelle che compartecipano all’eziologia delle parodontopatie in soggetti con predisposizione o fattori di rischio (Page et al., 1997). La definizione della natura di questi microorganismi è ostacolata da numerosi fattori. Quasi costantemente l’infezione è sostenuta da una popolazione polimicrobica nella quale potenti sinergismi patogenetici possono innescare eventi difficili da riprodurre in vitro. I siti gengivali coinvolti non hanno un sincronismo di espressione anatomopatologica talchè il campionamento di una zona può fornire risultati colturali drammaticamente diversi. Analoga considerazione vale per i tempi di prelievo e per le loro modalità. In ogni caso il quadro ormai accettato è che alte cariche di patogeni orali, con valori di conta superiori a 106-108 nelle tasche gengivali vengono, nelle lesioni, ad associarsi agli usuali consorzi esistenti nel biofilm normale. I microrganismi virulenti sono in grado di produrre fattori chimici assai differenziati che sollecitano la comparsa di profondi fatti infiammatori locali accompagnati dall’induzione di alti livelli anticorpali specifici. La progressione della malattia è arrestata o rallentata, alla stregua di quanto accade in altre infezioni, solo dall’eliminazione o dalla concomitante riduzione del numero di questi batteri. Qual è l’identità di questi microorganismi? Verranno di seguito considerate solo quelle specie che hanno recentemente ricevuto un consenso diffuso, trascurando i germi per i quali il dibattito è rimasto aperto.
Actinobacillus actinomycetemcomitans
Questo batterio è un piccolo bastoncino immobile, gram-negativo, saccarolitico, capnofilo, sicuramente coinvolto nell’eziopatogenesi della parodontite giovanile localizzata e probabilmente in causa anche nelle forme adulte distruttive (Haffajee e Soczansky, 1994). A riprova della sua partecipazione attiva sta l’enorme risposta anticorpale nei confronti di alcuni dei suoi antigeni di superficie mostrata dai soggetti malati. Significativo è anche il fatto che in seguito a trattamenti seguiti da guarigione o remissione clinica A. actinomycetemcomitans scompare dai tessuti oil suo numero diminuisce radicalmente. La specie, a differenza di quelle saprofite della placca normale, produce una lunga serie di fattori di virulenza molto variabili in ogni modo nei cinque sierotipi che sono oggi conosciuti (a - e) tanto che l’importanza di infezioni clonali diviene sempre più evidente (He et al., 1998). Il bacillo sintetizza fimbrie adesive ma non emoagglutinanti, dotate di proprietà antigene e in grado di mediare l’adsorbimento alle cellule bersaglio (Darveau, Tanner e Page, 1997). Esprime anche un’emoagglutinina potenzialmente adesiva agli epiteli ed è capace di spiccata aggregazione con altri microorganismi con evidente incremento della massa batterica del biofilm. Come germe Gram-negativo è dotato di un lipopolisaccaride parietale che esprime modesta attività endotossica ed è incapace di attivare la E-selettina rendendo il microorganismo invisibile ai polimorfonucleati. Altro fattore di virulenza viene considerata la proiezione verso gli spazi extracellulari di vescicole ricche di enzimi che manifestano attività citotossica, demolendo i tessuti e mettendo a disposizione una larga quantità di elementi nutritivi per altri copatogeni. Concorrono alla virulenza dei vari cloni e sierotipi la produzione di collagenasi, gingipaina e proteasi, queste ultime con specifica attività di demolizione sulle immunoglobuline G umane, inibitrici della fagocitosi e dell’attivazione del complemento (Schwartz et al., 1997). Una caratteristica biologica di estremo interesse anche per l’orientamento nella scelta degli antibiotici da utilizzare come terapia aggiuntiva alle normali cure odontoiatriche è rappresentata dalla capacità che ha A. actinomycetemcomitans di penetrare e sopravvivere all’interno di cellule del connettivo gengivale, dell’epitelio orale e di cheratinociti (Hillman, Dagan e Genrtsen, 1998). Questa importante constatazione , che può essere estesa a Porphyromonas gingivalis e forse anche a Bacteroides forsythus accomuna i più importanti patogeni delle parodontopatie a batteri come Staphylococcus aureus e Streptococcus pyogenes per i quali è stata ugualmente dimostrata la capacità di esistenza intracellulare (Neuman et al., 1998).
Porphyromonas gingivalis
Germe Gram-negativo a morfologia bastoncellare, immobile, acapsulato, asaccarolitico e anaerobio, fa parte del gruppo dei Bacteroides che producono pigmento nero. Le cause che hanno condotto a una sua associazione con fatti parodontitici sono simili a quelle già proposte per A. actinomycetemcomitans (Haffajee e Socransky, 1994). I fattori di virulenza includono collagenasi, proteasi, endotossina, sintesi di acidi grassi a corta catena di carbonio nettamente citotossici, (Botta et al., 1989) produzione di ammoniaca, idrogeno solforato e indolo. Nei soggetti sintomatici è molto comune il riscontro di elevati titoli anticorpali contro elementi strutturali del germe. P. gingivalis si comporta come patogeno intracellulare facoltativo in elementi epiteliali isolati dalle lesioni di numerose forme cliniche di parodontiti.
Prevotella intermedia, Bacteroides forsythus, Fusobacterium nucleatum, Campylobacter rectus, Eikenella corrodens, Peptostreptococcus micros.
Questi microorganismi, di complessa classificazione tassonomica, sono oggi considerati tra i più probabili patogeni di quelle malattie infettive comunemente raggruppate sotto il nome di parodontopatie. Per la maggior parte di tali batteri la più recente letteratura indica numerosi fattori di virulenza intra e extracellulare, la ubiquitaria capacità di evocare pronte e durevoli risposte anticorpali e, almeno per B. forsythus, lo stato di microorganismo capace di penetrare nelle cellule della mucosa orale e di permanervi inalterato per lunghi periodi (Haffajee e Socransky, 1994; Page et al., 1997). Va sottolineato che è forse questa la base biologica dell’andamento cronico con esacerbazioni di tutte le malattie parodontali. Mentre i trattamenti che abbassano la concentrazione microbica nella placca sottogengivale possono portare a remissione delle manifestazioni cliniche, il permanere dei patogeni nell’ambiente intracellulare, protetto anche da eventuali terapie antibiotiche condotte con farmaci inappropiati per incapacità di penetrare in tale compartimento, può rappresentare la causa delle recidive.
La risposta dell’ospite al biofilm patologico
Quando, a causa della presenza di ben definiti fattori di rischio, i patogeni parodontali vengono a sovrapporsi alla popolazione normale della placca dentale il biofilm inizia ad inviare potenti segnali della propria presenza a causa delle endotossine e delle esotossine elaborate dai batteri virulenti. I persistenti stimoli antigene che ne derivano modulano le risposte delle difese locali. Dal punto di vista anatomopatologico l’infiltrato plasmacellulare, caratteristico delle parodontopatie, indica lo sforzo di contenimento basato sulla sintesi locale di anticorpi cui si sovraimpone la estesa attività dei polimorfonucleati richiamati in situ dalle elevate concentrazioni di metaboliti tossici (Kornman, Page e Tonetti, 1997). Se le difese locali sono appropriate esse risultano sufficienti a controllare l’infezione e si assiste a un momentaneo diminuire della carica batterica e dei suoi prodotti nocivi. Se l’asse anticorpi-neutrofili è inadeguato il biofilm continua ad espandersi, i patogeni microbici e i loro metaboliti penetrano sempre più profondamente nei tessuti. In questa sede l’organismo fa scattare le difese basate sul funzionamento dei monociti e dei linfociti (Ishikawa et al., 1997; Dennison e Van Dyke, 1997). Questi sono richiamati nelle lesioni assenzialmente dallo stimolo lipopolisaccaridico dovuto alle pareti cellulari dei patogeni Gram-negativi. Le endotossine inducono attivazione e produzione di una cascata di citochine cataboliche e mediatori che includono prostaglandine, interleuchina-1, IL-6, Tumor necrosis factor e altri principi (Gemmel, Marshall e Seymour, 1997). Ne consegue lo stabilirsi di una patologia da infiammazione con il risultato che i mediatori immunologici finiscono per attivare i fibroblasti che producono metallopretinasi della matrice. Questi eventi portano alla apoptosi cellulare e alla distruzione del connettivo e dell’osso alveolare (Schwartz et al., 1997). A seguito della sempre maggiore disponibilità di nutrienti causata dal processo infiammatorio la placca sottogengivale si espande ma a questa avanzata si contrappone, in un equilibrio instabile, la forte stimolazione dell’asse anticorpi-neutrofili che alla lunga frena e contiene il progredire delle lesioni. La parodontopatia entra in apparente stato di remissione ma il processo viene di solito riesacerbato dalla concomitante evoluzione imprevedibile dei fattori di rischio individuali (Page et al., 1997). Nelle peggiori condizioni la caduta dell’elemento dentario rimuove un ecosistema divenuto molto pericoloso evitando gravi infezioni sistemiche.
Approccio alla terapia delle malattie parodontali
Il grande paradosso del trattamento delle parodontopatie risiede nel fatto che malattie con una dichiarata eziologia microbica continuano ad esse affrontate principalmente sulla base di procedimenti meccanici. Questo fatto è veramente unico tra tutte le condizioni riferibili a cause batteriche. Lo scopo delle cure prestate al paziente affetto da parodontopatia è quello di preservare la dentatura arrestando, rallentando o comunque diminuendo il processo di distruzione tissutale in atto. Il successo di ogni tipo di trattamento si basa sulla possibilità di ottenere un significativa riduzione della popolazione microbica totale e, in particolare, degli elementi batterici più virulenti. Linee guida anche molto recenti ribadiscono che, per fortuna, esistono numerosi approcci alla terapia di queste infezioni (American Accademy of Periodontology, 1998). Nessun particolare trattamento può essere considerato il solo mezzo per la cura di tutte le parodontopatie note. Un approccio può rivelarsi adeguato per una parte della bocca mentre altre possibilità sono più produttive in altre sedi anatomiche dello stesso paziente. In ogni caso vengono sempre raccomandati questi comportamenti. Il soggetto deve essere educato e consigliato per ciò che concerne la sua igiene orale e deve essere aiutato a tenere sotto controllo, fin dove possibile, i propri fattori di rischio conosciuti. Devono sempre essere rimosse le placche sopra e sottogengivali accessibili e i calcoli dentali devono essere ugualmente allontanati. Le irregolarità delle superfici radicali indotte dal processo patologico vanno adeguatamente affrontate e laddove l’estensione e la gravità lo richiedano i trattamenti chirurgici sono certamente vantaggiosi.
Sono certamente queste le basi riconosciute di una terapia sovente destinata a produrre successo clinico. Vengono considerati aggiuntivi altri atti medici che includono il trattamento di resezione gengivale destinato a ridurre o eliminare le tasche parodontali con conseguente benefico effetto sull’igiene orale e l’impiego di agenti antimicrobici pensati come un mezzo per eradicare i patogeni batterici, protagonisti principali della malattia. Gli antibiotici possono essere utilizzati attraverso un uso topico o per via generale. Sebbene la disamina dell’impiego locale delle molecole antibatteriche, visti i positivi risultati che possono essere ottenuti (Greenstein e Palson, 1998), sembri allettante, nella presente rassegna, per motivi di spazio, l’attenzione verrà focalizzata solo sull’uso sistemico di questi presidi medicamentosi.
Antibioticoterapia sistemica delle parodontopatie
Quando paragonata agli interventi meccanici a all’applicazione topica di medicamenti, la somministrazione per via generale di antibiotici, pur sempre considerata come aggiuntiva alle altre pratiche, presenta notevoli vantaggi. In particolare la diffusione di un farmaco appropriato come caratteristiche cinetiche può garantire che tutte le sedi di lesioni attive o in quiescenza, molto evidenti o ben celate, vengano raggiunte da concentrazioni tali di molecole antimicrobiche da consentire l’eradicazione o la forte diminuzione della carica dei patogeni parodontali residenti. Quando ciò accade risulta ridotta la possibilità di ricolonizzazione e di recidive. Proprio le più recenti acquisizioni sulla biologia di A. actinomycetemcomitans, P. gingivalis, B. forsythus e altre specie virulente, capaci di rimanere latenti all’interno delle cellule deve in qualche misura far ripensare alla strategia nella scelta degli antibiotici da utilizzare.
In linea generale l’idoneità di un farmaco è definita dal suo spettro appropriato per la copertura dei microorganismi in causa, dalla capacità di produrre un effetto battericida, dall’idoneità a raggiungere i siti di infezione a livelli elevati, da una buona tollerabilità locale e generale, da facilità di somministrazione e da opportune caratteristiche farmacoeconomiche. Per ciò che riguarda lo spettro va ricordato che le infezioni parodontali sono sostenute da popolazioni miste di germi aerobi, aerobi facoltativi e anaerobi, sia Gram-positivi che Gram-negativi e che a causa del possibile sinergismo patogenico l’antibiotico ideale deve provvedere ad eliminare la maggior parte di questi microorganismi.
Per loro natura, intere classi di antibiotici non rispondono a questi requisiti e ben raramente infatti l’odontoiatra li utilizza nella propria pratica. Gli aminoglicosidi ad esempio (gentamicina, netilmicina, tobramicina, amikacina) sono totalmente inattivi sui germi anaerobi e questo limite è altrettanto evidente nei fluorochinoloni ad oggi disponibili (ciprofloxacina, ofloxacina, levofloxacina). Analogamente i glicopeptidi oltre a richiedere, come gli aminoglicosidi, una somministrazione parenterale, risultano battericidi solo sui microorganismi Gram-positivi (vancomicina, teicoplanina). I sulfamidici soffrono di diffuse resistenze e il metromidazolo, pur ampiamente impiegato (Goodson, 1994; Winkelhoff, Rams e Slots, 1996) è attivo essenzialmente solo contro la componente anaerobica della placca e tende pertanto ad essere utilizzato in associazione (Rudhart et al., 1998). Per lo stesso motivo la rifampicina, il cui spettro è uno dei più ampi esistenti, richiede una costante somministrazione di altro principio attivo, viste le inevitabili problematiche di resistenza.
Da questa disamina negativa risultano escluse le tetracicline, i ß-lattamici (salvo le cefalosporine, i monobattamici (aztreonam) e i carbapenemici (imipenem-cilastatina) a causa dello spettro inadeguato o delle modalità di somministrazione) e i macrolidi. Tutti questi antibiotici sono utilizzati nella pratica clinica con successo ma l’evoluzione genetica dei batteri responsabili delle parodontopatie richiede oggi una puntualizzazione sulle diverse basi teoriche del loro impiego.
Le tetracicline sono agenti batteriostatici, con forte affinità per il tessuto osseo nel quale possono permanere a lungo causando problemi estetici. La resistenza microbica a queste antiche molecole è così diffusa da averne limitato grandemente il consumo in tutte le infezioni sistemiche (Goodson, 1994; Ellen e Mc Culloch, 1996).
Le penicilline (ampicillina, amoxicillina) soffrono della presenza, nella popolazione polimicrobica della placca, di elementi che risultano forti produttori di ß-lattamasi. Prevotella, Capnocytophaga, P. gingivalis, E. corrodens, Veillonella parvula, Stafilococchi, Emofili e Moraxella, che costantemente colonizzano l’orofaringe, sono in grado di sintetizzare enormi quantità di questi enzimi idrolitici. E’ per questo motivo che l’associazione di amoxicillina con clavulanato, inibitore suicida delle ß-lattamasi, ha avuto un buon successo in odontoiatria (Ellen e Mc Culloch, 1996). Per i ß-lattamici è inoltre arduo superare la barriera costituita dall’ampia matrice del biofilm in cui sono indovati i patogeni e la loro efficacia viene certo diminuita dalla bassa velocità di moltiplicazione e dalle modifiche che la miniaturizzazione introduce negli enzimi che fabbricano la parete cellulare, primario bersaglio d’azione di questi farmaci. Un altro importante ostacolo al successo dei ß-lattamici è frapposto dalla collocazione intracellulare che possono assumere i più riconosciuti patogeni parodontali, visto che queste molecole sono quasi del tutto escluse da tale ambiente, rimanendo concentrate nei liquidi interstiziali (Turnidge, 1998; Craig, 1998).
I macrolidi, a causa del loro meccanismo d’azione, includono la quasi totalità dei batteri di interesse odontostomatologico nel loro spettro di attività sovente battericida (Gialdroni-Grassi, 1993) e l’effetto si esplica anche sui microorganismi capaci di produrre ß-lattamasi. Il fenomeno della resistenza a questa classe di molecole non è diffuso nei patogeni specifici delle parodontopatie (Piccolomini, Catamo e Bonaventura, 1998). Altro vantaggio posseduto dai macrolidi è la soddisfacente diffusione non solo tissutale ma anche intracellulare. In questo importante compartimento tali farmaci vengono attivamente concentrati, raggiungendo livelli più alti di quelli riscontrati nei fluidi circolanti (Gialdroni-Grassi,1993). A causa di queste favorevoli caratteristiche microbiologiche, farmacocinetiche e di ottima tollerabilità, eritromicina, roxitromicina, miokamicina, josamicina, spiramicina, claritromicina , fluritromicina e azitromicina sono state largamente usate anche in campo odontoiatrico (Ellen e Mc Culloch, 1996; Rubinstein e Keller, 1998).
Conclusioni
I progressi che ha compiuto la comprensione della patogenesi delle parodontopatie sono stati impressionanti. La natura di malattia infettiva è stata ribadita con la dimostrazione della virulenza delle specie microbiche coinvolte nel fatto eziologico. L’acquisizione del dato della loro posizione intracellulare facoltativa ha contribuito a chiarire i meccanismi delle esacerbazioni e dei fallimenti terapeutici. Molti fattori di rischio sono stati chiaramente identificati e sono stati introdotti modelli comportamentali da offrire ai pazienti nel tentativo di raggiungere una significativa modifica di quelli influenzabili. L’approccio terapeutico classico è più che collaudato e le nuove tecnologie promettono di renderlo sempre più efficace. Nel campo dei trattamenti aggiuntivi non vi è ancora consenso sulla piena utilità di somministrazione topica di sostanze antimicrobiche. Più concordia è stata raggiunta nel considerare utile l’impiego di antibiotici per via sistemica. L’orientamento dell’odontoiatra nella scelta dei farmaci più appropriati ha subito nel tempo significativi mutamenti. Messe in disparte le tetracicline, poco apprezzato il metronidazolo, sono padroni del campo i ß-lattamici e i macrolidi. A vantaggio dei macrolidi si possono vantare alcune qualità non condivise dalle penicilline. Uno spettro più completo, che include tutta la gamma dei patogeni orali, una capacità di penetrazione non solo tissutale ma soprattutto intracellulare, con effetto battericida, l’assenza di fenomeni di allergia e anafilassi, la capacità di collaborare con le difese dell’ospite, intesa anche in senso antiinfiammatorio, e l’ottima tollerabilità.
Se queste sono le caratteristiche generali che rendono la classe dei macrolidi, efficace nella clinica, ben accetta all’odontoiatra, la selezione definitiva della molecola da utilizzare dovrà essere guidata nella pratica da più fini considerazioni basate da una parte sulle proprietà dell’antibiotico specifico e dall’altra sulle condizioni del paziente.
fonte: http://www.microbiologia.unige.it/dpb/Appunti/17%20MICROBIOLOGIA%20ORALE.doc
sito web: http://www.microbiologia.unige.it/
Autore del testo: non indicato nel documento di origine
Microbiologia orale
Visita la nostra pagina principale
Microbiologia orale
Termini d' uso e privacy