Sistema endocrino
Sistema endocrino
I riassunti, le citazioni e i testi contenuti in questa pagina sono utilizzati per sole finalità illustrative didattiche e scientifiche e vengono forniti gratuitamente agli utenti.
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
SISTEMA ENDOCRINO
Il sistema endocrino ha la funzione di controllare costantemente le condizioni esterne e interne del corpo e l’informazione che ne deriva deve giungere ai centri in cui essa viene integrata allo scopo di fornire le risposte appropriate
ORMONI: molecole organiche (steroidi, proteine o derivati dagli amminoacidi) che producono specifici effetti su organi o tessuti bersaglio
GHIANDOLE: ammassi di cellule epiteliali specializzate nella sintesi e secrezione di ormoni. Si dividono in ghiandole esocrine (secernono i loro prodotti all’interno di dotti che sfociano a livello di superfici) e in ghiandole endocrine (essendo prive di dotti secernono i loro prodotti nei liquidi extracellulari, da cui diffondono nella corrente sanguigna).
FEROMONI: ormoni rilasciati all’esterno del corpo per comunicare informazioni ad organismi della stessa specie.
CONTROLLO A FEEDBACK NEGATIVO: meccanismo di controllo della secrezione di ormoni mediante il quale all’aumentare della concentrazione del prodotto finale del processo metabolico stimolato dall’ormone si ha l’inibizione del rilascio dell’ormone stesso.
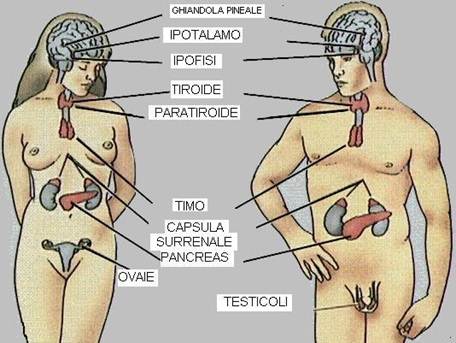
IPOFISI
E’ una piccola ghiandola localizzata alla base del cranio, sotto l’ipotalamo ed è costituita da tre parti: lobo anteriore, lobo intermedio e lobo posteriore.
Lobo anteriore:
- Ormone della crescita: stimola la sintesi proteica e la crescita delle ossa
- Prolattina: stimola dopo il parto la secrezione di latte nei mammiferi
- Ormoni tropici: TSH (stimola le cellule della tiroide e aumenta la produzione dell’ormone tiroideo; ACTH ( stimola le cellule della corticale surrenale e aumenta la produzione di cortisolo); gonadotropine (ormoni che agiscono su testicoli e ovaie: FSH follicolo stimolante e LH luteinizzante)
Lobo intermedio:
- È la fonte dell’ormone che stimola i melanociti (nei rettili e negli anfibi provoca il cambiamento di colore associato al mimetismo)
Lobo posteriore: funge da deposito per gli ormoni che vengono prodotti dall’ipotalamo:
- Ossitocina: favorisce il parto accelerando le contrazioni durante il travaglio; è il responsabile della fuoriuscita del latte dalle cellule in cui viene sintetizzato.
- Ormone ADH: diminuisce l’escrezione di acqua da parte dei reni; in alcune circostanze (come una grave emorragia) fa aumentare la pressione del sangue.
IPOTALAMO
E’ un’area dell’encefalo che si trova appena sopra all’ipofisi. Sintetizza:
- Ossitocina (ved. Ipofisi)
- ADH (ved. Ipofisi)
- Fattori di rilascio:agiscono stimolando o inibendo la secrezione di ormoni da parte del lobo anteriore dell’ipofisi. I fattori di rilascio sono 10 e sono piccoli peptici caratterizzati dal fatto che non entrano mai nella circolazione generale, ma compiono un breve tragitto tramite un sistema di capillari
Inoltre riceve informazioni da molte altre aree del cervello regolando la produzione ormonale anche in relazione ai cambiamenti dell’ambiente.
TIROIDE E PARATIROIDI
La TIROIDE è una ghiandola endocrina situata alla base del collo davanti alla trachea. Grazie all’influenza dell’ormone ipofisario TSH secerne:
- Tiroxina e triiodotironina: accelerano la velocità della respirazione cellulare; in alcuni animali svolgono un ruolo fondamentale nella regolazione della temperatura.
- Calcitonina: regola con l’aiuto degli ormoni paratoroidei il metabolismo del calcio (abbassa la concentrazione del calcio nel sangue stimolando l’assorbimento di questo da parte delle ossa e inibendo la sua assimilazione a livello intestinale e il suo riassorbimento da parte dei reni.
Le ghiandole PARATIROIDI sono 4 ghiandole endocrine situate dietro o all’interno della ghiandola tiroide. Queste secernono:
- Ormone paratiroideo: aumenta la concentrazione degli ioni calcio nel sangue in vari modi: stimola la conversione della vitamina D nella sua forma attiva, che a sua volta favorisce il passaggio di ioni calcio dall’intestino al sangue; riduce l’escrezione di ioni calcio da parte del rene; stimola il tessuto osseo a liberare il calcio nella corrente sanguigna.
GHIANDOLE SURRENALI
Le ghiandole surrenali si trovano sopra ai due reni e sono formate da due regioni diverse: la corticale surrenale e la midollare surrenale.
Corticale surrenale:
- Cortisolo: promuove la formazione di glucosio a partire dalle proteine e dai grassi; riduce l’utilizzo di glucosio da parte di molte cellule con l’eccezione delle cellule del cervello e del cuore; sopprimono le risposte infiammatorie immunitarie.
- Aldosterone: determina un maggiore assorbimento degli ioni sodio dal tubulo distale e dal dotto collettore del nefrone, fa aumentare le secrezioni di ioni potassio in essi e determina l’aumento del riassorbimento di acqua; produce piccole quantità di ormoni sessuali maschili.
Midollare surrenale:
- Dopamina: mediatore chimico implicato nella trasmissione dell’impulso nervoso nelle sinapsi del sistema nervoso centrale.
- Adrenalina e noradrenalina: accelerano e potenziano il battito cardiaco; aumentano la pressione sanguigna; stimolano la respirazione; dilatano le vie respiratorie; stimolano l’attività dell’enzima che scinde il glicogeno in glucosio.
PANCREAS
Il pancreas è una ghiandola sia esocrina che endocrina e quest’ultima è costituita da due differenti tipi di cellule: cellule alfa e cellule beta, riunite in isole completamente circondate dalla parte esocrina del pancreas. Le isole di Langerhans secernono:
- Insulina: secreta dalle cellule alfa, abbassa la concentrazione di zucchero ematico stimolando sia l’assorbimento e l’utilizzo del glucosio da parte delle cellule, sia la sua conversione il glicogeno nel fegato e in grassi da parte delle cellule adipose; favorisce l’assorbimento di amminoacidi da parte del fegato e stimola la sintesi proteica.
- Glucagone: secreto dalle cellule beta aumento lo zucchero nel sangue stimolando la scissione del glicogeno in glucosio nel fegato e la scissione dei grassi e delle proteine.
La molteplicità dei meccanismi che regolano i livelli di glucosio ematico assicura la costante presenza di questo zucchero nelle cellule celebrali.
LA GHIANDOLA PINEALE
La ghiandola pineale è un piccolo lobo situato al centro del cervello che secerne:
- Melatonina: ormone che inibisce l’attività delle gonadi in svariate specie; negli esseri umani sembra essere legata alla maturazione sessuale; regola i ritmi di sonno e veglia, migliorando la qualità del sonno e inducendo al rilassamento
- Ritmi circadiani
LE PROSTAGLANDINE
Sono composti chimici sintetizzati nelle vescicole seminali a partire da un acido grasso. Differiscono dagli ormoni per:
- Sono costituiti da acidi grassi
- Sono prodotte dalle membrane cellulari di quasi tutti gli organi del corpo
- I loro tessuti bersaglio sono generalmente gli stessi tessuti in cui sono prodotte
- Producono un effetto marcato a concentrazione molto più basse di quelle della maggior parte degli ormoni.
Le prostaglandine inducono:
- La contrazione di pareti uterine
- Lo stimolo nell’ inizio delle mestruazioni e del parto
- La modifica del processo di coagulazione del sangue
- Leucotrieni: agiscono da mediatori chimici della reazione infiammatoria e allergica.
MECCANISMO DI AZIONE DEGLI ORMONI
Le prostaglandine e i neurotrasmettitori percorrono solo brevi distanze per raggiungere le cellule bersaglio, mentre la maggior parte degli ormoni inviano i loro messaggi a grandi distanze; per fare questo :
- Recettori intracellulari: gli ormoni incontrano nella cellula specifiche molecole recettrici con cui si combinano. Il complesso ormone-recettore entra nel nucleo dove si lega a una proteina cromosomica specifica la quale avvia la trascrizione di un determinato segmento di DNA in mRNA.
- Recettori di membrana: gli ormoni peptidici e i derivati amminoacidici si combinano con recettori situati sulla membrana delle cellule bersaglio. A questo punto il complesso ormone-recettore viene portato nel citoplasma per endocitosi oppure l’ormone non entra nella cellula, ma legandosi al recettore mette in moto un secondo messaggero (AMP ciclico) responsabile della serie di eventi che si verificano all’interno della cellula.
PATOLOGIE LEGATE AL SISTEMA ENDOCRINO
Tiroide:
- Ipertiroidismo: eccessiva produzione degli ormoni secreti dalla tiroide
- Ipotiroidismo: malattia che se insorge nell’infanzia interferisce con il normale sviluppo mentale e fisico.
Pancreas:
- Diabete: si riferisce alla grande quantità di urina prodotta ed escreta nell’arco delle 24 ore ed è caratterizzata dall’aumento della diuresi , da una sete insaziabile,secchezza della pelle e stanchezza. Si può dividere in diabete insipido o mellito.
Autore: non indicato nel documento
fonte: http://www.freiheitfreedom.altervista.org/files/SISTEMA_ENDOCRINO.doc
Ormoni e sistema endocrino
Il sistema endocrino è composto da vari organi che espletano mansioni di regolazione per le diverse funzioni corporee mediante messaggi di tipo ormonale. Gli ormoni giungono a destinazione per mezzo dell’apparato sanguigno. Questa maniera di comunicare riguarda cellule distanti tra loro ed è detta “indiretta” per distinguerla dalla comunicazione tra cellule vicine chiamata “diretta”. Esistono anche altri tipi di messaggi, quelli relativi a:
- segnalazioni neuroendocrine, in cui sono le cellule nervose che rilasciano segnali chimici nel sangue;
- segnalazioni autocrine, in cui le cellule rispondono a sostanze rilasciate da loro stesse.
I messaggi ormonali, trasportati dal sangue, possono agire su organi e cellule in qualsiasi parte dell’organismo, la comunicazione può richiedere anche diverse ore.
Per l’apparato endocrino non si può parlare di continuità anatomica, ma di continuità funzionale, infatti spesso gli ormoni modulano la loro azione o sono modulati da quelli prodotti da un altro organo o da altre cellule.
I principali organi endocrini sono:
- l’ipofisi,
- la tiroide,
- il timo,
- le paratiroidi,
- il pancreas endocrino,
- le ghiandole surrenali,
- le gonadi (ovaio e testicolo).
L’ipofisi
È detta anche ghiandola PITUITARIA, ha forma ovoidale. È situata nella testa entro la sella turcica dell’osso sfenoide; collegata all’Ipotalamo mediante un peduncolo, può essere distinta in due parti:
- la neuroipofisi, che per la sua struttura è detta anche pars nervosa o lobo nervoso, costituisce la porzione posteriore della ghiandola, deriva dalle pareti del terzo ventricolo, viene considerata, anche funzionalmente una parte dell’Ipotalamo, non è che la sede in cui gli ormoni prodotti da nuclei dell’Ipotalamo (ADH e Ossitocina) vengono messi in circolo;
- l’adenoipofisi, che è una vera ghiandola endocrina, tra gli ormoni adenoipofisari vi è anche l’ormone della crescita.
La produzione degli ormoni ipofisari è sottoposta a regolazione:
- dell’Ipotalamo, che secerne fattori stimolanti la produzione degli stessi;
- degli ormoni prodotti dagli organi bersaglio.
La secrezione di ormoni è regolata in genere da processi di retroazione, i quali permettono che la secrezione di un ormone ipofisario venga inibita da determinate concentrazioni di ormone prodotto dall’organo bersaglio. A sua volta, la successiva diminuzione di ormone dell’organo bersaglio porterà ad un nuovo incremento del rilascio di ormone stimolante da parte dell’Ipofisi.
Ormoni adenoipofisari
della crescita o somatotropo, (GH o STH)
stimola l’accrescimento, in particolare dello scheletro e dei tessuti molli
corticotropo (ACTH)
stimola trofismo e attività delle ghiandole surrenali
tireotropo (TSH)
stimola trofismo e attività della tiroide
FSH
consente la maturazione del follicolo ooforo e la produzione di estrogeni nell’ovaio; stimola la spermatogenesi nel testicolo
LH
nella femmina provoca l’ovulazione, mentre nel maschio stimola le cellule interstiziali del testicolo a produrre testosterone
prolattina
mantiene attivo il corpo luteo, che secerne progestinici, durante la gravidanza; dopo il parto stimola la produzione di latte
Autore: non indicato nel documento di origine del testo
fonte: http://www.myskarlet.altervista.org/Scuola/sistema%20endocrino.doc
SISTEMA ENDOCRINO
Funzioni Generali del Sistema Endocrino. Le Ghiandole Endocrine
L’Endocrinologia si occupa dello studio delle ghiandole endocrine, ormoni da esse prodotte e interazione tra sistema endocrino e altri sistemi, come il sistema nervoso e immunitario, svolgendo un ruolo importante nello sviluppo, crescita e metabolismo.
Il sistema endocrino è costituito da ghiandole endocrine classiche, come l'ipofisi, ipotalamo, ghiandola pineale (melatonina), tiroide, paratiroidi, ghiandole surrenaliche, ovaie, testicoli e pancreas, e da altre strutture che, pur non facendo parte del sistema endocrino, producono ormoni:
- rene: produce la renina che converte l'angiotensinogeno in angiotensina I e l'eritropoietina (Epo) che stimola la produzione dei globuli rossi.
- tessuto adiposo: produce la leptina, importante mediatore del peso corporeo, e la resistina che regola la sensibilità dell'insulina e può essere coinvolta nella patogenesi del diabete tipo 2.
- cuore: produce peptidi natriuretici.
Infine, alcune molecole, ritenute metaboliti intermedi, come gli acidi grassi e la bile, oggi sono note per la loro funzione ormonale.
Gli Ormoni sono molecole o messaggeri chimici che trasportano le informazioni necessarie per attivare le funzioni delle cellule bersaglio.
Il termine endocrino indica la secrezione in circolo di sostanze biologicamente attive per cui si parla di increzione ormonale, mentre il termine esocrino indica una secrezione esterna attraverso i dotti escretori, ad es. le ghiandole sudoripare, salivari o i dotti gastro-intestinali.
La Comunicazione Ormonale viene distinta in:
- comunicazione ematica (endocrina): l’ormone dopo la sintesi a livello delle cellule endocrine viene rilasciato in circolo e raggiunge il tessuto bersaglio dove interagisce con recettori ormonali specifici che trasducono il messaggio ormonale nella cellula bersaglio, per cui stimolano le fx cellulari anche a distanza dalla sede di produzione.
- comunicazione paracrina: l’ormone dopo la sintesi da parte delle cellule endocrine interagisce con le cellule circostanti, senza entrare in circolo, come nel caso degli ormoni steroidei nell’ovaio e angiotensina II nel rene.
- comunicazione autocrina: l’ormone interagisce con recettori localizzati nella stessa cellula che lo ha prodotto, come nel caso dell'insulina e somatostatina che possono inibire il loro stesso rilascio rispettivamente dalle cellule B e D del pancreas insulare, e si parla di effetto intracrino.
- comunicazione neurocrina: i neuroni producono una serie di messaggeri neuroendocrini cioè sostanze che funzionano come neurormoni, neurotrasmettitori o ormoni classici:
- le catecolamine si comportano da ormoni quando sono secrete dalla midollare del surrene, e come neurotrasmettitori quando sono rilasciate dalle terminazioni nervose, usando gli stessi recettori adrenergici sia nei tessuti periferici che nel SNC.
- l'ormone di rilascio della tireotropina TRH si comporta da ormone quando è prodotto dall'ipotalamo e da neurotrasmettitore quando agisce a livello del SNC.
- dopamina, ormone di rilascio della corticotropina CRH, peptide gene-correlato alla calcitonina CGRH, somatostatina, ormone di rilascio delle gonadotropine GnRH, peptide intestinale vasoattivo VIP, gastrina, secretina, colecistochinina CCK, steroidi (neurosteroidi)...
I neurotrasmettitori sono sintetizzati nel corpo cellulare del neurone, viaggiano lungo l'assone dove vengono immagazzinati nelle vescicole sinaptiche e sono rilasciate per depolarizzazione, legandosi a specifici recettori presenti sul neurone post-sinaptico, regolando la risposta delle cellule nervose adiacenti (paracrina).
La Classificazione degli Ormoni si basa sulla struttura chimica delle molecole con distinzione tra ormoni peptidici, ormoni derivanti dal colesterolo, ormoni derivati dagli aminoacidi e ormoni derivati dagli acidi grassi poliinsaturi (oltre 50 ormoni).
Gli Ormoni Peptidici sono proteine distinte in ormoni peptidici, polipeptidici e glicoproteici:
- ormoni peptidici e polipeptidici: Calcitonina (CT), PTH, ACTH, PRL, GH, CRH, GnRH, GHRH, TRH, Somatostatina (SRIH), ADH, Ossitocina (OT), Insulina (Ins), Colecistochinina (CCK), Gastrina, Ghrelina, Glucagone, VIP, PP, Ormone natriuretico atriale (ANH), Renina, Somatomedina C (IGF-1), Leptina (Lep), Angiotensina II, Arginina,
- ormoni glicoproteici: FSH, LH, TSH, Gonadotropina corionica umana hCG.
La Sintesi degli ormoni peptidici deriva dai meccanismi di traduzione o sintesi proteica, cioè:
- il filamento stampo del DNA viene trascritto dalla RNA polimerasi II in pre-mRNA o RNA precursore che viene sottoposto a processi di maturazione post-trascrizionale, cioè a reazioni di capping, poliadenilazione e splicing con rimozione degli introni e saldatura degli esoni adiacenti, ottenendo molecole mature di mRNA che passano dal nucleo nel citoplasma dove si assemblano con i ribosomi su cui avviene la sintesi proteica.
- dopo alcuni cicli di allungamento, dal ribosoma emerge una sequenza di 15-30 aa detta peptide segnale che viene riconosciuta e legata dalla particella di riconoscimento del segnale SRP, presente nel citoplasma, che blocca temporaneamente la sintesi proteica e si lega ad un recettore specifico presente sulla membrana del R.E.; la molecola SRP viene rilasciata, riprende la sintesi proteica e la catena polipeptidica in allungamento viene spinta nel R.E..
In questa fase si osserva il precursore ormonale o pre-proormone legato al peptide segnale che viene rapidamente degradato da un enzima tripsino-simile situato nella membrana del R.E. dando origine al pro-ormone.
- la sintesi proteica termina non appena il ribosoma incontra il codone di stop sull’mRNA, per cui il ribosoma si dissocia nella subunità maggiore e minore, e il pro-ormone viene veicolato da alcune vescicole nell’apparato di Golgi dove subisce delle modifiche post-traduzionali, cioè reazioni di glicosilazione e tagli proteolitici, dando origine all’ormone maturo.
La Secrezione degli ormoni peptidici viene distinta in 2 tipi:
- secrezione costitutiva con rapida secrezione dell’ormone neosintetizzato a livello della membrana apicale della cellula.
- secrezione regolata in cui l’ormone neosintetizzato viene immagazzinato nei granuli secretori intracellulari, formando dei depositi ormonali da cui l’organismo attinge in caso di necessità fisiologica o patologica, consentendo alla cellula di rispondere agli stimoli secretori in tempi più brevi rispetto a quando è necessaria la sintesi de novo degli ormoni, come in caso di ipocalcemia con rapida secrezione di PTH da parte delle cellule paratiroidee.
Per cui in presenza di stimoli secretori si ha la fusione tra la membrana dei granuli di secrezione e la membrana cellulare a livello latero-basale con secrezione mediante esocitosi degli ormoni nel liquido extracellulare, cioè nel plasma.
Il Trasporto degli ormoni peptidici non richiede l’intervento di proteine di trasporto o carrier, infatti gli ormoni peptidici sono idrosolubili (solubili in H2O), per cui dopo la secrezione circolano liberi nel plasma e possono interagire con i recettori delle cellule bersaglio, anche se ci sono delle eccezioni, infatti la IGF-1 e 2 si legano alle IGF-binding protein, mentre la vasopressina e l’ossitocina si legano alle neurofisine.
Per quanto riguarda il Metabolismo degli ormoni peptidici dobbiamo ricordare che:
- la maggior parte degli ormoni peptidici hanno una emivita plasmatica breve, variabile da 3 a 10 min., come l'ACTH, insulina, glucagone, PTH, TRH e GnRH, e vengono metabolizzati e degradati a livello delle cellule bersaglio e solo in minima parte sono distrutti dalle proteasi plasmatiche.
- gli ormoni glicoproteici hanno un’emivita plasmatica più lunga correlata ai residui di acido sialico delle catene oligosaccaridiche che prevengono il riconoscimento, legame e degradazione da parte delle asialoglicoproteine: l’ormone LH ha un’emivita di 50 min., il TSH di 70-80 min., FSH e hCG di ~ 4 h, e sono metabolizzati a livello epatico, mentre solo una piccola quota viene secreta direttamente con le urine.
Gli Ormoni derivanti dal Colesterolo sono ormoni di natura lipidica, comprendenti gli ormoni steroidei, acidi biliari e vitamina D.
La Sintesi degli ormoni steroidei avviene a partire da un precursore comune, cioè il colesterolo, nella corteccia surrenale, gonadi (testicoli e ovaie), placenta durante la gravidanza e in parte nel tessuto nervoso, dove la sintesi viene controllata da enzimi citocromo P450 specifici.
La Secrezione degli ormoni glucocorticoidi avviene per semplice diffusione attraverso la membrana cellulare, subito dopo la sintesi perchè non sono immagazzinati in granuli secretori.
Il Trasporto degli ormoni steroidei avviene grazie a specifiche proteine plasmatiche dette SBP (Steroid Binding Protein), dato che gli ormoni steroidei sono liposolubili, tra cui abbiamo la CBG per il cortisolo, SHBG per gli steroidi sessuali, DBP per la vit. D, e l’albumina plasmatica, ma solo l’ormone libero è biologicamente attivo cioè capace di agire a livello dei tessuti bersaglio.
Il Metabolismo degli ormoni steroidei avviene a livello epatico dando origine a composti idrosolubili (solubili in acqua) eliminabili per via renale e biliare (urine e feci).
Gli Ormoni derivati dagli aminoacidi (ormoni amminici) sono distinti in:
- ormoni derivanti dal triptofano: Melatonina, Serotonina.
- ormoni derivanti dalla tirosina:
- catecolamine: Adrenalina (A), Noradrenalina (NA), Dopamina (DA).
- iodotironine: Tiroxina o Tetraiodotironina (T4) e Triiodiotironina (T3).
- ormoni derivanti dalla istidina: Istamina (H).
Gli Ormoni derivati dagli acidi grassi poliinsaturi sono gli Eicosanoidi (prostanoidi [CH3(CH2)18COOH]) cioè molecole derivanti dall’acido arachidonico che è un acido grasso polinsaturo a 20 atomi di C che a sua volta viene sintetizzato da altri precursori, come l'acido linoleico che è un acido grasso essenziale che viene immagazzinato nelle membrane cellulari.
Dalla cicloossigenasi dell’acido arachidonico derivano le Prostaglandine (PG), Prostacicline (PC) e Trombossani (TX), mentre dalla lipoossigenasi derivani i Leucotrieni (LT).
Gli eicosanoidi sono direttamente secreti dopo la sintesi, hanno un’emivita di pochi secondi e vengono degradati da enzimi tissutali, ed hanno il compito di regolare il rilascio e l'azione di altri ormoni, ad es. la PGE inibisce il rilascio ipofisario del GH e della PRL.
Meccanismo di Azione degli Ormoni: Recettori Ormonali e Patologie Recettoriali
Gli Ormoni esplicano le loro azioni a livello delle cellule bersaglio in seguito all’interazione con Recettori specifici cioè proteine specializzate localizzate sulla membrana cellulare, nel citoplasma o sulla membrana nucleare, capaci di legarsi agli ormoni presenti in circolo con alta affinità e di trasdurre il messaggio ormonale, necessario per attivare i meccanismi effettori o funzioni biologiche della cellula bersaglio.
In realtà, esistono molte molecole capaci di evocare una risposta recettoriale distinte in agonisti, superagonisti e antagonisti:
- agonisti: molecole non ormonali che si legano al recettore con la stessa affinità dell’ormone naturale, evocando la stessa risposta cellulare.
- superagonisti: molecole che si legano ai recettori con affinità > rispetto all’ormone naturale, evocando un’azione maggiore e di lunga durata, tra cui abbiamo alcuni ormoni sintetici, come il prednisone e desametasone utilizzati nella terapia antiinfiammatoria.
- antagonisti: molecole che si legano al recettore al posto dell’ormone inibendo la risposta biologica della cellula bersaglio (azione competitiva); sono sintetizzati in laboratorio, come:
- tamoxifene: antiestrogeno che si lega al recettore degli estrogeni inibendone l’azione (cr. mammario).
- mifepristone (RU 486): antiprogestinico (aborto) e antiglucocorticoide.
- farmaci antagonisti dei recettori α e β adrenergici.
- farmaci antagonisti del recettore dell’angiotensina 2.
L’espressione dei recettori ormonali nelle cellule bersaglio viene regolato da meccanismi di down-regulation, up-regulation e priming:
- down-regulation: rappresenta un vero e proprio meccanismo di difesa delle cellule bersaglio che si attiva in caso di eccessiva stimolazione ormonale, che determina una < del n° dei recettori cellulari mediante l’internalizzazione e degradazione del recettore oppure blocco della sintesi proteica, in modo da desensibilizzare la cellula bersaglio, cioè viene < la sua capacità di rispondere all’ormone, come in caso di iperinsulinemia.
- up-regulation: determina l’> del n° dei recettori nel tessuto bersaglio in caso di ridotta stimolazione ormonale attraverso la sintesi di nuovi recettori (PRL) o la ricomparsa sulla membrana plasmatica di recettori in precedenza internalizzati (ormoni peptidici e catecolamine).
- priming: in tal caso l’espressione del recettore di un ormone è controllata da un altro ormone, ad es. l’FSH induce la sintesi di recettori per l’LH nelle cellule di Leydig.
I Recettori di Membrana sono glicoproteine espresse sulla membrana plasmatica a livello della superficie cellulare specifiche per gli ormoni peptidici e neurotrasmettitori distinti in:
- recettori tirosin-chinasici e guanilato-ciclasici dotati di funzione effettrice cioè trasducono direttamente il messaggio ormonale senza necessità di formare secondi messaggeri.
- recettori accoppiati alle proteine G e citochinici che trasducono il messaggio ormonale indirettamente grazie alla formazione di secondi messaggeri.
I Recettori Tirosin-chinasici sono costituiti da 3 domini cioè un dominio extracellulare che presenta il sito di legame specifico per l’ormome, un dominio transmembrana e un dominio intracellulare ad attività tirosin-chinasica. In seguito al legame O-R si ha la dimerizzazione del recettore con attivazione dell’enzima tirosin-chinasi, fosforilazione di uno o più residui di tirosina del recettore e trasduzione del messaggio ormonale.
Tra questi recettori abbiamo il recettore per l’insulina e il fattore di crescita insulino-simile (IGF).
Le Patologie dei recettori tirosin-chinasici sono dovute a mutazioni inibenti o attivanti:
- le mutazioni inibenti possono < o inibire l’attivazione del recettore oppure < l’espressione dei recettori sulla superficie cellulare, provocando resistenza ormonale con ridotta risposta ormonale, ad es. resistenza all’insulina con iperinsulinemia.
- le mutazioni attivanti più note sono quelle del gene RET nella sindrome MEN-IIA e IIB.
I Recettori Guanilato-ciclasici (guanilil-ciclasi) sono recettori specifici per il peptide natriuretico atriale (ANP) o cerebrale (CNP) e sono costituiti da un dominio extracellulare NH2-terminale che presenta il sito di legame per l'ormone, un dominio transmembrana e un dominio intracellulare C-terminale che presenta un sito di legame simil-chinasico per l'ATP che regola l'attività dell’enzima guanilato-ciclasi. Infatti, in seguito al legame O-R si ha una variazione della conformazione del dominio intracellulare con attivazione della guanilato-ciclasi, > dei livelli cellulari di cGMP e trasduzione del messaggio ormonale.
I Recettori accoppiati alle proteine G (G-protein) sono recettori di membrana specifici per gli ormoni peptidici formati da:
- un domino extracellulare NH2-terminale che presenta il sito di legame per l'ormone.
- un dominio transmembrana costituito da 7 α-eliche idrofobiche derivanti dal ripiegamento della catena polipeptidica per 7 volte nel doppio strato lipidico della membrana cellulare.
- un dominio intracellulare C-terminale che interagisce con le proteine G localizzate sul versante citoplasmatico della membrana plasmatica, costituite dalle subunità α, β, γ.
In condizioni di riposo con recettore libero la proteina G è inattiva e presenta la subunità α legata alla molecola di guanosina difosfato GDP, mentre in seguito al legame O-R la proteina G viene attivata, si forma la GTP e si ha il distacco del complesso α-GTP che rappresenta la parte biologicamente attiva che interagisce con gli enzimi effettori che favoriscono la formazione di secondi messaggeri responsabili dell’attivazione delle funzioni delle cellule bersaglio, innescando un meccanismo di amplificazione del segnale ormonale perchè ogni singolo complesso O-R può attivare varie proteine G alla volta e ogni proteina G può restare associata all’enzima effettore per lunghi periodi di tempo con formazione di centinaia di secondi messaggeri.
A tal proposito si fa una distinzione tra proteina GS, GQ e GI.
Tra gli ormoni che si legano al recettore accoppiato alla proteina GS abbiamo le catecolamine, glucagone, releasing hormones ipotalamici, FSH, LH, TSH, PTH.
In seguito al legame O-R si ha l’attivazione della proteina GS che si lega all’enzima adenilato-ciclasi che catalizza la reazione di defosforilazione dell’ATP in cAMP che funge da secondo messaggero che attiva la protein-chinasi A che catalizza le reazioni di fosforilazione dei residui di serina e treonina (trasferimento del gruppo P dall’ATP ai residui aa) con attivazione degli enzimi che mediano le funzioni biologiche della cellula o dei fattori di trascrizione che favoriscono l’espressione dei geni che codificano per proteine o enzimi importanti per la proliferazione e differenziazione cellulare.
Tra gli ormoni che si legano al recettore accoppiato alla proteina GQ abbiamo il TRH e GnRH. In seguito al legame O-R si ha l’attivazione della proteina GQ che si lega all’enzima fosfolipasi C che catalizza la scissione del fosfatidil-inositolo-4,5-difosfato in diacilglicerolo (DAG) e inositolo-1,4,5-trifosfato (IP3) che agiscono da secondi messaggeri: l’IP3 interagisce con un recettore di membrana del R.E. inducendo il rilascio di Ca2+ nel citoplasma dove insieme al DAG e fosfatidil-serina attivano la protein-chinasi C (PKC) che catalizza la fosforilazione dei residui di serina e treonina attivando gli enzimi e i processi metabolici cellulari.
Subito dopo la formazione del secondo messaggero si ha l’idrolisi da GTP a GDP a livello della subunità α e il recettore ritorna in uno stato di riposo.
Tra gli ormoni che si legano al recettore accoppiato alla proteina GI abbiamo la somatostatina che agisce inibendo l’enzima adenilato-ciclasi attivando le funzioni cellulari senza produrre cAMP.
Le Patologie dei recettori accoppiati alle proteine G sono dovute a mutazioni missense o di senso con inattivazione o iperattivazione dei recettori.
L’inattivazione dei recettori determina l’insorgenza di sindromi da resistenza, come ad es.:
- diabete insipido nefrogenico da mutazione del gene per il recettore dell’ADH (V2, cr. X).
- ipercalcemia ipocalciurica familiare da mutazione inattivante il recettore del Ca2+ localizzato sulla membrana delle cellule paratiroidee che simula uno stato di iperparatiroidismo perchè la sintesi del PTH non viene inibita.
L’iperattivazione dei recettori determina l’insorgenza di sindromi da iperfunzione ghiandolare in presenza di valori ormonali normali o < nel plasma, come ad es.:
- ipertiroidismo familiare non autoimmune da mutazioni del recettore del TSH.
- pubertà precoce maschile di tipo familiare da mutazioni del recettore dell’LH.
Inoltre, possiamo avere mutazioni attivanti o inibenti le proteine G:
- mutazioni attivanti: sindrome di McCune-Albright, alcune neoplasie ovariche e surrenali.
- mutazioni inibenti: pseudoipoparatiroidismo di tipo I (patologia da resistenza al PTH).
I Recettori Citochinici comprendono i recettori per le citochine, come IL e IFN, per l'Eritropoietina (Epo), GH, PRL e Leptina. Sono costituiti solo da un dominio transmembrana che presenta il sito di legame per le proteine della famiglia JAK o Janus Kinasi, come la JAK2 nel caso dell'ormone GH che dopo fosforilazione attiva i fattori di trascrizione STAT che vengono fosforilati, si dissociano dal recettore e migrano nel nucleo dove si legano a segmenti del DNA specifici in modo da regolare la trascrizione dei geni bersaglio del GH, come l'IGF-1, che stimola la via di MAP kinasi, amplificando gli effetti del GH.
Tra le Patologie dei recettori citochinici abbiamo il nanismo di Laron dovuto ad una mutazione AR del recettore del GH e l’obesità grave da mutazione del recettore della leptina.
I Recettori Nucleari sono recettori specifici per gli ormoni liposolubili, localizzati sulla superficie della membrana nucleare rivolti verso il citoplasma o all’interno del nucleo, distinti in:
- recettori steroidei per i glucocorticoidi, mineralcorticoidi, androgeni e progesterone.
- recettori tiroidei per gli ormoni tiroidei, estrogeni, vit. D, acido retinoico...
I Recettori nucleari per gli ormoni steroidei sono costituiti da 3 domini:
- dominio N-terminale: presenta il sito di legame specifico per l’ormone, e rappresenta la regione di transattivazione che attiva la trascrizione genica.
- dominio centrale: presenta la sequenza aminoacidica che si lega al DNA (zinc finger region).
- dominio C-terminale: costituita dal dominio funzionale ricco di aminoacidi idrofobici che formano una specie di tasca che accoglie l’ormone, e 3 residui aa che interagiscono con le proteine da shock termico hsp (heat shock proteins, attivate alle alte T°C).
In assenza dell’ormone i recettori per gli ormoni steroidei sono rivolti verso il citoplasma, legati alle proteine hsp, come la hsp90 specifica dei glucocorticoidi, progesterone e androgeni, capace di prevenire il legame del recettore al DNA.
In seguito al legame dell'ormone si ha la dissociazione della proteina hsp che ritorna nel citoplasma, e l'ormone passa all'interno del nucleo dove si lega a sequenze specifiche del DNA dette elementi di risposta ormonale HRE (hormone responsive elements) che rappresentano gli elementi di regolazione della trascrizione da parte degli ormoni steroidei con produzione di mRNA specifici per la sintesi di proteine ed enzimi importanti per le funzioni cellulari.
I Recettori nucleari per gli ormoni tiroidei sono distinti in recettori α e β:
- il recettore α comprende l’isoforma α1, attiva, in grado di legare la T3, espressa nel SNC, muscolo scheletrico e grasso bruno, e l’isoforma α2 che è inattiva e non lega l’ormone.
- il recettore β comprende l’isoforma β1 espressa nel fegato, rene e SNC e l’isoforma β2 espressa solo nell’ipofisi dove regola la secrezione del TSH.
Questi recettori sono localizzati nel nucleo legati alla cromatina: il legame O-R attiva il recettore che interagisce con specifiche sequenze di DNA dette elementi responsivi all’ormone tiroideo TRE (thyroid hormone response element) situati nella regione regolatoria del gene, favorendo la trascrizione genica e la sintesi di proteine specifiche.
Le Patologie dei recettori nucleari sono dovute a mutazioni inattivanti con sindromi da resistenza ormonale, in cui il pz presenta un quadro clinico di deficit ormonale ma il laboratorio evidenzia un > dei livelli dell'ormone e delle tropine ipofisarie regolatorie, cioè ACTH, TSH, FSH, LH...., come in caso di:
- rachitismo di tipo II vitamina D-dipendente (AR) con lesioni ossee, iperparatiroidismo secondario e alopecia.
- sindrome da resistenza agli androgeni (X-linked) con quadro variabile dalla infertilità alla sindrome di femminilizzazione testicolare completa.
- sindromi da resistenza agli ormoni tiroidei (AD) con quadro variabile da un lieve deficit dell'attenzione fino al quadro di ipotiroidismo con compromissione della crescita.
- sindrome da resistenza ai mineralcorticoidi o pseudoipoaldosteronismo di tipo I con perdita di sale neonatale, disidratazione, ipotensione, iperpotassiemia, acidosi metabolica ipercloremica, nonostante la presenza di livelli elevati di aldosterone.
Raramente si ha una sindrome da mutazione attivante del recettore per i mineralcorticoidi con ipertensione arteriosa grave, ad insorgenza precoce, aggravata dalla gravidanza.
Meccanismi di Regolazione della Sintesi e Secrezione Ormonale - Ritmi Biologici
La Sintesi e Secrezione Ormonale sono regolati da meccanismi di Feedback, Retroregolazione o Controregolazione che si stabiliscono tra gli assi o sistemi neuroendocrini, cioè ipotalamo-ipofisi-surreni, ipotalamo-ipofisi-tiroide, ipotalamo-ipofisi-gonadi, consentendo di mantenere l’omeostasi cioè di mantenere i livelli degli ormoni circolanti entro il range di normalità e di garantire le funzioni biologiche delle cellule bersaglio.
Il feedback viene distinto in:
- feedback positivo, stimola la produzione ormonale:
- il TRH ipotalamico stimola la sintesi e secrezione del TSH ipofisario che a sua volta stimola la sintesi e secrezione degli ormoni tiroidei.
- il CRH ipotalamico stimola la sintesi e secrezione dell'ACTH ipofisario che a sua volta stimola la sintesi e secrezione dei corticosteroidi surrenalici.
- il GnRH ipotalamico stimola la sintesi e secrezione di FSH e LH a livello ipofisario che a loro volta stimolano la sintesi e secrezione degli ormoni sessuali a livello delle gonadi.
- feedback negativo, inibisce la produzione ormonale, cioè gli ormoni secreti dalle ghiandole periferiche inibiscono la secrezione degli ormoni ipofisari e degli ormoni ipofisiotropi ipotalamici.
Inoltre, si fa una distinzione tra:
- feedback lungo: si stabilisce tra ipotalamo e ghiandole periferiche.
- feedback corto: si stabilisce tra ormoni ipofisari e releasing hormones ipotalamici corrispondenti.
- feedback ultracorto: si stabilisce tra le cellule che producono l'ormone e quelle adiacenti con meccanismo autocrino e paracrino ed effetto inibitorio, come nel caso della PRL.
Inoltre, la secrezione ormonale dipende da altri fattori:
- livelli plasmatici di varie sostanze:
- livelli plasmatici di Ca2+ che si lega ai recettori per il Ca2+ espressi sulla membrana delle cellule paratiroidee inibendo la secrezione di PTH mediante un meccanismo di feedback –.
- l'insulina < i livelli plasmatici della glicemia che, a sua volta, inibisce la sintesi dell'insulina stessa, mantenendo l'omeostasi glucidica.
- regolazione a livello del SNC e SNP: gli impulsi nervosi regolano il rilascio degli ormoni ipotalamici e, di conseguenza, degli ormoni ipofisari e delle ghiandole periferiche.
- fattori di stimolazione esterni: la dieta può influenzare la secrezione di vari ormoni, come l’insulina in caso di ipo o iperglicemia, mentre l’esposizione al sole oltre a favorire la sintesi della vitamina D, favorisce anche la sintesi della melatonina a partire dalla serotonina a livello della ghiandola pineale, che regola il ritmo sonno-veglia ed ha una funzione anti-riproduttiva, dato che la melatonina blocca il GnRH e la secrezione di LH.
In condizioni fisiologiche la secrezione ormonale avviene rispettando i ritmi biologici cioè una specie di orologio interno che consente di mantenere l’omeostasi e all’organismo di adattarsi alle variazioni ambientali e di rispondere alle esigenze fisiologiche in maniera regolare.
I ritmi circadiani sono caratterizzati da un periodo che misura la frequenza delle variazioni dei livelli ormonali nell’intervallo di tempo tra 2 episodi identici, con distinzione tra:
- ritmi ultradiani: la secrezione avviene con una frequenza < 20 h come nel caso degli ormoni ipofisari che sono secreti in maniera episodica ad intervalli di 1-4 h.
- ritmi circadiani: la secrezione avviene con una frequenza di 20-28 h come nel caso dell’ACTH, cortisolo, PRL, TSH.
- ritmi infradiani: la secrezione avviene con una frequenza > 28 h, come nel caso delle gonadotropine FSH e LH durante il ciclo mestruale.
- ampiezza: è la differenza tra il valore ormonale massimo e minimo.
- acrofase o zenith: picco massimo della secrezione ormonale con valori plasmatici elevati.
- nadir: picco minimo della secrezione ormonale con valori plasmatici bassi.
Considerando che le endocrinopatie sono caratterizzate da variazioni del ritmo di secrezione ormonale, spesso per la diagnosi sono necessari prelievi seriati e la somministrazione dei farmaci deve avvenire rispettando il ritmo di secrezione fisiologica dell’ormone.
Integrazione del sistema endocrino con altri sistemi
Il sistema endocrino si integra dal punto di vista anatomo-funzionale con altri sistemi, in particolare con il sistema nervoso e immunitario.
In particolare, l’ipotalamo è costituito da cellule nervose ad attività endocrina capaci di produrre e secernere i cosiddetti ormoni ipofisiotropi, distinti in Releasing Hormones e Inhibiting Hormones, che attraverso il sistema portale ipofisario raggiungono l’adenoipofisi dove interagiscono con specifici recettori cellulari, stimolando o inibendo la sintesi e secrezione degli ormoni ipofisari che, a loro volta, attraverso la circolazione generale raggiungono le ghiandole bersaglio modulando la sintesi e secrezione degli ormoni periferici, costituendo 3 importanti sistemi o assi neuroendocrini, cioè Ipotalamo-Ipofisi-Surrene, Ipotalamo-Ipofisi-Tiroide e Ipotalamo-Ipofisi-Gonadi, da cui dipendono le attività di tutti gli organi e apparati, come lo sviluppo, crescita e funzioni sessuali-riproduttive, il metabolismo intermedio (proteine, carboidrati, lipidi), l’equilibrio idroelettrolitico (ADH, aldosterone), la funzione cardiovascolare e renale (sistema renina-angiotensinal, APN, catecolamine, ormoni tiroidei, ADH…), le funzioni cognitive e comportamentali (SNC) e la regolazione del sistema immunitario.
A tal proposito alcuni ormoni possono regolare il sistema immunitario, ad es. i glucocorticoidi hanno attività antiinfiammatoria e immunosoppressiva per cui sono usati per la terapia di vari processi infiammatori ed autoimmuni, gli estrogeni e androgeni hanno attività immunosoppressiva, mentre GH, PRL, TSH, ormoni tiroidei... stimolano la risposta immunitaria.
Tra le citochine immunitarie capaci di regolare gli assi neuroendocrini abbiamo:
- IL-1, 2 e 6: regolano l’asse IIS stimolando la secrezione di CRH da parte dell’ipotalamo che stimola la secrezione di ACTH a livello dell’adenoipofisi che stimola la secrezione di cortisolo corticosurrenale. L’IL-1 inibisce l’asse IIG cioè la secrezione di GnRH a livello dell’ipotalamo, inibendo la sintesi di FSH e LH a livello ipofisario e degli steroidi sessuali gonadici.
- TNFα: regola l’asse IIS < la risposta allo stimolo con CRH, GnRH, TRH, inibendo la secrezione di ACTH e cortisolo in risposta allo shock settico, e inibisce la sintesi di aldosterone bloccando l’angiotensina.
- IFNα e β: stimolano la steroidogenesi surrenale (asse IIS) e la captazione di iodio da parte dei tireociti favorendo la sintesi degli ormoni tiroidei e inibendo quella del TSH (asse IIT).
Ormoni e Oncogeni
Gli Oncogeni sono geni mutati capaci di trasformare una cellula normale in una tumorale, favorendo lo sviluppo delle neoplasie.
Il Protooncogene è un gene normale che controlla i meccanismi di crescita e differenziazione cellulare, tra cui abbiamo:
- protooncogeni che codificano per i fattori di crescita polipeptidici (c-sis).
- protooncogeni che codificano per i recettori per fattori di crescita (c-erb B, c-fos).
- protooncogeni che codificano per i recettori di membrana accoppiati alle proteine G (c-ras).
- protooncogeni che codificano per i recettori ormonali nucleari (c-erb A), come i recettori per gli ormoni steroidei e tiroidei.
- protooncogeni che codificano per i fattori di trascrizione nucleari (TF) (c-jun).
La trasformazione protooncogene-oncogene si deve all’azione di sostanze cancerogene chimiche (chemioterapici, idrocarburi), fisiche (radiazioni ionizzanti), virali, responsabili di anomalie cromosomiche o mutazioni geniche.
I geni mutati codificano per proteine anomale o onco-proteine che favoriscono la trasformazione delle cellule sane in cellule neoplastiche, che sfuggono ai meccanismi di controllo della crescita cellulare con iperproliferazione autonoma o espansione clonale delle cellule neoplastiche.
IPOTALAMO e IPOFISI
L’Ipotalamo è una struttura neuroendocrina cuneiforme situata nella parte più ventrale del diencefalo, costituita soprattutto da sostanza grigia, con Ø di 2,5 cm e peso di 4 gr, strettamente correlata con la ghiandola ipofisi sia dal punto di vista anatomico mediante il peduncolo ipofisario (ventralmente) sia dal punto di vista fisiologico attraverso gli ormoni ipofisiotropi.
La vascolarizzazione arteriosa dell’ipotalamo si deve a rami del poligono cerebrale di Willis, il drenaggio venoso si deve al sistema portale ipofisario e in parte a piccoli plessi venosi che confluiscono nella vena basale di Rosenthal.
Dai capillari portali originano le vene portali che attraverso il peduncolo ipotalamo-ipofisario giungono all’adenoipofisi dove formano una rete capillare a contatto con le cellule ipofisarie.
I neuroni ipotalamici sono organizzati in strutture dette nuclei ipotalamici formando il sistema ipotalamo-neuroipofisario e il sistema ipotalamo-tuberoinfundibulare:
Il sistema ipotalamo-neuroipofisario è costituito da:
- nucleo sopraottico e neuroni magnicellulari del nucleo paraventricolare (PVN) deputati alla sintesi di ossitocina e vasopressina (ADH).
Il sistema ipotalamo-tuberoinfundibulare è costituito dai neuroni ipofisiotropi cosiddetti perchè sintetizzano gli ormoni ipofisiotropi, cioè i Releasing hormones e Inhibiting hormones che regolano gli assi neuroendocrini, in particolare abbiamo:
- nucleo preottico: regola la frequenza cardiaca.
- nucleo periventricolare: produce la somatostatina.
- nucleo ventromediale (VNM): produce la somatostatina e comprende il centro della sazietà.
- nucleo arcuato, infundibolare: regola l’appetito, produce GHRH, GnRH, dopamina, somatostatina.
- neuroni parvicellulari del nucleo paraventricolare (PVN): producono TRH, CRH, ADH e VIP.
- nucleo soprachiasmatico: regola i ritmi biologici.
- nucleo dorsomediale: trasmette le informazioni dal nucleo VNM al nucleo PVN.
Inoltre, l’ipotalamo viene distinto in:
- ipotalamo anteriore: comprende il centro del freddo (T°C corporea) e il centro della sete.
- ipotalamo posteriore: comprende il centro del caldo (T°C corporea).
- ipotalamo laterale: comprende il centro della fame e della sete.
L’ipotalamo presenta una struttura specializzata detta Eminenza Mediana costituita da 3 zone:
- zona ependimale: forma il pavimento del terzo ventricolo.
- zona interna: in cui decorrono gli assoni amielinici del sistema ipotalamo-neuroipofisario.
- zona esterna: formata dalle fibre amieliniche del sistema ipotalamo-tuberoinfundibulare che trasportano e rilasciano gli ormoni ipofisiotropi nel sistema portale ipotalamo-ipofisario in modo da raggiungere l’adenoipofisi. L’eminenza mediana non è protetta dalla barriera emato-liquorale per cui le fibre amieliniche entrano direttamente in contatto con i capillari portali che sono fenestrati e permettono il passaggio di sostanze ad alto P.M. da un compartimento all’altro, ecco perchè il sistema ipotalamo-ipofisario risponde rapidamente a variazioni delle [ ] di ormoni circolanti e farmaci che non superano la barriera emato-liquorale.
Dal punto di vista Fisiologico l’ipotalamo riceve ed elabora sia gli stimoli provenienti dall’ambiente esterno sia quelli provenienti da vari organi e apparati, regolando funzioni endocrine e non endocrine.
Le Funzioni non endocrine controllate dall’ipotalamo sono:
- regolazione della T°C corporea a livello dei centri termoregolatori ipotalamici cioè il centro del freddo (ipotalamo anteriore) e il centro del caldo (ipotalamo posteriore) costituiti da neuroni che ricevono i segnali provenienti dai recettori cutanei termosensibili, consentendo di mantenere l’equilibrio tra produzione di calore (vasocostrizione) e dispersione di calore (vasodilatazione, sudorazione) con T°C corporea che si mantiene intorno ai 37°C.
- regolazione dell’appetito a livello del nucleo arcuato, VNM e PVN per azione di ormoni anoressigeni (leptina, insulina) che inibiscono l’introito di cibo, e ormoni oressigeni (ghrelina) che stimolano l’introito di cibo; in caso di lesioni ipotalamiche si può avere anoressia o obesità.
- regolazione del bilancio idroelettrolitico a livello di 2 centri dell’ipotalamo antero-laterale, deove sono localizzati gli osmocettori cioè recettori sensibili all’osmolarità plasmatica, cioè:
- centro antidiuretico: > il riassorbimento di H2O a livello renale favorendo la sintesi e il rilascio di vasopressina o ormone antidiuretico ADH da parte dei nuclei sopraottico e paraventricolare.
- centro della sete: controlla la sensazione della sete e l’impulso a bere.
- regolazione del ritmo sonno-veglia a livello della giunzione ipotalamo-mesencefalo.
- memoria (ipotalamo e sistema limbico).
- funzione cardiovascolare: il nucleo preottico interviene nella regolazione della frequenza cardiaca (bradicardia), mentre l’ipotalamo anteriore regola la P arteriosa (ipertensione).
- funzione gastrointestinale: i centri corticali, il sistema limbico e l’ipotalamo regolano la secrezione gastrica inviando segnali di tipo inibitori mediante il nervo vago.
- regolazione dei ritmi biologici nelle vie retino-ipotalamiche e nel nucleo soprachiasmatico.
Le Funzioni Endocrine sono regolate dagli ormoni ipofisiotropi, distinti in:
- Releasing Hormones Ipotalamici: GHRH, GnRH, TRH, CRH, PRH.
- Inhibiting Hormones Ipotalamici: somatostatina, dopamina (PIH), MSH-IF.
Gli ormoni ipofisiotropi insieme agli ormoni ipofisari regolano l’attività dei 3 assi neuroendocrini, cioè ipotalamo-ipofisi-tiroide, ipotalamo-ipofisi-surreni e ipotalamo-ipofisi-gonadi.
Il GHRH o ormone stimolante il rilascio dell'ormone della crescita (Growth Hormone Releasing Hormone) è un ormone polipeptidico sintetizzato dai neuroni del nucleo arcuato a partire dal precursore pre-proGHRH.
La secrezione del GHRH avviene in modo pulsatile durante le prime h del sonno, ha un’emivita plasmatica di ~ 50 min e agisce legandosi a recettori specifici delle cellule somatotrope dell’adenoipofisi favorendo la produzione di cAMP, stimolando la sintesi e secrezione dell'ormone della crescita GH.
Gli effetti del GHRH sono in parte inibiti dalla somatostatina.
La somministrazione di GHRH in soggetti normali determina un rapido rilascio di GH, entro pochi minuti, con picco massimo dopo 30 minuti che si mantiene per 60-120 minuti.
La Somatostatina (GHIH) (Growth Hormone Inhibiting Hormone) viene sintetizzata dai neuroni del nucleo periventricolare, arcuato e ventromediale ma è stata isolata anche nelle cellule D o δ delle insule pancreatiche, nella mucosa gastrointestinale e cellule C o parafollicolari della tiroide.
La sintesi avviene a partire dal precursore pre-prosomatostatina (116 aa) da cui per processazione della porzione C-terminale si ha la formazione della somatostatina 14 (SRIH-14) formata da 14 residui aa localizzata nell'ipotalamo, e la somatostatina 28 costituita da 28 residui aa corrispondenti all’estremità N-terminale, localizzata nella mucosa intestinale.
La secrezione della somatostatina viene stimolata dal glucosio, glucagone, aminoacidi, secretina, CCK, ipoinsulinemia, gastrina e succo acido gastrico, viene inibita dalla stessa somatostatina, iperinsulinemia, acetilcolina e bicarbonato HCO3–.
La somatostatina ha un’emivita plasmatica di ~ 2 min. perchè viene rapidamente inattivata da aminopeptidasi ed endopeptidasi, ed eliminata a livello renale.
Le Funzioni della somatostatina sono di tipo inibitorie (azione paracrina e endocrina):
- inibisce la secrezione di GH bloccando la produzione di cAMP nelle cellule somatotrope dell’adenoiposi, inibendo sia la secrezione basale di GH che dopo stimolazione con GHRH.
- inibisce la secrezione del TSH da parte delle cellule tireotrope dell'adenoipofisi.
- inibisce la secrezione di insulina, glucagone, gastrina, secretina e VIP.
- inibisce la secrezione di HCl– e pepsina a livello gastrico.
Il GnRH o ormone stimolante il rilascio delle gonadotropine (Gonadotropin Releasing Hormone) è un ormone polipeptidico sintetizzato dai neuroni del nucleo arcuato a partire dal precursore pro-GnRH.
La secrezione del GnRH avviene in maniera pulsatile con dismissione/h, ha un'emivita plasmatica di ~ 10 min., viene degradato da una endopeptidasi e carbossipeptidasi, metabolizzato a livello epatico ed escreto a livello renale.
Il GnRH agisce legandosi a specifici recettori di membrana delle cellule gonadotrope dell’adenoipofisi stimolando la secrezione delle gonadotropine LH e FSH.
E' stato dimostrato che se il GnRH stimola le cellule gonadotrope in modo continuo e non pulsatile, inizialmente si ha la secrezione delle gonadotropine, poi le cellule gonadotrope diventano refrattarie al GnRH e non secernono più le gonadotropine, perché si ha una down-regulation dei recettori con desensibilizzazione cellulare.
Il TRH o ormone stimolante il rilascio della tireotropina (Thyrotropin Releasing Hormone) è un ormone polipeptidico sintetizzato dai neuroni del nucleo paraventricolare a partire dal precursore pre-pro-TRH.
La secrezione del TRH dipende dai livelli in circolo degli ormoni tiroidei: se i livelli di T4 e T3 > si ha una < secrezione di TRH e TSH, se i livelli di T4 e T3 < si ha una > secrezione di TRH e TSH.
I v.n. del TRH sono di 25-100 pg/ml, ha una emivita plasmatica < 5 min. poichè viene metabolizzato rapidamente in una forma ciclica inattiva.
Il TRH agisce legandosi ad un recettore di membrana delle cellule tireotrope (G protein), dove attraverso un meccanismo di feedback + prima stimola la secrezione del TSH già immagazzinato nelle cellule tireotrope, poi stimola la sintesi e secrezione di nuove molecole di TSH.
Inoltre, favorisce la secrezione della PRL e inibisce la secrezione di GH durante il sonno.
Il CRH o ormone stimolante il rilascio della corticotropina (Corticotropin Releasing Hormone) è un ormone polipeptidico sintetizzato dai neuroni del nucleo paraventricolare a partire dal precursore pre-proCRH ma è stato isolato anche in altre aree cerebrali, dove agisce come neurotrasmettitore regolando la risposta allo stress, e nella placenta umana.
Il CRH ha un’emivita plasmatica di 60 min, agisce legandosi a specifici recettori di membrana delle cellule corticotrope dell’adenoipofisi stimolando la secrezione dell’ACTH e dei peptidi correlati, agendo in sinergia con l'ADH e l'angiotensina II, mentre l’ossitocina inibisce la secrezione di ACTH mediata dal CRH.
I livelli del CRH > in maniera significativa nelle fasi tardive della gravidanza e nel parto.
Gli Ormoni che stimolano il rilascio della Prolattina o PRH (Prolactin Releasing Hormone) sono il TRH e VIP che si legano ai recettori di membrana delle cellule lattotrope stimolando la secrezione della PRL.
La Dopamina o PIH (Prolactin Inhibiting Hormone) viene secreta dai neuroni del nucleo arcuato e agisce legandosi ai recettori dopaminergici D2 localizzati sulle cellule lattotrope, inducendo una < dell'AMPc intracellulare e inibendo la secrezione della PRL.
Per cui inibendo la secrezione di dopamina viene stimolata la secrezione di PRL.
Gli MSH-IF (MSH Inhibiting Factors) inibiscono la secrezione dell’ormone Melanocito-stimolante (MSH) tra cui abbiamo la dopamina e il tripeptide Pro-Leu-Gly amide dell’estremità N-terminale dell’ossitocina. L’MSH durante la vita fetale viene sintetizzato nel lobo intermedio dell’ipofisi, nell’età adulta viene secreto in piccole quantità insieme all’ACTH dalle cellule corticotrope.
L'ipotalamo produce anche neurotrasmettitori che modulano l'ipofisi e il SNC:
- amine bioattive: dopamina, serotonina, istamina, acetilcolina, GABA, adrenalina e noradrenalina.
- neuropeptidi: VIP, sostanza P, neurotensina, angiotensina, colecistochinina (CCK), peptide natriuretico atriale (ANP), endotelina, neuropeptide Y, oppioidi endogeni.
- il VIP stimola la secrezione di PRL a livello delle cellule lattotrope insieme al TRH.
- la CCK stimola direttamente la secrezione di ACTH.
- la sostanza P inibisce la secrezione di ACTH dopo stimolo con CRH.
- la neurotensina inibisce la secrezione di GH, PRL, TSH, ha effetti vasodilatatori e iperglicemizzanti, induce ipotermia.
- l'angiotensina stimola la secrezione di ADH.
- il neuropeptide Y agisce a livello ipotalamico stimolando l’assunzione di cibo (carboidrati) e modula la secrezione del GnRH.
Gli oppioidi endogeni sono la met-encefalina, leu-encefalina, dinorfina e proopiomelanocortina POMC, dotate di varie funzioni:
- inibiscono la liberazione di dopamina in condizioni di stress con > secrezione di PRL.
- < la secrezione di GnRH e gonadotropine FSH/LH e < la secrezione di ACTH.
- stimolano la secrezione di GH e TSH.
modulano la memoria, risposta allo stress, percezione del dolore, T°C corporea, appetito….
Ipofisi o Ghiandola Pituitaria
L’Ipofisi è una ghiandola impari e mediana, situata al centro della base cranica nella sella turcica dell'osso sfenoide che è una cavità compresa tra le piccole ali dell’osso sfenoide, delimitata anteriormente dai processi clinoidei anteriori, posteriormente dai processi clinoidei posteriori e lamina quadrilatera, inferiormente dal seno sfenoidale, mentre superiormente è separata dall’encefalo da un ripiegamento della dura madre che forma il diaframma della sella che impedisce alla membrana aracnoidea e al liquido cerebro-spinale di giungere a livello della sella turcica, e presenta un foro centrale attraverso cui passa il peduncolo ipotalamo-ipofisario che collega l’ipofisi alla regione infundibolo-tuberale dell’ipotalamo, mentre davanti al peduncolo c’è il chiasma ottico che poggia sul diaframma della sella.
L’ipofisi ha una forma ovale e dimensioni variabili in base al sesso ed età: alla nascita è di piccole dimensioni e pesa ~ 100 mg, > rapidamente di dimensioni nella prima infanzia e < nella senescenza; nelle donne le dimensioni e il peso raddoppiano durante la gravidanza e allattamento per iperproliferazione delle cellule lattotrope.
La ghiandoli ipofisi presenta una ricca vascolarizzazione dovuta alle arterie ipofisarie superiore, media e inferiore, rami dell’arteria carotide interna: le arterie ipofisarie superiori formano una rete capillare a livello dell’eminenza mediana dell’ipotalamo da cui originano le vene portali lunghe che drenano il peduncolo ipofisario e raggiungono l’adenoipofisi dove danno origine ad un secondo plesso capillare, costituendo il sistema portale ipotalamo-ipofisario che consente agli ormoni ipotalamici ipofisiotropi di raggiungere rapidamente l’adenoipofisi e di controllare le sue funzioni. Tra ipofisi e ipotalamo si realizza anche un flusso ematico retrogrado responsabile del feedback diretto tra ormoni ipofisari e centri di controllo neuroendocrino.
Il drenaggio venoso dell'adenoipofisi avviene attraverso il seno cavernoso nei seni petrosi superiore e inferiore, fino a raggiungere il bulbo della giugulare e la vena giugulare interna.
Il peduncolo ipofisario e la neuroipofisi sono irrorati da ramificazioni delle arterie ipofisarie medie e inferiori, mentre il drenaggio venoso si deve a vene che sboccano nei seni cavernosi e nella circolazione generale.
L’ipofisi è costituita da 2 lobi: il lobo anteriore o adenoipofisi e il lobo posteriore o neuroipofisi.
L’adenoipofisi rappresenta l’80% della ghiandola, origina dalla tasca di Rathke, un'evaginazione ectodermica dell'orofaringe che migra fino a raggiungere la neuroipofisi.
La neuroipofisi non è una ghiandola ma una struttura di origine neuronale derivante embriologicamente da una invaginazione dell'ipotalamo ventrale e del terzo ventricolo, costituita da assoni e terminazioni nervose di neuroni i cui corpi cellulari risiedono nei nuclei sopraottico e paraventricolare dell'ipotalamo e dei tessuti di sostegno.
Adenoipofisi e Ormoni Adenoipofisari
L’Adenoipofisi è costituita da 3 parti: la pars tuberalis che circonda il peduncolo ipofisario, la pars intermedia rudimentale nell’uomo e la pars distalis costituita da varie cellule ormono-secernenti:
- cellule somatotrope (50%, acidofile alla colorazione con ematossilina-eosina): secernono GH.
- cellule lattotrope (10-25%, acidofile): secernono PRL.
Gli ormoni GH e PRL sono detti ormoni somato-mammotropici.
- cellule corticotrope (10-15%, basofile): secernono ACTH e peptidi correlati, detti ormoni corticotropi.
- cellule gonadotrope (10-15%, basofile): secernono le gonadotropine LH e FSH.
- cellule tireotrope (< 10%, basofile): secernono TSH.
- cellule nulle: cellule cromofobe, cioè non si colorano con metodi convenzionali, deputate alla sintesi di neuropeptidi, neurotrasmettitori, fattori di crescita e citochine ad azione paracrina che regolano la funzione delle cellule ipofisarie adiacenti.
L’ACTH o Ormone Adrenocorticotropo è un ormone polipeptidico sintetizzato dalle cellule corticotrope dell’adenoipofisi a partire dal precursore pro-opiomelanocortina POMC, glicoproteina di 265 aa dalla cui idrolisi derivano l’ACTH e i peptidi correlati.
L’ACTH è polipeptide di 39 aa, dove il segmento 1-24 rappresenta la parte biologicamente attiva, mentre il segmento 25-39 conferisce le proprietà immunologiche.
La Secrezione dell’ACTH avviene in maniera episodica, pulsatile secondo un ritmo circadiano con picco di secrezione massima nelle prime h del mattino (5.00-8.00), pari a 9-52 pg/ml (2-11 pmol/l), seguito dalla progressiva < della secrezione con picco minimo intorno alla mezzanotte.
Il ritmo circadiano dell'ACTH è responsabile delle corrispondenti variazioni circadiane della secrezione di cortisolo a livello surrenale.
L’ACTH ha un’emivita plasmatica breve, pari a 7-12 min., al termine della quale viene degradata da enzimi sierici.
La secrezione circadiana dell'ACTH viene modulata da 2 ormoni, cioè il CRH e il cortisolo.
Il CRH stimola la secrezione di ACTH mediante un meccanismo di feedback +.
La secrezione di ACTH viene stimolata anche in risposta ai pasti e a stress psico-fisici e chimici, come il dolore, traumi, interventi chirurgici, infezioni acute, ipoglicemia acuta, ipossia, esposizione al freddo, depressione, vasopressina con ipersecrezione di ACTH e cortisolo.
L'> dei livelli di ACTH durante lo stress è mediato dalla vasopressina e CRH.
Il cortisolo e la somministrazione di glucocorticoidi agiscono mediante un meccanismo di feedback -, lento o rapido sulla secrezione di ACTH:
- feedback lento o ritardato: l’azione continua del cortisolo o la somministrazione prolungata di glucocorticoidi possono sopprimere la secrezione di CRH e ACTH, con conseguente atrofia della zona fascicolata e reticolare del surrene dovuto al deficit di ACTH. La soppressione dell’asse ipotalamo-ipofisi-surrene non è in grado di rispondere allo stress.
- feedback rapido: in caso di brusco > della cortisolemia, l’ACTH inibisce la secrezione ipotalamica di CRH, ma l’effetto si instaura ed esaurisce in ~ 10 min.
Inoltre, l'ACTH può inibire la sua stessa secrezione mediante un feedback ‒ ad ansa corta.
Le Funzioni dell’ACTH si esplicano soprattutto a livello corticosurrenale dove si lega ad un recettore di membrana accoppiato alla proteina G, attivando l’adenilato-ciclasi con produzione di AMPc, secondo messaggero che traduce le funzioni dell’ACTH, cioè:
- stimola la secrezione di glucocorticoidi (cortisolo) e androgeni da parte della corticale del surrene.
- stimola la sintesi proteica con iperplasia e ipertrofia dei corticosurreni.
Inoltre, in caso di ipersecrezione di ACTH si osserva iperpigmentazione cutanea e mucosa.
I Peptidi correlati all’ACTH sono:
- ormone melanocistostimolante α-MSH: stimola i melanociti.
- frammento N-terminale della POMC (1-131): agisce come fattore di crescita surrenale, potenziando l’azione dell’ACTH.
- frammento C-terminale della POMC: dà origine alla β-Lipotropina (β-LPH) che viene secreta nella stessa quantità dell’ACTH ma ha un’emivita > pari a 20-24 min perchè non viene degradata dagli enzimi sierici, e dà origine alla met-encefalina e β-endorfina da cui originano l'α e γ-endorfina.
NB: TSH o ormone tireostimolante → vedi Tiroide
Il GH o Ormone della Crescita (Growth Hormone, somatotropina) è un polipeptide (191 a.a.) sintetizzato e secreto dalle cellule somatotrope a partire dal precursore pre-GH.
La Secrezione del GH avviene in maniera episodica, pulsatile ogni 3-4 h con un ritmo circadiano correlato al ritmo sonno-veglia e all'età con picchi di secrezione massima 1-4 ore dopo l'inizio del sonno, cioè negli stadi 3 e 4 (non-REM), che sono responsabili di quasi il 70% della secrezione giornaliera di GH, sono più elevati nei bambini e tendono a ridursi col passare dell'età.
In condizioni normali il GH non è dosabile nell’intervallo tra i picchi, mentre in caso di acromegalia il GH è sempre dosabile. I v.n. del GH sono pari a 1-5 ng/ml.
Il GH circola nel plasma in parte libero, in parte legato a proteine di trasporto dette GHBP, ha un’emivita di 20-25 min. e viene metabolizzato a livello epatico e renale.
La secrezione del GH viene regolata da 2 ormoni ipotalamici:
- GHRH: stimola la secrezione del GH.
- somatostatina: inibisce la secrezione del GH.
Per cui il picco di secrezione è preceduto dalla < somatostatina e > GHRH.
La secrezione di GH può essere stimolata da:
- fattori fisiologici: sonno, stress psico-fisico, ipoglicemia post-prandiale.
- fattori patologici: digiuno prolungato e carenza di proteine con malnutrizione cronica, iperaminoacidemia da pasto proteico o somministrazione e.v. di aminoacidi (arginina), anoressia nervosa, produzione ectopica di GHRH, insufficienza renale cronica, acromegalia (TRH, GnRH).
- farmaci: insulina o 2-desossiglucosio con ipoglicemia assoluta, glucagone con ipoglicemia relativa, ormoni come GHRH, ACTH, α-MSH, ADH, estrogeni, neurotrasmettitori, agonisti α-adrenergici come la clonidina, agonisti dopaminergici come la bromocriptina, antagonisti β-adrenergici come il propranololo, precursori della serotonina, agonisti dei GABA (muscimol), infusione di potassio, pirogeni (endotossina dello Pseudomonas).
Invece, la secrezione di GH può essere inibita da:
- fattori fisiologici: iperglicemia post-prandiale, elevata [ ] di acidi grassi liberi (FFA), bambini con grave carenza affettiva.
- fattori patologici: obesità, acromegalia (agonisti della dopamina), ipotiroidismo, ipertiroidismo.
- farmaci: ormoni come la somatostatina, GH, progesterone, glucocorticoidi, agonisti β-adrenergici come l’isoproterenolo, antagonisti α-adrenergici come la fentolamina, antagonisti della serotonina come il metisergide, antagonisti della dopamina come le fenotiazine.
La Funzione del GH più importante è quella di favorire la crescita lineare, regolando il metabolismo proteico, lipidico e glucidico e il bilancio idroelettrolitico, anche se la maggior parte delle funzioni del GH sono mediate dall'IGF-1 o fattore di crescita insulino-simile-1 o somatomedina C (Insulin Like Growth Factor 1) che viene sintetizzato dalle cellule epatiche stimolate dal GH stesso:
- il GH stimola la sintesi proteica favorendo la captazione degli aminoacidi e accelerando direttamente la trascrizione-traduzione dell’mRNA.
- il GH inibisce il catabolismo proteico e induce la liberazione di acidi grassi dal tessuto adiposo favorendo la loro conversione in acetil-CoA che viene usato come fonte di energia.
Grazie al risparmio delle proteine il GH promuove la crescita lineare e lo sviluppo con > del n° e dimensioni delle cellule dei muscoli scheletrici, > della massa e forza muscolare, influenzando le dimensioni degli organi interni (reni) e > la massa dei globuli rossi.
Inoltre, il GH agisce a livello del nucleo epifisario delle ossa lunghe favorendo la loro crescita favorisce, mentre l’IGF-1 stimola l’iperplasia e ipertrofia delle cellule cartilaginee con > della deposizione di tessuto osseo e allungamento osseo e > generale dell’altezza.
- il GH regola il metabolismo dei carboidrati, infatti stimola la secrezione di insulina, aumentando la captazione e utilizzazione di glucosio a livello dei tessuti periferici con effetto ipoglicemizzante (effetto insulino-simile immediato) ma dopo 3-4 h il GH < la captazione di glucosio e la glicolisi con conseguente iperglicemia che a sua volta stimola la secrezione di insulina (effetto diabetogeno ritardato). Tutto ciò determina una insulino-resistenza GH-dipendente con intolleranza al glucosio e iperinsulinismo secondario, come nel caso del diabete insulino-resistente nei soggetti con acromegalia da ipersecrezione di GH o nei soggetti che usano in maniera impropria il GH, come gli atleti per potenziare la massa muscolare (doping).
Invece, in caso di deficit di GH si ha ipoglicemia a digiuno che migliora dopo terapia con GH.
- equilibrio idroelettrolitico: il GH > il flusso plasmatico renale e la filtrazione glomerulare, stimola il riassorbimento dei fosfati, < l’escrezione urinaria di Na+ e K+ determinando ritenzione idrica, stimola l’escrezione urinaria di Ca2+ favorendo l’idrossilazione del 25(OH)2D a 1,25(OH)2D, inducendo indirettamente l’assorbimento intestinale di Ca2+.
Le Gonadotropine ipofisarie sono l’Ormone Follicolo-stimolante FSH e Luteinizzante LH cioè ormoni glicoproteici secreti dalle cellule gonadotrope dell’adenoipofisi costituite da una subunità α di 92 aa, identica per tutti gli ormoni glicoproteici (TSH, hCG) e una subunità β di 111 aa per FSH e 121 aa per LH da cui dipende la specifica attività biologica e immunologica.
La Secrezione delle gonadotropine FSH e LH negli uomini e nelle donne è episodica con ritmo ultradiano, pulsatile con picchi secretori che si verificano ogni h.
La secrezione basale di LH e FSH viene regolata dalla liberazione pulsatile, oraria del GnRH.
L’ormone LH ha un’emivita di 50 min, mentre l’FSH ha un’emivita di 3-4 h dovuta al maggior contenuto di acido sialico nella catena oligosaccaridica che li protegge dalla degradazione da parte delle asialoglicoproteine.
I livelli normali di LH e FSH variano a seconda dell'età e sesso:
- nel periodo prepuberale i livelli di LH e FSH sono bassi, mentre nelle fasi iniziali della pubertà la secrezione pulsatile del GnRH determina un > notturno di LH nei ragazzi e una secrezione ciclica di FSH e LH nelle ragazze regolando il ciclo mestruale per tutto il periodo fertile.
- nelle donne in menopausa i livelli di LH e FSH sono elevati fino a provocare atrofia ovarica.
Dal punto di vista Fisiologico l'LH e FSH si legano ai recettori ovarici e testicolari, regolando la funzione gonadica, promuovendo la produzione di steroidi sessuali e la gametogenesi.
Negli uomini l'LH stimola la produzione di testosterone da parte delle cellule interstiziali del testicolo o cellule di Leydig, mentre l’FSH stimola la crescita testicolare e agisce a livello dei tubuli seminiferi dove induce la sintesi da parte delle cellule di Sertoli di una proteina legante gli androgeni che consente di mantenere elevati livelli di testosterone nel tubulo seminifero in modo da stimolare la spermatogenesi.
Nelle donne l’FSH e LH regolano le fasi del ciclo mestruale.
La Fase Follicolare (preovulatoria) viene stimolata dall’ormone follicolo-stimolante FSH responsabile della maturazione del follicolo primordiale in follicolo maturo di Graaf e increzione di estrogeni a livello del follicolo ovarico dominante (Estradiolo E2), per cui la fase follicolare è detta estrogenica perchè è caratterizzata da una iperproduzione di estradiolo che > rapidamente dall’8° giorno del ciclo e raggiunge il picco prima dell’ovulazione al 12°-13° giorno.
La produzione degli estrogeni è stimolata sia dall’FSH che agisce su recettori specifici presenti sulla superficie delle cellule della granulosa favorendo una maggiore produzione di liquido follicolare che è ricco di estrogeni, sia dall’LH che agisce su recettori specifici presenti sulla superficie delle cellule della teca interna stimolando la produzione di androgeni che per intervento dell’enzima aromatasi sono convertiti in estrogeni.
L’estradiolo e l’inibina mediante un meccanismo feedback ─ inibiscono l’increzione ipofisaria dell’FSH in modo che solo il follicolo dominante vada incontro a completa maturazione, mentre gli altri follicoli vanno incontro ad atresia non essendo stimolati dall’FSH.
Raggiunto il picco estrogenico, l’estradiolo mediante un meccanismo di feedback + stimola la produzione ipotalamica del GnRH che a sua volta stimola l’increzione dell’LH che favorisce la maturazione dell’ovocita in ovocita secondario.
Al 14° giorno del ciclo si ha l’Ovulazione con intervento del progesterone che favorisce la produzione di enzimi proteolitici responsabili della rottura del follicolo dominante, liberazione dell’uovo e migrazione nell’ampolla della tuba uterina in attesa di una eventuale fecondazione.
La Fase Luteinica (postovulatoria) viene stimolata dall’ormone luteinizzante LH che favorisce la trasformazione del follicolo in corpo luteo che stimolato dall’LH produce il progesterone indispensabile per preparare l’endometrio all’annidamento dell’embrione: i livelli del progesterone raggiungono il picco dopo 7-10 gg dall’ovulazione, intorno al 21°-24° giorno del ciclo mestruale e con un meccanismo feedback ─ inibisce la produzione di GnRH da parte dell’ipotalamo e la secrezione di LH da parte dell’ipofisi.
Se l’uovo non viene fecondato si ha la fase di luteolisi con degenerazione del corpo luteo e sfaldamento della mucosa endometriale con flusso mestruale.
Se l’uovo viene fecondato si ha la secrezione della gonadotropina corionica umana HCG che favorisce la formazione del corpo luteo gravidico.
La Prolattina PRL è un polipeptide (198 a.a.) sintetizzato e secreto dalle cellule lattotrope dell’adenoipofisi a partire dal precursore pre-PRL.
La Secrezione della PRL avviene in maniera episodica, pulsatile con picco di massima secrezione 60-90 min. dopo l’inizio del sonno che si mantiene elevato per ~ 2 h, correlata al sonno, cioè la secrezione avviene quando il soggetto dorme, anche nelle h pomeridiane.
I v.n. della PRL o prolattinemia sono pari a 3-15 ng/ml nei maschi e 4-20 ng/ml nelle donne; ha un'emivita di ~ 50 min, il 75% della PRL viene eliminata per via epatica e il 25% per via renale.
La secrezione della PRL può essere stimolata dal TRH e dal VIP, anche se in realtà dipende soprattutto dal tono inibitorio esercitato dalla dopamina che si lega ai recettori dopaminergici D2 delle cellule lattotrope, < la formazione di cAMP e inibendo la sintesi e secrezione della PRL.
Inoltre, la secrezione della PRL può essere stimolata da stress psico-fisico o stress operatorio, ipoglicemia, gravidanza e allattamento al seno o tutte le volte che si stimolano i capezzoli, oppure patologie dell’ipotalamo con deficit della secrezione di dopamina.
La secrezione della PRL può essere inibita dalla distruzione o asportazione chirurgica dell'ipofisi, ipofisite linfocitica, lesioni del midollo spinale o denervazione del capezzolo con deficit del riflesso neurogeno…
Le Funzioni della PRL sono di:
- stimolare lo sviluppo della ghiandola mammaria durante la gravidanza insieme a estrogeni, ormone lattogeno placentare hPL, insulina e cortisolo, preparandola alla lattazione.
- stimolare la lattazione nel puerperio, infatti durante la gravidanza gli estrogeni inibiscono l'effetto della PRL sulla lattazione, mentre nel post-partum si ha la caduta dei livelli plasmatici di estrogeni e progesterone con secrezione di PRL e produzione del latte, ecco perchè sospendendo l'assunzione di contraccettivi orali o estrogeni si ha la comparsa di galattorrea.
Nel post-partum la suzione del capezzolo attiva un riflesso nervoso che induce la secrezione di ossitocina e PRL, mantenendo la lattazione.
- la PRL regola il bilancio idroelettrolitico attraverso la ritenzione di Na+, K+ e H2O a livello renale, potenziando gli effetti dell’aldosterone e ADH.
- la PRL agisce da immunomodulatore, stimolando la proliferazione e sopravvivenza delle cellule immunitarie; la secrezione della PRL può avvenire in sede extra-ipofisaria, cioè nei linfociti T, e sono stati identificati recettori per la PRL sui linfociti T, B e macrofagi.
Neuroipofisi e Ormoni Neuroipofisari
Dal punto di vista Fisiologico la neuroipofisi secerne 2 ormoni, cioè la Vasopressina o Ormone Antidiuretico ADH (adiuretina, arginin-vasopressina AVP) e l’Ossitocina cioè ormoni peptidici che sono sintetizzati a livello dei nuclei sopraottico e paraventricolare dell’ipotalamo.
La Sintesi della Vasopressina avviene a partire dal precursore pre-proADH formato da un’estremità N-terminale costituita dalla sequenza dell’ADH e del peptide segnale, e da un’estremità C-terminale costituita da una glicoproteina; tra le 2 estremità c’è la sequenza della neurofisina 2.
La Sintesi dell’Ossitocina avviene da un precursore simile che differisce per l’assenza della glicoproteina a livello dell’estremina C-terminale.
Dopo la sintesi, l’ADH e ossitocina sono depositati in granuli secretori dove si legano alla neurofisina, cioè una proteina di trasporto distinta in neurofisina di tipo 1 che trasporta l’ossitocina e neurofisina di tipo 2 che trasporta l’ADH: si tratta di un legame non covalente, stabile a pH acido (5.2-5.8).
I granuli secretori vengono trasportati dall’ipotalamo alla neuroipofisi attraverso il flusso assonico lungo gli assoni neurosecretori.
La Secrezione dell’ADH e ossitocina da parte della neuroipofisi avviene per esocitosi (Ca2+-dipendente) nei vasi capillari dove a pH ematico basico (7.4) si ha la scissione del legame ormone-neurofisina, per cui la vasopressina e ossitocina circolano nel sangue in forma libera.
L’ADH viene secreta in maniera pulsatile con picco tra la mezzanotte e le 4.00 del mattino.
L’ossitocina e ADH hanno un’emivita plasmatica di ~ 10 min, vengono metabolizzate a livello epatico ed eliminate per via renale.
La secrezione dell’ossitocina viene stimolata dalla suzione del capezzolo e attivazione dei recettori presenti nel miometrio della cervice uterina al momento del parto.
Le Funzioni dell’ossitocina sono rilevanti al momento del parto e post-partum:
- al momento del parto gli estrogeni e ossitocina stimolano le contrazioni della muscolatura uterina (miometrio) con dilatazione del canale del parto, favorendo la discesa del feto.
- se il neonato viene allattato al seno materno, la suzione del capezzolo attiva il riflesso neuroormonale che stimola la secrezione di PRL e ossitocina; la PRL stimola la secrezione del latte nei dotti mammari, mentre l’ossitocina stimola la contrazione dei dotti mammari con espulsione del latte e stimola la secrezione di PRL.
La secrezione dell’ADH viene regolata dall’Osmolalità plasmatica (OSM P) che corrisponde alla P osmotica del plasma che per il 95% dipende dall’attività osmotica del Na+ sotto forma di NaCl e NaHCO3– (bicarbonato di Na+), in parte al glucosio e urea, consentendo di fare una distinzione tra soluzioni isotoniche, ipotoniche e ipertoniche caratterizzate da una P osmotica =, < o > a quella del plasma, per cui l’infusione di soluzioni saline isotoniche stimola la secrezione di ADH, le soluzione ipertoniche di glucosio o urea provocano una lieve secrezione di ADH.
In caso di variazioni minime dell’OSM P pari all’1% la [ ] di ADH subisce una modifica pari a ~ 1 pg/ml con alterazione della diuresi e osmolarità urinaria (OSM U).
In pratica, in caso di variazioni dell’OSM P si ha l’attivazione di cellule nervose specializzate dette osmocettori situate nell’ipotalamo anteriore: l’iperosmolalità plasmatica (> OSM P) stimola la secrezione di ADH, mentre l’ipoosmolalità plasmatica (< OSM P) inibisce la secrezione di ADH con livelli di ADH soppressi o indosabili.
Inoltre, la secrezione di ADH può essere stimolata dall’ipovolemia, ipotensione arteriosa, nausea e vomito, ipoglicemia acuta, ipotiroidismo, angiotensina II, adrenalina, cortisolo, istamina, nicotina, antidepressivi, stress, ipossia acuta, ipercapnia, mentre la secrezione di ADH viene inibita dall’ipervolemia, ipertensione, alcol, stimolazione α-adrenergica, oppioidi.
Le variazioni della Pressione arteriosa e della Volemia (volume ematico) alterano la secrezione dell’ADH tramite i barocettori o pressocettori localizzati nel cuore e grosse arterie, che inviano gli impulsi tramite il nervo vago e glossofaringeo al nucleo del tratto solitario, e tramite fibre postsinaptiche ai nuclei sopraottico e paraventricolare.
Le variazioni minime della P arteriosa e volemia non influenzano la secrezione di ADH, mentre variazioni ≥ al 10% alterano la secrezione di ADH senza alterare la regolazione osmotica:
- in caso di ipotensione arteriosa e ipovolemia si ha una spiccata secrezione di ADH e un lieve > dell’OSM P, esercitando azione antidiuretica e vasocostrittrice per ripristinare la P arteriosa.
- in caso di ipertensione arteriosa e ipervolemia viene inibita la secrezione di ADH.
L’ADH agisce in sedi diverse interagendo con recettori specifici, cioè:
- recettori V1: localizzati a livello della muscolatura liscia dei vasi dove determinano vasocostrizione con > delle resistenze vascolari periferiche e ipertensione arteriosa, che rappresenta un meccanismo di compenso in caso shock ipovolemico (emorragia); inoltre i recettori V1 sono presenti a livello intestinale dove stimolano la contrazione della muscolatura liscia.
- recettori V2: localizzati sulla superficie delle cellule epiteliali del tubulo contorto distale e dotto collettore del rene, attraverso i quali esercita la sua azione antidiuretica, regolando il riassorbimento di H2O.
- recettori V3: localizzati sulla superficie delle cellule corticotrope dell’adenoipofisi, stimolano la secrezione di ACTH, agendo in sinergia al CRH.
La Funzione principale dell’ADH è quella antidiuretica: si lega ai recettori V2 (G-protein) favorendo l’attivazione dell’enzima adenilato-ciclasi con produzione di AMPc che favorisce la migrazione della proteina Acquoporina 2 (AQP-2) dal citoplasma verso la zona apicale della membrana plasmatica, dove l’AQP-2 funge da canale di passaggio dell’H2O dal lume dei dotti all’interstizio ipertonico delle piramidi renali, regolando il bilancio idrico dell’organismo grazie al riassorbimento di H2O a livello del tubulo contorto distale e dotto collettore del rene, fino a 15-20 lt/die, con contrazione della diuresi, eliminazione di urine molto concentrate (midollare ipertonica, urina ipotonica), consentendo di mantenere costante l’OSM P tra 275-295 mOsm/Kg di H2O e il volume dei liquidi intra ed extracellulari specie in condizioni di disidratazione.
Autore: non indicato nel documento di origine del testo
Fonte: http://laprimapietra.altervista.org/alterpages/files/1-IlSistemaEndocrinoOrmoniIpotalamoeIpofisi.docx
Sistema endocrino
Visita la nostra pagina principale
Sistema endocrino
Termini d' uso e privacy