Legami chimici
Legami chimici
I riassunti, le citazioni e i testi contenuti in questa pagina sono utilizzati per sole finalità illustrative didattiche e scientifiche e vengono forniti gratuitamente agli utenti.
LEGAMI CHIMICI
L’insieme delle forze che tengono uniti due o più atomi fra loro in un assetto stabile di minore energia. Questa configurazione è composta da 8 elettroni ed è indicata anche con il termine di ottetto. I legami si distinguono in deboli e forti: i deboli sono i legami ad idrogeno (2-7 kcal/mol) e le forze di Van der Waals (1-4 kcal/mol), mentre i forti hanno energia compresa tra 50 e 250 kcal/mol.
Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi.
Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli (C-C, H-H, ecc).
Gli atomi formano legami chimici per raggiungere una configurazione elettronica più stabile, generalmente la configurazione elettronica del gas nobile più vicino, quindi l’ottetto. I gas nobili, che già hanno raggiunto l’ottetto, non formano legami chimici.
Nelle molecole costituite da due atomi (molecole biatomiche) come, per esempio, la molecola dell’idrogeno H2, un solo legame è sufficiente a tenere insieme i due atomi.

LEGAME CHIMICO ED ENERGIA
Quando formiamo legami chimici, gli atomi raggiungono una situazione di maggiore stabilità . Questo significa che l’energia totale del sistema costituito dai due atomi legati insieme (a) è minore dell’energia totale del sistema costituito dai due atomi separati (b). Quindi, quando si forma un legame chimico si libera una certa quantità di energia, mentre se si vuole rompere un legame un legame chimico è necessario spendere una certa quantità di energia. È detta energia di legame la quantità di energia necessaria per rompere una mole di legami del tipo considerato. Tale energia è misurata in KJ. mol-1.

Legami forti o legami interatomici
I legami forti si instaurano tra atomi oppure tra ioni per formare le molecole. Sono tutti dovuti a interazioni di natura elettrostatica e si distinguono in vari tipi secondo la natura dell’interazione.
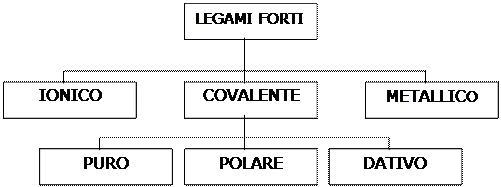
Regola dell’ottetto e legami chimici
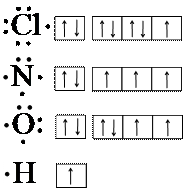
Nel 1916 G.N. Lewis propose di rappresentare gli atomi così: il simbolo di ciascun elemento circondato da un numero di puntini uguale al numero di elettroni nello strato più esterno. Tale rappresentazione degli elementi è chiamata struttura di Lewis o struttura a puntini. La tabella seguente elenca i primi 18 elementi della tavola periodica secondo lo schema suggerito da Lewis.
I membri del gruppo I (H, Li, Na, K, Rb, Cs) hanno un solo puntino e quindi un solo elettrone più esterno, denominato elettrone di valenza. I membri del gruppo II (Be, Mg, Ca, Sr, Ba) hanno due elettroni di valenza e due puntini e così via, sino al gruppo VIII. I sei elementi di quest’ultimo gruppo, elio He, neon Ne, argo Ar, cripto Kr, xeno Xe e radon Rn, sono chiamati gas nobili, a causa della loro grande inerzia chimica ossia resistenza alle reazioni chimiche. Soltanto i gas nobili posseggono strati esterni con otto elettroni (8 puntini) e quindi gli altri elementi tendono a raggiungere la configurazione più esterna con 8 elettroni.
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
H· |
|
|
|
|
|
||
Li· |
|||||||
Na· |
Facciamo degli esempi, per comprendere la regola dell’ottetto. Il cloro Cl del gruppo VII ha sette elettroni esterni, perciò, nelle reazioni con altri elementi, cercherà di acquistare 1 elettrone ed avere la stessa struttura elettronica con 8 puntini del vicino argo. Avendo acquistato 1 elettrone diventerà uno ione negativo Cl- che si chiama ione cloruro ed è differente dal cloro elemento. Analogamente agiscono, acquistando elettroni, gli altri elementi con 7, con 6 e con 5 elettroni più esterni (gruppi VII, VI, V). Gli atomi con pochi elettroni esterni (con 1, con 2 e con 3 elettroni) avranno un comportamento opposto. Per questi elementi (gruppi I, II, III) è più facile perdere elettroni e trasformarsi in ioni positivi. Per esempio, il magnesio ha 2 elettroni esterni (2 puntini) e cercherà di perdere questi elettroni, durante le reazioni chimiche, per mutarsi in ione Mg2+, più stabile di Mg e con struttura elettronica simile al gas nobile neon Ne, che lo precede. Volendo estendere la regola a tutti gli altri elementi si può dire quanto segue. Tutti gli elementi raggiungono le strutture elettroniche tipiche dei gas nobili in tre distinte maniere: cedendo, acquistando e mettendo in comune gli elettroni più esterni, denominati elettroni di valenza. I principali legami chimici fra gli atomi, legame ionico, legame covalente e legame metallico nascono in seguito alle tre operazioni di cessione, acquisto e scambio di elettroni.
Comunque, tutti i legami chimici che si stabiliscono fra gli atomi sono dovuti a forze di attrazione di natura elettrostatica
Elettronegatività e legami
L’elettronegatività è una misura della tendenza di ciascun atomo ad attirare gli elettroni coinvolti in un legame. Secondo la scala di elettronegatività di Pauling, essa è espressa da un numero adimensionale il cui valore più alto è 4. Questo valore corrisponde al fluoro che è l’elemento più elettronegativo. In generale l’elettronegatività aumenta da sinistra a destra lungo i periodi della tavola periodica, e si riduce lungo i gruppi dall’alto verso il basso.
La differenza di elettronegatività, tra gli atomi coinvolti in un legame è indicata con il simbolo D e consente di prevedere, con buona approssimazione, il tipo di legame che si forma:
Se D < 0,4 il legame è covalente puro o quasi puro
Se 0,4 < D < 1,9 il legame è covalente polare
Se D > 1,9 il legame è ionico
LEGAME IONICO
 : è una forza di natura elettrostatica che si stabilisce tra due ioni di carica opposta e si forma a seguito di un trasferimento reale di elettroni da un atomo all’altro. Non si può mai formare tra atomi dello stesso tipo.
: è una forza di natura elettrostatica che si stabilisce tra due ioni di carica opposta e si forma a seguito di un trasferimento reale di elettroni da un atomo all’altro. Non si può mai formare tra atomi dello stesso tipo.
Il legame ionico consiste nel trasferimento di elettroni da elementi che perdono facilmente elettroni (metalli) ad elementi in grado di acquistarli (non metalli).
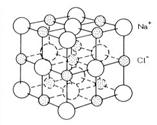
RETICOLO CRISTALLO NaCl
struttura del neon struttura dell’argo

Nei composti contenenti legami ionici non esistono molecole isolate ma reticoli cristallini formati da ioni positivi e negativi.
Un legame ionico si forma fra atomi che hanno una forte differenza di elettronegatività cioè la cui differenza dei valori di elettronegatività è superiore a 1,7.
Quando due atomi si avvicinano (un metallo e un atomo di un elemento degli ultimi gruppi), gli elettroni del livello più esterno dell’atomo meno elettronegativo (metallo con pochi elettroni di valenza) passano all’atomo più elettronegativo (non metallo con tanti elettroni di valenza). Quest’ultimo diviene quindi uno ione negativo, mentre l’altro atomo diviene uno ione positivo (uno ione è un atomo, dotato di carica elettrica). Fra i due ioni con cariche elettriche opposte si stabilisce un’attrazione di tipo elettrostatico che li tiene uniti: quest’attrazione costituisce il legame. I composti contenenti legami ionici sono chiamati composti ionici (NaCl, MgCl2, ecc).
Un esempio di composto ionico è il cloruro di sodio (NaCl). Il sodio (Na) appartiene al I gruppo e, quindi, ha un solo elettrone (e-) esterno; la sua elettronegatività è 0.93, un valore basso. Il cloro (Cl) appartiene al VII gruppo e ha, perciò, sette elettroni esterni; la sua elettronegatività è 3.16, un valore alto.
La differenza di elettronegatività (3.16 – 0.93 = 2.23) fra i due elementi supera il valore standard di 1.7, quindi fra i loro atomi si forma un legame ionico e l’elettrone dell’atomo di sodio passa a quello di cloro.
Formazione del legame ionico nel cloruro di sodio (NaCl)
1 – L’atomo di sodio perde il suo elettrone esterno e diventa uno ione positivo.
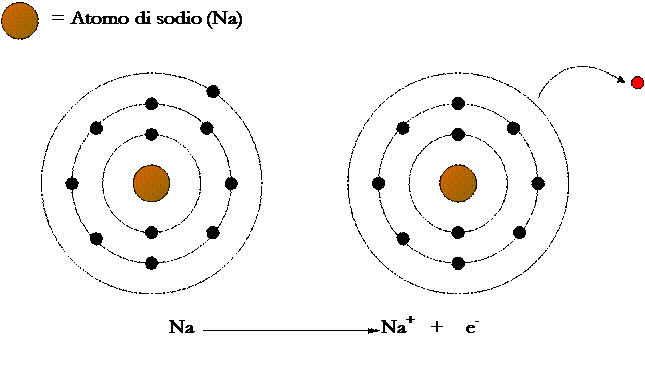
2 – L’atomo di cloro acquista l’elettrone perduto dal cloro e diventa ione negativo.
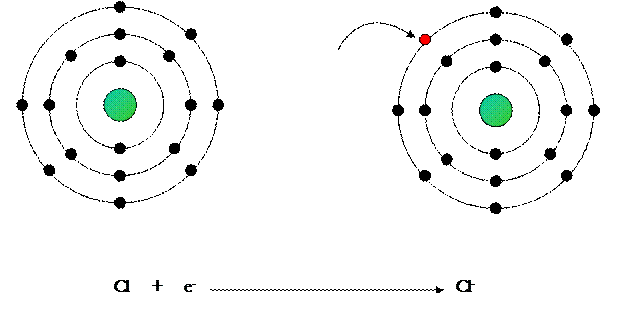
3 – I due ioni, avendo cariche elettriche di segno opposto, si attirano e restano uniti.
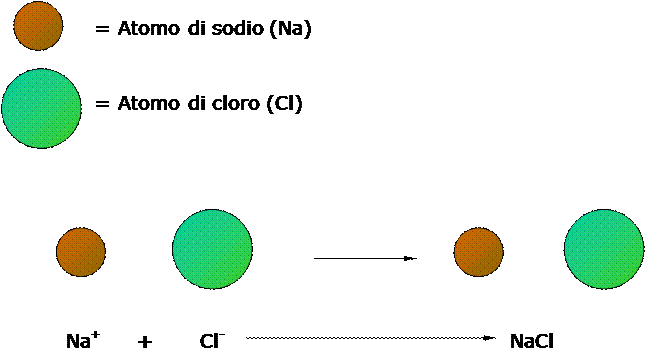
Caratteristiche Dei Composti Ionici
I composti ionici sono tutti solidi a temperatura ambiente. Hanno in genere punti di fusione elevati e punti di ebollizione ancora più elevati, per cui è difficile farli passare allo stato di vapore. Ciò indica che l’attrazione fra gli ioni è forte, per cui occorre molta energia per separarli.
LEGAME COVALENTE
Il legame covalente consiste nella condivisione di coppie di elettroni di valenza tra atomi della stessa specie o di specie diversa. In molti casi la condivisione degli elettroni consente agli atomi coinvolti di circondarsi di otto elettroni come nei gas nobili (regola dell’ottetto).
Il legame covalente si forma fra atomi la cui differenza dei valori di elettronegatività non è maggiore di 1,7. I due atomi mettono in comune un elettrone ciascuno. Gli elettroni che vengono messi in comune sono elettroni spaiati, cioè elettroni che si trovano isolati in un orbitale. Quando i due atomi si avvicinano a sufficienza, avviene una parziale sovrapposizione dei due orbitali in cui si trovano gli elettroni spaiati: i due orbitali si compenetrano l’un l’altro per una certa regione di spazio, che apparterrà contemporaneamente ad entrambi gli orbitali e di conseguenza gli elettroni che si trovano in questi orbitali apparterranno contemporaneamente ai due atomi.
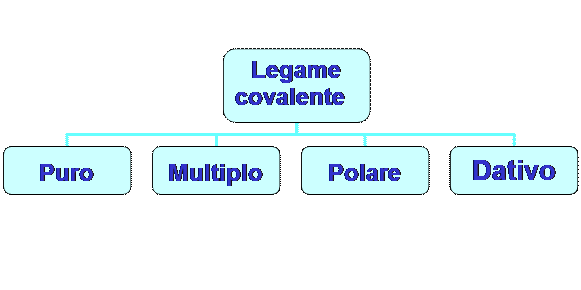
Il legame covalente è il legame chimico più forte e si distinguono due tipi di legame covalente:
1 - il legame covalente puro;
2 - il legame covalente polare.
IL LEGAME COVALENTE PURO
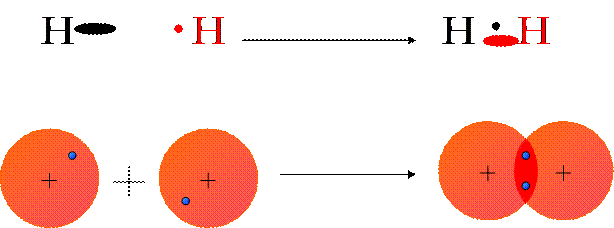
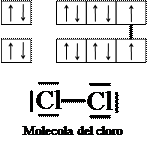
Un legame covalente è detto “puro” quando si forma fra atomi con lo stesso valore di elettronegatività, oppure valori molto vicini. In questo caso, gli elettroni che vengono messi in comune fra i due atomi vengono attratti con la stessa forza da entrambi i nuclei e, perciò, vengono ad essere condivisi in maniera uguale fra i due atomi (c’è una distribuzione simmetrica della nube elettronica). Esempi sono la molecola dell’idrogeno (H2) o del cloro (Cl2).
Il Legame Nella Molecola Di Idrogeno H2
L’atomo di idrogeno ha solo un elettrone esterno e quindi spaiato. Il gas nobile più vicino all’idrogeno è l’elio (He), che ha due elettroni nel livello più esterno, cioè ha il primo livello energetico completamente occupato. L’idrogeno tende a raggiungere la configurazione dell’elio, cioè a trovare un modo per avere due elettroni nel primo livello.
Se due atomi di idrogeno mettono in comune i loro elettroni, ognuno di essi avrà due elettroni, sia pure in comune con l’altro atomo.
Formazione di una molecola di cloro Cl2
Il legame covalente puro, detto anche omopolare, consiste nella condivisione di coppie di elettroni fra atomi della stessa specie.
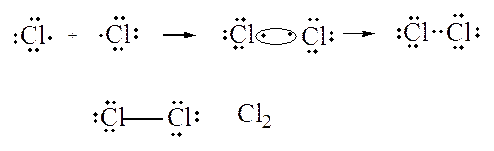
Molte molecole biatomiche di elementi chimici sono caratterizzate da legame covalente: H2, Br2, I2, F2.
Legami covalenti multipli
I legami covalenti possono essere anche doppi, cioè con condivisione di due coppie di elettroni di valenza, come nel caso della molecola di ossigeno, o tripli, con condivisione di tre coppie di elettroni di valenza, come nel caso dell’azoto. In entrambi i casi è rispettata la regola dell’ottetto.
Formazione di una molecola di ossigeno
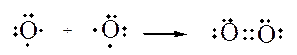
Formazione di una molecola di azoto
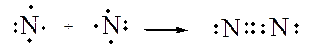
IL LEGAME COVALENTE POLARE
Un legame covalente polare si forma tra atomi che hanno elettronegatività diversa, ma non tanto diversa da rendere possibile la formazione di un legame ionico (la differenza dei valori di elettronegatività è sempre minore di 1,7).
I due atomi mettono in comune i loro elettroni spaiati, tramite la sovrapposizione degli orbitali in cui si trovano questi elettroni. Tuttavia la coppia di elettroni non è equamente condivisa fra i due atomi: gli elettroni passano più tempo attorno all’atomo più elettronegativo, rendendolo parzialmente (non c’è un trasferimento completo di una carica elettrica da un atomo all’altro, quindi non si formano ioni) negativo, mentre l’altro atomo diviene parzialmente positivo.
legame nella molecola di cloruro di idrogeno (HCl)
Sappiamo che l’atomo di idrogeno ha un elettrone spaiato nell’orbitale 1s e l’atomo di cloro ha un elettrone spaiato in uno degli orbitali 3p. Quando i due atomi si avvicinano, l’orbitale 1s dell’atomo di idrogeno e l’orbitale 3p dell’atomo di cloro si sovrappongono e i due elettroni spaiati vengono messi in comune.
In questo modo l’atomo di idrogeno raggiunge la configurazione del gas nobile più vicino, quindi l’elio (He), e l’atomo di cloro raggiunge l’ottetto.
L’atomo di cloro, essendo più elettronegativo dell’atomo di idrogeno, attira i due elettroni di legame più fortemente dell’atomo di idrogeno e così il cloro viene ad avere una parziale carica negativa, mentre l’idrogeno una parziale carica positiva (la carica parziale è indicata con d(delta) posto davanti al segno della carica).
La molecola si comporta quindi da dipolo elettrico, cioè come un’unità che ha cariche di segno opposto alle due estremità.
Al dipolo elettrico si associa una grandezza vettoriale chiamata momento dipolare (spesso il dipolo viene rappresentato da un vettore che va verso l’estremità negativa).
Il legame covalente polare consiste nella condivisione di coppie
di elettroni fra atomi di specie diverse. In questo caso la coppia di elettroni condivisi non è distribuita in maniera perfettamente simmetrica tra gli atomi legati, ma tende a spostarsi verso l’atomo più elettronegativo che viene a costituire il polo negativo della molecola. L’altro atomo costituisce il polo positivo.
La carica parziale viene indicata con i simboli d + e d – (d = delta).
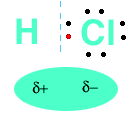
Una molecola biatomica contenente un legame polare è sempre polare, cioè ha un’estremità positiva e un’estremità negativa.
Nel caso di molecole con più di due atomi, la situazione può essere diversa, e dipende dalla geometria della molecola e dalla somma vettoriale dei momenti dipolari associati ai vari legami polari.
Possiamo considerare alcuni esempi:
- la molecola dell’acqua (H2O)
- la molecola del biossido di carbonio (CO2)
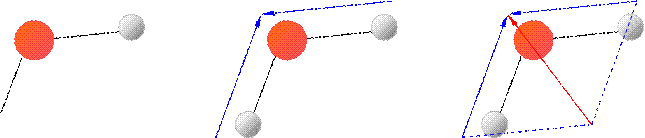
MOLECOLA DELL’ACQUA (H2O)
Nella molecola dell’acqua i legami O-H formano un angolo di 104,5°.
Siccome l’ossigeno è più elettronegativo dell’idrogeno, ciascuno dei due legami O-H è polare, con l’atomo di ossigeno parzialmente negativo e quello dell’idrogeno parzialmente positivo (a). Possiamo considerare con i vettori i momenti dipolari associati a ciascuno di questi legami (b). Possiamo anche considerare la somma dei due vettori (c) e siccome essa non è nulla, allora la molecola dell’acqua è polare.
È necessario introdurre il concetto di valenza:
- per numero di valenza (o elettroni di valenza) si intende il numero di elettroni presenti nell’ultimo livello energetico;
- per valenza base, invece, si considera il numero di elettroni spaiati presenti nell’ultimo livello energetico.
Esistono solidi in cui gli atomi sono legati l’uno all’altro da legami covalenti e costruiscono un’unica struttura (dove non si individuano singole molecole). Un esempio è il diamante, costituito da carbonio puro. Ogni atomo di carbonio è legato ad altri quattro atomi di carbonio, disposti intorno ad esso secondo i vertici di un tetraedro.
IL LEGAME DATIVO
Il legame dativo (o di coordinazione) è un legame covalente in cui due elettroni di legame provengono da uno stesso atomo.
Quindi, perché fra due atomi si possa formare un legame dativo, uno dei due deve avere una coppia di elettroni in uno stesso orbitale, non impegnata in un nessun legame, e l’altro atomo deve avere un orbitale vuoto nel quale poter “alloggiare” questa coppia. Allora la coppia di elettroni viene messa in comune fra i due atomi. I due orbitali si sovrappongono e si forma il legame. L’atomo che fornisce la coppia di elettroni si chiama agente nucleofilo o donatore, mentre l’altro atomo si chiama agente elettrofilo o accettore.
Esempi di legame dativo all’interno delle molecole li ritroviamo negli ossiacidi del cloro
(idrogeno + ossigeno + cloro):
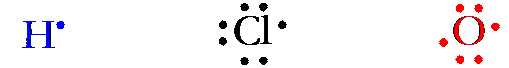
La molecola del più semplice di essi, l’acido ipocloroso (HClO), contiene due legami covalenti, uno tra l’atomo di cloro e quello di ossigeno,l’altro tra l’atomo di ossigeno e quello di idrogeno:
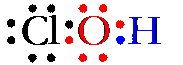
In questa molecola, l’atomo di cloro ha tre coppie di elettroni disponibili, cioè non impegnate in legami. Anche l’ossigeno ne ha due, ma, essendo l’ossigeno un atomo fortemente elettronegativo tende ad avere il ruolo di accettore. Se un altro atomo di ossigeno si avvicina alla molecola di HClO, esso “accoppia” i suoi due elettroni spaiati in un unico orbitale, in modo tale da avere un orbitale vuoto nel quale “alloggiare” una delle coppie di elettroni del cloro. Si forma così il legame dativo tra l’atomo di ossigeno (accettore) e l’atomo di cloro (donatore).
IL LEGAME METALLICO
Nei metalli il legame è dovuto alla dislocazione di tutti gli elettroni di valenza. In pratica gli ioni metallici occupano posizioni fisse all’interno del reticolo, mentre gli elettroni di valenza sono liberi di muoversi. La mobilità della nube elettronica che avvolge i cationi spiega molte proprietà dei metalli come la conducibilità termica ed elettrica e la lavorabilità.
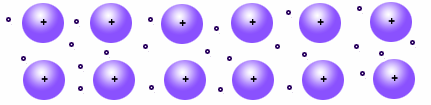
Circa i quattro quinti di tutti gli elementi sono metalli, che sono tutti solidi tranne il mercurio (Hg). I metalli hanno bassa energia di ionizzazione (quantità di energia necessaria per strappare un elettrone a un atomo neutro) e di elettronegatività. Quindi i loro elettroni esterni sono attratti debolmente dai rispettivi nuclei, e se ne separano facilmente. Ciò avviene anche quando il metallo si trova allo stato solido. Nei metalli, le posizioni (o nodi, occupati dalle particelle) del reticolo cristallino (schema geometrico creato dalla disposizione delle particelle che costituiscono un solido) sono occupate dagli ioni positivi del metallo. Gli elettroni esterni non rimangono vincolati ognuno al proprio atomo ma sono liberi di muoversi per tutto il solido, tenendo insieme in questo modo il solido stesso.
Gli elettroni esterni sono delocalizzati, cioè non appartengono ad un atomo specifico, e nemmeno sono condivisi fra una coppia specifica di atomi, ma possono trovarsi in qualsiasi zona all’interno del metallo. Perciò possiamo visualizzare la struttura del metallo come reticolo cristallino con i nodi occupati dagli ioni positivi, immerso in una nube elettronica formata da tutti gli elettroni esterni. La libertà di movimento degli elettroni è all’origine delle proprietà dei metalli:
- conducibilità elettrica
- conducibilità termica
- lucentezza
- malleabilità e duttilità
LEGAMI DEBOLI O INTERMOLECOLARI
I legami deboli sono quelle interazioni di natura elettrostatica che si stabiliscono tra molecole della stessa specie, o di specie diverse, già formate. Le loro energie sono molto più basse rispetto a quelle dei legami forti, ma sono importanti nel determinare le proprietà fisiche dei composti.

A IDROGENO
VAN DER WAALS
IL LEGAME A IDROGENO
Il legame idrogeno è caratteristico dell’acqua: trattandosi di una molecola contenente legami covalenti polari, l’atomo di ossigeno, parzialmente negativo, è in grado di legare i due atomi di idrogeno di un’altra molecola. Di conseguenza le molecole d’acqua, allo stato solido e allo stato liquido, sono tutte collegate tra loro. Il legame idrogeno spiega, per esempio, l’elevata temperatura di ebollizione dell’acqua rispetto a sostanze di struttura simile. Per passare allo stato vapore è infatti necessario rompere i legami idrogeno.
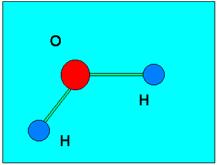
Molecola d’acqua Legame idrogeno
Il legame idrogeno è presente in poche altre sostanze come HF ed NH3, oltre che in macromolecole biologiche come proteine e acidi nucleici.
Il legame a idrogeno, o a ponte di idrogeno, è un legame che si forma fra molecole che contengono un atomo di idrogeno legato ad un altro atomo più elettronegativo e di piccole dimensioni.
Il legame in queste molecole è covalente polare, con polarità accentuata: l’atomo di idrogeno è parzialmente positivo, l’altro atomo è parzialmente negativo. Si stabilisce allora un’attrazione elettrostatica fra l’atomo di idrogeno di una molecola e l’altro atomo di un’altra molecola. Gli atomi che sono allo stesso tempo sufficientemente elettronegativi e piccoli sono soltanto tre: quelli dell’azoto, dell’ossigeno e del fluoro. Quindi si formano legami a idrogeno quando un atomo di idrogeno è legato a uno di questi tre atomi. Quindi come esempi possiamo analizzare in dettaglio:
- la molecola dell’acqua (H2O)
- la molecola del fluoruro di idrogeno (HF)
Legami a idrogeno nella molecola di Acqua (H2O)
Nella molecola di acqua, l’atomo di ossigeno è parzialmente negativo, mentre i due atomi di idrogeno sono parzialmente positivi. Quando due molecole di acqua si avvicinano, si stabilisce un’attrazione elettrostatica fra l’atomo di ossigeno di una di esse e uno degli atomi di idrogeno dell’altra. Si forma così un legame a idrogeno fra le due molecole.
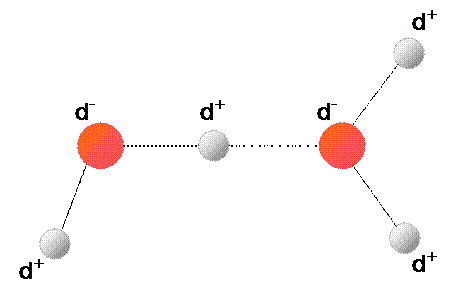
Legami a idrogeno nella molecola di fluoruro di idrogeno (FCl)
L’attrazione elettrostatica si stabilisce fra l’atomo di idrogeno di una molecola e l’atomo di fluoro di un’altra molecola. Si formano così catene di molecole di fluoruro di idrogeno (o acido fluoridrico).
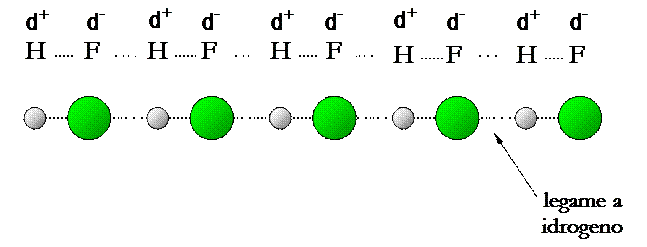
FORZE DI VAN DER WAALS
Le forze di Van der Waals, sono interazioni di natura elettrostatica che si stabiliscono tra molecole della stessa specie, o di specie diverse, già formate. Se ne distinguono tre tipi diversi secondo la natura delle molecole coinvolte.
1. L’interazione dipolo-dipolo avviene tra molecole polari:

2. L’interazione dipolo-dipolo indotto avviene tra molecole polari e molecole inizialmente apolari, che subiscono una separazione di carica per effetto induttivo:

3. L’interazione dipolo istantaneo - dipolo indotto avviene tra molecole apolari: una risulta temporaneamente polarizzata per effetto del moto degli elettroni, l’altra diventa polare per induzione. Queste interazioni si chiamano anche forze di London:

Fonte: http://www.liceocottini.it/documenti/FAD/chimica/LEGAMI%20CHIMICI.doc
Autore: non identificabile dal documento
Legami chimici
LEGAMI CHIMICI PRIMARI
I Legami chimici primari sono legami che derivano dalla interazione tra atomi o ioni e sono rappresentati da:
- LEGAME IONICO Consiste nell’acquistare elettroni da un atomo o nel cedere elettroni a un atomo. I due atomi interagenti si trasformano in inoni di carica opposta e si sviluppa una forza di attrazione elettrostatica tra i due.
Na + F  NaCl
NaCl
Lo stabilirsi di un legame ionico porta alla formazione di un’unità formula.
- LEGAME COOVALENTE Si realizza con la condivisione di elettroni tra due atomi uguali (puro) o diversi (eteropolare).
H∙ + ∙H 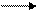 H2
H2
H∙ + Cl 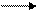 HCl
HCl
Lo stabilirsi di legami covalenti porta alla formazione di una molecola che costituisce od un elemento non metallico od un composto molecolare.
- LEGAME METALLICO. Si realizza con la condivisione di elettroni da parte di cationi dello stesso tipo. Questo porta alla formazione di un elemento metallico.
Le rappresentazioni di unità formula o molecole si chiamano formule chimiche e sono combinazioni di simboli chimici e di indici. I simboli chimici si scrivono in ordine crescente di elettronegatività. Nei composti molecolari si distinguono formule minime e molecolari. La formula minima o empirica indica gli elementi un composto nell’loro rapporto di combinazione. La formula molecolare indica quanti atomi di ciascun elemento sono presenti in una molecola di un composto. La formula molecolare può coincidere con la formula minima oppure può essere un multiplo intero.
Composto |
Formula minima |
Formula molecolare |
Acqua |
H2O |
H2O |
Acqua ossigenata |
HO |
H2O2 |
Ammoniaca |
NH3 |
NH3 |
Idrazina |
NH2 |
N2H2 |
LEGAME IONICO
Poiché il legame ionico si forma per trasferimento di elettronica un atomo ad un altrotra quelli che hanno bassa energia di ionizzazione ed elevata affinità elettronica, tra atomi che hanno un’elevata differenza di elettronegatività, tra atomi la cui
ΔE>1,9.
Da tener presente che la ΔE è in relazione con la polarità di un composto: maggiore è la ΔE , maggiore è il grado di polarità. Risulta evidente che la polarità nei composti ionici è molto grande. Per esempio, il sodio (Na) ha un’energia di ionizzazione pari a 496 Kj/mol e tende quindi a perdere un elettrone trasformandosi in ione sodio Na+,
Na + I 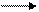 Na++ e- (I = 496Kj/mol)
Na++ e- (I = 496Kj/mol)
Il cloro appartenendo al VII gruppo ha configurazione elettronica esterna ns2 np5 e tende quindi ad acquistare un elettrone trasformandosi nello ione cloruro (Cl-) e raggiungendo la configurazione elettronica esterna dell’argon F = -347Kj/mol.
Cl + e- 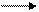 Cl+ (- F)
Cl+ (- F)
Tra ioni di carica opposta si stabilisce una forza di attrazione elettrostatica che è il legame ionico. Gli ioni Na+ e gli ioni Cl- si dispongono nelle dimensioni dello spazio a formare un reticolo cristallino, in cui uno ione sodio è circondato da sei ioni cloruro e, viceversa, uno ione Cloruro è circondato da sei ioni sodio. Questo numero è detto numero di coordinazione e dipende dalle dimensioni e dalla carica degli ioni.
Analizziamo la reazione di energia che la accompagna quando si verifica per una mole di cloruro di sodio (NaCl) (?). la trasformazione di una mole di sodio metallico in una di ioni sodio richiede un’energia di 490 Kj/mol . Il processo dovrebbe risultare sfavorevole (vedi immagine relativa N.d.R.), tuttavia bisogna considerare che i due ioni in seguito alla formazione del legame liberano un’energia (energia reticolare) che equivale a 583 KJ/mol. La variazione di energia globale è favorevole. Quindi ΔE=347+483+496=434 Kj/mol. È opportuno sottolineare che la formazione del legame ionico di un composto liquido o solido porta alla formazione di un’unità formula e non di una molecola che esiste in un composto ionico solo allo stato gassoso.
RAPPORTO QUANTITATIVO ESISTENTE ALLO STATO SOLIDO TRA GLI IONI DI UN CRISTALLO (?)
L’unità formula si esprime con la formula chimica :
Na+Cl- unità formula
NaCl formula chimica
Considerando la reazione tra alluminio ed ossigeno:
Al  Al3++3e- (configurazione elettronica del Neon)
Al3++3e- (configurazione elettronica del Neon)
Al  Al3++3e- (configurazione elettronica del Neon)
Al3++3e- (configurazione elettronica del Neon)
Tenendo presente che il numero degli elettroni ceduti da un atomo deve essere uguale a quello degli elettroni acquistati dall’altro è evidente che […]
2 Al3++ 32- che si rappresenta Al2O3
Metalli di post transizione
I metalli di post transizione perdono generalmente gli elettroni dei sottolivelli s e p esterni con formazione di ioni che hanno la configurazione elettronica del gas nobile che li precede circondata dagli orbitali nd completi. Questa configurazione è detta configurazione pseudo-nobile.
50Sn= [Kr] 5s24d105p2
Ci sono due soluzioni possibili
- Cedendo 4 elettroni (due dall’s e due dal p)
50Sn4+= [Kr] 4d10 (configurazione di gas pseudo-nobile)
- Cedendo 2 elettroni (dal sottolivello p)
50Sn2+= [Kr] 5s24d10 (non è pseudo-nobile)
Metalli di transizione
I metalli del blocco d perdono facilmente gli elettroni del sottolivello s ma possono anche perdere gli elettroni del sottolivello p.
26Fe= [Ar] 4s23d6
- Può perdere 2 elettroni. La sua configurazione sarà
26Fe= [Ar] 3d6 (non pseudo-nobile perché d deve essere completo)
- Può perdere 3 elettroni
26Fe= [Ar] 3d5
Ioni poliatomici
Gruppi di due o più atomi legati tra loro mediante legami covalenti e recanti una o più carche elettriche positive o negative.
Gli ossoanioni che contengono almeno un atomo di O e che derivano da ossiacidi per la perdita parziale o totale in soluzione acquosa di atomi di Idrogeno sottoforma di ioni H+. L’acido fosforico H3PO4 in soluzione acquosa può perdere uno, due o tre atomi di Idrogeno formando rispettivamente:
(H2P04)- ione diidrogenofosfato
(HP04)- ione idrogenofosfato
(P04)- ione fosfato
Altri ioni poliatomici importanti sono:
FORMULA CHIMICA |
NOME |
NH4+ |
Ione ammonio |
H30+ |
Ione ossonio |
NH2- |
Ione ammide |
O22- |
Ione perossido |
CN- |
Ione cianuro |
OH- |
Ione idrossido od ossidrile |
HS- |
Ione idrogenosolfuro o disolfuro |
Gli ioni negativi non possono esistere da soli ma sono legati con legame ionico a ioni positivi che ne bilanciano la carica:
Ca2++2OH-
2Al3++3 P04-
Massa formula relativa
Si indica con Fr ed è il numero che indica la massa di un’unità formula di un composto de è data dalla somma delle masse relative degli ioni che costituiscono l’unità formula. Ricordando che la massa degli elettroni è trascurabile rispetto a quella dei protoni e dei neutroni è evidente che la massa di uno ione coincide con la massa dell’atomo:
Fr(NaCl)=22,9+34,45=57,35
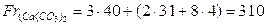
RIPASSARE:
- legge di Gay – Lussac
- Ipotesi di Avogadro
- Concetto di mole
fonte: http://www.brocca90.altervista.org/app/chimica/LEGAMI_CHIMICI_PRIMARI.doc
Autore: non identificabile dal documento
LEGAMI CHIMICI
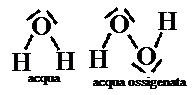 I legami chimici sono i modi in cui gli atomi si legano tra di loro. In natura solo i gas nobili si trovano come atomi isolati, gli atomi di tutti gli altri elementi si trovano invece legati ad altri atomi o dello stesso tipo, come avviene nelle sostanze elementari, o di tipo diverso, come avviene nelle sostanze composte. Ciò avviene perché legandosi gli atomi raggiungono, almeno formalmente, la configurazione elettronica del gas nobile più vicino, che, tranne nel caso dell’elio, è rappresentata dall’ottetto; i gas nobili quindi non si legano perché hanno già raggiunto la configurazione elettronica otteziale. Nei rari casi in cui si trovano atomi isolati di elementi diversi dai gas nobili essi sono molto reattivi, cioè reagiscono molto velocemente con altri atomi per cercare di formare un legame. Ne sono esempi gli atomi isolati di ossigeno che si sviluppano dall’ozono e dall’acqua ossigenata che, reagendo con gli atomi delle sostanze che incontrano, sono alla base della tossicità di queste due sostanze, utilizzate proprio per questo come disinfettanti. Nel formare legami gli atomi debbono entrare in contatto tra loro, essi quindi partecipano al legame stesso unicamente con gli elettroni più esterni ovvero con quelli dell’ultimo livello energetico. Il numero ed il tipo di legami che un atomo forma sono quindi determinati dalla sua configurazione elettronica esterna e rientrano nelle sue proprietà chimiche.
I legami chimici sono i modi in cui gli atomi si legano tra di loro. In natura solo i gas nobili si trovano come atomi isolati, gli atomi di tutti gli altri elementi si trovano invece legati ad altri atomi o dello stesso tipo, come avviene nelle sostanze elementari, o di tipo diverso, come avviene nelle sostanze composte. Ciò avviene perché legandosi gli atomi raggiungono, almeno formalmente, la configurazione elettronica del gas nobile più vicino, che, tranne nel caso dell’elio, è rappresentata dall’ottetto; i gas nobili quindi non si legano perché hanno già raggiunto la configurazione elettronica otteziale. Nei rari casi in cui si trovano atomi isolati di elementi diversi dai gas nobili essi sono molto reattivi, cioè reagiscono molto velocemente con altri atomi per cercare di formare un legame. Ne sono esempi gli atomi isolati di ossigeno che si sviluppano dall’ozono e dall’acqua ossigenata che, reagendo con gli atomi delle sostanze che incontrano, sono alla base della tossicità di queste due sostanze, utilizzate proprio per questo come disinfettanti. Nel formare legami gli atomi debbono entrare in contatto tra loro, essi quindi partecipano al legame stesso unicamente con gli elettroni più esterni ovvero con quelli dell’ultimo livello energetico. Il numero ed il tipo di legami che un atomo forma sono quindi determinati dalla sua configurazione elettronica esterna e rientrano nelle sue proprietà chimiche.
Il legame chimico esistente tra gli atomi determina quindi il comportamento chimico della sostanza. Per capire ciò basta pensare al cambiamento che si registra nel comportamento delle sostanze prima e dopo la formazione di un legame chimico. Pensiamo ad esempio all’acqua (H2O) ed agli elementi che la formano, cioè idrogeno e ossigeno: il primo è un gas esplosivo (detto per questo gas tonante), mentre il secondo è il gas indispensabile per far avvenire tutti i processi di combustione (detto per questo comburente). Il composto invece che da essi si forma, non solo è un liquido, ma viene comunemente utilizzato per spegnere le combustioni! Legandosi tra loro i vari elementi perdono quindi le caratteristiche possedute allo stato elementare e ne acquistano di nuove, determinate proprio dal tipo di legame che vanno a formare. Per riflettere ulteriormente sull’argomento consideriamo le differenze esistenti tra l’acqua (H2O) e l’acqua ossigenata (H2O2), due sostanze di formula molto simile, ma di proprietà chimiche assai differenti: la prima è infatti il composto indispensabile per la vita, la seconda è viceversa, come già detto, un composto tossico, tanto da essere impiegato come disinfettante. Tale differenza è determinata dai legami esistente tra i loro atomici, che possono essere schematizzati nelle due formule a lato.
 La rappresentazione di Lewis
La rappresentazione di Lewis
Oltre alle cellette, ed agli altri simboli già visti, esiste un terzo modo di rappresentare la configurazione elettronica esterna di un atomo. Tale rappresentazione, che prende il nome dal chimico americano G.N. Lewis (1875 – 1946) che l’ha introdotta, consiste nel circondare il simbolo dell’elemento con un numero di puntini uguale a quello degli elettroni presenti nel suo ultimo livello energetico. Poiché nell’ultimo livello energetico vi sono sempre quattro orbitali (tranne che per elio ed idrogeno), ognuno dei quattro lati che circondano il simbolo viene a raffigurare un orbitale, mentre i puntini che vi si posizionano rappresentano gli elettroni presenti al suo interno. Un orbitale pieno viene così rappresentato da due puntini, che comunemente vengono sostituiti da un trattino, mentre un orbitale semi riempito è rappresentato da un solo puntino. La rappresentazione di Lewis, di cui a lato si danno alcuni esempi, risulterà assai utile nella raffigurazione dei legami covalenti e nella rappresentazione delle molecole che da essi derivano.
Legame covalente
Nella configurazione elettronica di un elemento una coppia di elettroni che occupa uno stesso orbitale forma un doppietto, mentre un elettrone che occupa da solo un orbitale costituisce un singoletto, chiamato anche elettrone spaiato. Il legame covalente si realizza tra due atomi che abbiano nell’ultimo livello energetico almeno un elettrone spaiato; nella formazione del legame i due orbitali atomici si fondono, per formare un orbitale di legame, che circonda entrambi i nuclei ed al cui interno si trovano i due elettroni spaiati, i quali possiedono spin opposto (anche per gli orbitali di legame vale la regola di Pauli come per quelli atomici). Questi due elettroni risentono dell’attrazione di entrambi i nuclei atomici intorno a cui si trovano a ruotare. Essi non appartengono più ai singoli atomi, bensì ad entrambi: in questo caso si dice anche che i due atomi hanno messo ognuno in compartecipazione un orbitale con un elettrone. Si forma cioè una specie di società, nella quale ognuno dei due atomi legati mette in comune almeno un orbitale con un elettrone spaiato, mentre mantiene per se eventuali altri orbitali riempiti da due elettroni. Nel legame covalente gli elettroni messi in compartecipazione sono detti elettroni di legame o coppie di legame, mentre gli altri elettroni, facenti parte della configurazione elettronica esterna, ma che non vengono condivisi sono detti elettroni di non legame o coppie di non legame.
Il caso più semplice è quello dell’idrogeno, la cui configurazione elettronica è 1S1, esso possiede quindi solo un singoletto, mentre per raggiungere la configurazione elettronica dell’elio dovrebbe aggiungere un altro elettrone al suo orbitale. Per far ciò due atomi di idrogeno si legano con legame covalente, mettendo in compartecipazione i loro orbitali atomici coi relativi elettroni spaiati. Una cosa analoga fa anche il cloro, solo che la sua configurazione elettronica esterna è 3S2 3P5, con quindi tre doppietti ed un singoletto. Quando esso si lega ad un altro atomo di cloro mette in compartecipazione l’orbitale col singoletto, mentre gli orbitali col doppietto restano “di proprietà” di ciascuno dei due atomi ed i relativi elettroni continuano a ruotare intorno al nucleo rispettivo, formando così coppie di non legame. In tale maniera ognuno dei due atomi di cloro raggiunge formalmente la configurazione elettronica otteziale dell’argon, che è il gas nobile a loro più vicino. Sia nel caso dell’idrogeno, che in quello del cloro, i singoletti messi in comune sono uno solo (una sola coppia di legame) ed in tal caso si dice che si è formato un legame singolo.
 L’ossigeno, la cui configurazione elettronica esterna è 2S2 2P4 ed è dunque formata da due doppietti e da due singoletti, per raggiungere l’ottetto deve riempire due orbitali. Quando si forma un legame tra due atomi di ossigeno, ognuno di essi metterà quindi in compartecipazione due orbitali con un singoletto, formando due coppie di legame, mentre gli altri due orbitali col doppietto non partecipano al legame e costituiscono quindi coppie di non legame. In questo caso tra i due atomi si forma un legame doppio. Nel caso infine dell’azoto, la cui configurazione elettronica esterna è 2S2 2P3, i singoletti sono tre ed uno solo il doppietto; quando due atomi di azoto si legano mettono in compartecipazione tre orbitali con singoletto, formando così un legame triplo.
L’ossigeno, la cui configurazione elettronica esterna è 2S2 2P4 ed è dunque formata da due doppietti e da due singoletti, per raggiungere l’ottetto deve riempire due orbitali. Quando si forma un legame tra due atomi di ossigeno, ognuno di essi metterà quindi in compartecipazione due orbitali con un singoletto, formando due coppie di legame, mentre gli altri due orbitali col doppietto non partecipano al legame e costituiscono quindi coppie di non legame. In questo caso tra i due atomi si forma un legame doppio. Nel caso infine dell’azoto, la cui configurazione elettronica esterna è 2S2 2P3, i singoletti sono tre ed uno solo il doppietto; quando due atomi di azoto si legano mettono in compartecipazione tre orbitali con singoletto, formando così un legame triplo.
Il legame covalente non si realizza però solo tra atomi dello stesso elemento, ma anche tra atomi diversi, seguendo sempre lo schema e le finalità sopra descritte. Nell’acido cloridrico, ad esempio, la cui formula è HCl, un atomo di cloro ed uno di idrogeno si legano, mettendo in compartecipazione gli orbitali col singoletto. Nell’acqua, di formula H2O, un atomo di ossigeno si lega a due di idrogeno, mentre nell’ammoniaca, di formula NH3, un atomo di azoto si lega a tre atomi di idrogeno.
Un raggruppamento neutro di atomi legati da legame covalente si dice molecola, sono quindi molecole tutti i gruppi di atomi fin qui descritti. La molecola rappresenta la più piccola parte di una sostanza che mantiene tutte le proprietà chimiche e la composizione della sostanza medesima. L’idrogeno allo stato elementare è quindi formato da molecole biatomiche di formula H2, così come molecole biatomiche formano la struttura del cloro elementare (Cl2), dell’ossigeno (O2) e dell’azoto (N2); anche la molecola dell’acido cloridrico è biatomica, mentre quella dell’acqua è triatomica e quella dell’ammoniaca è tetratomica. In generale possiamo dire, almeno per gli elementi del secondo periodo, che un atomo può formare tanti legami, con atomi uguali o diversi, quanti sono i suoi elettroni spaiati nell’ultimo livello energetico. Tra due atomi non si possono però formare più di tre legami. La formula chimica di una sostanza indica il tipo di atomi presenti al suo interno e, attraverso gli indici o deponenti, indica anche le proporzioni in cui tali atomi sono presenti nella sostanza medesima: una formula di questo tipo di definisce formula minima o anche formula bruta. Quando una sostanza è formata da molecole, oltre alla sua formula bruta, è possibile scriverne anche un’altra, definita formula molecolare, che indica il reale raggruppamento di atomi che formano la molecola. Ad esempio l’idrogeno elementare ha formula bruta H, poiché però all’interno della sua molecola sono presenti due atomi, la sua formula molecolare sarà H2. L’acqua ossigenata è formata da idrogeno ed ossigeno in rapporto 1: 1, cioè per ogni atomo di ossigeno ve ne è uno di idrogeno e viceversa: la sua formula bruta sarà quindi HO. Nella molecola dell’acqua ossigenata vi sono però due atomi di idrogeno e due di ossigeno: la sua formula molecolare sarà pertanto H2O2. Solo per le sostanze formate da molecole è possibile scrivere una formula molecolare; alle volte essa coincide anche con la formula bruta, come avviene ad esempio per l’acqua. Essa, come sappiamo, è formata da idrogeno ed ossigeno, ogni atomo di ossigeno ve ne sono due di idrogeno e pertanto la sua formula bruta è H2O; questa è però anche la sua formula molecolare, in quanto una molecola di acqua è formata esattamente da un atomo di ossigeno e da due di idrogeno.
Quando i due atomi che si legano con un legame covalente hanno la stessa elettronegatività, essi attirano gli elettroni di legame con la stessa forza e pertanto questi si trovano a ruotare allo 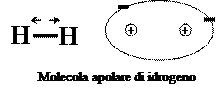 stesso modo intorno ad entrambi i nuclei. Un legame di questo tipo, che di fatto si realizza quasi esclusivamente nelle molecole delle sostanze elementari, si dice legame covalente omeopolare o covalente puro. In questo caso la molecola avrà una forma simmetrica, in quanto gli elettroni di legame passano lo stesso tempo intorno ai due nuclei, mentre anche la distribuzione della carica elettrica sarà uniforme: molecole di questo tipo si dicono pertanto apolari.
stesso modo intorno ad entrambi i nuclei. Un legame di questo tipo, che di fatto si realizza quasi esclusivamente nelle molecole delle sostanze elementari, si dice legame covalente omeopolare o covalente puro. In questo caso la molecola avrà una forma simmetrica, in quanto gli elettroni di legame passano lo stesso tempo intorno ai due nuclei, mentre anche la distribuzione della carica elettrica sarà uniforme: molecole di questo tipo si dicono pertanto apolari.
 Quando viceversa uno degli atomi che forma il legame è più elettronegativo degli altri, attira gli elettroni di legame con maggior forza; essi pertanto passeranno più tempo intorno al nucleo dell’elemento più elettronegativo e la molecola non sarà più simmetrica, in quanto l’orbitale di legame sarà più grande dalla parte dell’elemento più elettronegativo. In questo caso anche la distribuzione della carica elettrica non è più uniforme; dalla parte dell’elemento più elettronegativo vi è infatti una frazione di carica negativa in più (indicata con δ–), determinata dalla maggior presenza degli elettroni di legame, mentre dalla parte degli altri atomi si avrà una frazione di carica positiva in più (indicata con δ+), determinata dalla minor presenza degli elettroni di legame. Si forma cioè un dipolo elettrico (un dipolo elettrico in generale è costituito da una coppia di cariche elettriche di uguale grandezza, ma di segno opposto, separate da una certa distanza) e le molecole così formate si definiscono dipolari o polari, mentre il legame che si instaura al loro interno viene detto covalente eteropolare o covalente polare.
Quando viceversa uno degli atomi che forma il legame è più elettronegativo degli altri, attira gli elettroni di legame con maggior forza; essi pertanto passeranno più tempo intorno al nucleo dell’elemento più elettronegativo e la molecola non sarà più simmetrica, in quanto l’orbitale di legame sarà più grande dalla parte dell’elemento più elettronegativo. In questo caso anche la distribuzione della carica elettrica non è più uniforme; dalla parte dell’elemento più elettronegativo vi è infatti una frazione di carica negativa in più (indicata con δ–), determinata dalla maggior presenza degli elettroni di legame, mentre dalla parte degli altri atomi si avrà una frazione di carica positiva in più (indicata con δ+), determinata dalla minor presenza degli elettroni di legame. Si forma cioè un dipolo elettrico (un dipolo elettrico in generale è costituito da una coppia di cariche elettriche di uguale grandezza, ma di segno opposto, separate da una certa distanza) e le molecole così formate si definiscono dipolari o polari, mentre il legame che si instaura al loro interno viene detto covalente eteropolare o covalente polare.
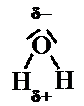 Vedremo poi come le molecole polari mostrino delle significative differenze rispetto a quelle apolari, soprattutto in relazione alla capacità di legarsi tra loro e di sciogliere determinati composti. Un composto polare è ad esempio l’acqua, in quanto l’ossigeno è più elettronegativo dell’idrogeno; nella sua molecola dalla parte dell’ossigeno vi è una frazione di carica negativa in più, mentre l’opposto avviene dalla parte dei due atomi di idrogeno. Proprio in quanto polare l’acqua è liquida a temperatura ambiente e riesce a sciogliere moltissime sostanze, assumendo per questo il ruolo fondamentale di solvente che le spetta, ad esempio all’interno del mondo vivente.
Vedremo poi come le molecole polari mostrino delle significative differenze rispetto a quelle apolari, soprattutto in relazione alla capacità di legarsi tra loro e di sciogliere determinati composti. Un composto polare è ad esempio l’acqua, in quanto l’ossigeno è più elettronegativo dell’idrogeno; nella sua molecola dalla parte dell’ossigeno vi è una frazione di carica negativa in più, mentre l’opposto avviene dalla parte dei due atomi di idrogeno. Proprio in quanto polare l’acqua è liquida a temperatura ambiente e riesce a sciogliere moltissime sostanze, assumendo per questo il ruolo fondamentale di solvente che le spetta, ad esempio all’interno del mondo vivente.
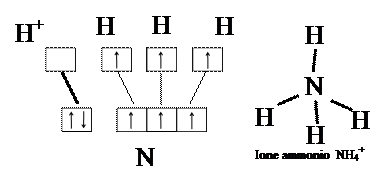 Legame dativo
Legame dativo
E’ un tipo particolare di legame covalente, che si realizza tra un atomo che, nella sua configurazione elettronica esterna, ha un orbitale vuoto ed un altro che nella configurazione elettronica esterna ha un orbitale riempito da due elettroni e non impegnato in altri legami. Anche così si forma un orbitale di legame, ma i due elettroni che lo occupano appartengono ad uno solo dei due elementi. Il legame dativo si realizza ad esempio nello ione ammonio, di formula NH4+, per la cui formazione possiamo immaginare che uno ione H+ si avvicini ad una molecola di ammoniaca. Lo H+ ha un solo orbitale completamente vuoto, in quanto ha perso l’elettrone che lo occupava, mentre l’azoto dell’ammoniaca ha a disposizione un orbitale di non legame pieno: quest’ultimo si fonde con l’orbitale vuoto dello H+ e viene riempito dai due elettroni dell’azoto. A parte la differente appartenenza degli elettroni, un legame dativo ha le stesse proprietà di un legame covalente normale.
Il legame ionico
Quando a legarsi sono due elementi con una grossa differenza di elettronegatività, l’elemento più elettronegativo letteralmente strappa gli elettroni di legame all’elemento meno elettronegativo. Il trasferimento di uno o più elettroni da un elemento all’altro trasforma i due elementi stessi in ioni: l’elemento più elettronegativo, che acquista elettroni, si trasforma in anione, mentre quello meno elettronegativo, che perde elettroni, diventa un catione. Anioni e cationi si attirano poi con una forza di tipo elettrostatico, in quanto sono dotati di carica elettrica opposta. Come già sappiamo, nell’acquistare elettroni l’anione aumenta il suo raggio, perché gli elettroni, che sono in numero maggiore rispetto ai protoni del nucleo, sono più liberi di muoversi negli orbitali; viceversa il catione rimpicciolisce, perché i protoni sono più degli elettroni ed li attirano con maggior forza. Nei composti ionici non vi è nessuna compartecipazione, né vi sono molecole, e la sostanza è costituita da una distribuzione tridimensionale di anioni e cationi, assimilabili a palline strettamente impacchettate tra loro. Ogni ione è attratto da tutti gli altri ioni di segno opposto che gli sono vicini ed il legame è lo stesso in tutte le direzioni. Il legame ionico si realizza dunque solo quando elementi dei primi gruppi, poco elettronegativi, si legano ad elementi degli ultimi gruppi, che sono invece molto elettronegativi ed è quindi tipicamente un legame tra metalli e non metalli; esso è inoltre un legame piuttosto forte e pertanto i composti ionici sono tutti solidi. Un composto ionico è ad esempio il cloruro di sodio, il comune sale da cucina, la cui formula è NaCl. Il sodio ha configurazione elettronica esterna 3S1 e cede dunque volentieri il suo elettrone spaiato, trasformandosi nel catione monovalente Na+ ed acquistando così la configurazione elettronica del Neon, il gas nobile a lui più vicino. Viceversa il cloro, con configurazione elettronica esterna 2S2 2P5, acquista facilmente l’elettrone del sodio, trasformandosi nell’anione Cl-, che ha configurazione elettronica otteziale. Na+ e Cl- si legano poi elettrostaticamente, come due palline dotate di carica opposta. A causa della loro struttura i solidi ionici sono tuttavia fragili, si rompono cioè facilmente quando vengono sottoposti a sollecitazioni di tipo meccanico. Ciò avviene perché la sollecitazioni, deformando la struttura, può far venire a contatto ioni di segno opposto, col risultato di generare forze di tipo repulsivo che rompono il solido.
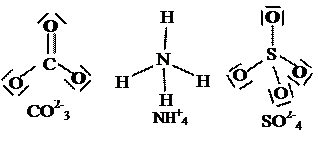 Ioni poliatomici o molecole ioni: finora, parlando di ioni, ci siamo limitati a considerare quelli monoatomici, ovvero formati da un solo atomo con qualche elettrone in più, o in meno, rispetto al numero dei suoi protoni. In verità esistono anche raggruppamenti di atomi legati con legame covalente, molecole quindi, al cui interno il numero totale dei protoni è diverso da quello degli elettroni. Tali raggruppamenti si definiscono pertanto ioni poliatomici o anche molecole ioni o ioni molecolari; come nel caso degli ioni monoatomici, se gli elettroni sono più dei protoni avremo anioni, viceversa cationi. Gli ioni poliatomici si comportano esattamente come quelli monoatomici, coi quali possono formare legami, tuttavia, rispetto a questi ultimi, essi sono più grossi. Solo in non metalli, a cui si aggiungono in alcuni casi anche cromo e manganese, possono formare ioni poliatomici, di cui alcuni esempi sono: NH4+ (che abbiamo già incontrato), CO32-; SO42-; ClO4-; H3O+ ecc.
Ioni poliatomici o molecole ioni: finora, parlando di ioni, ci siamo limitati a considerare quelli monoatomici, ovvero formati da un solo atomo con qualche elettrone in più, o in meno, rispetto al numero dei suoi protoni. In verità esistono anche raggruppamenti di atomi legati con legame covalente, molecole quindi, al cui interno il numero totale dei protoni è diverso da quello degli elettroni. Tali raggruppamenti si definiscono pertanto ioni poliatomici o anche molecole ioni o ioni molecolari; come nel caso degli ioni monoatomici, se gli elettroni sono più dei protoni avremo anioni, viceversa cationi. Gli ioni poliatomici si comportano esattamente come quelli monoatomici, coi quali possono formare legami, tuttavia, rispetto a questi ultimi, essi sono più grossi. Solo in non metalli, a cui si aggiungono in alcuni casi anche cromo e manganese, possono formare ioni poliatomici, di cui alcuni esempi sono: NH4+ (che abbiamo già incontrato), CO32-; SO42-; ClO4-; H3O+ ecc.
I tipi più comuni di ioni che si riscontrano nei vari gruppi
1° gruppo: solo cationi monoatomici monovalenti (Na+; K+ ecc.)
2° gruppo: solo cationi monoatomici bivalenti (Mg 2+; Ca 2+ ecc.)
3° gruppo: cationi monoatomici trivalenti (Al 3+) e anioni poliatomici (BO33-)
4° gruppo: cationi monoatomici tetravalenti (Sn 4+; Pb 4+ ) e anioni poliatomici (CO32-; SiO44-)
5° gruppo: raramente ioni monoatomici positivi (Bi 3+) o negativi (N3-); più spesso anioni poliatomici (NO3-; PO33- ecc.)
6° gruppo: anioni monoatomici bivalenti (O2-; S2-); anioni poliatomici (SO42-; SO32-)
7° gruppo: anioni monoatomici monovalenti (Cl-; F-; ecc.); anioni poliatomici (ClO4-; ClO-; BrO4- ecc.)
Deve essere inoltre segnalato che il passaggio tra legame covalente puro, legame covalente polare e legame ionico non è brusco, bensì graduale e continuo: Infatti, all’aumentare della differenza di elettronegatività degli elementi che formano il composto, il legame covalente diventa sempre più polarizzato, nel senso che l’elemento più elettronegativo attira sempre di più a se gli elettroni di legame. Quando la differenza di elettronegatività supera un certo limite, gli elettroni passano direttamente da un atomo all’altro e si forma un legame ionico.
 Il legame metallico
Il legame metallico
Come già sappiamo, gli elementi metallici hanno una bassa energia di ionizzazione ovvero cedono facilmente gli elettroni dell’ultimo livello energetico. Quando i metalli si legano tra di loro, la struttura del solido che ne deriva può essere immaginata come un insieme di cationi che tengono debolmente legati gli elettroni dei loro strati più esterni. Un solido metallico è dunque costituito da un insieme ordinato e compatto di cationi immersi in una nuvola di elettroni che, essendo attirati contemporaneamente da più cationi adiacenti, li legano tra di loro. Gli elettroni di tale nuvola non appartengono più ad un atomo specifico, bensì all’intero solido, all’interno del quale sono liberi di muoversi, senza indebolire il legame; è proprio questa mobilità degli elettroni più esterni a giustificare la conducibilità termica ed elettrica dei metalli. La corrente elettrica, come sappiamo, consiste infatti in uno spostamento degli elettroni all’interno del conduttore, mentre il calore si limita a farli vibrare intorno alle loro posizioni. E’ chiaro quindi che  in entrambi i casi, per consentire la conduzione, gli elettroni debbono essere dotati di una certa mobilità. I solidi metallici sono inoltre duttili e malleabili; ciò avviene perché, a causa della loro struttura, le sollevazioni meccaniche possono deformarli ampiamente, senza tuttavia romperli.
in entrambi i casi, per consentire la conduzione, gli elettroni debbono essere dotati di una certa mobilità. I solidi metallici sono inoltre duttili e malleabili; ciò avviene perché, a causa della loro struttura, le sollevazioni meccaniche possono deformarli ampiamente, senza tuttavia romperli.
Il legame tra le molecole
Lo stato fisico di una sostanza dipende dalla forza o meglio dall’energia con cui sono legate le particelle che la compongono: tra le particelle di un solido il legame è più forte di quello tra le particelle di un liquido, che a sua volta è più forte di quello tra le particelle di un gas. La temperatura di fusione e quella di ebollizione ci forniscono inoltre una misura diretta dell’energia con cui sono legate le particelle della sostanza. Le sostanze ioniche e metalliche sono tutte solide a temperatura ambiente (tranne mercurio e gallio ) ed hanno elevata temperatura di fusione. NaCl fonde ad 800°C, Fe fonde ad 1.535°C e bolle a 2.750 °C; anche il gallio, liquido oltre circa 30°C, bolle tuttavia a 2.403°C. Tutte le sostanze covalenti sono formate da molecole, all'interno delle quali il legame è molto forte, infatti è necessaria molta energia per rompere una molecola, separando gli atomi che la compongono. Tuttavia le sostanze covalenti possono essere gassose, come l’azoto, o liquide come l’acqua, ma anche quando sono solide, tranne qualche eccezione, come il carbonio o la silice, hanno tutte bassa temperatura di fusione, come ad esempio lo zolfo, che fonde a 112. °C.
L’apparente contraddizione tra la forza del legame covalente e lo stato gassoso, liquido o solido basso fondente delle sostanze covalenti si spiega se si prende in esame il legame che esiste tra molecola e molecola (legame intermolecolare), che è ben diverso da quello esistente all’interno della molecola stessa (legame intramolecolare). Quando ad esempio facciamo bollire l’acqua, trasformandola in vapore, non rompiamo il legame intramolecolare, bensì quello intermolecolare. Anche allo stato di vapore infatti, l’acqua è sempre formata da molecole di formula H2O, per rompere le quali, liberando ossigeno ed idrogeno, è necessaria un’energia ben maggiore di quella che forniamo all’acqua stessa scaldandola. In sostanza quindi nei composti covalenti sono presenti due tipi di legame: uno covalente e fortissimo entro la molecola, l’altro ben più debole tra molecola e molecola. I composti covalenti possono dunque essere assimilati ad una società strutturata in famiglie (molecole), all’interno delle quali gli individui (atomi) sono legati molto fortemente tra loro; viceversa tra famiglia e famiglia (tra molecola e molecola) il legame può essere più o meno forte, ma comunque sempre più debole di quello all’interno di ogni famiglia. I composti ionici possono invece essere assimilati ad una società formata solo da individui di due sessi diversi (anioni e cationi), ognuno dei quali è legato a tutti gli individui del sesso opposto. I composti metallici, infine, sono paragonabili ad una società di individui tutti uguali tra loro, ognuno dei quali è legato a tutti gli altri allo stesso modo.
Vediamo adesso quali sono i vari tipi di legame che si possono instaurare tra le varie molecole; tale studio è molto importante, in quanto consente di capire le caratteristiche chimiche e fisiche di molte sostanze fondamentali, come ad esempio l’acqua.
Solidi covalenti macromolecolari: questo tipo di sostanze rappresentano l’unica eccezione a quanto detto nel paragrafo precedente, al loro interno infatti gli atomi formano un’unica grande molecola, costituita da migliaia e migliaia di atomi legati insieme da legame covalente; tali sostanze hanno pertanto elevata temperatura di fusione. Il diamante, ad esempio, è una delle due forme del carbonio allo stato elementare; al suo interno ogni atomo di carbonio forma quattro legami covalenti con altrettanti atomi dello stesso elemento, originando una struttura tridimensionale estremamente stabile. Il diamante infatti è una pietra preziosa proprio perché rimane inalterato nel tempo, in quanto non reagisce con altre sostanze, non si altera né viene scalfito. L’altra forma del carbonio elementare è la grafite, che noi conosciamo ad esempio nelle mine delle matite. La grafite è formata da piani di atomi di carbonio legati molto fortemente tra loro, mentre tra piano e piano si ha un legame molto più debole. Quando ad esempio scriviamo col lapis sul foglio stacchiamo piani di atomi di carbonio, che si attaccano alla carta e lasciano un segno. La differenza nella struttura chimica del diamante e della grafite determina le differenze nelle loro proprietà; tuttavia anche la grafite è un solido che fonde ad alta temperatura (oltre 3.600 °C). L’ultimo esempio di solido covalente macromolecolare è il biossido di silicio (SiO2) nella cui struttura tridimensionale un atomo di silicio lega a se 4 atomi di ossigeno con un legame semplice; l’ossigeno può formare due legami e quindi ogni suo atomo si lega a due atomi di silicio, costituendo in tal modo un’unica grande molecola. Anche SiO2 è un solido che fonde ad alta temperatura; in natura esso costituisce il quarzo e la selce, ma forma anche la struttura di base del vetro.
 Il legame dipolo - dipolo: è un tipo di legame che si realizza nelle molecole polari, all’interno delle quali abbiamo cioè un legame covalente polare, e consiste nell’attrazione tra le parti caricate con segno opposto dei dipoli delle varie molecole. Questo legame è piuttosto debole e si realizza ad esempio nell’acido cloridrico (HCl).
Il legame dipolo - dipolo: è un tipo di legame che si realizza nelle molecole polari, all’interno delle quali abbiamo cioè un legame covalente polare, e consiste nell’attrazione tra le parti caricate con segno opposto dei dipoli delle varie molecole. Questo legame è piuttosto debole e si realizza ad esempio nell’acido cloridrico (HCl).
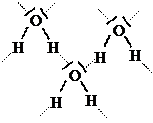 Il legame idrogeno (o a ponte di idrogeno): è un tipo particolare di legame tra molecole polari, che si forma quando nella molecola l’idrogeno è legato ad un elemento molto elettronegativo. Il composto più importante con questo tipo di legame è senz’altro l’acqua, dove due atomi di idrogeno sono legati ad uno di ossigeno, il quale possiede però anche due coppie di non legame. La molecola è polarizzata, perché l’ossigeno è molto più elettronegativo dell’idrogeno: sull’ossigeno è quindi localizzata la parte negativa del dipolo, mentre sugli atomi di idrogeno si localizza la parte positiva. Il legame a ponte d’idrogeno si realizza tra l’idrogeno di una molecola e le coppie di non legame dell’ossigeno di un’altra molecola. Questo legame, pur essendo abbastanza debole, è comunque più forte del legame dipolo-dipolo prima descritto; ciò spiega come mai l’acqua sia un liquido a temperatura ambiente, mentre molte molecole ad essa simili (ad esempio NH3, CH4 o H2S) siano tutte gassose. Tale situazione è di estrema importanza, soprattutto per gli esseri viventi, in quanto l’acqua allo stato liquido è essenziale per la vita: senza legame a ponte d’idrogeno non ci sarebbe quindi vita sul nostro pianeta. Un altro composto in cui troviamo il legame a ponte d’idrogeno è HF (il fluoro è ancora più elettronegativo dell’ossigeno) ed infatti questo composto è liquido, mentre altri a lui simili (HCl, HBr, HI) sono tutti gassosi a temperatura ambiente.
Il legame idrogeno (o a ponte di idrogeno): è un tipo particolare di legame tra molecole polari, che si forma quando nella molecola l’idrogeno è legato ad un elemento molto elettronegativo. Il composto più importante con questo tipo di legame è senz’altro l’acqua, dove due atomi di idrogeno sono legati ad uno di ossigeno, il quale possiede però anche due coppie di non legame. La molecola è polarizzata, perché l’ossigeno è molto più elettronegativo dell’idrogeno: sull’ossigeno è quindi localizzata la parte negativa del dipolo, mentre sugli atomi di idrogeno si localizza la parte positiva. Il legame a ponte d’idrogeno si realizza tra l’idrogeno di una molecola e le coppie di non legame dell’ossigeno di un’altra molecola. Questo legame, pur essendo abbastanza debole, è comunque più forte del legame dipolo-dipolo prima descritto; ciò spiega come mai l’acqua sia un liquido a temperatura ambiente, mentre molte molecole ad essa simili (ad esempio NH3, CH4 o H2S) siano tutte gassose. Tale situazione è di estrema importanza, soprattutto per gli esseri viventi, in quanto l’acqua allo stato liquido è essenziale per la vita: senza legame a ponte d’idrogeno non ci sarebbe quindi vita sul nostro pianeta. Un altro composto in cui troviamo il legame a ponte d’idrogeno è HF (il fluoro è ancora più elettronegativo dell’ossigeno) ed infatti questo composto è liquido, mentre altri a lui simili (HCl, HBr, HI) sono tutti gassosi a temperatura ambiente.
 , che si realizzano nelle molecole non polari, in cui normalmente non vi è separazione di carica; tuttavia anche in queste molecole è però possibile che, per un istante, le cariche si separino, creando così un dipolo istantaneo. Un fenomeno di questo tipo avviene, ad esempio, anche nei gas nobili, i quali, a temperatura estremamente bassa, possono diventare liquidi e persino solidi, a testimonianza dell’esistenza di forze di legame, sia pur debolissime, tra i loro atomi. Prendiamo ad esempio un atomo di elio, che possiede due protoni e due elettroni; normalmente il moto casuale degli elettroni intorno al nucleo impedisce che il centro delle cariche positive sia distinto da quello delle cariche negativa, per cui tale atomo, normalmente, non è un dipolo. Tuttavia, se per un istante i due elettroni vengono a trovarsi dalla stessa parte rispetto al nucleo dell’atomo, il centro delle cariche positive (posto nel nucleo) è distinto da quello delle cariche negative (posto sugli elettroni) e l’atomo diventa così un esempio di dipolo istantaneo. Se tale fenomeno si verifica anche in un altro atomo vicino, tra i due dipoli istantanei (vedi figura) può crearsi un legame dipolo istantaneo – dipolo istantaneo. In altri casi invece la polarizzazione delle molecola può essere indotta dall’esterno, generando così un dipolo indotto, ovvero una molecola non polare, che diventa temporaneamente polare a causa della separazione di cariche causata da un oggetto vicino. Questo fenomeno prende il nome di induzione elettrostatica. L’oggetto inducente (che cioè induce la polarizzazione nella molecola adiacente) può essere, ad esempio, uno ione o un dipolo, ma in ogni caso deve presentare una concentrazione di cariche elettriche, che indice la separazione temporanea delle cariche nell’oggetto indotto. Il dipolo indotto può a sua volta indurre la polarizzazione in altre molecole a lui vicine e legarsi ad esse con un legame dipolo indotto – dipolo indotto. Se invece il dipolo indotto si lega ad un dipolo istantaneo si realizza un legame dipolo istantaneo – dipolo indotto. Questi fenomeni sono temporanei, ma interessano tutte le molecole della sostanza; non è possibile stabilire esattamente quanti dipoli si formano in ogni istante, ma è plausibile che ce ne siano sempre abbastanza per formare legami, i quali spiegano come, sia pur a temperatura estremamente basse, anche le molecole non polari, ed i gas nobili, possano esistere allo stato liquido o solido.
, che si realizzano nelle molecole non polari, in cui normalmente non vi è separazione di carica; tuttavia anche in queste molecole è però possibile che, per un istante, le cariche si separino, creando così un dipolo istantaneo. Un fenomeno di questo tipo avviene, ad esempio, anche nei gas nobili, i quali, a temperatura estremamente bassa, possono diventare liquidi e persino solidi, a testimonianza dell’esistenza di forze di legame, sia pur debolissime, tra i loro atomi. Prendiamo ad esempio un atomo di elio, che possiede due protoni e due elettroni; normalmente il moto casuale degli elettroni intorno al nucleo impedisce che il centro delle cariche positive sia distinto da quello delle cariche negativa, per cui tale atomo, normalmente, non è un dipolo. Tuttavia, se per un istante i due elettroni vengono a trovarsi dalla stessa parte rispetto al nucleo dell’atomo, il centro delle cariche positive (posto nel nucleo) è distinto da quello delle cariche negative (posto sugli elettroni) e l’atomo diventa così un esempio di dipolo istantaneo. Se tale fenomeno si verifica anche in un altro atomo vicino, tra i due dipoli istantanei (vedi figura) può crearsi un legame dipolo istantaneo – dipolo istantaneo. In altri casi invece la polarizzazione delle molecola può essere indotta dall’esterno, generando così un dipolo indotto, ovvero una molecola non polare, che diventa temporaneamente polare a causa della separazione di cariche causata da un oggetto vicino. Questo fenomeno prende il nome di induzione elettrostatica. L’oggetto inducente (che cioè induce la polarizzazione nella molecola adiacente) può essere, ad esempio, uno ione o un dipolo, ma in ogni caso deve presentare una concentrazione di cariche elettriche, che indice la separazione temporanea delle cariche nell’oggetto indotto. Il dipolo indotto può a sua volta indurre la polarizzazione in altre molecole a lui vicine e legarsi ad esse con un legame dipolo indotto – dipolo indotto. Se invece il dipolo indotto si lega ad un dipolo istantaneo si realizza un legame dipolo istantaneo – dipolo indotto. Questi fenomeni sono temporanei, ma interessano tutte le molecole della sostanza; non è possibile stabilire esattamente quanti dipoli si formano in ogni istante, ma è plausibile che ce ne siano sempre abbastanza per formare legami, i quali spiegano come, sia pur a temperatura estremamente basse, anche le molecole non polari, ed i gas nobili, possano esistere allo stato liquido o solido.
 Un altro esempio di legami di questo tipo lo troviamo nello iodio elementare, la cui molecola, di formula I2, è naturalmente non polare; nonostante ciò, proprio a causa dei legami tra dipoli indotti e dipoli istantanei, lo iodio elementare è solido. I legami di questo tipo aumentano di intensità all’aumentare delle dimensioni delle molecole coinvolte, che diventano più facilmente polarizzabili. Tra gli elementi del settimo gruppo, che allo stato elementare formano tutte molecole biatomiche, i primi due, fluoro e cloro, sono gassosi, il terzo, il bromo, è liquido, mentre il quarto, lo iodio appunto, è solido. Tale andamento si verifica proprio perché scendendo lungo un gruppo aumentano le dimensioni degli atomi.
Un altro esempio di legami di questo tipo lo troviamo nello iodio elementare, la cui molecola, di formula I2, è naturalmente non polare; nonostante ciò, proprio a causa dei legami tra dipoli indotti e dipoli istantanei, lo iodio elementare è solido. I legami di questo tipo aumentano di intensità all’aumentare delle dimensioni delle molecole coinvolte, che diventano più facilmente polarizzabili. Tra gli elementi del settimo gruppo, che allo stato elementare formano tutte molecole biatomiche, i primi due, fluoro e cloro, sono gassosi, il terzo, il bromo, è liquido, mentre il quarto, lo iodio appunto, è solido. Tale andamento si verifica proprio perché scendendo lungo un gruppo aumentano le dimensioni degli atomi.
I legami che si instaurano tra le molecole di un liquido sono gli stessi che permettono l’esistenza dei solidi, anche se le forze di attrazione sono di minore entità. Nei liquidi formati da molecole polari i legami sono del tipo dipolo – dipolo, mentre nei liquidi non polari, come ad esempio il bromo, ma anche l’olio, i legami sono del tipo che abbiamo appena visto per lo iodio o l’elio..
A questo punto risulta quindi chiaro come le caratteristiche del legame che si forma tra le varie molecole siano fondamentali nel determinare non solo le proprietà chimiche delle sostanze, ma anche il loro stato fisico.
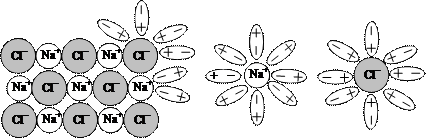 Il legame ione – dipolo Come sappiamo l’acqua scioglie il cloruro di sodio, ma anche moltissimi altri composti ionici. Ciò avviene perché gli ioni attirano verso di se le molecole polari dell’acqua, che si dispongono col loro polo negativo verso il cationee con il polo positivo verso l’anione. Risentendo della carica elettrica delle molecole dipolari, gli ioni si separano tra loro ed entrano in soluzione; all’interno di questa ogni ione è circondato dalle molecole polari, che rivolgono verso di esso il proprio polo con segno opposto rispetto a quello dello ione medesimo. I liquidi polari riescono a sciogliere solidi ionici o polari, ma non riescono però a sciogliere liquidi o solidi apolari.
Il legame ione – dipolo Come sappiamo l’acqua scioglie il cloruro di sodio, ma anche moltissimi altri composti ionici. Ciò avviene perché gli ioni attirano verso di se le molecole polari dell’acqua, che si dispongono col loro polo negativo verso il cationee con il polo positivo verso l’anione. Risentendo della carica elettrica delle molecole dipolari, gli ioni si separano tra loro ed entrano in soluzione; all’interno di questa ogni ione è circondato dalle molecole polari, che rivolgono verso di esso il proprio polo con segno opposto rispetto a quello dello ione medesimo. I liquidi polari riescono a sciogliere solidi ionici o polari, ma non riescono però a sciogliere liquidi o solidi apolari.
Questo è il motivo per il quale, ad esempio, l’acqua non scioglie l’olio, come ben sanno tutti coloro che hanno cercato di lavarsi le mani unte senza sapone. Per sciogliere l’olio, che è appunto un liquido apolare, è necessaria un’altra sostanza apolare, come ad esempio la benzina o la trielina, utilizzata proprio per togliere le macchie di unto dai vestiti. Analogamente lo iodio, altro composto apolare, non si scioglie in acqua, ma in alcool o in altri liquidi non polari. Lo zucchero invece, le cui molecole sono legate da legami idrogeno, si scioglie in acqua, ma non nella trielina. Queste conoscenze erano già note possedute agli albori della chimica ed erano state riassunte nella massima latina similia similibus solvuntur.
L’energia di legame
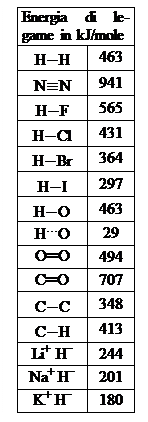 I vari tipi di legame che possono formarsi tra due atomi non sono uguali tra loro, soprattutto per quanto riguarda la loro energia di legame, ovvero l’energia che si deve impiegare per rompere il legame stesso e separare gli atomi. Un legame chimico che richiede molta energia sarà quindi un legame forte, mentre un legame che viene rotto con poca spesa di energia sarà un legame debole. Il concetto di energia di legame diventa in definitiva abbastanza intuitivo, se paragoniamo i legami chimici ai legami che si instaurano tra le persone nella vita di tutti i giorni. Anche questi legami “umani” possono essere più o meno forti e tanto più sono forti, tanto maggiore dovrà essere l’energia necessaria per romperli. Ad esempio, il legame tra genitori e figli è più forte del legame tra due amici ed è infatti molto più semplice, e meno traumatico, rompere i rapporti con un amico che con un genitore o con un figlio.
I vari tipi di legame che possono formarsi tra due atomi non sono uguali tra loro, soprattutto per quanto riguarda la loro energia di legame, ovvero l’energia che si deve impiegare per rompere il legame stesso e separare gli atomi. Un legame chimico che richiede molta energia sarà quindi un legame forte, mentre un legame che viene rotto con poca spesa di energia sarà un legame debole. Il concetto di energia di legame diventa in definitiva abbastanza intuitivo, se paragoniamo i legami chimici ai legami che si instaurano tra le persone nella vita di tutti i giorni. Anche questi legami “umani” possono essere più o meno forti e tanto più sono forti, tanto maggiore dovrà essere l’energia necessaria per romperli. Ad esempio, il legame tra genitori e figli è più forte del legame tra due amici ed è infatti molto più semplice, e meno traumatico, rompere i rapporti con un amico che con un genitore o con un figlio.
![]() Tanto maggiore è il legame che lega tra loro gli atomi di un composto, tanto più stabile sarà il composto medesimo; esso infatti per trasformarsi dovrà rompere i suoi legami, cosa non facile se questi sono forti. Tale concetto ci tornerà molto utile quando studieremo le reazioni chimiche, trasformazioni che si verificano perché i legami esistenti tra i reagenti si rompono e gli atomi così liberati si legano in modo diverso originando nuove sostanze dette prodotti. Le sostanze con legami più forti reagiranno infatti più difficilmente, mentre le sostanze con legami più deboli reagiranno invece più facilmente.
Tanto maggiore è il legame che lega tra loro gli atomi di un composto, tanto più stabile sarà il composto medesimo; esso infatti per trasformarsi dovrà rompere i suoi legami, cosa non facile se questi sono forti. Tale concetto ci tornerà molto utile quando studieremo le reazioni chimiche, trasformazioni che si verificano perché i legami esistenti tra i reagenti si rompono e gli atomi così liberati si legano in modo diverso originando nuove sostanze dette prodotti. Le sostanze con legami più forti reagiranno infatti più difficilmente, mentre le sostanze con legami più deboli reagiranno invece più facilmente.
Una volta però che il legame è stato rotto, dove finisce l’energia impiegata per romperlo? Poiché l’energia non può essere ne’ creata, ne’ distrutta, essa resta immagazzinata negli atomi isolati, che avranno quindi alta energia e che ce la restituiranno se il legame si forma di nuovo .
L’energia di legame dipende da tre fattori: le dimensioni degli atomi legati, il tipo di legame ed il numero di legami esistenti tra essi. Il legame è formato infatti dagli elettroni più esterni: se gli atomi sono piccoli gli elettroni di legame sono più vicini ai nuclei e risentono quindi maggiormente della loro attrazione; quanto viceversa gli atomi sono grandi, gli elettroni di legame sono più distanti dai nuclei e ne sono pertanto attratti più debolmente. Un legame tra atomi piccoli è quindi più forte di uno tra atomi grandi: ecco come si spiega la diminuzione della forza del legame tanto tra i composti covalenti dell’idrogeno con gli elementi del settimo gruppo, quanto tra i composti ionici dell’idrogeno con gli elementi del primo gruppo. Per quanto riguarda invece l’influenza del tipo di legame, già abbiamo detto che il legame covalente, presente all’interno delle molecole, è più forte dei legami esistenti tra una molecola e l’altra. Ecco quindi, ad esempio, perché il legame covalente tra idrogeno e ossigeno (rappresentato in tabella con H−O) e più forte del legame a ponte d’idrogeno presente tra gli stessi atomi (che in tabella viene rappresentato con H¼O). Per il legame covalente, infine, appare logico che un legame triplo sia più forte di uno doppio e che questo ultimo sia a sua volta più forte di un legame singolo.
Le sostanze in cui è presente un legame di questo tipo sono infatti gassose, liquide o solide a bassa temperatura di fusione
In natura tutto tende spontaneamente verso la minima energia e la massima stabilità. Una dimostrazione di ciò la si ricava, ad esempio, dal fatto che gli oggetti cadono sempre verso il basso (riducendo così la loro energia potenziale) ed assumono cadendo una posizione in genere più stabile di quella che avevano prima.
Fonte: http://www.liceodavincifi.it/_Rainbow/Documents/LEGAMI%20CHIMICI%201.doc
Autore : non identificabile dal documento
Legami chimici
Visita la nostra pagina principale
Legami chimici
Termini d' uso e privacy