Analisi della configurazione elettronica nella tabella periodica
Analisi della configurazione elettronica nella tabella periodica
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Analisi della configurazione elettronica nella tabella periodica
Se prendiamo in considerazione i diversi elementi a partire dall'idrogeno in ordine di numero atomico crescente possiamo osservare come al crescere di un'unità nel valore del numero atomico venga aggiunto un elettrone alla configurazione elettronica.
Ogni qual volta una serie di elementi ha sistemato abbastanza elettroni da riempire un livello energetico, gli elementi successivi, che iniziano a riempire il successivo livello energetico, vengono disposti in una riga sottostante, detta periodo, in modo tale che risultino incolonnati con gli elementi che presentano la stessa configurazione elettronica superficiale.
In questo modo il numero dei periodi che si producono (7) corrisponde al numero dei livelli energetici riempibili e quindi al valore del numero quantico principale.
Gli elementi che si incolonnano verticalmente formano i cosiddetti gruppi, composti da elementi che presentano un egual numero di elettroni disposti sullo stesso tipo di orbitali, ma naturalmente su di un diverso livello energetico. Poichè il comportamento chimico di un elemento dipende essenzialmente proprio dalla sua configurazione elettronica superficiale, elementi appartenenti ad uno stesso gruppo presentano forti analogie e somiglianze chimiche (stesso tipo di reazioni).
Le caratteristiche chimiche variano dunque progressivamente e con continuità mentre ci spostiamo lungo un periodo, mentre rimangono sostanzialmente simili all'interno di un gruppo.
Possiamo inoltre suddividere la tabella periodica in quattro grandi regioni che rappresentano raggruppamenti di elementi che stanno inserendo elettroni in orbitali dello stesso tipo.
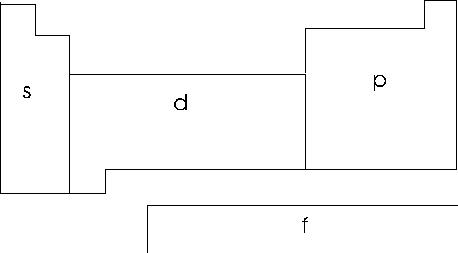
La prima regione è formata dai gruppi I A e II A dove si riempie l'orbitale s.
La regione all'estrema destra, composta dai rimanenti 5 gruppi A e dal gruppo 0 (zero) è costituita dagli elementi che distribuiscono i sei elettroni nei tre orbitali p.
La regione centrale, costituita da 10 file verticali riunite a formare 8 gruppi B, è formata dai cosiddetti metalli di transizione, elementi che stanno disponendo 10 elettroni nei 5 orbitali d.
Infine la regione in basso, formata da due serie orizzontali chiamate rispettivamente serie dei lantanidi e degli attinidi, è costituita da elementi che stanno distribuendo 14 elettroni nei 7 orbitali f (4f e 5f).
Il numero d'ordine di ciascun gruppo indica quanti elettroni sono presenti nel livello energetico superficiale, dandoci quindi una prima indicazione di massima sul numero di elettroni disponibili per i legami chimici.
Così tutti gli elementi del primo gruppo A presentano configurazione elettronica superficiale ns1, dove n indica evidentemente il numero quantico principale.
Possiamo dunque costruire il seguente schema che ci permette di correlare ciascun gruppo A con la configurazione elettronica superficiale degli elementi appartenenti al gruppo stesso.
gruppo configurazione numero
elettronica di
superficiale elettroni
I A ns1 1
II A ns2 2
III A ns2 np1 3
IV A ns2 np2 4
V A ns2 np3 5
VI A ns2 np4 6
VII A ns2 np5 7
0 ns2 np6 8
I gas nobili, appartenenti al gruppo zero, saturano con 8 elettroni l'orbitale s e i tre orbitali p del proprio livello. Tale configurazione elettronica (configurazione dell'ottetto) risulta particolarmente stabile e determina la caratteristica inerzia chimica di tali elementi.
Molte reazioni chimiche possono essere spiegate con la tendenza di un elemento a perdere o acquistare elettroni (a seconda della sua posizione nella tabella periodica) per raggiungere la configurazione stabile del gas nobile che lo segue o lo precede nella tabella periodica.
I gruppi B vengono ordinati in analogia ai gruppi A. Il primo gruppo B che si forma viene detto III B e non I B in quanto la sua configurazione superficiale presenta 3 elettroni, 2 nell'orbitale s e 1 nell'orbitale d, in modo analogo a quanto avviene per gli elementi del gruppo III A.
Tranne alcune eccezioni anche per i gruppi B vale la regola che il numero d'ordine indica il numero di elettroni presenti nello strato più superficiale.
I lantanidi e gli attinidi hanno caratteristiche chimiche simili rispettivamente al lantanio e all'attinio e si suole perciò considerarli appartenenti al gruppo III B.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Analisi della configurazione elettronica nella tabella periodica tipo file : doc
Analisi della configurazione elettronica nella tabella periodica
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Analisi della configurazione elettronica nella tabella periodica utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Analisi della configurazione elettronica nella tabella periodica
Termini d' uso e privacy