Bilanciamento delle reazioni chimiche
Bilanciamento delle reazioni chimiche
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Bilanciamento delle reazioni chimiche
La stechiometria (dal gr. stoikeion = elemento, sostanza fondamentale) è lo studio delle relazioni numeriche e dei rapporti ponderali che intercorrono tra le sostanze chimiche durante le reazioni.
Bilanciamento delle reazioni chimiche
Le equazioni chimiche sono la rappresentazione simbolica delle reazioni chimiche, cioè dei processi in cui una o più sostanze, dette reagenti, si trasformano in altre, dette prodotti di reazione.
Un'equazione in cui compaiano a sinistra del segno di reazione () le formule dei reagenti e a destra le formule dei prodotti di reazione, ha solamente significato qualitativo.
Affinchè la reazione acquisti anche un significato quantitativo, in modo da permettere il calcolo delle quantità delle sostanze che partecipano alla reazione, è necessario che la reazione venga bilanciata.
Bilanciare una reazione significa porre dinanzi alla formula di ciascuna sostanza un numero, detto coefficiente stechiometrico, in modo che ogni elemento compaia a destra e a sinistra del segno di reazione con lo stesso numero di atomi e venga così soddisfatto il principio di conservazione della massa.
Per bilanciare una reazione non vi sono regole precise, ma in genere è opportuno seguire i seguenti consigli:
1) Si pareggia inizialmente un elemento che non sia l'idrogeno o l'ossigeno.
2) se bilanciando tale elemento si modifica qualche altro elemento, si procede subito al suo bilanciamento
3) bilanciati tutti gli elementi, si procede a bilanciare l'idrogeno ed infine l'ossigeno
Bilanciamo ad esempio la seguente reazione
Fe2(CO3)3 + HNO3 ® Fe(NO3)3 + H2CO3
Iniziamo bilanciando il ferro:
poichè vi è un atomo di ferro tra i prodotti di reazione e 2 tra i reagenti, moltiplichiamo per 2 il nitrato ferrico ponendogli davanti un coefficiente "2".
Fe2(CO3)3 + HNO3 ® 2Fe(NO3)3 + H2CO3
in tal modo abbiamo modificato anche il numero di atomi di azoto tra i prodotti di reazione che ora sono 6. Poichè tra i reagenti vi è un solo atomo di azoto, poniamo un coefficiente "6" davanti all'acido nitrico
Fe2(CO3)3 + 6HNO3 ® 2Fe(NO3)3 + H2CO3
Ora sia il ferro che l'azoto sono bilanciati. Bilanciamo il carbonio. Vi sono 3 atomi di carbonio tra i reagenti e 1 tra i prodotti di reazione. Poniamo quindi un coefficiente "3" davanti all'acido carbonico
Fe2(CO3)3 + 6HNO3 ® 2Fe(NO3)3 + 3H2CO3
Verifichiamo l'idrogeno. 6 atomi tra i reagenti, 6 atomi tra i prodotti di reazione. L'idrogeno è bilanciato.
Verifichiamo l'ossigeno. 27 atomi tra i reagenti, 27 tra i prodotti di reazione. L'equazione è bilanciata!
Una volta che l'equazione è bilanciata siamo in grado di effettuare considerazioni di tipo quantitativo sulla reazione.
Nel caso della reazione appena bilanciata possiamo ad esempio affermare che una molecola di carbonato ferrico Fe2(CO3)3 necessita di 6 molecole di acido nitrico HNO3 per reagire e che da tale reazione si producono 2 molecole di nitrato ferrico Fe(NO3)3 e 3 di acido carbonico H2CO3.
Inoltre, a seguito della proporzionalità esistente tra numero di molecole e numero di moli, i coefficienti stechiometrici rappresentano contemporaneamente anche il numero di moli di ciascuna sostanza, coinvolte nella reazione chimica.
Ciò è fondamentale poichè ci permette di trasformare i rapporti numerici in proporzioni ponderali, consentendoci di calcolare le quantità in peso che partecipano alle reazioni chimiche.
Ad esempio, dopo aver calcolato il peso molare delle diverse specie chimiche,
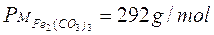
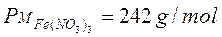
possiamo calcolare quanti grammi di ciascun composto partecipano alla reazione chimica, moltiplicando il peso molare di ciascuno per il numero di moli con cui ciascuna sostanza compare nella reazione.
Possiamo in definitiva affermare che
292 g di carbonato ferrico (1 mole x 292 g/mol) reagiscono con 378 g di acido nitrico (6 moli x 63 g/mol) per dare 484 g di nitrato ferrico (2 moli x 242 g/mol) e 186 g di acido carbonico (3 moli x 62 g/mol).
Reazioni di ossidoriduzione
ossidazione
Un elemento chimico si ossida quando, durante una reazione, il suo numero di ossidazione aumenta. Una reazione di ossidazione comporta quindi un trasferimento di elettroni. L'elemento che si ossida perde tanti elettroni quanti sono indicati dalla variazione del suo numero di ossidazione.
riduzione
Un elemento chimico si riduce quando, durante una reazione, il suo numero di ossidazione diminuisce. Una reazione di riduzione comporta quindi un trasferimento di elettroni. L'elemento che si riduce acquista tanti elettroni quanti sono indicati dalla variazione del suo numero di ossidazione.
E' allora evidente che quando, durante una reazione chimica, un elemento si ossida, perdendo elettroni, dovrà esistere un altro elemento che, acquistandoli, si riduce. Le reazioni di ossidazione e di riduzione devono perciò necessariamente avvenire contemporaneamente. Si parla pertanto di rezioni di ossidoriduzione o di reazioni redox.
Bilanciare una reazione redox è più complicato che bilanciare una reazione in cui non vi è trasferimento di elettroni.
In generale per bilanciare una reazione redox è necessario porre davanti agli elementi che si ossidano e che si riducono dei coefficienti tali da garantire l'eguaglianza tra il numero di elettroni persi da un elemento ed il numero di elettroni acquistati dall'altro.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Bilanciamento delle reazioni chimiche tipo file : doc
Bilanciamento delle reazioni chimiche
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Bilanciamento delle reazioni chimiche utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Bilanciamento delle reazioni chimiche
Termini d' uso e privacy