Concentrazione di una soluzione
Concentrazione di una soluzione
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Concentrazione di una soluzione
SOLUZIONI
Una soluzione è un sistema omogeneo di due o più componenti solidi, liquidi o gassosi, in cui i componenti sono presenti allo stato atomico o molecolare e risultano pertanto inosservabili.
Per definizione si chiama solvente la sostanza presente in quantità maggiore e soluto (o soluti) la sostanza (o le sostanze) presente in minor quantità.
Le soluzioni gassose (gas in gas) vengono normalmente dette miscele gassose.
Le soluzioni solide sono dette leghe.
Noi ci occuperemo delle soluzioni liquide in cui un soluto (solido, liquido o gassoso) si scioglie in un liquido ed essenzialmente delle soluzioni acquose, in cui il solvente è l'acqua.
Concentrazione di una soluzione
La concentrazione esprime la quantità relativa dei soluti rispetto al solvente. La concentrazione di un soluto si indica mettendo tra parentesi quadre la formula chimica. Ad esempio [H2SO4] si legge "concentrazione dell'acido solforico". Esistono diversi modi per esprimere la concentrazione di una soluzione.
1) Percentuale in peso C(p/p)
E' il rapporto percentuale tra il peso del soluto ed il peso della soluzione (grammi di soluto per 100 g di soluzione)
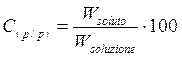
2) Percentuale in volume C(v/v)
E' il rapporto percentuale tra il volume del soluto ed il volume della soluzione (ml di soluto per 100 ml di soluzione). Viene spesso utilizzata nelle soluzioni in cui tutti i componenti sono liquidi. La gradazione delle bevande alcoliche è ad esempio espressa come percentuale in volume.
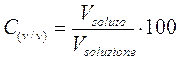
3) Rapporto peso-volume C(p/v)
E' il rapporto tra il peso del soluto espresso in grammi ed il volume della soluzione espresso in litri (g/l).
4) Frazione molare (c)
E' il rapporto tra il numero di moli di soluto ed il numero di moli totali.
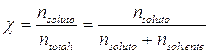
5) Molarità (M)
E' il rapporto tra il numero di moli di soluto ed il volume della soluzione espresso in litri. Indica il numero di moli di soluto presenti in un litro di soluzione (mol/l).
6) Molalità (m)
E' il rapporto tra il numero di moli di soluto ed il peso del solvente espresso in Kg. Indica il numero di moli di soluto presenti per chilogrammo di solvente (mol/Kg)
7) Normalità (N)
E' il rapporto tra il numero di equivalenti di soluto ed il volume della soluzione espresso in litri. Indica quanti equivalenti sono presenti in un litro di soluzione (eq/l).
Un equivalente o grammo-equivalente (gr-equivalente) o peso-equivalente (Peq) è una quantità, espressa in grammi, il cui valore dipende dal tipo di sostanza e dal tipo di reazione.
a) Nel caso di una reazione redox il peso-equivalente è il rapporto tra il peso molare della sostanza che si ossida (o si riduce) e il numero di elettroni persi (o acquistati)
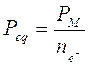
Calcoliamo ad esempio il peso equivalente dell'anidride solforosa, nelle seguenti 2 reazioni redox
1) SO2 + O2 ® SO3
2) SO2 + Fe2O3 ® FeS2 + O2
Nella prima lo zolfo si ossida passando da nox +4 a nox +6 con una perdita di 2 elettroni. Il peso equivalente dell'anidride solforosa sarà quindi in questa reazione
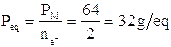
nella seconda lo zolfo si riduce passando da nox +4 a nox -1 con un acquisto di 5 elettroni. Il peso equivalente dell'anidride solforosa in questa seconda reazione sarà dunque
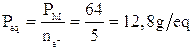
b) nel caso di una dissociazione di un acido (o di una base), il peso-equivalente è il rapporto tra il peso molare ed il numero di ioni H+ (o OH-)
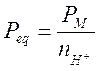
Ad esempio calcoliamo il valore del peso equivalente dell'acido ortofosforico relativamente alle seguenti due reazioni di dissociazione
1) H3PO4 ® 2H+ + HPO42-
2) H3PO4 ® 3H+ + PO43-
Nella prima in cui si liberano solo 2 ioni H+ il peso equivalente vale
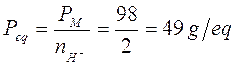
Nella seconda in cui si liberano 3 ioni H+ il peso equivalente vale
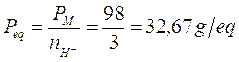
c) nel caso di una dissociazione di un sale, il peso-equivalente è il rapporto tra il peso molare ed il numero delle cariche positive (o negative) prodotte dalla dissociazione
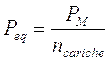
Calcoliamo ad esempio il peso equivalente del solfato ferrico nella seguente reazione
Fe2(SO4)3 ® 2Fe3+ + 3SO42-
Poichè vengono liberate complessivamente 6 cariche positive (o 6 negative) il peso equivalente risulta
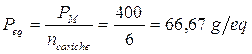
E' evidente che il peso equivalente ha un significato fisico analogo al peso molare. Se il peso molare è una quantità in grammi di una sostanza che contiene un numero di avogadro di particelle, il peso equivalente è una quantità in grammi di una sostanza in grado di mettere in gioco, a seconda delle circostanze, un numero di Avogadro di elettroni, di ioni H+ ( o OH-) o di cariche ioniche positive (o negative).
Ora, allo stesso modo in cui si calcola il numero di moli (n) facendo il rapporto tra il peso in grammi (W) ed il peso di una mole (PM), si può calcolare il numero di equivalenti (neq) facendo il rapporto tra il peso in grammi di una sostanza ed il peso di un equivalente (Peq).
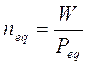
Per esemplificare quanto detto calcoliamo la Molarità e la Normalità di 2,3 l di una soluzione contenente 45 g di Cloruro di Magnesio MgCl2.
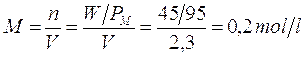
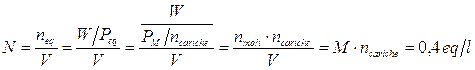
Da cui si deduce che per calcolare la Normalità di una soluzione è sufficiente moltiplicare il valore della Molarità per il numero di cariche ioniche (o di elettroni o di ioni H+) messe in gioco.
L'uso della Normalità permette di calcolare direttamente le quantità di sostanze che partecipano ai processi chimici senza bisogno di bilanciare la reazione. Infatti è facilmente verificabile che in qualsiasi reazione 1 equivalente di una sostanza reagisce sempre con un equivalente di qualsiasi altra sostanza che partecipi alla reazione.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Concentrazione di una soluzione tipo file : doc
Concentrazione di una soluzione
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Concentrazione di una soluzione utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Concentrazione di una soluzione
Termini d' uso e privacy