Distribuzione delle velocità Maxwelliana
Distribuzione delle velocità Maxwelliana
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Distribuzione delle velocità Maxwelliana
Secondo la teoria cinetica la velocità così calcolata rappresenta naturalmente solo un valore medio in quanto all'interno del gas le particelle possono assumere valori di velocità molto differenti dal valore medio.
Partendo dall'ipotesi che le particelle si scambino continuamente quantità di moto a causa dei loro urti reciproci e casuali, Maxwell dimostrò che all'interno del gas si stabilisce alla fine un equilibrio dinamico in cui è possibile calcolare la probabilità che una particella possieda una certa velocità, diversa dalla velocità media.
Maxwell ottenne così una relazione matematica, nota come funzione di distribuzione delle velocità o maxwelliana, che esprime la frazione di molecole
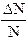 (da 0 ad 1) che possiedono una certa velocità.
(da 0 ad 1) che possiedono una certa velocità.
Naturalmente, essendo la frequenza una misura della probabilità (in questo caso una misura molto buona essendo le particelle molto numerose) , la relazione di Maxwell ci permette di calcolare anche la probabilità che una particella possieda una determinata velocità.
La forma di tale distribuzione dipende essenzialmente dalla massa (m) della particella e dalla temperatura assoluta T.
o, operando un cambio di variabile e ricordando che 
Tenendo presente che k = R/N ed m = Pm/N, facendo le opportune sostituzioni si ottiene
Da tale relazione è possibile ottenere, oltre alla velocità quadratica media, che coincide ovviamente con il valore che abbiamo già calcolato, anche la velocità media 

e la velocità più frequente (e quindi più probabile) che coincide con il massimo della curva (conosciuto in statistica come "moda")
Le tre velocità presentano valori molto vicini che stanno nel seguente rapporto
quadratica : media : moda = 1 : 0.9213 : 0.8165
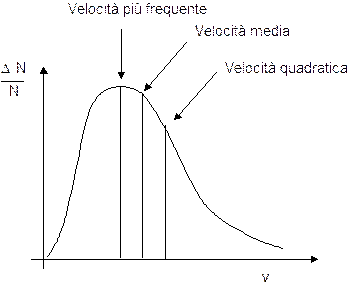
La forma e la posizione della curva rispetto agli assi dipende dai valori della temperatura e del peso molare del gas.
Possiamo ad esempio notare come la velocità più frequente (ma anche la velocità media e la velocità quadratica) sia proporzionale al rapporto T/PM.
All'aumentare del peso molare la curva si sposta verso sinistra (verso velocità minori).
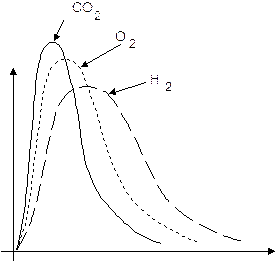
Così alla temperatura di 20°C le molecole di idrogeno (Pm = 2) viaggiano ad una velocità media di 1760 m/s, le molecole di ossigeno (Pm = 32) a 440 m/s, mentre le molecole di anidride carbonica (Pm = 44) ad una velocità media di 375 m/s.
Le variazioni di temperatura producono un effetto opposto.
All'aumentare della temperatura la curva si sposta verso destra e le molecole possiedono quindi mediamente una velocità superiore.

Come si può notare i movimenti della curva in orizzontale si accompagnano a delle variazioni dell'ampiezza della curva stessa. Quando il massimo della curva si sposta verso sinistra (velocità medie basse) le particelle presentano valori di velocità meno dispersi, concentrandosi in un intervallo più ristretto. Viceversa quando il massimo della curva si sposta verso destra (velocità medie elevate) le particelle presentano valori di velocità più dispersi, distribuiti in un intervallo maggiore.
In altre parole all'aumentare della temperatura e al diminuire del peso molare aumenta la percentuale di molecole che presentano valori di velocità molto distanti dal valore medio.
In statistica il parametro che misura la dispersione dei valori intorno ai valori centrali (ampiezza della distribuzione di frequenza) è lo scarto quadratico medio (). Più elevato è il suo valore, più dispersi sono i valori intorno alla media.
Lo scarto quadratico medio è pari alla radice quadrata della differenza tra media quadratica e media aritmetica. Utilizzando la velocità quadratica media e la velocità media la relazione diventa
Che ci conferma come la dispersione della curva aumenti all'aumentare della temperatura e al diminuire del peso molare.
Si noti infine che, poichè l'area sottesa alla curva (integrale della funzione) rappresenta il numero totale delle particelle (somma di tutte le frequenze), essa è costante ed il suo valore deve sempre essere pari ad 1.
Per questo motivo quando la dispersione aumenta la curva necessariamente si abbassa, in modo che l'area sottesa non vari.
Ciò significa che per temperature superiori e/o pesi molari inferiori diminuisce la percentuale di molecole che presentano valori di velocità vicini al valore medio.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Distribuzione delle velocità Maxwelliana tipo file : doc
Distribuzione delle velocità Maxwelliana
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Distribuzione delle velocità Maxwelliana utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Distribuzione delle velocità Maxwelliana
Termini d' uso e privacy