Effetto dello ione comune
Effetto dello ione comune
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Effetto dello ione comune
E' il caso ad esempio dell'aggiunta alla soluzione di un sale (o di un generico elettrolita poco solubile) di un elettrolita molto solubile che abbia con il primo uno ione in comune.
Per il principio di Le Chatelier l'equilibrio di solubilità del sale poco solubile si sposterà allora verso sinistra, con formazione di sale indissociato insolubile, il quale precipita.
Il valore di kps rimane naturalmente invariato, mentre, per effetto della precipitazione, diminuisce la solubilità del sale.
Vediamo ad esempio come varia la solubilità del cloruro di argento (kps = 1,56.10-10) se ad un litro di soluzione satura vengono aggiunte 10-2 moli di HCl.
L'equilibrio di solubilità del cloruro di argento è
AgCl(s) Ag+(l) + Cl-(l)
tenendo conto che per ogni X moli ad AgCl che si dissociano si formano X moli di ioni Ag+ e X moli di ioni Cl-, il prodotto di solubilità vale
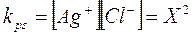
e la sua solubilità iniziale è
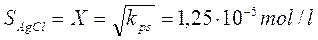
Se ora introduciamo nella soluzione 10-2 moli di acido cloridrico, ciò equivale ad aggiungere 10-2 moli di ioni H+ e 10-2 moli di ioni Cl-.
Parte degli ioni Cl- si uniranno con gli ioni Ag+ presenti in soluzione per ridare AgCl indissociato (che precipita), fino al punto in cui non venga nuovamente rispettato il valore di kps.
All'equilibrio dovranno rimanere in soluzione Y ioni Ag+ e (10-2 + Y) ioni Cl- in modo che il loro prodotto sia uguale a kps. Possiamo allora scrivere
Tenendo infine conto che Y dovrà essere minore di X e quindi trascurabile rispetto a 10-2, possiamo scrivere
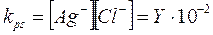
che risolta fornisce
Y = [Ag+] = 1,56.10-8 mol/l,
la concentrazione degli ioni Cl- sarà naturalmente pari a [Cl-] = 10-2 + 1,56.10-8 = 10-2 mol/l
mentre la solubilità del sale sarà naturalmente pari alla concentrazione dello ione presente in quantità minore e quindi SAgCl = [Ag+] = 1,56.10-8 mol/l
Come si può osservare la solubilità è diminuita di 3 ordini di grandezza, a causa della precipitazione di 1,248.10-5 (X- Y) moli di AgCl.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Effetto dello ione comune tipo file : doc
Effetto dello ione comune
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Effetto dello ione comune utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Effetto dello ione comune
Termini d' uso e privacy