Elettrolisi e celle elettrolitiche
Elettrolisi e celle elettrolitiche
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Elettrolisi e celle elettrolitiche
Come abbiamo già avuto modo di dire l'elettrolisi è un processo in cui energia elettrica viene impiegata per far avvenire una reazione redox che si produrrebbe spontaneamente in senso opposto.
Se immergiamo due elettrodi collegati ad un generatore di corrente continua in un recipiente che contenga NaCl fuso (e quindi dissociato in ioni Na+ e Cl-), gli ioni Na+ vengono attratti dall'elettrodo negativo dove si riducono acquistando un elettrone, mentre gli ioni Cl- vengono attratti dall'elettrodo positivo al quale cedono il loro elettrone ossidandosi.
Poichè in questo caso la reazione di riduzione avviene all'elettrodo negativo questo prende il nome di catodo, mentre l'elettrodo positivo, dove avviene l'ossidazione, è l'anodo.
Si noti che i segni risultano opposti rispetto ad una pila.
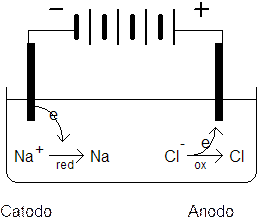
Dunque al catodo gli ioni Na+ si riducono a sodio metallico, mentre all'anodo glio ioni Cl- si ossidano a Cloro gassoso Cl2.
Gli elettroni fluiscono quindi dal catodo negativo all'anodo positivo in modo analogo a quanto avverrebbe se collegassimo i due elettrodi mediante un filo metallico.
La conduzione elettrica attraverso un filo metallico è detta conduzione di prima specie, mentre la conduzione che avviene grazie alle reazioni degli ioni presenti nel fluido è detta conduzione elettrolitica o di seconda specie.
Nel caso della conduzione elettrolitica gli elettroni che abbandonano il catodo non sono gli stessi che entrano nell'anodo, ma l'effetto complessivo è identico. Attraverso l'uso di un amperometro possiamo infatti verificare la presenza di una corrente elettrica che attraversa il circuito, sia che esso venga chiuso mediante un conduttore metallico, sia che venga chiuso attraverso una soluzione di elettroliti.
La reazione complessiva che avviene in soluzione è la seguente
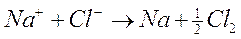
In assenza della corrente elettrica fornita dall'esterno tale reazione sarebbe naturalmente spontanea in senso contrario.
Possiamo dunque definire l'elettrolisi un processo di decomposizione di un composto, fuso o in soluzione, in cui il passaggio di corrente elettrica produce una reazione redox endoergonica.
Naturalmente solo i composti che si dissociano in ioni possono subire l'elettrolisi e per tale motivo essi sono comunemente detti elettroliti.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Elettrolisi e celle elettrolitiche tipo file : doc
Elettrolisi e celle elettrolitiche
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Elettrolisi e celle elettrolitiche utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Elettrolisi e celle elettrolitiche
Termini d' uso e privacy