Evaporazione e tensione di vapore
Evaporazione e tensione di vapore
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Evaporazione e tensione di vapore
Anche le velocità delle molecole che compongono un liquido possono essere descritte tramite una distribuzione di Maxwell.
Per ciascun liquido esiste un valore di velocità critico (Vc), che dipende essenzialmente dalla natura chimica della sostanza e dall'intensità delle forze intermolecolari, oltre il quale le molecole possiedono energia cinetica sufficiente per abbandonare la superficie del liquido e passare allo stato di vapore.
Tale processo interessa solo le molecole sufficientemente energetiche che si trovano sulla superficie del liquido ed è detto evaporazione.
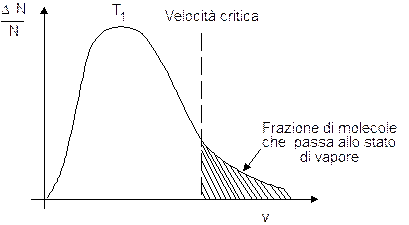
Aumentando la temperatura del liquido la maxwelliana si sposta verso destra ed una frazione maggiore di molecole risulta possedere energia cinetica sufficiente per passare allo stato di vapore.
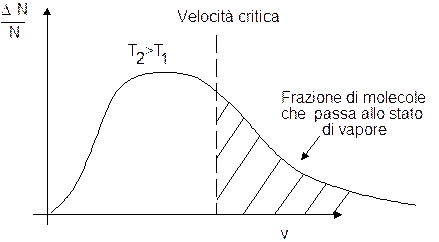
All'aumentare della temperatura il processo di evaporazione si fa più intenso.
Se poniamo un liquido all'interno di un recipiente chiuso dove abbiamo precedentemente fatto il vuoto, lo spazio non occupato dal liquido viene occupato dal suo vapore. Man mano che il processo di evaporazione procede il vapore che sovrasta la superficie del liquido si fa sempre più concentrato, essendo il recipiente chiuso, e la pressione misurabile all'interno aumenta progressivamente.
All'aumentare della concentrazione del vapore si fanno però sempre più frequenti gli urti tra le particelle gassose da una parte e tra le particelle e le pareti del recipiente dall'altra, in modo tale che un numero sempre maggiore di molecole, trasferendo quantità di moto durante gli urti, perde energia cinetica e ricade sulla superficie del liquido.
Il processo è noto come condensazione.
Si arriva quindi ad uno stato di equilibrio dinamico in cui la velocità del processo di evaporazione eguaglia la velocità del processo di condensazione. Il punto di equilibrio viene raggiunto quando la pressione del vapore cessa di aumentare.
Poichè in tale situazione possiamo ritenere che il numero di particelle che evaporano sia pari al numero di particelle che condensano, il vapore non è in grado di arricchirsi ulteriormente di particelle e viene per questo detto vapore saturo e la pressione esercitata è detta tensione di vapor saturo.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Evaporazione e tensione di vapore tipo file : doc
Evaporazione e tensione di vapore
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Evaporazione e tensione di vapore utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Evaporazione e tensione di vapore
Termini d' uso e privacy