Il MICROSCOPIO di Heisenberg
Il MICROSCOPIO di Heisenberg
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Il MICROSCOPIO di Heisenberg
Heisenberg non si limitò a dar forma matematica al principio di indeterminazione, ma cercò in qualche modo di esplicitarne il significato che esso poteva assumere, nell’ambito di una nuova teoria della conoscenza..
Egli si rese conto che mentre nel mondo macroscopico noi possiamo interagire senza limitazioni con gli oggetti della nostra conoscenza, misurarli ed ottenere informazioni da essi senza modificarli in modo sostanziale, nel mondo subatomico non è per principio possibile trascurare le perturbazioni che le nostre misure arrecano alle stesse grandezze che misuriamo.
In altre parole, mentre nella fisica classica la realtà oggettiva esiste indipendentemente dall'osservatore, nella fisica quantistica, il modo in cui decidiamo di misurare l'oggetto condiziona l'immagine stessa che di questo oggetto ci possiamo rappresentare: la realtà oggettiva non ha più esistenza autonoma a prescindere dall'osservatore.
Heisenberg illustrò questa sua convinzione attraverso un esperimento ideale.
Un esperimento ideale è un esperimento mentale in cui lo sperimentatore può immaginare qualsiasi strumento o artificio, purchè il suo funzionamento sia compatibile e non contraddica le leggi della fisica.
Heisenberg immaginò dunque di voler osservare un elettrone in movimento illuminandolo mediante una sorgente luminosa in grado di emettere un numero qualsiasi di fotoni della lunghezza d'onda desiderata.
Per poter individuare l'elettrone cominceremo con l'inviargli un fotone che abbia una lunghezza d'onda dello stesso ordine di grandezza dell'elettrone .
Secondo la fisica classica l'elettrone sparato dovrebbe seguire una traiettoria parabolica. Ma appena viene colpito dal fotone, l'elettrone cambia velocità e direzione per effetto Compton, assorbendo una certa porzione dell'energia del fotone.
A questo punto conosciamo la posizione dell'elettrone ma abbiamo perso ogni informazione sulla sua velocità e quindi sulla sua quantità di moto.
Per non disturbare la traiettoria dell'elettrone possiamo allora inviargli un fotone meno energetico, avente minor lunghezza d'onda. Ma in tal modo, diminuendo il potere di risoluzione della luce usata, perdiamo di definizione e possiamo sapere solo approssimativamente dove si trova l'elettrone, con una incertezza tanto maggiore quanto maggiore è la lunghezza d'onda utilizzata.
In prima approssimazione possiamo affermare che l'incertezza sulla posizione dell'elettrone è dell'ordine di grandezza della lunghezza d'onda della luce utilizzata
x
D'altra parte l'elettrone acquista per effetto Compton una parte dell'energia e quindi della quantità di moto del fotone. Ricordando che la quatità di moto di un fotone è pari a

l'elettrone assumerà quindi dal fotone una quantità di moto incognita il cui valore può variare da 0 a 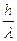 . La quantità di moto dell'elettrone presenterà quindi un'incertezza dello stesso ordine di grandezza della quatità di moto che il fotone potrebbe cedergli, pari a
. La quantità di moto dell'elettrone presenterà quindi un'incertezza dello stesso ordine di grandezza della quatità di moto che il fotone potrebbe cedergli, pari a
p 
da cui, sostituendo la lunghezza d'onda dell'elettrone con x, otteniamo
x p h
Heisenberg conclude perciò che nel campo delle particelle subatomiche è necessario rinunciare alla pretesa di determinare in modo esatto tutte le variabili del moto. Alla classica visione deterministica del mondo è dunque necessario sostituire una visione probabilistica, in accordo con l'interpretazione di Born.
Si tratta però di una probabilità diversa rispetto a quella utilizzata dai fisici della seconda metà dell'Ottocento per costruire la meccanica statistica.
In quel caso le molecole di un gas venivano descritte su basi statistico-probabilistiche solo a causa dell'incompletezza dell'informazione sulle singole particelle.
Se noi infatti conoscessimo le condizioni iniziali di ogni singola particella del gas, possibilità questa che non viene per principio negata dalla meccanica statistica, saremmo in grado di determinare qualsiasi variabile con una precisione grande a piacere.
Il principio di indeterminazione distrugge dalle fondamenta questo modo di pensare. Noi non possiamo prevedere i movimenti delle singole particelle perché siamo nell'impossibilità teorica, e non solo pratica, di conoscere con esattezza le condizioni iniziali.
Inoltre la probabilità quantistica presenta caratteristiche peculiari, di cui parleremo in seguito, rispetto alla probabilità ordinaria.
Le onde che investono una nave ancorata lasciano un'ombra d'acqua calma grazie ad un fenomeno di diffrazione, studiando il quale è possibile risalire alla forma della nave. Ma se le stesse onde investono un palo affiorante il fenomeno è insensibile. Non incontreremo invece alcuna difficoltà ad analizzare la forma del palo studiandone l'ombra prodotta da onde luminose. Il punto essenziale sta qui. Le onde possono essere usate per studiare oggetti che abbiano dimensioni maggiori o almeno dello stesso ordine di grandezza della lunghezza dell'onda usata.
Il potere risolutore di uno strumento ottico è la più piccola distanza alla quale due punti devono stare per essere visti come separati. Esso dipende essenzialmente da fenomeni di diffrazione, la cui entità e legata al diametro della più piccola apertura posta sul cammino dei raggi e alla lunghezza d'onda utilizzata. A causa del carattere ondulatorio della luce quindi non è in linea di principio mai possibile vedere distinti due oggetti che distino tra loro meno di l = d sena, dove l è la lunghezza d'onda utilizzata e a l'angolo di apertura del fascio di diffrazione.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Il MICROSCOPIO di Heisenberg tipo file : doc
Il MICROSCOPIO di Heisenberg
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Il MICROSCOPIO di Heisenberg utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Il MICROSCOPIO di Heisenberg
Termini d' uso e privacy