La geometria delle molecole teoria VSEPR e orbitali ibridi
La geometria delle molecole teoria VSEPR e orbitali ibridi
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
La geometria delle molecole teoria VSEPR e orbitali ibridi
La teoria VSEPR permette di fare delle previsioni intorno alla geometria delle molecole partendo da semplici considerazioni sulla repulsione che i doppietti elettronici superficiali esercitano reciprocamente.
La sigla VSEPR significa Valence-Shell Electron-Pairs Repulsion (repulsione tra doppietti elettronici dello strato di valenza).
Secondo tale teoria i doppietti elettronici più esterni (strato di valenza), essendo carichi negativamente, si respingono tendendo a disporsi il più lontano possibile gli uni dagli altri, in modo da rendere minima la forza repulsiva e più stabile l'intera molecola.
La teoria prevede inoltre che i doppietti elettronici liberi (non impegnati in legami) tendano ad occupare un volume maggiore rispetto ai doppietti elettronici condivisi (impegnati in legami) e esercitino in definitiva una forza repulsiva più intensa. I legami doppi e tripli vengono considerati alla stregua di legami semplici.
In prima approssimazione possiamo stilare la seguente graduatoria relativa all'intensità della repulsione esercitata tra coppie di elettroni
repulsione tra dopp. liberi > repulsione tra dopp. liberi e di legame > repulsione tra dopp. di legame
Sulla base di queste semplici premesse possiamo esemplificare alcune delle strutture geometriche molecolari previste dalla teoria
a) 2 doppietti
Il caso più semplice consiste in un atomo centrale con due coppie di elettroni. La teoria prevede in tal caso una struttura lineare con i doppietti elettronici equidistanti, a formare angoli di 180°.

Presentano struttura di questo tipo
l'anidride carbonica CO2 O = C = O
il fluoruro di berillio BeF2 F Be F
l'acido cianidrico HCN H C N
l'idruro di calcio CaH2 H Ca H
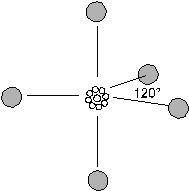
b) 3 doppietti
La teoria prevede una struttura trigonale planare con angoli di 120°.
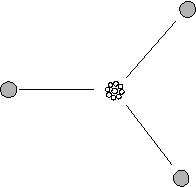
Possiedono tale struttura
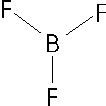
il fluoruro di boro BF3, lo ione carbonato CO32-, lo ione nitrato NO3-.
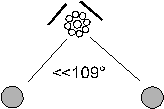
Nel caso un doppietto non sia impegnato in un legame il doppietto libero esercita una repulsione maggiore sui due doppietti impegnati, i quali si avvicinano leggermente.
Ne risulta una struttura angolare con un angolo di legame leggermente inferiore a 120°.
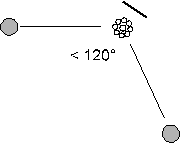
possiedono strutture di questo tipo l'anidride solforosa SO2 e l'ozono O3
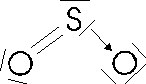
(in realtà in entrambe le strutture vi è risonanza e gli elettroni del legame sono delocalizzati su tutta la molecola).
c) 4 doppietti
La teoria prevede una struttura tetraedrica con angoli di legame di 109,5°

Hanno strutture di questo tipo il metano CH4 e lo ione solfato SO42-.
Nel caso uno dei doppietti non sia condiviso rimane una struttura a piramide triangolare, con gli angoli leggermente compressi, minori di 109,5° (intorno ai 107°).

Hanno struttura di questo tipo l'ammoniaca NH3, il tricloruro di fosforo PCl3, lo ione solfito SO32-.
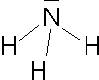
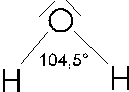
Nel caso le coppie non impegnate in legami siano 2 rimane una struttura angolare con angoli ancor più compressi (per le presenza di due doppietti liberi), intorno ai 103 - 104°.
Presentano strutture di questo tipo l'acqua H20 e l'acido solfidrico H2S.
Le strutture VSEPR con più di 4 doppietti elettronici sono più complesse, specialmente quando vi sono coppie elettroniche non impegnate in legami.
Diamo di seguito solo le strutture con più di 4 doppietti e tutte le coppie impegnate in legami.
e) 5 doppietti
La teoria prevede una struttura bipiramidale triangolare (due piramidi a base triangolare, aventi la base in comune)
Presenta una struttura di questo tipo il pentacloruro di fosforo PCl5.
f) 6 doppietti
La teoria prevede una struttura ottaedrica (due piramidi a base quadrata con la base in comune)
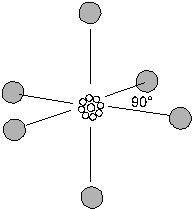
Presenta una struttura di questo tipo l'esafluoruro di zolfo SF6.
g) 7 doppietti
La teoria prevede una struttura bipiramidale pentagonale (due piramidi a base pentagonale, aventi la base in comune).
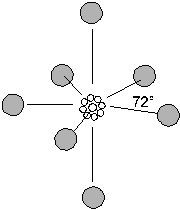
Presenta questa struttura l'eptafluoruro di iodio IF7.
Le strutture previste dalla teoria VSEPR sono state ampiamente confermate dai dati sperimentali.
L'introduzione del concetto di orbitale ibrido è una diretta conseguenza dei buoni risultati che tale teoria consente di ottenere nel prevedere la geometria delle molecole.
In altre parole se la teoria prevede per una certa molecola una struttura tetraedrica e tale struttura viene sperimentalmente confermata, diventa necessario ipotizzare che l'orbitale s e i 3 orbitali p superficiali si siano mescolati a formare 4 orbitali perfettamente identici (ibridazione sp3).
Vi è dunque una stretta corrispondenza tra geometria delle molecole e tipi di ibridazione.
geometria ibridazione
lineare sp
triangolare planare sp2
tetraedrica sp3
bipiramidale triangolare sp3 d
ottaedrica sp3 d2
bipiramidale pentagonale sp3 d3
E' bene sottolineare che una particolare ibridazione viene assegnata solo dopo che le previsioni VSEPR sulla geometria della molecola sono state sperimentalmente confermate.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : La geometria delle molecole teoria VSEPR e orbitali ibridi tipo file : doc
La geometria delle molecole teoria VSEPR e orbitali ibridi
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come La geometria delle molecole teoria VSEPR e orbitali ibridi utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
La geometria delle molecole teoria VSEPR e orbitali ibridi
Termini d' uso e privacy