Legame dativo o di coordinazione
Legame dativo o di coordinazione
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Legame dativo o di coordinazione
Da quanto abbiamo fin qui visto ci si potrebbe attendere che il numero di legami covalenti che un atomo può formare (valenza) sia sempre pari al numero di elettroni spaiati che può condividere fino al completamento dell'ottetto. In realtà ciò è vero nella maggior parte dei casi, ma non in tutti.
In alcuni casi ad esempio un legame covalente si può formare a partire da un doppietto elettronico messo a disposizione da un atomo donatore e da un orbitale vuoto messo a disposizione da un atomo accettore.
Tale legame è detto dativo e una volta formatosi è indistinguibile da un normale legame covalente.
Prendiamo ad esempio lo zolfo e l'ossigeno, entrambi appartenenti al VI gruppo A, aventi configurazione s2 p4, con due elettroni spaiati e due elettroni mancanti per raggiungere la configurazione dell'ottetto.

Ci attendiamo che si produca un doppio legame con condivisione delle due coppie di elettroni e formazione di una molecola del tipo
S = O
In realtà dalla reazione tra zolfo e ossigeno si producono due tipi di molecole diverse, l'anidride solforosa SO2 e l'anidride solforica SO3. Come possiamo dunque giustificare la capacità dello zolfo di legare altri atomi di ossigeno oltre al primo?
E' necessario prima di tutto tener presente che ogni legame in più che si forma produce un ulteriore aumento di stabilità della molecola.
Fatta questa premessa, si ritiene che l'ossigeno possa subire una transizione dalla configurazione più stabile, prevista dalla regola di Hund
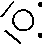
alla configurazione, meno stabile

nella quale un elettrone è stato spostato da un orbitale pz ad un orbitale py. In tal modo l'ossigeno possiede ora un orbitale pz vuoto che può utilizzare come accettore di un doppietto elettronico per formare un ulteriore legame chimico con lo zolfo.
Se lo zolfo utilizza uno solo dei suoi doppietti elettronici si forma l'anidride solforosa
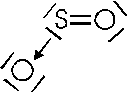
Nel caso vengano utilizzati entrambi i doppietti si forma l'anidride solforica
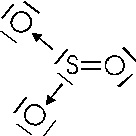
Come si può osservare, si suole rappresentare il legame dativo con una freccia che va dal doppietto elettronico messo a disposizione all'orbitale vuoto dell'atomo accettore.
L'esistenza del legame dativo ci permette di giustificare la capacità che hanno molti elementi ( in particolare gli elementi alla fine di un periodo) di formare un numero variabile di legami con l'ossigeno (valenza variabile) legandosi con esso in diverse proporzioni (legge delle proporzioni multiple di Dalton).
Il cloro, ad esempio, che possiede una configurazione superficiale s2 p5, presenta un elettrone spaiato e ben tre doppietti non condivisi disponibili per legami dativi. Si giustificano in tal modo l'esistenza di ben quattro composti ossigenati del cloro: L'anidride ipocloroso Cl2O, l'anidride clorosa Cl2O3, l'anidride clorica Cl2O5 e l'anidride perclorica Cl2O7.
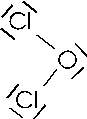
Non è necessario che un atomo liberi un orbitale per poter effettuare un legame dativo. In molti casi esistono già orbitali naturalmente liberi.
Ad esempio quando lo ione H+ si scioglie in acqua esso esiste nella forma H30+ in quanto si lega attraverso un legame dativo ad una molecola d'acqua.
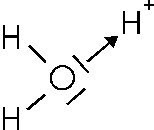
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Legame dativo o di coordinazione tipo file : doc
Legame dativo o di coordinazione
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Legame dativo o di coordinazione utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Legame dativo o di coordinazione
Termini d' uso e privacy