Legge di Raoult
Legge di Raoult
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Legge di Raoult
Il processo di evaporazione interessa, come sappiamo, solo le molecole presenti sulla superficie del liquido. In una soluzione in cui siano disciolti alcuni soluti, nelle quantità molari n1, n2, n3,.....nn, le molecole di ciascuno di essi sono distribuite in modo uniforme su tutta la massa della soluzione, e quindi anche sulla sua superficie, in modo proporzionale alla loro frazione molare (ni/ntot).
Ciascuna delle specie chimiche presenti in soluzione sarà soggetta ad un processo di evaporazione e contribuirà pertanto alla formazione di un vapore, costituito da una miscela di aeriformi. Ciascun componente la soluzione contribuirà alla tensione di vapore della soluzione in modo proporzionale alla frazione di molecole che occupano la superficie della soluzione ed alla sua maggiore o minore volatilità. In altre parole la tensione di vapore della soluzione dipenderà dalla frazione molare di ciascun componente la soluzione e dalla tensione di vapore del componente stesso.
La legge di Raoult esprime quantitativamente tale fenomeno, affermando che la tensione di vapore (P) di una soluzione, a temperatura costante è data dalla somma delle tensioni di vapore di ciascun componente la soluzione allo stato puro (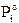 i) con cui il componente compare nella soluzione stessa.
i) con cui il componente compare nella soluzione stessa.
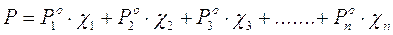
Ad esempio se misceliamo 5 moli di H2O, la cui tensione di vapore a 25°C è di 23,8 mm di Hg con 3 moli di alcool etilico, la cui tensione di vapore a 25°C è di 58,9 mm di Hg, la tensione di vapore della soluzione sarà
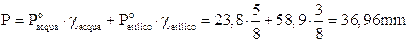
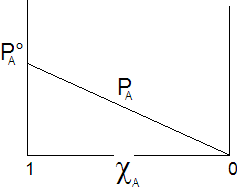
Possiamo rappresentare graficamente l'andamento della tensione di vapore nel caso di una soluzione a due componenti A e B, in funzione della loro frazione molare.
Il componente A contribuisce alla tensione di vapore totale con una tensione di vapore PA direttamente proporzionale alla sua frazione molare ed alla tensione di vapore che manifesta allo stato puro, secondo la relazione
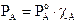
che rappresenta una retta di pendenza 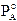 .
.
Il componente B contribuisce alla tensione di vapore totale con una tensione di vapore PA direttamente proporzionale alla sua frazione molare ed alla tensione di vapore che manifesta allo stato puro, secondo la relazione
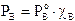
che rappresenta una retta di pendenza 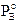 .
.
Tenendo conto che 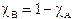 , l'equazione della retta diventa che potremo rappresentare sullo stesso grafico ottenendo
, l'equazione della retta diventa che potremo rappresentare sullo stesso grafico ottenendo
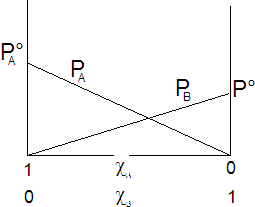
L'andamento della tensione di vapore della soluzione per tutte le possibili combinazioni di A e B può quindi essere ottenuta, secondo quanto previsto dalla legge di Raoult, sommando punto a punto gli apporti dei due componenti (PA + PB). Si ottiene
e riordinando
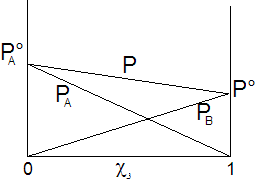
Dove si vede che il valore della tensione di vapore è sempre compreso tra quello dei due componenti allo stato puro, variando linearmente tra questi due estremi. La tensione di vapore totale è rappresentabile in un grafico che porti la frazione molare del componente B in ascissa, come una retta di pendenza e di intersezione con l'asse delle ordinate 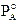 . Le soluzioni che rispettano la legge di Raoult si dicono soluzioni ideali.
. Le soluzioni che rispettano la legge di Raoult si dicono soluzioni ideali.
In moltissime soluzioni i soluti sono solidi che presentano tensioni di vapore talmente basse da poter essere trascurate. Nel caso più semplice di un unico soluto solido non volatile la legge di Raoult diventa
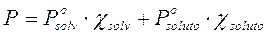
e, poichè possiamo porre 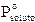 = 0, si otterrà
= 0, si otterrà
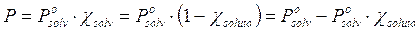
da cui
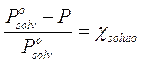
Tale relazione esprime il fatto che la presenza di molecole di soluto che non evaporano (o evaporano in modo trascurabile) alla superficie della soluzione, diminuiscono la superficie utile per l'evaporazione del solvente di una percentuale pari alla frazione molare del soluto e finiscono quindi per far diminuire la tensione di vapore del solvente della stessa percentuale.
La legge di Raoult per un soluto poco volatile afferma infatti che l'abbassamento relativo della tensione di vapore del solvente è uguale alla frazione molare del soluto.
Se ad esempio sciogliamo 100 g di saccarosio (soluto poco volatile, PM = 342 g/mol) in 500 g di H20 a 26°C ( PM = 18 g/mol, P° = 25,2 mm di Hg), possiamo calcolare di quanto si abbassa la tensione di vapore del solvente, calcolando semplicemente la frazione molare del soluto
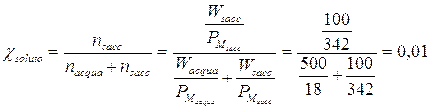
La tensione di vapore del solvente si abbassa dunque dell'1%, pari 25,2.0,01 = 0.25 mm di Hg e la tensione di vapore della soluzione sarà pari a
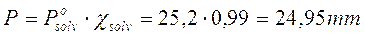
Si noti infine che se due componenti una soluzione possiedono diversa volatilità (diverse tensioni di vapore), quello più volatile tenderà ad arricchire maggiormente il vapore e la sua frazione molare nella miscela gassosa risulterà, per la legge di Dalton, superiore alla sua frazione molare nella soluzione.
Se ad esempio mescoliamo, a 25°C, 15 moli di acqua (tensione di vapore 23,8 mm) con 15 moli di alcool etilico (tensione di vapore 58,9 mm), per la legge di Raoult la tensione di vapore della soluzione sarà pari a
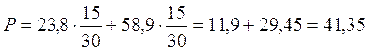
Si noti che la pressione parziale del vapor d'acqua nella miscela gassosa è di 11,9 mm di Hg, mentre la pressione parziale dell'alcool etilico gassoso è di 29,45 mm di Hg.
Per la legge di Dalton la frazione molare di un componente una miscela gassosa è esattamente pari al rapporto tra la sua pressione parziale e la pressione totale, per cui la frazione molare dell'alcool etilico nella miscela gassosa sarà pari a
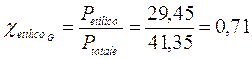
superiore alla frazione molare dell'etilico in soluzione . Il componente più volatile si trova dunque nel vapore in percentuale maggiore rispetto a quanto non sia in soluzione.
Questa circostanza permette normalmente di separare i due componenti una soluzione per distillazione. Il vapore che si ottiene facendo bollire una soluzione èinfatti più ricco nell'elemento più volatile. Se i vapori così ottenuti vengono poi fatti condensare, la nuova soluzione che se ne ottiene risulta anch'essa più concentrata nell'elemento più volatile. Eseguendo più volte il processo è possibile separare completamente i due componenti.
Ciò non è invece possibile per le soluzioni azeotropiche. Una soluzione azeotropica o azeòtropo è una soluzione in cui, per una certa concentrazione, il vapore presenta la stessa composizione del liquido. A tale concentrazione la soluzione si comporta come se fosse formata da un unico componente. Ad esempio le soluzioni idroalcoliche di acqua ed etanolo (alcool etilico) presentano un punto azeotropico al 95,57% di etanolo con temperatura di ebollizione di 78,15°C. Per distillazione è dunque impossibile ottenere etanolo puro. Quando si arriva infatti ad ottenere per distillazione la soluzione azeotropica, i vapori che essa forma sono sempre formati dal 95,57% di etanolo e dal 4,43% di acqua.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Legge di Raoult tipo file : doc
Legge di Raoult
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Legge di Raoult utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Legge di Raoult
Termini d' uso e privacy